新的罗汉果苷生产系统和方法
1.本技术于2021年3月17日作为pct国际专利申请提交,并且要求于2020年3月17日提交的美国临时专利申请序列号62/990,802的权益和优先权,该美国临时专利申请的全部披露内容通过引用以其全文并入。
2.根据37 c.f.r.
§
1.821(c)或(e),包含序列表的ascii文本版本的文件已经与本技术一起提交,其内容通过引用特此并入。
3.引言
4.随着全球各国对健康饮食以及肥胖症和糖尿病潜在风险的认识的提高,替代传统高热量甜味剂的低热量或无热量甜味剂对于食品和饮料行业以及其他行业变得越来越重要。这些替代的天然甜味剂用于取代人工甜味剂和高热量甜味剂(包括蔗糖、果糖和葡萄糖)。像一些人工甜味剂,一些天然甜味剂比相当数量的热量甜味剂提供了更大的甜味效果;因此,需要更少量的这些替代物以实现与糖相当的甜味。然而,一些低热量甜味剂的生产成本可能很高和/或具有令人不快的味道特征和/或异味,包括但不限于甜味残留、甜味开始延迟、负面口感、苦味、金属味、清凉味、涩味和类似甘草的味道。
5.少数天然植物生物合成地产生低热量或无热量甜味剂。例如,作为一类重要的天然甜味剂,罗汉果苷在化学上是一类由罗汉果(monk fruit)(学名:罗汉果(siraitia grosvenorii))天然产生的三萜糖苷或罗汉果醇糖苷。罗汉果苷不含热量,并且比蔗糖甜100-400倍。据报道,罗汉果苷还具有多种重要的药理作用。
6.罗汉果苷是基于三萜骨架的高度稳定的分子,由不同数量的葡萄糖单位形成,从1至6个附接到三萜骨架的碳24和/或碳3(图1)。各种罗汉果苷及其结构在图2中示出。罗汉果苷还可以包含非葡萄糖部分,诸如光果木鳖皂苷i。
7.一般来说,罗汉果苷的天然生物合成仅存在于罗汉果中。新鲜和干燥的罗汉果都被提取以产生含有约80%罗汉果苷的粉末,其中,主要组分是罗汉果苷v。罗汉果醇/罗汉果苷的生物合成途径以及从角鲨烯至罗汉果苷v的步骤中涉及的所有酶已经在果实的每个发育阶段通过基因组测序和转录组分析进行了鉴定。图1示出了罗汉果苷v的生物合成途径(seki等人bioscience,biotechnology,and biochemistry[生物科学、生物技术及生物化学],2018年第82卷,第6期,927-934)。
[0008]
尽管像罗汉果这样的植物产生天然的低热量和无热量甜味剂,但由于这些植物的天然或农业生产有限,从这些植物生产甜味剂是有限的。更重要的是,与体外化学或生物化学合成相比,植物中产生的甜味剂更容易被消费者接受。另外,出于多种原因,植物中产生的甜味剂可能很有用。此类果实或植物不仅可以用于生产低热量和无热量甜味剂,还可以用于生产风味剂、提取物或果汁,包括用于饮料的灌装果汁,用于具有降低热量和其他营养益处的食品和饮料中。
[0009]
此外,在体外或微生物中大量生产罗汉果苷,虽然在概念上已被证实,但可能需要大量的加工,因此在经济上并不有利。已经在用于发酵的微生物中尝试了产生罗汉果苷的生物合成途径。然而,小的甜味分子诸如罗汉果苷尚未完全开发出来。
[0010]
patron的us 2019/0071705提供了一种在重组宿主细胞中生产罗汉果苷iiie的方
法,该方法包括在特定条件下在培养基中培养重组宿主细胞,其中重组宿主细胞的基因表达催化罗汉果苷iiie生产的酶。
[0011]
houghton-larson的wo 2018/229283提供了一种能够在细胞培养物中产生一种或多种罗汉果苷化合物的重组宿主细胞,其中宿主细胞包含编码能够催化罗汉果苷生产的异源或内源多肽的重组基因。
[0012]
itkin的wo 2016/038617涉及生物合成地制备和分离产生罗汉果苷的酶的方法以及在重组宿主细胞中制备罗汉果醇前体、罗汉果醇和罗汉果苷的方法。
[0013]
liu的us 9932619和us 9920349都涉及用于酶促合成罗汉果苷化合物的体外方法和材料,以及使用细胞色素p450酶生产罗汉果醇和使用尿苷-5
′‑
二磷酸(udp)依赖性葡糖基转移酶(ugt)糖基化罗汉果醇以生产各种罗汉果苷化合物的方法。
[0014]
因此,需要用于有效生产罗汉果苷的新方法和生物系统,并且正是在上述背景下,本披露呈现了解决这种需求的优点和进步。
[0015]
新的罗汉果苷生产系统和方法
[0016]
披露概述
[0017]
本披露提供了生产低热量或无热量的罗汉果醇、罗汉果苷和基于罗汉果苷的甜味剂的解决方案。通过使用重组基因和植物转化技术,将编码产生罗汉果醇的酶和产生罗汉果苷的酶的非天然基因引入/实施到天然植物的基因组中,从而形成转基因植物,其中天然植物在其转化前的天然基因组中可能不天然地产生罗汉果醇或罗汉果苷。这种转基因植物能够产生非天然罗汉果醇前体、罗汉果醇、罗汉果苷、和/或其代谢物或衍生物。
[0018]
所提供的解决方案具有显著的优势。首先,由于成熟的农业技术,经由转基因植物的培养和再生产来生产罗汉果醇、低热量或无热量的罗汉果苷可能具有更好的技术经济性。此外,该解决方案可以允许罗汉果苷在植物的更多部分产生,而不仅仅是在果实内,从而提高转基因植物的整体营养和经济价值。此外,将产生罗汉果醇和/或罗汉果苷的转基因实施到快速生长或快速成熟的植物/作物中可以提高罗汉果苷生产和加工的效率,并提供有成本效益的益处。通过掺入这些转基因植物和材料或其部分,所提供的解决方案可以提供新的低热量或无热量食品和饮料。
[0019]
应注意的是,先前的披露主要集中在基于基因工程化微生物(主要是酵母)的制备罗汉果苷的方法上。本披露清楚地描述了能够产生罗汉果醇/罗汉果苷的转基因植物。基于酵母的方法在概念上能够合成罗汉果苷,但具有很少或没有经济效益。更重要的是,来源于植物的甜味剂和食品明显提高了消费者的接受度。根据本披露的转基因植物允许生产具有较低热量与甜味比率的果汁或植物提取物或植物材料或其他衍生消费品,其可以通过较少的加工或具有优选的额外风味特征和特性来使用。
[0020]
重要的是应注意,包含产生罗汉果苷的转基因的转基因生物体产生果实和/或种子的能力是罕见的。令人惊讶的是,根据本披露的转基因植物产生了包括果实和种子的各种组织,其中包括果实和种子的各种组织都包含罗汉果苷。含有本发明转基因植物果实的罗汉果苷可以用作各种食品和饮料产品的来源,并且因此在食品和消费品工业中提供了技术经济优势。此外,通过使用各种植物育种技术繁殖种子和农业再生产转基因植物,本披露的产生种子的转基因植物可以有益于大量和有成本效益的罗汉果苷生产。
[0021]
在一个示例应用中,西瓜果实由于其大的尺寸和受欢迎的风味而具有生产低热量
和/或无热量甜味剂的巨大潜力。为了设计用于途径工程化的基因组编辑或顺式基因策略,鉴定西瓜果实特异性启动子是至关重要的,这些启动子使得遗传有效载荷诸如罗汉果苷产生序列能够最佳表达。这些启动子的鉴定需要高分辨率的转录组数据集,从中可以产生在西瓜果实可食部分中特异性表达的基因列表。本披露中描述的方法和系统有利地提供了用于在不同发育阶段组织特异性表达感兴趣的基因的有效方法。
[0022]
本披露总体上描述了用于在转基因植物和组织或其部分中制备产生罗汉果醇和/或罗汉果苷的酶和罗汉果醇/罗汉果苷的转基因植物及其生物合成系统,以及用于制备此类转基因植物的方法。
[0023]
在一些实施例中,本披露涉及包含基因组转化事件的转基因植物,其中该基因组转化事件产生一种或多种产生罗汉果醇和/或罗汉果苷的酶的非天然表达或浓度,其中该转基因植物生物合成地产生非天然罗汉果醇前体、罗汉果醇、罗汉果苷、和/或其代谢物或衍生物。在这种转基因植物的某些实施例中,基因组转化事件包含表达盒,其中该表达盒包含如seq id no:1-31中列出的核苷酸序列中的一个或多个。在其他实施例中,这种表达盒包含以下核苷酸序列中的一个或多个:与如seq id no:1-31中列出的核苷酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、或至少99%的序列同一性。
[0024]
在其他实施例中,本披露涉及包含非天然罗汉果醇前体和/或罗汉果醇的转基因植物,其中该转基因植物生物合成地产生罗汉果醇、罗汉果苷、和/或其代谢物或衍生物。在某些实施例中,这种转基因植物包含表达盒,其中该表达盒包含如seq id no:1-31中列出的核苷酸序列中的一个或多个。在其他实施例中,这种表达盒包含以下核苷酸序列中的一个或多个:与如seq id no:1-31中列出的核苷酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、或至少99%的序列同一性。
[0025]
在某些实施例中,本披露的转基因植物包含其可获得的部分,包括但不限于器官、组织、叶子、茎、根、花或花部分、果实、嫩枝、配子体、孢子体、花粉、花药、小孢子、卵细胞、合子、胚胎、分生组织区域、愈伤组织、种子、插条、细胞或组织培养物或转基因植物的任何其他部分或产物,其中该部分包含罗汉果醇前体、罗汉果醇、罗汉果苷、和/或其代谢物或衍生物。
[0026]
在其他实施例中,本披露的转基因植物是可培养和可再生的。转基因植物的后代或祖先是一种或多种非天然酶的来源,该一种或多种非天然酶使得该后代和该祖先能够产生罗汉果醇、罗汉果苷、和/或其代谢物或衍生物。转基因植物种子的繁殖产生其有活力的后代,其中该后代产生罗汉果醇、罗汉果苷、和/或其代谢物或衍生物。
[0027]
在一些实施例中,转基因植物是二倍体植物。在一些实施例中,转基因植物是葫芦科/葫芦(cucurbitaceae/curcubits)。在某些实施例中,转基因植物是转基因西瓜(watermelon)(西瓜(citrullus lanatus))。
[0028]
本披露还涉及可从转基因植物获得的食品或饮料产品,其中这些食品或饮料产品含有罗汉果醇、罗汉果苷或基于罗汉果苷的甜味剂。在一些实施例中,本披露涉及基于罗汉果苷的甜味剂,其中基于罗汉果苷的甜味剂是从根据本披露的转基因植物或其部分中提取或纯化的。在某些实施例中,用于从转基因植物中提取和/或纯化基于罗汉果苷的甜味剂的方法是浸泡、色谱或吸收色谱。
[0029]
本披露涉及用于制备产生非天然罗汉果苷的转基因植物的方法,其中该方法包括将植物与基因组转化事件组合,从而形成转基因植物,其中该基因组转化事件产生一种或多种产生罗汉果醇和/或产生罗汉果苷的酶的非天然表达或浓度。将植物与基因组转化事件组合通常使用以下方法中的一种或多种进行:使用脂质体、使用电穿孔、使用增加游离dna摄取的化学品、使用将dna直接注射到植物中、使用粒子枪轰击、使用采用病毒或花粉转化、使用微突出物或使用农杆菌(agrobacterium)介导的转化。
[0030]
在一些实施例中,本披露涉及用于在转基因植物中生产非天然罗汉果醇前体、罗汉果醇和罗汉果苷的生物合成方法,该方法包括以下步骤:(a)将植物与基因组转化事件组合,从而形成转基因植物,其中该基因组转化事件产生一种或多种产生罗汉果醇和/或产生罗汉果苷的酶的非天然表达或浓度;(b)使转基因植物群体生长和再生;(c)选择产生罗汉果苷的转基因植物;以及(d)收获罗汉果苷。在某些实施例中,生物合成方法进一步包括:制备/提供包含表达盒的质粒,其中该表达盒表达一种或多种非天然的产生罗汉果醇和/或产生罗汉果苷的酶;用这些质粒转化宿主细胞;以及用多个转化的宿主细胞转染植物。
[0031]
术语的定义和解释
[0032]
在本披露中,将使用技术术语的以下定义或解释。本文使用的技术术语通常被给予在植物生物学、分子生物学、生物信息学和植物育种的相关领域中通常应用于它们的含义。以下所有术语定义适用于本技术的全部内容。应理解,如说明书和权利要求中所使用的,“一个/种(a或an)”可以意指一个或多个,这取决于其使用的上下文。因此,例如,提及“一个细胞”可以意味着至少一个细胞可以被利用。
[0033]
与属性或值有关的术语“基本上”、“约”、“大约”等,特别地也分别精确地定义了属性或值。在给定数值或范围的上下文中,术语“约”尤其涉及在给定值或范围的20%以内、10%以内或5%以内的值或范围。如本文所用,术语“包含”还包括术语“由
……
组成”。
[0034]
除非本文另有提及,否则术语“肽”、“寡肽”、“多肽”、“蛋白质”或“酶”在本文中可互换使用,并且是指通过肽键连接在一起的呈任何长度的聚合形式的氨基酸。
[0035]
术语“一个或多个基因序列”、“一个或多个多核苷酸”、“一个或多个核酸序列”、“一个或多个核苷酸序列”、“一个或多个核酸”、“核酸分子”在本文中可互换使用,并且是指呈任何长度的聚合无分支形式的核苷酸,核糖核苷酸或脱氧核糖核苷酸或两者的组合。
[0036]
转基因的/转基因/重组基因
[0037]
出于本披露的目的,“转基因的”、“转基因”或“重组”意指关于例如,核酸序列、表达盒、遗传构建体或包含该核酸序列的载体或用根据本披露的核酸序列、表达盒或载体转化的生物体,所有通过重组方法产生的那些构建体,其中(a)核酸的序列或其一部分,或(b)与根据本披露的核酸序列可操作地连接的一个或多个遗传控制序列,例如启动子,或(c)(a)和(b)的组合,不位于它们的天然遗传环境中或已经通过重组方法修饰,例如通过遗传工程化方法人工修饰和/或插入。
[0038]
如本文所用,术语“转基因的”涉及生物体,例如转基因植物是指生物体,例如植物、植物细胞、愈伤组织、植物组织或植物部分,其外源性含有本文所述的核酸、构建体、载体或表达盒或其一部分,其优选地通过基本上非生物的方法引入,优选地通过农杆菌介导的转化或粒子轰击。因此,如上所述,用于本披露目的的转基因植物被理解为意指本文所述的核酸不存在于或不来源于所述植物的基因组,或者存在于所述植物的基因组中,但不存
在于所述植物基因组中的天然遗传环境中,这些核酸可以同源或异源地表达。然而,如上所述,转基因还意味着,尽管根据本披露或用于所披露方法的核酸处于它们在植物基因组中的天然位置处,但该序列相对于天然序列已经被修饰,和/或天然序列的调控序列已经被修饰。转基因优选地被理解为意指在基因组中的非天然遗传环境下天然存在于该植物中的核酸序列的表达,即同源表达,或者发生非天然存在于该植物中的核酸序列的异源表达。
[0039]
植物/转基因植物/天然植物
[0040]
如本文所用的术语“植物”包括完整的植物、植物的祖先和后代以及植物部分,包括种子、嫩枝、茎、叶子、根(包括块茎)、花以及组织和器官,其中前述每一种都包含感兴趣的基因/核酸。术语“植物”还包括植物细胞、悬浮培养物、愈伤组织、胚胎、分生组织区域、配子体、孢子体、花粉和小孢子,此外其中前述每一种都包含感兴趣的基因/核酸。
[0041]
本文中的转基因植物是指已经使用遗传工程化技术将来自另一物种的一个或多个转基因引入植物基因组中的植物。引入的转基因编码并表达非天然蛋白质或酶,从而使得转基因植物具有新的特征,诸如产生非天然酶促途径产物,这些产物在引入转基因之前并不天然存在于该植物中。转基因植物与天然植物是相对的,该天然植物是自然的产物,没有人为的人工干扰。根据本技术的天然植物是指野生型植物、未被人类遗传修饰的植物、或用作表征根据本披露制备的转基因植物的对照的未转化/非转化植物。
[0042]
内源/天然
[0043]“内源”或“天然”核酸和/或蛋白质是指如在植物中发现的呈其天然形式(即,没有任何人为干预,如重组dna工程化技术)的所讨论核酸和/或蛋白质,但也指随后(重新)引入植物中的呈分离形式的相同基因(或基本上同源的核酸/基因)(转基因)。含有这种转基因的转基因植物可能会或可能不会遭遇转基因表达的实质性减少和/或内源基因表达的实质性减少。
[0044]
外源
[0045]
术语“外源”(与“内源”相反)核酸或基因是指已经通过重组dna技术引入植物的核酸。“外源”核酸或者不能以其天然形式存在于植物中,不同于如在植物中发现的呈其天然形式的所讨论核酸,或者可以与在植物中发现的呈其天然形式的核酸相同,但不整合在其天然遗传环境中。“外源”的对应含义适用于蛋白质表达的情况。例如,当与内源基因的表达相比时,含有转基因(即,外源核酸)的转基因植物可能会遭遇相应基因或蛋白质总体表达的实质性增加。根据本披露的转基因植物包括整合在任何基因座处的一种或多种外源核酸,并且任选地,该植物还可以包括天然遗传背景中的内源基因。
[0046]
表达盒
[0047]
如本文所用的“表达盒”是能够在宿主细胞中表达的载体dna。形成表达盒的dna、dna的部分或遗传元件的排列可以是人工的。熟练的技术人员知道为了成功产生表达,表达盒中必须存在的遗传元件。表达盒包含待表达的感兴趣的序列,该序列与一个或多个如本文所述的控制序列(至少与启动子)可操作地连接。另外的调控元件可以包括转录和翻译增强子。本领域技术人员将知道可以适用于进行本发明的终止子和增强子序列。还可以将内含子序列添加到5'非翻译区(utr)或编码序列中,以增加胞质溶胶中积累的成熟信息的量,如增加表达/过表达的定义部分所述。其他控制序列(除了启动子、增强子、沉默子、内含子序列、3'utr和/或5'utr区)可以是蛋白质和/或rna稳定元件。此类序列将是本领域技术人
员已知的或可以容易获得的。
[0048]
表达盒可以整合到宿主细胞的基因组中,并与所述宿主细胞的基因组一起复制。
[0049]
载体
[0050]
载体或载体构建体是部分或全部人造的dna(诸如但不限于质粒、病毒dna和染色体载体),或者在所含遗传元件的排列方面是人造的-能够在宿主细胞中复制,并用于将感兴趣的dna序列引入宿主细胞或宿主生物体中。载体可以是构建体,或者可以包含至少一个构建体。载体可以复制而不整合到宿主细胞的基因组中,例如细菌宿主细胞中的质粒载体,或者它可以将其部分或全部dna整合到宿主细胞的基因组中,并且由此导致其dna的复制和表达。本发明的宿主细胞可以是选自细菌细胞的任何细胞,诸如大肠杆菌(escherichia coli)或农杆菌属物种细胞、酵母细胞、真菌、藻类或蓝细菌细胞或植物细胞。熟练的技术人员知道为了成功转化、选择和繁殖含有感兴趣序列的宿主细胞,遗传构建体上必须存在的遗传元件。典型地,载体包含至少一个表达盒。一个或多个感兴趣的序列与一个或多个如本文所述的控制序列(至少与启动子)可操作地连接。另外的调控元件可以包括转录和翻译增强子。本领域技术人员将知道可以适用于进行本文所披露技术的终止子和增强子序列。
[0051]
可操作地连接
[0052]
术语“可操作地连接”或“功能性连接”可互换使用,并且如本文所用,是指启动子序列和感兴趣的基因之间的功能性连接,使得启动子序列能够指导感兴趣的基因的转录。
[0053]
启动子/植物启动子/强启动子/弱启动子
[0054]“启动子”或“植物启动子”包含调控元件,其介导编码序列片段在植物细胞中的表达。“植物启动子”可以来源于植物细胞,例如来自用待在本系统中表达并在本文中描述的核酸序列转化的植物。这还适用于其他“植物”调控信号,诸如植物终止子。可用于本披露方法的核苷酸序列上游的启动子可以通过一个或多个核苷酸取代、插入和/或缺失进行修饰,而不干扰启动子、开放阅读框(orf)或3'-调控区诸如终止子或位于远离orf的其他3'调控区的功能或活性。此外,启动子的活性可以通过修饰其序列而增加,或者它们完全被更有活性的启动子(甚至是来自异源生物体的启动子)替代。为了在植物中表达,如本文所述,核酸分子必须与合适的启动子可操作地连接或包含合适的启动子,该启动子在正确的时间点表达基因,并具有所需的空间表达模式。
[0055]
本文使用的启动子广义上包括组成型启动子、普遍存在型启动子、发育调控型启动子、诱导型启动子、器官特异性启动子、组织特异性启动子、种子特异性启动子、绿色组织特异性启动子、分生组织特异性启动子等。“普遍存在型启动子”在生物体的几乎所有组织或细胞中都有活性。
[0056]
为了鉴定功能等同的启动子,可以分析候选启动子的启动子强度和/或表达模式,例如通过将启动子与报道基因可操作地连接,并测定报道基因在植物各种组织中的表达水平和模式。通常,“弱启动子”是指驱动编码序列以低水平表达的启动子。“低水平”是指每个细胞约1/10,000个转录物至约1/100,000个转录物至约1/500,0000个转录物的水平。相反,“强启动子”驱动编码序列以高水平表达,或以每个细胞约1/10个转录物至约1/100个转录物至约1/1000个转录物的水平表达。通常,“中等强度启动子”是指驱动编码序列以低于强启动子的水平表达的启动子。
[0057]
终止子
[0058]
术语“终止子”包括控制序列,其是转录单位末端处的dna序列,其发出初级转录物的3'加工和聚腺苷酸化以及转录终止的信号。终止子可以来源于天然基因,来源于各种其他植物基因,或来源于t-dna。待添加的终止子可以来源于例如,胭脂碱合酶或章鱼碱合酶基因,或者可替代地来源于另一种植物基因,或者不太优选地来源于任何其他真核基因。
[0059]
报道基因
[0060]“选择性标记”、“选择性标记基因”或“报道基因”包括赋予细胞表型的任何基因,该基因在该细胞中表达,以便于鉴定和/或选择用本发明的核酸构建体转染或转化的细胞。这些标记基因能够经由一系列不同的原理鉴定核酸分子的成功转移。合适的标记可以选自赋予抗生素或除草剂抗性、引入新的代谢性状或允许视觉选择的标记。选择性标记基因的实例包括赋予抗生素诸如卡那霉素(kan)或潮霉素(hyg)抗性的基因。视觉标记基因的表达导致荧光(绿色荧光蛋白,gfp;红色荧光蛋白,rfp;及其衍生物)的形成。此列表仅代表少量可能的标记。熟练的技术人员熟悉此类标记。取决于生物体和选择方法,不同的标记是优选的。
[0061]
表达/基因表达
[0062]
术语“表达”或“基因表达”意指一种或多种特定基因或特定遗传构建体的转录。术语“表达”或“基因表达”特别意指rna的翻译以及随之而来的编码的蛋白质/酶的合成,即蛋白质/酶表达。
[0063]
同一性百分比/同源性
[0064]
如本文所用,序列同一性、同源性或“同一性百分比”意指两个最佳比对的dna或蛋白质片段在整个组分(例如核苷酸序列或氨基酸序列)比对窗口中不变的程度。测试序列和参考序列的比对片段的“同一性分数”是两个比对片段的序列所共有的相同组分的数量除以比对窗口上参考片段中序列组分的总数,该比对窗口是完整测试序列或完整参考序列中较小的序列。“同一性百分比”(“同一性%”)是同一性分数乘以100。
[0065]
引入/实施/转化
[0066]
如本文所指的术语“引入”、“实施”或“转化”包括将外源多核苷酸转移到宿主细胞中,而不考虑用于转移的方法。
[0067]
可以用本发明的遗传构建体转化能够通过器官发生或胚胎发生进行后续克隆繁殖的植物组织,并且从中再生出完整的植物。所选择的特定组织将根据可用于和最适合于被转化的特定物种的克隆繁殖系统而变化。示例性组织靶标包括叶盘、花粉、胚胎、子叶、下胚轴、大配子体、愈伤组织、现有分生组织(例如,顶端分生组织、腋芽和根分生组织)和诱导分生组织(例如,子叶分生组织和下胚轴分生组织)。多核苷酸可以瞬时或稳定地引入宿主细胞中,并且可以保持非整合,例如作为质粒。可替代地,它可以整合到宿主基因组中。然后可以用本领域技术人员已知的方式将所得转化的植物细胞用于再生转化的植物。可替代地,可以选择不能再生为植物的植物细胞作为宿主细胞,即所得转化的植物细胞不具有再生为(完整)植物的能力。
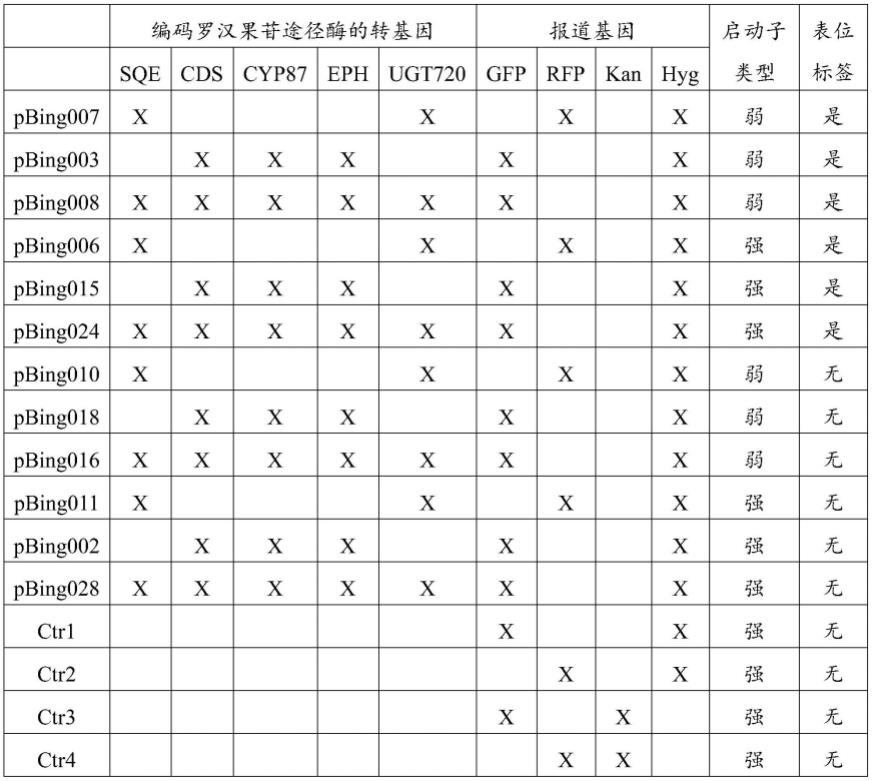
[0068]
将外来基因转移到植物基因组中称为转化。植物物种的转化现在是相当常规的技术。有利的是,可以将几种转化方法中的任一种用于将感兴趣的基因引入合适的祖先细胞中。描述的用于从植物组织或植物细胞转化和再生植物的方法可以用于瞬时或稳定转化。转化方法包括使用脂质体、电穿孔、增加游离dna摄取的化学品、将dna直接注射到植物中、
粒子枪轰击、使用病毒或花粉转化和微突出物。转基因植物,包括转基因作物植物,优选地经由农杆菌介导的转化产生。一种有利的转化方法是植物中的转化。为此,例如,可以使农杆菌作用于植物种子或用农杆菌接种植物分生组织。根据本发明,已经证明使转化的农杆菌悬浮液作用于完整植物或至少作用于花原基是特别有利的。植物随后继续生长,直到获得经处理的植物的种子(clough和bent,plant j.[植物学杂志](1998)16,735-743)。待表达的核酸或构建体优选地克隆到适用于转化根癌农杆菌(agrobacterium tumefaciens)的载体(例如pbinl9)中(bevan等人,nucl.acids res.[核酸研究]12(1984)8711)。然后,由这种载体转化的农杆菌可以以已知的方式用于植物的转化,这些植物诸如用作模型的植物,如拟南芥(arabidopsis)(拟南芥(arabidopsis thaliana)在本发明的范围内,不被认为是作物植物),或作物植物,例如像烟草植物,例如通过将挫伤的叶子或切碎的叶子浸入农杆菌溶液中,并且然后在合适的培养基中培养它们。通过根癌农杆菌转化植物例如由hofgen和willmitzer在nucl.acid res.[核酸研究](1988)16,9877中描述,或尤其从f.f.white,vectors for gene transfer in higher plants[高等植物基因转移的载体];transgenic plants[转基因植物],第1卷,engineering and utilization[工程化和利用],s.d.kung和r.wu编,学术出版社(academic press),1993,第15-38页中已知。
[0069]
倍性/倍性水平/染色体倍性/多倍体
[0070]
倍性或染色体倍性是指细胞核中出现的完整染色体组的数量。体细胞、组织和个体生物体可以根据存在的染色体组数量(“倍性水平”)来描述:单倍体(1组)、二倍体(2组)、三倍体(3组)、四倍体(4组)、五倍体(5组)、六倍体(6组)、七倍体(heptaploid)或七倍体(septaploid)(7组)等。本文使用通用术语多倍体来描述具有三个或更多个染色体组的细胞。
[0071]
调节
[0072]
术语“调节”意指与表达或基因表达相关的一个过程,其中与对照植物相比,所述基因表达改变了表达水平,该表达水平可以增加或降低。原始的、未调节的表达可以是结构rna(rrna、trna)或mrna随后翻译的任何种类的表达。出于本技术的目的,原始未调节的表达也可以是没有任何表达。术语“调节活性”或术语“调节表达”应意指靶核酸序列和/或编码的蛋白质表达的任何变化,其导致一种或多种产量相关性状的增加或减少,诸如但不限于种子产量的增加或减少和/或植物生长的增加或减少。该表达可以从零(不存在或不可测量的表达)增加到某一数量,或者可以从某一数量减少到不可测量的小数量或零。
[0073]
通常,在转化后,根据一种或多种标记的存在选择植物细胞或细胞分组,该一种或多种标记由与感兴趣的基因共转移的植物可表达基因编码,随后转化的材料再生为完整的植物。为了选择转化的植物,通常使在转化中获得的植物材料经受选择性条件,使得可以将转化的植物与未转化的植物区分开。例如,可以种植以上述方式获得的种子,并在初始生长期后,通过喷雾进行合适的选择。另一种可能性在于,如果合适的话,在灭菌后,使用合适的选择剂使种子在琼脂板上生长,使得只有转化的种子可以生长成植物。可替代地,筛选转化的植物中是否存在诸如本文所述的选择性标记。
[0074]
在dna转移和再生后,还可以评价推定转化的植物中感兴趣基因的存在、拷贝数和/或基因组组织。
[0075]
产生的转化的植物可以通过多种方式繁殖,诸如通过克隆繁殖或经典育种技术。
例如,第一代(或t1)转化的植物可以自交,并选择纯合的第二代(或t2)转化体,并且然后t2植物可以通过经典育种技术进一步繁殖。产生的转化的生物体可以采取多种形式。例如,它们可以是转化的细胞和非转化的细胞的嵌合体;克隆转化体(例如,转化为含有表达盒的所有细胞);转化和未转化的组织的嫁接物(例如,在植物中,转化的根茎嫁接到未转化的接穗)。
[0076]
在本技术中,用构建体转化或可互换地通过构建体转化或者用核酸或通过核酸转化的植物、植物部分、种子或植物细胞应理解为意指携带所述构建体或所述核酸作为转基因(这是由于通过生物技术手段引入所述构建体或所述核酸的结果)的植物、植物部分、种子或植物细胞。因此,植物、植物部分、种子或植物细胞包含所述表达盒、所述重组构建体或所述重组核酸。
[0077]
罗汉果苷的生物合成途径
[0078]
图1示出了来自罗汉果的罗汉果苷生物合成途径(itkin等人,proc nat acad sci usa[美国国家科学院学报],2016;113:e7619-e7628;seki等人,bioscience,biotechnology,and biochemistry[生物科学、生物技术及生物化学],2018年第82卷,第6期,927-934)。角鲨烯环氧酶(sqe)、葫芦二烯醇合酶(cds)和环氧水解酶(eph)参与了生产和将罗汉果醇前体转化为罗汉果醇的连续步骤。作为酶促途径中间产物的罗汉果醇前体包括但不限于:2,3-氧化角鲨烯、2,3;22.23-二氧化角鲨烯、24,25-环氧葫芦二烯醇和24,25-二羟基葫芦二烯醇。罗汉果苷生物合成途径的特征之一是cds,其是一种氧化角鲨烯环化酶,利用2,3;22,23-二环氧角鲨烯作为其底物以产生24,25-环氧葫芦二烯醇。基因组分析显示,罗汉果含有五个可以编码角鲨烯环氧酶(sqe)的基因。其中,两个在果实发育的初始阶段强烈表达,如cds、细胞色素p450(cyp87d18)和环氧水解酶(eph),它们催化随后的步骤,并被预测参与2,3;22,23-二环氧角鲨烯的产生。罗汉果基因组含有八个编码环氧化物水解酶的基因,这些水解酶催化24,25-环氧葫芦二烯醇转化为24,25-二羟基葫芦二烯醇。重要的是,根据本披露的罗汉果苷的酶促途径不受图1a所示机制的限制。其他萜烯结构、罗汉果醇前体、酶催化反应或转化机制也是可能的。某些酶可以催化多于一种类型的反应。例如,细胞色素p450酶催化葫芦二烯醇转化为11-羟基-葫芦二烯醇或11-氧代-葫芦二烯醇,24,25-环氧葫芦二烯醇转化为11-羟基-24,25环氧葫芦二烯醇。在一些相关的实施例中,非罗汉果葫芦科可以产生类似于罗汉果醇的四环三萜化合物,因为中间体中的至少一种,诸如三萜,存在于细胞途径中。此外,考虑到用于修饰四环三萜类化合物的相关途径需要相关的酶诸如还原酶,这些相关的植物已经表达了这些相关的网络酶。在其他相关的实施例中,可以将另外的基因引入非葫芦科或天然酶中,这些酶具有可以被上调的功能,以允许中间代谢物的产生或相关酶的产生,以便产生罗汉果醇、罗汉果苷和基于罗汉果苷的甜味剂。
[0079]
在形成罗汉果醇后,发生一系列糖基化,以在位置c-3和位置c-24处添加葡萄糖分子,从而产生具有各种程度糖基化的罗汉果苷i-vi。罗马数字i、ii、iii、iv、v和v分别代表对应的糖基化罗汉果苷、异罗汉果苷或氧代罗汉果苷中一个或多个葡萄糖单位的数量。两种尿苷磷酸化酶依赖性糖基转移酶(ugt)被证明对这些步骤有贡献。其中之一是ugt720-269-1,其在果实发育的初始阶段强烈表达,并且经由作为中间体的罗汉果苷i-a1(c-24葡糖基化)将一个葡萄糖分子分别转移到罗汉果醇位置c-24和c-3处的羟基上,以产生罗汉果苷iie(c-3和c-24葡糖基化)。第二种ugt是ugt94-289-3,其在果实发育的后期强烈表达,并
且将糖添加到受体分子上已经存在的其他糖上。ugt94-289-3被证明在罗汉果苷iie的c-24葡萄糖(其是由ugt720-269-1早先添加的)的位置c-2'和c-6'处各添加一个葡萄糖分子。ugt94-289-3还将葡萄糖分子添加到结合在罗汉果苷iie的位置c-3处的葡萄糖的位置c-6',从而依次催化三个或更多个糖转移反应,以产生具有五个或更多个葡萄糖单位的罗汉果苷。
[0080]
重要的是应注意,其他天然植物通过其天然基因组也可以表达产生罗汉果醇前体的酶,但这些植物不能以产生罗汉果苷所需的协调方式天然产生所有的酶。例如,如图1b所示,植物诸如黄瓜、甜瓜和西瓜天然表达葫芦二烯醇合酶,这些酶能够产生葫芦二烯醇,一种来自罗汉果属(siratia)的罗汉果醇或来自甜瓜的葫芦素的常见前体。然而,其他酶,如能够改变葫芦二烯醇支架的细胞色素p450酶(banerjee等人,phytochem.rev.[植物化学评论]2018,17:81-111)将这种中间体重定向为其他萜烯衍生物。由于这些非罗汉果属植物具有其他细胞色素p450、水解酶、环氧酶和糖基化酶基因,其酶产物在活性上可能是混杂的,并且可能不以罗汉果苷途径的协调方式表达,因此此类植物可能具有罗汉果苷途径的酶。因此,通过重组、基因编辑或其他现代植物育种技术对这些非罗汉果属植物的基因组进行改变,可以使这些非siratia植物开始产生罗汉果醇和罗汉果苷。
[0081]
如本文所用,术语“罗汉果苷途径酶”包括能够催化或促进生物合成反应以产生罗汉果醇前体、罗汉果醇、罗汉果苷及其代谢物和/或衍生物的任何酶。此类罗汉果苷途径酶包括但不限于cds、sqe、eph、细胞色素p450和ugt中每一种的酶家族。
[0082]
罗汉果醇前体广泛包括所有可能的萜烯衍生物和中间产物,用于生产图1a和1b所示酶促途径的罗汉果醇产物,包括但不限于2,3-氧化角鲨烯、2,3;22.23-二氧化角鲨烯、24,25-环氧葫芦二烯醇和24,25-二羟基葫芦二烯醇、葫芦二烯醇、11-羟基-葫芦二烯醇、11-氧代-葫芦二烯醇等。根据本披露的罗汉果苷是指罗汉果醇的任何可能的糖基化产物,包括但不限于赛门苷i、西拉糖(siratose)(赛门苷i的立体异构体)、罗汉果苷vi、罗汉果苷v、异罗汉果苷v、罗汉果苷iv、罗汉果苷iii、罗汉果苷iiie、罗汉果苷iie、罗汉果苷iia、罗汉果苷ie、罗汉果苷ia。这些结构中的一些在图2中示出。罗汉果苷的其他实例包括但不限于罗汉果苷iib、7-氧代罗汉果苷iie、11-氧代罗汉果苷a1、罗汉果苷iii a2、11-脱氧罗汉果苷iii、11-氧代罗汉果苷iva、7-氧代罗汉果苷v和11-氧代-罗汉果苷v。根据本披露的罗汉果苷的代谢物和衍生物是指通过代谢反应、天然发生的反应或非天然发生的反应的任何接近的罗汉果苷变体。与标准罗汉果苷相比,罗汉果苷衍生物可能包含一个或多个原子或官能团的缺失、改变或添加。然而,罗汉果苷的代谢物和衍生物基本上保持了标准罗汉果苷的相同功能和特征。
[0083]
附图的简要说明
[0084]
图1a示出了用于在罗汉果中产生罗汉果醇和罗汉果苷的报道的酶促途径。(seki等人bioscience,biotechnology,and biochemistry[生物科学、生物技术及生物化学],2018年第82卷,第6期,927-934)。
[0085]
图1b示出了用于在一些天然植物中产生罗汉果醇前体的酶促途径。(banerjee等人,phytochem.rev.[植物化学评论]2018,17:81-111)。
[0086]
图2示出了罗汉果醇及其衍生的所选择罗汉果苷的结构。
[0087]
图3示出了包含编码罗汉果苷途径酶的核苷酸序列的各种表达盒的设计。
[0088]
图4示出了罗汉果苷标准品的超高效液相色谱-飞行时间质谱(uplc-tofms)结果。
[0089]
图5示出了与对照植物p019相比,分别用表达盒pbing008和pbing024转化的转基因植物烟草(nicotiana bentamiana)的叶子中罗汉果苷ii检测的uplc-tofms(保留时间)分析结果。
[0090]
图6示出了与对照植物p019相比,用表达盒pbing003和pbing007共转化的转基因烟草的叶子以及用表达盒pbing006和pbing015共转化的转基因烟草的叶子中罗汉果苷ii检测的uplc-tofms(保留时间)分析结果。
[0091]
图7示出了用表达盒pbing008转化的转基因烟草的叶子中罗汉果苷ii检测的uplc-tofms(保留时间)结果。
[0092]
图8示出了用表达盒pbing008转化的转基因植物烟草的叶子中罗汉果苷ii检测的uplc-tofms(ms光谱)结果。
[0093]
图9示出了西瓜及其各种果实部分的解剖照片图像。
[0094]
图10示出了根据实例4,产色基因psy1在各种果实组织中的表达。
[0095]
图11示出了根据实例4,表5的8个鉴定的组织特异性基因在糖宝宝(sugar baby)西瓜的各种组织中的表达。
[0096]
图12示出了根据实例4,表5的8个鉴定的组织特异性基因在查尔斯顿格雷(charleston gray)西瓜的各种组织中的表达。
[0097]
图13示出了各种转基因西瓜样品(用pbing008转化)中蛋白质检测的分析结果。
[0098]
图14示出了通过用表达盒pbing008转化制备的转基因西瓜中蛋白质检测的化学发光结果。
[0099]
图15示出了转基因西瓜样品008sbe4-1的各种组织中蛋白质检测的分析结果,该西瓜样品是通过用表达盒pbing008转化制备的。
[0100]
图16示出了转基因西瓜样品008sbe5-4的各种组织中蛋白质检测的分析结果,该西瓜样品是通过用表达盒pbing008转化制备的。
[0101]
图17示出了转基因西瓜样品008che4-13的各种组织中蛋白质检测的分析结果,该西瓜样品是通过用表达盒pbing008转化制备的。
[0102]
图18示出了转基因西瓜样品008che4-16的各种组织中蛋白质检测的分析结果,该西瓜样品是通过用表达盒pbing008转化制备的。
[0103]
图19示出了与对照相比,包含表达盒pbing008的转基因西瓜的uplc-tofms结果。
[0104]
图20示出了包含表达盒pbing008的转基因西瓜的uplc-tofms(ms光谱)结果。
[0105]
图21a示出了来自转基因西瓜008ch4-19的果实的样品提取物的uplc-tofms结果。
[0106]
图21b示出了对照样品与转基因西瓜008ch4-19的果实提取物样品的uplc-tofms结果,其中对照样品是野生型、未修饰的果实的提取物,其产生并掺入100ng/ml罗汉果苷iie。
[0107]
图22示出了来自转基因西瓜样品008sbe5-2和008che4-5(两者都包含表达盒pbing008)的种皮的uplc-tofms结果。
[0108]
图23示出了31个转基因西瓜叶子果实中cds基因表达水平的比较。通过rt-pcr分析cds的表达水平,并归一化为肌动蛋白表达(设为1)的10%。橙色条代表来自果实的表达值,而蓝色条代表来自叶子的表达值。
[0109]
图24示出了根据实例6,31个转基因西瓜叶子果实中cyp87基因表达水平的比较。通过rt-pcr分析cyp87的表达水平,并归一化为肌动蛋白表达(设为1)的10%。橙色条代表来自果实的表达值,而蓝色条代表来自叶子的表达值。
[0110]
图25示出了根据实例6,31个转基因西瓜叶子果实中sqe基因表达水平的比较。通过rt-pcr分析sqe的表达水平,并归一化为肌动蛋白表达(设为1)的10%。橙色条代表来自果实的表达值,而蓝色条代表来自叶子的表达值。
[0111]
图26示出了根据实例6,31个转基因西瓜叶子果实中eph基因表达水平的比较。通过rt-pcr分析eph的表达水平,并归一化为肌动蛋白表达(设为1)的10%。橙色条代表来自果实的表达值,而蓝色条代表来自叶子的表达值。
[0112]
图27示出了根据实例6,31个转基因西瓜叶子果实中eph基因表达水平的比较。通过rt-pcr分析eph的表达水平,并归一化为肌动蛋白表达(设为1)的10%。橙色条代表来自果实的表达值,而蓝色条代表来自叶子的表达值。
[0113]
图28示出了标准罗汉果苷iie通过uplc-ms分析的分析结果。左边示出的是三种不同浓度的罗汉果苷iie的三个色谱图的叠加图:1000pg/ml、500pg/ml和250pg/ml。右边示出的是碎裂后罗汉果苷iie标准品的特征离子峰。
[0114]
图29示出了根据实例6在t0西瓜果实样品008che4-19的代谢物提取物中检测罗汉果苷iie的分析结果。lc-ms的提取离子色谱图(m/z423.36)在左边示出。质谱碎片的离子强度在右边示出。
[0115]
图30示出了根据实例6,t1转基因西瓜样品中cds基因表达的结果。使用多重pcr扩增来自32个转基因植物样品的dna。所有样品的身份和基因分型结论列于左边和右边的表格中。
[0116]
图31示出了根据实例6在t1西瓜果实样品008dle11-4-s4的代谢物提取物中检测罗汉果苷iie的分析结果。lc-ms的提取离子色谱图(m/z423.36)在左边示出。质谱碎片的离子强度在右边示出。
[0117]
图32示出了根据实例6在t1西瓜果实样品008dle11-2-s1的代谢物提取物中检测罗汉果苷iie的分析结果。lc-ms的提取离子色谱图(m/z423.36)在左边示出。质谱碎片的离子强度在右边示出。
[0118]
图33示出了根据实例6在t1西瓜果实样品008dle11-9-s3的代谢物提取物中检测罗汉果苷iie的分析结果。lc-ms的提取离子色谱图(m/z423.36)在左边示出。质谱碎片的离子强度在右边示出。
[0119]
详细描述
[0120]
本文件总体上描述了用于制备罗汉果醇/罗汉果苷途径酶和罗汉果苷的转基因植物及其生物合成系统,以及用于制备此类转基因植物的方法。以下部分提供了详细描述主题的实施例。
[0121]
表达盒和载体的构建
[0122]
在一些实施例中,本披露描述了包含基因组转化事件的转基因植物,其中该基因组转化事件产生一种或多种罗汉果苷途径酶的非天然表达或浓度,其中该转基因植物生物合成地产生非天然罗汉果醇前体、罗汉果醇、罗汉果苷、和/或其代谢物或衍生物。
[0123]
在其他相关的实施例中,本披露描述了包含基因组转化事件的基因编辑的植物,
其中该基因组转化事件产生一种或多种罗汉果苷途径酶的非天然表达或浓度,其中该转基因植物生物合成地产生非天然罗汉果醇前体、罗汉果醇、罗汉果苷、和/或其代谢物或衍生物。在至少这些实施例中,各种基因组编辑工具,诸如转录激活因子样效应核酸酶(talen)、锌指核酸酶(zfn)和兆核酸酶(mn),可以用于获得具有非天然罗汉果醇前体、罗汉果醇、罗汉果苷、和/或其代谢物或衍生物的所期望植物。
[0124]
如本文进一步描述的,基因编辑的植物可以包含seq id no:1-31。在一些示例实施例中,基因编辑的植物包含表达盒或转化事件,其包括以下核苷酸序列中的一个或多个:与seq id no:1-31中列出的核苷酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、或至少99%的序列同一性。
[0125]
在一些实施例中,本披露描述了包含非天然罗汉果醇前体和/或罗汉果醇的转基因植物,其中该转基因植物生物合成地产生罗汉果醇、罗汉果苷、和/或其代谢物或衍生物。
[0126]
在一些实施例中,根据本披露的转基因植物具有基因组转化事件,其中该基因组转化事件包含表达盒,其中该表达盒包含如seq id no:1-31中列出的核苷酸序列中的一个或多个。在一些实施例中,转基因植物的表达盒包含以下核苷酸序列中的一个或多个:与seq id no:1-31中列出的核苷酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、或至少99%的序列同一性。
[0127]
本文的表达盒已经在植物转化前经由合适的重组基因技术进行了设计和构建。
[0128]
在转基因植物的一些实施例中,表达盒中seq id no:1;seq id no:2;seq id no:3;seq id no:4;或seq id no:5中列出的核苷酸序列能够编码至少一种选自由cds、细胞色素p450、eph、sqe、ugt、及其组合组成的组的酶。
[0129]
在一些实施例中,表达盒进一步包含一种或多种选自由启动子、感兴趣的核苷酸序列、表位标签、终止子、间隔区、及其组合组成的组的组分。
[0130]
在某些实施例中,表达盒进一步包含一个或多个启动子。在一些实施例中,一个或多个启动子是强启动子。在其他实施例中,一个或多个启动子是弱启动子。在又其他实施例中,一个或多个启动子具有seq id no:6-17中列出的一个或多个核苷酸序列。在其他实施例中,一个或多个启动子具有一个或多个核苷酸序列,该一个或多个核苷酸序列与seq id no:6-17中列出的核苷酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、或至少99%的序列同一性。
[0131]
在某些实施例中,表达盒进一步包含一个或多个表位标签,其中一个或多个表位标签具有seq id no:18-22中列出的一个或多个核苷酸序列。在其他实施例中,一个或多个表位标签具有一个或多个核苷酸序列,该一个或多个核苷酸序列与seq id no:18-22中列出的核苷酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、或至少99%的序列同一性。
[0132]
在某些实施例中,表达盒进一步包含一个或多个终止子,其中一个或多个终止子具有seq id no:23-27中列出的一个或多个核苷酸序列。在其他实施例中,一个或多个终止子具有一个或多个核苷酸序列,该一个或多个核苷酸序列与seq id no:23-27中列出的核苷酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、或至少99%的序列同一性。
[0133]
图3示出了根据本披露的表达盒的一些非限制性示例设计。每个感兴趣的基因,例
如,编码cds的核苷酸序列,与启动子序列和编码表位标签的核苷酸序列可操作地连接,其中表位与终止子序列可操作地连接,从而形成作为启动子-cds-表位标签-终止子的可表达基因。此类“可表达基因”可以通过凭借间隔序列(间隔区)可操作地连接来进一步修饰,以改变由“表达盒”产生的表达或酶产物。在一些实施例中,转基因植物的表达盒包含一个或多个可表达基因和一个或多个间隔区,其中,每个可表达基因包含选自由以下组成的组的感兴趣的基因序列:编码cds的核苷酸序列、编码细胞色素p450(cyp87d18)的核苷酸序列、编码eph的核苷酸序列、编码sqe的核苷酸序列、编码ugt720的核苷酸序列、及其组合。
[0134]
在一些实施例中,本披露的表达盒进一步包含编码和表达一种或多种报道蛋白的一个或多个报道基因序列。报道蛋白包括但不限于卡那霉素抗性蛋白(kan)、潮霉素抗性蛋白(hyg)、绿色荧光蛋白(gfp)和绿色荧光蛋白(rfp)。在一些实施例中,一个或多个报道基因具有seq id no:28-31中列出的一个或多个核苷酸序列。在其他实施例中,一个或多个报道基因具有一个或多个核苷酸序列,该一个或多个核苷酸序列与seq idno:28-31中列出的核苷酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、或至少99%的序列同一性。在一些实施例中,核苷酸seq id no:28能够编码kan,核苷酸seq id no:29能够编码hyg,核苷酸seq id no:30能够编码gfp,并且核苷酸seq id no:31能够编码rfp。在某些实施例中,表达盒包含至少一个选自由如seq id no:28-31中列出的核苷酸序列组成的组的报道基因。在其他实施例中,转基因植物的表达盒包含至少两个选自由如seq id no:28-31中列出的核苷酸序列组成的组的报道基因。
[0135]
表1示出了代表本技术的表达盒的各种非限制性实例。表2示出了表达盒pbing008的组成,包括五个启动子序列、五个蛋白质标签、五个终止子序列和五个感兴趣的转基因。
[0136]
表1.编码一种或多种罗汉果苷途径酶的表达盒。
[0137][0138]
作为示例实施例,表达盒pbing008包含启动子序列、编码罗汉果苷途径酶的核苷酸序列、编码表位标签的核苷酸序列、编码gfp和hyg的报道基因,以及终止子序列。
[0139]
在pbing008中,核苷酸seq id no:1编码cds;核苷酸seq id no:2编码细胞色素p450(cyp87d18);核苷酸seq id no:3编码eph;核苷酸seq id no:4编码sqe;seq id no:5中的核苷酸编码ugt720;seq id no:6中的核苷酸代表启动子tctp;seq id no:7中的核苷酸代表启动子fsgt-pflt;seq id no:8中的核苷酸代表启动子csvmv;seq id no:9中的核苷酸代表启动子hlv h12;seq id no:10中的核苷酸代表启动子pclsv;seq id no:11中的核苷酸代表启动子mmv;seq id no:12中的核苷酸代表启动子camv e35s;seq id no:18中的核苷酸代表蛋白质标签myc;seq id no:19中的核苷酸代表蛋白质标签hsv;seq id no:20中的核苷酸代表蛋白质标签flag;seq id no:21中的核苷酸代表蛋白质标签ha;seq id no:22中的核苷酸代表蛋白质标签v5;seq id no:23中的核苷酸代表终止子camv 35s;seq id no:24中的核苷酸代表终止子ubq3;seq id no:25中的核苷酸代表终止子hsp18.2;seq id no:26中的核苷酸代表终止子pea3a;seq id no:27中的核苷酸代表终止子e9;seq id no:28中的核苷酸编码报道蛋白hyg;seq id no:29中的核苷酸编码报道蛋白gfp。
[0140]
特别地,表达盒pbing008包含以下七个可表达的基因:
[0141]
启动子tctp
‑‑‑
编码cds的核苷酸序列
‑‑‑
编码表位标签myc的核苷酸序列
‑‑‑
终止子camv 35s;
[0142]
启动子fsgt-pflt
‑‑‑
编码细胞色素p450(cyp87d18)的核苷酸序列
‑‑‑
编码表位标
签hsv的核苷酸序列
‑‑‑
终止子ubq3;
[0143]
启动子csvmv
‑‑‑
编码eph3的核苷酸序列
‑‑‑
编码表位标签flag的核苷酸序列
‑‑‑
终止子hsp18.2;
[0144]
启动子hlv h12
‑‑‑
编码sqe的核苷酸序列
‑‑‑
编码表位标签ha的核苷酸序列
‑‑‑
终止子pea3a;
[0145]
启动子pclsv
‑‑‑
编码ugt720的核苷酸序列
‑‑‑
编码表位标签v5的核苷酸序列
‑‑‑
终止子e9;
[0146]
启动子mmv
‑‑‑
编码gfp的核苷酸序列;
[0147]
启动子camv e35s
‑‑‑
编码hyg的核苷酸序列,
[0148]
其中上述七个可表达基因通过间隔区可操作地连接,以形成整合的表达盒pbing008。
[0149]
表2.表达盒pbing008的所选择序列。
[0150][0151][0152]
在一些实施例中,表达盒被携带在质粒上,以便允许由宿主细胞产生酶。在其他实施例中,表达盒被携带在允许染色体整合的载体上,这允许酶从染色体中表达。
[0153]
植物品系的构建和转化
[0154]
在一些实施例中,制备本披露的转基因植物的方法涉及构建植物品系,并用根据本披露制备的表达盒转化所选择的天然植物。
[0155]
通常已知的是,罗汉果醇/罗汉果苷途径酶的天然表达和天然罗汉果醇/罗汉果苷的天然产生仅存在于罗汉果中。在本技术的一些实施例中,选择待用编码罗汉果醇/罗汉果苷途径酶的核苷酸序列转化的天然植物不是罗汉果。特别地,天然植物在被其天然基因组转化之前,并不天然产生所有的罗汉果醇/罗汉果苷途径酶,并且不产生罗汉果醇和罗汉果苷。在一些实施例中,甚至天然植物通过其天然基因组可以产生一种或多种能够产生罗汉果醇前体或罗汉果醇的酶,这些植物不天然产生非天然罗汉果苷。在某些实施例中,选择的用于转化的天然植物包括野生型、或未转化的、或非转化的西瓜,其天然基因组不天然产生可检测的罗汉果醇或罗汉果苷。
[0156]
就效率和成本而言,能够快速生产罗汉果苷的快速生长的经济水果、蔬菜或植物的转化更令人感兴趣。快速生长植物的非限制性实例是灌木樱桃、桃子和油桃、杏、萝卜、李子和它们的亲属、酸(sour/pie)樱桃、苹果、梨、甜樱桃、柑橘、黄瓜、西葫芦、豌豆、芜菁等。
[0157]
根据本披露的转基因植物通过将植物与基因组转化事件组合从而形成转基因植
物而产生,其中该基因组转化事件产生一种或多种罗汉果醇/罗汉果苷途径酶的非天然表达或浓度。在一些实施例中,将植物与基因组转化事件组合使用以下方法中的一种或多种进行:使用脂质体、使用电穿孔、使用增加游离dna摄取的化学品、使用将dna直接注射到植物中、使用粒子枪轰击、使用采用病毒或花粉转化、使用微突出物或使用农杆菌介导的转化。优选地,经由农杆菌介导的转化方法制备转基因植物。在一些实施例中,用表达盒转化根癌农杆菌以产生转基因农杆菌,然后将其用于转染感兴趣的植物,并且基于表达盒中报道基因的表达选择成功转化的植物。
[0158]
在一些实施例中,转基因植物是通过瞬时转化产生的烟草。首先,使用由weigel等人(transformation of agrobacterium using the freeze-thaw method[使用冻融法转化农杆菌],csh protoc.[冷泉港试验设计手册]2006年12月1日;2006(7))报道的冻融法,用本技术的表达盒转化根癌农杆菌菌株eha105。简而言之,制备化学感受态农杆菌。在添加表达盒后,将混合物交替地在液氮中冷冻和融化成液体。然后使细胞在溶源肉汤(lb)培养基中恢复,并铺在含有选择的抗生素的lb板上。
[0159]
第二,使烟草植株被感染。简而言之,允许转化的eha105农杆菌生长以产生可行的群体/培养物。选择具有适当成熟度的所选择烟草植物用于转化。将适量的转化的农杆菌培养物装载到烟草植物的组织上,直到指示完成。在取样和选择之前,使装载有转化的农杆菌培养物的植物生长适当的时间段。
[0160]
第三,基于在表达盒中表达报道基因的叶子,选择成功转化的烟草植物。
[0161]
在转基因烟草植物的某些实施例中,用于转化根癌农杆菌菌株eha105并产生转基因烟草植物的表达盒是pbing008。在其他实施例中,使用的表达盒选自表1所示的那些。在一些实施例中,表达盒的报道基因是gfp,并且转化的烟草植物的选择基于其表达gfp的叶子。
[0162]
在其他实施例中,转基因植物是转基因西瓜(西瓜),其通过以下方法产生。简而言之,首先,使用相同的冻融法用本技术的表达盒转化根癌农杆菌菌株eha105。第二,使用具有适当成熟度的西瓜幼苗来制备用于转化的外植体。从下胚轴切下子叶,收集并适当处理用于转化。然后,将转化的农杆菌培养物添加到这些外植体中。在感染后,将外植体涂抹在无菌纸巾上,并转移到具有murashige和skoog(ms)培养基的板上。将板密封并允许共培养适当的时间段。在共培养后,将外植体移至生长室,以使其在所选抗生素的阈值含量的选择下生长。
[0163]
在某些转基因西瓜实施例中,用于转化根癌农杆菌菌株eha105并产生转基因西瓜的表达盒是pbing008。在其他实施例中,使用的表达盒选自表1所示的那些。在一些实施例中,表达盒的报道基因是gfp,并且转化的西瓜植物的选择基于其表达gfp的叶子。
[0164]
在其他实施例中,通过用两个或更多个表达盒感染来共转化植物,其中使用的表达盒选自表1所示的那些。
[0165]
转基因植物及其组织中的蛋白质表达
[0166]
在一些实施例中,制备本披露的转基因植物的方法涉及通过转基因植物中引入的表达盒来监测和分析罗汉果醇/罗汉果苷途径蛋白/酶的表达。
[0167]
在一些实施例中,对根据本技术制备的转基因植物的组织或部分进行取样和处理,以获得准备用于分析的样品。对样品进行进一步分析,以检测由表达盒中感兴趣的基因
表达的蛋白质的存在和/或含量。
[0168]
在一些实施例中,将根据本披露制备的转基因烟草植物的叶子在蛋白质提取缓冲液中磨碎,并且然后进行离心。将所得上清液进一步稀释,并且然后用于抗体检测。通过检测由对应抗体的结合产生的化学发光信号以及蛋白质的大小(如在每次测量中用作对照的蛋白质大小阶梯所示)来证实每种靶蛋白的存在。在一些实施例中,通过使用jess仪器(bio-techne公司)进行蛋白质检测,该仪器自动化了用于蛋白质检测的传统蛋白质印迹法的蛋白质分离和免疫检测。在某些实施例中,出于分析和选择的目的,将信/噪比(s/n比)》3用作阳性信号的截止值。
[0169]
在一些实施例中,转基因植物由蛋白质检测结果显示了如下所有五种罗汉果醇/罗汉果苷途径酶/蛋白的存在:cds、sqe、细胞色素p450(cyp87d18)、ugt720和eph。在某些实施例中,转基因植物是转基因烟草。在其他实施例中,转基因植物是转基因西瓜。
[0170]
在本技术的转基因植物的各种组织中检测到了罗汉果醇/罗汉果苷途径酶,这些组织包括但不限于器官、组织、叶子、茎、根、花或花部分、果实、嫩枝、配子体、孢子体、花粉、花药、小孢子、卵细胞、合子、胚胎、分生组织区域、愈伤组织、种子、插条、细胞或组织培养物、胎盘、子房室、中果皮、果皮、表皮或转基因植物的任何其他部分或产物。在某些实施例中,在转基因植物的胎盘、子房室、中果皮、果皮和表皮中检测到了罗汉果醇/罗汉果苷途径酶cds、sqe、细胞色素p450(cyp87d18)、ugt720和eph。在一些实施例中,罗汉果醇/罗汉果苷途径酶的表达是组织特异性的。在某些实施例中,cds和ugt720的表达水平低于cyp87、sqe和eph。在其他实施例中,与其他罗汉果醇/罗汉果苷途径酶相比,eph的表达水平显著更高,特别是在果实组织中。
[0171]
罗汉果苷的代谢调节和酶促生产
[0172]
在一些实施例中,制备本披露的转基因植物的方法涉及分析各种非天然罗汉果苷的产生。在某些实施例中,出于选择的目的,分析转基因植物的罗汉果苷产生,并与对应的对照植物进行比较。
[0173]
在一些实施例中,提取和/或纯化转基因植物的组织或部分,以获得准备用于分析的样品。在一些实施例中,将uplc与tofms联用用于分析转基因植物组织中的代谢物。通过将分析结果与标准罗汉果苷关于ms谱图的保留时间和峰模式进行比较来确定罗汉果苷的存在。
[0174]
在一些实施例中,通过uplc-tofms分析的转基因植物由分析结果显示至少一种罗汉果苷的信号,而对照植物显示不存在罗汉果苷。
[0175]
在某些实施例中,通过uplc-tofms分析的转基因植物显示至少一种选自由以下组成的组的罗汉果苷:赛门苷i、西拉糖、罗汉果苷vi、罗汉果苷v、异罗汉果苷v、罗汉果苷iv、罗汉果苷iii、罗汉果苷iiie、罗汉果苷ii、罗汉果苷iia、罗汉果苷iia1、罗汉果苷iia2、罗汉果苷iie、罗汉果苷iie2、罗汉果苷i、罗汉果苷ia、罗汉果苷ie、或其任何组合,而对照植物由分析结果显示不存在罗汉果苷。
[0176]
在其他实施例中,通过uplc-tofms分析的转基因植物显示至少一种选自由以下组成的组的罗汉果苷:罗汉果苷ia、罗汉果苷ie、罗汉果苷iia、罗汉果苷iia1、罗汉果苷iia2、罗汉果苷iie、罗汉果苷iie2、或其任何组合,而对照植物由分析结果显示不存在罗汉果苷。
[0177]
在本技术的转基因植物的各种组织中检测到了罗汉果苷,这些组织包括但不限于
器官、组织、叶子、茎、根、花或花部分、果实、嫩枝、配子体、孢子体、花粉、花药、小孢子、卵细胞、合子、胚胎、分生组织区域、愈伤组织、种子、插条、细胞或组织培养物或转基因植物的任何其他部分或产物。在转基因西瓜的某些实施例中,在来自果实的种皮中检测到了罗汉果苷。
[0178]
在一些实施例中,本披露的转基因植物是可培养和可再生的。转基因植物的后代或祖先是一种或多种非天然酶的来源,该一种或多种非天然酶使得该后代和该祖先能够产生罗汉果醇、罗汉果苷、和/或其代谢物或衍生物。转基因植物种子的繁殖产生其有活力的后代,其中该后代产生罗汉果醇、罗汉果苷、和/或其代谢物或衍生物。
[0179]
在一些实施例中,产生非天然罗汉果醇/罗汉果苷的转基因植物是二倍体植物,具有二倍体染色体组。在某些实施例中,二倍体转基因植物产生种子,其中这些种子包含非天然罗汉果苷,并且其中二倍体转基因植物的种子繁殖产生其有活力的后代,其中该后代产生罗汉果醇、罗汉果苷、和/或其代谢物或衍生物。在一些实施例中,转基因植物是葫芦科/葫芦。在一些实施例中,转基因植物是转基因西瓜(西瓜)。在某些实施例中,转基因西瓜是二倍体。
[0180]
来源于转基因植物的含罗汉果苷的甜味剂和消费品
[0181]
在一些实施例中,本披露总体上涉及包含罗汉果苷和/或其代谢物或衍生物的甜味剂或增甜组合物,其中甜味剂或增甜组合物来源于产生并包含非天然罗汉果醇/罗汉果苷的转基因植物。在某些实施例中,甜味剂或增甜组合物来源于根据本披露制备的罗汉果醇/罗汉果苷途径转基因植物。
[0182]
本披露的罗汉果醇/罗汉果苷途径转基因植物在适当加工后可以获得含罗汉果苷的甜味剂。所得甜味剂可以用于为许多目的提供低热量或无热量的甜味。提供甜味的此类用途的实例是在饮料,诸如茶、咖啡、果汁和水果饮料;食品,诸如果酱和果冻、花生酱、馅饼、布丁、谷物、糖果、冰淇淋、酸奶、烘焙产品;保健品,诸如牙膏、漱口水、止咳糖、止咳糖浆;口香糖;和糖替代品中。在某些实施例中,甜味剂在根据本技术的转基因植物的汁液中。
[0183]
在一些实施例中,本披露还涉及制备来源于产生非天然罗汉果醇/罗汉果苷的转基因植物的甜味剂的方法。这些方法通常包括以下步骤,包括但不限于预处理、清洗和粉碎转基因植物或其部分、提取转基因植物或其部分、沉降和/或离心、吸附和/或分离、浓缩和回收以产生粗制甜味剂、进一步纯化、任选的浓缩/干燥以及配制。提取方法包括在室温、或加热温度、或冷藏温度下的水提取;经由有机溶剂诸如乙醇等的提取。分离和纯化方法包括离心、浸泡、重力沉降、过滤、微滤、纳滤、超滤、反渗透、色谱、吸收色谱、交换树脂纯化等。
[0184]
在某些实施例中,甜味剂是从根据本披露制备的转基因植物的叶子中获得的。在其他实施例中,甜味剂是从根据本披露制备的转基因植物的果实中获得的。
[0185]
在一些实施例中,甜味剂是从根据本披露的转基因西瓜获得的,其中甜味剂包括由转基因西瓜产生的非天然罗汉果苷。
[0186]
虽然本文所述的罗汉果醇/罗汉果苷途径转基因植物的形式及其制备方法构成了本披露的优选实施例,但应理解,本披露不限于这些精确的形式。如对于本领域技术人员将是清楚的,上述各种实施例可以组合以提供进一步的实施例。如有必要,本发明的转基因植物、方法和过程(包括其特定组成部分)的方面可以被修改,以最佳地采用本披露的系统、方法、节点和组成部分以及概念。这些方面被认为完全在如所要求保护的本发明的范围内。例
如,上述各种方法可以省略一些动作,包括其他动作,和/或以不同于所示实施例中阐述的顺序执行动作。
[0187]
此外,在本文教导的转基因植物和制备方法中,各种动作可以以不同于所示和所述的顺序进行。根据以上描述,可以对本系统、方法和物品进行这些和其他改变。一般来说,在以下权利要求中,所使用的术语不应被解释为将本披露限制于说明书和权利要求中披露的具体实施例,而是应被解释为包括所有可能的实施例以及此类权利要求被授权的等同物的全部范围。因此,本发明不受披露内容的限制,而是其范围完全由所附权利要求来确定。
[0188]
说明书中提到的所有出版物、专利和专利申请表明了本披露内容所属领域中技术人员的水平。
[0189]
以下实例说明了本发明的优选但非限制性的实施例。
[0190]
实例
[0191]
实例1-与seq id no:1-31相关的核苷酸序列的鉴定
[0192]
经由先前报道的罗汉果苷途径的非专利文献(itkin等人,proc nat acad sci usa[美国国家科学院学报],2016;113:e7619-e7628)并且通过公开的专利申请wo 2014086842和wo 2013076577来鉴定与seq id no:1-31相关的核苷酸序列(全长cdna、est或基因组)。
[0193]
实例2-包含一个或多个选自seq id no:1-31的核苷酸序列的表达盒的构建
[0194]
如表1所示,构建了具有编码罗汉果苷途径酶的核苷酸序列的不同组合的各种表达盒。这些表达盒的构建遵循标准的基因工程化方法进行。
[0195]
简而言之,从基因合成供应商(genewiz公司)订购表达盒,并通过酶促消化和连接进行组装。例如,使用五个合成基因片段组装pbing008:1)tctp启动子/cds编码区/c-myc表位标签/camv 35s终止子;2)n3间隔区/fsgt-pflt启动子/cyp87d18编码区/hsv表位标签/at ubq3终止子;3)n5间隔区/csvmv启动子/eph3编码区/flag表位标签/at hsp18.2终止子;4)n8间隔区/hlv h12启动子/sqe1编码区/ha表位标签/pea 3a终止子;5)n7间隔区/pcslv启动子/ugt720编码区/v5表位标签/e9终止子。使用在它们的5'和3'末端处的独特bsai限制性位点将表达盒4和5组装到基于pcambia的植物二元体中,以产生中间载体pbing003。使用在它们的5'和3'末端处的独特bsai限制性位点将表达盒1、2和3组装到基于pcambia的植物二元载体中,以产生中间载体pbing005。然后将跨越表达盒1、2、3中间载体pbing005的mmv启动子/egfp基因的sbfi至sali限制性片段亚克隆到中间载体pbing003的sbfi至sali限制性位点中,以产生最终载体pbing008。使用酶sphi psti通过限制性消化分析来验证该载体,并且然后使用一系列寡核苷酸引物通过sanger测序来证实,这些寡核苷酸引物被设计为覆盖二元载体的整个t-dna区域。
[0196]
实例3-转基因植物烟草
[0197]
表达盒的构建:构建了选自表1的各种表达盒,并用于转化烟草和制备转基因烟草植物。表达盒pbing008包含编码罗汉果苷途径酶的所有五个转基因、分别编码gfp和hyg的两个报道基因,以及分别编码表位标签、弱启动子和终止子的核苷酸序列。以与如实例2所述的相同方式构建具有不同遗传组合的表达盒pbing003、pbing006、pbing007、pbing015和pbing024。
[0198]
转化的农杆菌的产生:使用冻融法(weigel,csh protoc.[冷泉港试验设计手册]
2006年12月1日;2006(7)),用一种或多种表达盒质粒(选自表1)转化根癌农杆菌菌株eha105。简而言之,制备化学感受态农杆菌。在添加质粒后,将混合物交替地在液氮中冷冻,并在37摄氏度水浴中融化成液体。然后使细胞在lb培养基中恢复约1小时,并铺在含有卡那霉素的lb板上。
[0199]
植物烟草的感染:简而言之,使转化的eha105农杆菌生长过夜,并且然后稀释直到od600读数达到0.12。选择六周大、各具有五片叶子的烟草植物用于转化。将稀释的转化的农杆菌培养物装载到5ml无针注射器中,并将约1.5ml注射到叶子的背面,直到叶子变成深绿色。在取样和选择之前,使装载有转化的农杆菌培养物的植物再生长10天。
[0200]
通过用一种或多种以下表达盒转化,分别制备了四种示例转基因烟草植物:
[0201]-pbing008(5个基因,弱启动子)
[0202]-pbing024(5个基因,强启动子)
[0203]-pbing003 pbing007(3 2个基因,弱启动子)
[0204]-pbing006 pbing015(3 2个基因,强启动子)
[0205]
组织中的蛋白质表达:将约50mg的叶子取样到1.7ml的微量离心管中,其中添加了500μl蛋白质提取缓冲液(1x ripa裂解缓冲液)。在离心去除碎片之前,将叶子组织在提取缓冲液中磨碎。在使用jess仪器(bio-techne公司)将4.5μl提取物用于抗体检测之前,通过提取缓冲液将上清液进一步稀释3倍,该仪器自动化了用于蛋白质检测的传统蛋白质印迹法的蛋白质分离和免疫检测。用于myc、hsv、flag、ha和v5标签的抗兔抗体购自赛默飞世尔公司(thermo fisher),并稀释50倍用于基于jess的western检测,该检测使用制造商手册进行。通过检测由对应抗体的结合产生的化学发光信号以及蛋白质的大小(如在每次测量中用作对照的蛋白质大小阶梯所示)来证实每种靶蛋白的存在。
[0206]
如表3所示,当用表达盒pbing008转化烟草叶子时,可以在10天内检测到所有五种靶蛋白,其中将s/n比》3用作阳性信号的截止值。
[0207]
表3.用表达盒pbing008转化的转基因烟草的叶子中罗汉果苷途径酶表达的分析结果。
[0208][0209]
代谢调节:在500μl提取缓冲液(80%甲醇)中提取约100mg植物组织。在离心后,迫使上清液通过0.22μm过滤器,以便除去剩余的颗粒。将waters acquity uplc与waters xevo四极杆飞行时间串联质谱仪联用,用于代谢物分析。对于uplc分离,使用waters acquity beh c18 1.7μm,2.1x 50mm柱,以水和乙腈作为溶剂(两者均含有1%甲酸)。对于
每次分析,注射1.5μl样品。将负esi下的ms/ms用于检测罗汉果苷化合物。为了检测罗汉果苷ii,将碰撞能量设置为30v。
[0210]
图4示出了标准罗汉果苷的upla分析结果。可以看出,罗汉果苷iia1和罗汉果苷iia在约5.9分钟的保留时间处被共洗脱。结果还显示m/z 423(罗汉果苷相关化合物的特征峰)穿过uplc分离梯度。罗汉果苷标准品显示浓度非常高(0.1mg/ml)。
[0211]
图5示出了分别用表达盒pbing008和pbing024转化的转基因植物烟草的叶子中罗汉果苷ii检测的uplc-tofms(保留时间)分析结果。可以看出,与不产生罗汉果苷峰的对照植物p019相比,pbing008转基因烟草和pbing024转基因烟草两者都产生了罗汉果苷ii峰,这通过与罗汉果苷标准品重叠的保留时间得到证实。
[0212]
图6示出了用表达盒pbing003和pbing007共转化的转基因烟草的叶子以及用表达盒pbing006和pbing015共转化的转基因烟草的叶子中罗汉果苷ii检测的uplc-tofms(保留时间)分析结果。可以看出,与不产生罗汉果苷峰的对照植物p019相比,pbing003 pbing007转基因烟草和pbing006和pbing015转基因烟草两者都产生了罗汉果苷ii峰,这通过罗汉果苷标准品的重叠的保留时间得到证实。
[0213]
图7和8示出了用表达盒pbing008转化的转基因烟草的叶子中罗汉果苷iia检测的uplc-tofms结果。可以看出,用表达盒pbing008感染的烟草叶子产生了峰a,其关于保留时间(图6)和质谱模式(图7)与罗汉果苷iia共有相同的特征,从而表明用表达盒pbing008转化的转基因植物烟草产生并包含罗汉果苷ii。
[0214]
实例4:组装的西瓜组织特异性转录组
[0215]
西瓜果实由于其大的尺寸和受欢迎的风味而具有生产无热量甜味剂的巨大潜力。为了设计用于途径工程化的基因组编辑或顺式基因策略,鉴定西瓜果实特异性启动子是至关重要的,这些启动子使得遗传有效载荷能够最佳表达。这些启动子的鉴定需要高分辨率的转录组数据集,从中可以产生在西瓜果实可食部分中特异性表达的基因列表。到目前为止,还没有公开可用的转录组资源可以区分西瓜果实在不同发育阶段的不同部分。
[0216]
本研究提供了一种生物分析方法,用于检测和量化两个商业品种的西瓜(查尔斯顿格雷和糖宝宝)的各种果实部分中内源基因的表达水平。使西瓜生长,并收集其组织和发育阶段特异性样品。从所有这些样品中提取高质量的rna,并且针对每个样品生成超过2000万个rna-seq读数。对每个样品中每个靶基因的测序结果和归一化rna表达水平进行分析和定量。产生了据发现在西瓜果实的果肉中高度富集的基因的初步列表。
[0217]
表4总结了收集用于rna-seq分析的各种西瓜组织样品。对于糖宝宝物种和查尔斯顿格雷物种中的每一个,收集了45个果实组织样品(5种类型
×
3个年龄
×
3个重复=45)、6个叶子样品(2个年龄
×
3个重复=6)和3个根样品。图9示出了西瓜及其各个部分的解剖。
[0218]
表4.收集各种西瓜组织用于rna-seq分析。
[0219]
变体变量1变量2变量3变量4变量5物种多样性糖宝宝查尔斯顿格雷
ꢀꢀꢀ
组织叶子根果实
ꢀꢀ
叶龄年轻的成熟的
ꢀꢀꢀ
果龄10天26天42天
ꢀꢀ
果实解剖表皮果皮中果皮子房室胎盘
[0220]
通过nanodrop和生物分析仪(bioanalyzer)检测所有rna。每个样品的总rna量为约1微克(μg)或更多。将纯度设定为od260/280=1.8-2.2,且od260/230≥2.0。通过生物分析仪由rin数检查rna的完整性将》7。作为rna-seq分析的结果,从所有样品中获得的最小读数为2080万,并且查尔斯顿格雷的平均读数为3.69亿,而糖宝宝的平均读数为3780万。
[0221]
对于rna-seq数据分析,低质量读数(q=30)被滤除。将干净的读数与查尔斯顿格雷参考基因组(wu等人,genome of
‘
charleston gray’,the principal american watermelon cultivar[美国主要西瓜品种“查尔斯顿格雷”的基因组],以及genetic characterization of 1,365accessions in the u.s.national plant germplasm system watermelon collection.[美国国家植物种质系统西瓜保藏中心1,365份材料的遗传特征]plant biotechnology journal[植物生物技术杂志],2019)进行比对。所得的比对率在89.7和93.58之间变化。计算每个样品的基因计数。然后将样品归一化以说明文库深度的差异。
[0222]
由查尔斯顿格雷和糖宝宝两者开发的西瓜果实的一个标志是粉红色/红色的果肉。番茄红素和β-胡萝卜素负责果实,并且已知这些色素的产生受八氢番茄红素合酶基因psy1控制(wang等人,developmental changes in gene expression drive accumulation of lycopene andβ-carotene in watermelon[基因表达的发育变化驱动番茄红素和β-胡萝卜素在西瓜中的积累],journal of the american society for horticultural science[美国园艺科学学会杂志],2016,141(5),434-443)。从这个rna-seq数据集中,psy1基因的表达与粉红色/红色的积累高度相关:在26天和42天龄的果实的中果皮、胎盘和子房室组织中检测到最高的表达水平,如图10所示,正是这些组织显示出可见的粉红色和红色。psy1基因表达和组织颜色的相关性验证了由此项目产生的rna-seq数据集具有生物学意义。
[0223]
作为下一步,筛选来自36组样品的所有22545个基因的表达,以鉴定另外的果实特异性基因,其表达模式类似于psy1。标准定义为:(1)基因表达在26天大和42天大的果实中,在中果皮、胎盘和子房室组织(称为“靶组织”)中高度富集。表达水平应比果皮中的表达高多于5倍,并且比果实的根、叶子和表皮中的表达高多于20倍;(2)靶组织中的表达水平应》100fpkm(每百万作图读数的每千碱基转录物的片段),以消除低丰度但组织特异性的基因;以及(3)表达特征在两个品种中均应满足两个标准。
[0224]
结果,8个基因被鉴定为这种靶组织特异性基因(使用查尔斯顿格雷参考基因组鉴定器http://cucurbitgenomics.org/)。有趣的是,这些基因中的大多数被预测为参与植物代谢,这些基因确实有望在果实成熟阶段得到富集,如表5所示。这些基因在根据表4的西瓜样品的各种组织部分中的表达富集在图11-12中可见。来自这项研究的基因表达数据集可以成为发现组织特异性基因和启动子的独特资源,用于设计和生产转基因植物,以及分析和量化转基因植物中靶基因的表达。
[0225]
表5.从rna-seq分析鉴定的西瓜的组织特异性基因。
[0226]
基因id功能注释clcg07g003720枯草杆菌蛋白酶样丝氨酸蛋白酶clcg09g0077301-氨基环丙烷-1-羧酸氧化酶,推定的clcg01g019300udp-糖基转移酶1
clcg05g002790甾醇去饱和酶,推定的clcg05g025620脂肪酶clcg10g021830囊泡谷氨酸转运体2.1clcg01g000580双向糖转运体n3clcg06g004430脱水相关蛋白pcc13-62
[0227]
实例5-转基因西瓜
[0228]
表达盒的构建:类似于在实例3中制备转基因烟草,根据表1制备了各种表达盒。
[0229]
转化的农杆菌的产生:遵循实例3中提供的相同程序来产生转化的农杆菌。
[0230]
西瓜的感染:将两个商业品种的西瓜,查尔斯顿格雷和糖宝宝,用作宿主。使用五天大的西瓜幼苗来制备用于转化的外植体。从下胚轴切下子叶,并收集在填充有无菌水的培养皿中。通过切开剩余的下胚轴片段将两个附着的子叶分开,并将子叶外植体切成2mm的小块以备转化。为了转化,将农杆菌培养物添加到这些外植体中,并真空处理5分钟。在感染后,将外植体涂抹在无菌纸巾上,并转移到具有ms培养基的培养皿中的过滤盘上。将板密封并在黑暗中于25℃下放置3天进行共培养。
[0231]
通过用一种或多种以下表达盒转化,制备了转基因西瓜的实例:
[0232]-pbing008(5个基因,弱启动子)
[0233]-pbing028(5个基因,强启动子,hgy和gfp报道蛋白)
[0234]
表6.表达盒pbing028的组成序列。
[0235][0236]
转基因西瓜中的蛋白质表达:遵循实例3中提供的相同程序来监测并分析转基因西瓜样品中的蛋白质表达。
[0237]
表7示出了转基因西瓜样品的倍性、代谢物和基因表达的结果。使用来自叶子rna样品的q-rt-pcr定量表达水平。将表达水平归一化为预先定义的标准(设为1)。对于代谢物结果,***表示丰富;**表示清楚存在;*表示可能存在。如表7所示,当用表达盒pbing008或pbing028转化西瓜叶子时,可以在对应的转基因西瓜植物中检测到所有五种靶罗汉果苷途径蛋白。在某些转基因西瓜样品中,叶子被证明具有明显存在的或丰富的罗汉果苷iie。重要的是应注意,具有二倍体染色体的转基因西瓜008che4-19产生种子和果实,其中008che4-19的叶子可能存在罗汉果苷iie和丰富的罗汉果苷iie,如代谢物结果所示。相比之下,具有多倍体诸如三倍体(3x)或四倍体(4x)的转基因西瓜仅显示开花,但最终不产生种子或果实,或者在叶子或其他组织中不产生罗汉果苷。这些结果令人惊讶地表明,转基因
西瓜产生果实和种子的能力是出乎意料的,并且染色体倍性可能是产生非天然罗汉果苷的转基因西瓜的可重复性的重要因素。
[0238]
表7.转基因西瓜样品的倍性、代谢物和基因表达。
[0239][0240]
图13示出了各种转基因西瓜样品(用pbing008转化)中蛋白质检测的分析结果。在y轴上,动作表达的10%被设为值1.0。eph的表达高于该范围,并且未显示在此图中。可以看出,所有转基因西瓜样品都显示所有五种罗汉果苷途径转基因的高表达。样品008dle11簇显示所有转基因的高表达。样品008dle11-8果实具有最高的表达,并且还产生50个种子。
[0241]
图14示出了通过用表达盒pbing008转化制备的转基因西瓜中蛋白质检测的化学发光结果。可以看出,在转基因西瓜中发现了所有五种靶罗汉果苷途径酶的表达。
[0242]
为了理解检测果实中罗汉果苷产生的能力的差异,收集来自各种新产生的植物品系的西瓜,并将其解剖成各种果实部分。然后从各种果实部分样品中提取rna,并使用采用标准方案测量的q-rt-pcr来定量各种新整合途径基因的rna表达水平。这些测量显示了如图15-18所示的几种趋势。可以看出,所有转基因cds、cyp87、sqe、eph和ugt720都在所有果实组织(包括胎盘、子房室、中果皮、果皮和表皮)中表达。值得注意的是,表达模式在所有组织类型中是一致的。此外,cds和ugt720的表达低于cyp87、sqe和eph。eph在一些果实部分(包括含罗汉果苷iie的果实(008che4-13))中的表达显著更高。这可能是由于转基因插入
的位置效应。
[0243]
图15-18示出了用于表达罗汉果苷途径转基因的代表性转基因西瓜样品的各种组织的分析结果。可以看出,所有转基因cds、cyp87、sqe、eph和ugt720都在所有果实组织(包括胎盘、子房室、中果皮、果皮和表皮)中表达。值得注意的是,表达模式在所有组织类型中是一致的。此外,cds和ugt720的表达低于cyp87、sqe和eph。eph在一些果实中的表达显著更高。
[0244]
代谢调节:遵循实例3中提供的相同程序来监测代谢调节并分析转基因西瓜样品的代谢物。
[0245]
如图19-20所示,与对照相比,包含表达盒pbing008的转基因西瓜显示出罗汉果苷iie的存在,这表明通过预期的酶促途径成功产生了罗汉果苷。
[0246]
评价了产生罗汉果苷iie的转基因植物在果实中产生罗汉果苷iie的能力。至少一种植物能够产生果实(008che4-13)。制备来自这种植物的果实的提取物并通过uplc-tofms进行分析。果实的提取物显示了罗汉果苷iie的特征性质量指纹图谱(在图21a中示出)。作为阳性对照,产生野生型、未修饰果实的提取物,并掺入100ng/ml罗汉果苷iie(在图21b中示出)。这些令人惊讶的结果表明了根据本披露的转基因植物产生包含非天然罗汉果苷的果实的出乎意料的能力。
[0247]
图22示出了来自转基因西瓜样品008sbe5-2和008che4-5(两者都包含表达盒pbing008)的种皮的uplc-tofms结果。可以看出,在果实的种皮中检测到罗汉果苷iie,表明在转基因西瓜的其他组织或部分(但不限于果实)中产生罗汉果苷。这些令人惊讶的结果表明了本披露的转基因植物的出乎意料的再现性。
[0248]
实例6:产生罗汉果苷的转基因的表达以及转基因西瓜t0和t1植物中罗汉果苷的产生。
[0249]
进行了进一步的研究以分析转基因西瓜(t0植物)及其后代(t1植物)两者中靶转基因的表达和罗汉果苷的产生。
[0250]
1.t0植物中靶基因的基因表达分析
[0251]
根据实例5中提供的方法,产生了超过100个转基因西瓜品系。将31株产生果实的植物用于基因表达分析。首先,使用q-rt-pcr研究了该途径中的关键限制酶cds在叶子和果实组织中的表达水平。为了比较所有样品的基因表达,将所有基因表达值归一化为肌动蛋白表达(设为1)的10%。结果(图23)示出了各种表达水平,从而证实了转基因cds的存在和表达。尽管表达变化在叶子中似乎是随机的,但在果实中可以看到更一致的模式,其中根据表6,来自两个转基因品系家族008che4和008dle11的多个植物显示出最高的表达(图23)。008che4-19在果实中显示最高基因表达。最初从008dle11外植体中分离的几个相关的转基因果实也在果实中显示高cds表达。发现了叶子和果实表达之间的显著差异。相比之下,野生型对照(在图23的右边)没有显示出如所预期的cds表达。其他4种靶基因cyp87、sqe、eph和ugt720的表达水平分别在图24-27中示出。
[0252]
2.转基因西瓜t0果实的代谢筛选证实转基因事件008che4-19中存在罗汉果苷iie
[0253]
使用uplc-ms分析西瓜果实的罗汉果醇衍生化合物,并且结果在图29中示出。作为对照,也使用uplc-ms分析标准罗汉果苷iie,并且结果在图28中示出。相比之下,来自008che4-19 t0果实的离子色谱和质谱片段两者的结果显示与罗汉果苷iie标准品的结果
非常匹配,从而表明罗汉果苷iie在此果实中的生物合成和积累。有趣的是,在t0中表征的所有果实中,来自008che4-19的果实也表达最高水平的cds,从而表明t0西瓜果实中cds表达和miie生物合成之间可能存在相关性。
[0254]
3.转基因西瓜后代(t1代)中转基因的事件表征和基因表达分析
[0255]
为了研究产生罗汉果苷的转基因的遗传并证实罗汉果苷iie可以在超过一代的转基因西瓜中产生,收集来自008che4和008dle11果实的种子并使其发芽。在发芽后,使用从叶子组织提取的dna,通过pcr对32株t1植物(包括5株gfp转基因对照)进行基因分型。将pcr探针设计用于扩增两个靶标:作为阳性对照的内源西瓜肌动蛋白基因和作为转基因整合指示的cds基因。如图30所示,肌动蛋白产物带的存在表明来自西瓜基因组dna的成功pcr;并且cds产物带的存在表明转基因的存在。所有样品的身份和基因分型结论列于左边和右边的表格中。如所预期的,还鉴定了几种野生型分离子(根据图30的样品#13、#16、#18、#27和#32)。这些基因分型结果证实了转基因盒的存在以及成功遗传到西瓜的t1代中。
[0256]
还对转基因t1植物的叶子取样,用于所有五个靶基因的q-rt-pcr检测。结果总结在表8中。将引物设计成特异性扩增转基因,而不是西瓜同源物(如由阴性对照所示)。这些值是三个独立生物重复的平均值,并归一化为肌动蛋白表达的10%,这在先前设为表达标准。发现植物008che4-1-s3、008che4-19-s5、008che4-19-s10、008dle11-2-s5和008dle11-7-s2是野生型分离子。与基因分型结果一致,所有野生型分离子和阴性、非转基因植物实际上没有显示这些靶标的表达。发现与包括008che4-19的其他转基因品系相比,008dle11-2家族显示了所有五个靶基因的总体更高的表达。在这五个基因中,由csvmv启动子驱动的eph始终显示出非常高的表达(为肌动蛋白的约10倍),从而表明这种启动子在西瓜中的强活性。
[0257]
表8.转基因西瓜t1植株叶子中所有五个产生罗汉果苷的基因的基因表达水平。
[0258][0259]
[0260]
4.代谢分析鉴定了三种产生罗汉果苷的西瓜t1果实
[0261]
收获由t1品系产生的果实用于代谢分析。如图31-33所示,lc-ms结果证实了在008dle11-4-s4、008dle11-2-s1和008dle11-9-s3中存在罗汉果苷iie,所有这些都是包含表达盒pbing008的t0转基因西瓜的后代。定量地,这三个t1样品分别产生约30ng、约17ng和约3ng(每克干重)的罗汉果苷iie。
[0262]
以下有编号的条款定义了本披露的进一步示例方面和特征:
[0263]
1.一种包含基因组转化事件的植物,其中该基因组转化事件产生一种或多种罗汉果苷途径酶的非天然表达或浓度,其中该植物生物合成地产生非天然罗汉果醇前体、罗汉果醇、罗汉果苷、和/或其代谢物或衍生物。
[0264]
2.一种包含非天然罗汉果醇前体和/或罗汉果醇的植物,其中该植物生物合成地产生罗汉果苷、和/或其代谢物或衍生物。
[0265]
3.根据条款1所述的植物,其中该植物是转基因植物,并且其中该基因组转化事件包含表达盒,其中该表达盒包含如seq id no:1-31中列出的核苷酸序列中的一个或多个。
[0266]
4.根据条款2所述的植物,其中该植物是包含表达盒的转基因植物,其中该表达盒包含如seq id no:1-31中列出的核苷酸序列中的一个或多个。
[0267]
5.根据条款3-4中任一项所述的转基因植物,其中该表达盒包含以下核苷酸序列中的一个或多个:与如seq id no:1-31中列出的核苷酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、或至少99%的序列同一性。
[0268]
6.根据条款2所述的转基因植物,其中该一种或多种罗汉果苷途径酶与如seq id no:1-31中列出的核苷酸序列具有至少70%、至少75%、至少80%、至少85%、至少90%、至少95%、至少96%、至少97%、至少98%、或至少99%的序列同一性。
[0269]
7.根据条款3-6中任一项所述的转基因植物,其中该表达盒包含选自由以下组成的组的一个或多个序列:启动子、间隔区、表位标签、终止子、报道基因、或其组合。
[0270]
8.根据条款1所述的转基因植物,其中该一种或多种罗汉果苷途径酶选自由以下组成的组:葫芦二烯醇合酶(cds)、角鲨烯环氧酶(sqe)、环氧水解酶(eph)、细胞色素p450、尿苷-5'-二磷酸(udp)依赖性葡糖基转移酶(ugt)、或其组合。
[0271]
9.根据条款1-8中任一项所述的转基因植物,其中该罗汉果苷选自由以下组成的组:赛门苷i、西拉糖、罗汉果苷vi、罗汉果苷v、异罗汉果苷v、罗汉果苷iv、罗汉果苷iii、罗汉果苷iiie、罗汉果苷ii、罗汉果苷iia、罗汉果苷iia1、罗汉果苷iia2、罗汉果苷iie、罗汉果苷iie2、罗汉果苷i、罗汉果苷ia、罗汉果苷ie、或其任何组合。
[0272]
10.根据条款1-9中任一项所述的转基因植物,其中该罗汉果苷选自由以下组成的组:罗汉果苷ia、罗汉果苷ie、罗汉果苷iia、罗汉果苷iia1、罗汉果苷iia2、罗汉果苷iie、罗汉果苷iie2、或其任何组合。
[0273]
11.一种可从根据条款1-10中任一项所述的植物获得的植物部分,该植物部分包括但不限于器官、组织、叶子、茎、根、花或花部分、果实、嫩枝、配子体、孢子体、花粉、花药、小孢子、卵细胞、合子、胚胎、分生组织区域、愈伤组织、种子、插条、细胞或组织培养物或该植物的任何其他部分或产物,其中该植物部分包含罗汉果醇前体、罗汉果醇、罗汉果苷、和/或其代谢物或衍生物。
[0274]
12.根据条款1-11中任一项所述的植物,其中其后代或祖先是一种或多种非天然酶的来源,该一种或多种非天然酶使得该后代和该祖先能够产生罗汉果醇前体、罗汉果醇、罗汉果苷、和/或其代谢物或衍生物。
[0275]
13.根据条款1-12中任一项所述的植物,其中该植物是二倍体植物。
[0276]
14.根据条款1-13中任一项所述的植物,其中该植物是葫芦科/葫芦。
[0277]
15.根据条款1-14中任一项所述的植物,其中该植物是西瓜(西瓜)。
[0278]
16.一种来源于植物的罗汉果苷甜味剂,其中该植物或其部分生物合成地产生并包含非天然罗汉果醇前体、罗汉果醇、罗汉果苷、和/或其代谢物或衍生物。
[0279]
17.根据条款16所述的罗汉果苷甜味剂,其中该甜味剂在该植物的提取物中。
[0280]
18.根据条款16-17中任一项所述的罗汉果苷甜味剂,其中该甜味剂从该植物或其一部分中纯化。
[0281]
19.根据条款18所述的罗汉果苷甜味剂,其中该甜味剂通过提取、浸泡、色谱或吸收色谱纯化。
[0282]
20.一种包含根据条款16-19中任一项所述的甜味剂的食品、配料、风味剂或饮料。
[0283]
21.一种用于生产非天然罗汉果醇前体、罗汉果醇或罗汉果苷的生物合成方法,该方法包括以下步骤:
[0284]
(a)将植物与基因组转化事件组合,从而形成转基因植物,其中该基因组转化事件产生一种或多种罗汉果醇/罗汉果苷途径酶的非天然表达或浓度;
[0285]
(b)使(a)的转基因植物群体生长和再生;
[0286]
(c)选择产生罗汉果苷的转基因植物;以及
[0287]
(d)收获罗汉果苷。
[0288]
22.根据条款21所述的方法,其进一步包括:
[0289]
制备/提供包含表达盒的质粒,其中该表达盒表达一种或多种非天然罗汉果醇/罗汉果苷途径酶;
[0290]
用这些质粒转化宿主细胞;以及
[0291]
用多个转化的宿主细胞转染该植物。
[0292]
23.一种制备产生非天然罗汉果醇前体、罗汉果醇或罗汉果苷的植物的方法,该方法包括将植物与基因组转化事件组合从而形成该转基因植物,其中该基因组转化事件产生一种或多种罗汉果醇/罗汉果苷途径酶的非天然表达或浓度。
[0293]
24.根据条款23所述的方法,其中将该植物与该基因组转化事件组合使用以下方法中的一种或多种进行:使用脂质体、使用电穿孔、使用增加游离dna摄取的化学品、使用将dna直接注射到植物中、使用粒子枪轰击、使用微突出物或使用农杆菌介导的转化。
[0294]
25.根据条款23-24所述的方法,其进一步包括:
[0295]
制备/提供包含表达盒的质粒,其中该表达盒表达一种或多种非天然罗汉果醇/罗汉果苷途径酶;
[0296]
用这些质粒转化宿主细胞;以及
[0297]
用多个转化的宿主细胞转染该植物。
[0298]
26.根据条款25所述的方法,其中该宿主细胞是微生物。
[0299]
27.根据条款26所述的方法,其中该微生物选自由以下组成的组:植物细胞、哺乳
动物细胞、昆虫细胞、真菌细胞、藻类细胞、细菌细胞、或其组合。
[0300]
28.根据条款27所述的方法,其中该细菌细胞是革兰氏阴性细菌。
[0301]
29.根据条款28所述的方法,其中,该革兰氏阴性细菌是根癌农杆菌。
[0302]
30.根据条款29所述的生物合成方法,其中使用冻融法用这些质粒转化该宿主细胞。
[0303]
31.一种用于生产非天然罗汉果醇前体、罗汉果醇或罗汉果苷的生物合成方法,该方法包括以下步骤:
[0304]
(a)将植物与基因组转化事件组合,从而形成基因编辑的植物,其中该基因组转化事件产生一种或多种罗汉果醇/罗汉果苷途径酶的非天然表达或浓度;
[0305]
(b)使(a)的基因编辑的植物群体生长和再生;
[0306]
(c)选择产生罗汉果苷的基因编辑的植物;以及
[0307]
(d)收获罗汉果苷。
[0308]
32.根据条款32所述的方法,其进一步包括:
[0309]
制备/提供包含表达盒的质粒,其中该表达盒表达一种或多种非天然罗汉果醇/罗汉果苷途径酶;
[0310]
用这些质粒转化宿主细胞;以及
[0311]
用多个转化的宿主细胞转染该植物。
[0312]
33.一种包含根据条款21-32中任一项所述的甜味剂的食品、配料、风味剂或饮料。
[0313]
34.根据条款1所述的植物,其中该植物是基因编辑的植物,并且其中该基因组转化事件通过选自包含转录激活因子样效应核酸酶(talen)、锌指核酸酶(zfn)、兆核酸酶(mn)及其组合的组的方法添加到植物中。
[0314]
以上说明书、实例、以及数据提供了对制造和使用本发明的组合物的完整描述。由于在不偏离本发明的精神和范围的情况下可以进行本发明的许多实施例,因此本发明在于下文所附的权利要求书。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。