1.本发明涉及生物医学技术领域,尤其涉及一种半乳糖凝集素-3磁微粒化学发光免疫定量检测试剂盒。
背景技术:
2.半乳糖凝集素-3(galectin-3,以下简称gal-3)是半乳糖凝集素家族的重要成员之一,大小为31kda。gal-3在巨噬细胞、嗜酸性细胞、中性粒细胞及肥大细胞中均有表达,主要定位于细胞质,但在细胞核和细胞膜表面也有表达。gal-3参与调节细胞增殖、抑制细胞凋亡、介导细胞黏附、参与血管形成及炎性反应等生物学功能。既往关于gal-3的研究多集中于肿瘤增殖、侵袭和转移方面,而从2006年开始,有学者注意到了gal-3与心力衰竭的相关性,发现gal-3通过参与炎症反应以及心机纤维化等病理过程,参与了心衰的发生、发展,对预测心衰的发生、预后评估、优化治疗具有重要作用,是临床实践中与心衰诊断和治疗密切相关的重要生物标志物。2017年美国心脏病学院,美国心脏协会及美国心衰学会共同制定的心衰指南中,gal-3的推荐等级为ⅱb,主要用于慢性心衰的预后评估。2020年,在《心力衰竭生物标志物中国专家共识》中,gal-3的推荐等级依然为ⅱb,临床上可用于预测心衰的发生,射血分数保留心衰(hfpef)的预后评估和危险分层以及指导慢性心衰的治疗。
3.目前用于gal-3检测的主要方法是酶联免疫吸附分析法(elisa)。酶联免疫吸附测定检测技术是利用抗原-抗体之间特异性的免疫反应识别生物液体中的靶分子,并利用酶-底物的显色反应定量反应待测样本中靶分子的含量。
4.但该方法自动化程度低且灵敏度,重复性均不够,操作上也不够方便,因此,已经不能满足大型医院快速定量检测的要求。
技术实现要素:
5.有鉴于此,本技术提供一种半乳糖凝集素-3磁微粒化学发光免疫定量检测试剂盒,操作快速简单、灵敏度及重复性高。
6.为达到上述技术目的,本技术采用以下技术方案:
7.第一方面,本技术提供一种半乳糖凝集素-3磁微粒化学发光免疫定量检测试剂盒,包括链霉素亲和素包被的磁微粒悬浮液,碱性磷酸酶标记的gal-3检测抗体溶液,生物素标记的gal-3捕获抗体溶液,重组gal-3抗原系列校准品,化学发光液及清洗剂。
8.优选地,所述gal-3检测抗体与gal-3捕获抗体为不同的鼠源单克隆抗体。
9.优选地,所述链霉素亲和素包被的磁微粒悬浮液为表面包裹有链霉素亲和素的粒径为1μm的四氧化三铁悬浮于含有0.01m pbs的磁微粒包被物缓冲液中所形成的悬浮液,所述链霉素亲和素包被的磁微粒悬浮液的浓度为0.2-0.4mg/ml。
10.优选地,所述重组gal-3抗原系列校准品的制备方法为,将重组gal-3抗原溶于含有0.1mtris和2%bsa的ph为7.4的校准品缓冲液中,所述重组gal-3抗原系列校准品依次为10ng/ml、60ng/ml。
11.优选地,所述化学发光液为2-氨基-2-甲基-1-丙醇的amppd底物液。
12.优选地,所述碱性磷酸酶标记的gal-3检测抗体溶液的制备方法为,将碱性磷酸酶标记的gal-3检测抗体溶于含有0.05m mes和1%bsa的ph为6.0的酶标缓冲液中,所述碱性磷酸酶标记的gal-3检测抗体溶液的浓度为0.1-4.0ug/ml,更为优选地,碱性磷酸酶标记的gal-3检测抗体溶液的浓度为1.0ug/ml。
13.优选地,所述生物素标记的gal-3捕获抗体溶液的制备方法为,将生物素标记的gal-3捕获抗体溶于含有0.01m pbs和1%bsa的ph为7.4的生物素标记缓冲液中,所述生物素标记的gal-3捕获抗体溶液的浓度为0.5-4.0ug/ml,更为优选地,生物素标记的gal-3捕获抗体溶液的浓度为2.0ug/ml。
14.优选地,所述生物素标记的gal-3捕获抗体的制备方法如下:将gal-3捕获抗体进行柱纯化,将纯化后的gal-3捕获抗体与生物素-nhs按照摩尔比1:1进行混合,并于25℃孵育反应45min,孵育结束后再次进行柱纯化。
15.优选地,所述碱性磷酸酶标记的gal-3检测抗体的制备方法如下:将n-琥珀酰亚胺-4-(n-马来酰亚胺甲基)-环乙烷-1-羧酸盐活化的gal-3捕获抗体与traunt’s试剂活化的碱性磷酸酶以摩尔比1:1.2的比例混合,而后进行柱纯化。
16.优选地,所述清洗液的组分包括tris,tween-20、防腐剂,所述清洗液的ph值为8.7。
17.本试剂盒的使用原理为:采用双抗体夹心法与磁微粒化学发光技术相结合,定量检测样本中的gal-3,在链霉素亲和素包被的磁微粒悬浮液中加入生物素标记的gal-3捕获抗体溶液,通过亲和素和生物素的亲和反应,形成磁微粒-亲和素-生物素-gal-3捕获抗体的复合物,加入gal-3检测样本或重组gal-3抗原系列校准品,通过抗原抗体反应,形成磁微粒-亲和素-生物素-gal-3捕获抗体-gal-3的复合物,再加入碱性磷酸酶标记的gal-3检测抗体,通过抗原抗体反应,gal-3检测抗体与gal-3的另一结合位点特异性结合,形成磁微粒-亲和素-生物素-gal-3捕获抗体-gal-3-gal-3检测抗体-碱性磷酸酶的复合结构,通过磁分离清洗过程,将复合物吸附在加样结构中,加入化学发光液,由仪器检测溶液的发光值(rlu),根据标准曲线定量计算出测试样品中gal-3的浓度。
18.本技术的有益效果如下:本方案将双抗夹心法与磁微粒化学发光技术相结合,制备试剂盒测定gal-3的含量,具有灵敏度高、准确度好、稳定性佳且可实现自动化操作简单便捷;检测快速,试剂量程宽,线性范围广。
附图说明
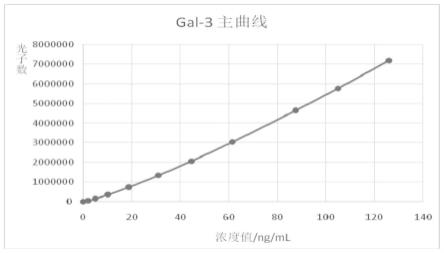
19.图1为本方案试剂盒gal-3的标准曲线;
20.图2为本方案试剂盒的临床比对结果。
具体实施方式
21.为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
22.本发明提供的半乳糖凝集素-3磁微粒化学发光免疫定量检测试剂盒中所用试剂
或仪器均可由市场购得。
23.下面结合实施例,进一步阐述本发明:
24.实施例1
25.一种半乳糖凝集素-3磁微粒化学发光免疫定量检测试剂盒,其制备方法如下:
26.1.链霉素亲和素包被的磁微粒悬浮液的制备
27.将表面包裹有链霉素亲和素磁微粒母液(采购于invitrogen公司)加入至磁微粒包被物缓冲液,形成浓度为0.2mg/ml的链霉素亲和素包被的磁微粒悬浮液,磁微粒包被物缓冲液按照表1的配方配制后,利用naoh或hcl调整ph值至7.4
±
0.1。
28.表1磁微粒包被物缓冲液的配方
29.物料名称浓度na2hpo4·
12h2o0.01mnah2po4·
2h2o0.01mnacl0.15mtween-200.05%bsa1%bnd1%
30.2.碱性磷酸酶标记的gal-3检测抗体溶液的制备
31.将商品化的磺基-琥珀酰亚胺-4-(n-马来酰亚胺甲基)-环乙烷-1-羧酸盐(sulfo-smcc,厂家:thermo fisher;货号:22322)活化的商品化的gal-3检测抗体(厂家:medix biochemica;货号:100733)与traunt’s试剂(厂家:thermo fisher;货号:26101)活化的碱性磷酸酶(厂家:bbi;货号:alpi12g)以1:1.2的比例混合,并用纯化柱(厂家:thermo fisher;货号:89882)进行分离纯化得到gal-3-ap母液。具体偶联步骤如下:
32.将gal-3抗体通过纯化柱进行脱盐纯化,并通过磷酸盐缓冲液(pbs=0.1m磷酸钠,0.15m氯化钠,ph 7.2)进行洗脱,使抗体的浓度为2.0mg/ml;
33.按照sulfo-smcc与抗体的摩尔比为20:1向gal-3抗体中加入sulfo-smcc,混匀后于25℃孵育30min;
34.反应结束后通过纯化柱进行纯化,得到活化后的带有酰胺键的gal-3抗体;
35.将ap酶溶解在ph 8.0的无胺磷酸盐缓冲液中,缓冲液中edta的浓度为2.5mm,使ap酶的浓度为2.0mg/ml;
36.按照traunt’s与ap酶的摩尔比为20:1向ap酶中加入traunt’s,混匀后于25℃孵育30min;
37.反应结束后通过纯化柱进行纯化,得到活化后的带有巯基的ap酶;
38.将活化后的带有酰胺键的gal-3抗体与活化后带有巯基的ap酶按照摩尔比1:1.2进行混合,混匀后于25℃孵育1h;
39.反应结束后通过纯化柱进行纯化,得到偶联的目标产物gal-3-ap。
40.将偶联好的gal-3-ap母液用酶标记物缓冲液稀释成浓度为1.0ug/ml的工作液待用,其中,酶标记物缓冲液按照表2的配方配制后,利用naoh或hcl调整ph值至6.0
±
0.1。
41.表2酶标记物缓冲液的配方
42.原料名称浓度
mes50mmnacl0.9%mgcl25mmzncl20.1mmbsa1%tween-200.1%pc-3000.05%
43.3.生物素标记的gal-3捕获抗体溶液的制备
44.将商品化(厂家:medix biochemica;货号:100733)的gal-3捕获抗体通过商品化的纯化柱(厂家:thermo fisher;货号:89882)进行纯化,收集纯化后的抗体,将gal-3捕获抗体与商品化的生物素-nhs(厂家:thermo fisher;货号:20217)按照摩尔比1:1进行混合,并于25℃孵育45min,孵育结束后将生物素-gal-3捕获抗体的偶联物通过纯化柱进行纯化得到gal-3-biotion母液,将偶联好的gal-3-biotion母液用生物素标记物缓冲液稀释成浓度为2.0ug/ml的工作液,生物素标记物缓冲液按照表3的配方配制后,利用naoh或hcl调整ph值至7.4
±
0.1。
45.表3生物素标记物缓冲液的配方
46.原料名称浓度na2hpo4·
12h2o0.01mnah2po4·
2h2o0.01mnacl0.15mtritonx-1000.1%甘油1%bsa1%pc-3000.1%
47.4.重组gal-3抗原系列校准品的制备
48.重组gal-3抗原(厂家:medix biochemica;货号:610144)系列校准品用校准品缓冲液分别配制成浓度约为10ng/ml和45ng/ml的工作液,校准品缓冲液按照表4的配方配制后,利用naoh或hcl调整ph值至7.4
±
0.1。
49.表4校准品缓冲液的配方
50.原料名称浓度tris0.1mbsa2%海藻糖2%pc-3000.3%
51.5.化学发光液的配制
52.化学发光液按照表5进行配制,而后利用naoh或hcl调整ph值至10.0
±
0.1。
53.表5化学发光液的配方
[0054][0055][0056]
6.清洗液的配制
[0057]
清洗液按照表6进行配制,而后利用naoh或hcl调整ph值至8.7
±
0.1。
[0058]
表6清洗液的配方
[0059]
原料名称浓度nacl0.9%tris0.01mtween-200.1%tritonx-1000.05%bnd0.1%
[0060]
将上述链霉素亲和素包被的磁微粒悬浮液,碱性磷酸酶标记的gal-3检测抗体溶液,生物素标记的gal-3捕获抗体溶液,重组gal-3抗原系列校准品,化学发光液及清洗剂组装成盒,于2-8℃保存。
[0061]
实施例2
[0062]
一种半乳糖凝集素-3磁微粒化学发光免疫定量检测试剂盒的测试方法:
[0063]
加样和孵育过程:吸取重组galectin-3抗原系列校准品(工作校准品或产品校准品)、或新鲜样本25μl加入反应杯中,然后加入链霉素亲和素包被的磁微粒悬浮液50μl,碱性磷酸酶标记的gal-3检测抗体溶液50μl,生物素标记的gal-3捕获抗体溶液50μl,然后37℃孵育反应10min。
[0064]
磁分离清洗过程:磁分离清洗3次。
[0065]
发光过程:加入化学发光液,37℃孵育后测定起光子数,样本中gal-3的含量与光子数成正比,绘制标准工作曲线,并根据标准工作曲线计算样本中的gal-3含量。
[0066]
测试与评价
[0067]
使用实施例1中的各个试剂对本方案的试剂盒进行半乳糖凝集素-3标准曲线的建立以及方法评价。
[0068]
标准曲线的建立
[0069]
加样和孵育过程:吸取重组galectin-3抗原校准品(工作校准品s0至s10,浓度分别为:0.00ng/ml,1.93ng/ml,4.83ng/ml,10.13ng/ml,18.64ng/ml,30.86ng/ml,44.41ng/ml,61.40ng/ml,87.48ng/ml,104.96ng/ml,125.89ng/ml,或产品校准品c1和c2,浓度分别
为10.08ng/ml和61.17ng/ml)25μl加入反应杯中,然后加入链霉素亲和素包被的磁微粒悬浮液50μl,碱性磷酸酶标记的gal-3检测抗体溶液50μl,生物素标记的gal-3捕获抗体溶液50μl,然后37℃孵育反应10min。
[0070]
磁分离清洗过程:磁分离清洗3次。
[0071]
发光过程:加入化学发光液,37℃孵育后测定起光子数,绘制标准工作曲线,如图1所示,本方案的试剂盒检测gal-3的标准曲线方程为:y=56686x-229218,r2=0.995。
[0072]
特异性
[0073]
取浓度为10ng/ml和50ng/ml的两份样本,将浓度为100mg/dl的胆红素母液分别添加0.1ml至0.9ml的上述两份样本中作为胆红素终浓度为10mg/dl的干扰样本;
[0074]
将浓度为91g/dl的甘油三酯母液分别添加0.011ml至0.989ml于上述两份样本中作为甘油三酯终浓度为1000mg/dl的干扰样本;
[0075]
将浓度为10g/dl的血红蛋白母液分别添加0.1ml至0.9ml于上述两份样本中作为血红蛋白终浓度为1000mg/dl的干扰样本;
[0076]
将浓度为142ng/ml的hama母液分别添加0.10ml至0.9ml于上述两份样本中作为hama终浓度为14.2ng/ml的干扰样本;
[0077]
将浓度为2000ng/ml的rf母液分别添加0.10ml至0.9ml于上述两份样本中作为rf终浓度为200ng/ml的干扰样本;
[0078]
另分别添加0.10ml生理盐水至另外一份0.9ml于上述两份样本中作为对照样本;分别添加0.011ml生理盐水至另外一份0.989ml于上述两份样本中作为甘油三酯对照样本。
[0079]
分别对干扰样本(测试结果记为x)和对照样本(测试结果记为x0)两份样本按照固定的加样及测试程序进行半乳糖凝集素3(gal-3)检测,每个样本重复三次取均值,测试结果见附表2所示。根据公式(1)计算两份样本浓度的相对偏差b。测试结果的干扰偏差在
±
10%以内,满足设计要求。
[0080]
b=(x-x0)/x0×
100%
……………………………………………………
(1)
[0081]
另外,测试浓度分别为1000ng/ml的半乳凝集素1与半乳凝集素9,其交叉反应率不足1%,结果如表7所示,其中,接受标准为:测试含有黄疸(胆红素≤10mg/dl)、血脂(甘油三酯≤1000mg/dl)、溶血(血红蛋白≤1000mg/dl)的样本,测试结果的干扰偏差在
±
10.0%以内,说明本方案的特异性强。
[0082]
表7特异性(内源性干扰)样本测试结果
[0083][0084]
精密度
[0085]
分别用已知浓度为10ng/ml和50ng/ml的两个样本分别作为低值样本和高值样本
按照固定的加样及测试程序各重复检测10次,计算10次测试结果的平均值m(低值样本的实测浓度为10.27ng/ml,高值样本的实测浓度为46.14ng/ml)和标准差sd(低值样本的sd为0.08ng/ml,高值样本的sd为0.42ng/ml),根据公式(2)计算变异系数(cv)。
[0086]
cv=sd/m
×
100%
……………………………………………………………
(2)
[0087]
按照公式(2)计算,低值样本和高值样本的实测cv分别为0.82%与0.90%,满足批内精密性变异系数不大于8.0%的设计要求,说明本方案的精密度高。
[0088]
线性范围
[0089]
将接近线性范围上限的高值样本(100ng/ml)和线性低值样本按附表8的比例进行混合,配制成6个浓度的样本。对每一浓度的样本按照固定的加样及测试程序均重复检测3次,计算其平均值,将理论浓度(0.00ng/ml,21.89ng/ml,43.79ng/ml,65.68ng/ml,87.57ng/ml,109.46ng/ml)作为x轴、检测结果平均值(0.00ng/ml,16.29ng/ml,39.40ng/ml,64.46ng/ml,88.87ng/ml,109.46ng/ml)作为y轴,用最小二乘法进行直线拟合,并计算线性相关系数r为0.998。满足试剂盒在2.0~100ng/ml范围内,线性相关系数(r)≥0.990的设计要求,线性范围广,具体测试结果见附表9。
[0090]
表8线性样本配制比例
[0091]
样本线性低值样本线性高值样本线性样本110000线性样本2800200线性样本3600400线性样本4400600线性样本5200800线性样本601000
[0092]
表9线性样本测试结果
[0093]
[0094][0095]
准确度
[0096]
将高浓度的gal-3(a)加入到低浓度的血清(或其他体液成分)b中,所加gal-3(a)与低浓度血清(或其他体液成分)b之间的比例为1:9,按照固定的加样及测试程序各重复检测3次,取平均值,a的浓度cs为63.78ng/ml,b的浓度c0为10.08ng/ml,混合后的样本浓度c为14.91ng/ml,根据下列公式(3)计算回收率。实测回收率为91%,满足回收率介于85%-115%范围内的设计要求,说明本方案的准确度高。
[0097][0098]
hook效应
[0099]
配制浓度约为1000ng/ml的高浓度样本,将高浓度样本使用抗原储存液按0.8倍,0.6倍,0.4倍,0.2倍,0.1倍依次梯度进行稀释。按照固定的加样及测试程序分别对高浓度样本和稀释样本进行测试,每个样本重复测试三次,计算三次测试发光值的平均值,其他样本的光值均不低于0.1倍稀释样本的光值。即gal-3浓度达到1000ng/ml,不出现钩状效应。满足产品的设计要求。具体测试结果见表10。
[0100]
表10 hook样本测试数据
[0101][0102]
校准品的均一性
[0103]
瓶内均一性
[0104]
取一盒同批次试剂盒中的产品校准品c1和c2,按照固定的加样及测试程序各重复检测10次,10个测量结果按照公式(4)~(6)计算测试结果的平均值(c1的实测浓度为10.01ng/ml,c2的实测浓度为60.15ng/ml),标准偏差(sd)(c1的sd为0.29ng/ml,c2的sd为0.79ng/ml)和变异系数(cv)。
[0105][0106][0107][0108]
按照公式(6)计算,c1和c2的实测cv分别为2.89%与1.31%,满足校准品瓶内均一性:变异系数cv≤8.0%的设计要求。具体测试结果见附表11。
[0109]
校准品瓶间均一性
[0110]
取同批号试剂盒10盒,取试剂盒内的校准品,按照固定的加样及测试程序每盒每管校准品测量1次,每个浓度水平共10个测定结果,按照公式(4)和(5)计算测试结果的平均值和标准偏差(sd1);
[0111]
取一盒同批次试剂盒中的校准品参考瓶内均一性的方法进行测试,按照公式(4)
和(5)计算测试结果的平均值和标准偏差(sd2);
[0112]
按照公式(7)和(8)计算瓶间均一性的标准偏差(sd)和变异系数(cv)。
[0113][0114][0115]
当sd1<sd2时,cv=0
[0116]
由附表11可知,校准品c1的瓶间均一性cv为0.62%,校准品c2的瓶间均一性cv为0.24%,满足设计要求。
[0117]
表11校准品均一性测试数据
[0118][0119][0120]
校准品的准确度
[0121]
取gal-3抗原用经校准的明德标准测量程序配制高、低两个浓度水平的定标样本,对全自动化学发光免疫分析仪进行校准后,检测产品校准品c1和c2,两个浓度各重复测量3次,其平均值记为m(c1与c2的测试浓度m分别为10.54ng/ml和60.51ng/ml),根据公式(9)计算测量浓度的相对偏差。
[0122]
b=(m-t)/t
×
100%
………………………………………………
(9)
[0123]
其中,t为标定浓度,c1与c2的标定浓度t分别为10.08ng/ml和61.17ng/ml,因此,c1与c2的相对偏差分别为4.56%和-1.08%,满足校准品测试结果与标定浓度的相对偏差在
±
15.0%范围内。
[0124]
效果验证
[0125]
与购自bg medicine.inc的酶联免疫试剂盒测定血清中gal-3的含量的测定值进行比较,实验结果如图2所示,并进行回归分析。从图2中可以看出本发明试剂盒与酶联试剂盒在血清中gal-3测定方面具有良好的相关性。
[0126]
在明德的平台上,来自于武汉大学人民医院(湖北省人民医院)的临床样本按照固定的加样及测试程序进行测试即可。比对平台elisa具体的测试步骤如下:
[0127]
1)按照说明书的要求稀释s1-s7及空白对照共8个点的工作校准品,浓度分别为10.0ng/ml,5.0ng/ml,2.5ng/ml,1.25ng/ml,0.625ng/ml,0.313ng/ml,0.156ng/ml,0.0ng/ml;
[0128]
2)将来自于武汉大学人民医院(湖北省人民医院)的样本按照1:10进行稀释;
[0129]
3)将步骤1中的工作校准品及步骤2的临床样本各取100μl加入到elisa的包被板中,在20-25℃的条件下孵育1h;
[0130]
4)孵育结束后,用清洗液进行洗板,每孔加入清洗液400μl,重复清洗4次;
[0131]
5)向每个反应孔中加入30倍稀释的示踪剂100μl,并在20-25℃的条件下孵育1h;
[0132]
6)孵育结束后,用清洗液进行洗板,每孔加入清洗液400μl,重复清洗4次;
[0133]
7)向每个反应孔中加入100μl的tmb底物,并在20-25℃的避光条件下进行孵育20min;
[0134]
8)孵育结束后,向每个反应孔中加入50μl的反应终止液,并在30min内完成在450nm处的吸光度测量。
[0135]
9)根据主曲线及临床样本的吸光度即可回算出临床样本的浓度。
[0136]
由以上结果可以看出,本发明涉及的试剂盒可实现自动化、操作简单方便、准确度高且各种性能指标均达标,本发明的半乳糖凝集素-3磁微粒化学发光试剂盒具有很好的适用性和先进性。
[0137]
以上,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。