1.本发明属于癌症治疗技术领域,尤其涉及一种七甲川菁染料-青蒿素偶联物及其应用。
背景技术:
2.青蒿素(art)是从黄花蒿中自主分离出的具有过氧化物桥(c-o-o-c)的倍半萜内酯类化合物,其衍生物主要有双氢青蒿素(dha)、蒿甲醚(artm)、青蒿琥酯(arts)、蒿乙醚(arte)等。近年来,大量的国内外研究表明,art除了具有抗疟作用外,在抗氧化、抗炎、抗肿瘤、抗菌、抗虫等方面也具有良好效果。但是青蒿素及其衍生物在癌症治疗中具有一定的局限性,如缺乏对癌细胞的靶向性、生物利用度低、药代动力学特性差和容易产生耐药性等。所以本领域亟需一种抗癌效果显著同时对耐药肿瘤也具有显著杀伤活性的新型化合物。
技术实现要素:
3.有鉴于此,本发明的目的在于提供一种七甲川菁染料-青蒿素偶联物,显著提高青蒿素的抗癌效果,同时对耐药肿瘤也具有显著杀伤活性。
4.为了实现上述发明目的,本发明提供了以下技术方案:
5.本发明提供了一种七甲川菁染料-青蒿素偶联物,所述七甲川菁染料-青蒿素偶联物的结构式为
[0006][0007]
本发明还提供了一种上述七甲川菁染料-青蒿素偶联物在制备治疗癌症药物中的应用。
[0008]
优选的,所述治疗癌症的途径包括杀伤癌细胞和/或抑制肿瘤生长。
[0009]
优选的,所述杀伤癌细胞的过程为:七甲川菁染料-青蒿素偶联物促进活性氧的产生,导致线粒体损伤,进而导致癌细胞快速死亡。
[0010]
本发明还提供了一种上述七甲川菁染料-青蒿素偶联物在制备治疗耐药癌症药物中的应用。
[0011]
优选的,所述耐药癌症包括对恩杂鲁胺、阿比特龙或紫杉醇具有抗药性的癌症。
[0012]
优选的,所述癌症的种类包括前列腺癌、乳腺癌和胰腺癌。
[0013]
本发明还提供了一种治疗癌症或治疗耐药癌症的药物,所述药物以上述七甲川菁染料-青蒿素偶联物为唯一活性成分。
[0014]
本发明的有益效果:本发明提供的两种七甲川菁染料-青蒿素偶联物能够有效杀死前列腺癌和乳腺癌细胞,活性显著高于抗癌药紫杉醇,其中hmcd-art1在体内的抑制前列腺22rv1肿瘤生长的效果显著。
[0015]
本发明七甲川菁染料-青蒿素偶联物均能在24小时内诱导前列腺癌和乳腺癌细胞快速死亡,且具有抑制肿瘤生长的作用。本发明七甲川菁染料-青蒿素偶联物在降低癌症细胞存活方面的效果要显著优于阳性药多西紫杉醇,而且对恩杂鲁胺、阿比特龙和紫杉醇具有抗药性的肿瘤细胞也具有显著的抗癌抑癌功效。
附图说明
[0016]
图1为本发明hmcd-art偶联物杀死前列腺癌细胞结果;
[0017]
图2为本发明hmcd-art偶联物杀死乳腺癌细胞结果;
[0018]
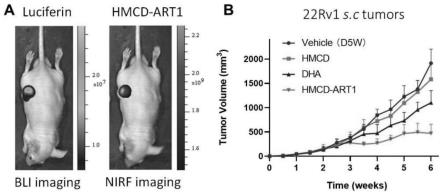
图3为hmcd-art1偶联物的肿瘤靶向特异性,a为hmcd-art1偶联物在注射后24小时进行活体生物发光(bioluminescence)bli和近红外荧光nirf成像结果,b为hmcd-art1显著抑制22rv1异种移植肿瘤生长结果;
[0019]
图4为hmcd-art1增加ros的产生并诱导线粒体损伤结果。
具体实施方式
[0020]
本发明提供了一种七甲川菁染料-青蒿素偶联物,所述七甲川菁染料-青蒿素偶联物的结构式为
[0021][0022]
本发明对于上述两种偶联物的具体来源或者制备方法没有特殊限定。
[0023]
本发明还提供了一种上述七甲川菁染料-青蒿素偶联物在制备治疗癌症药物中的应用。
[0024]
本发明七甲川菁染料-青蒿素偶联物通过杀伤癌细胞和/或抑制肿瘤生长,发挥治疗癌症的作用。所述杀伤癌细胞的过程为:七甲川菁染料-青蒿素偶联物促进活性氧的产生,导致线粒体损伤,进而导致癌细胞快速死亡。
[0025]
本发明还提供了一种上述七甲川菁染料-青蒿素偶联物在制备治疗耐药癌症药物中的应用。
[0026]
在本发明中,所述耐药癌症优选的包括对恩杂鲁胺、阿比特龙或紫杉醇具有抗药性的癌症,所述癌症的种类优选的包括前列腺癌、乳腺癌和胰腺癌。
[0027]
本发明还提供了一种治疗癌症或治疗耐药癌症的药物,所述药物以上述七甲川菁染料-青蒿素偶联物为唯一活性成分。
[0028]
本发明对于药物中的其他辅料成分没有特殊限定,采用本领域癌症药物的常规辅料即可。
[0029]
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0030]
下述实施例中,如无特殊说明,均为常规方法。
[0031]
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0032]
实施例1
[0033]
本发明七甲川菁染料-青蒿素偶联物的合成:
[0034]
所有化学品和试剂均购自sigma-aldrich(st.louis,mo)或fisher scientific(waltham,ma)。配制溶液的去离子水(18.2ω)来自milli-q direct ultrapure water system(merck millipore,billerica,massachusetts)。新合成的化合物的纯度通过高效液相色谱(hplc)进行检测,该系统由配备pda检测器的安捷伦系统组成,使用c18反向分析柱(2.7μm,50
×
4.6mm)。hplc使用0.1%tfa的80%乙腈水溶液,流速为1ml/min,在254和780nm双波长下检测。使用thermo fisher tsq fortis三重四极杆系统(thermo fisher scientific,waltham,massachusetts)以正离子模式进行电喷雾电离(esi)质谱分析。
[0035][0036]
化合物4b的合成:将乙酸钠(975毫克,11.9毫摩尔)添加到溶液化合物3(4.7克,13.0毫摩尔)和1-(6-羟基己基)-2,3,3-三甲基-3h-吲哚-1-ium 1c(4克,11.8毫摩尔)的150毫升无水乙醇溶液中,室温。将反应混合物在油浴中加热回流2小时。将反应液倒入冰水中。将混合物放置过夜并收集沉淀物,用甲醇-水重结晶并在真空下干燥,(4.3克,53%)。质谱(esi)m/z 691.43[m h] 。
[0037][0038]
hmcd-ars酯(hmcd-art1)6的合成:将化合物4b(350毫克,0.5毫摩尔)和青蒿琥酯5(195毫克,0.5毫摩尔)、edc(146毫克,0.76毫摩尔)和dmap(15毫克,0.12毫摩尔)溶解在10ml二氯甲烷。将混合物在室温搅拌15小时。减压除去溶剂,粗产物用二氧化硅柱色谱纯化,用二氯甲烷-甲醇洗脱。收集主要的绿色条带并在减压下除去溶剂。hmcd-青蒿琥酯酯6以深绿色固体形式获得179毫克(52%)。ms:m/z=1057.56[m h] 。
[0039][0040]
hmcd-dha醚(hmcd-art2)8的合成:在0℃搅拌下将hmcd-羟乙基氨基7(500毫克,0.67毫摩尔)和双氢青蒿素/dha 5(228毫克,0.81毫摩尔)溶解在10ml二氯甲烷中。加入三氟化硼乙醚合物(bf3.et2o,0.1ml)并将混合物在室温下搅拌约18小时,得到深绿色溶液。向反应混合物中加入乙醚(40毫升)。收集沉淀物并在真空下干燥。将粗产物溶解在3毫升甲醇中并通过c18反向硅胶柱色谱纯化,用甲醇-水洗脱。收集主要的绿色条带并在减压下除去溶剂。得到hmcd-dha醚8,为深绿色固体231毫克(34%)。质谱(esi)m/z 1014.50[m h] 。
[0041]
实施例2
[0042]
细胞培养:在以下的实施例中,除非另有说明,所有细胞系都是从美国生物标准品资源中心(atcc)购买的,并在美国atcc推荐的介质中培养,使用终浓度为10%的胎牛血清(fbs)和1
×
的青霉素/链霉素,除非另有规定,在37℃条件下,用5%的二氧化碳在细胞培养箱中培养链霉素。除非另有规定。
[0043]
c4-2b(crl-3315
tm
,上皮形态的人类前列腺癌细胞)亲代细胞系和由此衍生的耐药细胞在含有10%fbs的rpmi-1640中培养。
[0044]
pc3细胞(crl-1435
tm
,一种上皮形态的人类前列腺癌细胞系,起源于四级前列腺腺癌的骨转移)在含10%fbs的f-12k中培养。
[0045]
22rv1前列腺癌(pc)细胞(crl-2505
tm
,一种具有上皮形态的人类前列腺癌细胞系)在含有10%fbs的rpmi-1640中培养。
[0046]
mda-mb-231三阴乳腺癌细胞在含有10%fbs的rpmi-1640中培养
[0047]
抗前列腺癌细胞系mdvr和abir;mdvr细胞是抗恩杂鲁胺的细胞,abir是由父系c4-2b前列腺癌细胞形成的抗醋酸阿比特龙的细胞,taxr细胞是抗紫杉醇的细胞。具体为:将上述培养的细胞暴露于如下所示的各种药物中72小时。父系c4-2b细胞是c4-2b非耐药细胞,以前没有接触过癌症药物。抗药c4-2b细胞是通过长期暴露于相关药物(即mdvr采用恩杂鲁胺,abir细胞采用醋酸阿比特龙,taxr细胞采用紫杉醇)而产生的,最初是亚致死量,逐渐增加浓度,直到具有抗药性。
[0048]
将如上所述培养的细胞分别暴露于hmcd-art1和hmcd-art2的各种药物中24小时,即每一个细胞系都用hmcd-art(1,3)处理。以hmcd和未偶联的双氢青蒿素dha,以及紫杉醇(docetaxel,paclitaxel)作为对照组。对于每个细胞系,以0到100μm的浓度测定每种药物的ic
50
。通过mtt分析测定细胞活力和ic
50
,如下所示:将100μl中的1
×
104/ml细胞用增加的药物浓度或对照物处理24小时。在空白对照组(图中未显示)中,细胞暴露于dmso(载体)中,以达到与所测试药物的最高浓度相等的最终浓度,最大浓度小于0.1%v/v。在培养结束/添加sds前4小时,将10μl mtt(3-(4,5-二甲基-2-噻唑基)-2,5-二苯基-2h-四唑溴化物,sigma-aldrich)添加到含有细胞的孔中。培养结束时,加入100μl 10%十二烷基硫酸钠,然后将含有细胞的平板置于37℃细胞培养箱中培养8小时。上清液的吸光度密度在波长为595nm的96孔微板阅读器上读取。所有ic
50
均为相对ic
50
,结果如表1所示。相应剂量效应曲线结果分别如图1和图2所示。
[0049]
表1不同前列腺癌细胞的生长抑制(ic
50
,μm)
[0050] dhahmcdhmcd-art1hmcd-art2docetaxelc4-2b17.4》1002.63.72.2pc-3》100》1005.339.7》10022rv154.6》1003.85.14.5c4-2b
mdvr
》100》1001.86.7》100c4-2b
abir
37.1》1006.26.39.9c4-2b
taxr
31.6》1003.84.816.4mda-mb-231》100》10011.2618.43n/a
[0051]
说明:表1中记录的是三项独立研究的代表性结果。在所有研究中,细胞处理24小
时,然后用结晶紫检测细胞增殖。
[0052]
由图1和图2可以看出,本发明两种hmcd-art偶联物均能在24小时内诱导前列腺癌和乳腺癌细胞快速死亡。与亲本art类似物(未缀合的dha)和多西紫杉醇相比,本发明两种缀合物在降低c4-2b、pc3和22rv1pc细胞存活方面更有效。在对恩杂鲁胺mdv、阿比特龙abi和紫杉醇tax具有抗药性的4-2b细胞中也观察到了类似的效果。由表1可以看出,未结合的hmcd对癌细胞存活几乎没有影响。通过化学偶联,hmcd-art保留了肿瘤细胞特异性,同时获得了强大的抗肿瘤细胞毒性,这在未偶联的hmcd或art前体中是看不到的。
[0053]
实施例3
[0054]
将人癌细胞皮下植入(1
×
106)4-6周大的裸鼠(国家癌症研究所)中。通过体内生物发光成像或触诊评估,当小鼠肿瘤大小达到直径1-6mm时,给小鼠注射一次或多次药物,如hmcd、dha或hmcd-art1。对于携带22rv1前列腺肿瘤的小鼠,每周注射两次hmcd-art1(10mg/kg),hmcd(10mg/kg)或dha(如10mg/kg),持续6周。对于腹腔注射给药,所有试剂都溶解在5%葡萄糖水溶液(d5w),所以以d5w作为空白对照组。所有全身光学成像是在24小时或使用配有荧光滤光片组(激发/发射,800:850nm)的4000mm柯达成像站、直径120mm的视场、2mw/cm2的近红外发光的频率下摄像头进行拍摄的。相机设置:最大增益,2
×
2像素组合,1024
×
1024像素分辨率,曝光时间5秒。活鼠由perkinelmer ivis全鼠成像系统(激发,745nm;发射,820nm;perkinelmer公司)成像。成像前,用异氟烷(2.5单位)麻醉小鼠,并在成像过程中保持麻醉状态。实验的的比较结果如图3所示。结果表明本发明所述的hmcd-art1比hmcd和dha衍生物更有效地抑制前列腺22rv1皮下肿瘤的生长,而hmcd或art(dha)几乎没有肿瘤抑制活性。
[0055]
实施例4
[0056]
用hmcd、dha和hmcd-art处理癌细胞(22rv1)8小时,随后用mitosox在37℃下染色10分钟(染色细胞以产生线粒体ros),并用流式细胞术进行分析。22rv1细胞中的线粒体ros由增加的mitosox荧光定量,结果如图4所示,hmcd-art1诱导线粒体活性氧产生,与未结合的dha相比,hmcd-art1增强了ros的产生,进而诱导线粒体损伤,损害线粒体结构完整性和功能能力,导致癌细胞快速死亡,而hmcd和未结合的dha相对于22rv1癌细胞几乎没有作用。
[0057]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。