1.本发明涉及广藿香良种繁育技术领域,具体为一种道地南药高要广藿香良种组织培养方法。
背景技术:
2.广藿香(pogostemon cablin(blanco)benth.)又名刺蕊草、藿香、枝香,唇形科刺蕊草属多年生草本植物,以干燥地上部分入药,为2020版《中国药典》收载品种,广藿香原产于菲利宾、马来西亚、印度热带气候国家,宋朝时传入我国,以扦插繁殖栽培为主,被历代医家视为暑湿时令之要药,临床应用广泛,疗效较佳,是著名的道地南药,广东栽培广藿香的地方品种有石牌广藿香牌香、高要广藿香肇香和湛江广藿香湛香,广藿香是多种中成药的重要组成药物,也是新冠肺炎疫情常态化防控的中药防治处方成分之一。此外,从广藿香中提取的广藿香油可用于配制食品添加剂、口洁剂、化妆护肤品、定香剂和杀虫剂,在医药和轻化工业中具有重要作用,广藿香因不同产地的自然环境、种植习惯不同,其植物学形态、药材商品性状和品质有所差异,目前关于广藿香的研究主要集中在本草学的历史考证、全草中药饮片挥发油化学成分的提取鉴别及临床应用和药理药效研究方面。
3.有关广藿香组织培养体系研发的相关报道中对广藿香的愈伤组织诱导表明,培养基内同时含有0.5mg/l 6-ba和0.2mg/l naa,愈伤组织增殖较快、组织块为透明黄绿色,有利于广藿香愈伤组织的产生,对广藿香快繁技术的研究表明,ms培养基添加0.5mg/l 6-ba和0.1mg/l iba在培养21天时,对广藿香愈伤组织的产生及不定芽增殖效果较好,但调节剂浓度增高时,较易出现玻璃化和褐化现象,不适合于大规模工厂化生产,关于广藿香的生根诱导,研究表明,以1/2ms 蔗糖1.5% iba 0.5mg/l naa 0.5g/l为生根诱导培养基,培养25天时广藿香不定芽生根效果最佳,但随着培养时间延长会导致根毛增多,影响移栽,以1/2ms 蔗糖1.5% 活性炭1g/l naa0.2mg/l为生根培养基,有利于广藿香不定芽的生根,降低并缓解褐化现象。由此可见,广藿香组织培养体系中,从愈伤组织的诱导、不定芽增殖,到生根诱导的过程均较易出现玻璃化和褐化现象,对其培养基的精准筛选尤为重要。近年来生物医药产业发展迅速,广藿香种植基地向粤中西部迁移。高要广藿香[pogostemon cablin(blanco)benth.
‘
gaoyaoensis’]为入选国家中医药局选定100个品种的“国家中药标准化项目”之一,种植历史悠久,以其植株繁茂、抗逆性强、挥发油相对含量高的优点,种植面积逐年递增。但是,目前尚未见其组培体系研发的报道。以高要广藿香一年生植株为研究对象,通过植物学形态特性评鉴品种的适生性状,以优良品种植株的嫩茎段为外植体,筛选出高要广藿香增殖培养和生根诱导的最适培养配方,从而克服组培苗玻璃化、扦插种苗生根慢问题的方法。
技术实现要素:
[0004]
(一)解决的技术问题
[0005]
针对现有技术的不足,本发明提供了一种道地南药高要广藿香良种组织培养方
法,补增了现有专利尚未有研究的高要广藿香品种,并解决了现行技术中广藿香组培苗玻璃化和褐化、生根慢等问题。
[0006]
(二)技术方案
[0007]
为实现以上目的,本发明通过以下技术方案予以实现:一种道地南药高要广藿香良种组织培养方法,具体包括以下方法:
[0008]
s1.母株选取
[0009]
在晴朗天选取遗传性状良好的代表植株为母本,盆栽移植到工程技术中心驯化后,分别剪取新出枝条的第1~2节顶芽为外植体i,和第3节嫩茎段为外植体ii;
[0010]
s2.前期准备
[0011]
在进行实验寻找最合适培养方法前,需提前准备好相应的仪器和试剂;
[0012]
s3.高要广藿香植物学性状的测定
[0013]
随机采取高要广藿香种植地内的植株,对植株根、茎、叶的形状、颜色植物学性状进行观察并记录;
[0014]
s4.培养基的配制和灭菌
[0015]
高要广藿香组培体系采用ms培养基,配制过程为:取1l容量瓶,分别加入大量元素、微量元素、铁盐、有机物质母液各10ml,根据实验设置的培养基添加植物激素,加入蔗糖30g,用玻璃棒搅拌,蔗糖充分溶解后添加蒸馏水定容至1l,将ms基本培养基酸碱度调至ph5.8~6.4之间,最后加入卡拉胶9g;
[0016]
s5.外植体的消毒
[0017]
两种外植体用清水洗净,再用70%洗洁精冲洗2min,用清水洗去洗洁精后,在无菌超净工作台上用75%酒精浸泡8s;
[0018]
s6.诱导培养基下不同外植体的筛选
[0019]
将不同消毒处理后的外植体接种于诱导培养基,将不同部位的节茎组合对高要广藿香不定芽外植体的诱导效果进行比较;
[0020]
s7.芽增殖培养
[0021]
切取长势基本一致的丛芽接种到增殖培养基,每个配方接种30瓶,每瓶接种3丛,持续观察芽增殖情况,每隔5天统计芽数、增殖倍数、株高指标;
[0022]
s8.生根壮苗诱导培养
[0023]
增殖培养基中培养30天后,选取苗高约1.9~2.0cm且长势良好的高要广藿香无根芽苗,转接入生根培养基中;
[0024]
s9.培养条件
[0025]
本实验各个阶段的高要广藿香组培苗均置于28℃,光照时间12h/d,光照强度20%,湿度50%的人工气候室中进行培养;
[0026]
s10.组培苗的移栽
[0027]
生根壮苗诱导培养后,选取30天和40天、根系生长良好的组培苗,洗净组培苗根系上的培养基;
[0028]
s11.数据处理
[0029]
对所有生长指标进行了多次测定,并且用平均值
±
标准误差的形式来表示实验的结果,利用microsoft excel软件进行数据处理、表格和绘图分析。
[0030]
优选的,所述s2中仪器为sw-cj-1bu超净工作台、17100s-550立式压力蒸汽灭菌器、yh-jz
‑ⅱ
接种器械灭菌器、雷磁phs-3cph计、电子天平、500ml量筒、1000ml容量瓶、洗耳球、250ml烧杯、0.1ml刻度吸管、2ml刻度吸管、250ml酒精灯、手术剪刀、解剖刀、组培瓶、洗洁精、75%酒精、0.1%升汞。
[0031]
优选的,所述s2中以ms为基础培养基,所需试剂为hg/t3491-1999活性炭、iba、naa、6-ba、1mol/lhcl、1mol/lnaoh、大量元素、微量元素、铁盐、有机物质、蔗糖、卡拉胶。
[0032]
优选的,所述s4中具体还包括以下步骤:
[0033]
a.诱导培养基
[0034]
ms 1.0mg/l 6-ba 0.2mg/l naa 3.0%蔗糖 0.9%琼脂,ph值为6.2;
[0035]
b.增殖培养基
[0036]
ms 0.1mg/liba,ms 0.1mg/liba 0.2mg/l6-ba,ms 0.1mg/liba 0.4mg/l6-ba,ms 0.1mg/liba 0.6mg/l6-ba,各培养基添加3%蔗糖、0.9%琼脂,ph值为6.2;
[0037]
c.生根壮苗诱导培养基
[0038]
1/2ms,1/2ms 0.5g/l活性炭,1/2ms 1.0g/l活性炭,1/2ms 1.5g/l活性炭,各培养基添加1.5%蔗糖 0.9%琼脂,ph值为6.2,培养基分装后放入高压蒸气灭菌锅内进行灭菌。
[0039]
优选的,所述方法还包括分析高要广藿香的植物学性状。
[0040]
优选的,所述方法还包括诱导培养基下不同外植体的筛选。
[0041]
优选的,所述方法还包括不同浓度6-ba对高要广藿香不定芽增殖效果的影响。
[0042]
优选的,所述方法还包括不同浓度活性炭对高要广藿香不定芽生根壮苗诱导的影响。
[0043]
优选的,所述方法还包括组培苗的移栽。
[0044]
(三)有益效果
[0045]
本发明提供了一种道地南药高要广藿香良种组织培养方法。具备以下有益效果:
[0046]
本发明提供了一种道地南药高要广藿香良种组织培养方法,本方法选用高要广藿香第1~2节嫩茎作为组织培养的外植体有利于诱导芽的形成与存活进行实验,进而筛选出高要广藿香增殖培养和生根诱导的最适培养配方,从而克服组培苗玻璃化、褐化、生根慢的问题,从而得出高要广藿香增殖的最佳培养基配方为ms 0.1mg/liba 0.0~0.2mg/l6-ba,生根诱导的最佳培养基配方为1/2ms 1.5g/l活性炭。
附图说明
[0047]
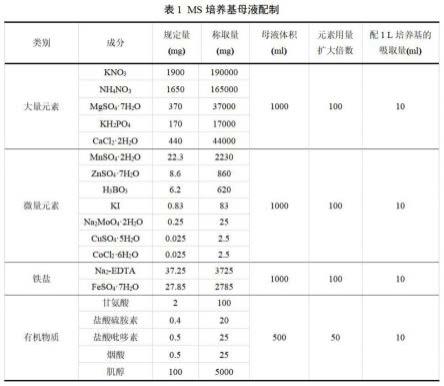
图1为本发明的ms培养基母液配制图表;
[0048]
图2为本发明高要广藿香组培体系外植体的筛选图;
[0049]
图3为本发明不同外植体在芽诱导培养基中的生长情况表;
[0050]
图4为本发明不同浓度6-ba对高要广藿香不定芽增殖的影响表;
[0051]
图5为本发明高要广藿香在ms 0.1mg/liba 0.2mg/l6-ba培养基中不定芽增殖的情况图;
[0052]
图6为本发明高要广藿香不定芽在增殖培养基中的培养情况表;
[0053]
图7为本发明高要广藿香在各培养基不定芽增殖的情况图;
[0054]
图8为本发明高要广藿香在生根壮苗培养基中的情况表;
[0055]
图9为本发明高要广藿香在生根壮苗培养基中的情况图;
[0056]
图10为本发明高要广藿香在生根壮苗培养基中的情况图;
[0057]
图11为本发明高要广藿香在生根壮苗培养基中的生根情况表;
[0058]
图12为本发明高要广藿香在生根壮苗培养基中的情况表;
[0059]
图13为本发明高要广藿香在1/2ms 1.5g/l活性炭培养基中的生长情况。
具体实施方式
[0060]
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
[0061]
实施例:
[0062]
如图1-13所示,本发明实施例提供一种道地南药高要广藿香良种组织培养方法,具体包括以下方法:
[0063]
s1.母株选取
[0064]
在晴朗天选取植物学遗传性状良好、有效成分含量高的代表植株为母本,盆栽移植到工程技术中心驯化后,分别剪取新出枝条的第1~2节顶芽为外植体i,和第3节嫩茎段为外植体ii。高要广藿香为多年生草本植物,单叶对生,叶柄细,多分枝,腋芽多且明显,枝条稍曲折,茎略呈方柱形,体表覆盖一层绒毛,质脆易折断,断面中部有髓,带有芳香味。高要广藿香主要以地上部分入药,出于经济效应与操作性考虑,因成熟叶两面被绒毛,消毒灭菌工作困难,用其作为外植体时容易污染,又因其茎较多,分为匍匐茎和直立茎,嫩茎段表面绒毛与叶相比较少,因此,选用高要广藿香的嫩茎作为外植体进行实验;
[0065]
s2.前期准备
[0066]
在进行实验寻找最合适培养方法前,需提前准备好相应的仪器和试剂;
[0067]
s3.高要广藿香植物学性状的测定
[0068]
随机采取高要广藿香种植地内的植株,对植株根、茎、叶的形状、颜色植物学性状进行观察并记录;
[0069]
s4.培养基的配制和灭菌
[0070]
高要广藿香组培体系采用ms培养基,ms基本培养基的具体母液成分用量配比见图1,配制过程为:取1l容量瓶,分别加入大量元素、微量元素、铁盐、有机物质母液各10ml,根据实验设置的培养基添加植物激素,加入蔗糖30g,用玻璃棒搅拌,蔗糖充分溶解后添加蒸馏水定容至1l,将ms基本培养基酸碱度调至ph5.8~6.4之间,ph过高用1mol/lhcl调节,过低用1mol/lnaoh调节,最后加入卡拉胶9g;
[0071]
s5.外植体的消毒
[0072]
两种外植体用清水洗净,再用70%洗洁精冲洗2min,用清水洗去洗洁精后,在无菌超净工作台上用75%酒精浸泡8s,其中,外植体i在浓度为0.1%的升汞溶液中浸泡4min,外植体ii浸泡5min,倒去升汞溶液,用无菌水漂洗5次,把残留的升汞漂洗干净,沥干水备用,在无菌操作台上,用无菌刀把消毒好的两种外植体切成长1.5~2.0cm的茎段;
[0073]
s6.诱导培养基下不同外植体的筛选
[0074]
将不同消毒处理后的外植体接种于诱导培养基,将不同部位的节茎组合对高要广藿香不定芽外植体的诱导效果进行比较,每个处理接种45瓶,每瓶一个外植体,观察记录外植体的生长、污染、褐化情况;
[0075]
s7.芽增殖培养
[0076]
切取长势基本一致的丛芽接种到增殖培养基,每个配方接种30瓶,每瓶接种3丛,持续观察芽增殖情况,每隔5天统计芽数、增殖倍数、株高指标;
[0077]
s8.生根壮苗诱导培养
[0078]
增殖培养基中培养30天后,选取苗高约1.9~2.0cm且长势良好的高要广藿香无根芽苗,转接入生根培养基中,每个配方接种30株单芽,每瓶3株,接种后持续观察芽苗生长及生根情况,每隔5天统计株高、根数、根长指标;
[0079]
s9.培养条件
[0080]
本实验各个阶段的高要广藿香组培苗均置于28℃,光照时间12h/d,光照强度20%,湿度50%的人工气候室中进行培养;
[0081]
s10.组培苗的移栽
[0082]
生根壮苗诱导培养后,选取30天和40天、根系生长良好的组培苗,洗净组培苗根系上的培养基,移栽至泥炭土:黄泥为2:1的基质中培养,移至温室大棚中,培养30天后统计成活率;
[0083]
s11.数据处理
[0084]
对所有生长指标进行了多次测定,并且用平均值
±
标准误差的形式来表示实验的结果,利用microsoft excel软件进行数据处理、表格和绘图分析。
[0085]
s2中仪器为sw-cj-1bu超净工作台、17100s-550立式压力蒸汽灭菌器、yh-jz
‑ⅱ
接种器械灭菌器、雷磁phs-3cph计、电子天平、500ml量筒、1000ml容量瓶、洗耳球、250ml烧杯、0.1ml刻度吸管、2ml刻度吸管、250ml酒精灯、手术剪刀、解剖刀、组培瓶、洗洁精、75%酒精、0.1%升汞。
[0086]
s2中以ms为基础培养基,所需试剂为hg/t3491-1999活性炭、iba、naa、6-ba、1mol/lhcl、1mol/lnaoh、大量元素、微量元素、铁盐、有机物质、蔗糖、卡拉胶。
[0087]
s4中具体还包括以下步骤:
[0088]
a.诱导培养基
[0089]
ms 1.0mg/l6-ba 0.2mg/lnaa 3.0%蔗糖 0.9%琼脂,ph值为6.2;
[0090]
b.增殖培养基
[0091]
ms 0.1mg/liba,ms 0.1mg/liba 0.2mg/l6-ba,ms 0.1mg/liba 0.4mg/l6-ba,ms 0.1mg/liba 0.6mg/l6-ba,各培养基添加3%蔗糖、0.9%琼脂,ph值为6.2;
[0092]
c.生根壮苗诱导培养基
[0093]
1/2ms,1/2ms 0.5g/l活性炭,1/2ms 1.0g/l活性炭,1/2ms 1.5g/l活性炭,各培养基添加1.5%蔗糖 0.9%琼脂,ph值为6.2,培养基分装后放入高压蒸气灭菌锅内进行灭菌,消毒灭菌时的压力为1.06kg
·
cm-2
或0.106mpa,121℃,保持20min;
[0094]
方法还包括分析高要广藿香的植物学性状,具体分析结果为一年生高要广藿香植株形态学高度约高72.8~79.2cm,冠宽约为35
×
32cm,叶片较厚,有皱折,叶形椭圆形,叶缘具不规则的钝齿,叶尖短尖或钝圆,叶基楔形,叶面色泽浓绿,叶背稍红紫色,全叶被密集细
绒状表皮毛或腺毛,叶长2.0~10.5cm,叶宽1.0~5.5cm,随年份增加叶片由嫩绿转变为深绿到紫红色,高要广藿香的茎分为匍匐茎和直立茎,分支数多,主茎为匍匐茎,实际长度可达110~150cm,直立茎由匍匐茎的节部分枝,通常4~10节的节部气生根明显,近地侧节间表皮有白色的不定根根凸,量多,茎枝呈椭圆形,全枝覆盖柔毛,随着枝龄的增加,其表皮颜色由绿色、紫红色逐渐转变,直立茎为紫红色,匍匐茎为土黄色,略带绿色,匍匐茎结实,有栓皮,有显著的褶皱和密布的皮孔,广藿香节间长达7~13cm,茎枝节部明显,节间稍膨大,老枝节部两侧有叶痕,高要广藿香的根系由主根与须根组成,主根粗壮较短为24.5~38.5cm,须根较细且分支多。
[0095]
方法还包括诱导培养基下不同外植体的筛选,具体的为高要广藿香外植体消毒后以ms 1.0mg/l6-ba 0.2mg/lnaa为诱导培养基,经15天的培养,各外植体在培养基中的成活率各不相同,如图3,其中外植体i的成活率最高,达53.3%,发芽率为30.0%,但污染率较高,达到46.7%,且褐化率为36.7%;外植体ii的发芽率仅有3.3%,褐化率高达83.3%,但污染率只有13.3%,虽然外植体ii在前期发芽率较高,但在后期发育状况明显比外植体i差,由图表分析得出,高要广藿香的第1~2节嫩茎做为外植体比第3节嫩茎效果更佳。
[0096]
方法还包括不同浓度6-ba对高要广藿香不定芽增殖效果的影响,具体的为切取长势基本一致的微小丛芽接种到增殖培养基,培养40天,如图2所示,随着培养时间增长,各实验组中不定芽增殖倍数均呈正生长,高要广藿香增殖培养过程中,添加浓度为0.4~0.6mg/l6-ba时,增殖倍数为6~8倍,均比其余实验组不定芽有较好的增殖效果,从图3可以看出,添加0.2mg/l6-ba培养基中不定芽生长健壮,长势较均匀,培养30天后增殖倍数变化不大,基本稳定,随后芽不断长高变粗,叶片变大叶脉清晰,从图3可以得出,无6-ba和添加6-ba浓度为0.2mg/l的培养基中不定芽长势较不均匀,株高较高,为(2.2
±
1.0)cm,而不定芽在添加0.4mg/l和0.6mg/l6-ba培养基中长势较均匀,其中添加0.4mg/l6-ba培养基中不定芽较矮小,株高为(1.9
±
0.3)cm,不定芽在无6-ba培养基中,与添加了不同质量浓度6-ba的培养基相比,增殖速度较慢,且芽体较小,但长势均匀,且有部分从节茎部位长出乳白色的根毛,添加0.6mg/l6-ba的培养基有40%的丛芽呈现玻璃化,而无6-ba和添加0.2mg/l6-ba的培养基并无玻璃化现象出现,综合分析成活率及其生长情况,得出随着6-ba质量浓度的增加,不定芽增殖倍数也增加,芽体较大,且有部分不定芽出现玻璃化。
[0097]
方法还包括不同浓度活性炭对高要广藿香不定芽生根壮苗诱导的影响,具体的为高要广藿香为丛生植物,与不添加活性炭的培养基比较,不同浓度活性炭对高要广藿香芽苗生根有一定影响,如图8,不定芽先生长后生根,与增殖培养时不同的是,随着培养进行不定芽节间距离变宽,出现分枝,叶片不断变大,底部形成一层透明的愈伤组织层并长出根,添加活性炭的培养基生根速率较快,在10天生根率达60%以上,添加0.5g/l活性炭生根快,生根率较高,10天时生根率达71.6%,不定芽长势良好,叶片深绿叶脉清晰,随着活性炭浓度增加,不定芽生根慢且生长较缓慢,叶片呈较透明绿色,无添加活性炭的1/2ms培养基生根较慢,生根率较低,10天时生根率达50.0%,不定芽生长缓慢,在30天时,添加活性炭的各培养基中不定芽皆已生根,根系密集,但根较细长,叶片呈深绿色,叶脉清晰可见。
[0098]
高要广藿香生根较快,10天就已长出根,但根长参差不齐,低浓度的活性炭会促进根部愈伤组织的产生,健壮的不定芽底部根系较发达,而较弱小的不定芽茎节上乳白色的根毛较多,添加0.5g/l与添加1.5g/l活性炭10天的平均根数达3.4条,但随着时间增长添加
0.5g/l活性炭生根速度降低,不添加活性炭的1/2ms培养基中的不定芽根部出现褐色愈伤组织,其叶片与另三组相比较小,培养到30天时,添加1.5g/l活性炭平均生根数较多,达8~14条,平均根长为1.5~2.0cm。
[0099]
方法还包括组培苗的移栽,具体的为分别将生根壮苗培养30天和40天后的组培苗移栽入泥炭土:黄泥为(2:1)的基质中培养,可以观察到移栽培养仅3天,组培苗皆已定根。继续培养30天后,两种组培苗的移栽成活率均达到100%,生长良好。
[0100]
高要广藿香外植体芽诱导以ms 6-ba1.0mg/l naa0.1mg/l作为培养基,研究不同外植体芽诱导的影响,经过15天的培养观察,发现外植体诱导的褐化率很髙,达到60%以上,而污染率在30%左右,未受到污染的高要广藿香外植体在培养5~10天后,其茎间可见有黄绿色腋芽冒出,且该腋芽在培养一段时间后,转为绿色,综合考虑为实验选择的消毒剂浓度和消毒时间对外植体的污染率和存活率有着重要影响,消毒剂浓度的过高过低及外植体消毒的时间过长过短都会抑制外植体的生理活性,造成外植体死亡,在本研究中使用0.1%升汞浸泡4~5min,考虑可能原因为消毒时间过长或升汞浓度过高,导致外植体褐变死亡,其次,这也与高要广藿香自身的植物学性状相关,其茎表面被有绒毛,会影响外植体的消毒工作,因此,高要广藿香组培仍需开展更多的实验工作,才能得到更适宜的外植体培养材料和更高效的外植体灭菌方式。
[0101]
高要广藿香增殖培养通过使用生长素iba和不同浓度细胞分裂素6-ba进行试验比较,据结果分析,细胞分裂素6-ba对高要广藿香有较好的增殖效果,芽苗生长较好,基本呈团簇状,但不定芽玻璃化在其高浓度培养基中均有出现,程度不均一,低浓度6-ba的培养基中,不定芽株高较高,而添加高浓度6-ba的培养基中,不定芽增殖倍数较高,但也增加不定芽玻璃化程度,可见高浓度细胞分裂素促进不定芽增殖,而低浓度促使其长高长壮,试验中观察到,6-ba浓度为0.0~0.2mg/l时,长出的芽健壮且叶片深绿,浓度增加至0.6mg/l时,芽扩繁倍数增大,但玻璃化程度也明显增大,其添加6-ba浓度高于0.2mg/l时,不定芽生长参差且出现玻璃化,随着培养时间增加,培养基中养分消耗,不定芽增殖速度减慢,到30天左右增殖稳定,不定芽生长,平均株高1.5~2.1cm。
[0102]
广藿香不定芽生根壮苗诱导,有学者认为无需添加激素便可诱导广藿香生根,于是本方法仅添加不同浓度活性炭以探究其生根效果,高要广藿香生根培养以不同浓度活性炭创造黑暗环境以利于诱导根系的生长,1/2ms中离子浓度低,不能满足不定芽生长的需求,因此会促使不定芽长根以汲取更多养分,本方法发现,无根不定芽先生长后生根,生根较快,发育好,但其底部根较少,随着培养时间的延长,茎节上长出乳白色细长的根毛,据结果分析,高浓度的活性炭促进高要广藿香生根效果较好,添加浓度为0.5g/l活性炭的培养基生根快,但根较短,当活性炭浓度达到1.5g/l时,高要广藿香生根快,且根数多较长,且除了常见的地下根外,还有不定芽节茎中长出的气生根,再转变为地下根,这与高要广藿香植物学性状所观察到的一致,这种生根特点也为高要广藿香后期炼苗种植提供研究思路,综合考虑认为高要广藿香有地下丛生根和白色细长的丛生状气生根两种根系,本方法中高要广藿香生根较快,可满足大规模生产快速制备芽苗的需要。
[0103]
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。