1.本发明涉及一种抗幽门螺旋杆菌的氧杂蒽酮类化合物以及该化合物的制备方法与应用。
背景技术:
2.幽门螺杆菌是一种螺旋形、微厌氧、对生长条件要求十分苛刻的革兰氏阴性菌,于1983年首次从慢性活动性胃炎患者的胃黏膜活检组织中分离成功。幽门螺杆菌生存于人体胃幽门部位,是最常见的细菌病原体之一,人体感染后首先引起慢性胃炎,并导致胃溃疡和胃萎缩,严重者则发展为胃癌。早在1994年世界卫生组织国际癌症研究机构就已将幽门螺旋杆菌列为i类致癌原,而根除幽门螺旋杆菌也被认为是能够有效预防胃癌发生的一级措施。然而近年来耐药菌株的增加以及特效抗菌药物的缺乏已成为临床治疗过程中的主要挑战,寻找新型的具有抗幽门螺旋杆菌活性的化合物作为药物先导分子是解决这一难题的重要手段。
技术实现要素:
3.本发明的第一目的是提供一种具有抗幽门螺旋杆菌活性的氧杂蒽酮类化合物,其结构式为:
4.本发明的第二目的是提供该化合物在抗幽门螺旋杆菌活性中的应用。
5.本发明提供的氧杂蒽酮类化合物具有较好的抗幽门螺旋杆菌(h.pylori bhks159)活性,可用于制备抗幽门螺旋杆菌药物。
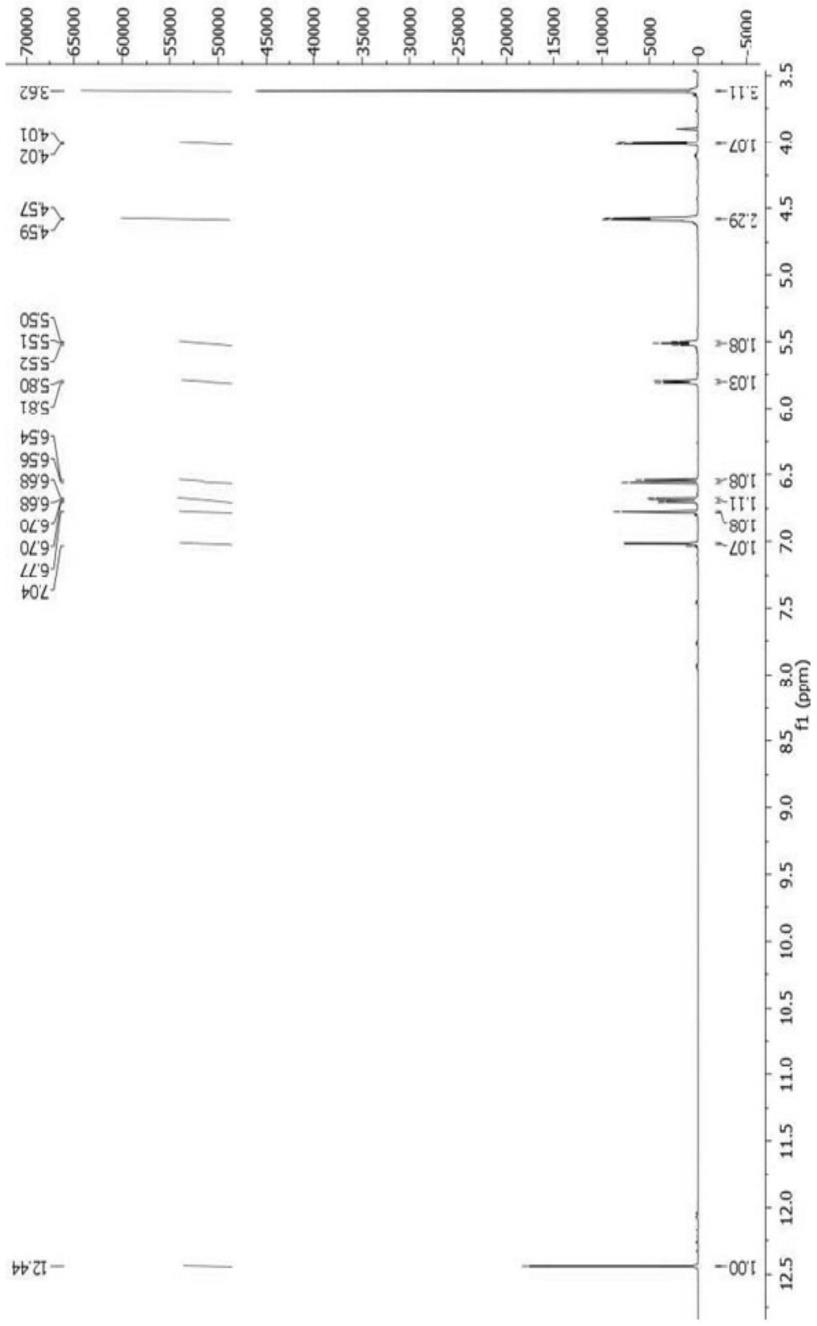
附图说明
6.图1为化合物(1)的1h核磁共振图谱。
7.图2为化合物(1)的
13
c核磁共振图谱。
具体实施方式
8.以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均来自常规生化试剂商店。以下实施例中的定量试验,均设置3次重复实验,结果取平均值。
9.实施例1
10.菌株zju5-1的分离和鉴定
11.1.菌株zju5-1的采集与分离
12.海洋沉积物中分离到一株菌,命名为菌株zju5-1。
13.菌株zju5-1为一种海洋来源的真菌。
14.2.菌株zju5-1的鉴定
15.分子鉴定
16.菌株zju5-1的18s ribosomal rna部分序列见序列表中的序列1(如seq id no.1所示),与genbank accession no.kr611594.1的序列相似性最高,相似性为99.81%。
17.根据以上鉴定结果,菌株zju5-1属于曲霉(aspergillus sp.)。
18.3.菌株zju5-1的保藏
19.菌株zju5-1,属于曲霉(aspergillus sp.),已于2019年11月6日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号),保藏号为cgmcc no.18829。
20.实施例2
21.化合物的制备
22.大米培养基:将200g大米在200ml水中浸泡过夜,121℃高压蒸汽灭菌30min。
23.pda培养基:将马铃薯200g、葡萄糖20g、琼脂15g和水1000ml混匀,121℃高压蒸汽灭菌30min。
24.1.菌株zju5-1的固体发酵
25.1.1菌株zju5-1的活化
26.将甘油管中保藏的菌株zju5-1在pda平板上培养5d,等待菌落长满平板。
27.1.2菌株zju5-1的固体发酵
28.当菌落长满平板后,将5个3cm2大小的菌块连同培养基接种到含有大米培养基的1000ml三角瓶中,25℃无菌培养30d。
29.2.化合物的提取
30.2.1在步骤1.2得到的三角瓶(含固体发酵物)中加入等体积有机试剂(乙酸乙酯:甲醇=4:1),室温浸提24h,收集第一次上清液。
31.2.2在步骤2.1的三角瓶中再次加入等体积有机试剂(乙酸乙酯:甲醇=4:1),室温浸提24h,收集第二次上清液。
32.2.3在步骤2.2的三角瓶中再次加入等体积有机试剂(乙酸乙酯:甲醇=4:1),室温浸提24h,收集第三次上清液。
33.2.4将步骤2.1的第一次上清液、步骤2.2的第二次上清液、步骤2.3的第三次上清液合并,减压蒸馏至干燥,得到11.0g粗提物。
34.3.化合物的分离纯化
35.3.1减压硅胶柱层析得到洗脱液
36.将步骤2.4得到的粗提物进行减压硅胶柱层析。
37.柱子型号为:6
×
35cm;
38.填充物为:薄层层析硅胶h;
39.洗脱过程为:用500ml洗脱液(由9.7体积份正己烷和0.3体积份二氯甲烷组成)进行洗脱,流速为50ml/min,收集过柱后的洗脱液。
40.3.2将层析洗脱液进行凝胶色谱分离得到凝胶洗脱液
41.所述凝胶色谱分离的参数具体如下:
42.柱子型号为:3
×
50cm;
43.填充物为:sephadex lh-20;
44.流动相为2体积份二氯甲烷和1体积份甲醇的混合物,流速为0.5ml/min;
45.收集保留体积为120
–
160ml的过柱后洗脱液,得凝胶洗脱液。
46.3.3将凝胶洗脱液进行反相hplc分离得hplc洗脱液
47.所述反相hplc分离的参数具体如下:
48.柱子型号为:eclipse xdb-c18(5μm;9.4
×
250mm);
49.洗脱过程为:用体积百分含量为25
–
65%的乙腈水溶液梯度洗脱28min,流速为3ml/min。
50.收集保留时间为7.5
–
8.2min(峰值的保留时间tr为7.9min)的过柱后洗脱液。
51.3.4将步骤3.3收集的hplc洗脱液减压蒸馏至干燥,得到44.1mg产物。
52.4.化合物的表征
53.将步骤3.4的产物进行有机质谱和核磁共振谱分析。
54.产物的表征数据如下:
55.黄色固体状;
56.分子式:c
16h14
o7;分子量:318;
[0057]1h核磁共振图谱见图1,
13
c核磁共振图谱见图2;
[0058]
依据以上表征数据上述化合物的理化数据和图谱,步骤3.4的产物为式(i)所示的化合物。
[0059][0060]
实施例3
[0061]
式(i)所示化合物对幽门螺旋杆菌(h.pylori bhks159)的抑制作用。
[0062]
采用微量稀释法检测式(i)所示化合物对幽门螺旋杆菌(h.pylori bhks159)的最低抑菌浓度(mic,100μl体系)。
[0063]
将甲硝唑(aladdin公司)作为化合物的阳性对照,进行平行实验。
[0064]
本实施例所用细菌为:幽门螺旋杆菌(h.pylori bhks159)。
[0065]
实验具体步骤如下:
[0066]
1.制备mic板
[0067]
第1孔先加脑心浸出液培养基(bhi)(具体成分包括:蛋白胨、脱水小牛脑浸粉、脱水牛心浸粉、氯化钠、葡萄糖、磷酸氢二钠,ph=7.4)173.6μl,再加6.4μl待测化合物,倍比稀释至第7孔;第8孔不加,保留90μl培养基,作为加菌不加待测化合物对照。
[0068]
2.制备菌液
[0069]
取固体平板上对数期生长的幽门螺旋杆菌(h.pylori bhks159),用bhi培养基制作成菌悬液,调整浓度od
600
为0.3(1
×
108cfu/ml),稀释10倍,为1
×
107cfu/ml,备用。
[0070]
3.接种菌液
[0071]
取10μl加至第1
–
8孔(每孔菌液浓度约为1.0
×
106cfu/ml)。培养72h判断结果。第1孔至第7孔化合物浓度分别为64、32、16、8、4、2、1μg/ml。
[0072]
4.结果判断
[0073]
以在小孔内完全抑制细菌生长的最低待测化合物浓度为mic。
[0074]
当阳性对照孔第8孔(即不含抗生素)内细菌明显生长试验才有意义。
[0075]
当在微量稀释法出现单一的跳孔时,应记录抑制细菌生长的最高化合物浓度。如出现多处跳孔,则不应报告结果,需重复试验。
[0076]
式(i)所示化合物对幽门螺旋杆菌(h.pylori bhks159)的抑菌作用需重复3次试验。
[0077]
式(i)所示化合物对幽门螺旋杆菌(h.pylori bhks159)的mic值为8μg/ml。
[0078]
甲硝唑对幽门螺旋杆菌(h.pylori bhks159)的mic值为大于16μg/ml。
[0079]
结论:式(i)所示化合物具有较强的抗幽门螺旋杆菌活性,可用作治疗幽门螺旋杆菌感染疾病的药物,也可用于制备抗幽门螺旋杆菌制剂。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。