用于治疗鼻炎的分配装置和药物组合物
1.本技术为分案申请,原申请的申请号为201880002822.x,申请日为2018年6月28日,优先权日为2017年6月28日,发明名称为“用于治疗鼻炎的分配装置和药物组合物”。
2.本技术要求于2018年4月16日提交的印度专利申请号201821014426以及于2018年2月23日提交的美国专利申请号15/903,597、于2017年12月14日提交的美国专利申请号15/842,063、于2017年9月27日提交的美国专利申请号15/716,661、于2017年8月30日提交的美国专利申请号15/691,500以及于2017年6月28日提交的美国专利申请号15/636,120的权益。
发明领域
3.本发明是关于一种用于向人类经鼻施用以治疗鼻炎的分配装置和药物组合物;并且更具体地说是关于一种含有包含莫米他松(mometasone)、其酯(例如莫米他松糠酸酯)或其盐及奥洛他定(olopatadine)或其盐(例如盐酸奥洛他定)的药物组合物的分配装置。
4.发明背景
5.鼻炎为关于鼻内部粘膜的刺激和炎症的医学术语。鼻炎可能会引起额外的症状,诸如打喷嚏、鼻发痒、咳嗽、头痛、疲劳、不适和认知损伤。对含有在治疗鼻炎时具有优良功效的药物组合物的易于使用、高效、可靠的分配装置存在需要。
技术实现要素:
6.本发明是关于一种用于经鼻施用含有莫米他松、其酯(例如莫米他松糠酸酯)或其盐以及奥洛他定或其盐(例如盐酸奥洛他定)的药物组合物的分配装置。所述分配装置和药物组合物尤其适合于治疗人类受试者的过敏性鼻炎。分配装置与药物组合物的组合实现了莫米他松和奥洛他定组分的一致给药。在一个实施方案中,组合物包含莫米他松糠酸酯和盐酸奥洛他定。
7.在一个实施方案中,用于向人类受试者经鼻施用的分配装置和药物组合物包括(a)药物组合物的容器;(b)用于从容器分配药物组合物的分配头,分配头至少包括泵或阀门机构、分配通道和分配孔口;(c)沿容器的纵轴延伸的滴管,滴管具有与分配头连通的近端和延伸至容器中的开口远端;以及(d)处于容器中并且与滴管的远端连通的药物组合物,其中药物组合物包含莫米他松、其酯或其盐以及奥洛他定或其盐。在一个实施方案中,药物组合物为含有水状胶体的水性悬浮液,其中莫米他松以微粒形式存在并且奥洛他定呈溶解形式。在一个优选实施方案中,药物组合物包含适当量的水状胶体,使得药物组合物具有10cps至约200cps或优选约20cps至约150cps的粘度。药物组合物可包含约0.001%w/w至约0.075%w/w呈微粒形式的莫米他松、其酯(例如莫米他松糠酸酯)或其盐,以及约0.5%w/w至约0.8%w/w呈溶解形式的奥洛他定或其盐(例如盐酸奥洛他定)。还可包括用于覆盖分配头端部的盖子。
8.在一个方面中,容器具有圆锥形形状的内部底部,其中内部底部朝向中心地向下与容器的侧面成角度。使中心沿容器的纵轴定位。内部底部可包括围绕纵轴定位于中心的
进一步凹陷加深的凹陷部,其中中心为容器内部底部的低点。在此方面中,滴管的远端可延伸至凹陷部中,或可定位于凹陷部的顶部。
9.在另一方面中,容器内部底部的凹陷部中还可包括凹槽。凹槽进一步加深凹陷部的内部底部并且延伸穿过容器的纵轴。因此,凹陷部的内部底部在中心处为容器的内部底部的低点。在此方面中,滴管的开口远端可延伸至凹槽中或可定位于凹槽的顶部。还是在此方面中,进一步加深凹陷部的内部底部的凹槽尺寸不影响凹陷部的外部底部,因为凹槽的加深尺寸在凹陷部底部的壁厚以内。
10.在另一方面中,至少容器内部底部的凹陷部中还包括凹槽。此凹槽进一步加深凹陷部的内部底部,尺寸大于凹陷部底部的壁厚,因此需要至少对凹陷部的外部底部加以修饰。在此方面中,其中具有凹槽的支持珠粒至少从凹陷部的外部底部延伸。支持珠粒还延伸穿过容器的纵轴。在此方面中,滴管的开口远端可延伸至凹槽中或可定位于凹槽的顶部。
11.在另一方面中,分配头在外部至少是由末端或端部壁和外侧壁限定。末端壁中包括分配孔口。在此方面中,盖子可释放地附接至分配头以至少覆盖分配孔口。盖子包括密封套筒,所述密封套筒可从盖子的内部表面延伸并且以不泄露或紧密密封的方式与分配头外侧壁的周边连通。
12.在另一方面中,在密封套筒与外侧壁的连通点处,密封套筒的远端的内径小于分配头的外侧壁的外径。此关系辅助使得盖子与分配头在闭合位置以紧密密封方式啮合。在此啮合中,密封套筒的远端为径向变形的。
13.在此方面或另一方面中,密封套筒可具有随密封套筒延伸远离盖子内部而减小的壁厚。盖子在其内部还可包括一个或多个突出片,所述一个或多个突出片与分配头的外侧壁卡扣配合以将盖子在闭合位置牢固地保持在分配头上。
14.在各种变更中可将上文和下文所叙述的分配装置的各种组件的特征选择性组合,所述各种变更各自涵盖于本文中。另外,可选择性地选择下文所叙述的药物组合物的特征来与分配装置一起使用。
15.在一个方面中,药物组合物包括约0.001%w/w至约0.075%w/w呈微粒形式的莫米他松、其酯(例如莫米他松糠酸酯)或其盐以及约0.5%w/w至约0.8%w/w呈溶解形式的奥洛他定或其盐(例如盐酸奥洛他定)。在此方面中,组合物还可包括水状胶体体系,所述水状胶体体系的量例如足以在当储存在25
±
2℃和60%
±
5%相对湿度下时持续至少24小时抑制相分离。在一个实施方案中,组合物当在25
±
2℃和60%
±
5%相对湿度下在分配装置中储存长达12个月时含有以下性质中的一种或多种:
16.(i)组合物含有不超过1%的总杂质(储存之后);
17.(ii)组合物含有不超过1%的dmc(储存之后);
18.(iii)组合物含有不超过1%的dmcf(储存之后);
19.(iv)组合物含有不超过1%的α-羟基奥洛他定(储存之后);
20.(v)组合物含有不超过1%的奥洛他定e-异构体(储存之后);
21.(vi)组合物含有不超过1%的奥洛他定相关化合物b(储存之后);和/或
22.(vii)组合物含有不超过0.42%的其他奥洛他定杂质(储存之后)。
23.在另一方面中,药物组合物包括约0.025%w/w至约0.05%w/w呈微粒形式的莫米他松、其酯(例如莫米他松糠酸酯)或其盐;以及约0.5%w/w至约0.8%w/w奥洛他定或其盐
(例如盐酸奥洛他定)。在另一方面中,药物组合物包括约0.025%w/w至约0.05%w/w呈微粒形式的莫米他松、其酯(例如莫米他松糠酸酯)或其盐;以及约0.6%w/w至约0.7%w/w奥洛他定或其盐。药物组合物还可包括如上文所描述的水状胶体。
24.在另一方面中,分配装置分配每揿约100μl的药物组合物,其中单次揿压分配约665mcg的盐酸奥洛他定和约25mcg或约50mcg的莫米他松糠酸酯(优选为25mcg莫米他松糠酸酯)。
25.更通常地,分配装置可包括容器、盖子和分配头,所述分配头可包括泵、滴管、阀门、揿压器、分配通道和分配孔口。泵被设计成通过装配有分配孔口的揿压器将药物组合物通过滴管分配至阀门中。以均匀喷雾形式释放药物组合物。阀门可为连续喷雾阀和/或计量阀。阀门可与揿压器串联操作,这允许易于打开和闭合阀门并且提供所需喷雾特征。揿压器包括但不限于喷雾揿压器、泡沫揿压器、固体流揿压器和专用揿压器。分配装置以均匀剂量的例如莫米他松(例如呈莫米他松糠酸酯形式)和奥洛他定(例如呈盐酸奥洛他定形式)递送鼻用喷雾,其中每当用户揿压分配装置时剂量得以分配。
26.为一致地分配组合物,分配装置可能需要启动约2-6次揿压。鼻用喷雾的液滴尺寸可由容器的分配孔口的尺寸控制。分配孔口尺寸还影响喷雾模式的特征。
27.在一个方面中,当通过分配装置以鼻用喷雾形式递送药物组合物时,其喷雾模式具有约15-75mm的最长轴、约10-65mm的最短轴和约1-2的椭圆率。
附图说明
28.结合图式参考以下描述将更好地理解本发明。出于说明的目的,在图式中展示本发明的某些实施方案。在图式中,在通篇中相同数字指示相同元件。然而,应了解,本发明不限于所示的精确布置、尺寸和仪器:
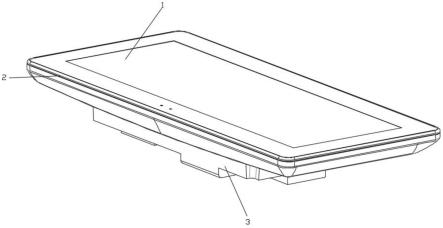
29.图1说明本发明的分配装置和药物组合物的容器的一个实施方案,容器具有平面底部;
30.图2说明本发明的分配装置和药物组合物的容器的另一实施方案的截面,容器具有圆锥形形状的底部;
31.图3说明本发明的分配装置和药物组合物的容器的另一实施方案的截面,容器具有含有凹陷加深的凹陷部的圆锥形形状的底部;
32.图4a和图4b分别说明本发明的分配装置和药物组合物的容器的另一实施方案的截面和底部透视图,容器具有含有凹陷加深的凹陷部的圆锥形形状的底部,所述圆锥形形状的底部包含在图4a中延伸至凹陷部底部下方的凹槽以及在图4b中在外部被显示在凹陷部下方的支持珠粒;
33.图5a和图5b分别说明本发明的分配装置和药物组合物的保护盖的一个实施方案的截面和部分分解视图,盖子被显示在分配头上处于闭合位置;并且
34.图6说明本发明的分配装置和药物组合物的分配装置的一个实施方案。
具体实施方式
35.本发明是关于一种用于向人类经鼻施用以治疗鼻炎的分配装置和药物组合物;并且更具体地说是关于一种含有包含莫米他松、其酯或其盐以及奥洛他定或其盐的药物组合
物的分配装置。
36.在一个实施方案中,用于向人类经鼻施用的分配装置和药物组合物包括(a)药物组合物的容器;(b)用于从容器分配药物组合物的分配头,分配头至少包括泵或阀门机构、分配通道和分配孔口;(c)沿容器的纵轴延伸的滴管,滴管具有与分配头连通的近端和延伸至容器中的开口远端;以及(d)处于容器中并且与滴管的远端连通的药物组合物,其中药物组合物包含莫米他松、其酯(例如莫米他松糠酸酯)或其盐以及奥洛他定或其盐(例如盐酸奥洛他定)。在一个实施方案中,药物组合物为含有水状胶体的水性悬浮液,其中莫米他松、其酯(例如莫米他松糠酸酯)或其盐以微粒形式存在并且奥洛他定或其盐(例如盐酸奥洛他定)呈溶解形式。在一个优选实施方案中,药物组合物包含适当量的水状胶体,使得药物组合物具有10cps至约200cps或优选约20cps至约150cps的粘度。药物组合物可包含约0.001%w/w至约0.075%w/w呈微粒形式的莫米他松、其酯(例如莫米他松糠酸酯)或其盐,以及约0.5%w/w至约0.8%w/w呈溶解形式的奥洛他定或其盐(例如盐酸奥洛他定)。还可包括用于覆盖分配头端部的盖子。
37.在一个方面中,容器可具有圆锥形形状的内部底部,其中内部底部朝向中心地向下与容器的侧面成角度。使中心沿容器的纵轴定位。内部底部可包括围绕纵轴定位于中心的进一步凹陷加深的凹陷部,其中中心为容器内部底部的低点。在此方面中,滴管的远端可延伸至凹陷部中,或可定位于凹陷部的顶部。
38.在另一方面中,分配头在外部至少是由末端或端部壁和外侧壁限定。末端壁中包括分配孔口。在此方面中,盖子可释放地附接至分配头以至少覆盖分配孔口。盖子包括从盖子的内部表面延伸的密封套筒,所述密封套筒以不泄露或紧密密封的方式与分配头外侧壁的周边连通。
39.在另一方面中,药物组合物包括约0.001%w/w至约0.075%w/w呈微粒形式的莫米他松、其酯(例如莫米他松糠酸酯)或其盐以及约0.5%w/w至约0.8%w/w呈溶解形式的奥洛他定或其盐(例如盐酸奥洛他定)。在此方面中,组合物还可包括水状胶体体系,所述水状胶体体系的量例如足以在当储存在25
±
2℃和60%
±
5%相对湿度下时持续至少24小时抑制相分离。在一个实施方案中,组合物当在25
±
2℃和60%
±
5%相对湿度下在分配装置中储存长达12个月时含有以下性质中的一种或多种:
40.(i)组合物含有不超过1%的总杂质(储存之后);
41.(ii)组合物含有不超过1%的dmc(储存之后);
42.(iii)组合物含有不超过1%的dmcf(储存之后);
43.(iv)组合物含有不超过1%的α-羟基奥洛他定(储存之后);
44.(v)组合物含有不超过1%的奥洛他定e-异构体(储存之后);
45.(vi)组合物含有不超过1%的奥洛他定相关化合物b(储存之后);和/或
46.(vii)组合物含有不超过0.42%的其他奥洛他定杂质(储存之后)。
47.在另一方面中,药物组合物包括约0.025%w/w至约0.05%w/w呈微粒形式的莫米他松、其酯(例如莫米他松糠酸酯)或其盐;以及约0.5%w/w至约0.8%w/w奥洛他定或其盐(例如盐酸奥洛他定)。在此方面中,药物组合物还可包括水状胶体。
48.通常,分配装置可包括容器、盖子和分配头,所述分配头可包括泵、滴管、阀门、揿压器、分配通道和分配孔口。泵被设计成通过装配有分配孔口的揿压器将药物组合物通过
滴管分配至阀门中。以均匀喷雾形式释放药物组合物。阀门可为连续喷雾阀和/或计量阀。阀门可与揿压器串联操作,这允许易于打开和闭合阀门并且提供所需喷雾特征。揿压器包括但不限于喷雾揿压器、泡沫揿压器、固体流揿压器和专用揿压器。分配装置以均匀剂量的例如莫米他松(例如莫米他松糠酸酯)和奥洛他定(例如盐酸奥洛他定)递送鼻用喷雾,其中每当用户揿压分配装置时剂量得以分配。
49.在一个方面中,分配装置分配每揿约100μl的药物组合物,其中单次揿压分配约665mcg的盐酸奥洛他定和约25mcg或约50mcg的莫米他松糠酸酯,优选为约25mcg莫米他松糠酸酯。
50.在另一方面中,分配装置可能需要启动约2-6次揿压以一致地分配组合物。鼻用喷雾的液滴尺寸可由容器的分配孔口的尺寸控制。分配孔口尺寸还影响喷雾模式的特征。
51.定义
52.术语“有效量”当结合活性成分使用时表示当向受试者施用以治疗鼻炎时活性成分在受试者中产生预期治疗益处的量。如本文所用的术语“活性成分”(可与“活性剂”或“活性物质”或“药物”互换使用)包括莫米他松糠酸酯或其盐以及奥洛他定或其盐。莫米他松糠酸酯或其盐的有效量可在约0.01mg至约10mg或优选约0.02mg至约5mg范围内。奥洛他定或其盐的有效量可在约0.05mg至约20mg或优选约0.1mg至约15mg范围内。
53.在本发明的一个方面中,对于通过经鼻途径每天施用,莫米他松糠酸酯或其盐的有效量可在约10mcg至约500mcg或优选约20mcg至约400mcg范围内,并且奥洛他定或其盐的有效量可在约50mcg至约7000mcg或优选约100mcg至约5400mcg范围内。
[0054]“盐”或“药学上可接受的盐”意味所述盐在合理医学判断范围内适合用于与人类和低等动物的组织接触而不会有过度毒性、刺激和过敏反应,与合理效益风险比相符,并且对其预期用途为有效的。代表性酸加成盐包括盐酸盐、氢溴酸盐、硫酸盐、硫酸氢盐、乙酸盐、草酸盐、戊酸盐、油酸盐、棕榈酸盐、硬脂酸盐、月桂酸盐、硼酸盐、苯甲酸盐、乳酸盐、磷酸盐、甲苯磺酸盐、甲磺酸盐、柠檬酸盐、马来酸盐、富马酸盐、琥珀酸盐、酒石酸盐、抗坏血酸盐、葡萄糖酸盐、乳糖酸盐和月桂基硫酸盐。代表性碱金属盐或碱土金属盐包括钠盐、钙盐、钾盐和镁盐。
[0055]
如本文所用的术语“治疗(treating/treatment)”包括预防、缓解、防止、改善或抑制在哺乳动物中由莫米他松、其酯或其盐或奥洛他定或其盐,或由两者的组合调节的病症。
[0056]“药学上可接受的赋形剂”意指药物组合物中除活性成分外并且由管理部门批准或通常被认为对于人类或动物使用安全的组分中的任一种。
[0057]
如本文所用,术语“平均粒度(average particle size)”(或同义地,“平均粒度(mean particle size)”)是指在粒子分布中所测量的所有粒子中约50体积百分比的尺寸小于所定义的平均粒度值并且所测量的所有粒子中约50体积百分比的粒度大于所定义的平均粒度值。这可通过术语“d
50”或“d
(0.5)”来鉴定。可使用各种技术来测量平均粒度,诸如显微术、激光衍射、光子相关光谱学(pcs)和库尔特氏原理(coulter'sprinciple)。
[0058]“水状胶体”是指其中亲水胶体粒子(例如亲水聚合物)分散于水中的胶体体系。水状胶体体系可以凝胶状态或溶胶(液体)状态存在。在悬浮液组合物中,水状胶体充当增稠剂、稳定剂和悬浮剂。水状胶体的非限制性实例包括黄原胶、阿拉伯胶、瓜尔胶、刺槐豆胶、海藻酸盐、淀粉、琼脂、角叉菜胶、明胶、avicel(微晶纤维素与羧甲基纤维素钠的
混合物)和纤维素衍生物(例如羧甲基纤维素钠)。优选地,水状胶体包括黄原胶或羧甲基纤维素钠。
[0059]
如本文所用,奥洛他定的术语“α-羟基奥洛他定”是指“(z)-2-{11-[3-(二甲氨基)亚丙基]-6,11-二氢二苯并[b,e]氧杂环庚烯-2-基}-2-羟基乙酸”。
[0060]
如本文所用,术语“奥洛他定e-异构体”是指“11-[(e)-3-(二甲氨基)亚丙基]-6,11-二氢二苯并[b,e]氧杂环庚烯-2-乙酸”。
[0061]
如本文所用,术语“奥洛他定相关化合物b”是指“(z)-3-{2-(羧甲基)二苯并[b,e]氧杂环庚烯-11(6h)-亚基}-n,n-二甲基丙-1-胺氧化物”。
[0062]
如本文所用,莫米他松的术语“8-dm”是指“(9β,11β-环氧基-17α,21-二羟基-16α-甲基孕甾-1,4-二烯-3,20-二酮)”。
[0063]
如本文所用,莫米他松的术语“dmc”是指“(21-氯-9β,11β-环氧基,17α,-羟基-16α-甲基孕甾-1,4-二烯-3,20-二酮)”。
[0064]
如本文所用,莫米他松的术语“dmcf”是指“(21-氯-9β,11β-环氧基-16α-甲基-3,20-二氧代孕甾-1,4-二烯-17基呋喃-2-甲酸酯)”。
[0065]“作用开始”为使患者可合理期望看到其过敏性鼻炎症状的有意义减轻(诸如反射性总鼻部症状得分(rtnss)、瞬时总鼻部症状得分(itnss)或反射性总眼部症状得分(rtoss)的有意义降低)的点。在统计学上,它是治疗起始之后药物在一级功效终点中相较于基线展示的变化大于安慰剂治疗时的首个时间点。药物与安慰剂之间的此统计显著性差异由此点向前维持一定时间(例如持续4小时)。参见“guidance for industry,allergic rhinitis:clinical development programs for drug products”,u.s.department of health and human services,food and drug administration,center for drug evaluation and research(cder),2000年4月。
[0066]
在一个实施方案中,术语“作用更快开始”是指与受试者的过敏性鼻炎的治疗相关的一个或多个参数的统计显著性更快减小,诸如受试者的反射性总鼻部症状得分(rtnss)、瞬时总鼻部症状得分(itnss)或反射性总眼部症状得分(rtoss)的统计显著性更快减小。
[0067]
术语“登广告”是指诸如通过大众媒体,包括但不限于报纸、杂志和网络广告、电视商业广告和广告牌标志通知、告知和/或报告一个或多个个体信息(例如用于治疗或减轻适应征的药物产品的功效或开始作用的时间)。如本文所用的术语“登广告”还包括在药物产品的标签中包括药物产品可治疗或减轻适应征的陈述。
[0068]
术语“销售”是指出售产品的动作或过程,包括但不限于任何为出售而供应产品或出售产品,以及登广告。
[0069]
分配装置
[0070]
用于向人类经鼻施用的分配装置包括(a)药物组合物的容器;(b)用于从容器分配药物组合物的分配头,分配头至少包括泵或阀门机构、分配通道和分配孔口;以及(c)沿容器的纵轴延伸的滴管,滴管具有与分配头连通的近端和延伸至容器中的开口远端。可能包括或可能不包括盖子。
[0071]
分配装置的容器可为圆形或椭圆形;优选地,容器为圆形。容器还可具有平面底部或大体圆锥形形状的底部。圆锥形形状的底部向下从容器侧面至底部中心成角度,中心为容器底部的低点。使底部的中心优选沿容器的纵轴定位。
[0072]
使滴管定位于容器内。在容器的平面底部实施方案中,使滴管的远端(开口)末端定位于平面底部附近。在容器的圆锥形形状实施方案中,使滴管的远端定位于容器的圆锥形形状部分(向下位于低点处)。使滴管的远端尽可能靠近容器底部的低点定位帮助避免在多次揿压期间在容器中形成死体积残余物(尤其当容器接近于耗尽时)。
[0073]
大体圆锥形形状的底部还可在容器的侧面与中心之间具有支持珠粒或围绕纵轴定位的凹陷加深的凹陷部,使得中心为容器的内部底部提供甚至更低的点。因此,凹陷部收容滴管的远端以更有效地减少任何死体积残余物。
[0074]
平面底部、圆锥形形状底部和含有加深的凹陷部的圆锥形形状底部可各自收容并且放置于具有平面封闭底部的基座杯上。基座杯可与容器底部卡扣配合,其中基座杯的上部开口端被装备成收容各别容器底部。
[0075]
图1说明本发明的分配装置的一个容器实施方案。容器110具有平面底部120。容器110的平面底部120放置于基座杯140上,所述基座杯140具有平面外部底部表面以使容器稳固从而易于储存。
[0076]
图2说明分配装置的另一容器实施方案。容器210具有含有内部低点230的圆锥形形状底部220。低点230可收容残余体积的药物组合物260。圆锥形形状底部220被显示放置于基座杯240上,所述基座杯240具有平面底部表面以使容器稳固地位于适当位置。
[0077]
滴管250定位于容器210内并且具有定位于容器210的低点230的远端(开口)末端。圆锥形形状底部220的这种特定构造使滴管250的远端尽可能靠近圆锥形形状底部220的低点230,允许在多次揿压分配装置后药物组合物260的残余体积较低,以尤其在容器210的内容物接近于耗尽时提供剂量体积。
[0078]
图3说明分配装置的另一容器实施方案。容器310具有含有围绕容器310的纵轴l定位的凹陷加深的凹陷部325的大体圆锥形形状的底部320。凹陷部325在容器310的侧面与容器310的中心之间加深,使得中心为容器310的内部底部提供低点330。另外,低点330可收容残余体积的药物组合物360。此实施方案再次被显示放置于基座杯340上,所述基座杯340具有平面底部表面以使容器稳固地位于适当位置。
[0079]
在如图3中所示的分配装置的另一容器实施方案中,凹陷部325的底部具有定位于其内部的凹槽365。凹槽365进一步加深凹陷部325的内部底部。在此实施方案中,凹槽365的尺寸不影响凹陷部325(或容器310)的外部底部。如图3中所示,容器310的外部底部呈凹陷部325的形状和轮廓。凹槽365的高度(或加深尺寸)在凹陷部325(和容器310)的底部的壁厚以内。在凹陷部325内,凹槽365横向延伸穿过容器310的纵轴l。
[0080]
使滴管350定位于容器310内。在仅具有凹陷部325(换句话说,凹陷部325内没有凹槽365)的容器310实施方案中,使滴管350的远端(开口)末端定位于凹陷部325的低点330处。在具有其中含有内部凹槽365的凹陷部325的容器310实施方案中,滴管350的远端(开口)末端延伸至凹槽365中,或延伸至凹陷部325的内部底部(如图3中所示,刚好位于凹槽365的顶部)。定位于容器310的纵轴l处的凹槽365的底部成为容器310中的组合物360的低点330。滴管350延伸至凹槽365中或延伸至凹陷部325的内部底部(刚好位于凹槽365的顶部)允许在多次揿压分配装置后药物组合物360的残余体积较低,尤其在容器310的内容物接近于耗尽时提供充足的剂量体积。
[0081]
图4a说明分配装置的另一容器实施方案的截面。图4b说明分配装置的容器实施方
案的外部、底部透视图,可将图4b中所示的外部容器实施方案与上文和下文所描述的内部容器实施方案中的一者或多者一起使用(例如可将图4b的外部容器实施方案与图3或图4a的内部容器实施方案一起使用)。
[0082]
在截面图4a中,容器410具有含有围绕容器410的纵轴l定位的凹陷加深的凹陷部425的圆锥形形状底部420。凹陷部425在容器410的侧面与容器410的中心之间加深,使得中心为容器410的内部底部提供低点430。在此实施方案中,凹槽465延伸至凹陷部425的底部下方(在图4a中以虚线示出),将容器410的内部底部的低点430加深至凹陷部425的底部下方。
[0083]
在此方面中,在凹槽465延伸至凹陷部425的底部下方的情况下,需要延伸容器410的外部底部。因此,如图4b中所示,使支持珠粒470在外部包围凹陷部425的底部定位,从而进一步加深凹陷部425的外部底部。在此实施方案中,凹槽465横向延伸,穿过容器410的纵轴l,尺寸大于加深的凹陷部425的直径。如图4b中很好地示出,容器410的外部底部呈包围(半圆形)凹陷部425的支持珠粒470的形状和轮廓。
[0084]
如图4a中所示,使滴管450定位于容器410内,并且使远端(开口)末端延伸至凹槽465中,或延伸至凹陷部425的底部(如图4a中所示,刚好位于凹槽465的顶部)。定位于容器410的纵轴l处的凹槽465的内部底部成为容器410中的组合物460的低点430。滴管450延伸至凹槽465中或延伸至凹陷部425的底部(刚好位于凹槽465的顶部)允许在多次揿压分配装置后药物组合物460的残余体积较低,尤其在容器410的内容物接近于耗尽时提供剂量体积。
[0085]
如上文所提到,图4b中所示的容器410的外部实施方案可包括图4a中所示的容器410的内部实施方案,或可包括图3中所示的容器310的内部实施方案。图4b的外部实施方案包括支持珠粒470,为容器底部提供结构支撑,不管采用何种内部容器实施方案。举例来说,在图3中,支持珠粒470为容器310的外部底部提供结构支撑,其中凹陷部325的底部的壁厚因凹槽365而减小。在图4a中,支持珠粒470为必需的,因为凹槽465被加深至凹陷部425的正常底部下方。在此方面中,本发明涵盖向容器的外部底部添加支持珠粒,不管各别容器的内部底部的特征如何。
[0086]
容器可由任何聚合物质制成。在此类实施方案中,适合的聚合物包括但不限于聚乙烯、聚丙烯(pp)、聚苯乙烯(ps)、尼龙(ny)、聚氯乙烯(pvc)、聚对苯二甲酸乙二酯(pet)、聚碳酸酯(pc)、聚甲醛(pom)、聚砜(psf)、聚醚砜(pes)、聚丙烯酸酯(par)和聚酰胺(pa)。在某些实施方案中,聚合物为聚乙烯,特别是中密度聚乙烯(mdpe)(或分枝链聚乙烯)或高密度聚乙烯(hdpe)(或线性聚乙烯)。在一个实施方案中,瓶子由高密度聚乙烯(hdpe)制成。
[0087]
容器可在其内表面具有惰性涂层以避免容器组分与本发明的药物组合物的任何相互作用。
[0088]
本发明的分配装置还包括被装备成覆盖分配装置的分配头的盖子。盖子由如上文所描述的聚合物质制成。优选地,盖子为安迪洛盖(antilop cap),也称为启动后防损失盖(anti-loss on priming cap)。盖子具有从其项壁内部延伸的密封元件,所述密封元件在盖子与分配头的分配孔口之间提供密封。围绕分配头的远端端部并且围绕分配头的分配孔口的密封元件布置防止分配头的远端端部变干并且防止在意外揿压后从分配头误喷射药物组合物。
[0089]
图5a和图5b分别说明分配头515上的本发明的保护盖510的截面和部分分解视图。分解视图中图5b为图5a的一部分。图5a和图5b示出了在分配头515上处于闭合、密封或不泄露位置的盖子。分配头515的形状可为圆锥形,但通常具有典型鼻用喷雾揿压器的形状。
[0090]
分配头515的远端在分配头515的端部或末端壁519中包括分配孔口517,分配孔口517定位于分配通道521的末端。在分配头515的近端为揿压表面523,所述揿压表面523用于与用于将分配头515连接至泵或阀门(图中未示)的连接件525一起揿压分配装置。靠近分配头515的端部或末端壁519为分配头515的外侧壁527,其间具有圆形边缘。
[0091]
盖子510包括密封元件或套筒530,所述密封元件或套筒530从盖子510的项壁532内部伸出。密封元件530可为环状密封法兰或套筒。当盖子510位于闭合位置时,密封元件530以不泄露或紧密密封的方式与分配头515的外侧壁527连通。密封元件530可与盖子构成整体。
[0092]
密封元件或套筒530可具有一定厚度,如图5b中容易地示出,所述厚度随密封元件延伸远离盖子510的项壁532内部而减小,其中密封元件530在近端534(在与盖子510的项壁532内部的连接点处)比在远端536更厚。密封元件530提供柔性以确保与分配头515的外侧壁527的紧密密封或不泄露连通。在盖子510闭合后,密封元件530的远端536通过摩擦配合与外侧壁527连通以形成紧密密封或不泄露的配合。在一个实施方案中,在密封元件530与分配头515的连通点处,密封元件530的远端536的内径小于分配头515的外侧壁527的外径,以确保密封元件530与分配头515之间的紧密密封配合。在此情况下,并且归因于密封元件530的远端536的柔性,当盖子510处于闭合位置时密封元件530的远端536为径向变形的。
[0093]
盖子510的内部和/或分配头515的外侧壁527的外部还可包括一个或多个片状物538,所述一个或多个片状物538与啮合卡位卡扣配合以在盖子510处于闭合位置时将盖子510牢固地保持在分配头515上。在盖子510在分配头515上处于牢固闭合位置的情况下,盖子510的顶壁532内部不接触分配头515的端部壁519。密封元件530仅以不泄露或紧密密封的方式接触分配头515的外侧壁527。
[0094]
因此,在盖子510处于闭合位置的情况下,在分配头515的端部壁519、盖子510的顶壁532内部和密封元件530之间仅含有少量空气。此量的空气防止分配孔口517内部的任何流体蒸发和/或变干。
[0095]
图6说明本发明的分配装置605的一个实施方案。图6中所示的分配装置605包括任选的盖子611、容器610、分配头615、泵619和滴管650(在图6中未见到)。泵619足以通过滴管650(在图6中未见到)从容器610将稳定固定剂量的本发明药物组合物分配至分配头615中,以及分配孔口外。可包括阀门从而以喷雾形式从分配头中的分配孔口释放组合物。泵619可包括预压缩泵,诸如由valois sa制造的vp3或vp7型号或其改良型式。举例来说,分配装置605足以在每次用户揿压分配装置时分配均匀剂量的莫米他松(例如莫米他松糠酸酯)和奥洛他定(例如盐酸奥洛他定)的鼻用喷雾。
[0096]
分配装置605可包括阀门以从分配孔口释放一阵稳定固定剂量组合物。阀门可包括但不限于连续喷雾阀和计量阀。通过揿压分配头来促进阀门的打开和闭合。各种类型的揿压包括但不限于喷雾揿压器、泡沫揿压器、固体流揿压器和专用揿压器。
[0097]
如下文进一步详述,在某些实施方案中,分配装置足以分配每揿约100μl的药物组合物,其中单次揿压分配约665mcg的盐酸奥洛他定和约25mcg或约50mcg的莫米他松糠酸
酯,优选为25mcg莫米他松糠酸酯。
[0098]
药物组合物
[0099]
用于向人类经鼻施用的药物组合物可包含约0.001%w/w至约0.075%w/w莫米他松、其酯(例如莫米他松糠酸酯)或其盐以及约0.5%w/w至约0.8%w/w奥洛他定或其盐(例如盐酸奥洛他定)。药物组合物为稳定的并且典型地包括固定剂量的莫米他松、其酯(例如莫米他松糠酸酯)或其盐以及奥洛他定或其盐(例如盐酸奥洛他定)。
[0100]
药物组合物可呈溶液或悬浮液形式。在一个优选实施方案中,组合物呈悬浮液(诸如单相悬浮液)形式,其中莫米他松、其酯(例如莫米他松糠酸酯)或其盐以粒子形式存在并且奥洛他定或其盐(例如盐酸奥洛他定)以溶解形式存在。莫米他松、其酯(例如莫米他松糠酸酯)或其盐以及奥洛他定或其盐(例如盐酸奥洛他定)可以约1:3至约1:106或约1:5至约1:53或优选约1:5至约1:36的重量比存在。
[0101]
组合物优选还包括水状胶体。在一个实施方案中,组合物为悬浮液并且包括水状胶体,所述水状胶体的量足以防止在25
±
2℃和60%
±
5%相对湿度(rh)下或在40
±
2℃和75%
±
5%rh下储存3个月或6个月之后发生相分离(即,粒子与溶液分离)。在一个实施方案中,水性药物组合物为单相悬浮液,所述单相悬浮液甚至在25
±
2℃和60%
±
5%rh下或在4
±
2℃和75%
±
5%rh下储存3个月或6个月之后仍为单相悬浮液。
[0102]
如结合水性悬浮液所用的术语
‘
稳定’是指在将组合物振荡并且然后在周围条件下储存至少24小时时在视觉检查时不显示相分离。优选地,此类稳定组合物至少3天或至少5天或至少7天的时间不显示相分离。在一个方面中,
‘
稳定’组合物在振荡(例如持续1分钟)和视觉检查后显示未形成结块并且在周围条件(在约25℃和约60%的相对湿度下)下储存至少6个月的时间后总杂质含量不超过1.0%。
[0103]
可通过诸如hplc、lc-ms和tlc等各种分析技术测定药物含量和杂质。
[0104]
观测到当制备包含莫米他松、其酯或其盐以及奥洛他定或其盐的用于经鼻施用的各种药物组合物时,所述组合物在悬浮液组合物中通常显示物理分离。此物理不稳定性进一步导致缺乏剂量均匀性。令人惊讶地,发现在悬浮液组合物中以某些浓度(例如以至少约0.1%w/w的浓度)添加水状胶体产生适合于经鼻施用的物理稳定的组合物(没有分离)。
[0105]
在另一实施方案中,药物组合物为用于向人类经鼻施用的稳定固定剂量水性药物悬浮液组合物,其中组合物包含约0.025%w/w至约0.05%w/w莫米他松、其酯(例如莫米他松糠酸酯)或其盐;约0.6%w/w至约0.7%w/w奥洛他定或其盐(例如盐酸奥洛他定);以及水状胶体。
[0106]
在另一实施方案中,药物组合物为用于向人类经鼻施用的稳定固定剂量水性药物悬浮液组合物,其中组合物包含约0.025%w/w至约0.05%w/w莫米他松、其酯(例如莫米他松糠酸酯)或其盐;约0.6%w/w至约0.7%w/w奥洛他定或其盐(例如盐酸奥洛他定);以及水状胶体,所述水状胶体包括羧甲基纤维素钠和黄原胶。水状胶体可以组合物的至少约0.1%w/w的浓度存在。
[0107]
在另一实施方案中,药物组合物为用于向人类经鼻施用的稳定固定剂量水性药物悬浮液组合物,包含约0.025%w/w至约0.05%w/w莫米他松糠酸酯、约0.6%w/w至约0.7%w/w盐酸奥洛他定和水状胶体,所述水状胶体包含黄原胶。黄原胶可以组合物的至少约0.1%w/w或优选在约0.3%w/w至约3%w/w之间的浓度存在。
[0108]
在另一实施方案中,药物组合物为用于向人类经鼻施用的稳定固定剂量水性药物悬浮液组合物,包含约0.025%w/w至约0.05%w/w莫米他松糠酸酯、约0.6%w/w至约0.7%w/w盐酸奥洛他定和水状胶体,所述水状胶体包含羧甲基纤维素钠。羧甲基纤维素钠可以组合物的至少约0.1%w/w或优选在约0.1%w/w至约3%w/w之间的浓度存在。
[0109]
在另一实施方案中,药物组合物为用于向人类经鼻施用的呈悬浮液形式的稳定固定剂量水性药物组合物,包含莫米他松、其酯或其药学上可接受的盐(例如莫米他松糠酸酯);奥洛他定或其药学上可接受的盐(例如盐酸奥洛他定);水状胶体(例如在组合物的至少约0.1%w/w的浓度下);以及药学上可接受的赋形剂。
[0110]
熟练技工还应了解,为改善本发明组合物的物理性质、外观或气味,可按需要添加一种或多种其他药学上可接受的赋形剂。适合的药学上可接受的赋形剂包括但不限于螯合剂、防腐剂、缓冲剂、表面活性剂、等渗剂、味道掩蔽剂、抗氧化剂、湿润剂、ph调节剂和前述任何物质的任何组合。
[0111]
可用于制备水性鼻用喷雾组合物的适合的表面活性剂可包括阴离子、阳离子、非离子或两性离子表面活性剂中的一种或多种。可用于水性鼻用喷雾悬浮液中的适合的表面活性剂的实例可选自但不限于聚乙氧基化脱水山梨醇衍生物(诸如聚山梨醇酯、其通过脱水山梨醇酯与环氧乙烷的反应制备的醚乙氧基化物)、聚氧乙烯烷基酚、聚氧乙烯鲸蜡基醚、聚氧乙烯烷基-芳基醚、聚氧乙烯单月桂酸酯、聚氧乙烯植物油、聚氧乙烯脱水山梨醇单月桂酸酯、聚氧乙烯酯或混合的脂肪酸和树脂酸、聚氧乙烯山梨糖醇羊毛脂衍生物、聚氧乙烯十三烷基醚、混合的脂肪酸和树脂酸的聚氧乙烯脱水山梨醇酯、聚氧乙烯脱水山梨醇单硬脂酸酯、聚氧乙烯脱水山梨醇单油酸酯、聚氧乙烯单硬脂酸酯、聚氧乙烯硬脂基醚、聚氧乙烯油烯基醚、聚氧乙烯十三烷基醚、聚氧乙烯脂肪醇、聚氧乙烯烷基胺、聚氧乙二醇单棕榈酸酯、聚氧乙烯脱水山梨醇单棕榈酸酯、聚氧乙烯鲸蜡基醚、聚氧乙烯氧化丙烯硬脂酸酯、聚氧乙烯月桂基醚、聚氧乙烯羊毛脂衍生物、油酸钠、季铵衍生物、油酸钾、乙基硫酸n-鲸蜡基n-乙基吗啉鎓、月桂基硫酸钠或其混合物。优选表面活性剂为聚乙氧基化脱水山梨醇衍生物(诸如聚山梨醇酯80)。表面活性剂的量可在相对于组合物的总重量约0.001%至约1%w/w范围内。
[0112]
为改善在施用至鼻粘膜后对水性鼻用喷雾悬浮液耐受的能力,将其配制成等张的为有利的。可如下设定渗透压:通过除莫米他松、奥洛他定和存在的任何其他物质之外改变存在于水性鼻用喷雾悬浮液中的物质的量,和/或通过以赋予等张性所必需的浓度添加等张剂,优选为生理学耐受的盐,诸如氯化钠或氯化钾;或生理学耐受的多元醇,诸如糖醇,特别是山梨糖醇或甘油。
[0113]
可用于水性鼻用喷雾悬浮液中的适合的防腐剂的实例包括但不限于苯甲醇、季铵卤化物、苯基甲醇、硫柳汞和依地酸二钠。季铵卤化物防腐剂为优选的。适合的季铵卤化物防腐剂包括聚季铵-1和苯扎卤铵。优选的苯扎卤铵包括苯扎氯铵和苯扎溴铵。存在于水性鼻用喷雾悬浮液中的防腐剂的量可在相对于组合物的总重量约0.005%至约0.2%w/w范围内。优选地,防腐剂以相对于组合物的总重量约0.02%w/w的浓度存在。
[0114]
可用于水性鼻用喷雾悬浮液中的适合的螯合剂的实例包括但不限于依地酸二钠(edta)、依地酸三钠、依地酸四钠和五乙酸二亚乙基胺,优选为edta。存在于本发明的水性鼻用喷雾悬浮液中的螯合剂的量可在相对于组合物的总重量约0.0002%w/w至约0.5%w/w
范围内。
[0115]
可用于水性鼻用喷雾悬浮液中的适合的缓冲液的实例包括但不限于柠檬酸、乙酸、富马酸、盐酸、苹果酸、硝酸、磷酸、丙酸、硫酸、酒石酸、磷酸盐(例如磷酸氢二钠,诸如七水合磷酸氢二钠)或其组合。本发明的悬浮液可包含足以使组合物的ph值维持至约3至约6的量的缓冲液。优选地,缓冲液的量在相对于组合物的总重量约0.005%至约1%w/w范围内。
[0116]
可用于水性鼻用喷雾悬浮液中的适合的甜味剂/味道掩蔽剂的实例包括但不限于三氯蔗糖、奇异果甜蛋白、蔗糖、糖精(包括诸如钠盐和钙盐等盐形式)、果糖、葡萄糖、右旋糖、玉米糖浆、阿斯巴甜、乙酰舒泛-k(acesulfame-k)、木糖醇、山梨糖醇、赤藓糖醇、甘草酸铵、纽甜、甘露糖醇、桉树油、樟脑和天然或人工调味剂(flavor/flavoring agent)(例如薄荷醇、薄荷、香草、橙子等)或此类剂中的两者或更多者的组合。特别优选的味道掩蔽剂为三氯蔗糖。存在于水性鼻用喷雾悬浮液中的甜味剂/味道掩蔽剂的量可在相对于组合物的总重量约0.01%至约1%w/w范围内。
[0117]
可用于水性鼻用喷雾悬浮液中的适合的抗氧化剂的实例包括但不限于抗坏血酸、α-生育酚(维生素-e)、丁基化羟基茴香醚、丁基化羟基甲苯、谷胱甘肽和前述物质中的任何物质的任何组合。存在于水性鼻用喷雾组合物中的抗氧化剂的量可在相对于组合物的总重量约0.0002%至约0.5%w/w范围内。
[0118]
可用于水性鼻用喷雾悬浮液中的适合的湿润剂的实例包括但不限于甘油、山梨糖醇、聚乙二醇、丙二醇或其混合物,这些物质与诸如水等适合的湿润剂媒介物混合。存在于水性鼻用喷雾悬浮液中的湿润剂的量可在相对于组合物的总重量约0.0002%至约0.5%w/w范围内。
[0119]
适合的ph调节剂包括但不限于氢氧化钠和盐酸。
[0120]
用于经鼻施用的药物组合物可具有在约3.3与约4.1之间或在约3.5与约3.9之间的ph值。本发明人发现在5至5.5的ph值下盐酸奥洛他定从固定剂量组合水性悬浮液中结晶析出。然而,在约3.3至约4.1的ph值下,盐酸奥洛他定保持溶解于水性悬浮液中。
[0121]
水性药物组合物优选基本上不含盐酸奥洛他定的晶体。在一个实施方案中,基于组合物中100%总重量的盐酸奥洛他定,水性药物组合物含有不到2%、不到1%、不到0.5%、不到0.2%或不到0.1%的结晶盐酸奥洛他定。在另一实施方案中,在25
±
2℃和60%
±
5%rh下或在40
±
2℃和75%
±
5%rh下储存3个月或6个月之后,水性药物组合物基本上不含盐酸奥洛他定的晶体。在另一实施方案中,在25
±
2℃和60%
±
5%rh下或在40
±
2℃和75%
±
5%rh下储存3个月或6个月之后,基于组合物中100%总重量的盐酸奥洛他定,水性药物组合物含有不到2%、不到1%、不到0.5%、不到0.2%或不到0.1%的结晶盐酸奥洛他定。
[0122]
组合物的渗透压可在约200mosm/kg与约400mosm/kg或约250mosm/kg与约350mosm/kg之间的范围内。组合物的粘度可为约10cps至约200cps或优选约20cps至约150cps。可通过诸如动力应力流变仪或布鲁克费尔德粘度计(brookfield viscometer)等各种已知仪器测定粘度。在一个优选实施方案中,通过布鲁克费尔德粘度计通过使用旋转轴测量通过样品的扭矩传递来测定粘度。
[0123]
在另一方面中,药物组合物呈悬浮液形式并且含有呈平均粒度在约1μm至约20μm
或优选约1μm至约15μm范围内的粒子形式的莫米他松、其酯或其盐,优选为莫米他松糠酸酯。在一个方面中,当通过显微术技术测定时,悬浮液药物组合物具有小于15μm的平均粒度。
[0124]
在另一方面中,药物组合物当在分配装置中递送时可具有最长轴为约15-75mm、最短轴为约10-65mm并且椭圆率为约1-2的喷雾模式。
[0125]
在另一实施方案中,药物组合物为用于向人类经鼻施用的稳定固定剂量水性药物组合物,其中组合物包含约0.001%w/w至约0.075%w/w单水合莫米他松糠酸酯和约0.5%w/w至约0.8%w/w盐酸奥洛他定。
[0126]
在另一实施方案中,药物组合物为用于向人类经鼻施用的呈悬浮液形式的稳定固定剂量药物组合物,包含单水合莫米他松糠酸酯、盐酸奥洛他定和水状胶体,所述水状胶体包含浓度为组合物的约0.3%w/w的黄原胶,其中组合物具有约3.5与约3.9之间的ph值。
[0127]
在另一实施方案中,药物组合物为用于向人类经鼻施用的呈悬浮液形式的稳定固定剂量药物组合物,包含单水合莫米他松糠酸酯、盐酸奥洛他定和水状胶体,所述水状胶体包含浓度为组合物的约0.5%w/w的羧甲基纤维素钠,其中组合物具有约3.5与约3.9之间的ph值。
[0128]
在另一实施方案中,药物组合物为用于向人类经鼻施用的稳定固定剂量药物水性悬浮液组合物,其中组合物包含(1)约0.025%w/w单水合莫米他松糠酸酯,(2)约0.665%w/w盐酸奥洛他定,(3)选自约0.3%w/w的黄原胶和约0.5%w/w羧甲基纤维素钠的水状胶体,(4)约0.02%w/w苯扎氯铵,(5)约0.4%w/w氯化钠,(6)约0.01%w/w依地酸二钠,(7)约0.94%w/w七水合磷酸钠,以及(8)约0.01%w/w聚山梨醇酯80。
[0129]
在另一实施方案中,药物组合物为用于向人类经鼻施用的稳定固定剂量药物水性悬浮液组合物,其中组合物包含(1)约0.050%w/w单水合莫米他松糠酸酯,(2)约0.665%w/w盐酸奥洛他定,(3)选自约0.3%w/w的黄原胶和约0.5%w/w羧甲基纤维素钠的水状胶体,(4)约0.02%w/w苯扎氯铵,(5)约0.4%w/w氯化钠,(6)约0.01%w/w依地酸二钠,(7)约0.94%w/w七水合磷酸钠,以及(8)约0.01%w/w聚山梨醇酯80。
[0130]
在另一实施方案中,药物组合物为用于向人类经鼻施用的稳定固定剂量药物水性悬浮液组合物,其中组合物包含(1)约0.025%w/w单水合莫米他松糠酸酯,(2)约0.665%w/w盐酸奥洛他定,(3)选自约0.3%w/w的黄原胶和约0.5%w/w羧甲基纤维素钠的水状胶体,(4)约1%w/w至约1.2%w/w微晶纤维素与羧甲基纤维素钠的混合物,(5)约0.02%w/w苯扎氯铵,(6)约0.4%w/w氯化钠,(7)约0.01%w/w依地酸二钠,(8)约0.94%w/w七水合磷酸钠,以及(9)约0.01%w/w聚山梨醇酯80。
[0131]
在另一实施方案中,药物组合物为用于向人类经鼻施用的稳定固定剂量药物水性悬浮液组合物,其中组合物包含(1)约0.050%w/w单水合莫米他松糠酸酯,(2)约0.665%w/w盐酸奥洛他定,(3)选自约0.3%w/w的黄原胶和约0.5%w/w羧甲基纤维素钠的水状胶体,(4)约1%w/w至约1.2%w/w微晶纤维素与羧甲基纤维素钠的混合物,(5)约0.02%w/w苯扎氯铵,(6)约0.4%w/w氯化钠,(7)约0.01%w/w依地酸二钠,(8)约0.94%w/w七水合磷酸钠,以及(9)约0.01%w/w聚山梨醇酯80。
[0132]
在另一实施方案中,药物组合物为适合于向人类经鼻施用的稳定悬浮液,包含(a)水性溶剂,(b)悬浮于溶剂中的莫米他松糠酸酯的粒子,粒子具有约1至约20μm的平均粒度,
(c)溶解于溶剂中的盐酸奥洛他定,以及(d)水状胶体,悬浮液具有在约20cps至约150cps范围内的粘度。在一个优选实施方案中,悬浮液具有约3.5-3.9的ph值,并且渗透压在约250mosm/kg至约350mosm/kg范围内。在一个实施方案中,悬浮液还包含螯合剂、防腐剂、缓冲液、表面活性剂、等张剂和任选的ph调节剂。
[0133]
优选地,悬浮液仅具有一个相(即,它们优选为单相悬浮液)。
[0134]
在另一实施方案中,将含有药物组合物的分配装置提供于药盒中,所述药盒具有含有关于药物组合物的使用的说明书的包装插页。
[0135]
在另一实施方案中,当从分配装置分配药物组合物时可提供最长轴为15-75mm,最短轴为10-65mm并且椭圆率为1-2的喷雾模式。可通过各种已知技术,诸如使用具有nspua设置的adsa(innova system)来测定喷雾模式,并且可通过各种已知技术,诸如使用具有nspua设置的malvern spraytec(innova system)来测定喷雾液滴尺寸分布。
[0136]
下文描述了用于表征喷雾的液滴尺寸分布的典型程序。为喷雾器装载如上文所描述的组合物并且通过经由揿压器揿压泵进行启动,直到从喷雾器的喷嘴中出现细雾。将可商购获得的激光衍射仪器布置成使得喷嘴在激光衍射仪器的激光束下方约3cm或6cm处。用揿压器使用恒定的力揿压泵。所得组合物喷雾穿过激光束。收集d
10
、d
50
、d
90
、span和《10μm的体积%的数据。计算三次喷雾的这些参数中的每一者的平均值。
[0137]
可使用分配装置施用药物组合物以治疗鼻炎。在一个实施方案中,每次喷雾提供(i)等效于约25mcg莫米他松糠酸酯的单水合莫米他松糠酸酯以及(ii)等效于约600mcg奥洛他定的盐酸奥洛他定(例如665mcg盐酸奥洛他定)。在一个优选实施方案中,每天两次由分配装置为罹患过敏性鼻炎的人类受试者施用两次药物组合物喷雾。在另一实施方案中,每天两次用分配装置为罹患过敏性鼻炎的人类受试者经鼻施用100mcg的莫米他松糠酸酯和1330mcg盐酸奥洛他定。在另一实施方案中,每天用分配装置为罹患过敏性鼻炎的人类受试者经鼻施用200mcg的莫米他松糠酸酯和2660mcg盐酸奥洛他定。鼻炎包括但不限于鼻内部粘膜的刺激和炎症以及与此相关的鼻部和非鼻部症状。它包括过敏性鼻炎、持续性鼻炎、常年性鼻炎、季节性鼻炎、慢性鼻炎、药物性鼻炎、血管舒缩性鼻炎、感染性鼻炎、自主性鼻炎、激素性鼻炎、药物诱发性鼻炎、萎缩性鼻炎和味觉性鼻炎。优选地,它包括过敏性鼻炎、常年性鼻炎、持续性鼻炎、季节性鼻炎以及与此相关的鼻部和非鼻部症状。
[0138]
与过敏性鼻炎相关的鼻部和非鼻部症状包括打喷嚏、鼻发痒、流鼻涕(流鼻水)、鼻塞、咳嗽、眼瘙痒、过度流泪、头痛、疲劳、普通感冒(也称为鼻咽炎(nasopharyngitis/rhinopharyngitis)、急性鼻炎或感冒)、不适和认知损伤。
[0139]
药物组合物可包含一种或多种选自治疗性类别的(但不限于)非类固醇消炎剂、减充血剂和前述物质中的任何物质的任何组合的额外的药物活性剂。
[0140]
在一个方面中,药物组合物包括约0.001%w/w至约0.075%w/w呈微粒形式的莫米他松、其酯(例如莫米他松糠酸酯)或其盐以及约0.5%w/w至约0.8%w/w呈溶解形式的奥洛他定或其盐(例如盐酸奥洛他定)。在此方面中,组合物还可包括水状胶体体系,所述水状胶体体系的量例如足以在当储存在25
±
2℃和60%
±
5%相对湿度下时持续至少24小时抑制相分离。在一个实施方案中,组合物当在25
±
2℃和60%
±
5%相对湿度下在分配装置中储存长达12个月时含有以下性质中的一种或多种:
[0141]
(i)组合物含有不超过1%的总杂质(储存之后);
[0142]
(ii)组合物含有不超过1%的dmc(储存之后);
[0143]
(iii)组合物含有不超过1%的dmcf(储存之后);
[0144]
(iv)组合物含有不超过1%的α-羟基奥洛他定(储存之后);
[0145]
(v)组合物含有不超过1%的奥洛他定e-异构体(储存之后);
[0146]
(vi)组合物含有不超过1%的奥洛他定相关化合物b(储存之后);和/或
[0147]
(vii)组合物含有不超过0.42%的其他奥洛他定杂质(储存之后)。
[0148]
治疗方法
[0149]
本发明人还令人惊讶地发现,当与盐酸奥洛他定单一疗法或莫米他松糠酸酯单一疗法相比时,经鼻施用莫米他松、其酯(例如莫米他松糠酸酯)或其盐以及奥洛他定或其盐(诸如盐酸奥洛他定)的药物组合物使得与诸如季节性过敏性鼻炎或常年性过敏性鼻炎等过敏性鼻炎相关的症状的缓解作用更快地开始。特别地,药物组合物提供诸如鼻充血、流鼻涕、发痒和打喷嚏等鼻部症状的更快缓解。药物组合物还可使得对诸如眼发痒、眼睛流泪/流水和眼发红等眼部症状的作用更快开始。作用的开始可为不到30分钟,诸如在约15分钟内,诸如在约10分钟内。一个实施方案为一种治疗有需要的受试者(例如人类)的过敏性鼻炎的方法,所述方法包括诸如由上文所描述的分配装置向受试者经鼻施用有效量的固定剂量药物组合物,其中药物组合物包含莫米他松、其酯或其盐以及奥洛他定或其盐。优选地,以受试者每个鼻孔1次或2次喷雾每天至少一次的形式经鼻施用组合物。每次喷雾优选包含呈约1:5至约1:60的重量比,诸如呈约1:12至约1:53、约1:13.3至约1:50或约1:18至约1:40的重量比(以奥洛他定游离碱的当量重量计)的莫米他松、其酯或其盐以及奥洛他定或其盐。在一个特定实施方案中,固定剂量药物组合物为悬浮液,其中莫米他松、其酯或其盐以微粒形式存在并且奥洛他定或其盐以溶解形式存在。
[0150]
另一实施方案为一种使得有需要的人类受试者的与过敏性鼻炎相关的症状更快开始缓解的方法,所述方法包括诸如由上文所描述的分配装置每个鼻孔两次喷雾每天两次经鼻施用固定剂量药物组合物,其中药物组合物包含莫米他松、其酯或其盐(例如莫米他松糠酸酯)以及奥洛他定其盐(例如盐酸奥洛他定)。与施用单独的莫米他松、其酯或其盐或单独的奥洛他定或其盐相比,此方法可使得一种或多种症状更快开始缓解。每次喷雾可包含呈约1:5至约1:60的重量比(诸如约1:12至约1:53、约1:13.3至约1:50或约1:18至约1:40的重量比)(以奥洛他定游离碱的当量重量计)的莫米他松、其酯或其盐以及奥洛他定或其盐(举例来说,每次喷雾包含约12.5mcg、约25mcg、约37.5mcg、约50mcg或约62.5mcg的莫米他松、其酯或其盐(诸如约50mcg莫米他松糠酸酯)以及等效于约300mcg、约450mcg、约600mcg、约750mcg或约900mcg奥洛他定的盐酸奥洛他定(诸如约665mcg盐酸奥洛他定))。所述施用可使得一种或多种症状在30分钟内,诸如在15分钟或10分钟内缓解。在另一实施方案中,所述施用可使得暴露于环境暴露室(eec)的受试者(诸如与浓度为3500
±
500个粒子/m3豚草花粉在一起持续6小时的受试者)的过敏性鼻炎的一种或多种症状(诸如鼻部症状)在不到15分钟内,诸如在约10分钟内缓解。
[0151]
在一个实施方案中,本文中的方法使得受试者的鼻部症状的缓解作用更快地开始。在另一实施方案中,本文中的方法使得受试者的眼部症状的缓解作用更快地开始。
[0152]
在一个实施方案中,药物组合物使得受试者的鼻部症状的缓解作用更快地开始。在另一实施方案中,药物组合物使得受试者的眼部症状的缓解作用更快地开始。
[0153]
另一实施方案为一种治疗罹患过敏性鼻炎的人类受试者的方法,所述方法包括以下步骤:诸如由上文所描述的分配装置向受试者施用用于每个鼻孔两次喷雾每天两次经鼻施用的药物组合物,其中(i)药物组合物使得治疗过敏性鼻炎的作用在15分钟内开始,并且(ii)药物组合物的每次喷雾包含约25mcg的莫米他松糠酸酯和约665mcg的盐酸奥洛他定。
[0154]
另一实施方案为一种治疗罹患过敏性鼻炎的人类受试者的方法,所述方法包括以下步骤∶
[0155]
(a)为受试者(例如人类受试者)开出固定剂量药物组合物的处方,用于任选与上文所描述的分配装置组合每个鼻孔两次喷雾每天两次经鼻施用,其中固定剂量药物组合物包含莫米他松、其酯或其盐(诸如莫米他松糠酸酯)以及奥洛他定或其盐(诸如盐酸奥洛他定),并且每次喷雾包含呈约1:5至约1:60的重量比(诸如约1:12至约1:53、约1:13.3至约1:50或约1:18至约1:40的重量比)(以奥洛他定游离碱的当量重量计)的莫米他松、其酯或其盐以及奥洛他定或其盐(举例来说,每次喷雾包含约12.5mcg、约25mcg、约37.5mcg、约50mcg或约62.5mcg的莫米他松、其酯或其盐(诸如约50mcg莫米他松糠酸酯)以及等效于约300mcg、约450mcg、约600mcg、约750mcg或约900mcg奥洛他定的盐酸奥洛他定(诸如约665mcg盐酸奥洛他定)),
[0156]
(i)任选与上文所描述的分配装置组合的药物组合物的销售,因为(a)与单独经鼻施用莫米他松、其酯或其盐(诸如25或50mcg莫米他松糠酸酯)或奥洛他定或其盐(诸如665mcg盐酸奥洛他定)相比,使得过敏性鼻炎的一种或多种症状(例如鼻部症状)的缓解作用更快开始(诸如在不到30分钟内,诸如在15分钟内,诸如在10分钟内开始作用),(b)使得过敏性鼻炎的一种或多种症状在15分钟(或30分钟)内缓解,(c)与单独经鼻施用莫米他松、其酯或其盐或奥洛他定或其盐相比,使得暴露于环境暴露室(eec)的受试者(诸如与浓度为3500
±
500个粒子/m3的豚草花粉在一起持续6小时的受试者)的过敏性鼻炎的一种或多种症状(例如鼻部症状)的缓解作用更快(诸如在15分钟内,诸如在约10分钟内)开始,和/或(d)使得暴露于环境暴露室(eec)的受试者(诸如与浓度为3500
±
500个粒子/m3的豚草花粉在一起持续6小时的受试者)的过敏性鼻炎的一种或多种症状(诸如鼻部症状)在15分钟内,诸如在约10分钟内缓解,以及(ii)将人类受试者诊断为罹患过敏性鼻炎来开出处方;以及
[0157]
(b)任选用上文所描述的分配装置向受试者施用所开出的药物组合物。在一个优选实施方案中,固定剂量药物组合物的每次喷雾提供25mcg莫米他松糠酸酯和665mcg盐酸奥洛他定。
[0158]
另一实施方案为一种治疗罹患过敏性鼻炎(诸如季节性过敏性鼻炎或常年性过敏性鼻炎)的人类受试者的方法,所述方法包括以下步骤:任选用上文所描述的分配装置向受试者施用所开出的用于每个鼻孔两次喷雾每天两次经鼻施用的固定剂量药物组合物,其中固定剂量药物组合物包含莫米他松、其酯或其盐(诸如莫米他松糠酸酯)以及奥洛他定或其盐(诸如盐酸奥洛他定),并且每次喷雾包含呈约1:5至约1:60的重量比(诸如约1:12至约1:53、约1:13.3至约1:50或约1:18至约1:40的重量比)(以奥洛他定游离碱的当量重量计)的莫米他松、其酯或其盐以及奥洛他定或其盐(举例来说,每次喷雾包含约12.5mcg、约25mcg、约37.5mcg、约50mcg或约62.5mcg的莫米他松、其酯或其盐(诸如约50mcg莫米他松糠酸酯)以及等效于约300mcg、约450mcg、约600mcg、约750mcg或约900mcg奥洛他定的盐酸奥洛他定(诸如约665mcg盐酸奥洛他定))。响应于(a)任选在上文所描述的分配装置存在下的药物组
合物的销售,因为(a)与单独经鼻施用莫米他松、其酯或其盐(诸如50mcg莫米他松糠酸酯)或奥洛他定或其盐(诸如665mcg盐酸奥洛他定)相比,使得过敏性鼻炎的症状(例如鼻部症状)的缓解作用更快开始(诸如在不到30分钟内,诸如在15分钟内,诸如在10分钟内开始作用),或(b)使得过敏性鼻炎的一种或多种症状在15分钟(或30分钟)内缓解,以及(b)将受试者诊断为罹患过敏性鼻炎开出药物组合物的处方。在一个优选实施方案中,固定剂量药物组合物的每次喷雾提供25mcg莫米他松糠酸酯和665mcg盐酸奥洛他定。
[0159]
与单独经鼻施用莫米他松、其酯或其盐或奥洛他定或其盐相比,诸如用上文所描述的分配装置施用药物组合物可使得受试者的过敏性鼻炎的一种或多种症状(诸如鼻部症状或眼部症状)更快缓解(例如在不到30分钟内,诸如在约15分钟内,诸如在10分钟内开始作用)。在另一实施方案中,与单独经鼻施用莫米他松、其酯或其盐或奥洛他定或其盐相比,所述施用可使得暴露于环境暴露室(eec)的受试者(诸如与浓度为3500
±
500个粒子/m3的豚草花粉在一起持续6小时的受试者)的过敏性鼻炎的一种或多种症状(诸如鼻部症状)更快缓解(例如在不到15分钟内,诸如在约10分钟内开始作用)。
[0160]
另一实施方案为一种使得有需要的人类受试者的与过敏性鼻炎相关的症状更快开始缓解的方法,所述方法包括诸如用上文所描述的分配装置每个鼻孔两次喷雾每天两次经鼻施用固定剂量药物组合物,其中药物组合物包含莫米他松、其酯或其盐(例如莫米他松糠酸酯)以及奥洛他定或其盐(例如盐酸奥洛他定)。与施用单独的莫米他松、其酯或其盐或单独的奥洛他定或其盐相比,此方法可使得一种或多种症状更快开始缓解。每次喷雾可包含呈约1:5至约1:60的重量比(诸如约1:12至约1:53、约1:13.3至约1:50或约1:18至约1:40的重量比)(以奥洛他定游离碱的当量重量计)的莫米他松、其酯或其盐以及奥洛他定或其盐(举例来说,每次喷雾包含约12.5mcg、约25mcg、约37.5mcg、约50mcg或约62.5mcg的莫米他松、其酯或其盐(诸如约50mcg莫米他松糠酸酯)以及等效于约300mcg、约450mcg、约600mcg、约750mcg或约900mcg奥洛他定的盐酸奥洛他定(诸如约665mcg盐酸奥洛他定))。所述施用可使得一种或多种症状在30分钟内,诸如在15分钟内或在10分钟内缓解。在另一实施方案中,所述施用可使得暴露于环境暴露室(eec)的受试者(诸如与浓度为3500
±
500个粒子/m3的豚草花粉在一起持续6小时的受试者)的过敏性鼻炎的一种或多种症状(诸如鼻部症状)在不到15分钟内,诸如在约10分钟内缓解。
[0161]
另一实施方案为一种治疗罹患过敏性鼻炎的人类受试者的方法,所述方法包括以下步骤:诸如用上文所描述的分配装置向受试者施用用于每个鼻孔两次喷雾每天两次经鼻施用的药物组合物,其中(i)药物组合物使得治疗过敏性鼻炎的作用在15分钟内开始,并且(ii)药物组合物的每次喷雾包含约25mcg的莫米他松糠酸酯和约665mcg的盐酸奥洛他定。
[0162]
在本文所描述的方法中的任一种的一个实施方案中,过敏性鼻炎是选自常年性过敏性鼻炎、持久性过敏性鼻炎、季节性过敏性鼻炎以及与此相关的鼻部和/或非鼻部症状。在本文所描述的方法中的任一种的一个优选实施方案中,过敏性鼻炎为季节性过敏性鼻炎。在本文所描述的方法中的任一种的另一优选实施方案中,过敏性鼻炎为常年性过敏性鼻炎。
[0163]
应了解,可对本文所公开的实施方案作出各种修改。因此,以上描述不应被视为具限制性,而应仅仅被视为优选实施方案的例示。其他安排和方法可由本领域技术人员在不背离本发明的范围和精神的情况下实现。
[0164]
以下实施例是为了使本领域技术人员能够实践本发明而提供并且仅仅说明本发明。所述实施例不应被读作限制本发明的范围。
[0165]
实施例
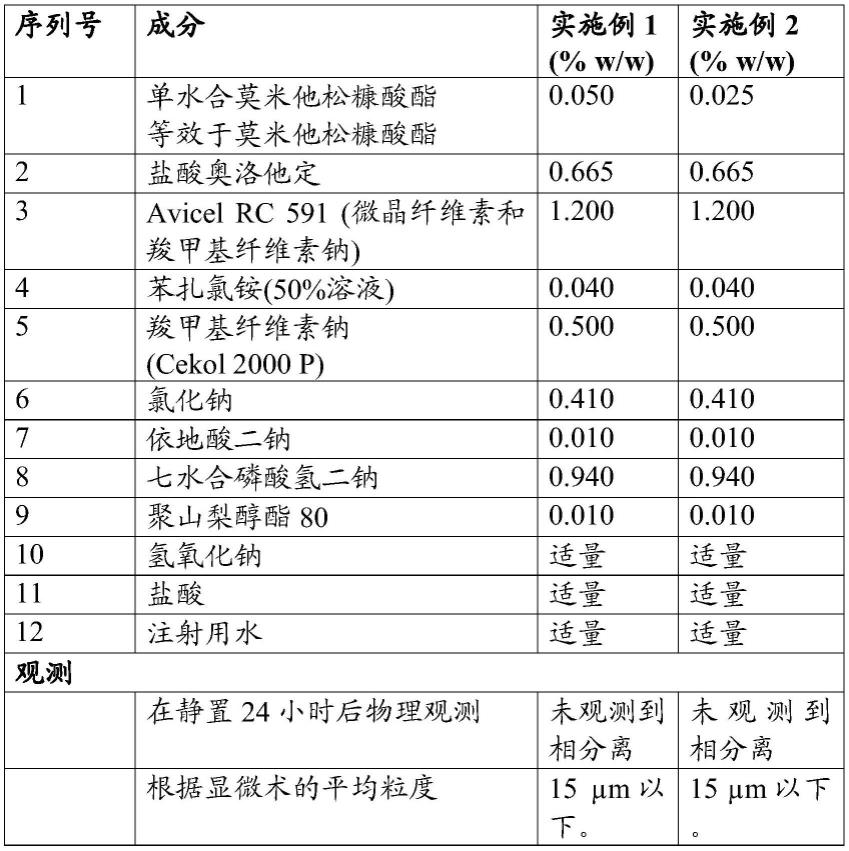
[0166]
实施例1和实施例2
[0167]
含有莫米他松糠酸酯、盐酸奥洛他定和羧甲基纤维素钠的悬浮液组合物
[0168][0169]
制造程序:
[0170]
1.在均质化的同时将avicel rc-591添加至注射用水中并且允许形成水合物。
[0171]
2.将羧甲基纤维素钠分散于注射用水中并且添加至步骤1。
[0172]
3.将七水合磷酸氢二钠、氯化钠、依地酸二钠和奥洛他定溶解于水中。用盐酸将ph值调节至2.8-3.2。
[0173]
4.在均质化的同时将步骤3添加至步骤1中。
[0174]
5.将聚山梨醇酯80溶解于注射用水中。添加单水合莫米他松糠酸酯并搅拌以形成浆料。
[0175]
6.在均质化的同时将步骤5添加至步骤4中。
[0176]
7.将苯扎氯铵溶解于注射用水中。
[0177]
8.在均质化的同时将步骤7添加至步骤6中。
[0178]
9.检验ph值并用hcl调节至3.5-3.9并且用注射用水调节总重量。组合物的渗透压为约250-350mosm/kg。在不同条件下对组合物进行稳定性研究。
[0179]
所述研究的结果如下:
[0180]
容器细节:用泵挤压并且装配有揿压器和盖子的含有喷雾器的hdpe瓶。
[0181]
[0182]
[0183][0184]
*通过advanced instruments渗透压计(型号3250)测定。
[0185]
**通过布鲁克费尔德粘度计测定。
[0186]
实施例3和实施例4
[0187]
含有莫米他松糠酸酯、盐酸奥洛他定和黄原胶的悬浮液组合物
[0188]
[0189][0190]
制造程序:
[0191]
1.在均质化的同时将avicel rc-591添加至注射用水中并且允许形成水合物。
[0192]
2.将黄原胶分散于注射用水中并且添加至步骤1。
[0193]
3.将七水合磷酸氢二钠、氯化钠、依地酸二钠和奥洛他定溶解于水中。用盐酸将ph值调节至2.8-3.2。
[0194]
4.将步骤3添加至步骤1中。
[0195]
5.将聚山梨醇酯80溶解于注射用水中。向其中添加单水合莫米他松糠酸酯并搅拌以形成浆料。
[0196]
6.在均质化的同时将步骤5添加至步骤4中。
[0197]
7.将苯扎氯铵溶解于注射用水中。
[0198]
8.在均质化的同时将步骤7添加至步骤6中。
[0199]
9.检验ph值并用hcl调节至3.5-3.9并且用注射用水调节重量。组合物的渗透压为约250-350mosm/kg。
[0200]
在不同条件下对组合物进行稳定性研究。所述研究的结果如下:
[0201]
容器细节:用泵挤压并且装配有揿压器和盖子的含有喷雾器的hdpe瓶
[0202]
[0203][0204]
比较实施例a和比较实施例b
[0205]
含有莫米他松糠酸酯和盐酸奥洛他定的悬浮液组合物
[0206][0207]
制造程序:
[0208]
遵循如在实施例1中所提到的制造程序。
[0209]
比较实施例c和比较实施例d
[0210]
含有莫米他松糠酸酯和盐酸奥洛他定的悬浮液组合物
[0211]
[0212][0213]
制造程序:
[0214]
遵循如在实施例3中所提到的制造程序。
[0215]
实施例5
[0216]
在人类患者中对莫米他松和奥洛他定鼻用喷雾的固定剂量组合的临床研究
[0217]
研究为单中心、双盲、双模拟、随机化、平行组、比较环境暴露室(eec)研究,用于评估(i)莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的两种固定剂量组合产品,(ii)盐酸氮卓斯汀(azelastine hydrochloride)和丙酸氟替卡松(fluticasone propionate)鼻用喷雾的固定剂量组合(iii)奥洛他定鼻用喷雾以及(iv)安慰剂鼻用喷雾在患有季节性过敏性鼻炎(sar)的患者中的功效、安全性和耐受性。
[0218]
主要目标
[0219]
●
为评估莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的两种强度的固定剂量组合(fdc)当与安慰剂鼻用喷雾相比较时的功效。
[0220]
●
为评估(i)两种方案的含有莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的fdc产品,(ii)盐酸氮卓斯汀和丙酸氟替卡松鼻用喷雾的固定剂量组合以及(iii)奥洛他定鼻用喷雾的比较功效。
[0221]
●
为比较(i)盐酸氮卓斯汀和丙酸氟替卡松鼻用喷雾的固定剂量组合以及(ii)奥洛他定鼻用喷雾当与安慰剂鼻用喷雾相比较时的功效。
[0222]
●
为比较在第一个剂量之后活性剂处理组之间的作用开始情况,作用开始被定义为“在起始处理之后当药物与安慰剂处理相比展示瞬时tnss的显著减小时的首个时间点,且证实从此点起为持久的”。
[0223]
●
为比较每天一次莫米他松糠酸酯和盐酸奥洛他定的固定剂量组合与每天两次莫米他松糠酸酯和盐酸奥洛他定的固定剂量组合之间的eec生活质量问卷(qolq)以及耐受性和可接受性。
[0224]
●
为评估各种处理实验组之间的比较安全性。
[0225]
样品尺寸
[0226]
在研究中对每个处理实验组总共36个患者进行随机化。在五个处理实验组中随机化受试者的总数目为180。
[0227]
患者群体
[0228]
研究中包括最近两年罹患季节性过敏性鼻炎且需要用鼻内抗组织胺和/或鼻内类固醇进行处理的受试者。
[0229]
主要受试者选择准则
[0230]
1.患者年龄≥18岁并且≤65岁,包括任一性别;
[0231]
2.患者有已知季节性过敏性鼻炎临床病史(持续至少2年)并且对区域性过敏原中的一种展现皮肤点刺测试阳性(风团直径比盐水对照大至少3mm);
[0232]
3.患者有能力理解并且签署书面知情同意书,在筛选之前必须已获得书面知情同意书;以及
[0233]
4.患者愿意遵守方案要求。
[0234]
研究设计
[0235]
在一个研究地点,将患者针对处理以1:1:1:1:1比率随机化至以下五个处理实验组:
[0236]
1.盐酸奥洛他定665mcg和莫米他松糠酸酯25mcg的固定剂量组合,每天两次(bid)
[0237]
2.盐酸奥洛他定665mcg和莫米他松糠酸酯50mcg的固定剂量组合,每天一次(qd)
[0238]
3.鼻用喷雾(盐酸氮卓斯汀137mcg 丙酸氟替卡松50mcg)喷雾,每天两次(bid)
[0239]
4.鼻用喷雾(盐酸奥洛他定665mcg),每天两次(bid)
[0240]
5.安慰剂鼻用喷雾
[0241]
在此研究中利用包括四个遮蔽的鼻用喷雾瓶(两个用于晚上给药,另外两个用于早上给药)的双模拟设计(参见表a)。
[0242]
表a
[0243]
使用四个遮蔽的鼻用喷雾瓶的处理施用
[0244][0245]
此研究由五次访问研究地点和12天在家给药期(和2天现场给药-总共14天给药)组成。在季节过去时在eec设备中进行功效终点的评估。在初始筛选访问(访问1)之后,满足所有研究准则(包括主要纳入准则:皮肤点刺测试(spt)阳性和2年对豚草过敏原的过敏性鼻炎(ar)病史)的患者在eec中经历进一步筛选/激发(访问2)。在eec阶段期间,使患者暴露于浓度为3500
±
500个粒子/m3的豚草花粉持续6小时。在满足6/12的最小合格tnss,包括在研究中持续在连续两条日记中鼻充血得分至少为2的eec患者中,患者使用电子日记(epdat
tm
)每30分钟对其眼部和鼻部症状进行评级。在访问3时,在次日(第1天),满足最小准则的患者回到eec进入第二连续eec阶段。在此次访问期间使患者暴露于过敏原持续约10小时。在头6小时内,患者每30分钟使用电子日记完成症状评估并且满足最小合格症状得分以便持续。将满足最小合格症状得分的那些患者随机化以在eec中在6小时时间点之后接受五种研究药物中的一种。在给药之后(大约在中午),让患者在5分钟、10分钟、15分钟、25分钟、30分钟、45分钟、60分钟时完成症状评估,然后在访问的剩余时间内每30分钟进行症状评估。使用在eec中的处理后症状评估来确定研究处理的作用开始情况。然后将患者与其研究药物一起送回家以继续在家bid给药,在第1天从晚上剂量开始。患者持续在家给药12天的时间。在家给药12天(第2天-第13天)之后,患者在第14天(访问4)时回到eec进入处理后6小时激发eec阶段。在进入eec之前一小时时,给予患者早上剂量的研究药物。在同一天的半夜摄入研究处理的最后一次剂量的eec患者中,每30分钟进行症状评估,并且在次日早上(第15天,访问5)返回进入6小时eec阶段。在6小时的时间内,患者每30分钟使用电子日记完成症状评估。除收集鼻部和眼部症状之外,在访问2、访问3、访问4和访问5时使用电子日记收集eec-生活质量问卷(eec-qolq),并且在访问5时收集可接受性和耐受性。访问5为研究的最后一次访问。
[0246]
激发
[0247]
在激发访问时两条连续日记卡读段中的每一者满足以下准则:最小tnss为6/12,包括鼻充血得分至少为2。
[0248]
随机化
[0249]
●
在3小时腔室持续时间的两次激发访问时满足这些相同准则的患者,以便进行处理访问(访问3)。
[0250]
●
在处理访问(访问3)时,最小tnss为6/12(包括鼻充血得分至少为2)。
[0251]
药物制剂
[0252]
研究中所用的测试产品制剂如下:
[0253]
测试产品1(tp-1)
[0254]
单水合莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾(25mcg 600mcg)
[0255]
每次喷雾递送等效于25mcg莫米他松糠酸酯的单水合莫米他松糠酸酯以及等效于600mcg奥洛他定的盐酸奥洛他定。
[0256]
测试产品2(tp-2)
[0257]
单水合莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾(50mcg 600mcg)
[0258]
每次喷雾递送等效于50mcg莫米他松糠酸酯的单水合莫米他松糠酸酯以及等效于600mcg奥洛他定的盐酸奥洛他定。
[0259]
给药方案
[0260]
1.研究性产品
[0261]
●
tp-1:盐酸奥洛他定(665mcg)和莫米他松糠酸酯(25mcg)鼻用喷雾的固定剂量组合:每个鼻孔2次喷雾每天两次(bid)递送两周。
[0262]
●
tp-2:盐酸奥洛他定(665mcg)和莫米他松糠酸酯(50mcg)鼻用喷雾的固定剂量组合:每个鼻孔2次喷雾每天一次(qd)递送两周。
[0263]
2.参考疗法
[0264]
●
盐酸奥洛他定鼻用喷雾(0.6%):每个鼻孔2次喷雾每天两次递送两周。
[0265]
●
(盐酸氮卓斯汀 丙酸氟替卡松)137mcg/50mcg鼻用喷雾:每个鼻孔1次喷雾每天两次递送两周。
[0266]
●
安慰剂鼻用喷雾(基于研究性产品的媒介物):每个鼻孔2次喷雾每天两次递送两周。
[0267]
主要评估准则(临床终点)
[0268]
●
相较于安慰剂,莫米他松糠酸酯和盐酸奥洛他定的固定剂量组合的平均处理后总鼻部症状得分(tnss)相较于基线的变化。计算在访问5时在处理后在eec中历经6小时(在第14天第一次给药之后第18小时至第24小时)的平均tnss并且匹配在访问3时(在第一次给药之前历经6小时)在eec中的基线tnss。
[0269]
●
两种方案的莫米他松糠酸酯和盐酸奥洛他定的固定剂量组合与参考产品:鼻用喷雾和鼻用喷雾的平均处理后tnss相较于基线的变化。计算在访问5时在处理后在eec中历经6小时(在第14天第一次给药之后第18小时至第24小时)的平均tnss并且匹配在访问3时(在第一次给药之前历经6小时)在eec中的基线tnss。
[0270]
●
两种方案的莫米他松糠酸酯和盐酸奥洛他定的固定剂量组合、鼻
用喷雾和鼻用喷雾的平均处理后tnss相较于基线的变化。计算在访问4时在处理后在eec中历经6小时(在第14天第一次给药之后第1小时至第7小时)的平均处理后tnss并且匹配在访问2时(历经6小时)在eec中的基线tnss。
[0271]
●
与参考产品:鼻用喷雾和鼻用喷雾相比,两种方案的莫米他松糠酸酯和盐酸奥洛他定的固定剂量组合的平均处理后tnss相较于基线的变化。计算在eec中在处理后历经12小时(在访问4时在第14天第一次给药之后1小时至7小时,以及在访问5时在第14天第一次给药之后18小时至24小时)的平均tnss,并且匹配在访问2和访问3时(在第一次给药之前历经12小时)在eec中的基线tnss。
[0272]
●
通过比较每种活性剂处理和安慰剂之间在第一次处理之后在每个时间点的处理后tnss相较于基线的变化来评估莫米他松糠酸酯和盐酸奥洛他定的固定剂量组合、和的每种处理的作用开始情况。在访问3时在eec中在研究处理的第一个剂量之后(即,在访问3时在eec中的最后四个小时)在每个时间点计算tnss相较于基线的变化,基线(访问3)定义为给药前最后两个时间点的平均值。
[0273]
●
在访问5时在eec中历经6小时的平均处理后总症状得分(tss)、个别鼻部症状得分(nss,四种鼻部症状:流鼻涕、瘙痒、打喷嚏和鼻充血)以及toss相较于基线的变化,并且匹配在访问3时(在第一次给药之前历经6小时)的基线。
[0274]
●
在访问4时在eec中历经6小时的平均处理后总症状得分(tss)、个别鼻部症状得分(nss,四种鼻部症状:流鼻涕、瘙痒、打喷嚏和鼻充血)以及toss相较于基线的变化,并且匹配在访问2时(在eec中历经6小时)的基线。
[0275]
●
在访问4和访问5时在eec中历经12小时的平均处理后总症状得分(tss)、个别鼻部症状得分(nss,四种鼻部症状:流鼻涕、瘙痒、打喷嚏和鼻充血)以及toss相较于基线的变化,并且匹配在访问2和访问3时在给药之前在eec中历经12小时的基线。
[0276]
●
所有处理实验组的eec-qolq,通过比较1)基线处(访问2时)的eec前qolq(pre-eec-qolq)与访问4时的eec前值(pre-eec);2)基线处访问2时的eec后值(post-eec)与访问4时的eec后值;3)访问3时(在第一次给药之前)在eec中6小时之后与访问5时的eec后值。
[0277]
●
与访问5时的安慰剂eec后值相比,处理实验组的反射性耐受性和可接受性。
[0278]
结果
[0279]
表b示出了从基线到在eec中历经6小时处理后的tnss变化的汇总(itt群体)。
[0280]
表b
[0281][0282]
表c示出了从基线到在eec中历经12小时处理后的tnss变化的汇总(itt群体)。(表c中nasonex的数据来源于其美国fda注册商标。)
[0283]
表c
[0284][0285]
*(莫米他松糠酸酯鼻用喷雾)美国fda注册商标(2011年1月19日)
[0286]
表d示出了从基线到在eec中历经12小时处理后的toss变化的汇总(itt群体)。
[0287]
表d
[0288][0289]
研究结果表明当向人类患者经鼻施用莫米他松糠酸酯与盐酸奥洛他定的组合时提供对季节性过敏性鼻炎的有效治疗以及临床上与此相关的鼻部与非鼻部症状两者的显著减轻。对于tnss,此缓解的量值为临床相关的(即,测试产品与安慰剂之间相差大于2个单位,这通常被认为是临床相关的)。测试产品-1与参考产品(和)相比显示总体更佳的症状缓解。对于tp-1,基于在访问3时在第一个剂量之后itnss相较于基线的变化(-1.26),到10分钟时开始作用。然而,对于tp-2、dymista和patanase,不能确定作用开始情况,因为在这些处理与安慰剂处理之间未在任何2个连续时间点观测到itnss相较于基线的变化的统计显著性差异。
[0290]
实施例6
[0291]
在人类患者中对莫米他松和奥洛他定鼻用喷雾的固定剂量组合的阶段ii临床研究
[0292]
研究为双盲、随机化、平行组、比较研究,用于评估在患有季节性过敏性鼻炎(sar)的受试者(12岁和12岁以上)中,与安慰剂鼻用喷雾以及盐酸奥洛他定鼻用喷雾和莫米他松糠酸酯鼻用喷雾的个别单一疗法制剂相比,两种不同强度和方案的莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的固定剂量组合的功效、安全性和耐受性。
[0293]
主要目标
[0294]
●
为比较每天一次莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾以及每天两次莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾与安慰剂鼻用喷雾以及与个别组成性单一疗法在相同剂量下在相同媒介物中历经14天的研究处理的功效。
[0295]
●
为比较每天一次莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾以及每天两次莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾与安慰剂以及与个别组成性单一疗法之间在相同剂量下在相同媒介物中在施用第一个剂量的研究药物之后的作用开始情况。
[0296]
●
为评估个别处理实验组的安全性和耐受性。
[0297]
表e
[0298]
研究性产品和其施用
[0299][0300]
样品尺寸:
[0301]
研究中招募总共1,106个随机化的受试者(每个处理实验组158个受试者)。
[0302]
主要受试者选择准则:
[0303]
●
年龄≥12岁和12岁以上,包括任一性别。
[0304]
●
记录有sar临床病史(在筛选访问前至少2年),并且加重(有活性症状的临床证据)并且对山区雪松过敏原展现出所记录的阳性spt(风团直径比对照风团大至少5mm)。
[0305]
●
在可能的12者中,12小时反射性tnss≥8,并且在筛选访问(访问1)时am评估的充血得分≧2。
[0306]
研究设计∶
[0307]
在多个研究地点,将受试者针对处理以1:1:1:1:1:1:1比率随机化至以下七个处理实验组。
[0308]
此研究中利用包括两个相同的鼻用喷雾瓶(一个用于早上[am]给药,另一个用于晚上[pm]给药)的双模拟设计(表f)。考虑所比较的处理的给药频率有变化(bid与qd相比较),确保双模拟设计为充分设盲的。
[0309]
表f
[0310]
使用两个相同的鼻用喷雾瓶的处理施用
[0311]
(每个鼻孔2次喷雾,每瓶总共4次喷雾,每天进行)
[0312]
[0313][0314]
此研究由四次访问研究地点组成。在初始筛选访问(访问1)之后,满足所有研究选择准则的受试者需要经历7-10天的单盲安慰剂导入期。在导入期完成之后,招募满足随机化准则的合格受试者并且随机化至七个处理实验组中的一者。按照随机化列表为受试者分配药物。随机化的受试者需要按照方案经历2周(14天)处理期以评估所分配的处理的功效和安全性。
[0315]
主要评估准则(临床终点):
[0316]
一级终点
[0317]
●
在14-天处理期内平均am和pm受试者报告的12小时rtnss(反射性tnss)相较于基线的变化。
[0318]
二级终点
[0319]
●
在14天处理期内平均am和pm受试者报告的12小时itnss(瞬时tnss)相较于基线的变化。
[0320]
●
在14-天处理期内平均am和pm受试者报告的12小时rtoss(反射性toss)相较于基线的变化。
[0321]
●
通过将每种活性剂处理与安慰剂之间在第一次研究处理之后的规定时间点(在第一个剂量之前(给药前)、15min、30min、45min、60min、90min、120min、150min、180min、210min和240min)的处理后itnss相较于基线的变化相比较持续4小时来评估每种处理的作用开始情况。
[0322]
●
如在随机化访问(rv)时3.0或更大的rqlq得分所定义在基线处生活质量受损的受试者(rqlq群体)在处理实验组之间第15天的鼻结膜炎生活质量问卷(rqlq)相较于基线的变化。
[0323]
三级功效终点
[0324]
鼻部症状:
[0325]
●
在14-天处理期内am受试者报告的rtnss相较于基线的变化。
[0326]
●
在14-天处理期内am受试者报告的itnss相较于基线的变化。
[0327]
●
在14-天处理期内pm受试者报告的rtnss相较于基线的变化。
[0328]
●
在14-天处理期内pm受试者报告的itnss相较于基线的变化。
[0329]
●
在14-天处理期内受试者报告的反射性个别鼻部症状(am、pm以及am和pm的平均值)相较于基线的变化。
[0330]
●
在14-天处理期内受试者报告的瞬时个别鼻部症状(am、pm以及am和pm的平均值)相较于基线的变化。
[0331]
●
每天平均am和pm受试者报告的rtnss和itnss相较于基线的变化。
[0332]
●
每天am受试者报告的rtnss和itnss相较于基线的变化。
[0333]
●
每天pm受试者报告的rtnss和itnss相较于基线的变化。
[0334]
眼部症状:
[0335]
●
在14-天处理期内平均am和pm受试者报告的itoss(瞬时toss)相较于基线的变化。
[0336]
●
在14-天处理期内am受试者报告的rtoss相较于基线的变化。
[0337]
●
在14-天处理期内am受试者报告的itoss相较于基线的变化。
[0338]
●
在14-天处理期内pm受试者报告的rtoss相较于基线的变化。
[0339]
●
在14-天处理期内pm受试者报告的itoss相较于基线的变化。
[0340]
●
在14-天处理期内受试者报告的反射性个别眼部症状(am、pm以及am和pm的平均值)相较于基线的变化。
[0341]
●
在14-天处理期内受试者报告的瞬时个别眼部症状(am、pm以及am和pm的平均值)相较于基线的变化。
[0342]
●
每天am和pm受试者报告的rtoss和itoss的平均值相较于基线的变化。
[0343]
●
每天am受试者报告的rtoss和itoss相较于基线的变化。
[0344]
●
每天pm受试者报告的rtoss和itoss相较于基线的变化。
[0345]
以类似于以上眼部症状的方式评估非鼻部症状。
[0346]
医师评估的鼻部症状得分(pnss)和鼻结膜炎生活质量问卷(rqlq):
[0347]
●
在第15天(访问4)时医师评估的鼻部症状得分(pnss)和医师评估的个别鼻部症状。
[0348]
●
rqlq群体(定义为在基线处生活质量受损的受试者)的第15天(访问4)时的rqlq的个别维度。
[0349]
●
全分析集(fas)的第15天(访问4)时的rqlq。
[0350]
结果
[0351]
表g示出了在此阶段ii研究期间观测到的一级临床终点(rtnss)和二级临床终点(itnss、rtoss、作用开始情况和rqlq)的汇总。对于组合疗法与单一疗法的比较,p值低于0.05被视为具统计显著性。
[0352]
表g
[0353][0354][0355]
*指示统计显著性
[0356]
如由表g可见,对于一级终点rtnss相较于基线的变化,当每天一次(tp-2)或每天两次(tp-1)施用莫米他松糠酸酯与盐酸奥洛他定的组合时在统计学上优于安慰剂(p《0.0001)。当每天一次(tp-2)或每天两次(tp-1)施用莫米他松糠酸酯与盐酸奥洛他定的组合时还满足试验中的二级临床终点,这支持其在治疗季节性过敏性鼻炎(sar)中的功效。对于一级(rtnss)与二级终点(itnss)两者,当每天两次施用莫米他松糠酸酯与盐酸奥洛他定的组合(tp-1)时还在统计学上优于个别单一疗法(go-2和gm-2)。
[0357]
表g2示出了tp-1和tp-2相较于安慰剂的个别反射性鼻部症状得分的最小二乘均数差。
[0358]
表g2
[0359][0360][0361]
表h示出了在此阶段ii研究期间观测到的处理紧急有害事件(teae)的汇总。
[0362]
表h
[0363][0364]
所有teae均为轻度到中度。味觉障碍(1.3%)和头痛(1.9%)分别为关于每天两次(bid)和每天一次(qd)施用莫米他松糠酸酯和盐酸奥洛他定的组合所报告的有害事件(ae)。
[0365]
实施例7
[0366]
在患有春季sar的人类患者中对莫米他松和奥洛他定鼻用喷雾的固定剂量组合的阶段iii临床研究
[0367]
此研究为双盲、随机化、平行组、比较研究,用于评估在患有春季季节性过敏性鼻
炎(sar)的受试者(12岁和12岁以上)中,与安慰剂鼻用喷雾以及盐酸奥洛他定鼻用喷雾和莫米他松糠酸酯鼻用喷雾的个别单一疗法制剂相比,莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的固定剂量组合的功效、安全性和耐受性。
[0368]
研究目标
[0369]
●
为比较每天两次莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾与安慰剂鼻用喷雾以及与个别组成性单一疗法在相同剂量下在相同媒介物中历经14天的研究处理的功效。
[0370]
●
为评估个别处理实验组的安全性和耐受性。
[0371]
●
为研究每天两次莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾处理的药代动力学(pk)。
[0372]
表i
[0373]
研究性产品和其施用
[0374][0375]
样品尺寸:
[0376]
研究中招募总共1,180个随机化的受试者(每个处理实验组295个受试者)。
[0377]
主要受试者选择准则:
[0378]
●
年龄≥12岁和12岁以上,包括任一性别。
[0379]
●
记录有sar临床病史(在筛选访问前至少2年),并且在针对山区季节花粉的研究季节期间加重(有活性症状的临床证据),并且对山区雪松过敏原展现所记录的阳性spt(风团直径比对照风团大至少5mm)。
[0380]
●
在可能的12者中,12小时反射性tnss≥8,并且在筛选访问(访问1)时am评估的充血得分≧2。
[0381]
研究设计∶
[0382]
在多个研究地点,将受试者针对处理以1:1:1:1比率随机化至以下四个处理实验组。
[0383]
表j
[0384]
使用两个相同的鼻用喷雾瓶的处理施用
[0385]
(每个鼻孔2次喷雾,每瓶总共4次喷雾,每天进行)
[0386][0387]
此研究由四次访问研究地点组成。在初始筛选访问(访问1)之后,满足所有研究选择准则的受试者需要经历7-10天的单盲安慰剂导入期。在导入期完成之后,招募满足随机化准则的合格受试者并且随机化至四个处理实验组中的一者。按照随机化列表为受试者分配药物。随机化的受试者需要按照方案经历2周(14天)处理期以评估所分配的处理的功效和安全性。令受试者在症状评估日记中记录症状得分。还安排他们在处理期期间取至少两个血液样品用于pk评估。
[0388]
主要评估准则(临床终点):
[0389]
一级终点
[0390]
●
在14-天处理期内平均am和pm受试者报告的12小时rtnss(反射性tnss)相较于基线的变化。
[0391]
二级终点
[0392]
●
在14天处理期内平均am和pm受试者报告的12小时itnss(瞬时tnss)相较于基线的变化。
[0393]
●
在14-天处理期内平均am和pm受试者报告的12小时rtoss(反射性toss)相较于基线的变化。
[0394]
●
通过将每种活性剂处理与安慰剂之间在第一次研究处理之后的规定时间点(在第一个剂量之前(给药前)、15min、30min、45min、60min、90min、120min、150min、180min、210min和240min)的处理后itnss相较于基线的变化相比较持续4小时来评估每种处理的作用开始情况。
[0395]
●
全分析集(fas)的第15天(访问4)时的总鼻结膜炎生活质量问卷(rqlq)-标准化活动(rqlq(s))得分相较于基线的变化。
[0396]
药代动力学终点
[0397]
●
血浆pk:将基于药代动力学分析集(pkas)在第1天和第8天估计莫米他松糠酸酯和奥洛他定的最大血浆浓度(c
最大
)、达到c
最大
的时间(t
最大
)和在给药间隔内血浆浓度-时间曲线下面积(auc
tau
)。
[0398]
三级功效终点
[0399]
鼻部症状:
[0400]
●
在14-天处理期内am受试者报告的rtnss相较于基线的变化。
[0401]
●
在14-天处理期内am受试者报告的itnss相较于基线的变化。
[0402]
●
在14-天处理期内pm受试者报告的rtnss相较于基线的变化。
[0403]
●
在14-天处理期内pm受试者报告的itnss相较于基线的变化。
[0404]
●
在14-天处理期内受试者报告的反射性个别鼻部症状(am、pm以及am和pm的平均值)相较于基线的变化。
[0405]
●
在14-天处理期内受试者报告的瞬时个别鼻部症状(am、pm以及am和pm的平均值)相较于基线的变化。
[0406]
●
每天平均am和pm受试者报告的rtnss和itnss相较于基线的变化。
[0407]
●
每天am受试者报告的rtnss和itnss相较于基线的变化。
[0408]
●
每天pm受试者报告的rtnss和itnss相较于基线的变化。
[0409]
眼部症状:
[0410]
●
在14-天处理期内平均am和pm受试者报告的itoss(瞬时toss)相较于基线的变化。
[0411]
●
在14-天处理期内am受试者报告的rtoss相较于基线的变化。
[0412]
●
在14-天处理期内am受试者报告的itoss相较于基线的变化。
[0413]
●
在14-天处理期内pm受试者报告的rtoss相较于基线的变化。
[0414]
●
在14-天处理期内pm受试者报告的itoss相较于基线的变化。
[0415]
●
在14-天处理期内受试者报告的反射性个别眼部症状(am、pm以及am和pm的平均值)相较于基线的变化。
[0416]
●
在14-天处理期内受试者报告的瞬时个别眼部症状(am、pm以及am和pm的平均值)相较于基线的变化。
[0417]
●
每天am和pm受试者报告的rtoss和itoss的平均值相较于基线的变化。
[0418]
●
每天am受试者报告的rtoss和itoss相较于基线的变化。
[0419]
●
每天pm受试者报告的rtoss和itoss相较于基线的变化。
[0420]
以类似于以上眼部症状的方式评估非鼻部症状。
[0421]
医师评估的鼻部症状得分(pnss)、鼻结膜炎生活质量问卷标准化活动(rqlq(s))和鼻炎控制评估测试(rcat):
[0422]
●
第15天(访问4)时的pnss和医师评估的个别鼻部症状相较于基线的变化。
[0423]
●
fas的第15天(访问4)时的rqlq(s)的个别维度相较于基线的变化。
[0424]
●
rqlq(s)分析集的第15天(访问4)时的总rqlq(s)得分和rqlq(s)的个别维度相较于基线的变化。
[0425]
●
第15天(访问4)时的rcat相较于基线的变化。
[0426]
●
第15天(访问4)时的rcat的个别维度相较于基线的变化。
[0427]
●
rqlq群体(定义为在基线处生活质量受损的受试者)的第15天(访问4)时的rqlq的个别维度。
[0428]
●
全分析集(fas)的第15天(访问4)时的rqlq。
[0429]
结果
[0430]
表k示出了在此阶段iii研究期间观测到的一级临床终点(rtnss)和二级临床终点
(itnss、rtoss、作用开始情况和rqlq)的汇总。对于组合疗法与单一疗法的比较,p值低于0.05被视为具统计显著性。
[0431]
表k
[0432][0433]
*指示统计显著性。
[0434]
如由表k可见,当每天两次施用莫米他松糠酸酯和盐酸奥洛他定的组合(tp-1)时对于一级终点rtnss相较于基线的变化在统计学上优于安慰剂(p《0.0001),并且在统计学上优于盐酸奥洛他定单一疗法(go-2)。当每天两次施用莫米他松糠酸酯与盐酸奥洛他定的组合(tp-1)时,二级终点也具统计显著性,这支持其在治疗季节性过敏性鼻炎(sar)中的功效。
[0435]
当与盐酸奥洛他定单一疗法或莫米他松糠酸酯单一疗法相比时,如通过itnss所测量,当每天两次施用莫米他松糠酸酯与盐酸奥洛他定的组合(tp-1)时还展现更快(快速)的作用开始(在15分钟内开始作用)。
[0436]
所有teae均为轻度到中度。味觉障碍(3.3%)和头痛(0.7%)被报告为每天两次(bid)施用莫米他松糠酸酯与盐酸奥洛他定的组合的有害事件。
[0437]
在第1天和第8天(稳态)针对阶段iii临床研究中的患者子集测量tp-1的药代动力学(pk)。以下提供接受tp-1的患者的pk结果。
[0438][0439][0440]
实施例8
[0441]
在患有秋季和山区雪松季节sar的人类患者中对莫米他松和奥洛他定鼻用喷雾的
固定剂量组合的阶段iii临床研究
[0442]
此研究为双盲、随机化、平行组、比较研究,用于评估在患有秋季和山区雪松季节的季节性过敏性鼻炎(sar)的受试者(12岁和12岁以上)中,与安慰剂鼻用喷雾以及盐酸奥洛他定鼻用喷雾和莫米他松糠酸酯鼻用喷雾的个别单一疗法制剂相比,莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的固定剂量组合的功效、安全性和耐受性。
[0443]
研究目标
[0444]
●
为比较每天两次莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾与安慰剂鼻用喷雾以及与个别组成性单一疗法在相同剂量下在相同媒介物中历经14天的研究处理的功效。
[0445]
●
为评估个别处理实验组的安全性和耐受性。
[0446]
表l
[0447]
研究性产品和其施用
[0448][0449]
样品尺寸:
[0450]
研究中招募总共1,176个随机化的受试者(每个处理实验组约294个受试者)。对于此研究,受试者群体为患有sar的成年和青年受试者(12岁和12岁以上),这些受试者在秋季过敏季节期间对相关季节性过敏原(例如豚草)展现sar症状。
[0451]
研究设计∶
[0452]
在多个研究地点,将受试者针对处理以1:1:1:1比率随机化至以下四个处理实验组。
[0453]
表m
[0454]
使用两个相同的鼻用喷雾瓶的处理施用
[0455]
(每个鼻孔2次喷雾,每瓶总共4次喷雾,每天进行)
[0456]
[0457][0458]
此研究由四次访问研究地点组成。在初始筛选访问(访问1)之后,满足所有研究选择准则的受试者需要经历7-10天的单盲安慰剂导入期。在导入期完成之后,招募满足随机化准则的合格受试者并且随机化至四个处理实验组中的一者。按照随机化列表为受试者分配药物。随机化的受试者需要按照方案经历2周(14天)处理期以评估所分配的处理的功效和安全性。令受试者在症状评估日记中记录症状得分。
[0459]
主要评估准则(临床终点):
[0460]
一级终点
[0461]
●
在14-天处理期内平均am和pm受试者报告的12小时rtnss(反射性tnss)相较于基线的变化。
[0462]
二级终点
[0463]
●
在14天处理期内平均am和pm受试者报告的12小时itnss(瞬时tnss)相较于基线的变化。
[0464]
●
在14-天处理期内平均am和pm受试者报告的12小时rtoss(反射性toss)相较于基线的变化。
[0465]
●
通过将每种活性剂处理与安慰剂之间在第一次研究处理之后的规定时间点(在第一个剂量之前(给药前)、15min、30min、45min、60min、90min、120min、150min、180min、210min和240min)的处理后itnss相较于基线的变化相比较持续4小时来评估每种处理的作用开始情况。
[0466]
●
全分析集(fas)的第15天(访问4)时的总鼻结膜炎生活质量问卷(rqlq)-标准化活动(rqlq(s))得分相较于基线的变化。
[0467]
三级功效终点
[0468]
鼻部症状:
[0469]
●
在14-天处理期内am受试者报告的rtnss相较于基线的变化。
[0470]
●
在14-天处理期内am受试者报告的itnss相较于基线的变化。
[0471]
●
在14-天处理期内pm受试者报告的rtnss相较于基线的变化。
[0472]
●
在14-天处理期内pm受试者报告的itnss相较于基线的变化。
[0473]
●
在14-天处理期内受试者报告的反射性个别鼻部症状(am、pm以及am和pm的平均值)相较于基线的变化。
[0474]
●
在14-天处理期内受试者报告的瞬时个别鼻部症状(am、pm以及am和pm的平均值)相较于基线的变化。
[0475]
●
每天平均am和pm受试者报告的rtnss和itnss相较于基线的变化。
[0476]
●
每天am受试者报告的rtnss和itnss相较于基线的变化。
[0477]
●
每天pm受试者报告的rtnss和itnss相较于基线的变化。
[0478]
眼部症状:
[0479]
●
在14-天处理期内平均am和pm受试者报告的itoss(瞬时toss)相较于基线的变化。
[0480]
●
在14-天处理期内am受试者报告的rtoss相较于基线的变化。
[0481]
●
在14-天处理期内am受试者报告的itoss相较于基线的变化。
[0482]
●
在14-天处理期内pm受试者报告的rtoss相较于基线的变化。
[0483]
●
在14-天处理期内pm受试者报告的itoss相较于基线的变化。
[0484]
●
在14-天处理期内受试者报告的反射性个别眼部症状(am、pm以及am和pm的平均值)相较于基线的变化。
[0485]
●
在14-天处理期内受试者报告的瞬时个别眼部症状(am、pm以及am和pm的平均值)相较于基线的变化。
[0486]
●
每天am和pm受试者报告的rtoss和itoss的平均值相较于基线的变化。
[0487]
●
每天am受试者报告的rtoss和itoss相较于基线的变化。
[0488]
●
每天pm受试者报告的rtoss和itoss相较于基线的变化。
[0489]
以类似于以上眼部症状的方式评估非鼻部症状。
[0490]
医师评估的鼻部症状得分(pnss)、鼻结膜炎生活质量问卷标准化活动(rqlq(s))和鼻炎控制评估测试(rcat):
[0491]
●
第15天(访问4)时的pnss和医师评估的个别鼻部症状相较于基线的变化。
[0492]
●
fas的第15天(访问4)时的rqlq(s)的个别维度相较于基线的变化。
[0493]
●
rqlq(s)分析集的第15天(访问4)时的总rqlq(s)得分和rqlq(s)的个别维度相较于基线的变化。
[0494]
●
第15天(访问4)时的rcat相较于基线的变化。
[0495]
●
第15天(访问4)时的rcat的个别维度相较于基线的变化。
[0496]
结果
[0497]
表n示出了在此阶段iii研究期间观测到的一级临床终点(rtnss)和二级临床终点(itnss、rtoss、作用开始情况和rqlq)的汇总。对于组合疗法与单一疗法的比较,p值低于0.05被视为具统计显著性。
[0498]
表n
[0499][0500]
*指示统计显著性
[0501]
如由表n可见,当每天两次施用莫米他松糠酸酯与盐酸奥洛他定的组合(tp-1)时对于一级终点rtnss相较于基线的变化在统计学上优于安慰剂(p《0.0001),并且在统计学上优于盐酸奥洛他定单一疗法(go-2)和莫米他松糠酸酯单一疗法(gm-2)。当每天两次施用莫米他松糠酸酯与盐酸奥洛他定的组合(tp-1)时,二级终点也具统计显著性,这支持其在治疗季节性过敏性鼻炎(sar)中的功效。
[0502]
表n2示出了tp-1组相较于安慰剂组的个别反射性和瞬时鼻部症状得分的最小二乘均数差。
[0503]
表n2
[0504][0505]
当与盐酸奥洛他定单一疗法或莫米他松糠酸酯单一疗法相比时,如通过itnss所测量,当每天两次施用莫米他松糠酸酯与盐酸奥洛他定的组合(tp-1)时还展现更快(快速)的作用开始(在15分钟内开始作用)。
[0506]
所有teae均为轻度到中度。味觉障碍(3.8%)鼻部不适(1%)和泌尿道感染(1%)为关于每天两次(bid)施用莫米他松糠酸酯与盐酸奥洛他定的组合所报告的有害事件。
[0507]
实施例9
[0508]
在人类患者中对莫米他松和奥洛他定鼻用喷雾的固定剂量组合的阶段iii临床研究
[0509]
研究为双盲、随机化、平行组、比较研究,用于评估在患有常年性过敏性鼻炎(par)的受试者(12岁和12岁以上)中,与两种安慰剂鼻用喷雾相比,莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的固定剂量组合的长期安全性、功效和耐受性。
[0510]
研究目标
[0511]
为比较每天两次莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾与两种安慰剂鼻用喷雾在患有par的受试者中在相同剂量下在相同媒介物中历经52周的研究处理的长期安全性和耐受性。
[0512]
次要目标为评估与安慰剂鼻用喷雾制剂(ph=3.7)相比,莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的固定剂量组合在患有par的受试者中的长期功效。
[0513]
主要受试者选择准则:
[0514]
●
男性和非妊娠女性,年龄≥12岁。
[0515]
●
最少2年的par病史并且对至少1种相关过敏原皮肤点刺测试呈阳性。
[0516]
●
在可能的12者中,am受试者报告的反射性总鼻部症状得分(rtnss)≥5,并且在筛选访问(访问1)时早上(am)评估的充血得分≥2。
[0517]
●
在安慰剂导入期结束时,适合随机化,受试者尚未经历将导致不满足筛选纳入准则的ae。
[0518]
●
在导入期的最后4天期间(从第3天am评估至随机化当天的am评估的最后4次连续am评估),最小am受试者报告的rtnss平均为5(在可能的12者中)
[0519]
●
在导入期的最后4天期间(从第3天am评估至随机化当天的am评估的最后4次连续am评估),am受试者报告的反射性鼻充血得分平均为2或更大
[0520]
研究设计∶
[0521]
研究中招募总共个601个随机化的受试者。在多个地点,将受试者针对处理以4:1:1比率随机化至3个处理组。下表o中提供了处理组。
[0522]
表o
[0523]
研究性产品和其施用
[0524][0525]
此研究由十二次访问研究地点组成。在初始筛选访问(访问1)之后,满足所有研究选择准则的受试者经历7-10天的单盲安慰剂导入期。在导入期完成之后,招募满足随机化准则的合格受试者并且随机化至三个处理实验组中的一者。随机化的受试者按照方案经历52周处理期以评估所分配的处理的功效和安全性。
[0526]
主要评估准则(临床终点):
[0527]
一级终点
[0528]
●
具有处理紧急有害事件(teae)的受试者的比例。
[0529]
●
具有处理相关teae的受试者的比例。
[0530]
●
在30周的研究处理之后teae的发生率、类型和严重程度。
[0531]
●
在52周的研究处理之后teae的发生率、类型和严重程度。
[0532]
●
在基线处、第30周和第52周的临床实验室评估(血液学、血清生物化学和尿分析)。
[0533]
●
在基线处、第30周和第52周的生命体征、身体检查(pe)和聚焦耳鼻喉(ent)检查和眼睛检验。
[0534]
二级终点
[0535]
功效终点
[0536]
●
在头6周、30周和52周的处理期间平均am受试者报告的rtnss相较于基线的变
化。
[0537]
●
在头6周、30周和52周的处理期间平均am受试者报告的瞬时总鼻部症状得分(itnss)相较于基线的变化。
[0538]
●
全分析集(fas)在第6周、第30周和第52周时的总鼻结膜炎生活质量问卷-标准化活性(rqlq(s))得分相较于基线的变化。
[0539]
其他功效终点
[0540]
其他终点包括am受试者报告的个别鼻部症状、从基线到每个处理周结束am受试者报告的rtnss和itnss、医师评估的鼻部症状得分和医师评估的个别鼻部症状、fas群体的rqlq的个别维度以及鼻炎控制评估测试和鼻炎控制评估测试的个别维度相较于基线的变化的其他评估。
[0541]
分析的数据集
[0542]
●
全分析集(fas)由被随机化并且接受至少一个剂量的研究性产品并且具有至少一种基线后功效评估的所有受试者组成。这是功效分析的一级分析集。
[0543]
●
符合方案集(per protocol set,pps)由fas的不满足pps排除准则的子集组成。pps为功效分析的次要分析集(除了rqlq(s))。
[0544]
●
安全分析集(sas)由在随机化之后摄入至少一个剂量的研究药物的所有受试者组成,并且用于所有安全分析。
[0545]
●
rqlq(s)分析集由如在随机化访问(访问2)时rqlq(s)得分为3.0或更大所定义在基线处生活质量受损的所有≥18岁的说英语的受试者组成
[0546]
功效分析
[0547]
对fas和pps进行功效分析。
[0548]
使用针对研究处理组、地点和基线(定义为在导入期的最后4天期间从第3天am评估至随机化当天的am评估的最后4次连续am评估的平均值)调整的协方差分析(ancova)模型分析在头6周、30周和52周的处理期间的平均am rtnss和itnss相较于基线的变化。呈现了处理差异的最小二乘均数(lsm)和相关95%置信区间(95%ci)和p值。
[0549]
以类似于上文所描述的方式对每个处理周结束时rtnss和itnss相较于基线的变化以及在处理期的头6周、30周和52周期间(和每个处理周结束时)个别鼻部症状得分相较于基线的变化进行分析。
[0550]
使用针对研究处理组、地点和基线rqlq(s)(线性、连续协变量)调整的ancova模型针对fas和rqlq(s)分析集对在第6周、第30周和第52周时的rqlq(s)相较于基线的变化进行分析。在每个时间点,仅分析完成各别访问者。
[0551]
rcat结果的分析类似于rqlq(s)分析,除了它仅对fas进行。
[0552]
安全分析
[0553]
将在第一个剂量的随机化研究药物之后发生的有害事件定义为teae。
[0554]
与ae有关的的安全性终点为:
[0555]
●
具有teae的受试者的比例。
[0556]
●
具有处理相关teae的受试者的比例。
[0557]
●
在30周的研究处理之后teae的发生率、类型和严重程度。
[0558]
●
在52周的研究处理之后teae的发生率、类型和严重程度。
[0559]
结果
[0560]
安全分析
[0561]
下表汇总了在52周施用期内对三个处理组的安全分析。
[0562][0563][0564]
如表中可见,在三个处理组之间不存在有意义的差异。大部分teae为轻度到中度严重程度的并且被研究者认为“不相关”。tp-1处理为安全的并且良好耐受,安全型态与关于个别单一疗法组分所预期的一致。研究期间未报告死亡。
[0565]
功效分析
[0566]
下表汇总了功效终点鼻部症状平均am反射性总鼻部症状(rtnss,持续12小时)的结果(全集分析,fas)。
[0567][0568]
*统计显著性
[0569]
如表中可见,在研究的头6周、30周和52周期间相较于pbo-1(ph=3.7),tp-1在rtnss中展现统计显著性和有意义的改善。
[0570]
下表汇总了功效终点鼻部症状平均am瞬时总鼻部症状(itnss,持续12小时)的结果(全集分析,fas)。
[0571][0572][0573]
*统计显著性
[0574]
如表中可见,在研究的头6周、30周和52周期间相较于pbo-1(ph=3.7),tp-1在itnss中展现统计显著性和有意义的改善。
[0575]
下表汇总了生活质量终点rqlq(s)的结果(全集分析,fas)。
[0576][0577]
*统计显著性
[0578]
如表中可见,在研究的头6周和30周期间相较于pbo-1(ph=3.7),tp-1在rqlq(s)中展现统计显著性和有意义的改善。
[0579]
实施例10
[0580]
在莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的固定剂量组合中奥洛他定的药代动力学
[0581]
在临床试验中评估在莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的固定剂量组合中奥洛他定的药代动力学。临床试验为用于评估以鼻用喷雾形式施用的三种处理的随机化、单中心、单剂量、开放标签、三阶段、六顺序、交叉研究。这三种处理包括莫米他松糠酸酯与盐酸奥洛他定鼻用喷雾的组合、盐酸奥洛他定鼻用喷雾和鼻用喷雾。
[0582]
将受试者以1:1:1:1:1:1比率随机化至6种处理顺序中的1种,所有受试者接受单个剂量的莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的固定剂量组合、盐酸奥洛他定鼻用喷雾和鼻用喷雾。研究由筛选访问、3个单剂量处理期加上在每个处理期的给药之间的7至14天的清除期、早期退出访问(如果适用)和第三处理期完成之后1至7天时的
跟踪电话访问(或访问)组成。
[0583]
将总共30个受试者随机化至6种处理顺序中的1种并且接受至少1个剂量的研究药物。安全分析集和药代动力学子集中包括所有30个受试者。除2个外全部受试者完成符合方案的研究。安全分析集由30个受试者组成:在安全分析集中分别29个、29个以及和30个受试者接受单个剂量的莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的固定剂量组合、盐酸奥洛他定鼻用喷雾和鼻用喷雾。药代动力学子集由30个受试者组成:在药代动力学子集中分别29个、29个以及和30个受试者接受单个剂量的莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的固定剂量组合、盐酸奥洛他定鼻用喷雾和鼻用喷雾。
[0584]
直至最后一个时间点(48小时)一直观测到可定量浓度的奥洛他定。所有3种处理均为良好耐受的。没有受试者死亡或报告严重有害事件;并且在此研究中仅一个受试者因处理紧急有害事件(轻度口咽疼痛)而停止。在3种处理中处理紧急有害事件和处理相关处理紧急有害事件均匀分布。所有处理紧急有害事件均为轻度的。处理中的任一种对实验室值、生命体征测量或ecg参数均没有临床显著影响。
[0585]
实施例11
[0586]
在莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的固定剂量组合中莫米他松糠酸酯的药代动力学
[0587]
在临床试验中评估在莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的固定剂量组合中莫米他松糠酸酯的药代动力学。所述临床试验为用于评估通过鼻用喷雾施用的三种处理的随机化、单中心、单剂量、开放标签、三阶段、六顺序、交叉研究。这三种处理包括莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的组合、莫米他松糠酸酯鼻用喷雾和鼻用喷雾。
[0588]
将受试者以1:1:1:1:1:1比率随机化至6种处理顺序中的1种,所有受试者接受单个剂量的莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的固定剂量组合、莫米他松糠酸酯鼻用喷雾和鼻用喷雾。研究由筛选访问、3个单剂量处理期加上在每个处理期的给药之间的7天至14天的清除期、早期退出访问(如果适用)和第三处理期完成之后1天至7天时的跟踪电话访问(或访问)组成。
[0589]
将总共30个受试者随机化至6种处理顺序中的1种并且接受至少1个剂量的研究药物。安全分析集和药代动力学子集中包括所有30个受试者。除2个外全部受试者完成符合方案的研究。安全分析集由30个受试者组成:在安全分析集中分别29个、29个以及和30个受试者接受单个剂量的莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的固定剂量组合、莫米他松糠酸酯鼻用喷雾和鼻用喷雾。药代动力学子集由30个受试者组成:在药代动力学子集中分别29个、29个和30个受试者接受单个剂量的莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的固定剂量组合、莫米他松糠酸酯鼻用喷雾和鼻用喷雾。
[0590]
直至最后一个时间点(72小时)一直观测到可定量浓度的莫米他松糠酸酯。所有3种处理均为良好耐受的。在此研究中没有受试者死亡或报告严重有害事件,或归因于处理紧急有害事件而停止。在3种处理中处理紧急有害事件均匀分布。所有处理紧急有害事件均为轻度的。处理中的任一种对实验室值、生命体征测量或ecg参数均没有临床显著影响。
[0591][0592]
实施例12
[0593]
在儿科患者中对莫米他松和奥洛他定鼻用喷雾的固定剂量组合的阶段iii临床研究
[0594]
此研究为双盲、随机化、平行组、12-周研究,用于评估在患有常年性季节性过敏性鼻炎(par)的儿科受试者(2岁至12岁以下)中,与安慰剂鼻用喷雾相比莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的固定剂量组合的功效、安全性和耐受性。
[0595]
研究目标
[0596]
为比较莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾(按每个鼻孔1次喷雾每天两次施用)与安慰剂鼻用喷雾在患有par的儿科受试者(年龄≥2岁至<12岁)中进行治疗的功效。
[0597]
次要目标为比较莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾与安慰剂鼻用喷雾历经12周的研究处理的安全性和耐受性。
[0598]
主要受试者选择准则
[0599]
●
到筛选访问(访问1)时为止年龄≥2岁至<12岁的男性或非妊娠女性受试者。
[0600]
●
记录有par临床病史(在筛选访问[访问1]前,对于年龄≥6岁至<12岁的受试者
为≥12个月,对于年龄≥2岁至<6岁的受试者为≥6个月),并且加重(有活性症状的临床证据)。在研究者的判断中,par必须在过去严重到足以需要治疗(连续或间断)并且预期在研究持续时间内需要治疗。
[0601]
●
对至少一种已知诱导par的过敏原被记录为皮肤点刺测试阳性(风团直径比阴性对照风团大至少3mm)。在筛选访问(访问1)之前12个月内的阳性结果记录为可接受的。受试者的阳性过敏原测试必须与par病史一致。另外,受试者预期在研究的整个持续时间内暴露于他或她经由皮肤点刺测试进行测试呈阳性的par过敏原。
[0602]
●
在筛选访问(访问1)时am评估的12小时rtnss值≥6(在可能的12者中)。
[0603]
研究设计
[0604]
在研究中将以2:1比率将总共约540个受试者(≥2岁至《12岁)随机化为用于莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的固定剂量组合(360个受试者)与安慰剂鼻用喷雾(180个受试者)。
[0605]
研究的持续时间将为12周。受试者参与可延长长达13周至14,由长达7天至10天的筛选/安慰剂导入期和12周的处理期加上可允许的用于研究访问的窗口期组成。下表中提供了处理组。
[0606]
研究性产品和其施用
[0607][0608]
*-每次喷雾提供665μg盐酸奥洛他定和25μg莫米他松糠酸酯。
[0609]
一级终点:
[0610]
●
年龄≥6岁至《12岁的受试者在头4周的处理期间的平均am和pm受试者报告的12小时反射性总鼻部症状得分(rtnss)相较于基线的变化。
[0611]
一种或多种二级终点:
[0612]
●
≥6岁至《12岁的受试者在头4周的处理期间的平均am和pm受试者报告的12小时瞬时总鼻部症状得分(itnss)相较于基线的变化。
[0613]
●
≥2岁至《12岁的受试者在头4周的处理期间的平均am和pm受试者报告的12小时rtnss相较于基线的变化。
[0614]
●
≥2岁至《12岁的受试者在头4周的处理期间的平均am和pm受试者报告的12小时itnss相较于基线的变化。
[0615]
●
在处理组之间在第4周时总儿科鼻结膜炎生活质量问卷(prqlq)得分相较于基线的变化。
[0616]
一种或多种其他终点:
[0617]
鼻部症状:
[0618]
tnss-头4周,受试者年龄≥6岁至<12岁:
[0619]
●
在头4周的处理期间am受试者报告的rtnss相较于基线的变化。
[0620]
●
在头4周的处理期间pm受试者报告的rtnss相较于基线的变化。
[0621]
●
在头4周的处理期间am受试者报告的itnss相较于基线的变化。
[0622]
●
在头4周的处理期间pm受试者报告的itnss相较于基线的变化。
[0623]
●
在头4周的处理期间受试者报告的反射性个别鼻部症状(am、pm以及am和pm的平均值)相较于基线的变化。
[0624]
●
在处理的头4周受试者报告的瞬时个别鼻部症状(am、pm以及am和pm的平均值)相较于基线的变化。
[0625]
●
每天受试者报告的rtnss和itnss(am、pm以及am和pm的平均值)相较于基线的变化。
[0626]
tnss-头4周,受试者年龄≥2岁至<6岁:
[0627]
●
年龄≥2岁至《6岁的受试者在头4周的处理期间平均am和pm受试者报告的12小时rtnss相较于基线的变化。
[0628]
●
年龄≥2岁至《6岁的受试者在头4周的处理期间平均am和pm受试者报告的12小时itnss相较于基线的变化。
[0629]
tnss-头4周,受试者年龄≥2岁至《12岁:
[0630]
●
年龄≥2岁至《12岁的受试者在头4周的处理期间平均am和pm受试者报告的12小时rtnss相较于基线的变化。
[0631]
●
年龄≥2岁至《12岁的受试者在头4周的处理期间平均am和pm受试者报告的12小时itnss相较于基线的变化。
[0632]
将针对以下各项(例如am、pm、个别症状)评估额外的总鼻部症状得分(tnss)结果:
[0633]
●
12周,受试者年龄≥6岁至《12岁。
[0634]
●
12周,受试者年龄≥2岁至《6岁。
[0635]
●
12周,受试者年龄≥2岁至《12岁。
[0636]
医师评估的鼻部症状得分(pnss):
[0637]
●
在第4周和第12周的pnss和医师评估的个别鼻部症状相较于基线的变化。
[0638]
儿科鼻结膜炎生活质量问卷(prqlq):
[0639]
●
在第4周和第12周的prqlq的个别维度。
[0640]
实施例13
[0641]
在儿科患者中对莫米他松和奥洛他定鼻用喷雾的固定剂量组合的阶段iii临床研究
[0642]
此研究为双盲、随机化、平行组14天研究,用于评估在患有季节性过敏性鼻炎(sar)的儿科受试者(年龄6岁至12岁以下)中,与安慰剂鼻用喷雾相比,莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的固定剂量组合历经14天的功效、安全性和耐受性。
[0643]
研究目标
[0644]
为比较莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾(按每天两次每个鼻孔1次喷雾进行施用)与安慰剂鼻用喷雾用于在患有sar的儿科受试者(年龄≥6岁至《12岁)中进行治疗的功效。
[0645]
次要目标为比较莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾与安慰剂鼻用喷雾在研究期内的安全性和耐受性。
[0646]
主要受试者选择准则
[0647]
●
在筛选访问(访问1)时年龄≥6岁至<12岁的男性或非妊娠女性受试者。
[0648]
●
记录有sar临床病史(在筛选访问[访问1]前至少2年),并且在针对相关季节性过敏原(树/草的花粉)的研究季节期间加重(有活性症状的临床证据)。sar必须在过去严重到足以需要治疗(连续或间断),并且在研究者的判断中预期在整个研究期内需要治疗。
[0649]
●
通过记录的对相关季节性过敏原的皮肤点刺测试呈阳性(风团直径比阴性对照大至少5mm)发现对至少1种已知诱导sar的季节性过敏原(树/草的花粉)展现敏感性。在筛选访问(访问1)之前12个月内的阳性结果记录为可接受的。受试者的阳性过敏原必须与sar病史一致。另外,预期受试者在研究的整个持续时间内适当暴露于他/她已测试呈阳性的sar过敏原。
[0650]
●
在筛选访问(访问1)时早上(am)评估的12小时反射性总鼻部症状得分(rtnss)值≥6(在可能的12者中)。
[0651]
研究设计
[0652]
在研究中将以1:1比率将总共约450个受试者(≥6岁至《12岁)随机化为用于莫米他松糠酸酯和盐酸奥洛他定鼻用喷雾的固定剂量组合(225个受试者)与安慰剂鼻用喷雾(225个受试者)。
[0653]
下表中提供了处理组。
[0654]
研究性产品和其施用
[0655][0656]
*-每次喷雾提供665μg盐酸奥洛他定和25μg莫米他松糠酸酯。
[0657]
受试者参与可为22天至27天,其中7天至10天为筛选/导入期并且14天为处理期,并且具有可允许的用于研究访问的窗口期。
[0658]
主要评估准则(临床终点):
[0659]
一级终点
[0660]
●
在14天处理期内平均am和pm受试者报告的12小时反射性总鼻部症状得分(rtnss)相较于基线的变化。
[0661]
一种或多种二级终点:
[0662]
●
在14天处理期内平均am和pm受试者报告的12小时瞬时总鼻部症状得分(itnss)相较于基线的变化。
[0663]
●
处理组之间第15天(访问4)时的总儿科鼻结膜炎生活质量问卷(prqlq)得分相
较于基线的变化。
[0664]
●
在14-天处理期内平均am和pm受试者报告的12小时反射性总眼部症状得分(rtoss)相较于基线的变化。
[0665]
一种或多种其他功效终点:
[0666]
鼻部症状
[0667]
●
在14-天处理期内am受试者报告的rtnss相较于基线的变化。
[0668]
●
在14-天处理期内am受试者报告的itnss相较于基线的变化。
[0669]
●
在14-天处理期内pm受试者报告的rtnss相较于基线的变化。
[0670]
●
在14-天处理期内pm受试者报告的itnss相较于基线的变化。
[0671]
●
在14-天处理期内受试者报告的反射性个别鼻部症状(am、pm以及am和pm的平均值)相较于基线的变化。
[0672]
●
在14-天处理期内受试者报告的瞬时个别鼻部症状(am、pm以及am和pm的平均值)相较于基线的变化。
[0673]
●
每天平均am和pm受试者报告的rtnss和itnss相较于基线的变化。
[0674]
●
每天am受试者报告的rtnss和itnss相较于基线的变化。
[0675]
●
每天pm受试者报告的rtnss和itnss相较于基线的变化。
[0676]
眼部症状:
[0677]
●
在14-天处理期内平均am和pm受试者报告的瞬时总眼部症状得分(itoss)相较于基线的变化。
[0678]
●
在14-天处理期内am受试者报告的rtoss相较于基线的变化。
[0679]
●
在14-天处理期内am受试者报告的itoss相较于基线的变化。
[0680]
●
在14-天处理期内pm受试者报告的rtoss相较于基线的变化。
[0681]
●
在14-天处理期内pm受试者报告的itoss相较于基线的变化。
[0682]
●
在14-天处理期内受试者报告的反射性个别眼部症状(am、pm以及am和pm的平均值)相较于基线的变化。
[0683]
●
在14-天处理期内受试者报告的瞬时个别眼部症状(am、pm以及am和pm的平均值)相较于基线的变化。
[0684]
●
每天am和pm受试者报告的rtoss和itoss的平均值相较于基线的变化。
[0685]
●
每天am受试者报告的rtoss和itoss相较于基线的变化。
[0686]
●
每天pm受试者报告的rtoss和itoss相较于基线的变化。
[0687]
将以类似于以上眼部症状的方式评估非鼻部症状(如统计分析计划[sap]中所描述)。
[0688]
医师评估的鼻部症状得分(pnss):
[0689]
●
第15天(访问4)时的pnss和医师评估的个别鼻部症状相较于基线的变化。
[0690]
儿科鼻结膜炎生活质量问卷(prqlq):
[0691]
●
第15天的prqlq的个别维度相较于基线的变化。
[0692]
虽然本文中已参考特定实施方案描述了本发明,但应了解这些实施方案仅说明本发明的原理和应用。因此,应了解,可对说明性实施方案作出许多修改,并且可在不背离如所描述的本发明精神和范围的情况下设计其他布置。
[0693]
本技术中引用的所有出版物、专利和专利申请以引用的方式并入本文中,所达到的程度如同指示每个个别出版物、专利或专利申请具体地并且个别地以引用的方式并入本文中一样。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。