1.本技术涉及硼中子俘获治疗领域,特别地,涉及一种硼中子俘获治疗方法和装置。
背景技术:
2.众所周知,癌症已成为威胁人类生命健康的头号杀手。放射治疗作为一种局部、无创的治疗方式,其优异的治疗效果已在临床上得到验证,目前已成为癌症治疗的三大手段之一。放射治疗中的光子治疗虽然是目前最为成熟的放射治疗技术,但受限于光子的能量沉积方式,必然会对靶区内的危及器官产生剂量沉积,增加了辐射二次癌风险。因此,新型的放疗技术需被进一步的研究。
3.硼中子俘获治疗(boron neutron capture therapy,bnct)技术是新兴的精准放射治疗技术之一,其利用外照射中子束与富集于肿瘤区的含硼靶向药物作用,通过10b(n,α)7li反应产生的高传能线密度重离子α、7li,在细胞尺度内选择性杀死癌细胞,而对未摄取含硼药物的正常细胞的损伤控制在较低的水平,是一种具有精准靶向制导、高生物效应与短疗程优势的多粒子协同放疗技术。对大范围弥散性恶性肿瘤、放疗复发性肿瘤,如原发性脑肿瘤、复发性头颈部肿瘤及腺癌肝转移等传统放疗效果较差的癌症具有特殊治疗优势,有望成为传统治疗技术的有利补充,实现癌症治疗全覆盖。
4.目前硼中子俘获治疗需要首先利用计算机断层扫描图像,依据mri或pet图像或离线硼浓度测量方法提供的硼浓度信息以及ct提供的解剖结构信息来进行辐射剂量计算。
5.现有的常规放射治疗考虑治疗过程中解剖误差,常采用图像引导技术实现精准放射治疗。常用得有锥形束ct图像引导、在线ct引导、mri引导等。其相比锥形束ct(cbct),mri具有难以比拟的优势,如:优越的软组织对比、无额外的剂量辐射、多序列的生物功能影像等。
6.虽然mri图像引导相比ct图像引导更为安全有效,但是这仅对于光子治疗,mri图像应用于硼中子俘获治疗目前并没研究。
技术实现要素:
7.针对现有技术的不足,本发明提供一种新型硼中子俘获治疗方法,包括:s1,获得多个病人mri初始扫描图像及对应的ct初始扫描图像;s2,搭建神经网络,利用多个上述mri初始扫描图像和对应的ct初始扫描图像对上述神经网络进行训练和验证,得到训练后的神经网络,其中上述训练后的神经网络能够根据mri初始扫描图像输出对应的伪ct图像,且上述伪ct图像与上述ct初始扫描图像的相似度在限定误差范围内;s3,利用上述伪ct图像,完成靶区及危及器官的勾画,拟定中子束流相对位置,计算得到放射剂量,实施硼中子俘获治疗。
8.进一步地,搭建并训练神经网络为:选用基于卷积神经网络的人工智能网络,搭建神经网络;在上述神经网络中引入注意力机制,且上述神经网络中包含注意力权重和卷积网络参数,在输出每个上述伪ct图像时,利用上述注意力机制计算对应的上述注意力权重,
选取上述限定误差范围最小时的注意力权重和对应的上述卷积网络参数形成上述训练好的神经网络。
9.进一步地,计算上述注意力权重,并输出上述伪ct图像的方法为:上述注意力机制包括通道注意力机制,上述mri初始扫描图像包括初始特征f;上述通道注意力机制通过全局平均池化和最大池化方法将三维上述mri初始扫描图像处理为两个一维通道图像,再分别经过多层感知机mlp得到两个输出特征,两个上述输出特征相加后经过激活函数σ得到上述注意力权重系数vc,上述注意力权重系数vc与上述初始特征f的乘积即为上述伪ct图像;
10.vc(f)=σ(mlp(avgpool(f)) mlp(maxpool(f)))
11.式中max pool和avg pool分别为最大池化以及平均值池化操作,mlp为多层感知机,σ为激活函数,vc为注意力权重系数。
12.进一步地,计算上述注意力权重,并输出上述伪ct图像的方法为:上述注意力机制包括空间注意力机制,上述mri初始扫描图像包括初始特征f;上述空间注意力机制通过一个通道维度的平均池化和最大池化方法将三维上述mri初始扫描图像处理为两个二维通道图像,将两个上述二维通道图像按照通道拼接在一起,经过激活函数σ获得注意力权重系数vs,上述注意力权重系数vs与初始特征f的乘积为上述伪ct图像;
[0013]vs
(f)=σ(f([avgpool(f),maxpool(f)]))
[0014]
式中max pool和avg pool分别为最大池化以及平均值池化操作,mlp为多层感知机,σ为激活函数,vs为注意力权重系数。
[0015]
进一步地,选取上述限定误差范围最小时的注意力权重的方法为:计算上述伪ct图像和上述初始ct图像的相似度的平均绝对误差或均方误差,选取上述平均绝对误差或均方误差最小时的权重,设置为上述神经网络中的权重值。
[0016]
进一步地,上述mri初始扫描图像中包括硼浓度分布信息,结合上述硼浓度分布信息,利用蒙特卡罗程序,计算上述放射剂量。
[0017]
进一步地,还包括:利用最大类方差法将上述mri初始扫描图像,按照图像的灰度特性,分成背景和前景两部分,选取前景部分的mri输入图像,利用刚性迭代配准,将上述前景部分的mri初始扫描图像与对应的同一病人的ct的初始扫描图像进行刚性配准,得到配准后的mri输入图像为输入上述神经网络的mri初始图像。
[0018]
进一步地,上述刚性配准的方法为:利用simpleitk工具包执行上述刚性迭代配准,其中设置直方图分类数为50,抽样百分比为1%,插值器选用sitklinear。
[0019]
本技术还涉及一种离线硼中子俘获治疗的装置,包括:mri扫描仪,对病人病灶部位进行mri扫描成像;治疗床,承担病人并在上述mri扫描仪或粒子加速器内滑动;处理器,根据上述mri扫描成像,实施如上任一上述方法,输出伪ct图像,计算硼中子辐射剂量,发送指令至粒子加速器;粒子加速器,接收上述指令,并发射硼中子至上述病灶部位进行硼中子俘获治疗。
[0020]
本技术还涉及一种在线硼中子俘获治疗的装置,包括:mri-粒子加速器一体机,对病人病灶部位进行mri扫描成像,并输出硼浓度分布和解剖结构信息,并在接收指令后发射射束进行治疗;治疗床,承担病人并在上述mri-粒子加速器一体机内滑动;处理器,根据上述mri扫描成像,实施如上任一方法,输出伪ct图像,计算硼中子辐射剂量,根据上述硼浓度分布解剖结构信息和上述辐射剂量,拟定治疗计划,发送指令至上述mri-粒子加速器一体
机。
[0021]
本技术的方法,利用磁共振影像mri获取解剖图像后,再通过深度学习技术实现mri图像到ct图像的转换。在结合利用mri或者pet或者其他硼浓度测量方法获取的硼浓度数据计算得到bnct辐照剂量,并用于后续硼中子俘获治疗。将解决硼浓度分布与ct图像配准不准确的问题,实现简化治疗流程的同时,大大提高剂量计算的精度。
[0022]
且mri可以获取ct/cbct难以比拟的优势,如:优越的软组织对比,无骨伪影;无额外的剂量辐射;3d数据,任意方位的断层;多序列的生物功能影像;无需体表标记物等。进一步地,mri图像的高熵表明存在mri图像到ct图像的满射变换。
[0023]
在此方法基础上,本技术还公开了一种硼中子俘获治疗的装置,包括:mri-粒子加速器一体机,对病人病灶部位进行mri扫描成像,并输出硼浓度分布解剖结构信息,并在接收指令后发射射束进行治疗;治疗床,承担病人并在上述mri-粒子加速器一体机内滑动;处理器,根据上述mri扫描成像,实施如上任一方法,输出伪ct图像,计算硼中子辐射剂量,根据上述硼浓度分布解剖结构信息和上述辐射剂量,拟定治疗计划,发送指令至上述粒子加速器一体机;
[0024]
本技术还涉及一种硼中子俘获治疗的装置,包括:mri扫描仪,对病人病灶部位进行mri扫描成像;治疗床,承担病人并在上述mri扫描仪或粒子加速器内滑动;处理器,根据上述mri扫描成像,实施如上任一方法,输出伪ct图像,计算硼中子辐射剂量,发送指令至粒子加速器;粒子加速器,接收上述指令,并发射硼中子至上述病灶部位进行硼中子俘获治疗;
[0025]
通过深度学习将mri用于引导硼中子俘获治疗bnct的优点总结如下:1)在治疗前可以利用深度学习网络获得对应体素的ct值,无需ct扫描便可以实现放疗前的计划设计和剂量计算;2)mri可以与加速器相结合可以在放疗过程中实现实时定位;3)mri有非常软组织分辨率;4)mri不会带来额外的辐射;5)mri不会引入金属伪影;6)对于bnct而言mri图像可以获取硼浓度信息。
[0026]
本发明的附加方面和优点将在下面的描述中部分给出,部分将从下面的描述中变得明显,或通过本发明的实践了解到。
附图说明
[0027]
图1为本技术硼中子俘获治疗方法的流程图。
[0028]
图2为本技术硼中子俘获治疗方法的示意图。
[0029]
图3示出了利用卷积神经网络的人工智能网络处理mri初始图像为伪ct图像的示意图。
[0030]
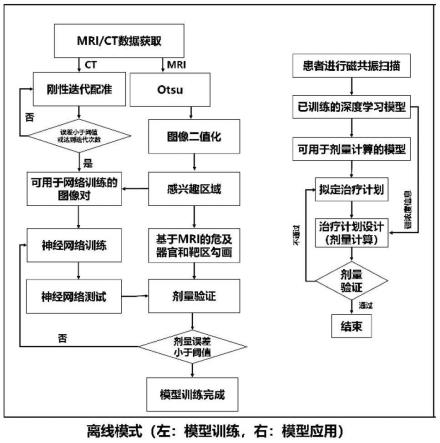
图4示出了本技术离线模式硼中子俘获治疗方法的示意图。
[0031]
图5示出了本技术在线模式硼中子俘获治疗方法的示意图。
具体实施方式
[0032]
以下结合附图和实施例,对本发明的具体实施方式进行更加详细的说明,以便能够更好地理解本发明的方案以及其各个方面的优点。然而,以下描述的具体实施方式和实施例仅是说明的目的,而不是对本发明的限制。
[0033]
在本发明的描述中,需要理解的是,术语"中心"、"纵向"、"横向"、"长度"、"宽度"、"厚度"、"上"、"下"、"前"、"后"、"左"、"右"、"坚直"、"水平"、"顶"、"底"、"内"、"外"、"顺时针"、"逆时针"等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对本发明的限制。此外,术语"第一"、"第二"仅用于描述目的,而不能理解为指示或暗示相对重要性或者隐含指明所指示的技术特征的数量。由此,限定有"第一"、"第二"的特征可以明示或者隐含地包括一个或者更多个所述特征。在本发明的描述中,"多个"的含义是两个或两个以上,除非另有明确具体的限定。
[0034]
在本发明的描述中,需要说明的是,除非另有明确的规定和限定,术语"安装"、"相连"、"连接"应做广义理解,例如,可以是固定连接,也可以是可拆卸连接,或一体地连接:可以是机械连接,也可以是电连接或可以相互通讯;可以是直接相连,也可以通过中间媒介间接相连,可以是两个元件内部的连通或两个元件的相互作用关系。对于本领域的普通技术人员而言,可以根据具体情况理解上述术语在本发明中的具体含义。
[0035]
下文的公开提供了许多不同的实施方式或例子用来实现本发明的不同结构。为了简化本发明的公开,下文中对特定例子的部件和设置进行描述。当然,它们仅仅为示例,并且目的不在于限制本发明。此外,本发明可以在不同例子中重复参考数字和/或参考字母,这种重复是为了简化和清楚的目的,其本身不指示所讨论各种实施方式和/或设置之间的关系。此外,本发明提供了的各种特定的工艺和材料的例子,但是本领域普通技术人员可以意识到其他工艺的应用和/或其他材料的使用。
[0036]
图1为本技术基于神经网络的硼中子俘获治疗方法的流程图。
[0037]
如图1所示,本技术中基于神经网络的硼中子俘获治疗方法主要通过以下步骤:
[0038]
步骤s1,获得多个病人mri初始扫描图像及对应的ct初始扫描图像。将所有mri初始图像与对应的ct初始扫描图像以图像对的形式一一保存,供后续神经网络训练验证使用。将所有图像分为三个部分,分别作为mri-ct神经网络的训练样本、验证样本及测试样本。
[0039]
进一步地,在s1步骤后,对获得地mri初始扫描图像可进行进一步处理:
[0040]
1)利用最大类方差法将所述mri初始扫描图像,按照图像的灰度特性,分成背景和前景两部分,选取前景部分的mri输入图像。本实施例中地最大类方差法选择otsu算法,也称为最大类间方差法(大津算法),用该阈值对mri图像进行固定阈值二值化,类间方差最大,按图像的灰度特性,将图像分成背景和前景两部分,使类间方差最大的分割意味着错分概率最小。选取前景部分为感兴趣区域。
[0041]
对选取的前景部分还可进一步处理。
[0042]
2)利用刚性迭代配准,将前景部分的mri初始扫描图像与对应的同一病人的ct的初始扫描图像进行刚性配准,得到配准后的mri输入图像为输入所述神经网络的mri初始图像利用刚性迭代配准,完成同一病人mri和ct数据刚性配准:
[0043]
本技术选用simpleitk工具包执行mri与ct图像的刚性迭代配准,设置直方图分类数为50,抽样百分比为1%。插值器选用sitklinear。
[0044]
步骤s2,搭建神经网络,利用多个mri初始扫描图像和对应的ct初始扫描图像对神经网络进行训练和验证,得到训练后的神经网络,其中训练后的神经网络能够根据mri初始
扫描图像获得对应的伪ct图像,且伪ct图像与ct初始图像的相似度在限定误差范围内。
[0045]
步骤s2中首先包括步骤s21搭建神经网络:
[0046]
在这一过程中,搭建神经网络可采用如下方法。使用的人工智能算法采用的框架为deeplearntoolbox、caffe、cntk、tensorflow、theano、torch、keras、lasagne、dsstne、mxnet、deeplearning4j、convnetjs、chainer、scikit-learn、matlab中的一种或多种,人工智能网络模型可采用深度置信网络、深度神经网络、卷积神经网络、堆叠式自动编码器或卷积自动编码器中的一种或几种。
[0047]
本技术选用的基于卷积神经网络的人工智能网络,且在该神经网络中引入注意力机制。即本技术采用带有自注意力机制的unet人工智能网络(sarunet)。将病人的mri样本带入人工智能网络框架sarunet中进行训练,以获取伪ct图像。
[0048]
步骤s2中首先还包括步骤s22训练神经网络:
[0049]
神经网络包含约18m待训练参数(包含注意力权重和其他卷积网络参数),利用随机梯度下降方法进行网络训练。选取上述伪ct图像与ct初始图像误差(mae)在限定范围最小时的注意力权重和其他卷积网络参数,此参数下的神经网络即为训练好的网络。
[0050]
更为详细地,注意力机制(attention mechanism)是在机器学习模型中嵌入的一种特殊结构,用来自动学习和计算输入数据对输出数据的贡献大小。注意力机制通过对编码器所有时间步的隐藏状态做加权平均来得到权重。解码器在每一时间步调整这些权重,即注意力权重,从而能够在不同时间步分别关注输入序列中的不同部分。
[0051]
本方法将注意力机制引入unet人工神经网络(即sarunet)以用于mri-ct图像转换。如图2和图3,图2为本技术硼中子俘获治疗方法的示意图,图3示出了利用卷积神经网络的人工智能网络处理mri初始图像为伪ct图像的示意图。将多组mri和ct初始扫描图像不断对sarunet神经网络进行训练。通过注意力机制计算注意力权重,并输出伪ct图像的方法主要有以下两种:通道注意力机制以及空间注意力机制。
[0052]
通道注意力机制:采用全局平均池化和最大池化两种方式来分别利用高层和底层信息。当输入是一个h
×w×
c的特征图,首先分别经过一个空间的全局平均池化和最大池化得到两个1
×1×
c的通道图像。接着,将它们分别送入多层感知机。然后,再将得到的两个输出特征相加后经过一个sigmoid激活函数σ得到权重系数。最后,拿权重系数vc和原来的特征f相乘即可得到缩放后的新特征图。
[0053]
vc(f)=σ(mlp(avgpool(f)) mlp(maxpool(f)))
[0054]
式中max pool和avg pool分别为最大池化以及平均值池化操作,mlp为多层感知机,σ为激活函数,vc为注意力权重系数,f为初始特征。
[0055]
空间注意力机制:与通道注意力相似,给定一个三维h
×w×
c的特征图,先分别进行一个通道维度的平均池化和最大池化得到两个二维h
×w×
1的图像,并将这两个图像按照通道拼接在一起。然后,经过一个激活函数σ获得权重系数vs。最后,拿权重系数vs和初始特征图f相乘即可得到缩放后的新特征。
[0056]vs
(f)=σ(f([avgpool(f),maxpool(f)]))
[0057]
式中max pool和avg pool分别为最大池化以及平均值池化操作,mlp为多层感知机,σ为激活函数,vs为注意力权重系数。
[0058]
步骤s2中首先还包括步骤s23选取权重值:
[0059]
计算输出的伪ct图像和初始的作为对比用的ct扫描图像的误差(mae,平均绝对误差或mse,均方差),其之间的平均绝对误差或均方差,选取平均绝对误差或均方误差最小时的权重,设置为该神经网络中的权重值。
[0060]
计算平均绝对误差或均方误差的方法如下,利用之前获得的验证集数据,分析由人工智能网络预测得到的伪ct图与真实的ct初始扫描图像之间的相似度,重点分析平均绝对误差(mae)和平均误差(me)两个参数。通过对比训练集误差,以及验证集误差,判断网络是否产生过拟合(训练集误差持续降低而验证集误差保持不变或上升),如果已产生较为明显的过拟合或网络已达到预定训练批次,则停止网络训练,选择在验证集上平均绝对误差(mae)最小的批次的权重和对应的其他卷积网络参数作为已训练网络的参数设置。
[0061]
mae(mean absolute error)其定义为误差绝对值的平均值,公式如下,其中yi为伪ct图像,为真实ct图像:
[0062][0063]
它可以表示伪ct图像与真实ct图像之间的平均距离。
[0064]
均方误差(root mean square error)的定义,假设ct图像大小是m*n,针对每个像素求出误差的平方和并求均值再开方,其中yi为伪ct图像,为真实ct图像:
[0065][0066]
综合来说,神经网络的训练过程可以表述为如下:sarunet是一种基于卷积网络的人工智能网络,主要可以实现图像到图像的预测。例如,通过向sarunet输入病人脑部的t1加权mri图像,sarunet依据该图像生成一张预测的伪ct图像。训练过程中的损失函数为真实ct图像与伪ct图像的l1范数。随着训练次数的增加,利用梯度下降法进行网络参数的更新。sarunet生成的伪ct图与真实ct图越来越接近,当达到训练批次或满足误差要求后可认为网络训练已完成。
[0067]
其中损失函数是将随机事件或其有关随机变量的取值映射为非负实数以表示该随机事件的“风险”或“损失”的函数,通常作为学习准则与优化问题相联系,即通过最小化损失函数求解和评估模型。l1损失函数:也被称为最小绝对值偏差(lad),绝对值损失函数(lae)。总的说来,它是把目标值与估计值的绝对差值的总和最小化。本方法选用l1误差(mae)作为损失函数,从而进行网络优化。
[0068][0069]
式中,l为范数误差,yi为真实ct图像,f(xi)为伪ct图像,xi为神经网络的输入,f()函数代表神经网络所映射的函数。
[0070]
s3,利用s2的训练好的神经网络预测得到基于任意病人mri图像的伪ct图像,完成靶区及危及器官的勾画,拟定中子束流的相对位置,计算放射剂量,实施硼中子俘获治疗。
[0071]
详细来说,利用已经训练好的神经网络,进行mri-ct的图像转换,进行病人硼中子俘获治疗的方法如图4,本技术基于神经网络的离线硼中子俘获治疗方法的示意图:
[0072]
p1,将治疗床上的病人利用mri扫描仪进行mri扫描,获得其中的硼浓度分布解剖
结构信息;
[0073]
p2,利用上述s1,s2步骤已完成训练的深度学习模型,实现mri到可用于剂量计算模型的快速转换;
[0074]
p3,利用步骤p1中获取的mri图像序列,由专业放疗物理师完成患者的靶区及危及器官勾画;
[0075]
p4,利用病人病灶的先验信息拟定放射源或中子束流相对位置。
[0076]
p5,利用步骤p2中获取的可用于剂量计算模型,结合步骤p4中拟定的放射源或中子束流的相对位置,根据硼浓度分布解剖结构信息和源位置通过蒙特卡罗算法实现剂量计算,拟定治疗计划,再实施实际的bnct治疗。
[0077]
蒙特卡罗方法又叫随机抽样法或统计实验法,属于计算数学的一个分支,可以真实地模拟实际粒子输运的物理过程,解决实际问题。可选地,使用蒙特卡罗程序基于患者的ct图像与不同组织的材料组成对其模型进行构建,并确定其对不同粒子的响应。蒙特卡罗程序是基于蒙特卡罗方法的用于计算三维复杂几何结构中的中子、光子、电子或多粒子输运问题的通用软件包。蒙特卡罗程序可采用mcnp、geant4、topas、gate、fluka、supermc或phits中的一种或几种。使用蒙特卡罗程序模拟不同治疗方案下的能量沉积与粒子输运过程,获得不同肿瘤形状、不同肿瘤类型、不同肿瘤位置及不同硼浓度分布下靶区内的特征瞬发伽马射线产额分布图和三维剂量分布图。根据能量沉积与剂量的计算方法,根据公式(1)~(3)获得不同剂量组分信息,根据公式(4)获得总生物剂量分布。
[0078]
dose
boron
=(energy
α
energy7
li
)/m
ꢀꢀ
(1),
[0079]
dose
neutron
=energ
yproton
/m
ꢀꢀ
(2),
[0080]
dose
gamma
=energy
gamma
/m
ꢀꢀ
(3),
[0081]
dose
ree
=rbe
boron
·
dose
boron
rbe
neutron
·
dose
neutron
rbe
gamma·
dose
gamma
ꢀꢀ
(4)。
[0082]
其中,dose
boron
为硼剂量,dose
neutron
为中子剂量,dose
gamma
为伽马剂量,energy
α
为α粒子在体素内的能量沉积,energy
7li
为7li粒子在体素内的能量沉积,m为体素的质量,energy
proton
为质子在体素内的能量沉积,energy
gamma
为光子在体素内的能量沉积,dose
reb
为体素内的总生物剂量,rbe
boron
为硼剂量的相对生物效应值,对于肿瘤体素该值为3.8,对于正常组织体素其值为1.4,对于皮肤体素其值为2.5,rbe
neutron
为中子剂量的相对生物效应值,对于肿瘤体素、正常组织与皮肤组织,该值均为3.2,rbe
gamma
为伽马剂量的相对生物效应值,对于肿瘤体素、正常组织与皮肤组织,该值均为1。蒙特卡罗计算辐射剂量的方法在此不再做详细解释。
[0083]
最后,可通过步骤p5获得的剂量计算结果验证治疗剂量是否满足治疗要求(iaea);本方法实施例中利用如下的用于评估中子射束剂量表现优劣的参数:
[0084]
1.照射时间≤30min(加速器使用的质子电流为10ma
[0085]
2. 30gy可治疗深度≥7cm
[0086]
3.肿瘤最大剂量≥60gy
[0087]
4.正常脑组织最大剂量≤12.5gy
[0088]
5.皮肤最大剂量≤11gy
[0089]
若不符合上述要求1-5,则重复步骤p4-5,即调整放射源或中子束流位置,重新计算剂量等,直至治疗计划满足治疗要求。
[0090]
利用此方法,本技术公开了一种离线模式硼中子俘获治疗装置,包括:mri扫描仪,对病人病灶部位进行mri扫描成像,并输出硼浓度分布解剖结构信息;治疗床,承担病人并在mri内滑动,以调整角度供硼中子入射;处理器,根据所述mri扫描成像,实施如上述方法,输出伪ct图像,结合mri得到的硼浓度信息,计算硼中子辐射剂量,根据所述硼浓度分布解剖结构信息和所述辐射剂量,拟定治疗计划。
[0091]
另外,利用本技术提到的mri-ct图像转换技术,还可以在线进行硼中子俘获治疗,如图5所示,本技术基于神经网络的在线模式硼中子俘获治疗方法的示意图:
[0092]
p1',将治疗床上的病人利用mri-粒子加速器一体机进行mri扫描,获得其中的病人实时定位信息,结合病人的病灶信息,利用治疗床运动完成病人的定位与摆位;
[0093]
治疗床的运动方式如下,例如平躺时通过步骤p1'中获取的病人定位信息,传递至信号处理系统计算得到病灶的定位,其并不符合中子发射器的中子入射角度,通过治疗床控制器控制治疗床发生偏转或旋转等,并通过治疗床中的惯性传感器不断测量并反射角度信息至治疗床控制器,直至病灶定位信息符合中子入射角度为止。
[0094]
p2',mri-粒子加速器一体机发射硼中子,硼中子俘获治疗实施;
[0095]
治疗过程如下,mri-粒子加速器一体机,对病人病灶部位进行mri扫描成像;治疗床,承担病人并在mri-粒子加速器一体机内滑动,调整到合适的硼中子入射角度;处理器,根据mri扫描成像,实施如上述方法,输出伪ct图像,计算硼中子辐射剂量,发送指令至粒子加速器;粒子加速器,接收指令,并发射硼中子至病灶部位进行硼中子俘获治疗。
[0096]
应用上述的在线模式的硼中子俘获治疗方法,本技术还公开了一种在线模式硼中子俘获治疗装置如图5所示,包括:mri-粒子加速器一体机,对病人病灶部位进行mri扫描成像;治疗床,承担病人并在mri-粒子加速器一体机内滑动;处理器,根据mri扫描成像,实施如上述方法,输出伪ct图像,结合mri得到的硼浓度信息,计算硼中子辐射剂量,发送指令至mri-粒子加速器一体机;mri-粒子加速器一体机,接收指令,并发射硼中子至病灶部位进行硼中子俘获治疗。
[0097]
在该装置中还可包括辐射线检测装置和控制装置,辐射线检测裝置用于实时检测经中子束照射后瞬发的γ射线。同时检测装置还将实时检测步骤p1'中病人的摆位信息,若靶区偏差大于指定阈值则发送加速器停止出束指令。当然装置也包括辐射屏蔽装置等,处理器通过光缆通信在上位机和下位机中进行图像处理和中子束控制等,此为行业内常规操作,在此不一一解释。
[0098]
利用本技术中的硼中子俘获治疗的方法,避免了ct多次辐射带来的负面影响。利用深度学习网络获得的对应伪ct值,无需ct扫描便可实现放疗前的计划设计与剂量计算。且mri还可以与加速器相结合在放疗过程中实现实时定位。且bnct硼中子俘获治疗需要硼浓度信息,而mri图像可直接获得硼浓度信息,有利于俘获治疗过程进行。
[0099]
显然,上述实施例仅仅是为清楚地说明本发明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明的保护范围之中。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
