1.本发明涉及癌细胞粘附用组合物。另外,本发明涉及具有癌细胞粘附用组合物的癌细胞捕集过滤器。此外,本发明涉及使用该癌细胞捕集过滤器的癌细胞的检测方法。
背景技术:
2.以往,开展了利用各种高分子材料的医疗用材料的研究。就医疗用材料而言,由于使对生物体而言为异物的合成材料与生物体内组织、血液接触来使用,因此要求其具有生物相容性。至今为止,作为生物相容性材料,例如已开发了聚(丙烯酸2-甲氧基乙酯)(pmea)(参见专利文献1)。已知的是,该pmea由于具有被认为是通过与高分子链的相互作用而弱弱地束缚于高分子链上的水的、所谓的中间水(在差示扫描量热计测定中,在从-100℃起的升温过程中源于水的低温晶体形成的发热峰在-40℃附近被稳定地观测到的状态的水)而显示出生物相容性。
3.近年来,作为与pmea同样地在侧链上具有氧乙烯链结构、并且具有中间水的生物相容性材料,提出了作为亲水性乙烯基醚的二乙二醇单乙基单乙烯基醚(eoeove)与作为疏水性乙烯基醚的正丁基乙烯基醚的共聚物(参见专利文献2)。但是,已表明了该共聚物的癌细胞粘附性极小。
4.另一方面,目前,为了进行癌细胞的检测,需要为具有生物相容性的高分子材料、并且具有癌细胞粘附性的材料。
5.现有技术文献
6.专利文献
7.专利文献1:日本特开2004-161954号公报
8.专利文献2:国际公开第2017/150000号
技术实现要素:
9.发明所要解决的课题
10.因此,本发明的目的在于提供具有生物相容性、并且具有癌细胞粘附性的高分子材料。另外,本发明的目的在于提供使用具有癌细胞粘附性的高分子材料的癌细胞捕集过滤器、癌细胞的检测方法。
11.用于解决课题的手段
12.本技术的发明人为了解决上述课题而进行了深入研究,结果发现,含有来源于并非二乙二醇单乙基单乙烯基醚(eoeove)的特定亲水性乙烯基醚的特定重复单元(a)和来源于特定的疏水性乙烯基醚的重复单元(b)的共聚物具有生物相容性,并且具有癌细胞粘附性,从而完成了本发明。
13.即,根据本发明,提供了以下的发明。
14.[1]癌细胞粘附用组合物,其包含生物相容性共聚物,所述生物相容性共聚物含有
至少1种由下述式(1)表示的重复单元(a)、和至少1种由下述式(2)表示的重复单元(b)。
[0015]
[化学式1]
[0016][0017]
(式中,r1表示甲基或乙基)
[0018]
[化学式2]
[0019][0020]
(式中,r2表示脂肪族烃基)
[0021]
[2]如[1]所述的癌细胞粘附用组合物,其中,前述生物相容性共聚物为由前述重复单元(a)形成的链段a、与由重复单元(b)形成的链段b的无规共聚物。
[0022]
[3]如[1]或[2]所述的癌细胞粘附用组合物,其中,前述生物相容性共聚物的、前述重复单元(a)与重复单元(b)的组成比(摩尔比)为90:10~10:90。
[0023]
[4]如[1]~[3]中任一项所述的癌细胞粘附用组合物,其中,前述生物相容性共聚物的前述重复单元(b)中的r2为碳原子数2~10的直链状或支链状的烷基或烯基、或者碳原子数3~20的单环状或多环状的烷基或烯基。
[0024]
[5]如[1]~[3]中任一项所述的癌细胞粘附用组合物,其中,前述生物相容性共聚物的前述重复单元(b)中的r2为碳原子数2~10的直链状或支链状的烷基。
[0025]
[6]如[1]~[5]中任一项所述的癌细胞粘附用组合物,其中,前述生物相容性共聚物的重均分子量(mw)与数均分子量(mn)之比为1.0~3.0。
[0026]
[7]如[1]~[6]中任一项所述的癌细胞粘附用组合物,其中,前述生物相容性共聚物的数均分子量(mn)为3,000~30,000。
[0027]
[8]癌细胞捕集过滤器,其在表面的至少一部分具有[1]~[7]中任一项所述的癌细胞粘附用组合物。
[0028]
[9]癌细胞的检测方法,其包括使用[8]所述的癌细胞捕集过滤器对血液进行过滤的工序。
[0029]
[10]如[9]所述的癌细胞的检测方法,其中,前述癌细胞的检测方法还包括对过滤工序中被捕集的癌细胞进行培养的工序。
[0030]
发明效果
[0031]
根据本发明,能够提供具有生物相容性、并且具有癌细胞粘附性的高分子材料。另外,根据本发明,能够提供使用具有癌细胞粘附性的高分子材料的癌细胞捕集过滤器、癌细胞的检测方法。
具体实施方式
[0032]
<癌细胞粘附用组合物>
[0033]
基于本发明的癌细胞粘附用组合物包含生物相容性共聚物,所述生物相容性共聚物含有至少1种重复单元(a)、和至少1种重复单元(b)。
[0034]
(生物相容性共聚物)
[0035]
本发明中的生物相容性共聚物含有至少1种由下述式(1)表示的重复单元(a)、和至少1种由下述式(2)表示的重复单元(b)。
[0036]
[化学式3]
[0037][0038]
(式中,r1表示甲基或乙基)
[0039]
[化学式4]
[0040][0041]
(式中,r2表示脂肪族烃基)
[0042]
作为提供前述式(1)的重复单元(a)的单体,可举出由下述式(3)表示的亲水性乙烯基醚。
[0043]
[化学式5]
[0044]
ch2=ch-o-ch
2-ch
2-o-r1ꢀꢀꢀ
(3)
[0045]
(式中,r1与式(1)中的r1同样。)
[0046]
更具体而言,作为由式(3)表示的亲水性乙烯基醚,可举出2-甲氧基乙基乙烯基醚(move)及2-乙氧基乙基乙烯基醚(eove)。这些之中,从癌细胞粘附性更优异的方面考虑,优选为move。
[0047]
另外,作为提供重复单元(b)的单体,可举出由下述式(4)表示的疏水性乙烯基醚。
[0048]
[化学式6]
[0049]
ch2=ch-or2ꢀꢀ
(4)
[0050]
(式中,r2与式(2)中的r2同样。)
[0051]
此处,r2为脂肪族烃基,具体而言,为直链状或支链状的烷基或烯基、或者单环状或多环状的烷基或烯基。
[0052]
上述的直链状或支链状的烷基或烯基优选碳原子数为2~10,更优选碳原子数为3~8,进一步优选碳原子数为4~6。
[0053]
作为直链状或支链状的烷基或烯基的具体例,可举出例如乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、1-戊基、2-戊基、3-戊基、1-(2-甲基)-丁基、2-(2-甲基)-丁基、1-(3-甲基)-丁基、2-(3-甲基)-丁基、(2,2-二甲基)-丙基、1-己基、2-己基、3-己基、1-庚基、2-庚基、3-庚基、4-庚基、1-辛基、1-(2-乙基)-己基等直链状或支链状的烷基;乙烯基、1-丙烯基、烯丙基、2-丁烯基、3-丁烯基、异丙烯基、异丁烯基、1-戊烯基、2-戊烯基、3-戊烯基、4-戊烯基、1-己烯基、2-己烯基、3-己烯基、4-己烯基、5-己烯基等直链状或支链状的烯基。
[0054]
另外,单环状或多环状的烷基或烯基优选碳原子数为3~20,更优选碳原子数为4~15,进一步优选碳原子数为5~12。
[0055]
作为单环状或多环状的烷基或烯基的具体例,可举出例如环戊基、环戊基甲基、甲
基环戊基、二甲基环戊基、环己基、环己基甲基、甲基环己基、二甲基环己基、环己烯基、环庚基、环辛基、环壬基、环癸基、环十一烷基、环十二烷基、环十三烷基、环十四烷基、环十五烷基、环十八烷基、环二十烷基等单环状的烷基或烯基;双环己基、十氢萘基、降冰片基、甲基降冰片基、异冰片基、金刚烷基、三环癸基、三环癸烯基、四环十二烷基等多环状的烷基或烯基等。
[0056]
这些脂肪族烃基之中,优选为直链状或支链状的烷基。更具体而言,作为由式(4)表示的疏水性乙烯基醚,优选为正丁基乙烯基醚(nbve)及2-乙基己基乙烯基醚(ehve)。这些之中,从癌细胞粘附性更优异的方面考虑,优选为nbve。
[0057]
本发明中的生物相容性共聚物(以下,有时称为“共聚物”)中的重复单元(a)、与重复单元(b)的组成比(摩尔比)优选为在90:10~10:90的范围内,更优选在85:15~15:85的范围内,特别优选在80:20~20:80的范围内。
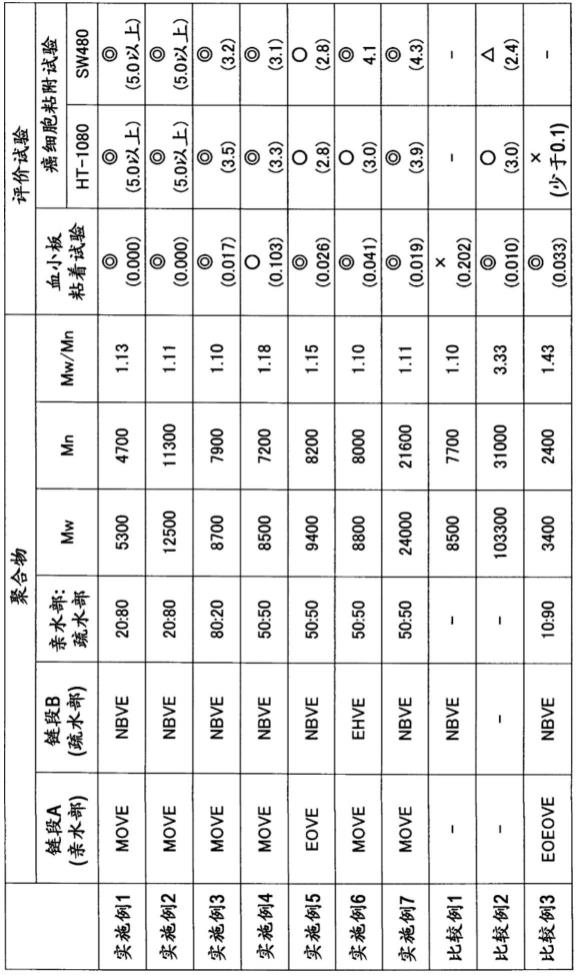
[0058]
对于本发明中的共聚物的分子量而言,例如,作为利用凝胶渗透色谱(gpc)法而由标准聚苯乙烯的标准曲线求出的数均分子量(mn),优选为1,000~100,000,更优选为2,000~50,000,进一步优选为3,000~30,000。若mn在上述范围内,则共聚物的癌细胞粘附性变得更优异。
[0059]
本发明中的共聚物的重均分子量(mw)与数均分子量(mn)之比(分子量分布,mw/mn)优选为1.0~3.0,更优选为1.0~2.0,进一步优选为1.0~1.5,进一步更优选为1.0~1.3。若分子量分布(mw/mn)在上述范围内,则共聚物的癌细胞粘附性变得更优异。
[0060]
本发明中的共聚物可以为无规共聚物及嵌段共聚物中的任意共聚物,但从癌细胞的粘附性的方面考虑,优选为包含由重复单元(a)形成的链段a和由重复单元(b)形成的链段b的无规共聚物。无规共聚物中的链段a及链段b的组成分布没有特别限定,例如,可举出接近于统计上的无规的组成的完全无规共聚物、在组成分布上具有梯度的锥状(梯度)无规共聚物。通过使共聚物为无规共聚物,从而能够不依赖于分子量而获得对癌细胞的充分粘附性。
[0061]
本发明中的共聚物可以通过按照常规方法使上述的式(3)表示的亲水性乙烯基醚、与上述的式(4)表示的疏水性乙烯基醚(4)进行聚合而制备。作为该聚合法,为了重现性良好地得到所期望的组成比及分子量的共聚物,特别优选为活性阳离子聚合。在活性阳离子聚合法中,共聚物的分子量几乎完全由单体与聚合引发剂的摩尔比决定,因此,通过改变单体和聚合引发剂的使用量,能够在广范围内任意地控制共聚物的分子量。
[0062]
在共聚物的聚合中使用的聚合引发剂只要使阳离子聚合以活性方式进行即可,没有特别限制,例如,作为乙烯基醚类的活性阳离子聚合引发剂,优选使用hi/i2系引发剂(例如,日本特开昭60-228509号公报)、将路易斯酸催化剂(有机铝化合物等)与碱等添加剂(醚等)组合而成的聚合引发剂(例如,日本专利第3096494号说明书、日本特公平7-2805号公报、日本特开昭62-257910号公报、日本特开平1-108202号公报及日本特开平1-108203号公报)等。
[0063]
相对于原料单体的总量而言,聚合引发剂的使用量优选为0.001~20摩尔%,更优选为0.01~10摩尔%,特别优选为1摩尔%以下。
[0064]
另外,活性阳离子聚合反应优选在存在适当的有机溶剂的条件下进行,但也可以在不存在适当的有机溶剂的条件下进行。作为可使用的有机溶剂,可举出例如苯、甲苯、二
甲苯等芳香族烃系溶剂;丙烷、正丁烷、异丁烷、正戊烷、异戊烷、正己烷、正庚烷、正辛烷、异辛烷、癸烷、十六烷、环己烷等脂肪族烃系溶剂;二氯甲烷、二氯乙烷、四氯化碳等卤代烃系溶剂;乙醚、二丁基醚、四氢呋喃(thf)、二噁烷、乙二醇二乙基醚等醚系溶剂。这些有机溶剂可以根据需要单独使用或者组合2种以上而使用。另外,这些有机溶剂之中,优选为芳香族烃系溶剂及脂肪族烃系溶剂等烃系溶剂,特别优选为甲苯或环己烷。
[0065]
该聚合反应中的聚合温度根据使用的聚合引发剂、单体、溶剂的种类等的不同而不同,但通常为-80~150℃,优选为-50~100℃,特别优选为-20~80℃。另外,聚合时间根据使用的聚合引发剂、单体、溶剂、反应温度等的不同而不同,但通常为10分钟~100小时左右。聚合反应可以通过间歇式、连续式中的任意方法来适宜地进行。在聚合反应后,根据需要,为了将未反应的单体除去,可以通过已知的方法来进行纯化处理。
[0066]
<癌细胞捕集过滤器>
[0067]
本发明的癌细胞捕集过滤器(以下,有时简称为“过滤器”)在表面的至少一部分具有上述的癌细胞粘附用组合物,通过利用该过滤器对血液进行过滤,能够捕集血液中的癌细胞。作为过滤器,只要是用于血液过滤的过滤器,就没有特别限定,可以使用以往已知的过滤器。过滤器在表面的至少一部分具有癌细胞粘附用组合物即可,但优选与进行过滤的血液接触的一侧的表面整体的面积的50%以上由癌细胞粘附用组合物覆盖,更优选80%以上被覆盖,进一步优选与进行过滤的血液接触的一侧的表面整体由癌细胞粘附用组合物覆盖。
[0068]
对于过滤器而言,从更高效地捕集癌细胞的方面考虑,贯通孔的平均孔径优选为5~30μm,更优选为5~15μm,进一步优选为5~10μm。
[0069]
过滤器的平均开口率优选为5~50%,更优选为10~40%,进一步优选为20~40%。此处,所谓过滤器的平均开口率,是指贯通孔的面积在过滤器整体的面积中所占的比例。
[0070]
作为使上述的癌细胞粘附用组合物保持于过滤器表面的方法,可以使用各种方法:利用癌细胞粘附用组合物涂覆过滤器的表面的方法;利用放射线、电子射线、紫外线等活性能量射线使过滤器的表面与生物相容性聚合物结合的方法;使过滤器的表面的官能团与癌细胞粘附用组合物进行反应而结合的方法;等等。使用涂覆法的情况下,作为涂覆癌细胞粘附用组合物的方法,可以使用涂布法、喷雾法、浸蘸法等中的任意方法。涂覆可通过下述方式来进行:利用浸渍法、喷雾法、旋涂法等使癌细胞粘附用组合物附着于基板表面,然后将溶剂除去(干燥)。干燥后的膜厚优选为0.01μm~1.0mm,更优选为0.1~100μm,进一步优选为0.5~50μm。若膜厚在上述范围内,则能够充分呈现癌细胞的粘附性。
[0071]
为了使癌细胞粘附用组合物更牢固地固定于基板上,可以在被覆了癌细胞粘附用组合物之后对基板加热。另外,也可以使生物相容性聚合物进行交联。作为进行交联的方法,可举出例如预先在聚合物的材料中添加交联性单体的方法。交联中可以使用电子射线、γ射线、光照射。
[0072]
过滤器的材质、形状没有特别限制,例如可以使用多孔质体、纤维、无纺布、膜、片材、管。作为基板的材质,可举出棉、麻等天然高分子、尼龙、聚酯、聚丙烯腈、聚烯烃、卤化聚烯烃、聚氨酯、聚酰胺、聚砜、聚醚砜、聚(甲基)丙烯酸酯、卤化聚烯烃乙烯-聚乙烯醇共聚物、丁二烯-丙烯腈共聚物等合成高分子或它们的混合物。另外,可举出金属、陶瓷及它们的
复合材料等,也可以由多个基板构成。
[0073]
上述金属没有特别限制,例如可以使用金、银等贵金属,铜、铝、钨、镍、铬、钛等贱金属,及这些金属的合金等。金属可以以单质的形式使用,也可以为了赋予功能性而以与其他金属的合金或金属的氧化物的形式使用。从价格、获得的容易性的观点考虑,优选使用镍、铜及以它们为主成分的金属。此处,所谓主成分,是指占形成上述基板的材料中的50重量%以上的成分。也可以使用光刻等方法在这些金属上形成贯通孔,从而制成网式过滤器。
[0074]
<癌细胞的检测方法>
[0075]
本发明的癌细胞的检测方法包括利用上述的癌细胞捕集过滤器对血液进行过滤的工序,优选还包括对过滤工序中被捕集的癌细胞进行培养的工序。以下,对各工序进行详述。
[0076]
(过滤工序)
[0077]
癌细胞的检测方法通过利用过滤器对血液进行过滤,从而能够以高回收率捕集血液中的癌细胞。作为利用过滤器对血液进行过滤的方法,可举出例如在血液循环的流路中设置过滤器,从而对血液进行过滤的方法。在这样的方法中,蓄积于骨髓、脾脏、肝脏等中的血液、脐带血等血液、以及淋巴、组织液等也可以用作试样,但使用在体内循环的外周血是最简便的。对外周血中的血中循环癌细胞(以下,称为“ctc”))的存在进行检测是判断癌的病情发展的有用手段。
[0078]
利用上述在血液循环的流路中设置过滤器从而对血液进行过滤的方法来检测癌细胞的存在的情况下,例如可以通过下述方式来实施:将过滤器装配到流路内,向流路中导入外周血,由此捕集包含ctc的细胞,确认在被捕集的细胞中是否存在ctc。对于血液向流路中的导入,可以例示下述方法:采用从流路的入口方向的加压的方法;采用从流路的出口方向的减压的方法;使用蠕动泵的方法;等等。另外,对于使用的过滤器的面积而言,例如在由1ml的血液浓缩ctc的情况下,1~10cm2是适合的。
[0079]
在通过上述方法对ctc进行了捕集的情况下,不仅ctc,白细胞等血细胞也同时被捕集。因此,需要确认所回收的细胞中是否包含癌细胞。例如,在通过上述的方法对ctc进行了捕集之后,可以利用经荧光标记的针对癌标志物的抗体进行染色,从而确认其为癌细胞。作为针对癌标志物的抗体,可以例示抗epcam抗体等。
[0080]
另外,也可以通过对由上述方法捕集的细胞的基因进行分析,从而确认其为癌细胞。例如,可以对p53、k-ras、h-ras、n-ras、braf、apc等基因中的突变进行分析,从而确认其为癌细胞。另外,这些基因分析的结果也可以用于随后的患者的治疗方针的确定等。或者,也可以通过对由上述方法捕集到的细胞的端粒酶活性等进行测定,从而确认其为癌细胞。
[0081]
(培养工序)
[0082]
癌细胞的检测方法通过还包括对癌细胞进行培养的工序,从而也可进行微量的癌细胞的检测。对癌细胞进行培养的方法没有特别限制,可以使用通常用于培养细胞的方法。
[0083]
实施例
[0084]
接下来,举出实施例及比较例来更详细地说明本发明,但本发明不受这些实施例等的任何制约。
[0085]
需要说明的是,在实施例中,分别地,共聚物的组成比由1h nmr的分析结果求出,重均分子量(mw)、数均分子量(mn)及分子量分布(mw/mn)由gpc的分子量分析结果(按聚苯
乙烯换算)求出。分析装置及测定条件等如下所述。
[0086]
(nmr的测定条件)
[0087]
·
装置:jeol制,型号:al-400
[0088]
·
溶剂:氘代氯仿
[0089]
·
测定温度:30℃
[0090]
(gpc的测定条件)
[0091]
·
装置:东曹株式会社制,“hlc-8320gpc”[0092]
·
检测器:ri检测器
[0093]
·
流动相:四氢呋喃
[0094]
·
流量:1ml/分钟
[0095]
·
色谱柱:昭和电工株式会社制“shodex lf-804
”×
3根
[0096]
·
柱温:40℃
[0097]
[实施例1]
[0098]
2-甲氧基乙基乙烯基醚/正丁基乙烯基醚无规共聚物(move-ran-nbve)的合成a
[0099]
在干燥氮气氛下,向于300℃以上进行了10分钟加热脱水的带有三通旋塞阀的舒伦克管中,加入作为溶剂的甲苯76.0ml、作为添加碱的乙酸乙酯32.6ml、作为亲水性乙烯基醚的2-甲氧基乙基乙烯基醚(move)2.3ml、作为疏水性乙烯基醚的正丁基乙烯基醚(nbve)10.3ml、作为引发种的乙酸1-异丁氧基乙酯(ibea)494.0μl,并充分搅拌。
[0100]
接着,保持于0℃,添加作为路易斯酸催化剂的et
1.5
alcl
1.5 0.93m(3.7ml)来引发聚合,进行90分钟反应。
[0101]
利用包含少量的甲醇钠(1m)的甲醇来终止聚合。向终止后的溶液中加入3g离子交换树脂(商品名:amberlyst msps2-1
·
dry,organo(株)制),进行彻夜搅拌。接着,将该溶液向硅藻土及孔径为1μm的过滤器中通液。将溶剂蒸发后,进行减压干燥,得到目标无规共聚物a。将得到的无规共聚物a的组成比、重均分子量(mw)、数均分子量(mn)及分子量分布(mw/mn)示于表1。
[0102]
[实施例2]
[0103]
2-甲氧基乙基乙烯基醚/正丁基乙烯基醚无规共聚物(move-ran-nbve)的合成b
[0104]
将ibea的添加量变更为185.0μl,除此以外,利用与实施例1同样的操作来得到无规共聚物b。将得到的无规共聚物b的组成比、重均分子量(mw)、数均分子量(mn)、及分子量分布(mw/mn)示于表1。
[0105]
[实施例3]
[0106]
2-甲氧基乙基乙烯基醚/正丁基乙烯基醚无规共聚物(move-ran-nbve)的合成c
[0107]
加入作为亲水性乙烯基醚的move 9.3ml、作为疏水性乙烯基醚的nbve 2.6ml、作为引发种的ibea 300.0μl,除此以外,利用与实施例1同样的操作来得到无规共聚物c。将得到的无规共聚物c的组成比、重均分子量(mw)、数均分子量(mn)、及分子量分布(mw/mn)示于表1。
[0108]
[实施例4]
[0109]
2-甲氧基乙基乙烯基醚/正丁基乙烯基醚无规共聚物(move-ran-nbve)的合成d
[0110]
加入作为亲水性乙烯基醚的move 5.8ml、作为疏水性乙烯基醚的nbve 6.4ml、作
为引发种的ibea 300.0μl,除此以外,利用与实施例1同样的操作来得到无规共聚物d。将得到的无规共聚物d的组成比、重均分子量(mw)、数均分子量(mn)、及分子量分布(mw/mn)示于表1。
[0111]
[实施例5]
[0112]
2-乙氧基乙基乙烯基醚/正丁基乙烯基醚无规共聚物(eove-ran-nbve)的合成e
[0113]
加入作为亲水性乙烯基醚的2-乙氧基乙基乙烯基醚(eove)7.3ml、作为疏水性乙烯基醚的nbve 6.4ml、作为引发种的ibea300.0μl,除此以外,利用与实施例1同样的操作来得到无规共聚物e。将得到的无规共聚物e的组成比、重均分子量(mw)、数均分子量(mn)、及分子量分布(mw/mn)示于表1。
[0114]
[实施例6]
[0115]
2-甲氧基乙基乙烯基醚/2-乙基己基乙烯基醚无规共聚物(move-ran-ehve)的合成f
[0116]
加入作为亲水性乙烯基醚的move5.8ml、作为疏水性乙烯基醚的2-乙基己基乙烯基醚(ehve)8.0ml、作为引发种的ibea300.0μl,除此以外,利用与实施例1同样的操作来得到无规共聚物f。将得到的无规共聚物f的组成比、重均分子量(mw)、数均分子量(mn)、及分子量分布(mw/mn)示于表1。
[0117]
[实施例7]
[0118]
2-甲氧基乙基乙烯基醚/正丁基乙烯基醚无规共聚物(move-ran-nbve)的合成g
[0119]
将ibea的添加量变更为74.0μl,除此以外,利用与实施例4同样的操作来得到无规共聚物g。将得到的无规共聚物g的组成比、重均分子量(mw)、数均分子量(mn)、及分子量分布(mw/mn)示于表1。
[0120]
[比较例1]
[0121]
聚(正丁基乙烯基醚)(pnbve)的合成h
[0122]
不添加亲水性乙烯基醚,加入作为疏水性乙烯基醚的nbve 12.9ml、作为引发种的ibea 300.0μl,除此以外,利用与实施例1同样的操作来得到均聚物h。将得到的均聚物h的重均分子量(mw)、数均分子量(mn)、及分子量分布(mw/mn)示于表1。
[0123]
[比较例2]
[0124]
聚(丙烯酸2-甲氧基乙酯)(pmea)的合成i
[0125]
将作为单体的丙烯酸2-甲氧基乙酯(mea)15.00g溶解于1,4-二噁烷60.23g中,利用氩气进行30分钟鼓泡。其后,加入2,2
’‑
偶氮二异丁腈(aibn)15.03mg作为引发种,一边进行氩气鼓泡,一边于75℃进行6小时聚合。将所生成的高分子的聚合溶液滴加至正己烷1l中,由此以沉淀物的形式回收聚合物,利用thf/正己烷体系反复实施3次沉淀操作,由此进行纯化。在沉淀操作后,与纯水接触并搅拌24小时以上,由此将溶出至水中的物质除去,其后,利用蒸发器及真空干燥(于40℃,72小时以上)来进行溶剂的除去。作为最终产物,得到均聚物i。将得到的均聚物i的重均分子量(mw)、数均分子量(mn)、及分子量分布(mw/mn)示于表1。
[0126]
[比较例3]
[0127]
二乙二醇单乙基单乙烯基醚/正丁基乙烯基醚无规共聚物(eoeove-ran-nbve)的合成j
[0128]
在干燥氮气氛下,向于300℃以上进行了10分钟加热脱水的带有三通旋塞阀的300ml三颈瓶中,加入作为溶剂的甲苯181.0ml、作为添加碱的乙酸乙酯76.4ml、作为亲水性乙烯基醚的二乙二醇单乙基单乙烯基醚(eoeove)4.0ml、作为疏水性乙烯基醚的n-丁基乙烯基醚(nbve)28.2ml、作为引发种的异丁基乙烯基醚的乙酸加成物4mm(450.0μl),并充分搅拌。
[0129]
接着,保持于0℃,添加作为路易斯酸催化剂的et
1.5
alcl
1.5 8mm(8.8ml)而引发聚合,进行90分钟反应。
[0130]
利用包含少量的甲醇钠(1m)的甲醇来终止聚合。向终止后的溶液中添加5质量%的离子交换树脂(商品名:amberlyst msps2-1
·
dry,organo(株)制),于室温进行1小时搅拌。接着,将该溶液向硅藻土及孔径为1μm的过滤器中通液。将溶剂蒸发后,进行减压干燥,得到目标无规共聚物j。将得到的无规共聚物j的组成比、重均分子量(mw)、数均分子量(mn)及分子量分布(mw/mn)示于表1。
[0131]
[评价试验]
[0132]
<血小板粘着试验>
[0133]
为了调查血液相容性,针对利用上文中合成的各聚合物a~j进行了表面被覆的聚对苯二甲酸乙二醇酯(pet)板(实施例1~7、比较例1~3),进行血小板的粘着试验。
[0134]
通过将各聚合物的1.0wt%乙醇溶液旋涂于pet板表面来进行利用各聚合物的pet板的表面被覆。
[0135]
将从美国购入的实验用人全血在实验前恢复至室温,利用离心分离机以400rcf进行5分钟离心分离。采集约0.5ml此时的上清液,将其作为富血小板血浆(platelet rich plasma;prp)。其后,进一步以2500rcf进行10分钟离心分离。采集约2ml此时的上清液,将其作为贫血小板血浆(platelet poor rich;ppp)。以接种密度成为4.0
×
107个细胞/cm2的方式将prp用ppp稀释,由此制备血小板悬浮液。在利用各聚合物进行了表面被覆的pet板及未进行被覆的pet板(空白)上,利用移液器滴加所制备的血小板悬浮液0.2ml,于37℃静置60分钟。接着,利用磷酸缓冲溶液进行冲洗,于37℃在1%戊二醛溶液中孵育120分钟,由此将所粘着的血小板固定。其后,利用磷酸缓冲生理盐水及水进行清洗,在装有硅胶的容器内进行2天以上的干燥。在干燥后,利用扫描型电子显微镜对样品表面进行观察,计测在1
×
105μm2的面积内所粘着的血小板数量。按下述基准对将粘着于未进行被覆的pet板(空白)上的血小板的数量设为1的情况下的、各实施例及比较例中的所粘着的血小板的相对数量进行评价。将评价结果示于表1。
[0136]
(评价基准)
[0137]
◎
:血小板的粘着数量少于0.1。
[0138]
○
:血小板的粘着数量为0.1以上、少于0.2。
[0139]
×
:血小板的粘着数量为0.2以上。
[0140]
<癌细胞粘附试验>
[0141]
为了调查癌细胞的粘附性,针对利用上文中合成的各聚合物a~g、i、j进行了表面被覆的聚对苯二甲酸乙二醇酯(pet)板(实施例1~7、比较例2、3)进行癌细胞的粘附试验。需要说明的是,对于聚合物h而言,由于血小板的粘着数量多,血液相容性不良,因此未进行癌细胞粘附试验。
[0142]
与上述的血小板粘着试验同样地操作,准备利用各聚合物进行了表面被覆的pet板及未进行被覆的pet板(空白)。将所准备的各pet板装入24个孔(底面积为1.9cm2)中,然后,利用移液器在各孔内的各pet板上滴加1.0ml癌细胞悬浮液(利用添加有10%的血清的培养基、以接种密度成为10,000个/cm2的方式调整),于37℃静置60分钟。作为癌细胞,使用人纤维肉瘤细胞株ht-1080及sw480。接着,使用磷酸缓冲生理盐水进行冲洗,计测粘附于样品表面上的癌细胞的数量。为了使计测容易进行,利用4%多聚甲醛将细胞固定化之后,利用4’,6-二氨基-2-苯基吲哚(dapi)对细胞核进行染色,利用经alexa fluor488标记化的鬼笔环肽对f-肌动蛋白进行染色,使用all-in-one荧光显微镜(keyence,bz-x710)来计测细胞核的数量,作为癌细胞的数量。按下述基准对将粘附于未进行被覆的pet板(空白)上的癌细胞的数量设为1的情况下的、各实施例及比较例中的所粘附的癌细胞的相对数量进行评价。将评价结果示于表1。需要说明的是,对于聚合物j而言,由于未观察到针对ht-1080的粘附性,因此未进行针对sw480的粘附试验。
[0143]
(评价基准)
[0144]
◎
:癌细胞的粘附数量多于3.0。
[0145]
○
:癌细胞的粘附数量多于2.5、为3.0以下。
[0146]
△
:癌细胞的粘附数量多于1.0、为2.5以下。
[0147]
×
:癌细胞的粘附数量为1.0以下。
[0148]
[表1]
[0149]
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。