1.本发明涉及抗肿瘤医药技术领域,具体涉及西达本胺联合西奥罗尼在抗卵巢癌中的用途。
背景技术:
2.卵巢癌是指发生在卵巢的恶性肿瘤性疾病,是女性生殖器官常见的恶性肿瘤之一,发病率仅次于子宫颈癌和子宫体癌。卵巢癌以上皮癌最多见,其次是恶性生殖细胞肿瘤,其中卵巢上皮癌死亡率占各类妇科肿瘤的首位,对女性生命可造成严重威胁。卵巢癌早期多无症状,晚期可出现下腹不适、腹胀、食欲下降等消化道症状,主要的治疗方式包括手术切除、药物治疗和放射治疗,总体预后较差。
3.西达本胺是深圳微芯生物科技股份有限公司自主研发合成的首个亚型选择性hdaci,是唯一被国家药品监督管理局(national medical products administration,nmpa)批准可用于临床试验的hdaci类药物,主要应用于复发或难治性外周t细胞淋巴瘤(peripheral t cell lymphoma,ptcl)。研究证明,西达本胺能调控肿瘤细胞多种恶性生物学行为,包括抑制肿瘤细胞增生与迁移、诱导肿瘤细胞发生凋亡等。
4.西奥罗尼是深圳微芯生物科技股份有限公司自主研发合成的靶向肿瘤微环境的新型三通路肿瘤抑制剂,主要通过抑制vegfr2、aurora b及csf1r等通路发挥抗肿瘤的作用。前期研究显示其对多种实体瘤包括非小细胞肺癌、肝癌、结肠癌和淋巴瘤等具有杀伤作用,且i期临床试验结果显示良好的耐受性及毒副作用小。
5.现有技术中并没有西达本胺联合西奥罗尼在制备预防和/或治疗卵巢癌的研究与报道。
技术实现要素:
6.本发明提供了西达本胺联合西奥罗尼在制备预防和/或治疗原发性卵巢癌的药物中的用途。
7.优选的,上述用途中,所述西达本胺的衍生物选自其可药用盐、对映异构体、晶型a和晶型b。cn201210489178.8公开了西达本胺的晶型a和晶型b,cn201410136761.x公开了西达本胺的对映异构体,它们被全文引入本发明中。
8.优选的,上述用途中,所述西奥罗尼的衍生物选自其可药用盐、非溶剂化晶型a、晶型b和晶型c。西奥罗尼的非溶剂化晶型a、晶型b和晶型c及其制备方法公开于cn201610856945.2中,其全文内容被引入本发明。
9.优选的,上述用途中,所述卵巢癌为上皮性卵巢癌或卵巢畸胎瘤。
10.优选的,上述用途中,所述西达本胺或其衍生物的单位剂量为5-100mg,优选为5-60mg;所述西奥罗尼或其衍生物的单位剂量为5-100mg,优选为10-100mg。
11.本发明还提供了一种预防和/或治疗原发性卵巢癌的方法,包括向有需要的患者施用治疗有效量的西达本胺或其衍生物和西奥罗尼或其衍生物。
12.优选的,上述方法中,所述卵巢癌为上皮性卵巢癌或卵巢畸胎瘤。
13.本发明的有益效果:
14.本发明经mts、流式细胞周期检测、凋亡/坏死荧光染色分析、parp/caspase 3活化的western blot检测等实验发现,西达本胺联合西奥罗尼可协同诱导人卵巢癌细胞coc1及人卵巢畸胎瘤细胞pa-1的周期抑制和凋亡。且在coc1裸鼠移植瘤模型上验证了西达本胺联合西奥罗尼具有协同抗肿瘤药效。通过序贯给药实验研究发现,西达本胺联合西奥罗尼对卵巢癌细胞coc1的协同药效具有合成致死的机制特点。
15.本发明西达本胺联合西奥罗尼具有显著的协同抗卵巢癌、尤其是原发性卵巢癌疗效,表现在二者联合给予能协同阻断卵巢癌细胞的细胞周期,协同诱导卵巢癌细胞的凋亡,并且在皮下接种人卵巢癌的裸鼠动物模型的药效试验中证实了所述药物组合的协同抗卵巢癌疗效。尤其地,与既往研究发现不同的,西达本胺联合西奥罗尼同时作用于卵巢癌细胞时可发挥更显著协同药效,表明所述药物组合物在卵巢癌、尤其是原发性卵巢癌中具有意想不到的协同药效机制特征。
16.本发明西达本胺或其衍生物联合西奥罗尼或其衍生物治疗卵巢癌、尤其是原发性卵巢癌具有很好的协同效应,能够很好地治疗卵巢癌、尤其是原发性卵巢癌,为卵巢癌、尤其是原发性卵巢癌的治疗提供了一种更好的选择。
附图说明
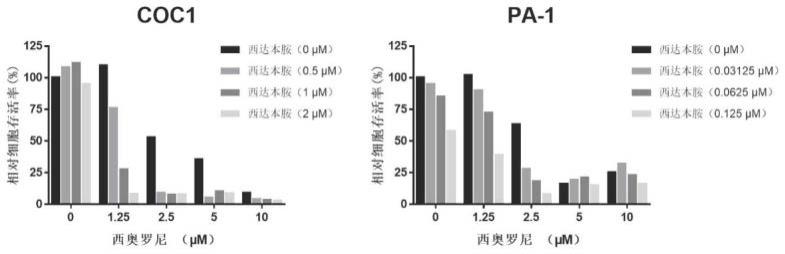
17.图1西达本胺与西奥罗尼之组合对卵巢癌细胞系coc1和pa-1的协同抑制作用;
18.图2西达本胺与西奥罗尼之组合对卵巢癌细胞系coc1细胞周期的影响;
19.图3西达本胺与西奥罗尼之组合显著诱导卵巢癌细胞系coc1的凋亡;
20.图4西达本胺与西奥罗尼之组合在卵巢癌coc1裸鼠中具有协同抗肿瘤药效;
21.图5序贯给药实验表明西达本胺与西奥罗尼同时作用于卵巢癌细胞时协同药效最显著。
具体实施方式
22.以下进一步通过非限制性实例来说明本发明,其不旨在限制本发明所涵盖的范围。
23.除非另有定义,否则本文中使用的所有技术和科学术语均具有与本领域一般技术人员通常所理解的含义相同的含义。
24.本发明经mts、流式细胞周期检测、凋亡/坏死荧光染色分析、parp/caspase 3活化的western blot检测等实验发现,西达本胺联合西奥罗尼可协同诱导人卵巢癌细胞coc1及人卵巢畸胎瘤细胞pa-1的周期抑制和凋亡。且在coc1裸鼠移植瘤模型上验证了西达本胺联合西奥罗尼具有协同抗肿瘤药效。通过序贯给药实验研究发现,西达本胺联合西奥罗尼对卵巢癌细胞coc1的协同药效具有合成致死的机制特点。
25.具体实验过程和结果如下:
26.实施例
27.1.材料和方法
28.1.1材料
29.人卵巢癌细胞系coc1购于中国典型培养物保藏中心(china center for type culture collection,cctcc)、人卵巢畸胎瘤细胞系pa-1购自美国菌种保藏中心(american type culture collection,atcc),均用含1%双抗(青链霉素,hyclone)及10%胎牛血清(gibco)的rpmi1640培养液(hyclone)培养。
30.西达本胺(chidamide)、西奥罗尼(chiauranib)均来源于深圳微芯生物科技股份有限公司。将二者分别溶于二甲基亚砜(dimethyl sulfoxide,dmso;上海生工,dn3039a)中,配置成20mm的工作母液,置于-20℃的冰箱中备用,使用时根据各项实验需要配置相应终浓度的工作溶液。
31.主要实验试剂及仪器设备
32.celltiter aqueous non-radioactive cell proliferationassay(mts)试剂盒(promega,g5421)
33.碘化丙啶(propidium iodide,pi;上海生工,a601112)
34.核糖核酸酶a(rnasea;上海生工,b500474)
35.tritonx-100(上海生工,a110694)
36.apoptosis/necrosis assay kit(blue,green,red)(abcam,英国)
37.哺乳动物蛋白抽提试剂(thermo,美国)
38.抗体:cleaved parp(asp214)(d64e10)rabbit mab(cell signaling,#5625),anti-cleaved caspase-3antibody(abcam,ab2302),β-actin antibody(ac-15)(santa cruz,sc-69879),anti-rabbit igg,hrp-linked antibody(cell signaling,#7074),hrp-conjugated goat anti-mouse igg(上海生工,d110087)
39.balb/c(nu/nu)雌性裸鼠(spf级),5周龄,体重14~18g,购自广东省实验动物中心,共40只。在ivc笼具中按spf条件饲喂,注射瘤株前饲养约1周,以使裸鼠适应新环境。
40.0.2%cmc-na助悬剂(用于制备西奥罗尼悬液并作为对照溶剂):在200ml去离子水中,分多次加入共0.4g cmc-na,边加边搅拌,然后在沸水浴上加热搅拌直至溶液澄清。冷却后离心取上清,于高温高压灭菌后加入0.2g吐温-20混匀,室温备用。
41.超净工作台(苏净安泰)
42.co2细胞培养箱(rs biotech,galaxy s)
43.倒置显微镜(广州市明美科技有限公司)
44.细胞计数板(上海求精生化试剂仪器有限公司)
45.tecan infinite f50光吸收酶标仪
46.冷冻高速离心机(eppendorf)
47.bd facscelestatm流式细胞仪
48.激光共聚焦扫描显微镜(zeiss)
49.蛋白电泳及转膜装置(bio-rad)
50.1.2实验方法
51.1.2.1 mts实验测试药物或药物组合对细胞活力的影响
52.将悬浮培养的coc1细胞及消化收集的pa-1细胞按每孔5000个/180μl接种到96孔细胞培养板中,并留出blank孔不接种细胞,只加入相同体积的培养液;5%co2、37℃培养。
53.细胞接种过夜后按图1所示的分组和终浓度剂量给药(给药后每孔最终体积均为
200μl),每个分组剂量设置3个复孔。药物处理120小时后,弃去96孔板中培养液,每孔加入100μl mts细胞活性检测试剂,其中包括89.5μl无酚红rpmi-1640、10μl mts和0.5μl pms,在未种细胞的孔中加入同样体积的mts细胞活性检测试剂作为检测背景(od
490-blk
)。37℃孵育约1小时后,通过酶标仪读取每孔490nm波长处的吸光度值。各孔读数减去od
490-blk
后获得扣除检测背景的各给药孔od
490-t
及阴性对照孔od
490-t0
。
54.各给药孔细胞的相对存活率按公式:存活率(%)=od
490-t
/od
490-t0
×
100%计算。结果见2.1。
55.1.2.2流式细胞术检测药物或药物组合对细胞周期的影响
56.将对数生长期的coc1细胞收集计数。按每孔106个细胞接种到六孔板内,各接种12孔。正常培养过夜后,将所接种细胞分为4组,分别设为溶剂对照组、西达本胺组、西奥罗尼组和联合用药组,每组设置3个重复孔,分别按如图2(a)所示终浓度加入相应化合物。继续培养48小时后收集细胞样品,每个样品以300μlpbs缓冲液充分重悬、逐滴滴入预冷的700μl无水乙醇中,随即轻柔颠倒混匀数次,使细胞分散固定。所固定样品于4℃静置12小时以上,1周内进行流式细胞分析。
57.将pbs与10mg/ml的pi储备液、10mg/ml的rnasea溶液及triton x-100按1000:5:2:1的比例混匀成为工作染液。将固定好的细胞样品于4℃、1000rpm离心10分钟,吸净上清并用pbs洗两次,按每个样品300μl重悬于上述工作染液中。37℃避光孵育30分钟后,用200目不锈钢网过滤细胞,滤液上机进行流式细胞周期分析(每个样本计数20000个细胞)。结果见2.2。
58.1.2.3凋亡/坏死荧光染色实验分析药物或药物组合对细胞死亡的诱导
59.应用apoptosis/necrosis assay kit(blue,green,red)进行测试,可直观地反映药物或药物组合作用于细胞时是否诱导细胞的死亡,该试剂盒含有apopxin green indicator、7-aminoactinomycin d(7-aad)和cytocalcein violet 450三种荧光染料。其中apopxin green indicator和7-aad均为不可透膜染料,分别可在特定波长激发光激发后发射绿色和红色荧光。细胞发生凋亡时,磷脂酰丝氨酸(phosphatidylserine,ps)被转移到质膜外侧是凋亡早、中期的标志性事件,质膜外侧的ps可被apopxin green indicator特应性识别结合;而当细胞处于凋亡晚期阶段或发生坏死时,细胞膜通透性发生改变,apopxin green indicator和7-aad可进入细胞内分别识别标记ps和细胞核。cytocalcein violet450为透膜染料,可停留在活细胞的细胞质中并被激发出蓝色荧光,在该实验中被用于活细胞的示踪。
60.按图3(a)所示剂量的药物或药物组合作用于coc1细胞,分别在24小时和48小时后收集细胞进行染色,通过激光共聚焦扫描显微镜对细胞进行观察和成像,并对不同染色细胞分别计数统计。结果见2.3。
61.1.2.4 western blot实验检测药物或药物组合对细胞凋亡的影响
62.将对数生长期的coc1细胞收集计数,按每孔106个/2ml接种到六孔细胞培养板中,培养过夜后给药,每孔分别按图3(b)所示的终浓度加入药物或药物组合,继续培养48小时。
63.药物作用48小时后,将各孔培养物分别转移至相应标记的15ml离心管中,再每孔加入1ml pbs洗涤一遍,清洗液对应转入同一离心管,4℃离心机1200rpm离心5分钟,弃去上清,细胞沉淀加入500μl pbs重悬,转移至1.5ml离心管,4℃离心机1200rpm离心5分钟,弃上
清。向细胞沉淀加入110μl 1
×
蛋白上样缓冲液,剧烈振荡混匀后置于金属浴,100℃煮沸10分钟,取出样品管冰浴冷却后待用(可于-80℃冰箱保存)。
64.将上述蛋白样品离心后取上清进行sds-page电泳,每孔上样体积40μl,电泳条件为恒压140v,50分钟;电泳结束后,在bio-rad turbo半干转印仪的电极板上铺上一层与胶大小相同并经转膜缓冲液浸透的滤纸,再铺上提前用甲醇活化好的pvdf膜,将page胶铺在膜上,赶走气泡后再铺一层与胶大小相同并经转膜缓冲液浸透的滤纸,启动装置开始转印,条件为25v,7分钟;完成转印后,将膜放在杂交袋中,加入封闭液,封口,室温下摇床摇动1小时。封闭结束取出膜放入新的杂交袋,加入按比例配置的一抗溶液,赶气泡后封口,室温下孵育1小时,用pbst洗涤4次,每次5分钟;洗涤后将膜放入二抗中室温摇床摇动孵育1小时,孵育结束之后用pbst洗涤3次,每次5分钟,最后用pbs洗涤一次,5分钟。将洗好的膜放到显影仪中,每条膜滴加200μl预混的ecl发光液,操作仪器进行影像记录。结果见2.3。
65.1.2.5在裸鼠荷瘤模型中观察药物或药物组合的体内抑瘤药效
66.将coc1细胞大量扩增培养并使细胞保持在对数生长状态。待细胞数量达到所需后收集,大量pbs充分清洗2次以彻底去除血清成分,4℃、1000rpm离心10分钟,弃上清。用不含血清和双抗且冰上预冷的rpmi1640培养液将细胞按108个/ml的密度重悬。将细胞悬液按100μl/管加入到预先分装且提前一晚于冰上冻融的100μl/管matrigel中,吸打混匀后置冰上待用。
67.在每只裸鼠近腋部背上区域的皮下进行肿瘤细胞接种,以上述每管混合物为1个接种单位,即按每只裸鼠接种一针、107个细胞。接种后每天观察接种部位肿瘤的生长情况,适时以游标卡尺测量、记录肿瘤最长径(l)及与之垂直的最宽径(w)并计算肿瘤体积(ts=l
×w×
w/2),个体荷瘤体积基本达到100mm3以上时进行随机分组并开始给药。
68.如图4所示,荷coc1裸鼠被随机分为四组,每天给药1次。每天给药前称量体重,按每千克体重计算给药剂量,即溶剂对照组按每克体重10μl的cmc-na溶液、西奥罗尼组按每克体重10μl的0.4mg/ml西奥罗尼-cmc-na悬浊液、西达本胺组按每克体重10μl的0.6mg/ml西达本胺-cmc-na悬浊液、联合用药组按每克体重10μl的0.4mg/ml西奥罗尼和0.6mg/ml西达本胺-cmc-na悬浊液进行灌胃给药。每2天测算、记录荷瘤体积。以任一组平均肿瘤体积达到2000mm3为实验终点,结束实验。结果见2.4。
69.1.2.6序贯给药实验探索药物组合的协同作用机制
70.通过将药物或药物组合按不同先后顺序加入培养体系作用于细胞,比较不同情况对细胞活力的影响,可以用于分析在协同作用中两种药物间的相互关系。
71.将对数生长期的coc1细胞收集计数,按每孔5000个/180μl接种于u型圆底96孔细胞培养板中。5%co2、37℃培养过夜后,按图5所示加入0~48小时对应分组和终浓度的药物,并使每孔最终体积均达到200μl。继续培养48小时后,于室温、1000rpm离心5分钟,扣板弃去培养液,每孔加入180μl新鲜培养液,并按图5所示加入48~96小时对应分组和终浓度的药物(使每孔终体积达到200μl)。继续培养48小时即药物处理总时长达到96小时后,离心弃去板中培养液,加入mts细胞活性检测试剂,检测并计算每孔中细胞存活率。结果见2.5。
72.2.结果
73.2.1药物组合对卵巢癌细胞有显著的协同抑制作用
74.人卵巢癌细胞系coc1,分别加入终浓度为0、1.25、2.5、5、10μm的西奥罗尼,同时分
别加入终浓度为0、0.5、1、2μm的西达本胺,以使不同剂量的两药形成两两组合。人卵巢畸胎瘤细胞系pa-1,分别加入终浓度为0、1.25、2.5、5、10μm的西奥罗尼,同时分别加入终浓度为0、0.03125、0.0625、0.125μm的西达本胺,以使不同剂量的两药形成两两组合。每种剂量组合均设置三个复孔,在药物作用120小时后,通过mts实验检测各孔细胞的活力情况,并以(西奥罗尼0μm 西达本胺0μm)为阴性对照计算各给药孔中细胞的相对存活率。
75.如图1所示,coc1细胞中,当西奥罗尼作用剂量为0时,0.5、1、2μm的西达本胺单药作用下所测算到的相对细胞存活率分别为107.90%、111.42%和95.11%;当西达本胺作用剂量为0时,1.25、2.5、5、10μm西奥罗尼单药作用下的相对细胞存活率分别为109.79%、52.80%、35.39%和8.81%。当西达本胺与西奥罗尼联合作用于细胞时,尤其地,在各剂量西达本胺与1.25、2.5、5μm西奥罗尼联合作用时,细胞活力受到的抑制作用均显著强于两药单独抑制强度之和,如0.5μm西达本胺与1.25μm西奥罗尼联合作用下,coc1的相对细胞存活率为75.94%(即抑制率为24.06%),比较于两药相应剂量单独作用下所测算到接近100%的细胞活力(即抑制率之和为0%),联用显然获得了额外的细胞抑制效果,即协同抑瘤作用。
76.同样地,在pa-1细胞中,当西奥罗尼作用剂量为0时,0.03125、0.0625、0.125μm西达本胺单药作用下的相对细胞存活率分别为95.01%、85.26%和58.33%;当西达本胺作用剂量为0时,1.25、2.5、5、10μm西奥罗尼单药作用下的相对细胞存活率分别为102.46%、63.50%、16.24%和25.11%。而在两药联合作用时,尤其在各剂量西达本胺与1.25和2.5μm西奥罗尼联合作用时,获得了显著强于两药单独强度之和的抑制效果。
77.2.2药物组合对卵巢癌细胞的周期抑制与各单药有显著差异
78.如图2(a)所示,coc1细胞分别在0.5μm西达本胺、1.5μm西奥罗尼或0.5μm西达本胺和1.5μm西奥罗尼二者联合作用下48小时后,收集细胞进行固定、pi染色和流式细胞周期分析,可发现在两单药和药物联合作用下,coc1的细胞周期分布相对溶剂对照组均受到了显著影响。将所获得数据加载到flowjo(v7.6.5)软件中调用细胞周期分析模块进行分析,并将分析结果以如图2(b)所示柱状图进行呈现。结果表明,与溶剂对照相比,西达本胺单药作用下,coc1中处于g1期的细胞比例显著增加而s期细胞比例明显减少、sub-g1期(即处于凋亡状态下)的细胞比例有少量增加;西奥罗尼单药作用下,处于g2/m期的细胞比例明显增加而g1期细胞比例有所下降。表明两单药作用下使coc1细胞发生了不同的细胞周期阻滞。在两药联合作用下,意外地发现,coc1不仅发生了g2/m期细胞比例增加和g1、s期比例减少,同时还发生了较高比例的细胞凋亡,sub-g1期细胞占比18.07%,显著高于两单药分别作用下的4.43%与0.24%之和。
79.2.3药物组合诱导卵巢癌细胞的凋亡,与各单药有显著差异
80.将coc1细胞分别经0.5或1μm西达本胺、1.5μm西奥罗尼及上述剂量两药联合处理24小时和48小时后收集细胞用apoptosis/necrosisassay kit(blue,green,red)进行标记。在共聚焦扫描显微镜下,可以观察到(图3(a)),24小时,在联合用药处理组,被标记为绿色荧光的细胞(发生凋亡)较溶剂对照和各单药组已有明显地增加,而各单药组尚未引起显著的凋亡;当药物处理48小时后,各单药组凋亡细胞的数量有所上升,此时联合用药组的凋亡细胞数量的增加更为显著(未见明显红色荧光染色,表明coc1细胞在药物作用下主要受到诱导的是凋亡而非坏死通路)。
81.通过对各组5个随机视野进行凋亡细胞的计数和统计,以所有计数中最大值为100%,继而量化比较各处理组间凋亡细胞数量的差异(图3(b)),各联合用药组凋亡细胞的比例均显著高于相应单药组凋亡细胞比例之和。
82.如图3(c),通过western blot实验检测了相应药物或药物组合对细胞凋亡指标cleaved of parp和cleaved of caspase 3的影响,实验结果同样表明,只有当两药联合作用于coc1细胞时,parp和caspase 3受到明显的活化剪切,即细胞发生凋亡。
83.2.4药物组合在卵巢癌动物模型中抑瘤药效显著强于单药
84.将coc1细胞接种到裸鼠皮下,11天后可判断所有模型已成瘤,随机分为溶剂对照、西达本胺单药、西奥罗尼单药及联合用药4组。灌胃给药的同时进行各荷瘤体积的测算和记录,如图4所示,在开始给药后的第34天,溶剂对照组平均荷瘤体积达到2000mm3,体内药效实验至此结束。根据测算数据,相较于溶剂对照组,西达本胺或西奥罗尼单药及联合用药均具有统计学意义的肿瘤抑制效果(p<0.05),而相对于两单药组联合用药组的抑瘤药效则具更为显著的优势(p<0.05)。
85.2.5药物组合在卵巢癌细胞中具有合成致死的抗肿瘤机制
86.如图5所示,在0~48小时,将接种于96孔板的coc1细胞分为溶剂对照、西达本胺单药、西奥罗尼单药和联合用药四组,分别用相应剂量药物进行预处理;在48~96小时,将上述各组的培养液更换成新鲜培养液并分别再分为溶剂对照、西达本胺单药、西奥罗尼单药和联合用药四组,用相应剂量药物处理。药物处理结束后,通过mts实验测算各孔细胞相对存活率。
87.结果表明,无论西达本胺单药或西奥罗尼单药的0~48小时预处理,均未给后续48~96小时的药物处理带来额外的肿瘤细胞抑制效应,只有当两药同时存在时,协同抑瘤效应才得以体现,且西达本胺与西奥罗尼同时作用的时间越长,对肿瘤细胞的抑制作用越明显。这一结果意外地提示,在卵巢癌中,西达本胺与西奥罗尼的联合用药通过独特的具有“合成致死”特征的机制发挥药效。
88.以上对本发明进行了详细的介绍,本文中应用了具体个例对本发明的原理及实施方式进行了阐述,以上实施例的说明只是用于帮助理解本发明的方法及其核心思想,包括最佳方式,并且也使得本领域的任何技术人员都能够实践本发明,包括制造和使用任何装置或系统,和实施任何结合的方法。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也落入本发明权利要求的保护范围内。本发明专利保护的范围通过权利要求来限定,并可包括本领域技术人员能够想到的其他实施例。如果这些其他实施例具有不是不同于权利要求文字表述的结构要素,或者如果它们包括与权利要求的文字表述无实质差异的等同结构要素,那么这些其他实施例也应包含在权利要求的范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。