减小遗传抽样中的统计偏差
1.相关专利申请的交叉引用
2.本技术要求于2020年2月27日提交的美国临时申请第62/982,677号以及于2020年10月16日提交的美国临时申请第63/093,015号的权益,这些美国临时申请据此以其全文引用的方式并入。
技术领域
3.本技术涉及减小使用杂交捕获过程的基因组测试中的抽样偏差。
背景技术:
4.基因组测试有可能识别出更有可能对某些治疗产生应答的患者。一些基因组测试方法使用杂交捕获步骤,例如,以丰富某些目标基因座处的序列读段(frampton,g.m.等人(2013)nat.biotechnol.31:1023-1031)。然而,当杂交捕获应用于多态性等位基因时,与特定捕获探针的等位基因结合中的差异可能会在抽样中引入偏差。无论特定多态性如何,准确的基因组分析都需要对等位基因频率进行无偏的测序和计数。
5.已在其中应用基因组测试的一个领域是确定用于癌症治疗的个性化基因组信息。高度多态性的等位基因可能对获得准确和全面的基因组信息提出挑战。例如,一些肿瘤的特征在于hla-i等位基因的缺失(称为杂合性缺失或loh)。肿瘤是否已在某些遗传位置处经历loh可能是一个重要的临床事实,尤其是当遗传位置与重要的生物学功能诸如人的免疫系统或其他功能相关时。例如,一个或多个hla-i等位基因处的loh可导致较少的新抗原呈递给免疫系统,从而导致肿瘤的免疫逃逸。此外,可通过拷贝缺失loh(即,一个等位基因缺失)或通过拷贝中性loh(即,其中一个等位基因缺失但另一个等位基因被复制,导致拷贝数没有净变化)来修饰各个基因座。
6.免疫疗法已彻底改变晚期癌症患者的当前治疗。一些(例如,基于细胞的疗法)提供或刺激对癌症的免疫应答,而其他(例如,免疫检查点抑制剂或ici)被认为可重振患者自身的t-细胞介导的免疫应答[reck,m.,等人n engl j med 375,1823-1833(2016);hellmann,m.d.,等人n engl j med 378,2093-2104(2018);nghiem,p.t.,等人n engl j med 374,2542-2552(2016);robert,c.,等人n engl j med 372,2521-2532(2015);le,d.t.,等人n engl j med 372,2509-2520(2015)]。适应性免疫系统经由cd8 t细胞经由呈递在人白细胞抗原i类(hla-i)编码的主要组织相容性复合物i类(mhc-i)蛋白上呈递的肿瘤特异性突变肽(新抗原)来识别肿瘤细胞[mok,t.s.k.,等人lancet 393,1819-1830(2019);schumacher,t.n.&schreiber,r.d.science 348,69-74(2015);turajlic,s.,等人lancet oncol 18,1009-1021(2017)]。从这个角度而言,看起来很直观的是,由于有更大数量的潜在新抗原可供呈递,肿瘤突变负荷(tmb)增加的肿瘤似乎将更容易成为经由ici进行的免疫刺激的目标[hellmann,m.d.,等人n engl j med 378,2093-2104(2018);le,d.t.,等人n engl j med 372,2509-2520(2015);rizvi,n.a.,等人science 348,124-128(2015)],但情况可能并非总是如此。例如,在针对非小细胞肺癌(nsclc)的试验中,tmb未能
充分预测患者存活期。然而,使用hla基因分型来预测新抗原呈递的相对效率以及使用该信息与tmb一起来预测检查点应答的努力颇具前景(goodman am,等人genome med.2020;12(1):45;shim jh,等人ann oncol.2020;31(7):902-11)。
[0007]
已发现不同患者中对免疫疗法(诸如ici治疗)的应答是不同的。为了确保每位患者接受最有可能对其特定肿瘤有效的治疗,需要进一步的方法和系统来获得无偏的多态性等位基因序列和频率,例如,以预测对免疫疗法的应答并快速对患者进行分层,以获得最可能有效的治疗。
技术实现要素:
[0008]
因此,本文提供了用于减小经由杂交捕获引入的抽样偏差的方法和系统。这些方法和系统考虑并减小了在获得与多态性等位基因相关的基因组数据时可能引入的偏差(例如,由用于测序的多核苷酸的杂交捕获产生)。
[0009]
例如,对个性化治疗方法至关重要的人类基因组的一个高度多态性基因座是hla-i基因座。在hla-i基因座处使用loh对潜在的免疫疗法患者进行分层有可能识别出最有可能对诸如ici等免疫重振治疗产生应答的患者。如本文所证明的,hla-i的体细胞缺失被证明是经ici治疗的nsclc中患者存活的负向预测因子,其减弱了高tmb的影响。还确定了59个疾病组中的83,000多个患者样品中的体细胞hla-i loh的情况,发现泛癌发生率为17%,并且在具有高tmb的肿瘤和以pd-l1表达为代表的发炎肿瘤中显著富集。组合的tmb和hla-i loh可更好地选择最有可能从ici中受益的发炎癌症患者,并对个性化癌症疫苗的设计产生影响。本文还描述了已知参与loh事件的其他基因座。
[0010]
本文描述了一种方法,其包括识别多个化学反应,使得:每个反应对应于与多态性基因的不同等位基因结合的诱饵分子,并且每个反应导致对应等位基因分数的捕获;并且所述多个化学反应包括反应的第一子集和反应的第二子集,其中所述第一子集和所述第二子集不共享共同的反应,并且其中所述第一子集和所述第二子集各自包括至少一个化学反应;识别多个反应式,所述多个反应式共同地关联每个化学反应的结合倾向和每个捕获的等位基因的等位基因分数;凭经验识别所述多个化学反应的所述第一子集的相对结合倾向;以及通过最小化总误差来识别所述第二子集的相对结合倾向。
[0011]
在一些实施例中,最小化所述总误差受制于中值相对结合倾向等于1的约束。
[0012]
在一些实施例中,一种相对结合倾向被设定为等于1。
[0013]
在一些实施例中,最小化所述总误差包括执行最小二乘法。
[0014]
在一些实施例中,所述方法进一步包括:执行杂交捕获过程以测量患者的dna样品中的原始等位基因频率;以及使用相对结合倾向的所述第一子集和所述第二子集来缩放经测量的原始等位基因频率,从而减小抽样偏差。
[0015]
在一些实施例中,所述多态性基因包括人白细胞抗原基因。在一些实施例中,所述多态性基因为st7/ray1、arh1/noey2、tslc1、rb、pten、smad2、smad4、dcc、tp53、atm、mir-15a、mir-16-1、nat2、brca1、brca2、hogg1、cdh1、igf2、cdkn1c/p57、men1、prkar1a、h19、kras、bap1、ptch1、smo、sufu、notch1、ppp6c、lats1、casp8、ptpn14、arid1a、fbxw7、m6p/igf2r、ifn-α、嗅觉受体基因、cbfa2t3、dutt1、fhit、apc、p16、fcmd、tsc2、mir-34、c-mpl、runx3、diras3、nras、mir-9、fam50b、plagl1、er、flt3、zdbf2、gpr1、c-kit、nap1l5、grb10、
egfr、peg10、braf、mest、jak2、dapk1、lit1、wt1、nf-1、pr、c-cbl、dlk1、akt1、snurf、细胞色素p450基因(cyp)、znf587、socs1、timp2、runx1、ar、cebpa、c19mc、emp3、znf331、cdkn2a、peg3、nnat、gnas或gata5。
[0016]
在一些实施例中,所述方法进一步包括确定所述患者是否已经历杂合性缺失。
[0017]
本文还描述了一种系统,其包括:一个或多个处理器;以及存储器,所述存储器被配置为存储一个或多个计算机程序指令,其中所述一个或多个计算机程序指令当由所述一个或多个处理器执行时被配置为:识别多个化学反应,使得:每个反应对应于与多态性基因的不同等位基因结合的诱饵分子,并且每个反应导致对应等位基因分数的捕获;并且所述多个化学反应包括反应的第一子集和反应的第二子集,其中所述第一子集和所述第二子集不共享共同的反应,并且其中所述第一子集和所述第二子集各自包括至少一个化学反应;识别多个反应式,所述多个反应式共同地关联每个化学反应的结合倾向和每个捕获的等位基因的等位基因分数;接收所述多个化学反应的所述第一子集的凭经验识别的相对结合倾向;以及通过最小化总误差来识别所述第二子集的相对结合倾向。
[0018]
在所述系统的一些实施例中,最小化所述总误差受制于中值相对结合倾向等于1的约束。
[0019]
在所述系统的一些实施例中,一种相对结合倾向被设定为等于1。
[0020]
在所述系统的一些实施例中,最小化所述总误差包括执行最小二乘法。
[0021]
在所述系统的一些实施例中,所述方法进一步包括:在所述一个或多个处理器处接收患者的dna样品中的经测量的原始等位基因频率,其中通过执行杂交捕获过程测量了所述经测量的原始等位基因频率;以及在所述一个或多个处理器处,使用相对结合倾向的所述第一子集和所述第二子集来缩放所述经测量的原始等位基因频率,从而减小抽样偏差。
[0022]
在所述系统的一些实施例中,所述多态性基因包括人白细胞抗原基因。在所述系统的一些实施例中,所述多态性基因为st7/ray1、arh1/noey2、tslc1、rb、pten、smad2、smad4、dcc、tp53、atm、mir-15a、mir-16-1、nat2、brca1、brca2、hogg1、cdh1、igf2、cdkn1c/p57、men1、prkar1a、h19、kras、bap1、ptch1、smo、sufu、notch1、ppp6c、lats1、casp8、ptpn14、arid1a、fbxw7、m6p/igf2r、ifn-α、嗅觉受体基因、cbfa2t3、dutt1、fhit、apc、p16、fcmd、tsc2、mir-34、c-mpl、runx3、diras3、nras、mir-9、fam50b、plagl1、er、flt3、zdbf2、gpr1、c-kit、nap1l5、grb10、egfr、peg10、braf、mest、jak2、dapk1、lit1、wt1、nf-1、pr、c-cbl、dlk1、akt1、snurf、细胞色素p450基因(cyp)、znf587、socs1、timp2、runx1、ar、cebpa、c19mc、emp3、znf331、cdkn2a、peg3、nnat、gnas或gata5。
[0023]
在所述系统的一些实施例中,所述方法进一步包括在所述一个或多个处理器处确定所述患者是否已经历杂合性缺失。
[0024]
本公开的某些方面涉及用于确定等位基因频率的方法。在一些实施例中,所述方法包括:a)在一个或多个处理器处接收针对基因的等位基因的观察到的等位基因频率,其中所述观察到的等位基因频率对应于:如在与所述基因相对应的多个序列读段中检测到的对所述等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸执行测序获得了所述多个序列读段;b)在一个或多个处理器处接收针对所述等位基因对所述诱饵分子的相对结合倾向,其中所述等位基因的所述
相对结合倾向对应于:对所述等位基因的至少一部分编码的核酸在存在对所述基因的一个或多个其他等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;c)由所述一个或多个处理器执行目标函数以测量所述等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;d)由所述一个或多个处理器执行优化模型以最小化所述目标函数;以及e)由所述一个或多个处理器基于所述优化模型和所述观察到的等位基因频率来确定所述等位基因的经调整的等位基因频率。
[0025]
在一些实施例中,所述优化模型为最小二乘优化模型。在一些实施例中,所述优化模型受制于一个或多个约束。在一些实施例中,所述一个或多个约束要求针对所述基因的多个等位基因的所述相对结合倾向的中值等于1。在一些实施例中,所述观察到的等位基因频率对应于:如在所述多个序列读段中检测到的对所述等位基因的至少一部分编码的核酸与参考值相比时的相对频率。在一些实施例中,所述参考值为序列读段的总数。在一些实施例中,所述参考值为与参考基因相对应的序列读段的数量。
[0026]
在根据本文所述的实施例中任一项所述的一些实施例中,所述基因为对主要组织相容性(mhc)i类分子编码的人白细胞抗原(hla)基因。在一些实施例中,所述基因为st7/ray1、arh1/noey2、tslc1、rb、pten、smad2、smad4、dcc、tp53、atm、mir-15a、mir-16-1、nat2、brca1、brca2、hogg1、cdh1、igf2、cdkn1c/p57、men1、prkar1a、h19、kras、bap1、ptch1、smo、sufu、notch1、ppp6c、lats1、casp8、ptpn14、arid1a、fbxw7、m6p/igf2r、ifn-α、嗅觉受体基因、cbfa2t3、dutt1、fhit、apc、p16、fcmd、tsc2、mir-34、c-mpl、runx3、diras3、nras、mir-9、fam50b、plagl1、er、flt3、zdbf2、gpr1、c-kit、nap1l5、grb10、egfr、peg10、braf、mest、jak2、dapk1、lit1、wt1、nf-1、pr、c-cbl、dlk1、akt1、snurf、细胞色素p450基因(cyp)、znf587、socs1、timp2、runx1、ar、cebpa、c19mc、emp3、znf331、cdkn2a、peg3、nnat、gnas或gata5。在一些实施例中,所述方法进一步包括在确定所述经调整的等位基因频率之后:至少部分地基于所述经调整的等位基因频率确定所述基因已经历杂合性缺失(loh)。在一些实施例中,通过对通过与所述诱饵分子杂交捕获的核酸执行下一代测序(ngs)、全外显子组测序或甲基化测序获得了所述多个序列读段。在一些实施例中,所述方法进一步包括在接收所述观察到的等位基因频率之前:通过下一代测序(ngs)、全外显子组测序或甲基化测序对多个多核苷酸执行测序以便获得所述多个序列读段,其中所述多个多核苷酸包括对所述等位基因的至少一部分编码的核酸。在一些实施例中,所述方法进一步包括在对所述多个多核苷酸执行测序之前:在适用于杂交的条件下使多核苷酸的混合物与所述诱饵分子接触,其中所述混合物包括能够与所述诱饵分子杂交的多个多核苷酸;以及分离与所述诱饵分子杂交的多个多核苷酸,其中对与所述诱饵分子杂交的经分离的多个多核苷酸执行测序。在一些实施例中,所述方法进一步包括在使多核苷酸的所述混合物与所述诱饵分子接触之前:从个体获得样品,其中所述样品包含肿瘤细胞和/或肿瘤核酸;以及从所述样品提取多核苷酸的所述混合物,其中多核苷酸的所述混合物来自所述肿瘤细胞和/或所述肿瘤核酸。在一些实施例中,所述样品进一步包含非肿瘤细胞。在一些实施例中,所述样品包含流体、细胞或组织。在一些实施例中,所述样品包含血液或血浆。在一些实施例中,所述样品包含肿瘤活组织切片或循环肿瘤细胞。在一些实施例中,来自所述个体的所述样品为核酸样品。在一些实施例中,所述核酸样品包含mrna、基因组dna、循环肿瘤dna、细胞外dna或细胞外rna。在一些实施例中,所述方法进一步包括:获得针对基因的两个或更多个等位基因
中的每个等位基因的观察到的等位基因频率,其中所述观察到的等位基因频率对应于:如在与所述基因相对应的多个序列读段中检测到的对相应等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸执行测序获得了所述多个序列读段;获得针对所述两个或更多个等位基因中的每个等位基因对所述诱饵分子的相对结合倾向,其中所述两个或更多个等位基因中的第二等位基因与所述两个或更多个等位基因中的第一等位基因相比具有对所述诱饵分子的较低相对结合倾向;以及识别第二诱饵分子,其中所述两个或更多个等位基因中的所述第二等位基因具有的对所述第二诱饵分子的相对结合倾向高于对所述第一诱饵分子的相对结合倾向。在一些实施例中,所述第二诱饵分子包括与所述两个或更多个等位基因中的所述第二等位基因的至少一部分互补的序列。
[0027]
在又一些其他方面,本文提供了选择诱饵分子的方法,其包括:获得针对基因的两个或更多个等位基因的观察到的等位基因频率,其中所述观察到的等位基因频率对应于:如在与所述基因相对应的多个序列读段中检测到的对相应等位基因的至少一部分编码的核酸的频率,并且其中通过对编码如通过与第一诱饵分子杂交捕获的所述基因或其一部分的核酸执行测序获得了所述多个序列读段;获得针对基因的两个或更多个等位基因对所述第一诱饵分子的相对结合倾向,其中所述两个或更多个等位基因中的第二等位基因与所述两个或更多个等位基因中的第一等位基因相比具有对所述第一诱饵分子的较低相对结合倾向;以及识别或选择第二诱饵分子的序列,其中所述两个或更多个等位基因中的所述第二等位基因具有的对所述第二诱饵分子的相对结合倾向高于对所述第一诱饵分子的相对结合倾向。在一些实施例中,所述第二诱饵分子包括与所述基因的所述两个或更多个等位基因中的所述第二等位基因的至少一部分互补的序列。在一些实施例中,所述第二诱饵分子包括至少部分地基于所述基因的所述两个或更多个等位基因中的所述第二等位基因和第三等位基因的序列的序列,其中所述第二等位基因和所述第三等位基因与所述第一等位基因相比具有对所述第一诱饵分子的较低相对结合倾向。
[0028]
在又一些其他方面,本文提供了非暂时性计算机可读存储介质。在一些实施例中,所述非暂时性计算机可读存储介质包括用于由装置的一个或多个处理器执行的一个或多个程序,所述一个或多个程序包括指令,所述指令当由所述一个或多个处理器执行时致使所述装置执行根据本文所述的实施例中任一项所述的方法。
[0029]
在又一些其他方面,本文提供了用于检测人白细胞抗原(hla)基因的杂合性缺失(loh)的方法。在一些实施例中,所述方法包括:a)在一个或多个处理器处接收针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸执行测序获得了所述多个序列读段;b)在一个或多个处理器处接收针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;c)由所述一个或多个处理器执行目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;d)由所述一个或多个处理器执行优化模型以最小化所述目标函数;e)基于所述优化模型和所述观察到的等位基因频
率来确定所述hla等位基因的经调整的等位基因频率;以及f)由所述一个或多个处理器确定当所述hla等位基因的所述经调整的等位基因频率小于预先确定的阈值时loh已经发生。在一些实施例中,所述hla基因为人hla-a基因、人hla-b基因或人hla-c基因。在一些实施例中,通过对从包括肿瘤细胞和/或肿瘤核酸的样品获得的核酸执行测序获得了所述多个序列读段。在一些实施例中,所述样品进一步包含非肿瘤细胞。
[0030]
在又一些其他方面,本文提供了识别患有癌症的个体的方法,其中人白细胞抗原(hla)基因的杂合性缺失(loh)指示患有特定类型疾病的所述个体对特定治疗产生应答的倾向。在一些实施例中,所述方法包括:检测来自所述个体的样品中的所述hla基因的loh,其中按照根据本文所述的实施例中任一项所述的方法来检测所述hla基因的loh。在一些实施例中,所述样品中的所述hla基因的loh指示所述个体不太可能受益于包含ici的治疗。在一些实施例中,检测到所述样品中不存在所述hla基因的loh指示所述个体可能受益于包含ici的治疗。在一些实施例中,所述方法进一步包括:检测从所述个体获得的样品中的肿瘤突变负荷(tmb)。在一些实施例中,所述方法进一步包括:获取对于从所述个体获得的样品中的高肿瘤突变负荷(tmb)的了解。在一些实施例中,所述hla基因的loh以及高tmb指示所述个体可能受益于包含ici的治疗。在一些实施例中,所述hla基因的loh以及低tmb或者所述hla基因的loh但没有高tmb指示所述个体不太可能受益于包含ici的治疗。
[0031]
在又一些其他方面,本文提供了选择针对患有癌症的个体的疗法的方法。在一些实施例中,所述方法包括:检测来自所述个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh),其中按照根据本文所述的实施例中任一项所述的方法检测所述hla基因的loh。在一些实施例中,所述样品中的所述hla基因的loh指示所述个体不太可能受益于包含ici的治疗。在一些实施例中,检测到所述样品中不存在所述hla基因的loh指示所述个体可能受益于包含ici的治疗。在一些实施例中,所述方法进一步包括:检测从所述个体获得的样品中的肿瘤突变负荷(tmb)。在一些实施例中,所述方法进一步包括:获取对于从所述个体获得的样品中的高肿瘤突变负荷(tmb)的了解。在一些实施例中,所述hla基因的loh以及高tmb指示所述个体可能受益于包含ici的治疗。在一些实施例中,所述hla基因的loh以及低tmb或者所述hla基因的loh但没有高tmb指示所述个体不太可能受益于包含ici的治疗。
[0032]
在又一些其他方面,本文提供了识别针对患有癌症的个体的一个或多个治疗选项的方法。在一些实施例中,所述方法包括:(a)获取对于来自所述个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中按照根据本文所述的实施例中任一项所述的方法检测所述hla基因的loh;以及(b)生成报告,所述报告包括至少部分地基于所述了解针对所述个体识别的一个或多个治疗选项。在一些实施例中,所述样品中的所述hla基因的loh指示所述个体不太可能受益于包含ici的治疗。在一些实施例中,所述一个或多个治疗选项不包括包含ici的治疗。在一些实施例中,所述方法包括:(a)获取对于来自所述个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中按照根据本文所述的实施例中任一项所述的方法检测不存在所述hla基因的loh;以及(b)生成报告,所述报告包括至少部分地基于所述了解针对所述个体识别的一个或多个治疗选项。在一些实施例中,所述样品中不存在所述hla基因的loh指示所述个体可能受益于包含ici的治疗。在一些实施例中,所述方法进一步包括:检测从所述个体获得的样品中的肿瘤突变负荷(tmb)。在一些实施例中,所述hla基因的loh以及高tmb指示所述个体可能受益于包含ici的治疗。在一些
实施例中,所述hla基因的loh以及低tmb或者所述hla基因的loh但没有高tmb指示所述个体不太可能受益于包含ici的治疗。在一些实施例中,所述方法进一步包括获取对于来自所述个体的样品中的高tmb的了解,并且所述一个或多个治疗选项包括包含ici的治疗。
[0033]
在又一些其他方面,本文提供了选择针对患有癌症的个体的治疗的方法。在一些实施例中,所述方法包括获取对于来自患有癌症的个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中按照根据本文所述的实施例中任一项所述的方法检测所述hla基因的loh。在一些实施例中,响应于所述了解的所述获取:(i)所述个体被归类为不接受用免疫检查点抑制剂(ici)进行治疗的候选者;(ii)所述个体被识别为不太可能对包含免疫检查点抑制剂(ici)的治疗产生应答;和/或(iii)所述个体被归类为接受除免疫检查点抑制剂(ici)之外的治疗的候选者。在一些实施例中,所述方法包括获取对于来自患有癌症的个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中按照根据本文所述的实施例中任一项所述的方法检测不存在所述hla基因的loh。在一些实施例中,响应于所述了解的所述获取:(i)所述个体被归类为接受用免疫检查点抑制剂(ici)进行治疗的候选者;和/或(ii)所述个体被识别为可能对包含免疫检查点抑制剂(ici)的治疗产生应答。在一些实施例中,所述方法包括:获取对于来自所述个体的样品中的人白细胞抗原(hla)基因的loh的了解以及获取对于来自所述个体的样品中的高肿瘤突变负荷(tmb)的了解。在一些实施例中,响应于所述了解的所述获取:(i)所述个体被归类为接受用免疫检查点抑制剂(ici)进行治疗的候选者;和/或(ii)所述个体被识别为可能对包含免疫检查点抑制剂(ici)的治疗产生应答。
[0034]
在又一些其他方面,本文提供了预测接受用免疫检查点抑制剂(ici)进行治疗的患有癌症的个体的存活期的方法。在一些实施例中,所述方法包括获取对于来自所述个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中按照根据本文所述的实施例中任一项所述的方法检测所述hla基因的loh。在一些实施例中,响应于所述了解的所述获取,预测所述个体在接受用所述ici进行治疗后与接受用所述ici进行治疗的其癌症未表现出所述hla基因的loh的个体的存活期相比具有较短的存活期。在一些实施例中,所述方法包括获取对于来自所述个体的样品中不存在人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中按照根据本文所述的实施例中任一项所述的方法检测不存在所述hla基因的loh。在一些实施例中,响应于所述了解的所述获取,预测所述个体在接受用所述ici进行治疗后与接受用所述ici进行治疗的其癌症表现出所述hla基因的loh的个体的存活期相比具有较长的存活期。在一些实施例中,所述方法包括获取对于来自所述个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解以及获取对于来自所述个体的样品中的高肿瘤突变负荷(tmb)的了解,其中按照根据本文所述的实施例中任一项所述的方法检测所述hla基因的loh。在一些实施例中,响应于所述了解的所述获取,预测所述个体在接受用所述ici进行治疗后与接受用所述ici进行治疗的其癌症具有所述hla基因的loh但没有高tmb的个体的存活期相比具有较长的存活期。
[0035]
在又一些其他方面,本文提供了监测患有癌症的个体的方法,其包括获取对于来自所述个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中按照根据本文所述的实施例中任一项所述的方法检测所述hla基因的loh,并且其中响应于所述了解的所述获取,预测所述个体与其癌症未表现出所述hla基因的loh的个体相比具有增加的复
发风险。
[0036]
在又一些其他方面,本文提供了筛选患有癌症的个体的方法,其包括获取对于来自所述个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中按照根据本文所述的实施例中任一项所述的方法检测所述hla基因的loh,并且其中响应于所述了解的所述获取,预测所述个体与其癌症未表现出所述hla基因的loh的个体相比具有增加的复发风险。
[0037]
在又一些其他方面,本文提供了评估患有癌症的个体的方法,其包括获取对于来自所述个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中按照根据本文所述的实施例中任一项所述的方法检测所述hla基因的loh,并且其中所述hla基因的所述loh将所述个体识别为与其癌症未表现出所述hla基因的loh的个体相比具有增加的复发风险。
[0038]
在根据本文所述的实施例中任一项所述的一些实施例中,所述hla基因的loh通过以下方式确定:a)在一个或多个处理器处接收针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸执行测序获得了所述多个序列读段;b)在一个或多个处理器处接收针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;c)由所述一个或多个处理器执行目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;d)由所述一个或多个处理器执行被配置为最小化所述目标函数的优化模型;e)由所述一个或多个处理器基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及f)确定当所述hla等位基因的所述经调整的等位基因频率小于预先确定的阈值时loh已经发生。
[0039]
在又一些其他方面,本文提供了治疗癌症或延缓癌症进展的方法。在一些实施例中,所述方法包括:(1)检测从个体获得的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh),其中所述hla基因的loh通过以下方式来检测:a)在一个或多个处理器处接收针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸执行测序获得了所述多个序列读段;b)在一个或多个处理器处接收针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;c)由所述一个或多个处理器执行目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;d)由所述一个或多个处理器执行优化模型以最小化所述目标函数;e)由所述一个或多个处理器基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及f)由所述一个或多个处理器确定当所述hla等位基因的所述经调整的等位基因频率小于预先确定的阈值时loh已经发生;以及(2)至少部分地基于检测到所述hla基因的
loh,向所述个体施用有效量的除免疫检查点抑制剂(ici)之外的治疗。在一些实施例中,所述方法包括:(1)检测从个体获得的样品中不存在人白细胞抗原(hla)基因的杂合性缺失(loh),其中不存在所述hla基因的loh通过以下方式来检测:a)在一个或多个处理器处接收针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸执行测序获得了所述多个序列读段;b)在一个或多个处理器处接收针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;c)由所述一个或多个处理器执行目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;d)由所述一个或多个处理器执行优化模型以最小化所述目标函数;e)由所述一个或多个处理器基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及f)由所述一个或多个处理器确定当所述hla等位基因的所述经调整的等位基因频率大于预先确定的阈值时loh尚未发生;以及(2)至少部分地基于检测到不存在所述hla基因的loh,向所述个体施用有效量的免疫检查点抑制剂(ici)。在一些实施例中,所述方法包括:(1)检测从个体获得的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh),其中所述hla基因的loh通过以下方式来检测:a)在一个或多个处理器处接收针对hla等位基因的观察到的等位基因频率,其中所述观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述hla基因或其一部分的核酸执行测序获得了所述多个序列读段;b)在一个或多个处理器处接收针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;c)由所述一个或多个处理器执行目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;d)由所述一个或多个处理器执行优化模型以最小化所述目标函数;e)由所述一个或多个处理器基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;f)由所述一个或多个处理器确定当所述hla等位基因的所述经调整的等位基因频率小于预先确定的阈值时loh已经发生;g)获取对于从所述个体获得的样品中的高肿瘤突变负荷(tmb)的了解或检测从所述个体获得的样品中的高tmb;以及(3)至少部分地基于检测到所述hla基因的loh以及高tmb,向所述个体施用有效量的包含免疫检查点抑制剂(ici)的治疗。
[0040]
在又一些其他方面,本文提供了一种用于在治疗个体中的癌症或延缓个体中的癌症进展的方法中使用的免疫检查点抑制剂(ici),其中已通过以下方式在从所述个体获得的样品中检测到人白细胞抗原(hla)基因的杂合性缺失(loh):a)在一个或多个处理器处接收针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸执行测序获得了所述多个序列读段;b)在一个或多个处理器处接收针对所述hla等位基因对所述
诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;c)由所述一个或多个处理器执行目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;d)由所述一个或多个处理器执行优化模型以最小化所述目标函数;e)由所述一个或多个处理器基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及f)由所述一个或多个处理器确定当所述hla等位基因的所述经调整的等位基因频率大于预先确定的阈值时loh尚未发生。
[0041]
在又一些其他方面,本文提供了一种在用于治疗个体中的癌症或延缓个体中的癌症进展的药物的制造中使用的免疫检查点抑制剂(ici),其中已通过以下方式在从所述个体获得的样品中检测到人白细胞抗原(hla)基因的杂合性缺失(loh):a)在一个或多个处理器处接收针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸执行测序获得了所述多个序列读段;b)在一个或多个处理器处接收针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;c)由所述一个或多个处理器执行目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;d)由所述一个或多个处理器执行优化模型以最小化所述目标函数;e)由所述一个或多个处理器基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及f)由所述一个或多个处理器确定当所述hla等位基因的所述经调整的等位基因频率大于预先确定的阈值时loh尚未发生。
[0042]
在又一些其他方面,本文提供了一种在用于治疗个体中的癌症或延缓个体中的癌症进展的药物的制造中使用的免疫检查点抑制剂(ici),其中已通过以下方式在从所述个体获得的样品中检测到人白细胞抗原(hla)基因的杂合性缺失(loh)以及高肿瘤突变负荷(tmb):a)在一个或多个处理器处接收针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸执行测序获得了所述多个序列读段;b)在一个或多个处理器处接收针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;c)由所述一个或多个处理器执行目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;d)由所述一个或多个处理器执行优化模型以最小化所述目标函数;e)由所述一个或多个处理器基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;f)由所述一个或多个处理器确定当所述hla等位基因的所述经调整的等位基因频率大于预先确定的阈值时loh已经发生;以及g)检测从所述个体获得的样品中的高肿瘤突变负荷(tmb)。
[0043]
在又一些其他方面,本文提供了一种非暂时性计算机可读存储介质,其包括能够由一个或多个计算机处理器执行以执行方法的一个或多个程序,所述方法包括:使用所述一个或多个处理器接收针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸执行测序获得了所述多个序列读段;使用所述一个或多个处理器接收针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;使用所述一个或多个处理器执行目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;使用所述一个或多个处理器执行优化模型以最小化所述目标函数;使用所述一个或多个处理器基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及使用所述一个或多个处理器确定当所述hla等位基因的所述经调整的等位基因频率小于预先确定的阈值时loh已经发生。在又一些其他方面,本文提供了一种系统,其包括:一个或多个处理器;以及存储器,其被配置为存储一个或多个计算机程序指令,其中所述一个或多个计算机程序指令当由所述一个或多个处理器执行时被配置为:确定针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸执行测序获得了所述多个序列读段;确定针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;执行目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;执行优化模型以最小化所述目标函数;基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及确定当所述hla等位基因的所述经调整的等位基因频率小于预先确定的阈值时loh已经发生。在一些实施例中,所述hla基因为人hla-a基因、人hla-b基因或人hla-c基因。在一些实施例中,通过对从包括肿瘤细胞和/或肿瘤核酸的样品获得的核酸执行测序获得了所述多个序列读段。在一些实施例中,所述样品进一步包含非肿瘤细胞。在一些实施例中,所述样品来自肿瘤活组织切片或肿瘤样本。在一些实施例中,所述样品包含肿瘤细胞外dna(cfdna)。在一些实施例中,所述样品包含流体、细胞或组织。在一些实施例中,所述样品包含血液或血浆。在一些实施例中,所述样品包含肿瘤活组织切片或循环肿瘤细胞。在一些实施例中,所述样品为核酸样品。在一些实施例中,所述核酸样品包含mrna、基因组dna、循环肿瘤dna、细胞外dna或细胞外rna。在一些实施例中,所述方法进一步包括使用所述一个或多个处理器从多个序列读段获取对于肿瘤突变负荷(tmb)的了解或检测所述tmb,其中通过对基因组的至少一部分的核酸执行测序获得了所述多个序列读段。在一些实施例中,所述tmb基于每兆碱基经测序的基因组的非驱动基因体细胞编码突变的数量来确定。
[0044]
在又一些其他方面,本文提供了用于检测人白细胞抗原(hla)基因的杂合性缺失(loh)的方法,其包括:(1)提供从来自个体的样品获得的多种核酸,其中所述多种核酸包括
编码hla基因的核酸;(2)任选地,将一个或多个衔接子连接到所述多种核酸中的一种或多种核酸上;(3)扩增所述多种核酸中的核酸;(4)捕获对应于所述hla基因的多种核酸,其中通过与诱饵分子杂交从经扩增的核酸捕获对应于所述hla基因的所述多种核酸;(5)通过测序仪对捕获的核酸执行测序,以获得对应于所述hla基因的多个序列读段;通过一个或多个处理器将与所述多个序列读段中的一个或多个序列读段相关联的一个或多个值拟合到模型;以及(6)基于所述模型,检测所述hla基因的loh和针对所述hla基因的hla等位基因的相对结合倾向。在一些实施例中,所述hla基因的loh和针对所述hla基因的hla等位基因的相对结合倾向通过以下方式来检测:a)获得针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与所述hla基因相对应的所述多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率;b)获得针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;c)应用目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;d)应用优化模型以最小化所述目标函数;e)基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及f)确定当所述hla等位基因的所述经调整的等位基因频率小于预先确定的阈值时loh已经发生。在一些实施例中,所述方法进一步包括:至少部分地基于检测到所述hla基因的loh,向所述个体施用有效量的除免疫检查点抑制剂(ici)之外的治疗。在一些实施例中,所述方法进一步包括:至少部分地基于检测到所述hla基因的loh,建议除免疫检查点抑制剂(ici)之外的治疗。在一些实施例中,所述方法进一步包括:检测所述样品(或从所述个体获得的第二样品)中的高肿瘤突变负荷(tmb)或获取对于所述样品中的所述tmb的了解。在一些实施例中,所述方法进一步包括:至少部分地基于检测到所述hla基因的loh以及高tmb,向所述个体施用有效量的免疫检查点抑制剂(ici)。在一些实施例中,所述方法进一步包括:至少部分地基于检测到所述hla基因的loh以及高tmb,建议针对所述个体的包含免疫检查点抑制剂(ici)的治疗。在一些实施例中,所述hla基因为人hla-a基因、人hla-b基因或人hla-c基因。在一些实施例中,所述方法进一步包括在(1)之前从所述样品提取所述多种核酸。在一些实施例中,所述样品包含肿瘤细胞和/或肿瘤核酸。在一些实施例中,所述样品进一步包含非肿瘤细胞。在一些实施例中,所述样品来自肿瘤活组织切片或肿瘤样本。在一些实施例中,所述样品包含肿瘤细胞外dna(cfdna)。在一些实施例中,所述样品包含流体、细胞或组织。在一些实施例中,所述样品包含血液或血浆。在一些实施例中,所述样品包含肿瘤活组织切片或循环肿瘤细胞。在一些实施例中,所述样品为核酸样品。在一些实施例中,所述核酸样品包含mrna、基因组dna、循环肿瘤dna、细胞外dna或细胞外rna。在一些实施例中,所述tmb基于每兆碱基经测序的基因组的非驱动基因体细胞编码突变的数量来确定。
[0045]
在根据本文所述的实施例中任一项所述的一些实施例中,所述ici包括pd-1抑制剂、pd-l1抑制剂或ctla-4抑制剂。在一些实施例中,所述方法进一步包括检测从所述个体获得的样品中的肿瘤突变负荷(tmb)。在一些实施例中,所述样品中的所述hla基因的loh以及高tmb将所述个体标识为可能受益于包含ici的所述治疗的个体。在一些实施例中,至少部分地基于所述样品中的所述hla基因的loh以及高tmb,向所述个体施用有效量的免疫检
查点抑制剂(ici)。在一些实施例中,高tmb是指大于或等于10个突变/mb或者大于或等于13个突变/mb的tmb。在一些实施例中,所述hla基因为hla-i基因。
[0046]
应了解,本文所描述的各种实施例的一种、一些或所有特性可组合形成本发明的其它实施例。本发明的这些和其它方面对于本领域技术人员将变得显而易见。通过下面的详细描述进一步描述本发明的这些和其它实施例。
附图说明
[0047]
图1是杂交捕获过程的示意图。
[0048]
图2示出了偏差去除过程的结果。
[0049]
图3a描绘了根据一些实施例的示例性装置。
[0050]
图3b描绘了根据一些实施例的示例性系统。
[0051]
图4a至d描绘了hla-i检测的特性和方法。图4a是在其他致癌过程的上下文中的体细胞hla-i loh、pd-l1表达和肿瘤突变负荷(tmb)的示意图(改编自hegde,p.s.和chen,d.s.(2020)immunity 52:17-35)。图4b示出了hla-i loh与免疫应答的关系。hla-i loh通过新抗原与tmb相关,并作为逃避机制与pd-l1相关(参见mcgranahan,n.等人(2017)cell 171:1259-1271)。图4c是用于从混合肿瘤正常的下一代测序结果中检测hla-i基因座的体细胞杂合性缺失及种系纯合性的计算流程的示意图。图4d示出了针对由于引诱效应(baiting effect)检测hla-i loh的方法学考虑因素,包括baf中的诱饵/靶序列分歧效应(上),以及用于测序的建模baf中的诱饵/靶序列分歧效应(下)。
[0052]
图4e至图4g示出了杂交对hla引诱效率的影响。图4e提供了杂交捕获如何可以以不同的效率沉降(pull down)hla靶序列的实例。示出了在针对具有hla-a*31:01等位基因和hla-a*11:01等位基因的样品中的杂交捕获结合亲和力偏差进行调整之前(顶部;af中值=0.3)和之后(底部;af中值=0.5)hla-a*31:01等位基因的等位基因频率(af)。图4f示出了针对hla-a的每个已知两位单倍型的代表性序列的树状图。所有成对序列距离的矩阵用于对单倍型进行聚类。针对左侧单倍型的k亲和常数均大于或等于1,而针对右侧序列的k常数均小于1。图4g示出了针对hla-a的每个已知两位单倍型的代表性序列的树状图。所有成对序列距离的矩阵用于对单倍型进行聚类。针对左侧单倍型的k亲和常数均大于或等于1,而针对右侧序列的k常数均大于0.7或介于0.7至0.9之间。左轴上的点代表用于捕获各种hla等位基因的特定诱饵分子的序列。
[0053]
图5a和图5b描绘了针对临床基因组数据库(cgdb)中的已知基因组关联的存活概率。图5a示出了针对高肿瘤突变负荷(tmb)(≥10个突变/mb)和低tmb(<10个突变/mb)的存活期曲线。tmb高与存活期呈正相关(hr=0.76,p=0.007)。图5b示出了针对stk11或keap1的缺失的存活期曲线。在对经过二线检查点抑制剂单一疗法治疗的非鳞状非小细胞肺癌(nsclc)队列(n=652)的先前分析中,stk11或keap1的缺失与存活期呈负相关(hr=1.3,p=0.009)。
[0054]
图6a至图6d表明,体细胞hla-i loh和tmb是经免疫检查点抑制剂(ici)治疗的nsclc中的患者存活期的独立且显著的预测因子。图6a示出了具有hla-i loh(右,n=2,769)和没有hla-i loh的证据(左,n=10,471)的非鳞状nsclc样品中的样品属性的富集,包括基因组驱动基因改变。tmb高:≥10个突变/mb;pd-l1阳性:≥1%的肿瘤比例评分。通过
fisher's exact进行了统计,并且只有高度显著(p<0.01)的关联被标记。图6b示出了非鳞状nsclc患者从二线ici单一疗法开始的按hla-i loh状态分层的总体存活期。针对hla-i完整(n=180)的总体存活期中值(mos)为11.3个月[8.2-15.3],并且hla-i loh(n=60)为8.0个月[5.2-13.1]。针对hla-i完整的hr=0.68[0.49-0.95],p=0.02。图6c示出了cgdb中不存在活组织切片定时的影响。图6d描绘了非鳞状nsclc患者从二线ici单一疗法开始的按hla-i loh和tmb状态分层的总体存活期(tmb高:≥10个突变/mb,tmb低:小于10个突变/mb)。tmb高,hla-i完整(n=82)mos 14.09个月[9.0-21.1]。tmb高,hla-i loh(n=31)mos 10.87个月[6.60-20.0]。tmb低,hla-i完整(n=98)mos 9.59个月[6.18-14.8]。tmb低,hla-i loh(n=29)mos 4.83个月[2.86-12.6]。针对tmb高的hr=0.74[0.54-0.99],p=0.046。针对hla-i完整的hr=0.65[0.47-0.91],p=0.013。体细胞hla-i loh和tmb作为经ici治疗的nsclc中的患者存活期的独立且显著的预测因子。
[0055]
图7a和图7b示出了hla-i种系接合性对经ici治疗的nsclc中的患者存活期的影响。图7a描绘了从二线ici单一疗法开始的所有非鳞状nsclc患者的按种系独特hla-i等位基因的数量分层的总体存活期。无论种系hla-i等位基因计数如何,两个队列的mos都是相同的(种系hla-i等位基因计数=6(n=182):mos 10.8[7.49-14.0];种系hla-i等位基因计数<6:mos 10.8[4.80-18.3];p=0.6)。图7b描绘了从二线ici单一疗法开始的没有体细胞hla-i loh证据的非鳞状nsclc患者的按种系独特hla-i等位基因的数量分层的总体存活期。针对种系hla-i等位基因计数为6(n=141)的患者的mos为11.9个月[8.84-15.90],并且针对种系等位基因计数小于6(n=39)的患者的mos为7.1个月[3.68-19.20],p=0.9。hla-i种系接合性对经ici治疗的nsclc中的患者存活期的影响。
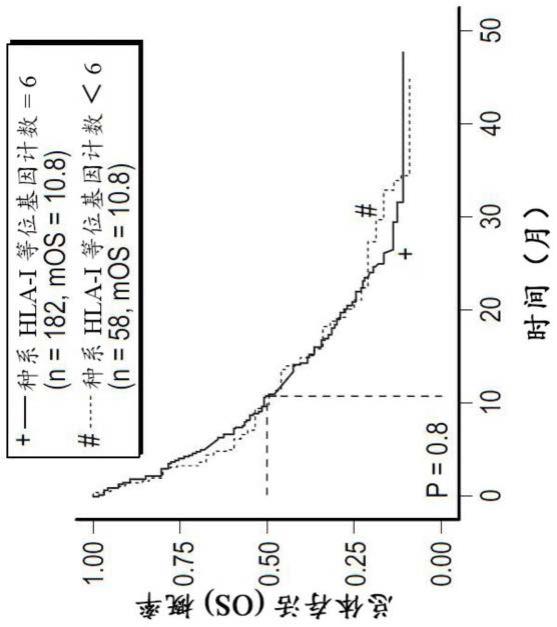
[0056]
图7c和图7d示出了从二线ici单一疗法开始的现实临床基因组队列中的非鳞状nsclc患者的总体存活期。图7c示出了按最具有统计学意义的tmb(突变/mb)和hla-i状态组合分层的总体存活期。针对任何tmb、hla-i完整或tmb≥13、hla-i loh(n=203)的患者的mos为12.2个月[9.1-15.3]。针对tmb小于13、hla-i loh(n=37)的患者的mos为6.0个月[2.9-8.9]。针对任何tmb、hla-i完整;tmb≥13、hla-i loh的hr=0.45[0.31-0.66],p=0.00004。图7d示出了在多个tmb阈值(1个至20个突变/mb)上按hla-i loh和tmb状态分层的总体存活期。对于每个阈值而言,tmb高≥tmb阈值并且tmb低<tmb阈值。风险比源自在每个tmb阈值处针对tmb控制的多变量cox比例风险模型。
[0057]
图8a至图8f示出了体细胞hla-i loh的泛癌景观。图8a描绘了遍及83,664个独特患者样品中的59种不同实体瘤类型的hla-i loh的患病率。每种肿瘤类型中的患者数量汇总在表2中。图8b示出了与具有微卫星不稳定性的高频率(≥3%)的肿瘤类型中的微卫星不稳定(msi-h)样品相比,处于微卫星稳定(mss)的hla-i loh的患病率。样品的数量(mss,msi):小肠(n=420,n=21),胃(n=1100,n=49),结肠直肠(n=9787,n=332),子宫内膜(n=1883,n=330),子宫(n=385,n=20)。通过fisher's exact进行了统计。图8c示出了乳腺癌分子亚型中的hla-i loh的患病率。所有乳腺(n=9686)、her (n=281)、er /her2-(n=731)、三阴性(n=631)。通过卡方进行了统计。图8d示出了与pd-l1阴性样品(<1%肿瘤比例评分,n=9920)相比的pd-l1阳性样品中的hla-i loh的患病率(≥1%肿瘤比例评分,n=3271)(顶部)。通过fisher
′
s exact进行了统计。图8d还示出了每个肿瘤类型中的hla-i loh的患病率和pd-l1阳性的患病率之间的关联性(底部)。关联性用线性回归拟合。图8e示
出了与tmb低样品(<10个突变/mb,n=70263)相比的tmb高样品(≥10个突变/mb,n=13393)中的hla-i loh的患病率(顶部)。通过fisher's exact进行了统计。图8e还示出了每个肿瘤类型中的hla-i loh样品的患病率和tmb高样品的患病率之间的关联性(底部)。关联性用回归模型(例如,loess回归、二次回归等)拟合。对于具有高微卫星不稳定性率的肿瘤类型(小肠、胃、结肠直肠、子宫内膜和子宫)而言,mss和msi-h样品分别表示在图8d和图8e的底部曲线图中。显著(p<0.05)关联性用星号标记。图8f示出了具有tmb的hla-i loh与pd-l1的关联性。
[0058]
图9a和图9b示出了具有低pd-l1阳性率和低tmb的肿瘤类型中的daxx功能缺失突变与hla-i loh的关联性。图9a示出了具有hla-i loh(右,n=97)和没有hla-i loh的证据(左,n=157)的胰岛细胞样品中的样品属性的富集,包括基因组驱动基因改变。图9b示出了具有hla-i loh(右,n=62)和没有hla-i loh的证据(左,n=110)的肾上腺皮质癌样品中的样品属性的富集,包括基因组驱动基因改变。通过fisher's exact进行了统计,并且只有显著的(p<0.05)关联性被标记。
[0059]
图10a和图10b示出了将体细胞hla-i loh与具有肿瘤抗原呈递的样品中的免疫逃避相联系的结果。图10a示出了通过netmhcpan进行的对复发性驱动基因突变的新抗原预测。预测的新抗原被列为基因:蛋白质效应,并且示出了在杂合性缺失事件期间预测的呈递等位基因缺失或保留的次数的百分比。仅包括涉及>5个事件的新抗原。通过二项检验进行了统计,并且显著性被确定为p<0.05。图10b描绘了具有已知致癌病毒关联性的肿瘤类型中的hla-i loh的患病率。hpv:人乳头瘤病毒;ebv:爱泼斯坦-巴尔病毒;hbv:乙型肝炎病毒。样品的数量(病毒阳性、病毒阴性):头颈部鳞状细胞癌(sqcc)(n=363,n=771)、宫颈(n=141,n=121)、胃(n=189,n=1018)、鼻咽(n=50,n=38)、肝细胞(n=64,n=506)。通过fisher’s exact进行了统计,并且显著的(p<0.05)关联性用星号标记。体细胞hla-i loh是针对具有肿瘤抗原呈递的样品中的免疫逃避的潜在机制
[0060]
图11a和图11b示出了具有体细胞hla-i loh的样品中的基因组改变的富集。图11a示出了具有hla-i loh(“hla-i loh样品中富集”)和没有hla-i loh的证据(“hla-i完整样品中富集”)的肿瘤类型中的基因组改变的富集。示出了tmb高样品(≥10个突变/mb)、pd-l1阳性(≥1%肿瘤比例评分)、apobec突变特征、烟草突变特征和uv突变特征的患病率中总体排名前四分之一中的肿瘤类型。仅包括在至少六种不同的肿瘤类型中富集的基因。图11b描绘了具有选定基因组突变的样品中按hla-i loh状态分层的肿瘤类型富集。图11a和图11b中示出的统计通过fisher’s exact进行,并且仅示出了显著的(p<0.05)关联性。
[0061]
图12描绘了根据一些实施例的用于检测人白细胞抗原(hla)基因的杂合性缺失(loh)的示例性过程的框图。
[0062]
图13描绘了根据一些实施例的用于识别多态性基因的不同等位基因的与诱饵分子的相对结合倾向的示例性过程的框图。
[0063]
图14描绘了根据一些实施例的用于确定等位基因频率的示例性过程的框图。
具体实施方式
[0064]
评估受试者(例如,人或其他动物)是否已经历一个或多个基因中的杂合性缺失(“loh”)通常是重要的临床目标。确定受试者中的特定基因的loh的一种方式是使用杂交捕
获过程。如本文所用,loh可以指拷贝缺失loh和/或拷贝中性loh。
[0065]
图1示出了现有技术的杂交捕获过程。关于该过程和其他杂交捕获过程的更多详情可以在美国专利第9,340,830号中找到,该美国专利以其全文引用的方式并入。
[0066]
制备来自受试者的dna片段群104,其中一些对应于受试者的基因组102中的目标基因100。如果受试者在目标基因100处是杂合性的,则dna片段群104将包括大致等量的不同等位基因(每个亲本一个)。另一方面,如果受试者已经历loh,则在靶点(on-target)片段群104a中亲本的等位基因中的一个等位基因将不存在或显著减少。
[0067]
因此,与杂交捕获方法一致,将与目标基因100相对应的诱饵分子群106引入到受试者的dna片段群104中。诱饵分子106将与“靶点”片段104a(即,源自目标基因100的dna片段104)结合。相反,诱饵分子106不会与“非靶点(off-target)”片段104b结合。
[0068]
在足以允许这种结合发生的时间之后,片段/诱饵混合体被捕获,并且剩余的片段被丢弃。然后对捕获的混合体执行测序以确定存在哪些等位基因及它们的相对频率。如果等位基因频率足够接近于相等,则可以确定患者是杂合性的。如果一个等位基因频率足够低,则可以确定患者已经历目标基因100中的loh。
[0069]
这个相对简便的过程可能因许多因素而变得复杂。首先,患者样品可能具有混合性质。例如,如果样品来自肿瘤活组织切片,则样品可能既包含来自患者的正常健康细胞,也包含来自肿瘤的癌细胞。其次,一些癌细胞可能表现出非整倍性,其中癌细胞具有比典型数量更多或更少的重复染色体。如果存在这些因素中的一个或两个,则它们可能会改变针对杂合性受试者或已经历loh的受试者的预期等位基因频率。
[0070]
已开发出甚至在存在这些因素的情况下评估loh的技术。一种方法是在类似于上文描述的数学计算中引入额外的参数,包括肿瘤纯度(即,含有肿瘤细胞与健康细胞的样品的比例)和肿瘤倍性(即,肿瘤细胞拥有的重复染色体的数量)。该方法的实例描述于例如mcgranahan等人,allele-specific hla loss and immune escape in lung cancer evolution(cell,2017nov 30;171(6):1259-1271.e11)中,其以其全文引用的方式并入本文。
[0071]
然而,其中公开的技术仍然容易出现统计偏差,这可能会歪曲对经测量的等位基因频率的评估,尤其是对于表现出高度多态性的目标基因100而言。
[0072]
一个这样的基因家族是人白细胞抗原(“hla”)基因。这些基因部分地负责调节人的免疫系统。这些功能分布在人类基因组102内的若干基因座上,但即使在某些特定基因座处也可能存在多达数千个可能的等位基因。
[0073]
因此,在上述杂交捕获过程中,特定诱饵分子106将不会与大多数可能的等位基因完全互补。此外,不同的等位基因可能会彼此竞争与相同的诱饵分子结合。反过来,这些现象会影响(有时深刻地)靶点片段104a成功结合到诱饵分子106的倾向。这导致捕获过程对特定等位基因抽样不足或过抽样,并且因此导致经测量的等位基因频率人为地高或低,并且在一些情况下错误地作出关于受试者是否已经历loh的确定。
[0074]
减小这种抽样误差的一种方法是凭经验确定各种等位基因对特定诱饵分子的相对结合倾向;例如,如果受试者dna片段104的样品确实包括来自两个不同等位基因的相等比例的靶点片段104a,则可以凭经验确定使用特定诱饵分子106的杂交捕获过程产生哪些实际等位基因频率。因为结合倾向至少部分归因于等位基因间的竞争,所以可以按逐个等
位基因对而不仅仅是按逐个等位基因来作出这种确定。如果这些相对结合倾向是已知的,则可以通过缩放观察到的等位基因频率来校正具有这些等位基因和诱饵分子的后续杂交捕获过程的抽样偏差。例如,可以应用目标函数来测量给定等位基因的相对结合倾向与观察到的等位基因频率之间的差。
[0075]
但是对于像hla这样的高度多态性基因而言,这种方法可能不实用,因为在这个程度上存在太多的等位基因对而无法确定所有的相对结合倾向。然而,如果仅已知相对结合倾向的子集,则以下技术可能是有用的。
[0076]
在下文中,假设目标基因100是具有n个可能的等位基因的多态性基因。等位基因i和j对诱饵分子的相对结合倾向由下式给出:
[0077][0078]
其中ki和kj分别为等位基因i和j的相对结合倾向,并且afi和afj分别表示等位基因i和j的对应的等位基因频率。
[0079]
应注意,因为afi和afj部分地由它们的对应的等位基因的相互作用决定,所以这些数字应理解为仅在存在其他等位基因的情况下描述等位基因i和j的等位基因频率。换句话讲,如果i、j和k是不同的,则在存在等位基因j与等位基因k的情况下afi可能是不同的。在一些具体实施中,方便的是通过取上述表达式的对数来对这些方程进行线性化,得到:
[0080]
log(ki)
–
log(kj)=log(afi)
–
log(afj)
[0081]
对于n个等位基因,存在总共n(n-1)个等位基因对。因此,可以得到上述形式的n(n-1)线性方程组,其根据观察到的等位基因频率表达等位基因的相对结合倾向。如果经验等位基因频率数据可用于所有可能的等位基因对,则可以简便的方式求解该组。
[0082]
然而,即使经验等位基因频率数据仅可用于可能的对的子集,仍然可以通过误差最小化方法进行有用的估计。上述方程组可以表达为ax=b的形式,其中a为矩阵,具有n(n-1)行和n列,其中除一列中的1项和另一列中的-1项之外,每行中的所有项都为0,因此没有两行是相等的。向量x为在第i位具有分量log ki的列向量,并且b为具有log(afn)
–
log(afm)的形式的每个分量的列向量,其中n和m的值对应于对应行中的a的非零项的位置。在一些具体实施中,可以修改矩阵的行,使其唯一的非零项在某个位置(例如,列m)等于1。这相当于将诱饵分子对等位基因m的相对结合倾向任意设定为等于1,从而设定针对其测量其他相对结合倾向的量度。
[0083]
如果不是所有的ki和/或afi项都是已知的,则可以通过以下方式来获得实际估计:通过以下表达式定义误差项e
i,j
[0084][0085]
并且选择未知的ki和/或afi项以最小化总误差(或其某些数学函数;例如,绝对值、平方值等)。在一些具体实施中,这种最小化可以受制于其他约束而被执行,例如,所有ki项的中值都等于1的要求。在一些具体实施中,通过执行最小二乘优化使误差最小化,尽管其他优化方法也是合适的。
[0086]
由于ki项已凭经验确定或根据前一段所述被计算出,它们可用于重新缩放来自杂交捕获过程的经测量的原始等位基因频率,从而减小由于上述因素而存在的抽样偏差。
[0087]
本公开的某些方面涉及用于确定等位基因频率的方法。在一些实施例中,所述方法包括:a)获得针对基因的等位基因的观察到的等位基因频率,其中所述观察到的等位基因频率对应于:如在与所述基因相对应的多个序列读段中检测到的对所述等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸执行测序获得了所述多个序列读段;b)获得针对所述等位基因对所述诱饵分子的相对结合倾向,其中所述等位基因的所述相对结合倾向对应于:对所述等位基因的至少一部分编码的核酸在存在对所述基因的一个或多个其他等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;c)应用目标函数以测量所述等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;d)应用优化模型以最小化所述目标函数;以及e)基于所述优化模型和所述观察到的等位基因频率来确定所述等位基因的经调整的等位基因频率。
[0088]
优化建模
[0089]
优化是指:寻求解决方案的方法和过程,该解决方案可能是最佳可用解决方案、优选解决方案或在一系列约束内提供特定益处的解决方案;或持续改进的方法和过程;或改进的方法和过程;或寻找针对目标的高点或最大值(或者低点或最小值)的方法和过程;或进行处理以减少罚分函数或成本函数的方法和过程;等等。在优化建模中,目标通常是最小化模型误差,也称为模型的残差(残差是观察值与由模型提供的拟合值之间的差)。
[0090]
通常,优化模型具有三个主要组成部分:a)目标函数,其是需要被优化的函数(例如,最小化模型的参数估计的误差);b)变量的集合,其中针对优化问题的解决方案是对于其而言目标函数达到其最优值的变量值集合;以及c)约束变量值的约束的集合。各种优化模型在本领域中是已知的并且可以在本公开的方法中使用。本领域技术人员将能够根据他们的具体需要和标准来确定要使用的合适的优化模型。本领域中的优化模型的实例包括但不限于最小二乘回归模型、逻辑回归模型、二次回归模型、loess回归模型、bayesian岭回归模型、套索回归模型、弹性网络回归模型、决策树模型、梯度提升树模型、神经网络模型和支持向量机模型。关于优化建模的进一步描述可见于例如yang,x.(2008).introduction to mathematical optimization.from linear programming to metaheuristics;allaire,g.,&allaire,g.(2007).numerical analysis and optimization:an introduction to mathematical modelling and numerical simulation.oxford university press;pedregal,p.(2006).introduction to optimization(第46卷).springer science&business media;chong,e.k.,&zak,s.h.(2004).an introduction to optimization.john wiley&sons等中。
[0091]
等位基因频率
[0092]
在一些实施例中,优化模型包括作为模型变量的等位基因频率。等位基因频率是等位基因等位基因(即,核苷酸序列的变体)在等位基因群群中的基因组基因座位点处的频率,以分数或百分比表达。当等位基因群是指一个个体受试者的等位基因群时,等位基因的频率可以计算为等位基因的序列计数与个体受试者的给定基因组基因座处的所有等位基因的总序列计数的比率。从这个意义上说,等位基因频率表示个体在基因组基因座处的等位基因组成,从其可以推断出接合性(例如纯合性或杂合性)。例如,对于二倍体个体受试者诸如人类而言:
[0093]
1)如果等位基因的等位基因频率具有或相当接近(例如,在其统计置信区间内)值0,则个体受试者被认为对于该等位基因而言是纯合无效的(homozygous null)(也称为无效接合的(nullizygous));
[0094]
2)如果等位基因的等位基因频率具有或相当接近(例如,在其统计置信区间内)值0.5,则个体受试者被认为对于该等位基因而言是杂合性的;并且
[0095]
3)如果等位基因的等位基因频率具有或相当接近(例如,在其统计置信区间内)值1,则个体受试者被认为对于该等位基因而言是纯合性的。
[0096]
在一些实施例中,等位基因频率是观察到的等位基因频率,对应于如在多个序列读段中检测到的对等位基因的至少一部分编码的核酸与参考值相比时的相对频率。在一些实施例中,所述参考值为序列读段的总数。在一些实施例中,参考值是与参考基因或其功能相对应的序列读段的数量,诸如每百万映射读段的读段(rpm)或每百万映射读段的计数(cpm)。
[0097]
在一些实施例中,等位基因频率可以表达为相对结合倾向。在基于杂交捕获的测序过程中,相对结合倾向对应于一个等位基因在存在一个或多个其他等位基因的情况下对诱饵分子进行结合的可能性。因此,在一些实施例中,将优化模型应用于目标函数,该目标函数测量一个等位基因的相对结合倾向与该等位基因的观察到的等位基因频率之间的差。
[0098]
举例来说,图2示出了针对各种hla-a等位基因的这种缩放的结果。左侧的条形图表示在存在水平轴上所指示的各种其他hla-a等位基因的情况下来自hla-a*31:01等位基因的杂合性受试者的原始等位基因频率。等位基因频率中值为0.38,指示hla-a*31:01在存在指定的其他等位基因的情况下通常抽样不足。校正偏差后,右图显示等位基因频率中值为0.5,这与杂合性样品群更为一致。
[0099]
图4d示出了用于在确定针对个体群中的人白细胞抗原i类(hla-i)基因的杂合性缺失(loh)时使用的经调整的等位基因频率的影响。x轴示出了群体中每个个体的b等位基因频率(baf),其中b等位基因是指非参考等位基因或次要等位基因。y轴示出了群体中的baf的样品计数。图4d显示在使用本公开的方法调整等位基因频率后,等位基因频率中值从大约0.32(上图)调整到大约0.5(下图),表明个体群中的大多数对于hla-i基因而言是杂合性的。
[0100]
如图4g所示,特定等位基因(或其片段)可以具有一定范围的对特定诱饵分子的相对结合倾向。为了改进对代表基因的完整多态性变异的序列的捕获,可能希望选择一种或多种附加的诱饵分子,特别是具有对等位基因的改进的结合倾向且具有对初始诱饵分子的较低的相对结合倾向的那些分子。
[0101]
因此,在一些实施例中,本公开的方法可以包括:获得针对基因的两个或更多个等位基因的观察到的等位基因频率;获得针对基因的两个或更多个等位基因对特定诱饵分子的相对结合倾向;和/或识别或选择第二诱饵分子的序列。在一些实施例中,具有对第一诱饵分子的较低的相对结合倾向的基因的一个或多个等位基因可以具有对第二诱饵分子的与对第一诱饵分子相比较高的结合倾向。例如,第二诱饵分子可以包括与基因的较低结合等位基因中的一个较低结合等位基因的至少一部分互补的序列,或者与基于与基因的一个或多个较低结合等位基因的序列的互补性或结合的序列(例如,共有序列)互补的序列。这允许基于多态性基因的较低结合等位基因的序列进行诱饵选择,例如,以便更全面地或以
更小的偏差对基因的多样性进行抽样(例如,基于杂交捕获)。
[0102]
最小二乘优化
[0103]
在一些实施例中,所述优化模型为最小二乘优化模型。最小二乘优化模型是一种回归优化模型,其中目标函数是待优化参数(例如,待最小化的可变残差/误差)的二次函数(例如,平方和函数)。在一些实施例中,在本公开的方法中使用最小二乘优化模型以最小化目标函数,该目标函数测量等位基因的相对结合倾向与观察到的等位基因频率之间的差。在一些实施例中,优化模型为二次回归。在一些实施例中,优化模型为loess回归。
[0104]
在一些实施例中,优化模型可用于校正或调整目标变量(例如,等位基因频率)。在一些实施例中,优化模型和等位基因的观察到的等位基因频率用于确定等位基因的经调整的等位基因频率。经调整的等位基因频率可以进一步用于下游操作中,例如,从而推断个体受试者的针对等位基因的接合性状态。
[0105]
对于最小二乘优化的进一步描述可见于例如wolberg,j.(2006).data analysis using the method of least squares:extracting the most information from experiments.springer science&business media;borowiak,d.(2001).linear models,least squares and alternatives;(1996).numerical methods for least squares problems.society for industrial and applied mathematics;luenberger,d.g.(1997)“least-squares estimation”.optimization by vector space methods.new york:john wiley&sons.第78
–
102页等中。
[0106]
模型约束
[0107]
在一些实施例中,所述优化模型受制于一个或多个约束。约束限制了针对优化模型中的变量的可能的值。在一些实施例中,所述一个或多个约束要求针对所述基因的多个等位基因的所述相对结合倾向的中值等于0。在一些实施例中,所述一个或多个约束要求针对所述基因的多个等位基因的所述相对结合倾向的中值等于0.5。在一些实施例中,所述一个或多个约束要求针对所述基因的多个等位基因的所述相对结合倾向的中值等于1。
[0108]
测序
[0109]
在一些实施例中,通过对通过与所述诱饵分子杂交捕获的核酸执行测序获得了所述多个序列读段。在一些实施例中,通过对通过与所述诱饵分子杂交捕获的核酸执行全外显子组测序获得了所述多个序列读段。在一些实施例中,通过对通过与所述诱饵分子杂交捕获的核酸执行下一代测序(ngs)、全外显子组测序或甲基化测序获得了所述多个序列读段。
[0110]
在一些实施例中,所述方法进一步包括在获得所述观察到的等位基因频率之前:通过下一代测序(ngs)对多个多核苷酸执行测序以便获得所述多个序列读段,其中所述多个多核苷酸包括对所述等位基因的至少一部分编码的核酸。ngs方法在本领域中是已知的并且描述于例如metzker,m.(2010)nature biotechnology reviews 11:31-46中。用于下一代测序的平台包括例如roche/454的基因组测序仪(gs)flx系统,illumina/solexa的基因组分析仪(ga),illumina的hiseq 2500、hiseq 3000、hiseq 4000和novaseq 6000测序系统,life/apg的支持寡核苷酸连接检测(solid)系统,polonator的g.007系统,helicos biosciences的heliscope基因测序系统以及pacific biosciences的pacbio rs系统。ngs技术可以包括一个或多个步骤,例如,模板制备、测序和成像以及数据分析。用于模板制备
的方法可以包括这样的步骤,诸如将核酸(例如,基因组dna)随机分解成更小的尺寸并生成测序模板(例如,片段模板或配对模板)。空间上分离的模板可以附接或固定到固体表面或支持物,从而允许同时进行大量的测序反应。可用于ngs反应的模板类型包括例如源自单个dna分子的克隆扩增模板以及单个dna分子模板。针对ngs的示例性测序和成像步骤包括例如循环可逆终止(crt)、连接测序(sbl)、单分子添加(焦磷酸测序)和实时测序。已生成ngs读段后,可以将它们与已知的参考序列比对或再次组装。例如,通过将ngs读段与参考序列(例如,野生型序列)比对,可以实现识别样品(例如,肿瘤样品)中的遗传变异,诸如单核苷酸多态性和结构变异。针对ngs的序列比对的方法描述于例如trapnell c.和salzberg s.l.nature biotech.,2009,27:455-457中。再次组装的实例描述于例如warren r.等人,bioinformatics,2007,23:500-501;butler j.等人,genome res.,2008,18:810-820;以及zerbino d.r.和birney e.,genome res.,2008,18:821-829中。序列比对或组装可以使用来自一个或多个ngs平台的读段数据进行,例如,混合roche/454和illumina/solexa读段数据。
[0111]
在一些实施例中,所述方法进一步包括在获得所述观察到的等位基因频率之前:通过全外显子组测序对多个多核苷酸执行测序以便获得所述多个序列读段,其中所述多个多核苷酸包括对所述等位基因的至少一部分编码的核酸。
[0112]
在一些实施例中,所述方法进一步包括在对所述多个多核苷酸执行测序之前:在适用于杂交的条件下使多核苷酸的混合物与所述诱饵分子接触,其中所述混合物包括能够与所述诱饵分子杂交的多个多核苷酸;以及分离与所述诱饵分子杂交的多个多核苷酸,其中通过ngs对与所述诱饵分子杂交的经分离的多个多核苷酸执行测序。图1示出了这种杂交捕获过程。关于该过程和其他杂交捕获过程的更多详情可以在美国专利第9,340,830号中找到,该美国专利以其全文引用的方式并入。在一些实施例中,所述方法进一步包括在使多核苷酸的所述混合物与所述诱饵分子接触之前:从个体获得样品,其中所述样品包含肿瘤细胞和/或肿瘤核酸;以及从所述样品提取多核苷酸的所述混合物,其中多核苷酸的所述混合物来自所述肿瘤细胞和/或所述肿瘤核酸。在一些实施例中,所述样品进一步包含非肿瘤细胞。
[0113]
在一些实施例中,所述方法包括对多个多核苷酸进行甲基化测序以便获得所述多个序列读段。在一些实施例中,所述多个多核苷酸包括对所述等位基因的至少一部分编码的核酸。
[0114]
在一些实施例中,核酸从样品(例如,包括肿瘤细胞和/或肿瘤核酸)获得。例如,样品可包括肿瘤细胞、循环肿瘤细胞、肿瘤核酸(例如,肿瘤循环肿瘤dna、cfdna或cfrna)、肿瘤活组织切片的部分或全部、流体、细胞、组织、mrna、基因组dna、rna、细胞外dna和/或细胞外rna。在一些实施例中,所述样品来自肿瘤活组织切片或肿瘤样本。在一些实施例中,所述样品进一步包含非肿瘤细胞和/或非肿瘤核酸。在一些实施例中,流体包括血液、血清、血浆、唾液、精液、脑脊液、羊水、腹膜液、间质液等。
[0115]
在一些实施例中,样品是或包括生物组织或流体。样品可以包含不与自然界中的组织自然混合的化合物,诸如防腐剂、抗凝剂、缓冲剂、固定剂、营养物、抗生素等。在一个实施例中,将样品保存为冷冻样品或保存为甲醛固定或多聚甲醛固定的石蜡包埋(ffpe)组织制剂。例如,样品可以包埋在基质中,例如,ffpe块或冷冻样品。在另一个实施例中,样品是
血液或血液成分样品。在又一个实施例中,样品是骨髓穿刺液样品。在另一个实施例中,样品包括无细胞dna(cfdna)。不希望受理论的束缚,据信在一些实施例中,cfdna是来自凋亡或坏死细胞的dna。通常,cfdna与蛋白质(例如,组蛋白)结合并由核酸酶保护。cfdna可用作例如用于无创产前检测(nipt)、器官移植、心肌病、微生物组和癌症的生物标志物。在另一个实施例中,样品包括循环肿瘤dna(ctdna)。不希望受理论的束缚,据信在一些实施例中,ctdna是具有遗传或表观遗传改变(例如,体细胞改变或甲基化特征)的cfdna,该改变可以辨别其源自肿瘤细胞还是非肿瘤细胞。在另一个实施例中,样品包括循环肿瘤细胞(ctc)。不希望受理论的束缚,据信在一些实施例中,ctc是从原发性或转移性肿瘤脱落到循环中的细胞。在一些实施例中,ctc凋亡是血液/淋巴中ctdna的源。
[0116]
在一些实施例中,生物样品可以是或包括骨髓;血液;血细胞;腹水;组织或细针活组织切片样品;含细胞的体液;游离的浮动核酸;痰;唾液;尿液;脑脊液;腹膜液;胸膜液;粪便;淋巴;妇科液;皮肤拭子;阴道拭子;口腔拭子;鼻拭子;洗涤物或灌洗物,诸如导管灌洗物或支气管肺泡灌洗物;抽出物;刮屑;骨髓样本;组织活组织切片样本;手术样本;粪便、其他体液、分泌物和/或排泄物;和/或来自其中的细胞等。在一些实施例中,生物样品是或包括从个体获得的细胞。在一些实施例中,获得的细胞是或包括来自从其获得样品的个体的细胞。
[0117]
图12示出了根据一些实施例的用于检测人白细胞抗原(hla)基因的杂合性缺失(loh)的示例性过程1200。例如,使用实现软件程序的一个或多个电子装置来执行过程1200。在一些实例中,使用客户端-服务器系统执行过程1200,并且过程1200的框以任何方式在服务器与客户端装置之间被划分。在其他实例中,过程1200的框在服务器与多个客户端装置之间被划分。因此,尽管过程1200的部分在本文中被描述为由客户端-服务器系统的特定装置执行,但应理解过程1200不限于此。在其他实例中,仅使用客户端装置或仅使用多个客户端装置来执行过程1200。在过程1200中,一些框被任选地组合,一些框的顺序被任选地改变,并且一些框被任选地省略。在一些实例中,可以结合过程1200来执行附加步骤。因此,所示出的(以及下文更详细描述的)操作在本质上是示例性的,并且因此不应被视为限制性的。
[0118]
在框1202处,提供从来自个体的样品获得的多种核酸,其中该多种核酸包括编码hla基因的核酸。任选地,在框1204处,一个或多个衔接子被连接到来自该多种核酸中的一种或多种核酸上。在框1206处,核酸从该多种核酸被扩增。在框1208处,通过与诱饵分子的杂交,从经扩增的核酸捕获到对应于hla基因的多种核酸。在框1210处,示例性测序仪对捕获的核酸执行测序以获得对应于hla基因的多个序列读段。在框1212处,示例性系统(例如,一个或多个电子装置)将与该多个序列读段中的一个或多个序列读段相关联的一个或多个值拟合到模型。在框1214处,系统基于模型检测hla基因的loh以及针对hla基因的hla等位基因的相对结合倾向。
[0119]
图13示出了根据一些实施例的用于识别多态性基因的不同等位基因对诱饵分子的相对结合倾向的示例性过程1300。例如,使用实现软件程序的一个或多个电子装置来执行过程1300。在一些实例中,使用客户端-服务器系统执行过程1300,并且过程1300的框以任何方式在服务器与客户端装置之间被划分。在其他实例中,过程1300的框在服务器与多个客户端装置之间被划分。因此,尽管过程1300的部分在本文中被描述为由客户端-服务器
系统的特定装置执行,但应理解过程1300不限于此。在其他实例中,仅使用客户端装置或仅使用多个客户端装置来执行过程1300。在过程1300中,一些框被任选地组合,一些框的顺序被任选地改变,并且一些框被任选地省略。在一些实例中,可以结合过程1300来执行附加步骤。因此,所示出的(以及下文更详细描述的)操作在本质上是示例性的,并且因此不应被视为限制性的。
[0120]
在框1302处,示例性系统(例如,一个或多个电子装置)识别多个化学反应,例如,使得每个反应对应于与多态性基因的不同等位基因结合的诱饵分子,并且每个反应导致对应等位基因分数的捕获,并且该多个化学反应包括反应的第一子集和反应的第二子集,其中第一子集和第二子集不共享共同的反应,并且其中第一子集和第二子集各自包括至少一个化学反应。在框1304处,系统识别多个反应式,该多个反应式共同地关联每个化学反应的结合倾向和每个捕获的等位基因的等位基因分数。在框1306处,系统凭经验识别该多个化学反应的第一子集的相对结合倾向。在框1308处,系统通过最小化总误差来识别第二子集的相对结合倾向。
[0121]
图14示出了根据一些实施例的用于确定等位基因频率的示例性过程1400。在一些实施例中,确定一个或多个hla等位基因的等位基因频率例如以检测loh。例如,使用实现软件程序的一个或多个电子装置来执行过程1400。在一些实例中,使用客户端-服务器系统执行过程1400,并且过程1400的框以任何方式在服务器与客户端装置之间被划分。在其他实例中,过程1400的框在服务器与多个客户端装置之间被划分。因此,尽管过程1400的部分在本文中被描述为由客户端-服务器系统的特定装置执行,但应理解过程1300不限于此。在其他实例中,仅使用客户端装置或仅使用多个客户端装置来执行过程1400。在过程1400中,一些框被任选地组合,一些框的顺序被任选地改变,并且一些框被任选地省略。在一些实例中,可以结合过程1400来执行附加步骤。因此,所示出的(以及下文更详细描述的)操作在本质上是示例性的,并且因此不应被视为限制性的。
[0122]
在框1402处,示例性系统(例如,一个或多个电子装置)接收针对基因的等位基因的观察到的等位基因频率。在一些实施例中,所述观察到的等位基因频率对应于:如在与所述基因相对应的多个序列读段中检测到的对所述等位基因的至少一部分编码的核酸的频率,并且通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸执行测序获得了所述多个序列读段。在一些实施例中,所述基因为人hla基因,并且所述等位基因为人hla等位基因(例如,如本文所述)。在框1404处,系统接收针对等位基因对诱饵分子的相对结合倾向。在一些实施例中,所述等位基因的所述相对结合倾向对应于:对所述等位基因的至少一部分编码的核酸在存在对所述基因的一个或多个其他等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向。在框1406处,系统执行目标函数以测量等位基因的相对结合倾向与观察到的等位基因频率之间的差。在框1408处,系统执行优化模型以最小化目标函数。在框1410处,系统基于优化模型和观察到的等位基因频率来确定等位基因的经调整的等位基因频率。
[0123]
软件和装置
[0124]
在一些其他方面,本文提供了非暂时性计算机可读存储介质。在一些实施例中,所述非暂时性计算机可读存储介质包括用于由装置的一个或多个处理器执行的一个或多个程序,所述一个或多个程序包括指令,所述指令当由所述一个或多个处理器执行时致使所
述装置执行根据本文所述的实施例中任一项所述的方法。
[0125]
图3a示出了根据一个实施例的计算装置的实例。装置300可以是连接到网络的主计算机。装置300可以是客户端计算机或服务器。如图3a所示,装置300可以是任何合适类型的基于微处理器的装置,诸如个人计算机、工作站、服务器或手持式计算装置(便携式电子装置),诸如电话或平板电脑。该装置可以包括例如处理器310、输入装置320、输出装置330、存储装置340和通信装置360中的一者或多者。输入装置320和输出装置330通常可以对应于上述那些,并且可以与计算机可连接或可集成。
[0126]
输入装置320可以是提供输入的任何合适的装置,诸如触摸屏、键盘或小键盘、鼠标或者语音识别装置。输出装置330可以是提供输出的任何合适的装置,诸如触摸屏、触觉装置或扬声器。
[0127]
存储装置340可以是提供存储的任何合适的装置(例如,包括ram、高速缓存、硬盘驱动器或可移动存储盘的电、磁或光存储器)。通信装置360可以包括能够通过网络传输和接收信号的任何合适的装置,诸如网络接口芯片或装置。计算机的部件可以以任何合适的方式连接,诸如经由有线介质(例如,物理总线、以太网或任何其他有线传递技术)或以无线方式(例如,或任何其他无线技术)。
[0128]
hla模块350可以作为可执行指令存储在存储装置340中并由处理器310执行,其可以包括例如体现本公开的功能性的过程(例如,如体现在如上所述的装置中)。
[0129]
hla模块350也可以在任何非暂时性计算机可读存储介质中存储和/或传送以供指令执行系统、设备或装置使用或者与指令执行系统、设备或装置结合使用,诸如上述那些,其可以从指令执行系统、设备或装置获取与软件相关联的指令并执行指令。在本公开的上下文中,计算机可读存储介质可以是任何介质,诸如存储装置340,其可以包含或存储供指令执行系统、设备或装置使用或者与指令执行系统、设备或装置结合使用的过程。计算机可读存储介质的实例可以包括存储器单元,如硬盘驱动器、闪存驱动器以及作为单个功能性单元工作的分布式模块。另外,本文所述的各种过程可以体现为被配置为根据上述实施例和技术工作的模块。此外,尽管可以单独地示出和/或描述过程,但是本领域技术人员应理解,上述过程可以是其他过程中的例程或模块。
[0130]
hla模块350也可以在任何传输介质中传播以供指令执行系统、设备或装置使用或者与指令执行系统、设备或装置结合使用,诸如上述那些,其可以从指令执行系统、设备、或装置获取与软件相关联的指令并执行指令。在本公开的上下文中,传输介质可以是可以传达、传播或传送程序以供指令执行系统、设备或装置使用或者与指令执行系统、设备或装置结合使用的任何介质。传送可读介质可包括但不限于电子、磁、光、电磁或红外有线或无线传播介质。
[0131]
装置300可以连接到网络(例如,网络404,如图3b所示和/或如下所述),其可以是任何合适类型的互连通信系统。该网络可以实现任何合适的通信协议并且可以通过任何合适的安全协议得以保护。该网络可以包括可以实现网络信号的传输和接收的任何合适布置的网络链路,诸如无线网络连接、t1或t3线路、电缆网络、dsl或电话线路。
[0132]
装置300可以实现适用于在网络上运行的任何操作系统。hla模块350可以用任何合适的编程语言编写,诸如c、c 、java或python。在各种实施例中,体现本公开的功能性的应用软件可以以不同的配置被部署,诸如被部署在客户端/服务器布置中,或者例如通过
web浏览器被部署为基于web的应用程序或web服务。
[0133]
图3b示出了根据一个实施例的计算系统的实例。在系统400中,装置300(例如,如上所述并且如图3a所示)连接到网络404,该网络也连接到装置406。在一些实施例中,装置406为测序仪。示例性测序仪可包括但不限于:roche/454的基因组测序仪(gs)flx系统,illumina/solexa的基因组分析仪(ga),illumina的hiseq 2500、hiseq 3000、hiseq 4000和novaseq 6000测序系统,life/apg的支持寡核苷酸连接检测(solid)系统,polonator的g.007系统,helicos biosciences的heliscope基因测序系统或pacific biosciences的pacbio rs系统。装置300和406可以例如经由网络404(诸如局域网(lan)、虚拟专用网络(vpn)或因特网)使用合适的通信接口进行通信。在一些实施例中,网络404可以是例如因特网、内联网、虚拟专用网络、云网络、有线网络或无线网络。装置300和406可以部分或全部经由无线或硬连线通信(诸如以太网、ieee 802.11b无线等)进行通信。另外,装置300和406可以例如经由第二网络(诸如移动/蜂窝网络)使用合适的通信接口进行通信。装置300和406之间的通信可以进一步包括各种服务器或与各种服务器通信,诸如邮件服务器、移动服务器、媒体服务器、电话服务器等。在一些实施例中,装置300和406可以例如经由无线或硬连线通信(诸如以太网、ieee 802.11b无线等)直接通信(代替经由网络404进行通信或除此之外)。
[0134]
装置300和406中的一个或全部通常包括逻辑器件(例如,http web服务器逻辑器件)或被编程以格式化从本地或远程数据库或其他数据和内容源访问的数据,以用于根据本文所述的各种实例经由网络404提供和/或接收信息。
[0135]
人白细胞抗原(hla)和杂合性缺失(loh)
[0136]
在根据本文所述的实施例中任一项所述的一些实施例中,所述基因为对主要组织相容性(mhc)i类分子编码的人白细胞抗原(hla)基因。在一些实施例中,所述方法进一步包括在确定所述经调整的等位基因频率之后:至少部分地基于所述经调整的等位基因频率确定所述基因已经历杂合性缺失(loh)。在其他实施例中,所述基因为st7/ray1、arh1/noey2、tslc1、rb、pten、smad2、smad4、dcc、tp53、atm、mir-15a、mir-16-1、nat2、brca1、brca2、hogg1、cdh1、igf2、cdkn1c/p57、men1、prkar1a、h19、kras、bap1、ptch1、smo、sufu、notch1、ppp6c、lats1、casp8、ptpn14、arid1a、fbxw7、m6p/igf2r、ifn-α、嗅觉受体基因、cbfa2t3、dutt1、fhit、apc、p16、fcmd、tsc2、mir-34、c-mpl、runx3、diras3、nras、mir-9、fam50b、plagl1、er、flt3、zdbf2、gpr1、c-kit、nap1l5、grb10、egfr、peg10、braf、mest、jak2、dapk1、lit1、wt1、nf-1、pr、c-cbl、dlk1、akt1、snurf、细胞色素p450基因(cyp)、znf587、socs1、timp2、runx1、ar、cebpa、c19mc、emp3、znf331、cdkn2a、peg3、nnat、gnas或gata5。
[0137]
在又一些其他方面,本文提供了用于检测人白细胞抗原(hla)基因的杂合性缺失(loh)的方法。在一些实施例中,所述方法包括:a)获得针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸执行测序获得了所述多个序列读段;b)获得针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;c)应用目标函数以测量所
述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;d)应用优化模型以最小化所述目标函数;e)基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及f)确定当所述hla等位基因的所述经调整的等位基因频率小于预先确定的阈值时loh已经发生。在一些实施例中,所述hla基因为人hla-a基因、人hla-b基因或人hla-c基因。在一些实施例中,通过对从包括肿瘤细胞和/或肿瘤核酸的样品获得的核酸执行测序获得了所述多个序列读段。在一些实施例中,所述样品进一步包含非肿瘤细胞。在一些实施例中,所述方法用于检测目标多态性基因的杂合性缺失(loh)。在一些实施例中,所述方法包括:a)获得针对目标基因的等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与所述基因相对应的多个序列读段中检测到的对所述等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸执行测序获得了所述多个序列读段;b)获得针对所述等位基因对所述诱饵分子的相对结合倾向,其中所述等位基因的所述相对结合倾向对应于:对所述等位基因的至少一部分编码的核酸在存在对一个或多个其他等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;c)应用目标函数以测量所述等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;d)应用优化模型以最小化所述目标函数;e)基于所述优化模型和所述观察到的等位基因频率来确定所述等位基因的经调整的等位基因频率;以及f)确定当所述等位基因的所述经调整的等位基因频率小于预先确定的阈值时loh已经发生。在一些实施例中,所述多态性基因为st7/ray1、arh1/noey2、tslc1、rb、pten、smad2、smad4、dcc、tp53、atm、mir-15a、mir-16-1、nat2、brca1、brca2、hogg1、cdh1、igf2、cdkn1c/p57、men1、prkar1a、h19、kras、bap1、ptch1、smo、sufu、notch1、ppp6c、lats1、casp8、ptpn14、arid1a、fbxw7、m6p/igf2r、ifn-α、嗅觉受体基因、cbfa2t3、dutt1、fhit、apc、p16、fcmd、tsc2、mir-34、c-mpl、runx3、diras3、nras、mir-9、fam50b、plagl1、er、flt3、zdbf2、gpr1、c-kit、nap1l5、grb10、egfr、peg10、braf、mest、jak2、dapk1、lit1、wt1、nf-1、pr、c-cbl、dlk1、akt1、snurf、细胞色素p450基因(cyp)、znf587、socs1、timp2、runx1、ar、cebpa、c19mc、emp3、znf331、cdkn2a、peg3、nnat、gnas或gata5。
[0138]
在又一些其他方面,本公开的方法中的任一种方法进一步包括(例如,在本公开的包括肿瘤细胞和/或肿瘤核酸的样品中)测量tmb。在一些实施例中,所述方法包括(例如,在本公开的样品中)确定loh以及评估tmb。如本文所证明的,hla loh和高tmb(以及任选地完整hla基因)可以预测例如与没有高tmb的hla loh相比时的增加的总体存活期、增加的更大存活期概率和/或增加的对ici疗法产生应答的可能性。在一些实施例中,高tmb是指大于或等于10个突变/mb或者大于或等于13个突变/mb的tmb。在一些实施例中,tmb获自多个序列读段,例如,通过对基因组的至少一部分的核酸(诸如来自富集或非富集的样品)执行测序而获得的多个序列读段。在一些实施例中,基于每兆碱基经测序的基因组的非驱动基因体细胞编码突变的数量来确定tmb。
[0139]
在一些实施例中,本公开的方法中的任一种方法包括获取对于hla基因的loh的了解(例如,在从个体获得的样品中)以及获取对于tmb的了解(例如,在从个体获得的样品中)。在一些实施例中,本公开的方法中的任一种方法包括检测hla基因的loh(例如,在从个体获得的样品中)以及获取对于tmb的了解(例如,在从个体获得的样品中)。在一些实施例中,本公开的方法中的任一种方法包括获取对于hla基因的loh的了解(例如,在从个体获得
的样品中)以及检测或确定tmb(例如,在从个体获得的样品中)。在一些实施例中,本公开的方法中的任一种方法包括检测hla基因的loh(例如,在从个体获得的样品中)以及检测或确定tmb(例如,在从个体获得的样品中)。在一些实施例中,用于检测/确定loh和tmb的样品是相同的。在一些实施例中,用于检测/确定loh和tmb的样品是不同的。
[0140]
治疗和疗法
[0141]
在又一些其他方面,本文提供了识别患有癌症的个体的方法,其中人白细胞抗原(hla)基因的杂合性缺失(loh)指示患有特定类型疾病的所述个体对特定治疗产生应答的倾向。在一些实施例中,所述方法包括:检测来自所述个体的样品中的所述hla基因的loh,其中按照根据本文所述的实施例中任一项所述的方法来检测所述hla基因的loh。在一些实施例中,所述样品中的所述hla基因的loh指示所述个体不太可能受益于包含ici的治疗。在一些实施例中,检测到所述样品中不存在所述hla基因的loh指示所述个体可能受益于包含ici的治疗。在一些实施例中,所述方法进一步包括:检测从所述个体获得的样品中的肿瘤突变负荷(tmb)。在一些实施例中,所述方法进一步包括:获取对于从所述个体获得的样品中的高肿瘤突变负荷(tmb)的了解。在一些实施例中,所述hla基因的loh以及高tmb指示所述个体可能受益于包含ici的治疗。在一些实施例中,所述hla基因的loh以及低tmb或者所述hla基因的loh但没有高tmb指示所述个体不太可能受益于包含ici的治疗。
[0142]
在又一些其他方面,本文提供了选择针对患有癌症的个体的疗法的方法。在一些实施例中,所述方法包括:检测来自所述个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh),其中按照根据本文所述的实施例中任一项所述的方法检测所述hla基因的loh。在一些实施例中,所述样品中的所述hla基因的loh指示所述个体不太可能受益于包含ici的治疗。在一些实施例中,检测到所述样品中不存在所述hla基因的loh指示所述个体可能受益于包含ici的治疗。在一些实施例中,所述方法进一步包括:检测从所述个体获得的样品中的肿瘤突变负荷(tmb)。在一些实施例中,所述方法进一步包括:获取对于从所述个体获得的样品中的高肿瘤突变负荷(tmb)的了解。在一些实施例中,所述hla基因的loh以及高tmb指示所述个体可能受益于包含ici的治疗。在一些实施例中,所述hla基因的loh以及低tmb或者所述hla基因的loh但没有高tmb指示所述个体不太可能受益于包含ici的治疗。
[0143]
在又一些其他方面,本文提供了识别针对患有癌症的个体的一个或多个治疗选项的方法。在一些实施例中,所述方法包括:(a)获取对于来自所述个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中按照根据本文所述的实施例中任一项所述的方法检测所述hla基因的loh;以及(b)生成报告,所述报告包括至少部分地基于所述了解针对所述个体识别的一个或多个治疗选项。在一些实施例中,所述样品中的所述hla基因的loh指示所述个体不太可能受益于包含ici的治疗。在一些实施例中,所述一个或多个治疗选项不包括包含ici的治疗。在一些实施例中,所述方法包括:(a)获取对于来自所述个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中按照根据本文所述的实施例中任一项所述的方法检测不存在所述hla基因的loh;以及(b)生成报告,所述报告包括至少部分地基于所述了解针对所述个体识别的一个或多个治疗选项。在一些实施例中,所述样品中不存在所述hla基因的loh指示所述个体可能受益于包含ici的治疗。在一些实施例中,所述方法进一步包括:检测从所述个体获得的样品中的肿瘤突变负荷(tmb)。在一些实施例中,所述hla基因的loh以及高tmb指示所述个体可能受益于包含ici的治疗。在一些
实施例中,所述hla基因的loh以及低tmb或者所述hla基因的loh但没有高tmb指示所述个体不太可能受益于包含ici的治疗。在一些实施例中,所述方法进一步包括获取对于来自所述个体的样品中的高tmb的了解,并且所述一个或多个治疗选项包括包含ici的治疗。
[0144]
在又一些其他方面,本文提供了选择针对患有癌症的个体的治疗的方法。在一些实施例中,所述方法包括获取对于来自患有癌症的个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中按照根据本文所述的实施例中任一项所述的方法检测所述hla基因的loh。在一些实施例中,响应于所述了解的所述获取:(i)所述个体被归类为不接受用免疫检查点抑制剂(ici)进行治疗的候选者;(ii)所述个体被识别为不太可能对包含免疫检查点抑制剂(ici)的治疗产生应答;和/或(iii)所述个体被归类为接受除免疫检查点抑制剂(ici)之外的治疗的候选者。在一些实施例中,所述方法包括获取对于来自患有癌症的个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中按照根据本文所述的实施例中任一项所述的方法检测不存在所述hla基因的loh。在一些实施例中,响应于所述了解的所述获取:(i)所述个体被归类为接受用免疫检查点抑制剂(ici)进行治疗的候选者;和/或(ii)所述个体被识别为可能对包含免疫检查点抑制剂(ici)的治疗产生应答。在一些实施例中,所述方法包括:获取对于来自所述个体的样品中的人白细胞抗原(hla)基因的loh的了解以及获取对于来自所述个体的样品中的高肿瘤突变负荷(tmb)的了解。在一些实施例中,响应于所述了解的所述获取:(i)所述个体被归类为接受用免疫检查点抑制剂(ici)进行治疗的候选者;和/或(ii)所述个体被识别为可能对包含免疫检查点抑制剂(ici)的治疗产生应答。
[0145]
在又一些其他方面,本文提供了预测接受用免疫检查点抑制剂(ici)进行治疗的患有癌症的个体的存活期的方法。在一些实施例中,所述方法包括获取对于来自所述个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中按照根据本文所述的实施例中任一项所述的方法检测所述hla基因的loh。在一些实施例中,响应于所述了解的所述获取,预测所述个体在接受用所述ici进行治疗后与接受用所述ici进行治疗的其癌症未表现出所述hla基因的loh的个体的存活期相比具有较短的存活期。在一些实施例中,所述方法包括获取对于来自所述个体的样品中不存在人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中按照根据本文所述的实施例中任一项所述的方法检测不存在所述hla基因的loh。在一些实施例中,响应于所述了解的所述获取,预测所述个体在接受用所述ici进行治疗后与接受用所述ici进行治疗的其癌症表现出所述hla基因的loh的个体的存活期相比具有较长的存活期。在一些实施例中,所述方法包括获取对于来自所述个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解以及获取对于来自所述个体的样品中的高肿瘤突变负荷(tmb)的了解,其中按照根据本文所述的实施例中任一项所述的方法检测所述hla基因的loh。在一些实施例中,响应于所述了解的所述获取,预测所述个体在接受用所述ici进行治疗后与接受用所述ici进行治疗的其癌症具有所述hla基因的loh但没有高tmb的个体的存活期相比具有较长的存活期。
[0146]
在根据本文所述的实施例中任一项所述的一些实施例中,所述hla基因的loh通过以下方式来确定:a)获得针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其
一部分的核酸执行测序获得了所述多个序列读段;b)获得针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;c)确定目标函数,所述目标函数测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;d)确定优化模型,所述优化模型被配置为最小化所述目标函数;e)基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及f)确定当所述hla等位基因的所述经调整的等位基因频率小于预先确定的阈值时loh已经发生。
[0147]
在又一些其他方面,本文提供了治疗癌症或延缓癌症进展的方法。在一些实施例中,所述方法包括:(1)检测从个体获得的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh),其中所述hla基因的loh通过以下方式来检测:a)获得针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸执行测序获得了所述多个序列读段;b)获得针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;c)应用目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;d)应用优化模型以最小化所述目标函数;e)基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及f)确定当所述hla等位基因的所述经调整的等位基因频率小于预先确定的阈值时loh已经发生;以及(2)至少部分地基于检测到所述hla基因的loh,向所述个体施用有效量的除免疫检查点抑制剂(ici)之外的治疗。在一些实施例中,所述方法包括:(1)检测从个体获得的样品中不存在人白细胞抗原(hla)基因的杂合性缺失(loh),其中不存在所述hla基因的loh通过以下方式来检测:a)获得针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸执行测序获得了所述多个序列读段;b)获得针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;c)应用目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;d)应用优化模型以最小化所述目标函数;e)基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及f)确定当所述hla等位基因的所述经调整的等位基因频率大于预先确定的阈值时loh尚未发生;以及(2)至少部分地基于检测到不存在所述hla基因的loh,向所述个体施用有效量的免疫检查点抑制剂(ici)。
[0148]
本公开的某些方面涉及免疫检查点抑制剂(ici)。如本领域已知的,检查点抑制剂靶向至少一种免疫检查点蛋白以改变免疫应答的调节。免疫检查点蛋白包括例如ctla4、pd-l1、pd-1、pd-l2、vista、b7-h2、b7-h3、b7-h4、b7-h6、2b4、icos、hvem、ceacam、lair1、
cd80、cd86、cd276、vtcn1、i类mhc、ii类mhc、gals、腺嘌呤核苷、tgfr、csf1r、mica/b、精氨酸酶、cd160、gp49b、pir-b、kir家族受体、tim-1、tim-3、tim-4、lag-3、btla、sirpalpha(cd47)、cd48、2b4(cd244)、b7.1、b7.2、ilt-2、ilt-4、tigit、lag-3、btla、ido、ox40和a2ar。在一些实施例中,调节免疫检查点中涉及的分子包括但不限于:pd-1(cd279)、pd-l1(b7-h1,cd274)、pd-l2(b7-cd,cd273)、ctla-4(cd152)、hvem、btla(cd272)、杀伤细胞免疫球蛋白样受体(kir)、lag-3(cd223)、tim-3(havcr2)、ceacam、ceacam-1、ceacam-3、ceacam-5、gal9、vista(pd-1h)、tigit、lair1、cd160、2b4、tgfrbeta、a2ar、gitr(cd357)、cd80(b7-1)、cd86(b7-2)、cd276(b7-h3)、vtcni(b7-h4)、i类mhc、ii类mhc、gals、腺嘌呤、tgfr、b7-h1、ox40(cd134)、cd94(klrd1)、cd137(4-1bb)、cd137l(4-1bbl)、cd40、ido、csf1r、cd40l、cd47、cd70(cd27l)、cd226、hhla2、icos(cd278)、icosl(cd275)、light(tnfsf14,cd258)、nkg2a、nkg2d、ox40l(cd134l)、pvr(necl5,cd155)、sirpa、mica/b和/或精氨酸酶。在一些实施例中,免疫检查点抑制剂(即,检查点抑制剂)降低负调节免疫细胞功能的检查点蛋白的活性,例如,以便增强t细胞活化和/或抗癌免疫应答。在其他实施例中,检查点抑制剂增加正调节免疫细胞功能的检查点蛋白的活性,例如,以便增强t细胞活化和/或抗癌免疫应答。在一些实施例中,检查点抑制剂为抗体。检查点抑制剂的实例包括但不限于pd-1轴结合拮抗剂、pd-l1轴结合拮抗剂(例如,抗pd-l1抗体,例如阿特珠单抗(mpdl3280a))、针对共抑制分子的拮抗剂(例如,ctla4拮抗剂(例如,抗ctla4抗体)、tim-3拮抗剂(例如,抗tim-3抗体)或lag-3拮抗剂(例如,抗lag-3抗体))或其任意组合。在一些实施例中,免疫检查点抑制剂包括药物,诸如小分子、重组形式的配体或受体或者抗体,诸如人抗体(参见例如国际专利公开w02015016718;pardoll,nat rev cancer,12(4):252-64,2012;均以引用方式并入本文)。在一些实施例中,可以使用已知的免疫检查点蛋白抑制剂或其类似物,特别是可以使用嵌合、人源化或人形式的抗体。
[0149]
在根据本文所述的实施例中任一项所述的一些实施例中,所述ici包括pd-1拮抗剂/抑制剂或pd-l1拮抗剂/抑制剂。
[0150]
在一些实施例中,该检查点抑制剂为pd-l1轴结合拮抗剂,例如pd-1结合拮抗剂、pd-l1结合拮抗剂或pd-l2结合拮抗剂。pd-1(程序性死亡1)在本领域中也称为“程序性细胞死亡1”、“pdcd1”、“cd279”和“sleb2”。示例性人pd-1显示在uniprotkb/swiss-prot登录号q15116中。pd-l1(程序性死亡配体1)在本领域中也称为“程序性细胞死亡1配体1”、“pdcd1 lg1”、“cd274”、“b7-h”和“pdl1”。示例性人pd-l1显示在uniprotkb/swiss-prot登录号q9nzq7.1中。pd-l2(程序性死亡配体2)在本领域中也称为“程序性细胞死亡1配体2”、“pdcd1 lg2”、“cd273”、“b7-dc”、“btdc”和“pdl2”。示例性人pd-l2显示在uniprotkb/swiss-prot登录号q9bq51中。在一些情况下,pd-1、pd-l1和pd-l2是人pd-1、pd-l1和pd-l2。
[0151]
在一些情况下,pd-1结合拮抗剂/抑制剂为抑制pd-1与其配体结合配偶体结合的分子。在具体实施例中,pd-1配体结合配偶体为pd-l1和/或pd-l2。在另一情况下,pd-l1结合拮抗剂/抑制剂为抑制pd-l1与其结合配体结合的分子。在具体实施例中,pd-l1结合配偶体为pd-1和/或b7-1。在另一情况下,pd-l2结合拮抗剂是抑制pd-l2与其配体结合配偶体结合的分子。在具体实施例中,pd-l2结合配体配偶体为pd-1。拮抗剂可以为抗体、其抗原结合片段、免疫粘附素、融合蛋白或寡肽。在一些实施例中,pd-1结合拮抗剂为小分子、核酸、多肽(例如,抗体)、碳水化合物、脂质、金属或毒素。
[0152]
在一些情况下,pd-1结合拮抗剂是抗pd-1抗体(例如,人抗体、人源化抗体或嵌合抗体),例如,如下文所述。在一些情况下,抗pd-1抗体为mdx-1 106(纳武单抗)、mk-3475(派姆单抗,)、medi-0680(amp-514)、pdr001、regn2810 mga-012、jnj-63723283、bi 754091或bgb-108。在其他情况下,pd-1结合拮抗剂为免疫粘附素(例如,包括与恒定区(例如,免疫球蛋白序列的fc区)融合的pd-l1或pd-l2的细胞外或pd-1结合部分的免疫粘附素)。在一些情况下,pd-1结合拮抗剂是amp-224。抗pd-1抗体的其他实例包括但不限于medi-0680(amp-514;astrazeneca)、pdr001(cas registry no.1859072-53-9;novartis)、regn2810(或cemiplimab-rwlc;regeneron)、bgb-108(beigene)、bgb-a317(beigene)、bi 754091、js-001(shanghai junshi)、sti-a1110(sorrento)、incshr-1210(incyte)、pf-06801591(pfizer)、tsr-042(也称为anb011;tesaro/anaptysbio)、am0001(armo biosciences)、enum 244c8(enumeral biomedical holdings)或enum 388d4(enumeral biomedical holdings)。在一些实施例中,该pd-1轴结合拮抗剂包括替雷利珠单抗(bgb-a317)、bgb-108、sti-a1110、am0001、bi 754091、信迪利单抗(ibi308)、西利单抗(jnj-63723283)、特瑞普利单抗(js-001)、卡瑞利珠单抗(shr-1210,incshr-1210,hr-301210)、medi-0680(amp-514)、mga-012(incmga 0012)、纳武单抗(bms-936558,mdx1106,ono-4538)、spartalizumab(pdr00l)、派姆单抗(mk-3475,sch 900475,)、pf-06801591、西米普利单抗(regn-2810,regen2810)、多塔利单抗(tsr-042,anb011)、fitc-yt-16(pd-1结合肽)、apl-501或cbt-501或genolimzumab(gb-226)、ab-122、ak105、amg 404、bcd-100、f520、hlx10、hx008、jtx-4014、lzm009、sym021、psb205、amp-224(融合蛋白靶向pd-1)、cx-188(pd-1probody)、agen-2034、gls-010、布格利单抗(abbv-181)、ak-103、bat-1306、cs-1003、am-0001、tilt-123、bh-2922、bh-2941、bh-2950、enum-244c8、enum-388d4、hab-21、h eiscoi 11-003、ikt-202、mcla-134、mt-17000、pegmp-7、prs-332、rxi-762、sti-1110、vxm-10、xmab-23104、ak-112、hlx-20、ssi-361、at-16201、sna-01、ab122、pd1-pik、pf-06936308、rg-7769、cab pd-1abs、ak-123、medi-3387、medi-5771、4h1128z-e27、remd-288、sg-001、by-24.3、cb-201、ibi-319、oncr-177、max-1、cs-4100、jbi-426、ccc-0701或ccx-4503或其衍生物。
[0153]
在一些实施例中,pd-l1结合拮抗剂是抑制pd-1的小分子。在一些实施例中,pd-l1结合拮抗剂是抑制pd-l1的小分子。在一些实施例中,pd-l1结合拮抗剂是抑制pd-l1和vista或pd-l1和tim3的小分子。在一些实施例中,pd-l1结合拮抗剂是ca-170(也称为aupm-170)。在一些实施例中,pd-l1结合拮抗剂是抗pd-l1抗体。在一些实施例中,抗pd-l1抗体可以结合人pd-l1,例如uniprotkb/swiss-prot登录号q9nzq7.1中所示的人pd-l1,或其变体。在一些实施例中,pd-l1结合拮抗剂为小分子、核酸、多肽(例如,抗体)、碳水化合物、脂质、金属或毒素。
[0154]
在一些情况下,例如,如下所述,pd-l1结合拮抗剂是抗pd-l1抗体。在一些情况下,抗pd-l1抗体能够抑制pd-l1与pd-1之间和/或pd-l1与b7-1之间的结合。在一些情况下,抗pd-l1抗体是单克隆抗体。在一些情况下,抗pd-l1抗体是选自fab、fab
′‑
sh、fv、scfv或(fab
′
)2片段的抗体片段。在一些情况下,抗pd-l1抗体是人源化抗体。在一些情况下,抗pd-l1抗体是人抗体。在一些情况下,抗pd-l1抗体选自yw243.55.s70、mpdl3280a(阿特珠单抗)、mdx-1 105、medi4736(德瓦鲁单抗)或msb0010718c(阿维鲁单抗)。在一些实施例中,该
pd-l1轴结合拮抗剂包括阿特珠单抗、阿维鲁单抗、德瓦鲁单抗(imfinzi)、bgb-a333、shr-1316(hti-1088)、ck-301、bms-936559、恩弗利单抗(kn035、asc22)、cs1001、mdx-1105(bms-936559)、ly3300054、sti-a1014、faz053、cx-072、incb086550、gns-1480、ca-170、ck-301、m-7824、hti-1088(hti-131、shr-1316)、msb-2311、ak-106、ava-004、bbi-801、ca-327、cba-0710、cbt-502、fpt-155、ikt-201、ikt-703、10-103、js-003、kd-033、ky-1003、mcla-145、mt-5050、sna-02、bcd-135、apl-502(cbt-402或tqb2450)、imc-001、kd-045、inbrx-105、kn-046、imc-2102、imc-2101、kd-005、imm-2502、89zr-cx-072、89zr-dfo-6e11、ky-1055、medi-1109、mt-5594、sl-279252、dsp-106、gensci-047、remd-290、n-809、prs-344、fs-222、gen-1046、bh-29xx或fs-118或其衍生物。
[0155]
在一些实施例中,检查点抑制剂是ctla4的拮抗剂/抑制剂。在一些实施例中,检查点抑制剂是ctla4的小分子拮抗剂。在一些实施例中,检查点抑制剂为抗ctla4抗体。ctla4是免疫检查点分子cd28-b7免疫球蛋白超家族的一部分,可负向调节t细胞活化,尤其是cd28依赖性t细胞应答。ctla4与cd28竞争结合常见的配体,诸如cd80(b7-1)和cd86(b7-2),并以比cd28更高的亲和力与这些配体结合。阻断ctla4活性(例如,使用抗ctla4抗体)被认为可增强cd28介导的共刺激(导致t细胞活化/启动增加)、影响t细胞发育和/或消耗tregs(诸如肿瘤内tregs)。在一些实施例中,ctla4拮抗剂是小分子、核酸、多肽(例如,抗体)、碳水化合物、脂质、金属或毒素。在一些实施例中,ctla-4抑制剂包括伊匹木单抗(ibi310、bms-734016、mdx010、mdx-ctla4、medi4736)、曲美木单抗(cp-675、cp-675,206)、apl-509、agen1884、cs1002、agen1181、阿巴西普(orencia,bms-188667,rg2077)、bcd-145、onc-392、adu-1604、regn4659、adg116、kn044、kn046或其衍生物。
[0156]
在一些实施例中,抗pd-1抗体或抗体片段是mdx-1106(纳武单抗)、mk-3475(派姆单抗,)、medi-0680(amp-514)、pdr001、regn2810、mga-012、jnj-63723283、bi 754091、bgb-108、bgb-a317、js-001、sti-a1110、incshr-1210、pf-06801591、tsr-042、am0001、enum 244c8或enum 388d4。在一些实施例中,pd-1结合拮抗剂是抗pd-1免疫粘附素。在一些实施例中,抗pd-1免疫粘附素是amp-224。在一些实施例中,抗pd-l1抗体或抗体片段是yw243.55.s70、mpdl3280a(阿特珠单抗)、mdx-1105、medi4736(德瓦鲁单抗)、msb0010718c(阿维鲁单抗)、ly3300054、sti-a1014、kn035、faz053或cx-072。
[0157]
在一些实施例中,免疫检查点抑制剂包括lag-3抑制剂(例如,抗体、抗体缀合物或其抗原结合片段)。在一些实施例中,lag-3抑制剂包括小分子、核酸、多肽(例如,抗体)、碳水化合物、脂质、金属或毒素。在一些实施例中,lag-3抑制剂包括小分子。在一些实施例中,lag-3抑制剂包括lag-3结合剂。在一些实施例中,lag-3抑制剂包括抗体、抗体缀合物或其抗原结合片段。在一些实施例中,lag-3抑制剂包括eftilagimodα(imp321、imp-321、eddp-202、eoc-202)、瑞拉利单抗(bms-986016)、gsk2831781(imp-731)、lag525(imp701)、tsr-033、evip321(可溶性lag-3蛋白)、bi 754111、imp761、regn3767、mk-4280、mgd-013、xmab22841、incagn-2385、enum-006、ava-017、am-0003、ionctura抗-lag-3抗体、arcus biosciences lag-3抗体、sym022、其衍生物或与前述任意一种竞争的抗体。
[0158]
在一些实施例中,抗癌疗法包括免疫调节分子或细胞因子。在一些实施例中,本文提供的方法包括向个体施用免疫调节分子或细胞因子,例如,与另一种抗癌疗法组合。需要免疫调节谱来触发有效的免疫应答并平衡受试者的免疫。合适的免疫调节细胞因子的实例
包括但不限于干扰素(例如,ifnα、ifnβ和ifnγ)、白细胞介素(例如,il-1、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-9、il-10、il-12和il-20)、肿瘤坏死因子(例如,tnfα和tnfβ)、促红细胞生成素(epo)、flt-3配体、gip10、tca-3、mcp-1、mif、mip-1α、mip-1β、rantes、巨噬细胞集落刺激因子(m-csf)、粒细胞集落刺激因子(g-csf)和粒细胞-巨噬细胞集落刺激因子(gm-csf)以及其功能片段。在一些实施例中,与趋化因子受体(即,cxc、cc、c或cx3c趋化因子受体)结合的任何免疫调节趋化因子都可用于本公开的上下文中。趋化因子的实例包括但不限于mip-3α(lax)、mip-3β、hcc-1、mpif-1、mpif-2、mcp-2、mcp-3、mcp-4、mcp-5、eotaxin、tarc、elc、i309、il-8、gcp-2groα、gro-β、nap-2、ena-78、ip-10、mig、i-tac、sdf-1或bca-1(blc)以及其功能片段。在一些实施例中,免疫调节分子包括在本文提供的治疗中的任何治疗中。
[0159]
在一些实施例中,免疫检查点抑制剂是单价的和/或单特异性的。在一些实施例中,免疫检查点抑制剂是多价的和/或多特异性的。
[0160]
在一些实施例中,该方法包括施用第二治疗剂。在一些实施例中,第二药剂是除ici(例如,如下文所述)或第二ici(例如,如上文所述)之外的药剂。
[0161]
在一些实施例中,该方法包括施用除ici之外的药剂。在一些实施例中,该药剂包括化疗剂、抗激素剂、抗代谢物化疗剂、激酶抑制剂、肽、基因疗法、疫苗、铂基化疗剂、免疫疗法或抗体。
[0162]
在一些实施例中,抗癌疗法包括化学疗法。在一些实施例中,本文提供的方法包括向个体施用化学疗法,例如,与另一种抗癌疗法相组合。化疗剂的实例包括烷化剂,诸如噻替哌和环磷酰胺;烷基磺酸盐,诸如白消安、英丙舒凡和哌泊舒凡;氮杂环丙烷类,诸如苯佐替哌、卡波醌、美妥替哌和乌瑞替哌;乙烯亚胺类和甲基蜜胺类,包括六甲蜜胺、曲他胺、三亚乙基磷酰胺、三亚乙基硫代磷酰胺和三羟甲基蜜胺;多聚乙酰(尤其是布拉它辛和布拉它辛酮);喜树碱(包括合成类似物拓扑替康);苔藓抑素;卡利他汀;cc-1065(包括其阿多来新、卡折来新和比折来新合成类似物);念珠藻素(特别是念珠藻素1和念珠藻素8);多拉司他汀;杜卡霉素(包括合成类似物kw-2189和cb1-tm1);五加素;水鬼蕉碱;匍枝珊瑚醇;海绵抑素;氮芥类,诸如苯丁酸氮芥、氯苯哌嗪、氯磷酰胺、雌莫司汀、异环磷酰胺、甲氮芥、盐酸甲氧氮芥、美法仑、新氮芥、苯芥胆甾醇、泼尼氮芥、曲洛磷胺、乌拉莫司汀;亚硝基脲类,诸如卡莫司汀、氯脲霉素、福莫司汀、洛莫司汀、尼莫司汀和雷莫司汀;抗生素,诸如烯二炔类抗生素(例如加利车霉素,尤其是加利车霉素γll和加利车霉素ωll);达尼霉素,包括达尼霉素a;双膦酸盐,诸如氯膦酸盐;艾司米星;以及新抑癌菌素发色团和相关的发色蛋白烯二炔类抗生素发色团、阿克拉霉素、放线菌素、氨茴霉素、偶氮丝氨酸、博来霉素、放线菌素、卡柔比星、洋红霉素、嗜癌素、色霉素、更生霉素、道诺霉素、地托比星、6-叠氮-5-氧代-l-正亮氨酸、阿霉素(包括吗啉代-阿霉素、氰基吗啉代-阿霉素、2-吡咯啉合-阿霉素和脱氧阿霉素)、表柔比星、伊索比星、伊达比星、马塞罗霉素、丝裂霉素(诸如丝裂霉素c)、霉酚酸、诺加霉素、橄榄霉素、培洛霉素、甲基丝裂霉素、嘌呤霉素、三铁阿霉素、罗多比星、链黑菌素、链脲佐菌素、杀结核菌素、乌苯美司、净司他汀和佐柔比星;抗代谢物,诸如甲氨蝶呤和5-氟尿嘧啶(5-fu);叶酸类似物,诸如二甲叶酸、喋罗呤、三甲曲沙;嘌呤类似物,诸如氟达拉滨、6-巯基嘌呤、硫咪嘌呤和硫鸟嘌呤;嘧啶类似物,诸如安西他滨、阿扎胞苷、6-氮杂尿苷、卡莫氟、阿糖胞苷、双脱氧尿苷、多西氟啶、依诺他宾和氟尿苷;雄激素,诸如卡普睾酮、丙酸屈他
雄酮、环硫雄醇、美雄烷和睾内酯;抗肾上腺素类药物,诸如米托坦和曲洛斯坦;叶酸补充剂,诸如亚叶酸;醋葡醛内酯;醛磷酰胺糖苷;氨基乙酰丙酸;恩尿嘧啶;安吖啶;倍曲布西;比生群;依达曲沙;地磷酰胺;秋水仙胺;亚胺醌;依洛尼塞;依利醋铵;埃博霉素;乙环氧啶;硝酸镓;羟基脲;香菇多糖;氯尼达明;美登木素生物碱,诸如美登素和安丝菌素;米托胍腙;米托蒽醌;莫哌达醇;二胺硝吖啶;喷司他汀;蛋氨氮芥;吡柔比星;洛索蒽醌;鬼臼酸;2-乙基肼;甲基苄肼;psk多糖复合物;雷佐生;根霉素;裂裥菌素;锗螺胺;细交链孢菌酮酸;三亚胺醌;2,2',2
”‑
三氯三乙胺;单端孢霉烯族毒素(尤其是t-2毒素、维拉库林a、漆斑菌素a和蛇形菌素);尿烷;长春地辛;达卡巴嗪;甘露醇氮芥;二溴甘露醇;二溴卫矛醇;哌泊溴烷;加西托星;阿拉伯糖苷(“ara-c”);环磷酰胺;紫杉烷类,例如,紫杉醇和多西他赛吉西他滨;6-硫鸟嘌呤;巯基嘌呤;铂配位配合物,诸如顺铂、奥沙利铂和卡铂;长春花碱;铂;依托泊苷(vp-16);异环磷酰胺;米托蒽醌;长春新碱;长春瑞滨;诺万隆;替尼泊苷;依达曲塞;道诺霉素;氨基蝶呤;卡培他滨;伊班膦酸盐;伊立替康(例如,cpt-ll);拓扑异构酶抑制剂rfs 2000;二氟甲基鸟氨酸(dmfo);维甲酸类,诸如视黄酸;卡培他滨;卡铂、甲基苄肼、普利霉素、吉西他滨、长春瑞滨、法尼基蛋白转移酶抑制剂、转铂和上述任何物质的药用盐、酸或衍生物。
[0163]
可以与本公开的抗癌疗法组合的化疗药物的一些非限制性实例是卡铂(paraplatin)、顺铂(platinol、platinol-aq)、环磷酰胺(cytoxan、neosar)、多西他赛(taxotere)、多柔比星(adriamycin)、厄洛替尼(tarceva)、依托泊苷(vepesid)、氟尿嘧啶(5-fu)、吉西他滨(gemzar)、甲磺酸伊马替尼(gleevec)、伊立替康(camptosar)、甲氨蝶呤(folex、mexate、amethopterin)、紫杉醇(taxol、abraxane)、索拉非尼(nexavar)、舒尼替尼(sutent)、拓扑替康(hycamtin)、长春新碱(oncovin、vincasar pfs)和长春花碱(velban)。
[0164]
在一些实施例中,抗癌疗法包括激酶抑制剂。在一些实施例中,本文提供的方法包括向个体施用激酶抑制剂,例如,与另一种抗癌疗法相组合。激酶抑制剂的实例包括靶向一种或多种受体酪氨酸激酶的那些,例如,bcr-abl、b-raf、egfr、her-2/erbb2、igf-ir、pdgfr-a、pdgfr-β、ckit、flt-4、flt3、fgfr1、fgfr3、fgfr4、csf1r、c-met、ron、c-ret或alk;靶向一种或多种细胞质酪氨酸激酶的那些,例如,c-src、c-yes、abl或jak-2;靶向一种或多种丝氨酸/苏氨酸激酶的那些,例如,atm、aurora a&b、cdks、mtor、pkci、plks、b-raf、s6k或stk11/lkb1;或靶向一种或多种脂质激酶的那些,例如,pi3k或ski。小分子激酶抑制剂包括pha-739358、尼洛替尼、达沙替尼、pd166326、nsc 743411、拉帕替尼(gw-572016)、卡那替尼(ci-1033)、司马沙尼(su5416)、瓦他拉尼(ptk787/zk222584)、索坦(su1 1248)、索拉非尼(bay 43-9006)或来氟米特(su101)。酪氨酸激酶抑制剂的附加的非限制性实例包括伊马替尼(格列卫/基利克)和吉非替尼(易瑞沙)。
[0165]
在一些实施例中,抗癌疗法包括抗血管生成剂。在一些实施例中,本文提供的方法包括向个体施用抗血管生成剂,例如,与另一种抗癌疗法相组合。血管生成抑制剂可防止肿瘤生存所需的血管广泛生长(血管生成)。可用于本公开的方法中的血管生成介导分子或血管生成抑制剂的非限制性实例包括可溶性vegf(例如:vegf同种型,例如,vegf121和vegf165;vegf受体,例如,vegfr1、vegfr2;以及共受体,例如,神经纤毛蛋白-1和神经纤毛蛋白-2)、nrp-1、血管生成素2、tsp-1和tsp-2、血管抑素及相关分子、内皮细胞抑制素、血管生成抑素、钙网蛋白、血小板因子-4、timp和cdai、甲基-1和甲基-2、ifnα、ifn-β和ifn-γ、
cxcl10、il-4、il-12和il-18、凝血酶原(三环结构域-2)、抗凝血酶iii片段、催乳素、vegi、sparc、骨桥蛋白、乳腺丝抑蛋白、血管能抑素、多育曲菌素相关蛋白、休眠蛋白和药物,诸如贝伐单抗、伊曲康唑、羧胺三唑、tnp-470、cm101、ifn-α、血小板因子-4、苏拉明、su5416、血小板反应蛋白、vegfr拮抗剂、血管抑制类固醇和肝素、软骨源性血管生成抑制因子、基质金属蛋白酶抑制剂、2-甲氧基雌二醇、替可加兰、四硫代钼酸盐、沙利度胺、血小板反应蛋白、催乳素νβ3抑制剂、利诺胺和他喹莫德。在一些实施例中,根据本公开的方法可使用的已知治疗候选物包括天然存在的血管生成抑制剂,包括但不限于血管抑制素、内皮抑制素或血小板因子-4。在另一个实施例中,根据本公开的方法可使用的治疗候选物包括但不限于内皮细胞生长的特异性抑制剂,诸如tnp-470、沙利度胺和白细胞介素-12。根据本公开的方法可使用的其他抗血管生成剂包括中和血管生成分子的那些,包括但不限于成纤维细胞生长因子的抗体、血管内皮生长因子的抗体、血小板衍生生长因子的抗体、或者egf vegf或pdgf的受体的抗体或其他类型的抑制剂。在一些实施例中,根据本公开的方法可使用的抗血管生成剂包括但不限于苏拉明及其类似物以及替可加兰。在其他实施例中,根据本公开的方法可使用的抗血管生成剂包括但不限于中和血管生成因子受体的药剂或干扰血管基底膜和细胞外基质的药剂,包括但不限于金属蛋白酶抑制剂和血管抑制类固醇。根据本公开的方法可使用的另一组抗血管生成化合物包括但不限于抗粘附分子,诸如针对整联蛋白αvβ3的抗体。根据本公开的方法可使用的其他抗血管生成化合物或组合物包括但不限于激酶抑制剂、沙利度胺、伊曲康唑、羧胺三唑、cm101、ifn-α、il-12、su5416、血小板反应蛋白、软骨源性血管生成抑制因子、2-甲氧基雌二醇、四硫代钼酸盐、血小板反应蛋白、催乳素和利诺胺。在一个具体实施例中,根据本公开的方法可使用的抗血管生成化合物是针对vegf的抗体,诸如贝伐单抗(genentech)。
[0166]
在一些实施例中,抗癌疗法包括抗dna修复疗法。在一些实施例中,本文提供的方法包括向个体施用抗dna修复疗法,例如,与另一种抗癌疗法相组合。在一些实施例中,抗dna修复疗法为parp抑制剂(例如,他拉唑帕尼、卢卡帕尼、奥拉帕尼)、rad51抑制剂(例如,ri-1)或dna损伤应答激酶抑制剂,例如,chck1(例如,azd7762)、atm(例如,ku-55933、ku-60019、nu7026或ve-821)和atr(例如,nu7026)。
[0167]
在一些实施例中,抗癌疗法包括放射增敏剂。在一些实施例中,本文提供的方法包括向个体施用放射增敏剂,例如,与另一种抗癌疗法相组合。示例性辐射增敏剂包括缺氧辐射增敏剂,诸如米索硝唑、甲硝唑和藏红花酸二钠盐,一种有助于增加氧气扩散到缺氧肿瘤组织中的化合物。辐射增敏剂也可以是干扰碱基切除修复(ber)、核苷酸切除修复(ner)、错配修复(mmr)、包括同源重组(hr)和非同源末端连接(nhej)的重组修复和直接修复机制的dna损伤应答抑制剂。单链断裂(ssb)修复机制包括ber、ner或mmr途径,而双链断裂(dsb)修复机制包括hr和nhej途径。辐射导致dna断裂,如果不加以修复,就会致命。使用完整的dna链作为模板,通过ber、ner和mmr机制的组合修复ssb。ssb修复的主要途径是利用称为聚(adp-核糖)聚合酶(parp)的相关酶家族的ber。因此,辐射增敏剂可以包括dna损伤应答抑制剂,诸如parp抑制剂。
[0168]
在一些实施例中,抗癌疗法包括抗炎剂。在一些实施例中,本文提供的方法包括向个体施用抗炎剂,例如,与另一种抗癌疗法相组合。在一些实施例中,抗炎剂是阻断、抑制或降低炎症或来自炎症信号通路的信号的药剂。在一些实施例中,抗炎剂抑制或降低以下任
意一种或多种的活性:il-1、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-9、il-10、il-12、il-13、il-15、il-18、il-23;干扰素(ifn),例如,ifnα、ifnβ、ifnγ、ifn-γ诱导因子(igif);转化生长因子-β(tgf-β);转化生长因子-α(tgf-α);肿瘤坏死因子,例如,tnf-α、tnf-β、tnf-ri、tnf-rii;cd23;cd30;cd40l;egf;g-csf;gdnf;pdgf-bb;rantes/ccl5;ikk;nf-κb;tlr2;tlr3;tlr4;tl5;tlr6;tlr7;tlr8;tlr8;tlr9;和/或其任何同源受体。在一些实施例中,抗炎剂是il-1或il-1受体拮抗剂,诸如阿那白滞素利纳西普或卡纳单抗。在一些实施例中,抗炎剂是il-6或il-6受体拮抗剂,例如抗il-6抗体或抗il-6受体抗体,诸如托珠单抗奥洛组单抗、克拉扎珠单抗、沙利姆单抗、西鲁库单抗、司妥昔单抗或alx-0061。在一些实施例中,抗炎剂是tnf-α拮抗剂,例如,抗tnfα抗体,诸如英夫利昔单抗戈利木单抗阿达木单抗聚乙二醇结合赛妥珠单抗或依那西普。在一些实施例中,抗炎剂是皮质类固醇。示例性皮质类固醇包括但不限于可的松(氢化可的松、氢化可的松磷酸钠、氢化可的松琥珀酸钠、hydrocort磷酸氢化可酮)、地卡特隆(地塞米松、醋酸地塞米松、地塞米松磷酸钠、卡特隆(地塞米松、醋酸地塞米松、地塞米松磷酸钠、)、甲基强的松龙(6-甲基强的松龙、醋酸甲基强的松龙、甲基强的松龙琥珀酸钠、松龙琥珀酸钠、)、强的松龙(强的松龙()和泼尼松()和泼尼松()和双膦酸盐(例如,帕米膦酸盐和唑来膦酸)。
[0169]
在一些实施例中,抗癌疗法包括抗激素剂。在一些实施例中,本文提供的方法包括向个体施用抗激素剂,例如,与另一种抗癌疗法相组合。抗激素剂是用于调节或抑制激素对肿瘤的作用的药剂。抗激素剂的实例包括:抗雌激素和选择性雌激素受体调节剂(serm),包括例如他莫昔芬(包括他莫昔芬)、雷洛昔芬、屈洛昔芬、4-羟基他莫昔芬、曲沃昔芬、keoxifene、ly117018、奥那司酮和托瑞米芬;抑制对肾上腺中的雌激素产生进行调节的酶芳香化酶的芳香化酶抑制剂,诸如,例如4(5)-咪唑类、氨鲁米特、醋酸甲地孕酮、依西美坦、福美司坦、法屈唑、伏氯唑、来曲唑和(阿那曲唑);抗雄激素,诸如氟他胺、尼鲁米特、比卡鲁胺、亮丙瑞林和戈舍瑞林;曲沙他滨(一种1,3-二氧戊环核苷胞嘧啶类似物);反义寡核苷酸,特别是抑制与异常细胞增殖有关的信号通路中的基因表达的那些,诸如,例如pkc-α、raf、h-ras和表皮生长因子受体(egf-r);疫苗,诸如基因疗法疫苗,例如,疫苗、疫苗和疫苗;拓扑异构酶1抑制剂;rmrh;以及上述任何物质的药用盐、酸或衍生物。
[0170]
在一些实施例中,抗癌疗法包括抗代谢物化疗剂。在一些实施例中,本文提供的方法包括向个体施用抗代谢物化疗剂,例如,与另一种抗癌疗法相组合。抗代谢物化疗剂是在结构上与代谢物相似但不能被身体以生产方式使用的药剂。许多抗代谢物化疗剂会干扰rna或dna的产生。抗代谢物化疗剂的实例包括吉西他滨5-氟尿嘧啶(5-fu)、
卡培他滨(xeloda
tm
)、6-巯基嘌呤、甲氨蝶呤、6-硫鸟嘌呤、培美曲塞、雷替曲塞、阿糖胞嘧啶ara-c阿糖胞苷达卡巴嗪(dtic-domed)、偶氮胞嘧啶、脱氧胞嘧啶、嘧啶、氟达拉滨cladrabine和2-脱氧-d-葡萄糖。在一些实施例中,抗代谢物化疗剂为吉西他滨。hcl吉西他滨由eli lilly以商标销售。
[0171]
在一些实施例中,抗癌疗法包括铂基化疗剂。在一些实施例中,本文提供的方法包括向个体施用铂基化疗剂,例如,与另一种抗癌疗法相组合。铂基化疗剂是包括含有铂作为分子的组成部分的有机化合物的化疗剂。在一些实施例中,化疗剂为铂剂。在一些此类实施例中,铂剂选自顺铂、卡铂、奥沙利铂、奈达铂、四硝酸三铂、菲铂、吡铂或沙铂。
[0172]
在一些实施例中,抗癌疗法包括热休克蛋白(hsp)抑制剂、myc抑制剂、hdac抑制剂、免疫疗法、新抗原、疫苗或细胞疗法。在一些实施例中,抗癌疗法包括化学疗法、vegf抑制剂、整合素β3抑制剂、他汀、egfr抑制剂、mtor抑制剂、pi3k抑制剂、mapk抑制剂或cdk4/6抑制剂中的一者或多者。
[0173]
在一些实施例中,抗癌疗法包括激酶抑制剂。在一些实施例中,本文提供的方法包括向个体施用激酶抑制剂,例如,与另一种抗癌疗法相组合。在一些实施例中,激酶抑制剂为克唑替尼、艾乐替尼、色瑞替尼、劳拉替尼、布加替尼、恩沙替尼(x-396)、瑞波替尼(tpx-005)、恩曲替尼(rxdx-101)、azd3463、cep-37440、贝扎替尼(tsr-011)、asp3026、krca-0008、tq-b3139、tpx-0131或tae684(nvp-tae684)。根据本文提供的方法中的任一种方法可使用的alk激酶抑制剂的附加的实例描述于wo2005016894的实例3至39中,其以引用方式并入本文。
[0174]
在一些实施例中,抗癌疗法包括热休克蛋白(hsp)抑制剂。在一些实施例中,本文提供的方法包括向个体施用hsp抑制剂,例如,与另一种抗癌疗法相组合。在一些实施例中,hsp抑制剂为pan-hsp抑制剂,诸如knk423。在一些实施例中,hsp抑制剂为hsp70抑制剂,诸如cmhsp70.1、槲皮素、ver155008或17-aad。在一些实施例中,hsp抑制剂为hsp90抑制剂。在一些实施例中,hsp90抑制剂为17-aad、debio0932、加特司匹(sta-9090)、盐酸瑞他霉素(瑞他霉素,ipi-504)、auy922、阿螺旋霉素(kos-1022、17-dmag)、坦螺旋霉素(kos-953、17-aag)、ds 2248或at13387(onalespib)。在一些实施例中,hsp抑制剂为hsp27抑制剂,诸如apatorsen(ogx-427)。
[0175]
在一些实施例中,抗癌疗法包括myc抑制剂。在一些实施例中,本文提供的方法包括向个体施用myc抑制剂,例如,与另一种抗癌疗法相组合。在一些实施例中,myc抑制剂为myci361(nucc-0196361)、myci975(nucc-0200975)、omomyc(显性负肽)、zinc16293153(min9)、10058-f4、jky-2-169、7594-0035或者myc/max二聚化和/或myc/max/dna配合物形成的抑制剂。
[0176]
在一些实施例中,抗癌疗法包括组蛋白脱乙酰酶(hdac)抑制剂。在一些实施例中,本文提供的方法包括向个体施用hdac抑制剂,例如,与另一种抗癌疗法相组合。在一些实施例中,hdac抑制剂为贝利司他(pxd101,)、saha(伏立诺他、辛二酰苯胺羟胺、)、帕比司他(lbh589、laq-824)、acy1215(rocilinostat)、quisinostat(jnj-26481585)、阿贝司他(pci-24781)、普雷司他(sb939)、吉维司他(itf2357)、resminostat(4sc-201)、曲古菌素a(tsa)、ms-275(etinostat)、罗米地新(缩酚酸肽、fk228)、mgcd0103
(莫替司他)、bml-210、cay10603、丙戊酸、mc1568、cudc-907、ci-994(他地那兰)、pivanex(an-9)、ar-42、西达本胺(cs055、hbi-8000)、cudc-101、chr-3996、mpt0e028、brd8430、mrlb-223、apicidin、rgfp966、bg45、pci-34051、c149(ncc149)、tmp269、cpd2、t247、t326、lmk235、c1a、hpob、nexturastat a、befexamac、cbha、苯丁酸酯、mc1568、sndx275、scriptaid、merck60、px089344、px105684、px117735、px117792、px117245、px105844、如由li等人,cold spring harb perspect med(2016)6(10):a026831所述的化合物12或px117445。
[0177]
在一些实施例中,抗癌疗法包括vegf抑制剂。在一些实施例中,本文提供的方法包括向个体施用vegf抑制剂,例如,与另一种抗癌疗法相组合。在一些实施例中,vegf抑制剂为贝伐单抗bms-690514、雷莫芦单抗、帕唑帕尼、索拉非尼、舒尼替尼、golvatinib、凡德他尼、卡博替尼、levantinib、阿昔替尼、西地尼布、替沃扎尼、lucitanib、司马沙尼、nindentanib、瑞戈非尼或阿柏西普。
[0178]
在一些实施例中,抗癌疗法包含整合素β3抑制剂。在一些实施例中,本文提供的方法包括向个体施用整合素β3抑制剂,例如,与另一种抗癌疗法相组合。在一些实施例中,整合素β3抑制剂为抗avb3(克隆lm609)、西仑吉肽(emd121974、nsc、707544)、sirna、glpg0187、mk-0429、cnto95、tn-161、埃达组单抗(medi-522)、英妥木单抗(cnto95)(抗αv亚基抗体)、阿比妥珠单抗(emd525797/di17e6)(抗αv亚基抗体)、jsm6427、sj749、bch-15046、sch221153或sc56631。在一些实施例中,抗癌疗法包括αiibβ3整合素抑制剂。在一些实施例中,本文提供的方法包括向个体施用αiibβ3整合素抑制剂,例如,与另一种抗癌疗法相组合。在一些实施例中,αiibβ3整合素抑制剂为阿昔单抗、依替巴肽或替罗非班
[0179]
在一些实施例中,抗癌疗法包括他汀或他汀基药剂。在一些实施例中,本文提供的方法包括向个体施用他汀或他汀基药剂,例如,与另一种抗癌疗法相组合。在一些实施例中,他汀或他汀基药剂为辛伐他汀、阿托伐他汀、氟伐他汀、匹伐他汀、普伐他汀、罗舒伐他汀或西立伐他汀。
[0180]
在一些实施例中,抗癌疗法包括mtor抑制剂。在一些实施例中,本文提供的方法包括向个体施用mtor抑制剂,例如,与另一种抗癌疗法相组合。在一些实施例中,mtor抑制剂为坦罗莫司(cci-779)、ku-006379、pp242、torin1、torin2、icsn3250、rapalink-1、cc-223、西罗莫司(雷帕霉素)、依维莫司(rad001)、dactosilib(nvp-bez235)、gsk2126458、way-001、way-600、wye-687、wye-354、sf1126、xl765、ink128(mln012)、azd8055、osi027、azd2014或ap-23573。
[0181]
在一些实施例中,抗癌疗法包括pi3k抑制剂。在一些实施例中,本文提供的方法包括向个体施用pi3k抑制剂,例如,与另一种抗癌疗法相组合。在一些实施例中,pi3k抑制剂为gsk2636771、buparlisib(bkm120)、azd8186、copanlisib(bay80-6946)、ly294002、px-866、tgx115、tgx126、bez235、sf1126、艾代拉里斯(gs-1101、cal-101)、pictilisib(gdc-094)、gdc0032、ipi145、ink1117(mln1117)、sar260301、kin-193(azd6482)、杜韦利西布、gs-9820、gsk2636771、gdc-0980、amg319、pazobanib或阿培利司(byl719、piqray)。
[0182]
在一些实施例中,抗癌疗法包括mapk抑制剂。在一些实施例中,本文提供的方法包
括向个体施用mapk抑制剂,例如,与另一种抗癌疗法相组合。在一些实施例中,mapk抑制剂为sb203580、skf-86002、birb-796、sc-409、rjw-67657、birb-796、vx-745、ro3201195、sb-242235或mw181。
[0183]
在一些实施例中,抗癌疗法包括cdk4/6抑制剂。在一些实施例中,本文提供的方法包括向个体施用cdk4/6抑制剂,例如,与另一种抗癌疗法相组合。在一些实施例中,cdk4/6抑制剂为瑞博西尼(lee011)、帕博西尼(pd0332991、)或阿贝西利(ly2835219)。
[0184]
在一些实施例中,抗癌疗法包括egfr抑制剂。在一些实施例中,本文提供的方法包括向个体施用egfr抑制剂,例如,与另一种抗癌疗法相组合。在一些实施例中,egfr抑制剂为西妥昔单抗、帕尼单抗、拉帕替尼、吉非替尼、凡德他尼、达克替尼、埃克替尼、奥希替尼(azd9291)、afatanib、奥莫替尼、egf816(nazartinib)、avitinib(ac0010)、rociletinib(co-1686)、bms-690514、yh5448、pf-06747775、asp8273、pf299804、ap26113或厄洛替尼。在一些实施例中,egfr抑制剂为吉非替尼或西妥昔单抗。
[0185]
在一些实施例中,抗癌疗法包括癌症免疫疗法,诸如癌症疫苗、基于细胞的疗法、基于t细胞受体(tcr)的疗法、辅助免疫疗法、细胞因子免疫疗法和溶瘤病毒疗法。在一些实施例中,本文提供的方法包括向个体施用癌症免疫疗法,诸如癌症疫苗、基于细胞的疗法、基于t细胞受体(tcr)的疗法、辅助免疫疗法、细胞因子免疫疗法和溶瘤病毒疗法,例如,与另一种抗癌疗法相组合。在一些实施例中,癌症免疫疗法包括小分子、核酸、多肽、碳水化合物、毒素、基于细胞的药剂或细胞结合剂。癌症免疫疗法的实例在本文中进行了更详细的描述,但并非旨在是限制性的。在一些实施例中,癌症免疫疗法活化免疫系统的一个或多个方面以攻击表达新抗原(例如,由本公开的癌症表达的新抗原)的细胞(例如,肿瘤细胞)。本公开的癌症免疫疗法被考虑用作单一疗法,或以包括任何组合或数量的两种或更多种的组合方法使用,这取决于医学判断。任何癌症免疫疗法(任选地作为单一疗法或与本文描述的另一种癌症免疫疗法或其他治疗剂组合)可用于本文描述的任何方法中。
[0186]
在一些实施例中,癌症免疫疗法包括癌症疫苗。已经测试了一系列癌症疫苗,它们采用不同的方法来促进对癌症的免疫应答(参见例如,emens l a,expert opin emerg drugs 13(2):295-308(2008)和us20190367613)。已经设计了一些方法来增强b细胞、t细胞或专职抗原呈递细胞对肿瘤的应答。癌症疫苗的示例性类型包括但不限于基于dna的疫苗、基于rna的疫苗、病毒转导的疫苗、基于肽的疫苗、树突细胞疫苗、溶瘤病毒、全肿瘤细胞疫苗、肿瘤抗原疫苗等。在一些实施例中,癌症疫苗可以是预防性或治疗性的。在一些实施例中,癌症疫苗被配制为基于肽的疫苗、基于核酸的疫苗、基于抗体的疫苗或基于细胞的疫苗。例如,疫苗组合物可以包含在阳离子脂质制剂中的裸cdna;脂肽(例如,vitiello,a.et al,j.clin.invest.95:341,1995),裸cdna或肽,例如封装在聚(dl-丙交酯-共-乙交酯)(“plg”)微球中(参见,例如,eldridge,et al,molec.immunol.28:287-294,1991:alonso et al,vaccine 12:299-306,1994;jones et al,vaccine 13:675-681,1995);包含在免疫刺激复合物(iscom)中的肽组合物(例如,takahashi et al,nature 344:873-875,1990;hu et al,clin.exp.immunol.113:235-243,1998);或多抗原肽系统(map)(参见例如,tam,j.p.,proc.natl acad.sci.u.s.a.85:5409-5413,1988;tam,j.p.,j.immunol.methods 196:17-32,1996)。在一些实施例中,将癌症疫苗被配制成基于肽的疫苗或基于核酸的疫
苗,其中核酸编码多肽。在一些实施例中,癌症疫苗被配制为基于抗体的疫苗。在一些实施例中,癌症疫苗被配制成基于细胞的疫苗。在一些实施例中,癌症疫苗是肽癌症疫苗,在一些实施例中,其是个性化肽疫苗。在一些实施例中,癌症疫苗是多价长肽、多肽、肽混合物、杂合肽或肽脉冲树突细胞疫苗(参见,例如,yamada et al,cancersci,104:14-21),2013)。在一些实施例中,此类癌症疫苗增强抗癌应答。
[0187]
在一些实施例中,癌症疫苗包括编码新抗原(例如,由本公开的癌症表达的新抗原)的多核苷酸。在一些实施例中,癌症疫苗包括编码新抗原的dna或rna。在一些实施例中,癌症疫苗包括编码新抗原的多核苷酸。在一些实施例中,癌症疫苗进一步包括一种或多种附加的抗原、新抗原或促进抗原呈递和/或免疫应答的其他序列。在一些实施例中,多核苷酸与一种或多种附加的药剂(诸如脂质体或脂质复合物(lipoplex))配合。在一些实施例中,多核苷酸被抗原呈递细胞(apc)吸收和翻译,其然后经由apc细胞表面上的mhc i类呈递新抗原。
[0188]
在一些实施例中,癌症疫苗选自sipuleucel-t(dendreon/valeant pharmaceuticals),其已被批准用于治疗无症状或轻微症状的转移性去势抵抗性(激素难治性)前列腺癌;和talimogene laherparepvec(biovex/amgen,以前称为t-vec),一种转基因溶瘤病毒疗法,被批准用于治疗黑色素瘤中不可切除的皮肤、皮下和淋巴结病灶。在一些实施例中,癌症疫苗选自溶瘤病毒疗法,诸如pexastimogene devacirepvec(pexavec/jx-594、sillajen/以前的jennerex biotherapeutics),一种胸苷激酶-(tk-)缺陷型牛痘病毒,经工程化以表达gm-csf,用于肝细胞癌(nct02562755)和黑色素瘤(nct00429312);pelareorep(oncolytics biotech),一种呼吸道肠道孤儿病毒(呼肠孤病毒)的变体,在许多癌症中,包括结直肠癌(nct01622543)、前列腺癌(nct01619813)、头颈部鳞状细胞癌(nct01166542)、胰腺癌(nct00998322)和非小细胞肺癌(nsclc)(nct 00861627),它不会在未被ras活化的细胞中复制;enadenotucirev(ng-348、psioxus,以前称为coloadl),一种腺病毒,在卵巢癌(nct02028117)、转移性或晚期上皮肿瘤,诸如结直肠癌、膀胱癌、头颈部鳞状细胞癌和唾液腺癌(nct02636036)中,经工程化以表达全长cd80和特异于t细胞受体cd3蛋白的抗体片段;oncos-102(targovax/以前的oncos),一种在黑色素瘤(nct03003676)和腹膜疾病、结直肠癌或卵巢癌(nct02963831)中,经工程化以表达gm-csf的腺病毒;gl-onc1(glv-1h68/glv-1h153,genelux gmbh),经工程化以表达β-半乳糖苷酶(β-gal)/β-葡萄糖醛酸酶或β-gal/人钠碘转运体(hnis),在腹膜转移瘤(nct01443260)、输卵管癌、卵巢癌(nct 02759588)中分别研究;或cg0070(cold genesys),一种在膀胱癌中经工程化以表达gm-csf的腺病毒(nct02365818);抗gp100;stingvax;gvax;dcvaxl和dnx-2401。在一些实施例中,癌症疫苗选自jx-929(sillajen/原jennerex biotherapeutics),一种经工程化以表达胞嘧啶脱氨酶的tk和牛痘生长因子缺陷型牛痘病毒,其能够将前药5-氟胞嘧啶转化为细胞毒性药物5-氟尿嘧啶;tgo1和tg02(targovax/原oncos),靶向难治ras突变的基于肽的免疫疗法药剂;和tilt-123(tilt biotherapeutics),一种设计好的工程化腺病毒:ad5/3-e2f-delta24-htnfα-ires-hil20;和vsv-gp(viratherapeutics),一种经工程化以表达淋巴细胞性脉络丛脑膜炎病毒(lcmv)的糖蛋白(gp)的水疱性口炎病毒(vsv),其可进一步工程化以表达旨在提高抗原特异性cd8
t细胞应答的抗原。在一些实施例中,癌症疫苗包括基于载体的肿瘤抗原疫苗。基于载体的肿瘤抗原疫苗可用作提供稳定的抗原供应以刺激抗肿瘤免疫应答的一种方式。在一些实施例中,将编码肿瘤抗原的载体注射到个体体内(可能带有促炎剂或其他引诱剂诸如gm-csf),由细胞在体内吸收以制造特异性抗原,然后该特异性抗原引发预期的免疫应答。在一些实施例中,载体可用于一次递送大于一种肿瘤抗原,以增强免疫应答。此外,重组病毒、细菌或酵母载体可触发其自身的免疫应答,这也可增强总体免疫应答。
[0189]
在一些实施例中,癌症疫苗包括基于dna的疫苗。在一些实施例中,基于dna的疫苗可用于刺激抗肿瘤应答。直接注射编码抗原蛋白的dna引发保护性免疫应答的能力已在许多实验系统中得到证实。通过直接注射编码抗原蛋白的dna接种疫苗以引发保护性免疫应答,通常会产生细胞介导和体液应答。此外,已经报道了小鼠对编码各种抗原的dna的重复性免疫应答基本上持续了动物的一生(参见例如,yankauckas等人(1993)dna cell biol.,12:771-776)。在一些实施例中,将包含编码与基因表达所需的调节元件可操作地连接的蛋白质的序列的质粒(或其他载体)dna施用于个体(例如人类患者、非人类哺乳动物等)。在一些实施例中,个体的细胞吸收施用的dna并表达编码序列。在一些实施例中,如此产生的抗原成为免疫应答所针对的靶标。
[0190]
在一些实施例中,癌症疫苗包括基于rna的疫苗。在一些实施例中,基于rna的疫苗可用于刺激抗肿瘤应答。在一些实施例中,基于rna的疫苗包括自我复制的rna分子。在一些实施例中,自我复制的rna分子可以是α病毒衍生的rna复制子。自我复制的rna(或“sam”)分子在本领域中是众所周知的并且可以通过使用衍生自例如α病毒的复制元件和用编码目标蛋白质的核苷酸序列取代结构病毒蛋白质来产生。自我复制的rna分子通常是可在递送至细胞后直接翻译的 链分子,这种翻译提供了rna依赖性rna聚合酶,然后从递送的rna产生反义转录本和有义转录本。因此,递送的rna导致多个子rna的产生。这些子rna以及共线的亚基因组转录本可自身翻译以提供编码多肽的原位表达,或可转录以提供与递送的rna具有相同意义的进一步转录本,这些转录本被翻译以提供抗原的原位表达。
[0191]
在一些实施例中,癌症免疫疗法包括基于细胞的疗法。在一些实施例中,癌症免疫疗法包括基于t细胞的疗法。在一些实施例中,癌症免疫疗法包括过继疗法,例如基于t细胞的过继疗法。在一些实施例中,t细胞对于受体是自体的或同种异体的。在一些实施例中,t细胞为cd8 t细胞。在一些实施例中,t细胞为cd4 t细胞。过继免疫疗法是指一种治疗癌症或传染病的治疗方法,其中将免疫细胞施用于宿主,目的是使细胞直接或间接介导对肿瘤细胞的特异性免疫(即产生针对肿瘤细胞的免疫应答)。在一些实施例中,免疫应答导致肿瘤和/或转移性细胞生长和/或增殖的抑制,并且在相关实施例中导致肿瘤细胞死亡和/或再吸收。免疫细胞可以衍生自不同的生物体/宿主(外源性免疫细胞)或可以是从受试者生物体获得的细胞(自体免疫细胞)。在一些实施例中,免疫细胞(例如,自体或同种异体t细胞(例如,调节性t细胞、cd4 t细胞、cd8 t细胞或γ-δt细胞)、nk细胞、不变nk细胞或nkt细胞)可以经基因工程化以表达抗原受体,诸如工程化tcr和/或嵌合抗原受体(car)。例如,宿主细胞(例如,自体或同种异体t细胞)被修饰以表达对癌症抗原具有抗原特异性的t细胞受体(tcr)。在一些实施例中,nk细胞经工程化以表达tcr。nk细胞可以进一步经工程化以表达car。多个car和/或tcr,诸如不同的抗原,可以添加到单个细胞类型,诸如t细胞或nk细胞。在一些实施例中,细胞包括经由基因工程引入的编码一种或多种抗原受体的一种或多种核
酸/表达构建体/载体,以及此类核酸的基因工程产物。在一些实施例中,核酸是异源的,即通常不存在于细胞或获自该细胞的样品中,诸如一种获自另一生物体或细胞的核酸,例如,其通常不存在于经工程化的细胞中和/或这种细胞来源的生物体中。在一些实施例中,核酸不是天然存在的,诸如自然界中不存在的核酸(例如嵌合的)。在一些实施例中,免疫细胞群可以从需要疗法或患有与免疫细胞活性降低相关的疾病的受试者获得。因此,细胞对于需要治疗的受试者来说是自体的。在一些实施例中,免疫细胞群可以从供体获得,诸如组织相容性匹配的供体。在一些实施例中,免疫细胞群可以从受试者或供体中存在的免疫细胞的外周血、脐带血、骨髓、脾脏或任何其他器官/组织中收获。在一些实施例中,免疫细胞可以从受试者和/或供体库中分离,诸如从合并的脐带血中分离。在一些实施例中,当免疫细胞群从不同于受试者的供体获得时,供体可以是同种异体的,只要获得的细胞是受试者相容的,因为它们可以被引入受试者。在一些实施例中,同种异体供体细胞可以是或可以不是人-白细胞-抗原(hla)-相容的。在一些实施例中,为了使受试者相容,可以处理同种异体细胞以降低免疫原性。
[0192]
在一些实施例中,基于细胞的疗法包括:基于t细胞的疗法,诸如自体细胞,例如肿瘤浸润淋巴细胞(til);使用自体dc、淋巴细胞、人工抗原呈递细胞(apc)或包被t细胞配体和活化抗体的珠体外活化的t细胞,或通过捕获靶细胞膜分离的细胞;天然表达抗宿主肿瘤t细胞受体(tcr)的同种异体细胞;以及非肿瘤特异性自体或同种异体细胞,其经基因重编程或“重定向”以表达显示出抗体样肿瘤识别能力的肿瘤反应性tcr或嵌合tcr分子,称为“t体”。用于功能性抗肿瘤效应细胞的分离、衍生、工程化或修饰、活化和扩增的若干种方法在过去的二十年中已有描述,并且可以根据本文提供的方法中的任一种方法进行使用。在一些实施例中,t细胞衍生于血液、骨髓、淋巴、脐带或淋巴器官。在一些实施例中,细胞为人类细胞。在一些实施例中,细胞是原代细胞,诸如直接从受试者分离和/或从受试者分离并冷冻的那些细胞。在一些实施例中,细胞包括一种或多种t细胞亚群或其他细胞类型,诸如全t细胞群、cd4
细胞、cd8
细胞及其亚群,诸如由功能、活化状态、成熟度、分化潜能、扩增、再循环、定位和/或持续能力、抗原特异性、抗原受体的类型、存在于特异性器官或隔室中、标志物或细胞因子分泌谱和/或分化程度定义的那些。在一些实施例中,细胞可以是同种异体的和/或自体的。在一些实施例中,诸如对于现成的技术,细胞是多能的(pluripotent和/或multipotent),诸如干细胞,诸如诱导多能干细胞(ipsc)。
[0193]
在一些实施例中,基于t细胞的疗法包括基于嵌合抗原受体(car)-t细胞的疗法。这种方法涉及工程化一种car,该car与目标抗原特异性结合,并包括一个或多个用于t细胞活化的细胞内信号结构域。然后car在工程化t细胞(car-t)的表面上表达并施用于患者,导致针对表达抗原的癌细胞的t细胞特异性免疫应答。
[0194]
在一些实施例中,基于t细胞的疗法包括t细胞表达重组t细胞受体(tcr)。该方法涉及识别与目标抗原特异性结合的tcr,然后将其用于替换施用于患者的工程化t细胞表面上的内源性或天然tcr,导致针对表达抗原的癌细胞的t细胞特异性免疫应答。
[0195]
在一些实施例中,基于t细胞的疗法包括肿瘤浸润淋巴细胞(til)。例如,til可以从本公开的肿瘤或癌症中分离,然后在体外分离和扩增。这些til中的一些或全部可以特异性识别本公开的由肿瘤或癌症表达的抗原。在一些实施例中,til在分离后在体外暴露于一种或多种新抗原,例如新抗原。然后将til施用于患者(任选与一种或多种细胞因子或其他
免疫刺激物质组合)。
[0196]
在一些实施例中,基于细胞的疗法包括基于自然杀伤(nk)细胞的疗法。自然杀伤(nk)细胞是淋巴细胞的一个亚群,对多种肿瘤细胞、病毒感染的细胞以及骨髓和胸腺中的一些正常细胞具有自发的细胞毒性。nk细胞是对转化和病毒感染细胞的早期先天免疫应答的关键效应物。nk细胞可以通过特异性表面标志物来检测,诸如人类中的cd16、cd56和cd8。nk细胞不表达t细胞抗原受体、泛t标志物cd3或表面免疫球蛋白b细胞受体。在一些实施例中,nk细胞通过本领域中众所周知的方法衍生自人外周血单核细胞(pbmc)、未刺激的白细胞分离产物(pbsc)、人胚胎干细胞(hesc)、诱导多能干细胞(ipsc)、骨髓或脐带血。
[0197]
在一些实施例中,基于细胞的疗法包括基于树突细胞(dc)的疗法,例如树突细胞疫苗。在一些实施例中,dc疫苗包括能够诱导特异性t细胞免疫的抗原呈递细胞,其从患者或供体中收获。在一些实施例中,然后可以将dc疫苗在体外暴露于肽抗原,从而在患者体内产生t细胞。在一些实施例中,然后将携带抗原的树突细胞注射回患者体内。在一些实施例中,如果需要,可以多次重复免疫接种。用于收获、扩增和施用树突细胞的方法是本领域已知的;参见例如,wo2019178081。树突细胞疫苗(诸如sipuleucel-t,也称为apc8015和)是涉及施用充当apc以向患者的免疫系统呈递一种或多种癌症特异性抗原的树突细胞的疫苗。在一些实施例中,树突细胞对于受体是自体的或同种异体的。
[0198]
在一些实施例中,癌症免疫疗法包括基于tcr的疗法。在一些实施例中,癌症免疫疗法包括施用特异性结合本公开的由癌症表达的抗原的一种或多种tcr或基于tcr的治疗剂。在一些实施例中,基于tcr的治疗剂可以进一步包括结合免疫细胞(例如,t细胞)的部分,诸如特异性结合t细胞表面蛋白或受体的抗体或抗体片段(例如,抗cd3抗体或抗体片段)。
[0199]
在一些实施例中,免疫疗法包括辅助免疫疗法。辅助免疫疗法包括使用一种或多种活化先天免疫系统成分的药剂,例如靶向tlr7通路的(咪喹莫特)。
[0200]
在一些实施例中,免疫疗法包括细胞因子免疫疗法。细胞因子免疫疗法包括使用一种或多种活化免疫系统成分的细胞因子。实例包括但不限于阿地白介素(白细胞介素2)、干扰素α-2a干扰素α-2b和聚乙二醇干扰素α-2b
[0201]
在一些实施例中,免疫疗法包括溶瘤病毒疗法。溶瘤病毒疗法使用转基因病毒在癌细胞中复制并杀死癌细胞,导致释放刺激免疫应答的抗原。在一些实施例中,表达肿瘤抗原的具有复制能力的溶瘤病毒包括任何天然存在的(例如来自“野生来源”)或经修饰的具有复制能力的溶瘤病毒。在一些实施例中,溶瘤病毒除了表达肿瘤抗原外,还可以被修饰以增加病毒对癌细胞的选择性。在一些实施例中,具有复制能力的溶瘤病毒包括但不限于作为肌尾噬菌体科、长尾噬菌体科、短尾噬菌体科、复层噬菌体科、覆盖噬菌体科、芽生噬菌体科、脂毛噬菌体科、微小纺锤形噬菌体科、痘病毒科、虹彩病毒科、藻类脱氧核糖核酸病毒科、杆状病毒科、疱疹病毒科、腺病毒科、乳多泡病毒科、聚脱氧核糖核酸病毒科、丝状病毒科、微病毒科、双生病毒科、环状病毒科、细小病毒科、嗜肝脱氧核糖核酸病毒科、逆转录病毒科、囊状病毒科、呼肠孤病毒科、双核糖核酸病毒科、副粘病毒科、弹状病毒科、丝状病毒科、正粘病毒科、布尼亚病毒科、沙粒病毒科、光滑病毒科、小核糖核酸病毒科、伴生病毒科、
豇豆花叶病毒科、马铃薯y病毒科、杯状病毒科、星状病毒科、罗达病毒科、四病毒科、番茄丛矮病毒科、冠状病毒科、黄病毒科、披膜病毒科和杆菌状核糖核酸病毒科家族的成员的溶瘤病毒。在一些实施例中,具有复制能力的溶瘤病毒包括腺病毒、逆转录病毒、呼肠孤病毒、弹状病毒、新城疫病毒(ndv)、多瘤病毒、牛痘病毒(vacv)、单纯疱疹病毒、小核糖核酸病毒、柯萨奇病毒和细小病毒。在一些实施例中,表达肿瘤抗原的复制性溶瘤牛痘病毒可经工程化以缺乏一种或多种功能基因,以增加病毒的癌症选择性。在一些实施例中,溶瘤牛痘病毒经工程化以缺乏胸苷激酶(tk)活性。在一些实施例中,溶瘤牛痘病毒可经工程化以缺乏牛痘病毒生长因子(vgf)。在一些实施例中,溶瘤牛痘病毒可经工程化以缺乏vfg和tk活性两者。在一些实施例中,溶瘤牛痘病毒可经工程化以缺乏涉及逃避宿主干扰素(ifn)应答的一种或多种基因,诸如e3l、k3l、b18r或b8r。在一些实施例中,复制性溶瘤牛痘病毒是western reserve、copenhagen、lister或wyeth株并且缺乏功能性tk基因。在一些实施例中,溶瘤牛痘病毒是缺乏功能性b18r和/或b8r基因的western reserve、copenhagen、lister或wyeth株。在一些实施例中,表达肿瘤抗原的复制性溶瘤牛痘病毒可以局部或全身施用于受试者,例如经由肿瘤内、腹膜内、静脉内、动脉内、肌肉内、皮内、颅内、皮下或鼻内施用。
[0202]
以下示例性实施例代表本发明的一些方面:
[0203]
实施例1.一种检测人白细胞抗原(hla)基因的杂合性缺失(loh)的方法,其包括:
[0204]
提供从来自个体的样品获得的多种核酸,其中所述多种核酸包括编码hla基因的核酸;
[0205]
任选地,将一个或多个衔接子连接到所述多种核酸中的一种或多种核酸上;
[0206]
扩增所述多种核酸中的核酸;
[0207]
捕获对应于所述hla基因的多种核酸,其中通过与诱饵分子杂交从经扩增的核酸捕获对应于所述hla基因的所述多种核酸;
[0208]
通过测序仪对捕获的核酸进行测序,以获得对应于所述hla基因的多个序列读段;
[0209]
通过一个或多个处理器将与所述多个序列读段中的一个或多个相关联的一个或多个值拟合到模型;以及
[0210]
基于所述模型,检测所述hla基因的loh和针对所述hla基因的hla等位基因的相对结合倾向。
[0211]
实施例2.根据实施例1所述的方法,其中所述hla基因的loh和针对所述hla基因的hla等位基因的相对结合倾向通过以下方式来检测:
[0212]
a)获得针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与所述hla基因相对应的所述多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率;
[0213]
b)获得针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;
[0214]
c)应用目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;
[0215]
d)应用优化模型以最小化所述目标函数;
[0216]
e)基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经
调整的等位基因频率;以及
[0217]
f)确定当所述hla等位基因的所述经调整的等位基因频率小于预先确定的阈值时loh已经发生。
[0218]
实施例3.根据实施例1或实施例2所述的方法,其进一步包括:至少部分地基于检测到所述hla基因的loh,向所述个体施用有效量的除免疫检查点抑制剂(ici)之外的治疗。
[0219]
实施例4.根据实施例1或实施例2所述的方法,其进一步包括:至少部分地基于检测到所述hla基因的loh,建议除免疫检查点抑制剂(ici)之外的治疗。
[0220]
实施例5.根据实施例1或实施例2所述的方法,其进一步包括:检测所述样品中的高肿瘤突变负荷(tmb)或获取对于所述样品中的所述tmb的了解。
[0221]
实施例6.根据实施例5所述的方法,其进一步包括:至少部分地基于检测到所述hla基因的loh以及高tmb,向所述个体施用有效量的免疫检查点抑制剂(ici)。
[0222]
实施例7.根据实施例5所述的方法,其进一步包括:至少部分地基于检测到所述hla基因的loh以及高tmb,建议针对所述个体的包含免疫检查点抑制剂(ici)的治疗。
[0223]
实施例8.根据实施例1至7中任一项所述的方法,其中所述hla基因为人hla-a基因、人hla-b基因或人hla-c基因。
[0224]
实施例9.根据实施例1至8中任一项所述的方法,其进一步包括在(1)之前从所述样品提取所述多种核酸。
[0225]
实施例10.根据实施例1至9中任一项所述的方法,其中所述样品包含肿瘤细胞和/或肿瘤核酸。
[0226]
实施例11.根据实施例10所述的方法,其中所述样品进一步包含非肿瘤细胞。
[0227]
实施例12.根据实施例10所述的方法,其中所述样品来自肿瘤活组织切片或肿瘤样本。
[0228]
实施例13.根据实施例10所述的方法,其中所述样品包含肿瘤细胞外dna(cfdna)。
[0229]
实施例14.根据实施例10所述的方法,其中所述样品包含流体、细胞或组织。
[0230]
实施例15.根据实施例14所述的方法,其中所述样品包含血液或血浆。
[0231]
实施例16.根据实施例10所述的方法,其中所述样品包含肿瘤活组织切片或循环肿瘤细胞。
[0232]
实施例17.根据实施例16所述的方法,其中来自所述个体的所述样品为核酸样品。
[0233]
实施例18.根据实施例17所述的方法,其中所述核酸样品包含mrna、基因组dna、循环肿瘤dna、细胞外dna或细胞外rna。
[0234]
实施例19.根据实施例5至18中任一项所述的方法,其中所述tmb基于每兆碱基经测序的基因组的非驱动基因体细胞编码突变的数量来确定。
[0235]
实施例20.一种方法,其包括:
[0236]
识别多个化学反应,使得:
[0237]
每个反应对应于与多态性基因的不同等位基因结合的诱饵分子,并且每个反应导致对应等位基因分数的捕获;
[0238]
所述多个化学反应包括反应的第一子集和反应的第二子集,其中所述第一子集和所述第二子集不共享共同的反应,并且其中所述第一子集和所述第二子集各自包括至少一个化学反应;
[0239]
识别多个反应式,所述多个反应式共同地关联每个化学反应的结合倾向和每个捕获的等位基因的等位基因分数;
[0240]
凭经验识别所述多个化学反应的所述第一子集的相对结合倾向;以及
[0241]
通过最小化总误差来识别所述第二子集的相对结合倾向。
[0242]
实施例21.根据实施例20所述的方法,其中最小化所述总误差受制于中值相对结合倾向等于1的约束。
[0243]
实施例22.根据实施例20所述的方法,其中一种相对结合倾向被设定为等于1。
[0244]
实施例23.根据实施例20所述的方法,其中最小化所述总误差包括执行最小二乘法。
[0245]
实施例24.根据实施例20所述的方法,其进一步包括:
[0246]
执行杂交捕获过程以测量患者的dna样品中的原始等位基因频率;以及
[0247]
使用相对结合倾向的所述第一子集和所述第二子集来缩放经测量的原始等位基因频率,从而减小抽样偏差。
[0248]
实施例25.根据实施例20所述的方法,其中所述多态性基因包括人白细胞抗原基因。
[0249]
实施例26.根据实施例20所述的方法,其中所述多态性基因为st7/ray1、arh1/noey2、tslc1、rb、pten、smad2、smad4、dcc、tp53、atm、mir-15a、mir-16-1、nat2、brca1、brca2、hogg1、cdh1、igf2、cdkn1c/p57、men1、prkar1a、h19、kras、bap1、ptch1、smo、sufu、notch1、ppp6c、lats1、casp8、ptpn14、arid1a、fbxw7、m6p/igf2r、ifn-α、嗅觉受体基因、cbfa2t3、dutt1、fhit、apc、p16、fcmd、tsc2、mir-34、c-mpl、runx3、diras3、nras、mir-9、fam50b、plagl1、er、flt3、zdbf2、gpr1、c-kit、nap1l5、grb10、egfr、peg10、braf、mest、jak2、dapk1、lit1、wt1、nf-1、pr、c-cbl、dlk1、akt1、snurf、细胞色素p450基因(cyp)、znf587、socs1、timp2、runx1、ar、cebpa、c19mc、emp3、znf331、cdkn2a、peg3、nnat、gnas或gata5。
[0250]
实施例27.根据实施例24所述的方法,其进一步包括确定所述患者是否已经历杂合性缺失。
[0251]
实施例28.一种系统,其包括:
[0252]
一个或多个处理器;以及
[0253]
存储器,其被配置为存储一个或多个计算机程序指令,其中所述一个或多个计算机程序指令当由所述一个或多个处理器执行时被配置为:
[0254]
识别多个化学反应,使得:
[0255]
每个反应对应于与多态性基因的不同等位基因结合的诱饵分子,并且每个反应导致对应等位基因分数的捕获;
[0256]
所述多个化学反应包括反应的第一子集和反应的第二子集,其中所述第一子集和所述第二子集不共享共同的反应,并且其中所述第一子集和所述第二子集各自包括至少一个化学反应;
[0257]
识别多个反应式,所述多个反应式共同地关联每个化学反应的结合倾向和每个捕获的等位基因的等位基因分数;
[0258]
接收所述多个化学反应的所述第一子集的凭经验识别的相对结合倾向;以及
[0259]
通过最小化总误差来识别所述第二子集的所述相对结合倾向。
[0260]
实施例29.根据实施例28所述的系统,其中最小化所述总误差受制于中值相对结合倾向等于1的约束。
[0261]
实施例30.根据实施例28所述的系统,其中一种相对结合倾向被设定为等于1。
[0262]
实施例31.根据实施例28所述的系统,其中最小化所述总误差包括执行最小二乘法。
[0263]
实施例32.根据实施例28所述的系统,其中所述一个或多个计算机程序指令当由所述一个或多个处理器执行时被进一步配置为:
[0264]
在所述一个或多个处理器处接收患者的dna样品中的经测量的原始等位基因频率,其中通过执行杂交捕获过程测量了所述经测量的原始等位基因频率;以及
[0265]
在所述一个或多个处理器处,使用相对结合倾向的所述第一子集和所述第二子集来缩放所述经测量的原始等位基因频率,从而减小抽样偏差。
[0266]
实施例33.根据实施例28所述的系统,其中所述多态性基因包括人白细胞抗原基因。
[0267]
实施例34.根据实施例28所述的系统,其中所述多态性基因为st7/ray1、arh1/noey2、tslc1、rb、pten、smad2、smad4、dcc、tp53、atm、mir-15a、mir-16-1、nat2、brca1、brca2、hogg1、cdh1、igf2、cdkn1c/p57、men1、prkar1a、h19、kras、bap1、ptch1、smo、sufu、notch1、ppp6c、lats1、casp8、ptpn14、arid1a、fbxw7、m6p/igf2r、ifn-α、嗅觉受体基因、cbfa2t3、dutt1、fhit、apc、p16、fcmd、tsc2、mir-34、c-mpl、runx3、diras3、nras、mir-9、fam50b、plagl1、er、flt3、zdbf2、gpr1、c-kit、nap1l5、grb10、egfr、peg10、braf、mest、jak2、dapk1、lit1、wt1、nf-1、pr、c-cbl、dlk1、akt1、snurf、细胞色素p450基因(cyp)、znf587、socs1、timp2、runx1、ar、cebpa、c19mc、emp3、znf331、cdkn2a、peg3、nnat、gnas或gata5。
[0268]
实施例35.根据实施例32所述的系统,其中所述方法进一步包括在所述一个或多个处理器处确定所述患者是否已经历杂合性缺失。
[0269]
实施例36.一种用于确定等位基因频率的方法,其包括:
[0270]
a)在一个或多个处理器处接收针对基因的等位基因的观察到的等位基因频率,其中所述观察到的等位基因频率对应于:如在与所述基因相对应的多个序列读段中检测到的对所述等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸执行测序获得了所述多个序列读段;
[0271]
b)在一个或多个处理器处接收针对所述等位基因对所述诱饵分子的相对结合倾向,其中所述等位基因的所述相对结合倾向对应于:对所述等位基因的至少一部分编码的核酸在存在对所述基因的一个或多个其他等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;
[0272]
c)由所述一个或多个处理器执行目标函数以测量所述等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;
[0273]
d)由所述一个或多个处理器执行优化模型以最小化所述目标函数;以及
[0274]
e)由所述一个或多个处理器基于所述优化模型和所述观察到的等位基因频率来确定所述等位基因的经调整的等位基因频率。
[0275]
实施例37.根据实施例36所述的方法,其中所述优化模型为最小二乘优化模型。
[0276]
实施例38.根据实施例36或实施例37所述的方法,其中所述优化模型受制于一个或多个约束。
[0277]
实施例39.根据实施例38所述的方法,其中所述一个或多个约束要求针对所述基因的多个等位基因的所述相对结合倾向的中值等于1。
[0278]
实施例40.根据实施例36至39中任一项所述的方法,其中所述观察到的等位基因频率对应于:如在所述多个序列读段中检测到的对所述等位基因的至少一部分编码的核酸与参考值相比时的相对频率。
[0279]
实施例41.根据实施例40所述的方法,其中所述参考值为序列读段的总数。
[0280]
实施例42.根据实施例40所述的方法,其中所述参考值为与参考基因相对应的序列读段的数量。
[0281]
实施例43.根据实施例36至42中任一项所述的方法,其中所述基因为对主要组织相容性(mhc)i类分子编码的人白细胞抗原(hla)基因。
[0282]
实施例44.根据实施例36至42中任一项所述的方法,其中所述基因为st7/ray1、arh1/noey2、tslc1、rb、pten、smad2、smad4、dcc、tp53、atm、mir-15a、mir-16-1、nat2、brca1、brca2、hogg1、cdh1、igf2、cdkn1c/p57、men1、prkar1a、h19、kras、bap1、ptch1、smo、sufu、notch1、ppp6c、lats1、casp8、ptpn14、arid1a、fbxw7、m6p/igf2r、ifn-α、嗅觉受体基因、cbfa2t3、dutt1、fhit、apc、p16、fcmd、tsc2、mir-34、c-mpl、runx3、diras3、nras、mir-9、fam50b、plagl1、er、flt3、zdbf2、gpr1、c-kit、nap1l5、grb10、egfr、peg10、braf、mest、jak2、dapk1、lit1、wt1、nf-1、pr、c-cbl、dlk1、akt1、snurf、细胞色素p450基因(cyp)、znf587、socs1、timp2、runx1、ar、cebpa、c19mc、emp3、znf331、cdkn2a、peg3、nnat、gnas或gata5。
[0283]
实施例45.根据实施例36至44中任一项所述的方法,其进一步包括在确定所述经调整的等位基因频率之后:至少部分地基于所述经调整的等位基因频率确定所述基因已经历杂合性缺失(loh)。
[0284]
实施例46.根据实施例36至45中任一项所述的方法,其中通过对通过与所述诱饵分子杂交捕获的核酸执行下一代测序(ngs)、全外显子组测序或甲基化测序获得了所述多个序列读段。
[0285]
实施例47.根据实施例36至46中任一项所述的方法,其进一步包括在接收所述观察到的等位基因频率之前:通过下一代测序(ngs)、全外显子组测序或甲基化测序对多个多核苷酸执行测序以便获得所述多个序列读段,其中所述多个多核苷酸包括对所述等位基因的至少一部分编码的核酸。
[0286]
实施例48.根据实施例47所述的方法,其进一步包括在对所述多个多核苷酸执行测序之前:
[0287]
在适用于杂交的条件下使多核苷酸的混合物与所述诱饵分子接触,其中所述混合物包括能够与所述诱饵分子杂交的多个多核苷酸;以及
[0288]
分离与所述诱饵分子杂交的多个多核苷酸,其中对与所述诱饵分子杂交的经分离的多个多核苷酸进行测序。
[0289]
实施例49.根据实施例48所述的方法,其进一步包括在使多核苷酸的所述混合物
与所述诱饵分子接触之前:
[0290]
从个体获得样品,其中所述样品包含肿瘤细胞和/或肿瘤核酸;以及
[0291]
从所述样品提取多核苷酸的所述混合物,其中所述多核苷酸的所述混合物来自所述肿瘤细胞和/或所述肿瘤核酸。
[0292]
实施例50.根据实施例49所述的方法,其中所述样品进一步包含非肿瘤细胞。
[0293]
实施例51.根据实施例49所述的方法,其中所述样品来自肿瘤活组织切片或肿瘤样本。
[0294]
实施例52.根据实施例49所述的方法,其中所述样品包含肿瘤细胞外dna(cfdna)。
[0295]
实施例53.根据实施例36至52中任一项所述的方法,其进一步包括:
[0296]
(1)在一个或多个处理器处接收针对基因的两个或更多个等位基因中的每个等位基因的观察到的等位基因频率,其中所述观察到的等位基因频率对应于:如在与所述基因相对应的多个序列读段中检测到的对相应等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸进行测序获得了所述多个序列读段;
[0297]
(2)在一个或多个处理器处接收针对所述两个或更多个等位基因中的每个等位基因对所述诱饵分子的相对结合倾向,其中所述两个或更多个等位基因中的第二等位基因与所述两个或更多个等位基因中的第一等位基因相比具有对所述诱饵分子的较低相对结合倾向;以及
[0298]
(3)通过所述一个或多个处理器识别第二诱饵分子,其中所述两个或更多个等位基因中的所述第二等位基因具有的对所述第二诱饵分子的相对结合倾向高于对所述第一诱饵分子的相对结合倾向。
[0299]
实施例54.根据实施例53所述的方法,其中所述第二诱饵分子包括与所述两个或更多个等位基因中的所述第二等位基因的至少一部分互补的序列。
[0300]
实施例55.一种非暂时性计算机可读存储介质,其包括用于由装置的一个或多个处理器执行的一个或多个程序,所述一个或多个程序包括指令,所述指令当由所述一个或多个处理器执行时致使所述装置执行根据实施例36至46、53和54中任一项所述的方法。
[0301]
实施例56.一种用于检测人白细胞抗原(hla)基因的杂合性缺失(loh)的方法,其包括:
[0302]
a)在一个或多个处理器处接收针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸进行测序获得了所述多个序列读段;
[0303]
b)在一个或多个处理器处接收针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;
[0304]
c)由所述一个或多个处理器执行目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;
[0305]
d)由所述一个或多个处理器执行优化模型以最小化所述目标函数;
[0306]
e)由所述一个或多个处理器基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及
[0307]
f)由所述一个或多个处理器确定当所述hla等位基因的所述经调整的等位基因频率小于预先确定的阈值时loh已经发生。
[0308]
实施例57.根据实施例56所述的方法,其中所述hla基因为人hla-a基因、人hla-b基因或人hla-c基因。
[0309]
实施例58.根据实施例56或实施例57所述的方法,其中通过对从包括肿瘤细胞和/或肿瘤核酸的样品获得的核酸执行测序获得了所述多个序列读段。
[0310]
实施例59.根据实施例58所述的方法,其中所述样品进一步包含非肿瘤细胞。
[0311]
实施例60.根据实施例58所述的方法,其中所述样品来自肿瘤活组织切片或肿瘤样本。
[0312]
实施例61.根据实施例58所述的方法,其中所述样品包含肿瘤细胞外dna(cfdna)。
[0313]
实施例62.根据实施例58所述的方法,其中所述样品包含流体、细胞或组织。
[0314]
实施例63.根据实施例62所述的方法,其中所述样品包含血液或血浆。
[0315]
实施例64.根据实施例58所述的方法,其中所述样品包含肿瘤活组织切片或循环肿瘤细胞。
[0316]
实施例65.根据实施例58所述的方法,其中所述样品为核酸样品。
[0317]
实施例66.根据实施例65所述的方法,其中所述核酸样品包含mrna、基因组dna、循环肿瘤dna、细胞外dna或细胞外rna。
[0318]
实施例67.一种识别可能受益于包含免疫检查点抑制剂(ici)的治疗的患有癌症的个体的方法,所述方法包括检测来自所述个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh),其中根据实施例36至66中任一项所述的方法检测所述hla基因的loh。
[0319]
实施例68.一种选择针对患有癌症的个体的疗法的方法,所述方法包括检测来自所述个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh),其中根据实施例36至66中任一项所述的方法检测所述hla基因的loh。
[0320]
实施例69.一种识别针对患有癌症的个体的一个或多个治疗选项的方法,所述方法包括:
[0321]
(a)获取对于来自所述个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中根据实施例36至66中任一项所述的方法检测所述hla基因的loh;以及
[0322]
(b)生成报告,所述报告包括至少部分地基于所述了解针对所述个体识别的一个或多个治疗选项。
[0323]
实施例70.根据实施例67至69中任一项所述的方法,其中所述样品中的所述hla基因的loh指示所述个体不太可能受益于包含ici的治疗。
[0324]
实施例71.根据实施例70所述的方法,其中所述一个或多个治疗选项不包括包含ici的治疗。
[0325]
实施例72.一种选择针对患有癌症的个体的治疗的方法,其包括获取对于来自患有癌症的个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中根据实施例36至66中任一项所述的方法检测所述hla基因的loh,并且其中响应于所述了解的所述获取:(i)所述个体被归类为不接受用免疫检查点抑制剂(ici)进行治疗的候选者;(ii)所
述个体被识别为不太可能对包含免疫检查点抑制剂(ici)的治疗产生应答;和/或(iii)所述个体被归类为接受除免疫检查点抑制剂(ici)之外的治疗的候选者。
[0326]
实施例73.一种预测用免疫检查点抑制剂(ici)进行治疗的患有癌症的个体的存活期的方法,其包括获取对于来自所述个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中根据实施例36至66中任一项所述的方法检测所述hla基因的loh,并且其中响应于所述了解的所述获取,预测所述个体在接受用所述ici进行治疗后与接受用所述ici进行治疗的其癌症未表现出所述hla基因的loh的个体的存活期相比具有较短的存活期。
[0327]
实施例74.一种监测患有癌症的个体的方法,其包括获取对于来自所述个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中根据实施例36至66中任一项所述的方法检测所述hla基因的loh,并且其中响应于所述了解的所述获取,预测所述个体与其癌症未表现出所述hla基因的loh的个体相比具有增加的复发风险。
[0328]
实施例75.一种评估患有癌症的个体的方法,其包括获取对于来自所述个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中根据实施例36至66中任一项所述的方法检测所述hla基因的loh,并且其中所述hla基因的所述loh将所述个体识别为与其癌症未表现出所述hla基因的loh的个体相比具有增加的复发风险。
[0329]
实施例76.一种筛选患有癌症的个体的方法,其包括获取对于来自所述个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中根据实施例36至66中任一项所述的方法检测所述hla基因的loh,并且其中响应于所述了解的所述获取,预测所述个体与其癌症未表现出所述hla基因的loh的个体相比具有增加的复发风险。
[0330]
实施例77.根据实施例67至76中任一项所述的方法,其中所述hla基因的loh通过以下方式确定:
[0331]
a)在一个或多个处理器处接收针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸进行测序获得了所述多个序列读段;
[0332]
b)在一个或多个处理器处接收针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;
[0333]
c)由所述一个或多个处理器确定目标函数,所述目标函数测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;
[0334]
d)由所述一个或多个处理器确定优化模型,所述优化模型被配置为最小化所述目标函数;
[0335]
e)由所述一个或多个处理器基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及
[0336]
f)由所述一个或多个处理器确定当所述hla等位基因的所述经调整的等位基因频率小于预先确定的阈值时loh已经发生。
[0337]
实施例78.一种治疗癌症或延缓癌症进展的方法,其包括:
[0338]
(1)检测从个体获得的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh),其中所述hla基因的loh通过以下方式来检测:
[0339]
a)在一个或多个处理器处接收针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸进行测序获得了所述多个序列读段;
[0340]
b)在一个或多个处理器处接收针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;
[0341]
c)由所述一个或多个处理器执行目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;
[0342]
d)由所述一个或多个处理器执行优化模型以最小化所述目标函数;
[0343]
e)由所述一个或多个处理器基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及
[0344]
f)由所述一个或多个处理器确定当所述hla等位基因的所述经调整的等位基因频率小于预先确定的阈值时loh已经发生;以及
[0345]
(2)至少部分地基于检测到所述hla基因的loh,向所述个体施用有效量的除免疫检查点抑制剂(ici)之外的治疗。
[0346]
实施例79.一种治疗癌症或延缓癌症进展的方法,其包括:
[0347]
(1)检测在从个体获得的样品中不存在人白细胞抗原(hla)基因的杂合性缺失(loh),其中不存在所述hla基因的loh通过以下方式来检测:
[0348]
a)在一个或多个处理器处接收针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸进行测序获得了所述多个序列读段;
[0349]
b)在一个或多个处理器处接收针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;
[0350]
c)由所述一个或多个处理器执行目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;
[0351]
d)由所述一个或多个处理器执行优化模型以最小化所述目标函数;
[0352]
e)由所述一个或多个处理器基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及
[0353]
f)由所述一个或多个处理器确定当所述hla等位基因的所述经调整的等位基因频率大于预先确定的阈值时loh尚未发生;以及
[0354]
(2)至少部分地基于检测到不存在所述hla基因的loh,向所述个体施用有效量的免疫检查点抑制剂(ici)。
[0355]
实施例80.根据实施例67至79中任一项所述的方法,其中所述ici包括pd-1抑制剂、pd-l1抑制剂或ctla-4抑制剂。
[0356]
实施例81.根据实施例67至80中任一项所述的方法,其中所述方法进一步包括检测从所述个体获得的样品中的肿瘤突变负荷(tmb)。
[0357]
实施例82.根据实施例67至80中任一项所述的方法,其中所述方法进一步包括获取对于从所述个体获得的样品中的肿瘤突变负荷(tmb)的了解。
[0358]
实施例83.根据实施例67至82中任一项所述的方法,其中所述治疗或者所述一个或多个治疗选项进一步包括第二治疗剂。
[0359]
实施例84.根据实施例67至69以及72至83中任一项所述的方法,其中所述样品中的所述hla基因的loh以及高tmb指示所述个体可能受益于包含免疫检查点抑制剂(ici)的治疗。
[0360]
实施例85.根据实施例84所述的方法,其中所述一个或多个治疗选项包括包含ici的治疗。
[0361]
实施例86.根据实施例81至85中任一项所述的方法,其中在从所述个体获得的相同样品中检测到所述hla基因的loh以及高tmb。
[0362]
实施例87.根据实施例81至85中任一项所述的方法,其中在从所述个体获得的不同样品中检测到所述hla基因的loh以及高tmb。
[0363]
实施例88.一种选择针对患有癌症的个体的治疗的方法,其包括:(a)获取对于来自患有癌症的个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中根据实施例36至66中任一项所述的方法检测所述hla基因的loh;以及(b)获取对于来自患有癌症的所述个体的样品中的高肿瘤突变负荷(tmb)的了解;其中响应于(a)和(b)中的所述了解的所述获取:(i)所述个体被归类为接受用免疫检查点抑制剂(ici)进行治疗的候选者;(ii)所述个体被识别为可能对包含免疫检查点抑制剂(ici)的治疗产生应答;和/或(iii)所述个体被归类为接受包含免疫检查点抑制剂(ici)的治疗的候选者。
[0364]
实施例89.一种预测接受用免疫检查点抑制剂(ici)治疗的患有癌症的个体的存活期的方法,其包括:(a)获取对于来自所述个体的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh)的了解,其中根据实施例36至66中任一项所述的方法检测所述hla基因的loh,(b)获取对于来自所述个体的样品中的高肿瘤突变负荷(tmb)的了解;其中响应于(a)和(b)中的所述了解的所述获取,预测所述个体在接受用所述ici进行治疗后与接受用所述ici进行治疗的其癌症具有hla基因的loh但没有高tmb的个体的存活期相比具有较长的存活期。
[0365]
实施例90.一种治疗癌症或延缓癌症进展的方法,其包括:
[0366]
(1)检测从个体获得的样品中的人白细胞抗原(hla)基因的杂合性缺失(loh),其中所述hla基因的loh通过以下方式来检测:
[0367]
a)在一个或多个处理器处接收针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸进行测序获得了所述多个序列读段;
[0368]
b)在一个或多个处理器处接收针对所述hla等位基因对所述诱饵分子的相对结合
倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;
[0369]
c)由所述一个或多个处理器执行目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;
[0370]
d)由所述一个或多个处理器执行优化模型以最小化所述目标函数;
[0371]
e)由所述一个或多个处理器基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及
[0372]
f)由所述一个或多个处理器确定当所述hla等位基因的所述经调整的等位基因频率小于预先确定的阈值时loh已经发生;
[0373]
(2)检测从所述个体获得的样品中的高肿瘤突变负荷(tmb);以及
[0374]
(3)至少部分地基于检测到所述hla基因的loh以及高tmb,向所述个体施用有效量的包含免疫检查点抑制剂(ici)的治疗。
[0375]
实施例91.一种非暂时性计算机可读存储介质,其包括能够由一个或多个计算机处理器执行以执行方法的一个或多个程序,所述方法包括:
[0376]
使用一个或多个处理器识别多个化学反应,使得:
[0377]
每个反应对应于与多态性基因的不同等位基因结合的诱饵分子,并且每个反应导致对应等位基因分数的捕获;
[0378]
所述多个化学反应包括反应的第一子集和反应的第二子集,其中所述第一子集和所述第二子集不共享共同的反应,并且其中所述第一子集和所述第二子集各自包括至少一个化学反应;
[0379]
使用所述一个或多个处理器识别多个反应式,所述多个反应式共同地关联每个化学反应的结合倾向和每个捕获的等位基因的等位基因分数;
[0380]
在所述一个或多个处理器处接收所述多个化学反应的所述第一子集的凭经验识别的相对结合倾向;以及
[0381]
使用所述一个或多个处理器通过最小化总误差来识别所述第二子集的所述相对结合倾向。
[0382]
实施例92.根据实施例91所述的非暂时性计算机可读存储介质,其中最小化所述总误差受制于中值相对结合倾向等于1的约束。
[0383]
实施例93.根据实施例91所述的非暂时性计算机可读存储介质,其中一种相对结合倾向被设定为等于1。
[0384]
实施例94.根据实施例91所述的非暂时性计算机可读存储介质,其中最小化所述总误差包括执行最小二乘法。
[0385]
实施例95.根据实施例91所述的非暂时性计算机可读存储介质,其中所述方法进一步包括:
[0386]
在所述一个或多个处理器处接收患者的dna样品中的经测量的原始等位基因频率,其中通过执行杂交捕获过程测量了所述经测量的原始等位基因频率;以及
[0387]
在所述一个或多个处理器处,使用相对结合倾向的所述第一子集和所述第二子集来缩放所述经测量的原始等位基因频率,从而减小抽样偏差。
[0388]
实施例96.根据实施例91所述的非暂时性计算机可读存储介质,其中所述多态性基因包括人白细胞抗原基因。
[0389]
实施例97.根据实施例91所述的非暂时性计算机可读存储介质,其中所述多态性基因为st7/ray1、arh1/noey2、tslc1、rb、pten、smad2、smad4、dcc、tp53、atm、mir-15a、mir-16-1、nat2、brca1、brca2、hogg1、cdh1、igf2、cdkn1c/p57、men1、prkar1a、h19、kras、bap1、ptch1、smo、sufu、notch1、ppp6c、lats1、casp8、ptpn14、arid1a、fbxw7、m6p/igf2r、ifn-α、嗅觉受体基因、cbfa2t3、dutt1、fhit、apc、p16、fcmd、tsc2、mir-34、c-mpl、runx3、diras3、nras、mir-9、fam50b、plagl1、er、flt3、zdbf2、gpr1、c-kit、nap1l5、grb10、egfr、peg10、braf、mest、jak2、dapk1、lit1、wt1、nf-1、pr、c-cbl、dlk1、akt1、snurf、细胞色素p450基因(cyp)、znf587、socs1、timp2、runx1、ar、cebpa、c19mc、emp3、znf331、cdkn2a、peg3、nnat、gnas或gata5。
[0390]
实施例98.根据实施例95所述的非暂时性计算机可读存储介质,其中所述方法进一步包括在所述一个或多个处理器处确定所述患者是否已经历杂合性缺失。
[0391]
实施例99.一种用于在治疗个体中的癌症或延缓个体中的癌症进展的方法中使用的免疫检查点抑制剂(ici),其中已通过以下方式检测到在从所述个体获得的样品中不存在人白细胞抗原(hla)基因的杂合性缺失(loh):
[0392]
a)在一个或多个处理器处接收针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸进行测序获得了所述多个序列读段;
[0393]
b)在一个或多个处理器处接收针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;
[0394]
c)由所述一个或多个处理器执行目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;
[0395]
d)由所述一个或多个处理器执行优化模型以最小化所述目标函数;
[0396]
e)由所述一个或多个处理器基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及
[0397]
f)由所述一个或多个处理器确定当所述hla等位基因的所述经调整的等位基因频率大于预先确定的阈值时loh尚未发生。
[0398]
实施例100.一种用于在治疗个体中的癌症或延缓个体中的癌症进展的方法中使用的免疫检查点抑制剂(ici),其中已通过以下方式在从所述个体获得的样品中检测到人白细胞抗原(hla)基因的杂合性缺失(loh)以及高肿瘤突变负荷(tmb):
[0399]
a)在一个或多个处理器处接收针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸进行测序获得了所述多个序列读段;
[0400]
b)在一个或多个处理器处接收针对所述hla等位基因对所述诱饵分子的相对结合
倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;
[0401]
c)由所述一个或多个处理器执行目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;
[0402]
d)由所述一个或多个处理器执行优化模型以最小化所述目标函数;
[0403]
e)由所述一个或多个处理器基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;
[0404]
f)由所述一个或多个处理器确定当所述hla等位基因的所述经调整的等位基因频率小于预先确定的阈值时loh已经发生;以及
[0405]
g)获取对于从所述个体获得的样品中的高tmb的了解或检测从所述个体获得的样品中的高tmb。
[0406]
实施例101.一种在用于治疗个体中的癌症或延缓个体中的癌症进展的药物的制造中使用的免疫检查点抑制剂(ici),其中已通过以下方式在从所述个体获得的样品中检测到人白细胞抗原(hla)基因的杂合性缺失(loh)以及高肿瘤突变负荷(tmb):
[0407]
a)在一个或多个处理器处接收针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸进行测序获得了所述多个序列读段;
[0408]
b)在一个或多个处理器处接收针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;
[0409]
c)由所述一个或多个处理器执行目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;
[0410]
d)由所述一个或多个处理器执行优化模型以最小化所述目标函数;
[0411]
e)由所述一个或多个处理器基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及
[0412]
f)由所述一个或多个处理器确定当所述hla等位基因的所述经调整的等位基因频率小于预先确定的阈值时loh已经发生;以及
[0413]
g)获取对于从所述个体获得的样品中的高tmb的了解或检测从所述个体获得的样品中的高tmb。
[0414]
实施例102.一种在用于治疗个体中的癌症或延缓个体中的癌症进展的药物的制造中使用的免疫检查点抑制剂(ici),其中已通过以下方式检测到在从所述个体获得的样品中不存在人白细胞抗原(hla)基因的杂合性缺失(loh):
[0415]
a)在一个或多个处理器处接收针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸进行测序获得了所述多个序列读段;
[0416]
b)在一个或多个处理器处接收针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;
[0417]
c)由所述一个或多个处理器执行目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;
[0418]
d)由所述一个或多个处理器执行优化模型以最小化所述目标函数;
[0419]
e)由所述一个或多个处理器基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及
[0420]
f)由所述一个或多个处理器确定当所述hla等位基因的所述经调整的等位基因频率大于预先确定的阈值时loh尚未发生。
[0421]
实施例103.一种系统,其包括:
[0422]
一个或多个处理器;以及
[0423]
存储器,其被配置为存储一个或多个计算机程序指令,其中所述一个或多个计算机程序指令当由所述一个或多个处理器执行时被配置为:
[0424]
识别多个化学反应,使得:
[0425]
每个反应对应于与多态性基因的不同等位基因结合的诱饵分子,并且每个反应导致对应等位基因分数的捕获;
[0426]
所述多个化学反应包括反应的第一子集和反应的第二子集,其中所述第一子集和所述第二子集不共享共同的反应,并且其中所述第一子集和所述第二子集各自包括至少一个化学反应;
[0427]
识别多个反应式,所述多个反应式共同地关联每个化学反应的结合倾向和每个捕获的等位基因的等位基因分数;
[0428]
接收所述多个化学反应的所述第一子集的凭经验识别的相对结合倾向;以及
[0429]
通过最小化总误差来识别所述第二子集的所述相对结合倾向。
[0430]
实施例104.根据实施例103所述的系统,其中最小化所述总误差受制于中值相对结合倾向等于1的约束。
[0431]
实施例105.根据实施例103所述的系统,其中一种相对结合倾向被设定为等于1。
[0432]
实施例106.根据实施例103所述的系统,其中最小化所述总误差包括执行最小二乘法。
[0433]
实施例107.根据实施例103所述的系统,其中所述一个或多个计算机程序指令当由所述一个或多个处理器执行时被进一步配置为:
[0434]
接收患者的dna样品中的经测量的原始等位基因频率,其中通过执行杂交捕获过程测量了所述经测量的原始等位基因频率;以及
[0435]
使用相对结合倾向的所述第一子集和所述第二子集来缩放所述经测量的原始等位基因频率,从而减小抽样偏差。
[0436]
实施例108.根据实施例103所述的系统,其中所述多态性基因包括人白细胞抗原基因。
[0437]
实施例109.根据实施例103所述的系统,其中所述多态性基因为st7/ray1、arh1/
noey2、tslc1、rb、pten、smad2、smad4、dcc、tp53、atm、mir-15a、mir-16-1、nat2、brca1、brca2、hogg1、cdh1、igf2、cdkn1c/p57、men1、prkar1a、h19、kras、bap1、ptch1、smo、sufu、notch1、ppp6c、lats1、casp8、ptpn14、arid1a、fbxw7、m6p/igf2r、ifn-α、嗅觉受体基因、cbfa2t3、dutt1、fhit、apc、p16、fcmd、tsc2、mir-34、c-mpl、runx3、diras3、nras、mir-9、fam50b、plagl1、er、flt3、zdbf2、gpr1、c-kit、nap1l5、grb10、egfr、peg10、braf、mest、jak2、dapk1、lit1、wt1、nf-1、pr、c-cbl、dlk1、akt1、snurf、细胞色素p450基因(cyp)、znf587、socs1、timp2、runx1、ar、cebpa、c19mc、emp3、znf331、cdkn2a、peg3、nnat、gnas或gata5。
[0438]
实施例110.根据实施例107所述的系统,其中所述一个或多个计算机程序指令当由所述一个或多个处理器执行时被进一步配置为确定所述患者是否已经历杂合性缺失。
[0439]
实施例111.一种非暂时性计算机可读存储介质,其包括能够由一个或多个计算机处理器执行以执行方法的一个或多个程序,所述方法包括:
[0440]
使用所述一个或多个处理器接收针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸进行测序获得了所述多个序列读段;
[0441]
使用所述一个或多个处理器接收针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;
[0442]
使用所述一个或多个处理器执行目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;
[0443]
使用所述一个或多个处理器执行优化模型以最小化所述目标函数;
[0444]
使用所述一个或多个处理器基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及
[0445]
使用所述一个或多个处理器确定当所述hla等位基因的所述经调整的等位基因频率小于预先确定的阈值时loh已经发生。
[0446]
实施例112.根据实施例111所述的非暂时性计算机可读存储介质,其中所述hla基因为人hla-a基因、人hla-b基因或人hla-c基因。
[0447]
实施例113.根据实施例111或实施例112所述的非暂时性计算机可读存储介质,其中通过对从包括肿瘤细胞和/或肿瘤核酸的样品获得的核酸执行测序获得了所述多个序列读段。
[0448]
实施例114.根据实施例113所述的非暂时性计算机可读存储介质,其中所述样品进一步包含非肿瘤细胞。
[0449]
实施例115.根据实施例113所述的非暂时性计算机可读存储介质,其中所述样品来自肿瘤活组织切片或肿瘤样本。
[0450]
实施例116.根据实施例113所述的非暂时性计算机可读存储介质,其中所述样品包含肿瘤细胞外dna(cfdna)。
[0451]
实施例117.根据实施例113所述的非暂时性计算机可读存储介质,其中所述样品
包含流体、细胞或组织。
[0452]
实施例118.根据实施例117所述的非暂时性计算机可读存储介质,其中所述样品包含血液或血浆。
[0453]
实施例119.根据实施例113所述的非暂时性计算机可读存储介质,其中所述样品包含肿瘤活组织切片或循环肿瘤细胞。
[0454]
实施例120.根据实施例113所述的非暂时性计算机可读存储介质,其中所述样品为核酸样品。
[0455]
实施例121.根据实施例120所述的非暂时性计算机可读存储介质,其中所述核酸样品包含mrna、基因组dna、循环肿瘤dna、细胞外dna或细胞外rna。
[0456]
实施例122.根据实施例111至121中任一项所述的非暂时性计算机可读存储介质,其中所述方法进一步包括:
[0457]
使用所述一个或多个处理器从多个序列读段确定肿瘤突变负荷(tmb),其中通过对基因组的至少一部分的核酸进行测序获得了所述多个序列读段。
[0458]
实施例123.根据实施例122所述的非暂时性计算机可读存储介质,其中所述tmb基于每兆碱基经测序的基因组的非驱动基因体细胞编码突变的数量来确定。
[0459]
实施例124.一种系统,其包括:
[0460]
一个或多个处理器;以及
[0461]
存储器,其被配置为存储一个或多个计算机程序指令,其中所述一个或多个计算机程序指令当由所述一个或多个处理器执行时被配置为:
[0462]
确定针对hla等位基因的观察到的等位基因频率,其中观察到的等位基因频率对应于:如在与hla基因相对应的多个序列读段中检测到的对所述hla等位基因的至少一部分编码的核酸的频率,其中通过对编码如通过与诱饵分子杂交捕获的所述基因或其一部分的核酸进行测序获得了所述多个序列读段;
[0463]
确定针对所述hla等位基因对所述诱饵分子的相对结合倾向,其中所述hla等位基因的所述相对结合倾向对应于:对所述hla等位基因的至少一部分编码的核酸在存在对一个或多个其他hla等位基因的部分编码的核酸的情况下结合所述诱饵分子的倾向;
[0464]
执行目标函数以测量所述hla等位基因的所述相对结合倾向与所述观察到的等位基因频率之间的差;
[0465]
执行优化模型以最小化所述目标函数;
[0466]
基于所述优化模型和所述观察到的等位基因频率来确定所述hla等位基因的经调整的等位基因频率;以及
[0467]
确定当所述hla等位基因的所述经调整的等位基因频率小于预先确定的阈值时loh已经发生。
[0468]
实施例125.根据实施例124所述的系统,其中所述hla基因为人hla-a基因、人hla-b基因或人hla-c基因。
[0469]
实施例126.根据实施例124或实施例125所述的系统,其中通过对从包括肿瘤细胞和/或肿瘤核酸的样品获得的核酸执行测序获得了所述多个序列读段。
[0470]
实施例127.根据实施例126所述的系统,其中所述样品进一步包含非肿瘤细胞。
[0471]
实施例128.根据实施例126所述的系统,其中所述样品来自肿瘤活组织切片或肿
瘤样本。
[0472]
实施例129.根据实施例126所述的系统,其中所述样品包含肿瘤细胞外dna(cfdna)。
[0473]
实施例130.根据实施例126所述的系统,其中所述样品包含流体、细胞或组织。
[0474]
实施例131.根据实施例130所述的系统,其中所述样品包含血液或血浆。
[0475]
实施例132.根据实施例126所述的系统,其中所述样品包含肿瘤活组织切片或循环肿瘤细胞。
[0476]
实施例133.根据实施例126所述的系统,其中所述样品为核酸样品。
[0477]
实施例134.根据实施例133所述的系统,其中所述核酸样品包含mrna、基因组dna、循环肿瘤dna、细胞外dna或细胞外rna。
[0478]
实施例135.根据实施例124至134中任一项所述的系统,其中所述一个或多个计算机程序指令当由所述一个或多个处理器执行时被进一步配置为:
[0479]
使用所述一个或多个处理器从多个序列读段获取对于肿瘤突变负荷(tmb)的了解或检测所述tmb,其中通过对基因组的至少一部分的核酸进行测序获得了所述多个序列读段。
[0480]
实施例136.根据实施例135所述的系统,其中所述tmb基于每兆碱基经测序的基因组的非驱动基因体细胞编码突变的数量来确定。
[0481]
本文描述的本发明的方法步骤旨在包括致使一个或多个其他参与方或实体执行这些步骤的任何合适的方法,除非明确提供不同的含义或以其他方式从上下文中是清楚的。此类参与方或实体无需受任何其他参与方或实体的指导或控制,也无需位于特定管辖范围内。因此,例如,“将第一个数字添加到第二个数字”的描述或引用包括致使一个或多个参与方或实体将这两个数字相加在一起。例如,如果x者与y者进行公平交易以将这两个数字相加,并且y者确实将两个数字相加,则x者和y者两者都执行所述步骤:y者是因为他实际将数字相加的事实,并且x者是因为他致使y者将数字相加的事实。此外,如果x者位于美国境内并且y者位于美国境外,则由于x者参与致使该步骤被执行,因此该方法在美国境内被执行。
[0482]
在本文中描述的各种实施例的描述中使用的术语仅用于描述特定实施例的目的并且不旨在是限制性的。如在所描述的各种实施例和所附权利要求的描述中所用,单数形式“一个”、“一种”和“该”也旨在包括复数形式,除非上下文另外明确地指出。还应理解,如本文所用的术语“和/或”是指并涵盖一个或多个相关列出的项目的任何和所有可能的组合。还应进一步理解,当在本说明书中使用术语“包括(includes)”、“包括(including)”、“包含(comprises)”和/或“包含(comprising)”时,其指定了所陈述的特征、整数、步骤、操作、要素和/或组分的存在,但并不排除存在或添加一个或多个其他特征、整数、步骤、操作、要素、组分和/或它们的组。
[0483]
本文提及的所有出版物、专利和专利申请的公开内容均据此以引用其整体的方式并入本文。如果以引用方式并入的任何参考文献与本公开相冲突,应以本公开为准。
[0484]
实例
[0485]
通过参考以下实施例将更全面地理解本发明。但是,它们不应被解释为限制本发明的范围。应当理解,本文描述的实例和实施例仅用于说明目的,并且其各种修改或改变将
被建议给本领域技术人员,并且将被包括在本技术的精神和界限内以及本发明所附权利要求的范围内。
[0486]
实例1:体细胞hla i类缺失是癌症免疫逃避的普遍机制,其改进了肿瘤突变负荷作为检查点抑制剂应答的生物标志物的使用
[0487]
该实例描述了旨在预测在经ici治疗的非小细胞肺癌(nsclc)中从体细胞hla-i loh的患者存活的实验结果。该实例还描述了确定在各种癌症类型之间和具有高肿瘤突变负荷(tmb)的肿瘤中hla-i loh的发生率的实验。
[0488]
免疫检查点抑制剂(ici)彻底改变了晚期癌症患者的当前治疗,并被认为可以重振患者自身的t细胞介导的免疫应答[1-5]。cd8 t细胞经由在人类白细胞抗原i类(hla-i)编码的主要组织相容性复合物i类(mhc-i)蛋白上呈递肿瘤特异性突变肽(新抗原)来识别肿瘤细胞[6-8]。这一假设得到了ici在具有高肿瘤突变负荷(tmb)的疾病中的疗效以及tmb作为检查点抑制剂应答的生物标志物的潜在泛癌效用的支持。然而,在仅关注非小细胞肺癌(nsclc)的试验中,tmb未能充分预测患者存活期[2,5,9]。然而,使用hla基因分型来预测新抗原呈递的相对效率以及使用该信息与tmb一起来预测检查点应答的努力颇具前景(goodman am,等人genome med.2020;12(1):45;shim jh,等人ann oncol.2020;31(7):902-11)。
[0489]
如图4a中所预测的,hla-i的缺失可导致呈递给免疫细胞的新抗原较少并可导致免疫逃逸。图4b进一步示出了hla-i loh与免疫应答之间的关系。hla-i loh通过新抗原与tmb相关,并作为逃避机制与pd-l1相关。在该实例中,hla-i的体细胞缺失被证明是经ici治疗的nsclc中患者存活的负向预测因子,这减弱了高tmb的影响。还确定了59个疾病组中的83,000多个患者样品中的体细胞hla-i loh的情况,发现泛癌发生率为17%,并且在具有高tmb的肿瘤和以pd-l1表达为代表的发炎肿瘤中显著富集。组合的tmb和hla-i loh可更好地选择最有可能从ici中受益的发炎癌症患者,并对个性化癌症疫苗的设计产生影响。
[0490]
材料和方法
[0491]
基因组分析
[0492]
在经临床实验室改进修正案(clia)认证、经美国病理学家学院(cap)认可、经纽约州批准的实验室中,使用有针对性的综合性基因组分析测定法将基因组数据作为针对83,664明患者的常规临床护理的一部分进行了收集,如先前所述[20]。提取了dna并对315个基因的所有编码外显子以及在癌症中经常重排的28个内含子进行了杂交捕获。对文库测序到了>500x的中值覆盖深度。对基因组改变进行了分析,包括短变体改变(碱基替换、插入和缺失)、拷贝数改变(扩增和纯合缺失)以及基因重排,如先前所述[20,21]。tmb被定义为每兆碱基经测序的基因组中非驱动基因体细胞编码突变的数量[22]。在具有≥20个非驱动基因体细胞错义突变的样品中确定了突变特征,包括沉默和非编码改变。使用人类癌症突变过程的cosmic特征对特征进行了分配,如zehir等人先前所述[23]。如果样品有≥40%适配突变过程,则确定为阳性状态。通过velvet[24]重新组装未映射到人类参考基因组(hg19)的测序读段进行了病毒dna检测。组装的重叠群通过blastn(blast v2.6.0[25])竞争性地映射到了>300万个病毒核苷酸序列的ncbi数据库,并且阳性病毒状态由与blast序列具有≥97%的同一性的长度≥80个核苷酸的重叠群确定。
[0493]
组织学
[0494]
pd-l1状态通过对福尔马林固定石蜡包埋(ffpe)组织切片进行的免疫组织化学确定,其中使用了可商购获得的抗体克隆22c3(dako/agilent,santa clara,ca,usa)或sp142(ventana,tuscon,az,usa)。病理学家确定了表达的肿瘤细胞百分比(0%-100%)和表达强度(0,1 ,2 )。pd-l1表达被报告为具有染色强度≥1 的肿瘤细胞的百分比的连续变量。针对每个样品的pd-l1表达也汇总为阴性(<1%肿瘤细胞)或阳性(≥1%肿瘤细胞)。病理学实验室按照临床实验室改进修正案(clia
′
88)的要求并根据美国病理学家协会(cap)清单要求和指南确定了针对该测定的性能特征。雌激素受体(er)和孕激素受体(pr)状态从病理报告进行了手动提取,或通过自动机器读段算法验证为针对er的准确度为97%并且针对pr的准确度为94%。来自下一代测序(ngs)的基因组扩增状态用于her2(erbb2)阳性[20]。
[0495]
hla杂合性缺失确定和新抗原预测
[0496]
使用sgz(体细胞-种系-接合性)算法确定了hla-i接合性,这是先前由sun等人[21]描述的一种计算方法,其用于从混合肿瘤正常样品(20-95%肿瘤)的下一代测序结果预测接合性。简而言之,sgz通过考虑肿瘤纯度、肿瘤倍性、次要等位基因频率和每个基因组片段的局部拷贝数来对接合性建模。分别计算了每个hla-i基因的次要等位基因频率(hla-a、-b和-c)。测序结果的hla-i基因分型通过optitype[26]v1.3.1进行至四位分辨率。与每个样品的种系等位基因匹配的hla参考序列从ipd-imgt/hla数据库中获得[27]。仅针对loh的种系杂合等位基因进行了评估,并且在本研究中未使用在所有三个基因座处识别为种系纯合的样品。
[0497]
使用samtools[28]v1.5提取了与人类参考基因组(hg19,6p21-22)的hla区域对齐的测序读段以及所有未映射的读段。picard v1.56用于去除所有pcr和光学复制。使用bwa[28]v0.7.17将读段与特异于每个样品的hla参考序列竞争性地重新比对。samtools v1.5用于仅保留唯一对齐的读段并去除所有未成对的配对。使用blast v2.6.0在每个种系杂合性同源等位基因之间进行局部比对。btop函数用于识别每个同源等位基因之间的错配位置。
[0498]
samtools v1.5用于收集与每个错配位置对齐的所有唯一读段,并且针对每个等位基因的等位基因频率计算为与一个同源等位基因唯一对齐的读段数除以与两个同源等位基因唯一对齐的读段的总数。引诱式测序方法用于分离目标区域。对于hla-i基因座而言,观察到了同源hla对具有一致的等位基因频率(af)歪曲(图4e)。为了说明杂交对由hla类型引起的引诱效率的影响,将观察到的af(obsaf)建模为af的函数以及针对诱饵的hla类型的关联常数。
[0499][0500]
其中obsaf
i,j
为在i,j对中观察到的hla类型i的等位基因频率;ki为hla类型i的关联常数,并且af
i,j
为具有i,j对的样品中hla类型i的等位基因频率。注意af
i,j
=1-af
j,i
。
[0501]
为了拟合关联常数,假设等位基因平衡(af
i,j
=1-af
j,i
)。鉴于大多数样品不处于loh,所有样品的中值等位基因频率与同一对同源hla类型一起使用。还添加了需要50个样品才能提供代表性af的约束。因此,
[0502]
[0503][0504]
结合这些方程得到:
[0505][0506]
为了确定针对每种hla类型的最佳k值,使用了最小二乘拟合:
[0507][0508]
针对所有对确定k值后,可以从观察到的等位基因频率确定输入等位基因频率:
[0509][0510]
评估了关联常数(k值)如何映射到hla-a中的序列多样性。hla-a两位序列的树状图显示两个主要分支,其中一个分支的k值>1,而另一个分支的k值<1,从而支持了序列驱动的杂交效应是maf歪曲的根本原因的假设(图4f)。诱饵分子的序列描绘在图4g所示的树状图中。与被引诱的序列差异最大的hla单倍型具有比与诱饵序列更密切相关的单倍型更差的结合。
[0511]
使用该模型,从观察到的次要等位基因频率计算出了代表样品中的真实等位基因频率的经调整的次要等位基因频率。然后将经调整的次要等位基因频率用于上述sgz算法中。在被识别为具有hla-i loh的基因座处,具有较低等位基因频率的等位基因被确定为处于loh的等位基因。
[0512]
新抗原预测
[0513]
使用mhcpan-4.0和iedb api计算出了针对所有野生型和突变肽的端到端处理和mhc-i结合预测[14]。api产生蛋白酶体切割评分、tap转运评分和mhc-i结合亲和力,以及以hla与肽特异性方式结合这些上述值的总评分。至少-0.8的总评分和至多500nm的mhc-i结合亲和力用于将给定样品中的每个肽作为结合剂或非结合剂进行二分。在识别出结合剂后,针对其野生型对应物对结合剂突变肽进行了过滤。
[0514]
临床队列和存活分析
[0515]
回顾性临床分析利用了现实临床基因组数据集(截至2019年6月30日收集的数据),其中包括针对数据库中接受了综合性基因组分析的患者的电子健康记录(ehr)数据[11]。除了由训练有素的医疗记录提取者遵循预先指定的标准化政策和程序经由技术支持的图表抽象从医生的笔记中收集的非结构化数据(例如吸烟状况、组织学)之外,来自ehr的去识别的患者级临床数据还包括结构化数据(例如,规定的治疗、接受的治疗、治疗开始日期)。去识别的患者级基因组数据包括由综合性基因组分析报告的样本(例如肿瘤突变负荷、病理肿瘤纯度)和基因组(例如基因改变、改变类型)数据。
[0516]
被纳入临床分析中的患者被诊断为患有非鳞状nsclc,并且针对egfr和alk改变呈阴性。接受了多种二线ici单一疗法,包括纳武单抗、派姆单抗、德瓦鲁单抗和阿特珠单抗。研究的主要临床终点是从二线ici方案开始直到死亡或失访的总体存活期。在存活分析中,考虑到左侧截断,患者仅在其测序报告日及2011年1月1日或之后在flatiron网络中的其第二次访视中的较晚者之后才被视为有死亡风险,因为两者都是针对纳入队列中的要求。对
于kaplan-meier分析而言,对数秩检验用于比较组。在多变量分析中,当针对种族/民族、二线ici开始时的年龄、接受的一线疗法和医疗实践类型进行调整时,该队列中的存活结果的显著性不受影响。在r软件3.6.0版(用于统计计算的r foundation)上进行了分析。
[0517]
患者同意和数据可用性
[0518]
针对本研究的批准,从西方机构审查委员会获得了包括放弃知情同意和hipaa授权放弃(协议号20152817)。未同意患者发布原始测序数据。
[0519]
结果
[0520]
为了评估等位基因特异性hla-i loh的景观,开发了仅针对肿瘤的下一代组织活组织切片测序的流程,该流程可以检测hla-i基因座处的杂合性缺失(loh)以及种系纯合性(hla-a、-b和-c)。该流程的概览描绘在图4c中。用于检测hla-i loh的其他方法学考虑因素示出在图4d中。
[0521]
临床基因组数据库中的已知基因组关联性的存活概率的影响示出在图5a和图5b中。tmb高与存活期呈正相关(hr=0.76,p=0.007),如图5a所示。然而,发现stk11或keap1的缺失与存活期呈负相关(hr=1.3,p=0.009),如图5b所示。
[0522]
根据之前的报告[10],具有hla-i loh的非鳞状nsclc(归类为至少一个hla-i等位基因的体细胞loh)针对具有tmb高(≥10个突变每兆碱基[突变/mb])、pd-l1 (≥1%肿瘤比例评分)、吸烟和apobec突变特征、肿瘤转移以及tp53中的改变的样品进行了富集,如图6a所示。为了研究hla-i loh对ici治疗的影响,采用了现实的临床基因组数据集[11]来分析于2014年7月至2019年2月之间接受了二线ici单一疗法的具有egfr和alk野生型非鳞状nsclc的240名患者的队列。表1汇总了现实的临床基因组队列中的患者的特征。
[0523]
表1.现实临床基因组队列中的患者的特征
[0524][0525][0526]
选择了经二线ici治疗的队列,因为在同时获得fda批准的情况下,无论pd-l1状态如何,患者都可能接受了治疗[12]。在二线ici开始时,该队列的总体存活期中值(mos)为10.8个月,25%出现hla-i loh,59%为女性,并且年龄中值为68岁。当按hla-i loh对队列进行分层时,包括活组织切片定时在内,没有人口统计学变量有显著差异(p>0.05)。按照体细胞hla-i loh进行的分层显示,与hla-i完整组相比,hla-i loh组中的存活期显著降低(mos缺失:8个月[5.2-13.1];mos完整:11.3个月[8.2-15.3];针对hla-i完整的hr=0.68[0.49-0.95];p=0.02)。图6b描绘了该分析的结果。相比之下,在赞助的随机对照临床试验中,针对所有接受了用ici进行治疗的二线非鳞状nsclc患者的mos为12.2个月,而
对照组中接受多西他赛的患者的mos证实为9.4个月[13]。在cgbd中没有观察到活组织切片定时的影响,如图6c所示。
[0527]
通过tmb进一步对患者分层,截止值为10个突变/mb。该分析的结果描绘在图6d中。tmb和hla-i loh是多变量cox回归模型中独立且显著的存活期预测因子(hla-i完整hr=0.65[0.47-0.91],p=0.01;tmb高hr=0.74[0.54-0.99],p=0.05)。tmb高、hla-i完整组的mos为14.09个月[9.0-21.1],而tmb低、hla-i缺失组的mos为4.83个月[2.86-12.6]。在针对整个队列中的任何一者按6个与<6个独特的种系hla-i等位基因进行分层时(6等位基因hr=1.0[0.73-1.47],p=0.8),没有发现种系接合性的影响且没有观察到存活期差异,如图7a所示,在hla-i完整组内(6等位基因hr=0.91[0.60-1.38],p=0.7)也没有发现种系接合性的影响且没有观察到存活期差异,如图7b所示。为了评估组合生物标志物是否比单独的hla-i loh或tmb表现更好,根据样品是hla-i完整还是hla-i loh,通过设置不同的tmb
hi
阈值将队列分层为两组。当组合所有hla-i完整样品和针对hla-i loh的tmb≥13个突变/mb时,观察到最显著的差异(图7c,hr=0.45[0.31-0.66],p=0.00004),其中在组合高组中有203/240名患者。单独使用tmb创建具有相似数量的生物标志物阳性患者(200/240)的预测因子不会对存活期进行显著分层(图7d,tmb≥3个突变/mb,p>0.05)。总的来说,这些数据表明hla-i loh在与tmb组合时可以识别出最有可能和最不可能受益于免疫检查点抑制剂的患者。
[0528]
对59种不同的肿瘤类型进行了评估,包括83,664名独特的患者样品,大部分来自晚期疾病患者的肿瘤。表2汇总了该分析的结果。
[0529]
表2.肿瘤样品计数
[0530]
[0531]
[0532][0533]
总体而言,在17%的实体瘤样品中检测到了hla-i loh,其中85%的hla-i loh事件涉及整个hla-i基因座的loh。如图8a所示,各肿瘤类型之间的患病率差异很大(2%至42%)。hla-i loh最高发生率发现于鳞状细胞癌(sqcc)(30%),其次是非sqcc癌(16%)、神经内分泌肿瘤(11%)、肉瘤(11%)和非sqcc皮肤癌(6%)。疾病通过微卫星不稳定性(msi)状态进一步细分,发现hla-i loh在msi-高和稳定(mss)子集中相似或在mss肿瘤中增加,其中子宫内膜癌达到显著性(p=0.02),如图8b所示。通过激素受体状态和her2扩增对乳腺癌进行细分发现子集之间没有显著差异(p=0.3),如图8c所示。
[0534]
还检查了具有pd-l1的hla-i与tmb的关系。如图8d所示,与16%的pd-l1
–
样品(p《0.0001)相比,在pd-l1
样品(25%)中发现了显著较高的hla-i loh患病率。hla-i loh也与高tmb显著相关(tmb高:21%,tmb低:16%;p《0.0001),如图8e所示。也如图8d所示,pd-l1
和hla-i loh的发生率呈线性相关(p=0.0001)。然而,如图8e所示,tmb表现出更复杂的关系,其中tmb最低的疾病(例如神经内分泌肿瘤)和tmb最高的疾病(例如皮肤黑色素瘤)表现出hla-i loh的低患病率,而介于两者之间的肿瘤表现出hla-i loh的高患病率。具有tmb的hla-i loh与pd-l1的关联性也示出在图8f中。对于tmb和pd-l1关联性而言的两个显著例外是胰岛细胞肿瘤和肾上腺皮质癌,两者具有低发生率的高tmb(5%至10%)和pd-l1
(3%至7%),尽管有相当多的hla-i loh(36%至38%)。如图9a和图9b所示,在这两种疾病中,hla-i loh与daxx中的功能缺失突变有关,这是一种肿瘤抑制因子,距离hla-b约2mb(均为p<0.01)。这些结果表明,胰岛细胞肿瘤和肾上腺皮质癌中的hla-i loh是由附近肿瘤抑制因子基因的loh驱动的乘客事件。总体而言,hla-i loh表现出与pd-l1
呈线性关联以及与高tmb呈复杂关系。
[0535]
鉴于tmb与hla-i loh之间的复杂关系,进一步评估了肿瘤抗原和hla-i loh之间的联系。新抗原驱动基因突变表现出独特的新抗原子集,因为该突变驱动肿瘤发生,但也引发免疫应答。使用netmhcpan[14]预测了复发性驱动基因新抗原,并且评估了具有hla-i loh的病例的呈递等位基因是缺失还是保留。如图10a所示,针对98%(125/127)的预测的驱动基因新抗原和62%(77/125)的呈递等位基因缺失更频繁,具有统计学意义(p<0.05)。总体而言,在评估的任何hla-i loh事件中,保留的等位基因上没有显著更频繁地出现复发性驱动基因新抗原。病毒感染还可以驱动肿瘤发生和由免疫系统进行的识别[15]。图10b示出了hla-i loh在病毒性感染子集中的患病率。在其中病毒感染介导细胞内在致癌转化的肿
treated advanced cervical cancer:results from the phase ii keynote-158study.j clin oncol 37,1470-1478(2019)。
[0560]
20.frampton,g.m.,等人development and validation of a clinical cancer genomic profiling test based on massively parallel dna sequencing.nat biotechnol 31,1023-1031(2013)。
[0561]
21.sun,j.x.,等人a computational approach to distinguish somatic vs.germline origin of genomic alterations from deep sequencing of cancer specimens without a matched normal.plos comput biol 14,e1005965(2018)。
[0562]
22.chalmers,z.r.,等人analysis of 100,000human cancer genomes reveals the landscape of tumor mutational burden.genome med 9,34(2017)。
[0563]
23.zehir,a.,等人mutational landscape of metastatic cancer revealed from prospective clinical sequencing of 10,000patients.nat med 23,703-713(2017)。
[0564]
24.zerbino,d.r.&birney,e.velvet:algorithms for de novo short read assembly using de bruijn graphs.genome res 18,821-829(2008)。
[0565]
25.camacho,c.,等人blast :architecture and applications.bmc bioinformatics 10,421(2009)。
[0566]
26.szolek,a.,等人optitype:precision hla typing from next-generation sequencing data.bioinformatics 30,3310-3316(2014)。
[0567]
27.robinson,j.,等人ipd-imgt/hla database.nucleic acids res 48,d948-d955(2020)。
[0568]
28.li,h.,等人the sequence alignment/map format and samtools.bioinformatics 25,2078-2079(2009)。
[0569]
29.hartmaier,r.j.,等人genomic analysis of 63,220tumors reveals insights into tumor uniqueness and targeted cancer immunotherapy strategies.genome med 9,16(2017)。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。