用于治疗由csf-1r调节的疾病的给药方案
1.序列表
2.本技术含有已经以ascii格式电子递交的序列表,并且将该序列表通过援引以其全文特此并入。所述ascii副本创建于2021年2月15日,名称为pat058798-wo-pct_sl.txt并且大小为87,285字节。
技术领域
3.本披露涉及药学领域,特别涉及用于在治疗由csf-1r调节的疾病中使用的csf-1r抑制剂。例如,本披露涉及用于在癌症或神经退行性疾病的治疗中使用的csf-1r抑制剂。本披露还涉及用于在癌症的治疗中使用的csf-1r抑制剂,或包含csf-1r抑制剂或其药学上可接受的盐以及抗pd-1抗体分子或其药学上可接受的盐的药物组合;涉及施用csf-1r抑制剂或所述组合治疗癌症的方法;并且涉及csf-1r抑制剂或所述组合用于制造治疗癌症的药物的用途。
背景技术:
4.csf-1r是m-csf(巨噬细胞集落刺激因子,也称为csf-1)的受体,并介导这种细胞因子的生物效应。roussel等人,nature[自然]325:549-552(1987)中首次描述了集落刺激因子-1受体(也称为c-fms)的克隆。在该出版物中,表明csf-1r的转化潜力取决于蛋白质c末端尾部的变化,该变化包括与cbl结合从而调节受体的下调的抑制性酪氨酸969磷酸化的丧失(lee等人,embo[欧洲分子生物学学会杂志]18:3616-28(1999))。
[0005]
csf-1r是受体酪氨酸激酶(rtk),并且是含有rtk的免疫球蛋白(ig)基序家族的成员,其特征在于受体细胞外部分中的重复ig结构域。细胞内蛋白酪氨酸激酶结构域被独特的插入结构域中断,该结构域也存在于其他相关的rtk iii类家族成员中,该rtk iii类家族成员包括血小板衍生的生长因子受体(pdgfr)、干细胞生长因子受体(c-kit)和fms样细胞因子受体(flt3)。尽管该生长因子受体家族具有结构同源性,但它们具有独特的组织特异性功能。
[0006]
csf-1r信号传导的主要生物效应是来自单核细胞系的前体巨噬细胞和破骨细胞的分化、增殖、迁移和存活。csf-1r的激活是由其配体csf-1介导的。csf-1与csf-1r的结合诱导了同型二聚体的形成和通过酪氨酸磷酸化的激酶活化。进一步的信号传导由分别连接到pi3k/akt和ras/mapk途径的pi3k和grb2的p85亚基介导。这两个重要的信号传导途径可以调节增殖、存活和细胞凋亡。结合csf-1r的磷酸化细胞内结构域的其他信号传导分子包括stat1、stat3、plcγ和cbl(参见bourette及rohrschneider,growth factors[生长因子]17:155-166(2000))。
[0007]
csf-1(op/op小鼠;参见pollard等人,adv devel biochem 4:153-193(1996))或csf-1r(dai xm等人,blood[血液]99(1):111-20(2002))敲除的动物具有骨硬化、造血、组织巨噬细胞和生殖表型,这与csf-1r在这些细胞类型中的作用一致的。
[0008]
csf-1r信号传导可能通过三种不同的机制参与肿瘤的生长和转移。第一种是在起
源于雌性生殖系统(乳房、卵巢、子宫内膜)的肿瘤细胞中发现了csf-配体和受体的表达(scholl j.,nat.can.inst.[美国国立癌症研究所杂志]94:120-126(1994);kacinsky等人,mol.reprod.dev.[分子生殖发育]46:71-74(1997)),并且该表达与乳腺癌患者的乳腺癌异种移植物生长以及不良预后有关。在一项研究中测试的急性髓细胞性白血病、慢性髓细胞性白血病和骨髓增生异常患者的约10%至20%中看到csf-1r中的两处点突变,并且发现突变之一破坏受体周转(rigde等人,pnas[美国国家科学院院刊]87:1377-1380(1990))。在一些肝细胞癌病例中也发现了突变(yang等人,hepatobiliary pancreat dis int[国际肝胆胰疾病杂志]3:86-9(2004))和原发性骨髓纤维化(abu duhier等人,br jhaematol[英国血液病杂志]120:464-70(2003))。
[0009]
第二种机制基于阻断骨中的转移位点处经由m-csf/csf-1r的信号传导,该信号传导在被抑制时减少破骨细胞生成、骨吸收和溶骨性病变。已发现乳腺癌、肾癌和肺癌会转移到骨并引起溶骨性骨病,从而导致骨骼并发症。用小分子抑制剂抑制破骨细胞中的csf-1r激酶活性可能会预防转移性疾病中的这些骨骼相关事件。
[0010]
第三种机制基于最近的观察,即在乳腺癌、前列腺癌、卵巢癌和宫颈癌的实体瘤中发现的肿瘤相关巨噬细胞(tam)与不良预后相关(bingle等人,j pathol[病理学杂志]196(3):254-65(2002))。m-csf和其他趋化因子将巨噬细胞募集到肿瘤中。然后,巨噬细胞可通过tam通过分泌血管生成因子、蛋白酶和其他生长因子促进肿瘤进展,并可以通过抑制csf-1r信号传导而被阻断。另一方面,已知巨噬细胞通过吞噬作用和直接的细胞毒性具有杀肿瘤作用。仍然需要更好地了解巨噬细胞对肿瘤的特定作用,包括其功能的潜在时空依赖性和与特定肿瘤类型的相关性。
[0011]
脑癌和神经系统癌是最难治疗的癌症。患有这些癌症的患者的预后取决于肿瘤的类型和位置以及其发展阶段。对于许多类型的脑癌,症状发作后的平均预期寿命可能为数月或一年或两年。治疗主要由手术切除和放射疗法组成;也使用化学疗法,但是合适的化学治疗剂的范围是有限的,这可能是因为大多数治疗剂不能充分穿透血脑屏障来治疗脑瘤。与手术和放射一起使用已知的化学疗法很少能使生存期远远超过仅由手术和放射所产生的生存期。因此,对于脑瘤需要改善的治疗选择。
[0012]
神经胶质瘤是脑瘤的一种常见类型。它们来自由神经胶质细胞组成的支持性神经元组织(因此称为神经胶质瘤),该支持性神经元组织维持神经元的位置和功能。神经胶质瘤根据其类似的神经胶质细胞的类型进行分类:星形细胞瘤(包括胶质母细胞瘤)类似于星形胶质细胞,少突胶质细胞瘤类似于少突胶质细胞;以及室管膜瘤类似于形成大脑中的液体腔膜的室管膜胶质细胞。在一些情况下,肿瘤可能含有这些细胞类型的混合物,并且被称为混合神经胶质瘤。
[0013]
目前,脑癌的典型治疗是手术切除大部分肿瘤组织,这可以通过侵入性手术或使用活检或提取方法进行。但是,神经胶质瘤倾向于不规则地扩散,并且很难完全清除。结果,肿瘤切除后不久几乎总是发生复发。放射疗法和/或化学疗法可以与手术切除组合使用,但是这些通常只能适度延长生存时间。例如,最近的统计数据表明,在美国,只有一半被诊断为患有胶质母细胞瘤的患者在诊断后一年还活着,并且即使使用目前的标准护理组合治疗,两年后仍然只有25%的患者还活着。
[0014]
多形性胶质母细胞瘤(gbm)是最常见的成人原发性脑瘤,并且因其致死性和对当
前治疗方法的反应性不足而臭名昭著。不幸的是,近年来治疗选择没有实质性的改善,并且gbm患者的生存前景几乎没有改善。因此,仍迫切需要改善脑癌(例如神经胶质瘤)的治疗。
[0015]
神经胶质瘤在复杂的组织微环境中发展,该组织微环境中除了癌细胞本身以外,还包含脑实质中许多不同类型的细胞。肿瘤相关巨噬细胞(tam)是目前存在的主要基质细胞类型之一,通常占肿瘤组织中细胞的很大一部分。它们的来源尚不确定:这些tam可能源自小胶质细胞,即大脑中的定居巨噬细胞群体,或者它们可能是从周围组织募集的。
[0016]
tam可以以组织特异性方式调节肿瘤的发生和进展:在一些情况下,它们似乎抑制了癌症的发展,但是迄今为止,在大多数研究中,它们增强了肿瘤的进展。实际上,在大约80%的巨噬细胞浸润增加的癌症中,tam水平升高与更具侵袭性的疾病和不良的患者预后相关。几项研究表明,人神经胶质瘤的tam数量也表现出显著的增加,这与晚期肿瘤等级相关,并且tam通常是神经胶质瘤中主要的免疫细胞类型。然而,tam在胶质瘤发生中的功能仍然知之甚少,并且目前尚不清楚靶向这些细胞是否代表一种可行的治疗策略。实际上,在文献中已经报告了对肿瘤生长的不利影响,在一些情况下,即使在相同的原位胶质瘤植入模型中使用了相似的实验策略来消耗巨噬细胞的情况下,也是如此。在一些研究中,tam产生的tnf-α或整联蛋白β3与胶质瘤生长的抑制有关,而在其他报告中,ccl2和mt1-mmp被认为是肿瘤发展和侵袭的增强剂。
[0017]
csf-1r信号传导的抑制代表了一种新颖的、翻译相关的方法,该方法已在若干种肿瘤学背景下使用,包括异种移植胫骨内骨肿瘤。然而,尚未证明它在脑瘤中有效。一些非脑癌已被化合物靶向,这些化合物影响与肿瘤细胞相关或支持肿瘤细胞的多种细胞类型,而不是直接靶向肿瘤细胞本身。例如,据报告plx3397共抑制三个靶标(fms、kit和flt3-itd)并下调各种细胞类型,包括巨噬细胞、小胶质细胞、破骨细胞和肥大细胞。plx3397已通过治疗霍奇金淋巴瘤的测试。但是,根据plx3397的文献,霍奇金淋巴瘤对各种化学疗法的反应都很好,而脑瘤对化学疗法的抵抗力要强得多,并且尚未得到成功的治疗。如本文所证明,尽管,csf-1r抑制剂对培养中的胶质母细胞瘤细胞的增殖没有直接影响,并且它也不会减少治疗动物肿瘤中巨噬细胞的数量。因此,令人惊奇的是,还如本文还证明的那样,csf-1r抑制剂可以有效地抑制体内脑瘤的生长,导致晚期gbm中肿瘤体积的减小,甚至明显根除了一些胶质母细胞瘤。
[0018]
程序性死亡1(pd-1)蛋白是t细胞调节子的扩展的cd28/ctla4家族的抑制性成员(okazaki等人.curr.opin.immunol.[免疫学当前观点]2002,14,391779;bennett等人j.immunol.[免疫学杂志]2003,170,711)。cd28受体的配体包括一组相关的b7分子,也称为“b7超家族”(coyle等人nature immunol.[自然免疫学]2001,2(3),203;sharpe等人nature rev.immunol.[自然综述免疫学]2002,2,116;collins等人genome biol.[基因组生物学]2005,6,223.1;korman等人adv.immunol.[免疫学进展]2007,90,297)。b7超家族的几个成员是已知的,包括b7.1(cd80)、b7.2(cd86)、诱导型共刺激配体(icos-l)、程序性死亡-1配体(pd-l1;b7-h1)、程序性死亡-2配体(pd-l2;b7-dc)、b7-h3、b7-h4和b7-h6(collins等人genome biol.[基因组生物学]2005,6,223.1)。cd28家族的其他成员包括cd28、ctla-4、icos和btla。pd-1被认为作为单体存在,缺乏其他cd28家族成员特有的未配对半胱氨酸残基。pd-1在活化的b细胞、t细胞和单核细胞上表达。
[0019]
pd-l1大量存在于多种人类癌症中(dong等人nat.med.[自然医学]2002,8,787)。
已知pd-1是负调节tcr信号的免疫抑制性蛋白(ishida等人embo j[欧洲分子生物学学会杂志]1992,11,3887;blank等人.immunol.immunother.[免疫学和免疫疗法]2006,56(5),739)。pd-1和pd-l1之间的相互作用可以充当免疫检查点,该相互作用可以导致例如肿瘤浸润性淋巴细胞的减少、t细胞受体介导的增殖的减少和/或癌细胞的免疫逃逸(dong等人j.mol.med.[分子医学杂志]2003,81,281;blank等人.cancer immunol.immunother.[癌症免疫学和免疫疗法]2005,54,307;konishi等人clin.cancer res[临床癌症研究]2004,10,5094)。通过抑制pd-1与pd-l1或pd-l2的局部相互作用可以逆转免疫抑制;当pd-1与pd-l2的相互作用被阻断时,效果也是累加的(iwai等人proc.nat'l.acad.sci.usa[美国国家科学院院刊]2002,99:12293-7;brown等人j.immunol[免疫学杂志].2003,170,1257)。
[0020]
在i期临床研究中,已对csf-1r抑制剂blz945作为单一药剂和与斯巴达珠单抗(spartalizumab)的组合进行了研究。在临床研究过程中,在使用单一药剂blz945治疗的所有患者和使用组合方案治疗的所有患者中,均报告了所有等级的不良事件(ae),无论与研究治疗的关系如何。怀疑与blz945单一药剂有关的最常报告的ae(》10%)是天冬氨酸转氨酶(ast)增加、恶心、呕吐、丙氨酸转氨酶(alt)增加、疲劳、淀粉酶增加、血肌酸磷酸激酶增加和食欲下降。组合治疗最常报告的可疑ae(》10%)是ast增加、alt增加、瘙痒、疲劳、恶心、皮疹和呕吐。虽然认为通过blz945增加的alt/ast水平是由于肝脏中kupffer细胞的抑制引起的这些酶清除降低所致,但这些观察结果通常被认为是肝损伤的指征。因此,对于导致不良事件最小的递送治疗有效剂量的具有式(i)的化合物的替代给药方案存在尚未满足的医学需求。
[0021]
单独地,正在对肌萎缩性侧索硬化症(als)进行blz945的研究。als是一种致命的退行性疾病,其特征在于运动皮质的上运动神经元(umn)和脊柱或延髓水平的下运动神经元(lmn)的逐渐丧失[rowland lp和schneider na,2001]。考虑到中位生存期(3至5年)、功能性措施的迅速下降以及疾病自然过程中的预后不良,als对患者、家庭成员和护理人员的负担是巨大的。在美国,als的发生率为约5000/年,在美国约有16000例普遍患者,在欧盟有29000例(logroscino g和piccininni m.)。
[0022]
als患者的主要护理是及时干预以管理症状,包括使用鼻胃喂养,预防误吸和提供通气支持(通常在双水平气道正压通气下)(r.h.brown等人,2017年)。目前,可用的疗法为als患者提供有限的临床益处。利鲁唑和依达拉奉已在美国获得批准;但是,对于可能减慢als进展的疗法,仍然存在迫切的未满足的医学需求。
[0023]
神经炎症在als中起关键作用(rodriguez和mahy 2016)。als的重要病理生理机制是与退行性运动神经元相关的小胶质细胞活化。最近的证据将巨噬细胞集落刺激因子1受体(csf-1r)依赖性小胶质细胞增生与als疾病进展相关联(martinez muriana等人2016)。高度选择性和有效的csf-1r抑制剂具有通过靶向小胶质细胞减慢疾病进展,从而延迟对机械通气的需求,改善生活质量并增加als患者生存率来治疗als患者的潜力。
[0024]
blz945是有效和选择性的csf-1r抑制剂。在使用als啮齿动物模型进行的临床前研究中,blz945证明了对维持正常体重增加以及与疾病相关的握力和肌肉神经支配性损伤的剂量依赖性延迟的益处。
[0025]
尸检时,该功效与脊髓中小胶质细胞的剂量依赖性消耗有关。在als患者中,近期使用马赛替尼(一种效力适中且特异性低的csf-1r抑制剂)进行的2b/3期临床试验表明,
[0026]
疾病进展的显著延迟。综上所述,这些数据表明使用blz945消耗小胶质细胞的选择性csf-1r抑制可能代表了预防或减缓als进展的治疗策略。但是,通过blz945治疗的als患者中alt/ast的增加将极大地影响用于治疗als患者的安全有效的给药方案。因此,仍然需要针对als患者的安全有效的治疗。因此,用特定的给药方案选择性抑制csf-1r以消耗小胶质细胞有望代表预防或减缓als进展的治疗策略。这种选择性的csf-1r抑制剂还可以与其他干预方法共同施用,例如,与目前的标准护理(利鲁唑或依达拉奉)或其他als临床化合物组合。
技术实现要素:
[0027]
本发明基于可以用csf-1r抑制剂治疗晚期实体瘤的证明。据信,本文所述的csf-1r抑制剂的有效性被认为是由于它们抑制了tam的某些活性,即使它似乎并未显著降低所存在的tam的数量,并且可能也是这些化合物在脑瘤受试者中有效渗透血脑屏障的能力所证明的一种功能。这些方法为诊断为晚期实体瘤,特别是脑瘤,特别是胶质母细胞瘤的患者提供了更需要的新治疗选择。
[0028]
集落刺激因子-1(csf-1),也称为巨噬细胞集落刺激因子(m-csf),通过其受体csf-1r(也称为c-fms)发出信号,以调节巨噬细胞的分化、增殖、募集和存活。与其他受体酪氨酸激酶抑制剂一样,已开发出通过竞争活性位点中的atp结合来阻断受体磷酸化的csf-1r小分子抑制剂。如rcas-pdgf-b-ha/nestin-tv-a;ink4a/arf-/-胶质瘤发生小鼠模型所示,本发明使用有效的、选择性的csf-1r抑制剂,其渗透血脑屏障(bbb),以阻断神经胶质瘤中的csf-1r信号传导。该基因工程化的神经胶质瘤模型作为人类gbm的模型进行临床前测试是理想的,因为它概括了人类gbm在免疫活性环境的所有特征。因为它紧密地模拟了人类gbm,特别是原神经gbm,所以该模型的功效有望转化为对人类胶质母细胞瘤(例如多形性胶质母细胞瘤和混合性神经胶质瘤)的临床功效。
[0029]
可以用能够穿透脑的任何csf-1r抑制剂来实施本发明。一些此类化合物是wo 2007/121484中披露的6-o-取代的苯并噁唑和苯并噻唑化合物,特别是该参考文献中的具有式iia和iib的化合物,以及本文披露的化合物。
[0030]
一方面,本发明提供一种用于在csf-1r调节的疾病(例如癌症或神经退行性疾病)的治疗中使用的具有式(i)的csf-1r抑制剂4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺:
[0031][0032]
或其药学上可接受的盐疾病,其中以4天给药和10天停药施用(i),每个周期两次。
[0033]
在另一方面,本发明提供一种用于在癌症的治疗中使用的药物组合,所述药物组合包含(i)具有式(i)的csf-1r抑制剂4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺[具有(i)的化合物]:
[0034][0035]
或其药学上可接受的盐,以及(ii)抗pd-1抗体分子或其药学上可接受的盐,其中以4天给药和10天停药施用(i),每个周期两次,并且每个周期施用(ii)至少一次。
附图说明
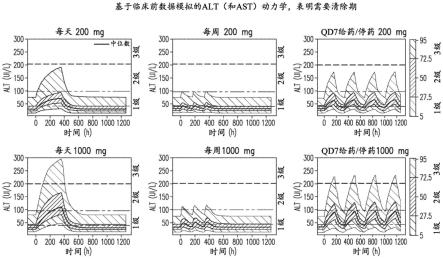
[0036]
图1:基于临床前数据模拟的alt(和ast)动力学表明需要清除期
[0037]
图2:基于临床前数据的食蟹猴模型描述了切换为4天给药/10天停药可能会降低最大alt并回到基线水平
[0038]
图3:比较blz945在两种单独给药方案以及与抗pd-1组合的给药方案中的初步功效数据
[0039]
图4a:在两种不同日程表上blz945单独治疗以及与抗pd-1组合治疗后小鼠血浆中的小鼠csf-1水平
[0040]
图4b:在两种不同日程表上blz945单独治疗以及与抗pd-1组合治疗后小鼠血浆中的小鼠csf-1水平
[0041]
图5a:使用blz945以4天给药/3天停药治疗后,tam和treg的免疫调节(小鼠模型)
[0042]
图5b(图4-8b):使用blz945以4天给药/3天停药治疗后,tam和treg的免疫调节(小鼠模型)
[0043]
图6:单一药剂剂量组的ast升高(临床数据)
[0044]
图7:单一药剂剂量组的alt升高(临床数据)
[0045]
图8:使用blz945对als小鼠模型连续给药数天后的小胶质细胞消耗的分析
[0046]
图9:使用几种剂量的blz945的小胶质细胞减少的分析
[0047]
图10:使用b.i.d.给药的als sod1
g93a
小鼠中的小胶质细胞消耗
[0048]
图11:功效研究中als sod1
g93a
小鼠中的小胶质细胞消耗
[0049]
图12:blz945对体重累积的剂量依赖性作用
[0050]
图13:blz945对握力和cmap的作用
具体实施方式
[0051]
可以用能够穿透脑的csf-1r抑制剂来实施本发明。一些此类化合物是wo 2007/121484中披露的6-o-取代的苯并噁唑和苯并噻唑化合物,特别是该参考文献中的具有式iia和iib的化合物,以及本文披露的化合物。
[0052]
一方面,本发明提供一种用于在癌症的治疗中使用的具有式(i)的csf-1r抑制剂4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺:
[0053]
[0054]
或其药学上可接受的盐,其中以4天给药和10天停药施用(i),每个周期两次。
[0055]
在另一方面,本发明提供了用于在癌症的治疗中使用的csf-1r化合物,其中每个周期为28天。
[0056]
在另外的方面中,本发明提供了用于在癌症的治疗中使用的csf-1r化合物,其中每天施用具有式(i)的化合物两次。
[0057]
在另一方面,本发明提供了用于在癌症的治疗中使用的csf-1r化合物,其中所述具有式(i)的化合物的每日剂量为100mg/天、150mg/天、200mg/天、300mg/天、400mg/天、500mg/天、600mg/天、700mg/天、900mg/天或1200mg/天。
[0058]
在其他方面,本发明提供了用于在癌症的治疗中使用的csf-1r化合物,其中每日剂量为700mg/天。
[0059]
在另一方面,本发明提供了用于在癌症的治疗中使用的csf-1r化合物,其中所述癌症是白血病、前列腺癌、肾癌、肝癌、肉瘤、脑癌、淋巴瘤、卵巢癌、肺癌、宫颈癌、皮肤癌、乳腺癌、头颈部鳞状细胞癌(hnscc)、胰腺癌、胃肠癌、结肠直肠癌、三阴性乳腺癌(tnbc)、肺鳞状细胞癌、食道鳞状细胞癌、宫颈鳞状细胞癌、神经胶质瘤、胶质母细胞瘤或黑素瘤。
[0060]
在其他方面,本发明提供了用于在癌症的治疗中使用的csf-1r化合物,其中所述癌症是胶质母细胞瘤。
[0061]
一方面,本发明提供一种用于在癌症的治疗中使用的药物组合,所述药物组合物包含(i)具有式(i)的csf-1r抑制剂4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺,或其药学上可接受的盐,以及(ii)抗pd-1抗体分子或其药学上可接受的盐,其中以4天给药和10天停药施用(i),每个周期两次,并且每个周期施用(ii)至少一次。
[0062]
在另外的方面中,本发明提供了用于在癌症的治疗中使用的药物组合,其中具有式(i)的csf-1r抑制剂仅在4天给药的3天中施用。
[0063]
在其他方面,本发明提供了用于在癌症的治疗中使用的药物组合,其中每个周期为28天。
[0064]
在另一方面,本发明提供了用于在癌症的治疗中使用的药物组合,其中每天施用(i)两次。
[0065]
在另一方面,本发明提供了用于在癌症的治疗中使用的药物组合,其中(i)的每日剂量为100mg/天、150mg/天、200mg/天、300mg/天、400mg/天、500mg/天、600mg/天、700mg/天、900mg/天或1200mg/天。
[0066]
在其他方面,本发明提供了用于在癌症的治疗中使用的药物组合,其中(i)的每日剂量为1200mg/天。
[0067]
在另一方面,本发明提供了用于在癌症的治疗中使用的药物组合,其中每4周施用(ii)一次。
[0068]
在另外的方面中,本发明提供了用于在癌症的治疗中使用的药物组合,其中(ii)选自纳武单抗(nivolumab)、派姆单抗(pembrolizumab)、匹地利珠单抗(pidilizumab)、斯巴达珠单抗、或其药学上可接受的盐。
[0069]
在其他方面,本发明提供了用于在癌症的治疗中使用的药物组合,其中(ii)是斯巴达珠单抗或其药学上可接受的盐。
[0070]
在另外的方面中,本发明提供了用于在癌症的治疗中使用的药物组合,其中以300至400mg/天的单次剂量静脉内施用(ii)。
[0071]
在其他方面,本发明提供了用于在癌症的治疗中使用的药物组合,其中(ii)的单次剂量为400mg/天。
[0072]
在另一方面,本发明提供了用于在癌症的治疗中使用的药物组合,其中所述癌症是白血病、前列腺癌、肾癌、肝癌、肉瘤、脑癌、淋巴瘤、卵巢癌、肺癌、宫颈癌、皮肤癌、乳腺癌、头颈部鳞状细胞癌(hnscc)、胰腺癌、胃肠癌、结肠直肠癌、三阴性乳腺癌(tnbc)、肺鳞状细胞癌、食道鳞状细胞癌、宫颈鳞状细胞癌、神经胶质瘤、胶质母细胞瘤或黑素瘤。
[0073]
在其他方面,本发明提供了用于在癌症的治疗中使用的药物组合,其中所述癌症是胶质母细胞瘤。
[0074]
与抗pd-1抗体分子组合的csf-1r抑制剂,或其药学上可接受的盐是具有式(i)的4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺,或其药学上可接受的盐,
[0075][0076]
如披露于wo 2007/121484中(实例157)。
[0077]
因此,本披露还提供了用于在癌症的治疗中使用的药物组合,其包含(i)4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺,或其药学上可接受的盐,以及(ii)抗pd-1抗体分子或其药学上可接受的盐,其中以4天给药和10天停药施用具有式(i)的化合物即4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺或其药学上可接受的盐,每个周期两次,并且每个周期施用本文所述的抗pd-1抗体分子(ii)至少一次。
[0078]
在另一方面,本发明提供一种用于在治疗由csf-1r调节的神经炎性疾病中使用的具有式(i)的csf-1r抑制剂,4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺:
[0079][0080]
或其药学上可接受的盐,其中在给药期间施用所述csf-1r抑制剂,然后在停药期间不施用所述csf-1r抑制剂,并且其中至少一对给药期和停药期组成一个周期。
[0081]
在其他方面,本发明提供一种用于在神经炎性疾病的治疗中使用的具有式(i)的csf-1r抑制剂或其药学上可接受的盐,其中以4天给药施用所述csf-1r抑制剂。
[0082]
在另外的方面中,本发明提供一种用于在神经炎性疾病的治疗中使用的具有式(i)的csf-1r抑制剂或其药学上可接受的盐,其中以7天给药施用所述csf-1r抑制剂。
[0083]
在其他方面,本发明提供一种用于在神经炎性疾病的治疗中使用的具有式(i)的csf-1r抑制剂或其药学上可接受的盐,其中以4天给药施用所述csf-1r抑制剂,然后是至多
10天停药,优选地7至10天停药,更优选地10天停药。
[0084]
在其他方面,本发明提供一种用于在神经炎性疾病的治疗中使用的具有式(i)的csf-1r抑制剂或其药学上可接受的盐,其中以4天给药和10天停药施用所述csf-1r抑制剂。
[0085]
在其他方面,本发明提供一种用于在神经炎性疾病的治疗中使用的具有式(i)的csf-1r抑制剂或其药学上可接受的盐,其中以7天给药和7天停药施用所述csf-1r抑制剂。
[0086]
在其他方面,本发明提供一种用于在神经炎性疾病的治疗中使用的具有式(i)的csf-1r抑制剂或其药学上可接受的盐,其中每天施用所述csf-1r抑制剂两次。
[0087]
在其他方面,本发明提供一种用于在神经炎性疾病的治疗中使用的具有式(i)的csf-1r抑制剂或其药学上可接受的盐,其中所述具有式(i)的csf-1r抑制剂的每日剂量为100mg/天、150mg/天、200mg/天、300mg/天、400mg/天、500mg/天、600mg/天、700mg/天、900mg/天或1200mg/天。
[0088]
在其他方面,本发明提供一种用于在神经炎性疾病的治疗中使用的具有式(i)的csf-1r抑制剂或其药学上可接受的盐,其中每日剂量为300mg/天、600mg/天或1200mg/天,优选地1200mg/天。
[0089]
在其他方面,本发明提供一种用于在神经炎性疾病的治疗中使用的具有式(i)的csf-1r抑制剂或其药学上可接受的盐,其中所述神经炎性疾病是肌萎缩性侧索硬化症。
[0090]
在其他方面,本发明提供一种用于在神经炎性疾病的治疗中使用的药物组合,所述药物组合包含(i)具有式(i)的csf-1r抑制剂4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺,或其药学上可接受的盐,以及(ii)依达拉奉或利鲁唑中的任何一种。
[0091]
有关在癌症的治疗中使用csf-1r抑制剂的列举的实施例:
[0092]
实施例1.1:一种用于在癌症的治疗中使用的具有式(i)的csf-1r抑制剂4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺:
[0093][0094]
或其药学上可接受的盐,其中以4天给药和10天停药施用(i),每个周期两次。
[0095]
实施例1.2:根据实施例1.1所述的用于在癌症的治疗中使用的csf-1r化合物,其中每个周期为28天。
[0096]
实施例1.3:根据实施例1.1所述的用于在癌症的治疗中使用的csf-1r化合物,其中每天施用具有式(i)的化合物两次。
[0097]
实施例1.4:根据实施例1.1至1.3中任一项所述的用于在癌症的治疗中使用的csf-1r化合物,其中所述具有式(i)的化合物的每日剂量为100mg/天、150mg/天、200mg/天、300mg/天、400mg/天、500mg/天、600mg/天、700mg/天、900mg/天或1200mg/天。
[0098]
实施例1.5:根据实施例1.4所述的csf-1r化合物,其中每日剂量为700mg/天。
[0099]
实施例1.6:根据实施例1.1至1.5中任一项所述的用于在癌症的治疗中使用的csf-1r化合物,其中所述癌症是白血病、前列腺癌、肾癌、肝癌、肉瘤、脑癌、淋巴瘤、卵巢癌、肺癌、宫颈癌、皮肤癌、乳腺癌、头颈部鳞状细胞癌(hnscc)、胰腺癌、胃肠癌、结肠直肠癌、三
阴性乳腺癌(tnbc)、肺鳞状细胞癌、食道鳞状细胞癌、宫颈鳞状细胞癌、神经胶质瘤、胶质母细胞瘤或黑素瘤。
[0100]
实施例1.7:根据实施例1.6所述的用于在癌症的治疗中使用的csf-1r化合物,其中所述癌症是胶质母细胞瘤。
[0101]
实施例1.8:一种用于在癌症的治疗中使用的药物组合,所述药物组合物包含(i)具有式(i)的csf-1r抑制剂4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺,或其药学上可接受的盐,以及(ii)抗pd-1抗体分子或其药学上可接受的盐,其中以4天给药和10天停药施用(i),每个周期两次,并且每个周期施用(ii)至少一次。
[0102]
实施例1.9:根据实施例1.8所述的用于在癌症的治疗中使用的药物组合,其中每个周期为28天。
[0103]
实施例1.10:根据实施例1.8所述的用于在癌症的治疗中使用的药物组合,其中每天施用(i)两次。
[0104]
实施例1.11:根据实施例1.8至1.10中任一项所述的用于在癌症的治疗中使用的药物组合,其中(i)的每日剂量为100mg/天、150mg/天、200mg/天、300mg/天、400mg/天、500mg/天、600mg/天、700mg/天、900mg/天或1200mg/天。
[0105]
实施例1.12:根据实施例1.11所述的用于在癌症的治疗中使用的药物组合,其中(i)的每日剂量为1200mg/天。
[0106]
实施例1.13:根据实施例1.8所述的用于在癌症的治疗中使用的药物组合,其中每4周施用(ii)一次。
[0107]
实施例1.14:根据实施例1.8至1.13中任一项所述的用于在癌症的治疗中使用的药物组合,其中(ii)选自纳武单抗、派姆单抗、匹地利珠单抗、斯巴达珠单抗、或其药学上可接受的盐。
[0108]
实施例1.15:根据实施例1.14所述的用于在癌症的治疗中使用的药物组合,其中(ii)是斯巴达珠单抗或其药学上可接受的盐。
[0109]
实施例1.16:根据实施例1.8至1.15中任一项所述的用于在癌症的治疗中使用的药物组合,其中以300至400mg/天的单次剂量静脉内施用(ii)。
[0110]
实施例1.17:根据实施例1.16所述的用于在癌症的治疗中使用的药物组合,其中所述单次剂量为400mg/天。
[0111]
实施例1.18:根据实施例1.8至1.17中所述的用于在癌症的治疗中使用的药物组合,其中所述癌症是白血病、前列腺癌、肾癌、肝癌、肉瘤、脑癌、淋巴瘤、卵巢癌、肺癌、宫颈癌、皮肤癌、乳腺癌、头颈部鳞状细胞癌(hnscc)、胰腺癌、胃肠癌、结肠直肠癌、三阴性乳腺癌(tnbc)、肺鳞状细胞癌、食道鳞状细胞癌、宫颈鳞状细胞癌、神经胶质瘤、胶质母细胞瘤或黑素瘤。
[0112]
实施例1.19:根据实施例1.18所述的用于在癌症的治疗中使用的药物组合,其中所述癌症是胶质母细胞瘤。
[0113]
实施例1.20:一种用于治疗有需要的受试者的癌症的方法,所述方法包括施用具有式(i)的csf-1r抑制剂4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺:
[0114][0115]
或其药学上可接受的盐,其中以4天给药和10天停药施用(i),每个周期两次。
[0116]
实施例1.21:根据实施例1.20所述的方法,其中每个周期为28天。
[0117]
实施例1.22:根据实施例1.20所述的方法,其中每天施用具有式(i)的化合物两次。
[0118]
实施例1.23:根据实施例1.20至1.22中任一项所述的用于在癌症的治疗中使用的方法,其中所述具有式(i)的化合物的每日剂量为100mg/天、150mg/天、200mg/天、300mg/天、400mg/天、500mg/天、600mg/天、700mg/天、900mg/天或1200mg/天。
[0119]
实施例1.24:根据实施例1.23所述的方法,其中每日剂量为700mg/天。
[0120]
实施例1.25:根据实施例1.20至1.24中任一项所述的方法,其中所述癌症是白血病、前列腺癌、肾癌、肝癌、肉瘤、脑癌、淋巴瘤、卵巢癌、肺癌、宫颈癌、皮肤癌、乳腺癌、头颈部鳞状细胞癌(hnscc)、胰腺癌、胃肠癌、结肠直肠癌、三阴性乳腺癌(tnbc)、肺鳞状细胞癌、食道鳞状细胞癌、宫颈鳞状细胞癌、神经胶质瘤、胶质母细胞瘤或黑素瘤。
[0121]
实施例1.26:根据实施例1.25所述的方法,其中所述癌症是胶质母细胞瘤。
[0122]
有关在神经炎性疾病的治疗中使用csf-1r抑制剂的列举的实施例:
[0123]
实施例2.1:一种用于在治疗由csf-1r调节的神经炎性疾病中使用的具有式(i)的csf-1r抑制剂4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺:
[0124][0125]
或其药学上可接受的盐,其中在给药期间施用所述csf-1r抑制剂,然后在停药期间不施用所述csf-1r抑制剂,并且其中至少一对给药期和停药期组成一个周期。
[0126]
实施例2.2:根据实施例2.1所述的用于在疾病的治疗中使用的具有式(i)的csf-1r抑制剂或其药学上可接受的盐,其中以4天给药施用所述csf-1r抑制剂。
[0127]
实施例2.3:根据实施例2.1所述的用于在疾病的治疗中使用的具有式(i)的csf-1r抑制剂或其药学上可接受的盐,其中以7天给药施用所述csf-1r抑制剂。
[0128]
实施例2.4:根据实施例2.1所述的用于在疾病的治疗中使用的具有式(i)的csf-1r抑制剂或其药学上可接受的盐,其中以4天给药施用所述csf-1r抑制剂,然后是至多10天停药,优选地7至10天停药,更优选地10天停药。
[0129]
实施例2.5:根据实施例2.1所述的用于在疾病的治疗中使用的具有式(i)的csf-1r抑制剂或其药学上可接受的盐,其中以4天给药和10天停药施用所述csf-1r抑制剂。
[0130]
实施例2.6:根据实施例2.1所述的用于在疾病的治疗中使用的具有式(i)的csf-1r抑制剂或其药学上可接受的盐,其中以7天给药和7天停药施用所述csf-1r抑制剂。
[0131]
实施例2.7:用于根据实施例2.1至2.6中任一项所述使用的具有式(i)的csf-1r抑
制剂或其药学上可接受的盐,其中每天施用所述csf-1r抑制剂两次。
[0132]
实施例2.8:用于根据实施例2.1至2.7中任一项所述使用的具有式(i)的csf-1r抑制剂或其药学上可接受的盐,其中所述具有式(i)的csf-1r抑制剂的每日剂量为100mg/天、150mg/天、200mg/天、300mg/天、400mg/天、500mg/天、600mg/天、700mg/天、900mg/天或1200mg/天。
[0133]
实施例2.9:用于根据实施例2.8所述使用的具有式(i)的csf-1r抑制剂或其药学上可接受的盐,其中每日剂量为300mg/天、600mg/天或1200mg/天,优选为1200mg/天。
[0134]
实施例2.10:用于根据实施例2.1至2.9中任一项所述使用的具有式(i)的csf-1r抑制剂或其药学上可接受的盐,其中所述神经炎性疾病是阿尔茨海默氏病、多发性硬化症或肌萎缩性侧索硬化症。
[0135]
实施例2.11:用于根据实施例2.1至2.9中任一项所述使用的具有式(i)的csf-1r抑制剂或其药学上可接受的盐,其中所述神经炎性疾病是肌萎缩性侧索硬化症。
[0136]
实施例2.12:一种用于在根据实施例2.1至2.10中任一项所述的治疗中使用的药物组合,所述药物组合包含(i)具有式(i)的csf-1r抑制剂4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺,或其药学上可接受的盐,以及(ii)依达拉奉或利鲁唑中的任何一种。
[0137]
实施例2.13:一种用于治疗有需要的受试者的由csf-1r调节的神经炎性疾病的方法,所述方法包括施用具有式(i)的csf-1r抑制剂4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺:
[0138][0139]
或其药学上可接受的盐,其中在给药期间施用所述csf-1r抑制剂,然后在停药期间不施用所述csf-1r抑制剂,并且其中至少一对给药期和停药期组成一个周期。
[0140]
实施例2.14:根据实施例2.13所述的方法,其中以4天给药施用所述csf-1r抑制剂。
[0141]
实施例2.15:根据实施例2.14所述的方法,其中以7天给药施用所述csf-1r抑制剂。
[0142]
实施例2.16:根据实施例2.13所述的方法,其中以4天给药施用所述csf-1r抑制剂,然后是至多10天停药,优选地7至10天停药,更优选地10天停药。
[0143]
实施例2.17:根据实施例2.13所述的方法,其中以4天给药和10天停药施用所述csf-1r抑制剂。
[0144]
实施例2.18:根据实施例2.13所述的方法,其中以7天给药和7天停药施用所述csf-1r抑制剂。
[0145]
实施例2.19:根据实施例2.13至2.18中任一项所述的方法,其中每天施用所述csf-1r抑制剂两次。
[0146]
实施例2.20:根据实施例2.13至2.19中任一项所述的方法,其中具有式(i)的csf-1r抑制剂的每日剂量为100mg/天、150mg/天、200mg/天、300mg/天、400mg/天、500mg/天、
600mg/天、700mg/天、900mg/天或1200mg/天。
[0147]
实施例2.21:根据实施例2.20所述的方法,其中每日剂量为300mg/天、600mg/天或1200mg/天,优选地1200mg/天。
[0148]
实施例2.22:根据实施例2.13至2.21中任一项所述的方法,其中所述神经炎性疾病是肌萎缩性侧索硬化症。
[0149]
在本披露中,术语“药物组合”是指非固定组合。术语“非固定组合”意指活性成分(例如,具有式(i)的化合物,即4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺或其药学上可接受的盐,以及抗pd-1抗体分子或药学上可接受的盐形式)作为分开的实体被同时或无特定时间限制顺序地施用于患者,其中这类施用在患者体内提供治疗有效水平的所述两种化合物。
[0150]
术语“组合”或“与
……
组合”并不旨在暗示疗法或治疗剂必需同时施用和/或将这些疗法或治疗剂配制用于一起递送,尽管这些递送方法也在本文所述的范围内。组合中的治疗剂可以与一种或多种其他另外的疗法或治疗剂同时、在其之前或之后施用。这些治疗剂或治疗方案可以以任何顺序施用。通常,每种药剂将以针对该药剂确定的剂量和/或日程表施用。还应理解,该组合中使用的另外的治疗剂可以一起施用或以不同成分分开施用。通常,预期组合中使用的另外的治疗剂以不超过它们单独使用时的水平使用。在一些实施例中,组合中使用的水平将低于单独使用的水平。
[0151]
可以与本披露的csf-1r抑制剂组合使用的抗pd-1抗体分子或其药学上可接受的盐是如本文所披露的任何抗pd-1抗体。例如,抗pd-1抗体分子可包含至少一个抗原结合区(例如可变区或其抗原结合片段),所述抗原结合区来自本文所述抗体,例如选自bap049-克隆-b或bap049-克隆-e中任一个的抗体;或者如表1中所述,或由表1中的核苷酸序列所编码;或者与前述序列中任一个基本上相同(例如,具有至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性)的序列。抗pd1抗体分子优选地选自纳武单抗(opdivo)、派姆单抗(keytruda)、匹地利珠单抗、斯巴达珠单抗、或其药学上可接受的盐。最优选地,抗pd-1抗体分子是斯巴达珠单抗或其药学上可接受的盐。命名为斯巴达珠单抗的抗pd-1抗体分子描述于pct/cn2016/099494中。更特别地,pdr-001抑制剂或其药学上可接受的盐包括重链可变区(vh)和轻链可变区(vl),所述重链可变区包含如表1所述的bap049-克隆-e的hcdr1、hcdr2和hcdr3氨基酸序列,所述轻链可变区包含bap049-克隆-e的lcdr1、lcdr2和lcdr3氨基酸序列。
[0152]
本披露的抗pd-1抗体分子或其药学上可接受的盐包括例如至少一个、两个、三个或四个可变区,所述可变区来自本文所述抗体,例如选自bap049-克隆-b或bap049-克隆-e中任一个的抗体;或者如表1中所述,或由表1中的核苷酸序列所编码;或者与前述序列中任一个基本上相同(例如,具有至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性)的序列。
[0153]
本披露的抗pd-1抗体分子或其药学上可接受的盐包括例如至少一个或两个重链可变区,所述重链可变区来自本文所述抗体,例如选自bap049-克隆-b或bap049-克隆-e中任一个的抗体;或者如表1中所述,或由表1中的核苷酸序列所编码;或者与前述序列中任一个基本上相同(例如,具有至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性)的序列。
[0154]
本披露的抗pd-1抗体分子或其药学上可接受的盐包括例如至少一个或两个轻链可变区,所述轻链可变区来自本文所述抗体,例如选自bap049-克隆-b或bap049-克隆-e中任一个的抗体;或者如表1中所述,或由表1中的核苷酸序列所编码;或者与前述序列中任一个基本上相同(例如,具有至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性)的序列。
[0155]
本披露的抗pd-1抗体分子或其药学上可接受的盐包括例如igg4(例如人igg4)的重链恒定区。人igg4包括根据eu编号的位置228处的取代(例如,ser被pro取代)。所述抗pd-1抗体分子包括igg1(例如人igg1)的重链恒定区。人igg1包括根据eu编号的位置297处的取代(例如,asn被ala取代)。人igg1还可包括根据eu编号的位置265处的取代、根据eu编号的位置329处的取代或两者(例如,位置265处的asp被ala取代和/或位置329处的pro被ala取代)。人igg1还包括根据eu编号的位置234处的取代、根据eu编号的位置235处的取代或两者(例如,位置234处的leu被ala取代和/或位置235处的leu被ala取代)。所述重链恒定区包含表3中列出的氨基序列,或与其基本上相同(例如具有至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性)的序列。
[0156]
根据本披露的抗pd-1抗体分子或其药学上可接受的盐包括例如κ轻链恒定区,例如人κ轻链恒定区。所述轻链恒定区包含表3中列出的氨基序列,或与其基本上相同(例如具有至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性)的序列。
[0157]
根据本披露的抗pd-1抗体分子或其药学上可接受的盐还包括例如igg4(如人igg4)的重链恒定区,和κ轻链恒定区(例如人κ轻链恒定区),例如包含表3中列出的氨基序列或与其基本上相同(例如具有至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性)的序列的重链和轻链恒定区。人igg4包括根据eu编号的位置228处的取代(例如,ser被pro取代)。所述抗pd-1抗体分子包括igg1(例如人igg1)的重链恒定区,和κ轻链恒定区(例如人κ轻链恒定区),例如包含表3中列出的氨基序列或与其基本上相同(例如具有至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性)的序列的重链和轻链恒定区。人igg1还可包括根据eu编号的位置297处的取代(例如asn被ala取代)。人igg1包括根据eu编号的位置265处的取代、根据eu编号的位置329处的取代或两者(例如,位置265处的asp被ala取代和/或位置329处的pro被ala取代)。人igg1包括根据eu编号的位置234处的取代、根据eu编号的位置235处的取代或两者(例如,位置234处的leu被ala取代和/或位置235处的leu被ala取代)。
[0158]
本披露的抗pd-1抗体分子或其药学上可接受的盐还包括例如重链可变结构域和恒定区、轻链可变结构域和恒定区、或两者,所述重链可变结构域和恒定区以及轻链可变结构域和恒定区包含bap049-克隆-b或bap049-克隆-e的氨基酸序列;或者如表1中所述,或由表1中的核苷酸序列所编码;或者与前述序列中任一个基本上相同(例如,具有至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性)的序列。所述抗pd-1抗体分子任选地包含来自如表4中所示的重链、轻链或两者的前导序列;或与其基本上相同的序列。
[0159]
根据本披露的抗pd-1抗体分子或其药学上可接受的盐包括至少一个、两个或三个互补决定区(cdr),所述互补决定区来自本文所述抗体(例如选自bap049-克隆-b或bap049-克隆-e中任一个的抗体)的重链可变区;或者如表1中所述,或由表1中的核苷酸序列所编码;或者与前述序列中任一个基本上相同(例如,具有至少80%、85%、90%、92%、95%、
97%、98%、99%或更高同一性)的序列。
[0160]
根据本披露的抗pd-1抗体分子或其药学上可接受的盐包括例如来自重链可变区的至少一个、两个或三个cdr(或总体上所有cdr),所述重链可变区包含表1所示的氨基酸序列或由表1所示核苷酸序列编码的氨基酸序列。相对于表1中所示的氨基酸序列或由表1中所示的核苷酸序列编码的氨基酸序列,所述cdr中的一个或多个(或总体上所有cdr)具有一个、两个、三个、四个、五个、六个或更多个变化,例如氨基酸取代或缺失。
[0161]
根据本披露的抗pd-1抗体分子或其药学上可接受的盐包括例如至少一个、两个、或三个cdr,所述cdr来自本文所述抗体(例如选自bap049-克隆-b或bap049-克隆-e中任一个的抗体)的轻链可变区;或者如表1中所述,或由表1中的核苷酸序列所编码;或者与前述序列中任一个基本上相同(例如,具有至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性)的序列。
[0162]
所述抗pd-1抗体分子或其药学上可接受的盐包括例如来自重链可变区的至少一个、两个或三个cdr(或总体上所有cdr),所述重链可变区包含表1所示的氨基酸序列或由表1所示的核苷酸序列编码的氨基酸序列。相对于表1中所示的氨基酸序列或由表1中所示的核苷酸序列编码的氨基酸序列,所述cdr中的一个或多个(或总体上所有cdr)具有一个、两个、三个、四个、五个、六个或更多个变化,例如氨基酸取代或缺失。
[0163]
所述抗pd-1抗体分子或其药学上可接受的盐包括例如至少一个、两个、或三个cdr,所述cdr来自本文所述抗体(例如选自bap049-克隆-b或bap049-克隆-e中任一个的抗体)的轻链可变区;或者如表1中所述,或由表1中的核苷酸序列所编码;或者与前述序列中任一个基本上相同(例如,具有至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性)的序列。
[0164]
所述抗pd-1抗体分子或其药学上可接受的盐包括例如来自轻链可变区的至少一个、两个或三个cdr(或总体上所有cdr),所述轻链可变区包含表1所示的氨基酸序列或由表1所示的核苷酸序列编码的氨基酸序列。相对于表1中所示的氨基酸序列或由表1中所示的核苷酸序列编码的氨基酸序列,所述cdr中的一个或多个(或总体上所有cdr)具有一个、两个、三个、四个、五个、六个或更多个变化,例如氨基酸取代或缺失。在某些实施例中,所述抗pd-1抗体分子或其药学上可接受的盐包括轻链cdr中的取代,例如轻链的cdr1、cdr2和/或cdr3中的一个或多个取代。所述抗pd-1抗体分子或其药学上可接受的盐包括在轻链cdr3中的轻链可变区位置102处的取代,例如在根据表1的轻链可变区的位置102处,半胱氨酸被酪氨酸取代,或半胱氨酸被丝氨酸残基取代(例如,针对经修饰的序列的seq id no:54或70)。
[0165]
根据本披露的抗pd-1抗体分子或其药学上可接受的盐包括例如来自重链和轻链可变区的至少一个、两个、三个、四个、五个或六个cdr(或总体上所有cdr),所述重链和轻链可变区包含表1所示的氨基酸序列或由表1所示的核苷酸序列编码的氨基酸序列。在一个实施例中,相对于表1中所示的氨基酸序列或由表1中所示的核苷酸序列编码的氨基酸序列,所述cdr中的一个或多个(或总体上所有cdr)具有一个、两个、三个、四个、五个、六个或更多个变化,例如氨基酸取代或缺失。
[0166]
本披露的抗pd-1抗体分子或其药学上可接受的盐包括例如所有六个cdr,所述cdr来自本文所述抗体,例如选自bap049-克隆-b或bap049-克隆-e中任一个的抗体;或者如表1所述,或由表1中的核苷酸序列所编码;或者密切相关的cdr,例如相同或具有至少一个氨基
酸改变,但不多于两个、三个或四个改变(例如取代、缺失或插入,例如保守取代)的cdr。所述抗pd-1抗体分子或其药学上可接受的盐还可包括本文所述的任何cdr。所述抗pd-1抗体分子或其药学上可接受的盐包括轻链cdr中的取代,例如轻链cdr1、cdr2和/或cdr3中的一个或多个取代。根据本披露的抗pd-1抗体分子或其药学上可接受的盐包括在轻链cdr3中的轻链可变区位置102处的取代,例如在根据表1的轻链可变区的位置102处,半胱氨酸被酪氨酸取代,或半胱氨酸被丝氨酸残基取代。
[0167]
本披露的抗pd-1抗体分子或其药学上可接受的盐包括至少一个、两个或三个根据kabat等人的cdr(例如,如表1中列出的至少一个、两个或三个根据kabat定义的cdr),所述cdr来自本文所述抗体(例如选自bap049-克隆-b或bap049-克隆-e中任一个的抗体)的重链可变区;或者如表1中所述,或由表1中的核苷酸序列所编码;或者与前述序列中任一个基本上相同(例如,具有至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性)的序列;或者相对于表1所示的一个、两个或三个根据kabat等人的cdr,具有至少一个氨基酸改变但不超过两个、三个或四个改变(例如,取代、缺失或插入,例如保守取代)的cdr。
[0168]
本发明的抗pd-1抗体分子或其药学上可接受的盐包括例如至少一个、两个或三个根据kabat等人的cdr(例如,如表1中列出的至少一个、两个或三个根据kabat定义的cdr),所述cdr来自本文所述抗体(例如选自bap049-克隆-b或bap049-克隆-e中任一个的抗体)的轻链可变区;或者如表1中所述,或由表1中的核苷酸序列所编码;或者与前述序列中任一个基本上相同(例如,具有至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性)的序列;或者相对于表1所示的一个、两个或三个根据kabat等人的cdr,具有至少一个氨基酸改变但不超过两个、三个或四个改变(例如,取代、缺失或插入,例如保守取代)的cdr。
[0169]
根据本披露的抗pd-1抗体分子或其药学上可接受的盐包括例如至少一个、两个、三个、四个、五个或六个根据kabat等人的cdr(例如,如表1中列出的至少一个、两个、三个、四个、五个或六个根据kabat定义的cdr),所述cdr来自本文所述抗体(例如选自bap049-克隆-b或bap049-克隆-e中任一个的抗体)的重链和轻链可变区;或者如表1中所述,或由表1中的核苷酸序列所编码;或者与前述序列中任一个基本上相同(例如,具有至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性)的序列;或者相对于表1所示的一个、两个、三个、四个、五个或六个根据kabat等人的cdr,具有至少一个氨基酸改变但不超过两个、三个或四个改变(例如,取代、缺失或插入,例如保守取代)的cdr。
[0170]
本披露的抗pd-1抗体分子或其药学上可接受的盐包括所有六个根据kabat等人的cdr(例如,如表1中列出的所有六个根据kabat定义的cdr),所述cdr来自本文所述抗体(例如选自bap049-克隆-b或bap049-克隆-e中任一个的抗体)的重链和轻链可变区;或者如表1中所述,或由表1中的核苷酸序列所编码;或者与前述序列中任一个基本上相同(例如,具有至少80%、85%、90%、92%、95%、97%、98%、99%或更高同一性)的序列;或者相对于表1所示的所有六个根据kabat等人的cdr,具有至少一个氨基酸改变但不多于两个、三个或四个改变(例如取代、缺失或插入,例如保守取代)的cdr。根据本披露的抗pd-1抗体分子或其药学上可接受的盐可包括本文所述的任何cdr。
[0171]
根据本披露的抗pd-1抗体分子或其药学上可接受的盐包括例如至少一个、两个或三个chothia高变环(例如,如表1中列出的至少一个、两个或三个根据chothia定义的高变环),所述高变环来自本文所述抗体(例如选自bap049-克隆-b或bap049-克隆-e中任一个的
抗体)的重链可变区;或者如表1中所述,或由表1中的核苷酸序列所编码;或者至少来自接触pd-1的那些高变环的氨基酸;或者相对于表1所示的一个、两个或三个根据chothia等人的高变环,具有至少一个氨基酸改变但不多于两个、三个或四个改变(例如取代、缺失或插入,例如保守取代)的高变环。
[0172]
根据本披露的抗pd-1抗体分子或其药学上可接受的盐包括例如至少一个、两个或三个chothia高变环(例如,如表1中列出的至少一个、两个或三个根据chothia定义的高变环),所述高变环来自本文所述抗体(例如选自bap049-克隆-b或bap049-克隆-e中任一个的抗体)的轻链可变区;或者如表1中所述,或由表1中的核苷酸序列所编码;或者至少来自接触pd-1的那些高变环的氨基酸;或者相对于表1所示的一个、两个或三个根据chothia等人的高变环,具有至少一个氨基酸改变但不多于两个、三个或四个改变(例如取代、缺失或插入,例如保守取代)的高变环。
[0173]
根据本披露的抗pd-1抗体分子或其药学上可接受的盐包括例如至少一个、两个、三个、四个、五个或六个高变环(例如,如表1中列出的至少一个、两个、三个、四个、五个或六个根据chothia定义的高变环),所述高变环来自本文所述抗体(例如选自bap049-克隆-b或bap049-克隆-e中任一个的抗体)的重链和轻链可变区;或者如表1中所述,或由表1中的核苷酸序列所编码;或者至少来自接触pd-1的那些高变环的氨基酸;或者相对于表1所示的一个、两个、三个、四个、五个或六个根据chothia等人的高变环,具有至少一个氨基酸改变但不多于两个、三个或四个改变(例如取代、缺失或插入,例如保守取代)的高变环。
[0174]
根据本披露的抗pd-1抗体分子或其药学上可接受的盐包括例如本文所述抗体(例如,选自bap049-克隆-b或bap049-克隆-e中任一个的抗体)的所有六个高变环(例如,如表1中列出的所有六个根据chothia定义的高变环),或者密切相关的高变环,例如相同的或具有至少一个氨基酸改变但不超过两个、三个或四个改变(例如,取代、缺失或插入,例如保守取代)的高变环;或者相对于表1所示的所有六个根据chothia等人的高变环,具有至少一个氨基酸改变但不多于两个、三个或四个改变(例如取代、缺失或插入,例如保守取代)的高变环。根据本披露的抗pd-1抗体分子或其药学上可接受的盐可包括本文所述的任何高变环。
[0175]
根据本披露的抗pd-1抗体分子或其药学上可接受的盐包括例如至少一个、两个或三个高变环,所述高变环具有与本文所述抗体(例如,选自bap049-克隆-b或bap049-克隆-e中任一个的抗体)的相应高变环相同的规范结构(例如,与本文所述抗体的重链和/或轻链可变结构域的至少环1和/或环2相同的规范结构)。(参见,例如chothia等人j.mol.biol.[分子生物学杂志]1992,227,799;tomlinson等人j.mol.biol.[分子生物学杂志]1992,227:776-798中关于高变环规范结构的描述)。这些结构可以通过查阅这些参考文献中描述的表格来确定。
[0176]
根据本披露的抗pd-1抗体分子或其药学上可接受的盐还可包括例如本文表1中所述的根据kabat等人的和chothia等人所定义的cdr或高变环的组合。
[0177]
根据本披露的抗pd-1抗体分子或其药学上可接受的盐包括例如至少一个、两个或三个根据kabat和chothia定义的cdr或高变环(例如,如表1中列出的至少一个、两个或三个根据kabat和chothia定义的cdr或高变环),所述cdr或高变环来自本文所述抗体(例如,选自bap049-克隆-b或bap049-克隆-e中任一个的抗体)的重链可变区;或者由表1中的核苷酸序列所编码;或者与前述序列中任一个基本上相同(例如,具有至少80%、85%、90%、92%、
95%、97%、98%、99%或更高同一性)的序列;或者相对于表1所示的一个、两个或三个根据kabat和/或chothia的cdr或高变环,具有至少一个氨基酸改变但不多于两个、三个或四个改变(例如取代、缺失或插入,例如保守取代)的cdr或高变环。
[0178]
例如,根据本披露的抗pd-1抗体分子或其药学上可接受的盐可以包括根据kabat等人的vh cdr1、或根据chothia等人的vh高变环1、或其组合,例如如表1中所示。vh cdr1的kabat和chothia cdr的组合包含氨基酸序列gytfttywmh(seq id no:224),或与其基本上相同的氨基酸序列(例如,具有至少一个氨基酸改变,但不超过两个、三个或四个改变(例如,取代、缺失或插入,例如保守取代))。所述抗pd-1抗体分子可以进一步包括例如根据kabat等人的vh cdr 2-3和根据kabat等人的vl cdr 1-3,例如如表1中所示。因此,框架区(fw)基于根据kabat等人定义的cdr和根据chothia等人定义的高变环的组合来定义。例如,所述抗pd-1抗体分子可包括基于根据chothia等人的vh高变环1定义的vh fw1和基于根据kabat等人的vh cdr 1-2定义的vh fw2,例如如表1中所示。所述抗pd-1抗体分子可进一步包含例如基于根据kabat等人的vh cdr 2-3定义的vh fw 3-4和基于根据kabat等人的vl cdr 1-3定义的vl fw 1-4。
[0179]
根据本披露的抗pd-1抗体分子或其药学上可接受的盐包括至少一个、两个或三个根据kabat和chothia定义的cdr(例如,如表1中列出的至少一个、两个或三个根据kabat和chothia定义的cdr),所述cdr来自本文所述抗体(例如,选自bap049-克隆-b或bap049-克隆-e中任一个的抗体)的轻链可变区。
[0180]
根据本披露的抗pd-1抗体分子或其药学上可接受的盐包括:
[0181]
(a)重链可变区(vh),其包含seq id no:4的vhcdr1氨基酸序列、seq id no:5的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;以及轻链可变区(vl),所述轻链可变区包含seq id no:13的vlcdr1氨基酸序列、seq id no:14的vlcdr2氨基酸序列、和seq id no:33的vlcdr3氨基酸序列;
[0182]
(b)vh,所述vh包含选自seq id no:1的vhcdr1氨基酸序列;seq id no:2的vhcdr2氨基酸序列;和seq id no:3的vhcdr3氨基酸序列;以及vl,所述vl包含seq id no:10的vlcdr1氨基酸序列、seq id no:11的vlcdr2氨基酸序列、和seq id no:32的vlcdr3氨基酸序列;
[0183]
(c)vh,所述vh包含seq id no:224的vhcdr1氨基酸序列、seq id no:5的vhcdr2氨基酸序列和seq id no:3的vhcdr3氨基酸序列;以及vl,所述vl包含seq id no:13的vlcdr1氨基酸序列、seq id no:14的vlcdr2氨基酸序列、和seq id no:33的vlcdr3氨基酸序列;或
[0184]
(d)vh,所述vh包含seq id no:224的vhcdr1氨基酸序列;seq id no:2的vhcdr2氨基酸序列;和seq id no:3的vhcdr3氨基酸序列;以及vl,所述vl包含seq id no:10的vlcdr1氨基酸序列、seq id no:11的vlcdr2氨基酸序列、和seq id no:32的vlcdr3氨基酸序列。
[0185]
根据本披露的抗pd-1抗体分子或其药学上可接受的盐包含重链可变区(vh),所述重链可变区包含选自seq id no:1、seq id no:4、或seq id no:224的vhcdr1氨基酸序列;seq id no:2或seq id no:5的vhcdr2氨基酸序列;和seq id no:3的vhcdr3氨基酸序列;以及轻链可变区(vl),所述轻链可变区包含seq id no:10或seq id no:13的vlcdr1氨基酸序列、seq id no:11或seq id no:14的vlcdr2氨基酸序列、和seq id no:32或seq id no:33
的vlcdr3氨基酸序列。
[0186]
根据本披露的抗pd-1抗体分子或其药学上可接受的盐可包含例如含有seq id no:38的氨基酸序列的重链可变结构域和含有seq id no:70的氨基酸序列的轻链可变结构域。
[0187]
根据本披露的抗pd-1抗体分子或其药学上可接受的盐可包含例如含有seq id no:91的氨基酸序列的重链和含有seq id no:72的氨基酸序列的轻链。
[0188]
本披露的抗pd-1抗体分子或其药学上可接受的盐包含重链可变区(vh)和轻链可变区(vl),所述重链可变区包含如表1中所述的bap049-克隆-b或bap049-克隆-e的hcdr1、hcdr2和hcdr3氨基酸序列,所述轻链可变区包含如表1中所述的bap049-克隆-b或bap049-克隆-e的lcdr1、lcdr2和lcdr3氨基酸序列。
[0189]
本披露的抗pd-1抗体分子或其药学上可接受的盐包含重链可变区(vh)和轻链可变区(vl),所述重链可变区包含如表1中所述的bap049-克隆-e的hcdr1、hcdr2和hcdr3氨基酸序列,所述轻链可变区包含如表1中所述的bap049-克隆-e的lcdr1、lcdr2和lcdr3氨基酸序列。
[0190]
应当理解,本披露的抗pd-1抗体分子或抗pd-1抗体分子可具有另外的保守或非必需氨基酸取代,这些取代对其功能没有实质性影响。
[0191]
术语“抗体分子”是指包含至少一种免疫球蛋白可变结构域序列的蛋白质,例如免疫球蛋白链或其片段。术语“抗体分子”包括例如单克隆抗体(包括具有免疫球蛋白fc区的全长抗体)。抗体分子包含全长抗体、或全长免疫球蛋白链、或者全长抗体或全长免疫球蛋白链的抗原结合片段或功能片段。抗体分子也可以是多特异性抗体分子,例如其包含多个免疫球蛋白可变结构域序列,其中所述多个中的第一免疫球蛋白可变结构域序列对第一表位具有结合特异性,并且所述多个中的第二免疫球蛋白可变结构域序列对第二表位具有结合特异性。
[0192]
术语“药学上可接受的盐”可以例如作为酸加成盐形成,优选与有机酸或无机酸形成。合适的无机酸是例如氢卤酸,如盐酸。合适的有机酸是例如羧酸或磺酸,例如富马酸或甲磺酸。出于分离或纯化的目的,还可以使用药学上不可接受的盐,例如苦味酸盐或高氯酸盐。对于治疗用途,仅采用药学上可接受的盐或游离化合物(在适用于药物制剂形式的情况下),并且因此这些是优选的。在适当和有利的情况下,对本文游离化合物的任何提及应理解为还指相应的盐。如本文所述,抑制剂的盐优选是药学上可接受的盐;形成药学上可接受的盐的合适的抗衡离子是本领域已知的。
[0193]
术语“药学上可接受的”是指适合用于与人类和动物的组织接触而不产生过度毒性、刺激、过敏反应、或其他问题或并发症,与合理的益处/风险比相称的那些化合物、材料、组合物、和/或剂型。
[0194]
术语“抑制”或“抑制剂”包括给定分子(例如免疫检查点抑制剂,如抗pd-1抗体分子)的某些参数(例如活性)的降低。例如,该术语包括抑制至少5%、10%、20%、30%、40%或更多的活性(例如pd-1或pd-l1活性)。因此,抑制不必是100%。
[0195]
术语“癌症”是指以快速和不受控制的生长的异常细胞增殖为特征的疾病。癌细胞可以局部或通过血流和淋巴系统扩散到身体的其他部位。各种癌症的实例包括但不限于白血病、前列腺癌、肾癌、肝癌、肉瘤、脑癌、淋巴瘤、卵巢癌、肺癌、宫颈癌、皮肤癌、乳腺癌、头
颈部鳞状细胞癌(hnscc)、胰腺癌、胃肠癌、结肠直肠癌、三阴性乳腺癌(tnbc)、肺鳞状细胞癌、食道鳞状细胞癌、宫颈鳞状细胞癌、神经胶质瘤、胶质母细胞瘤或黑素瘤。根据本披露,用上述组合治疗的特别合适的病症是多形性胶质母细胞瘤(gbm)。
[0196]
术语“肿瘤”和“癌症”在本文中可互换使用,例如,这两个术语涵盖实体瘤和液体瘤,例如弥漫性或循环性肿瘤。在一个实施例中,术语“癌症”或“肿瘤”包括恶性癌症和肿瘤,以及晚期癌症和肿瘤。
[0197]
术语“治疗”包括例如如本文所述的,向需要这种治疗的温血动物(特别是人类)治疗性施用csf-1r抑制剂或其药学上可接受的盐与抗pd-1抗体分子或其药学上可接受的盐的组合,以达到治愈疾病或对疾病消退或延缓疾病进展有效果的目的。任何疾病或障碍的术语“治疗(treat/treating/treatment)”是指减轻所述疾病或障碍(例如,减缓或阻止或减少所述疾病或其至少一个临床症状的发展),是指防止或延迟所述疾病或障碍的发作或发展或进展。
[0198]
csf-1r抑制剂,(i)4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺,或其药学上可接受的盐,可以以4天给药和10天停药施用,每个周期两次。如本文披露的csf-1r抑制剂可以每日施用一次或两次,两次连续给药之间间隔12小时。组合配偶体(ii)抗pd-1抗体分子可以继续施用更多周期,只要其具有临床意义。
[0199]
如本文披露的,组合配偶体在周期的同一天或不同天施用。术语“周期”是指以常规时间表重复的以天或月表示的特定时间段。如本文披露的周期更优选以天数表示。例如,所述周期可以是但不限于28天、30天、60天、90天。最优选地,本披露中提及的“周期”长28天。这样的周期可以重复数次(例如2次、3次、4次、5次等),每个周期长度相同并可以重复,只要其具有临床意义,即肿瘤的生长至少在被减少、被控制,或肿瘤缩小,并且不良事件是可以忍受的。
[0200]
csf-1r抑制剂,(i)4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺,或其药学上可接受的盐,可以口服或静脉内施用,最优选口服,每日剂量为100mg/天、150mg/天、200mg/天、300mg/天、400mg/天、500mg/天、600mg/天、700mg/天、900mg/天、或1200mg/天。优选地,每日剂量为700mg/天或1200mg/天。
[0201]
根据本披露,(i)4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺,或其药学上可接受的盐可以例如在药物组合物中与惰性稀释剂或载体一起口服施用。
[0202]
根据本披露,抗pd-1抗体分子(ii)或其药学上可接受的盐(选自纳武单抗(opdivo)、派姆单抗(keytruda)、匹地利珠单抗、斯巴达珠单抗、或其药学上可接受的盐)可以用于治疗癌症,并且在一个周期中每两周或每四周施用一次。最优选地,如本文所述的抗pd-1抗体分子斯巴达珠单抗(ii)或其药学上可接受的盐用于治疗癌症。最优选地,斯巴达珠单抗(ii)每四周施用一次。斯巴达珠单抗以300-400mg/天的剂量通过注射(例如皮下或静脉内)施用。优选地,抗pd-1抗体分子斯巴达珠单抗或其药学上可接受的盐以300至400mg/天的单次剂量静脉内施用。最优选地,抗pd-1抗体分子斯巴达珠单抗(ii)或其药学上可接受的盐以400mg/天的单次剂量施用。最优选地,抗pd-1抗体分子斯巴达珠单抗或其药学上可接受的盐以每四周400mg/天的剂量施用。剂量能以单次剂量或以若干分次剂量施用。
[0203]
具体地,给药方案可以按以下变化:100mg/天、150mg/天、200mg/天、300mg/天、400mg/天、500mg/天、600mg/天、700mg/天、900mg/天、或1200mg/天的具有式(i)的csf-1r抑制剂4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺,或其药学上可接受的盐(4天给药和10天停药,每个周期两次),和每两周或四周300mg/天至400mg/天的抗pd-1抗体分子(ii),或其药学上可接受的盐。例如,根据本披露,以4天给药和10天停药施用150mg/天的(i)4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺或其药学上可接受的盐,每个周期两次,并且每个周期每4周以400mg/天的剂量施用一次抗pd-1抗体分子(ii)或其药学上可接受的盐。根据本披露的另一个实例由以下组成:以4天给药和10天停药施用300mg/天的(i)4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺或其药学上可接受的盐,每个周期两次,并且每个周期每4周以400mg/天的剂量施用一次抗pd-1抗体分子(ii)或其药学上可接受的盐。根据本披露的又另一个实例提供了以下:以4天给药和10天停药,每个周期两次施用600mg/天的(i)4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺或其药学上可接受的盐,并且每个周期每4周以400mg/天的剂量施用一次抗pd-1抗体分子(ii)或其药学上可接受的盐。
[0204]
抗体分子可以通过本领域已知的多种方法施用,但是对于许多治疗性应用,优选的施用途径/方式是静脉内注射或输注。例如,抗体分子能以超过20mg/min的速率(例如20-40mg/min,并且典型地大于或等于40mg/min)通过静脉内输注而施用,以达到约300至400mg/天的剂量。对于静脉内注射或输注,治疗组合物通常在制造和贮藏条件下应该是无菌和稳定的。所述组合物可以被配制成溶液、微乳剂、分散体、脂质体或其他适合于高抗体浓度的有序结构。可以通过以下方式来制备无菌可注射溶液:将活性化合物(即抗体或抗体部分)以所需的量与所需的一种成分或成分组合一起掺入合适的溶剂中,然后进行过滤灭菌。总体上,通过将活性化合物掺入无菌媒介物来制备分散体,所述无菌媒介物含有基础分散介质以及所需其他成分。就用于制备无菌可注射溶液的无菌粉末而言,优选制备方法是真空干燥和冷冻干燥,这些方法产生活性成分的粉末以及来自其以前的无菌过滤溶液的任何另外的所需成分。例如,可以通过使用包衣(如卵磷脂)、通过在分散体的情况下维持所需粒度以及通过使用表面活性剂来维持溶液的适当流动性。可以通过在组合物中包括延迟吸收的试剂(例如,单硬脂酸盐和明胶)来延长可注射组合物的吸收。
[0205]
应当理解,施用途经和/或方式将随所希望的结果而变化。例如,活性化合物可与将保护该化合物避免快速释放的载体一起制备,如控释配制品,包括植入物、透皮贴剂和微胶囊化递送系统。可以使用可生物降解的生物相容性聚合物,如乙烯乙酸乙烯酯、聚酐类、聚乙醇酸、胶原、聚原酸酯类和聚乳酸。用于制备此类配制品的许多方法是已获专利或本领域技术人员公知的(例如,sustained and controlled release drug delivery systems[持续和控制释放药物递送系统],j.r.robinson编辑,marcel dekker,inc.[马塞尔
·
德克尔公司],纽约,1978)。
[0206]
同样,(i)4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺或其药学上可接受的盐与抗pd-1抗体分子(ii)或其药学上可接受的盐的组合可用于制造治疗癌症的药物。
[0207]
出于同样的原因,本披露还提供了用于治疗癌症的方法,所述方法包括向有需要
的患者施用有效量的组合配偶体(例如(i)4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺或其药学上可接受的盐以及抗pd-1抗体分子(ii)或其药学上可接受的盐)。
[0208]
术语“患者”或“受试者”是指温血动物。在最优选的实施例中,受试者或患者是人。如本文披露的,其可以是已被诊断并且需要治疗疾病或障碍的人。
[0209]
当用于制造治疗癌症的药物或用于治疗有需要的患者中的癌症的方法中时,(i)和(ii)能以如上所说明的剂量和给药方案使用。
[0210]
最优选地,所述组合包含csf-1r抑制剂,(i)4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺或其药学上可接受的盐,以及抗pd-1抗体分子斯巴达珠单抗(ii)或其药学上可接受的盐。这两个组合配偶体(i)和(ii)均可以根据如本文所述的给药方案施用。例如,(i)4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺,或其药学上可接受的盐,可以以4天给药和10天停药施用,每个周期两次。每个周期至少施用一次斯巴达珠单抗(ii)或其药学上可接受的盐。例如,(i)4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺,或其药学上可接受的盐,以这种特定的组合以100mg/天、150mg/天、200mg/天、300mg/天、400mg/天、500mg/天、600mg/天、700mg/天、900mg/天、或1200mg/天的剂量施用。优选地,剂量为700mg/天或1200mg/天。斯巴达珠单抗(ii)或其药学上可接受的盐以300-400mg/天的单次剂量,最优选400mg/天的剂量施用。
[0211]
出于同样的原因,本披露还提供了用于治疗癌症的方法,所述方法包括向有需要的患者施用有效量的组合配偶体(例如(i)4-((2-(((1r,2r)-2-羟基环己基)氨基)苯并[d]噻唑-6-基)氧基)-n-甲基吡啶甲酰胺或其药学上可接受的盐以及抗pd-1抗体分子(ii)或其药学上可接受的盐)。
[0212]
本披露的组合配偶体的术语“有效量”或“治疗有效量”是指以必要的剂量和在必要的时间段内有效实现所需治疗结果的量。组合配偶体的治疗有效量可根据以下因素而变化,如个体的疾病状态、年龄、性别、和体重。治疗有效量也是其中治疗有益效果超过如本文所述组合的任何毒性或有害作用的量。“治疗有效剂量”优选地抑制可测量的参数,例如相对于未治疗的受试者,肿瘤生长速率抑制至少约20%,更优选至少约40%,甚至更优选至少约60%,并且仍更优选至少约80%。
[0213]
表1:
[0214]
人源化抗体分子的氨基酸和核苷酸序列。抗体分子包括bap049-克隆-b和bap049-克隆-e。显示了重链和轻链cdr、重链和轻链可变区以及重链和轻链的氨基酸和核苷酸序列。
[0215]
[0216]
[0217]
[0218]
[0219]
[0220]
[0221]
[0222]
[0223]
[0224][0225]
表2:
[0226]
人源化mab bap049-克隆-b和bap049-克隆-e的重链和轻链框架区的氨基酸和核苷酸序列
[0227]
[0228]
[0229]
[0230]
[0231][0232]
表3:
[0233]
人igg重链和人κ轻链的恒定区氨基酸序列
[0234]
[0235]
[0236][0237]
表4:
[0238]
人源化mab bap049-克隆-b和bap049-克隆-e的重链和轻链前导序列的氨基酸序列
[0239]
bap049-克隆-bhcmawvwtlpflmaaaqsvqa(seq id no:221) lcmsvltqvlallllwltgtrc(seq id no:222)bap049-克隆-ehcmawvwtlpflmaaaqsvqa(seq id no:221) lcmsvltqvlallllwltgtrc(seq id no:222)
[0240]
用于本文中所描述的组合中的其他示例性抗pd-1抗体
[0241]
在一个实施例中,抗pd-1抗体是纳武单抗(百时美施贵宝公司(bristol-myers squibb)),也称为mdx-1106、mdx-1106-04、ono-4538、bms-936558、或纳武单抗(克隆5c4)和其他抗pd-1抗体披露在us 8,008,449和wo 2006/121168中,这些文献通过援引以其全文并入。在一个实施例中,抗pd-1抗体包含以下中的一种或多种:纳武单抗的cdr序列(或总体上所有cdr序列)、重链或轻链可变区序列、或重链或轻链序列,例如,如表5中所披露的。
[0242]
在一个实施例中,抗pd-1抗体是派姆单抗(默克公司(merck&co)),也称为兰罗利珠单抗(lambrolizumab)、mk-3475、mk03475、sch-900475、或派姆单抗和其他抗pd-1抗体披露于hamid,o.等人(2013)new england journal of medicine[新英格兰医学杂志]369(2):134
–
44;us 8,354,509和wo 2009/114335中,将其通过援引以其全文并入。在一个实施例中,抗pd-1抗体包含以下中的一种或多种:派姆单抗的cdr序列(或总体上所有cdr序列)、重链或轻链可变区序列、或重链或轻链序列,例如,如表5中所披露的。
[0243]
在一个实施例中,抗pd-1抗体是匹地利珠单抗(治疗科技公司(curetech)),也称为ct-011。匹地利珠单抗和其他抗pd-1抗体披露于rosenblatt,j.等人,(2011)j immunotherapy[免疫疗法杂志]34(5):409-18;us 7,695,715;us 7,332,582;和us 8,686,119中,这些文献通过援引以其全文并入。在一个实施例中,抗pd-1抗体包含以下中的一种
或多种:匹地利珠单抗的cdr序列(或总体上所有cdr序列)、重链或轻链可变区序列、或重链或轻链序列,例如,如表5中所披露的。
[0244]
在一个实施例中,所述抗pd-1抗体是medi0680(英商梅迪缪思有限公司(medimmune)),也称为amp-514。medi0680和其他抗pd-1抗体披露于us 9,205,148和wo 2012/145493(将其通过援引以其全文并入)中。在一个实施例中,抗pd-1抗体包含以下中的一种或多种:medi0680的cdr序列(或总体上所有cdr序列)、重链或轻链可变区序列、或重链或轻链序列。
[0245]
在一个实施例中,所述抗pd-1抗体是regn2810(再生元公司(regeneron))。在一个实施例中,抗pd-1抗体包含以下中的一种或多种:regn2810的cdr序列(或总体上所有cdr序列)、重链或轻链可变区序列、或重链或轻链序列。
[0246]
在一个实施例中,抗pd-1抗体是pf-06801591(辉瑞公司(pfizer))。在一个实施例中,抗pd-1抗体包含以下中的一种或多种:pf-06801591的cdr序列(或总体上所有cdr序列)、重链或轻链可变区序列、或重链或轻链序列。
[0247]
在一个实施例中,抗pd-1抗体是bgb-a317或bgb-108(百济神州公司(beigene))。在一个实施例中,抗pd-1抗体包含以下中的一种或多种:bgb-a317、或bgb-108的cdr序列(或总体上所有cdr序列)、重链或轻链可变区序列、或重链或轻链序列。
[0248]
在一个实施例中,抗pd-1抗体是incshr1210(因赛特公司(incyte)),也称为incshr01210或shr-1210。在一个实施例中,抗pd-1抗体包含以下中的一种或多种:incshr1210的cdr序列(或总体上所有cdr序列)、重链或轻链可变区序列、或重链或轻链序列。
[0249]
在一个实施例中,抗pd-1抗体是tsr-042(泰萨罗公司(tesaro)),也称为anb011。在一个实施例中,抗pd-1抗体包含以下中的一种或多种:tsr-042的cdr序列(或总体上所有cdr序列)、重链或轻链可变区序列、或重链或轻链序列。
[0250]
其他已知的抗pd-1抗体包括描述于例如以下中的那些:wo 2015/112800、wo 2016/092419、wo 2015/085847、wo 2014/179664、wo 2014/194302、wo 2014/209804、wo 2015/200119、us 8,735,553、us 7,488,802、us 8,927,697、us 8,993,731、和us 9,102,727(将其通过援引以其全文并入)。
[0251]
在一个实施例中,抗pd-1抗体是与本文所述的抗pd-1抗体之一竞争pd-1上的相同表位结合和/或结合至pd-1上的相同表位的抗体。
[0252]
表5.其他示例性抗pd-1抗体的氨基酸序列
[0253]
[0254]
[0255]
[0256][0257]
使用blz945组合治疗神经退行性疾病(例如als)
[0258]
迄今为止,目前有两种已批准的药物,即利鲁唑和依达拉奉,用于治疗als。人体中利鲁唑生物转化的主要肝代谢途径可能涉及利鲁唑的直接葡萄糖醛酸化(涉及葡萄糖醛转移酶同工型ugt-hp4),以及通过cyp1a2和cyp1a1将利鲁唑氧化为n-羟基利鲁唑,然后进行快速葡萄糖醛酸化(sanderink等人1997)。此外,已显示利鲁唑是乳腺癌抗性蛋白(bcrp)和p-糖蛋白(p-gp)的底物(milane等人2009)。预计共施用利鲁唑不会影响blz945的药代动力学。
[0259]
因此,在一个实施例中,利鲁唑与本文披露的blz945给药方案组合施用,用于治疗神经退行性疾病,例如als、多发性硬化症(ms)或阿尔茨海默氏病。
[0260]
当依达拉奉与blz945共施用时,预期不会有明显的pk相互作用。依达拉奉是一种静脉内疗法。葡萄糖醛酸苷缀合是依达拉奉代谢的主要途径,并且发现八种ugt(ugt1a1、ugt1a6、ugt1a7、ugt1a8、ugt1a9、ugt1a10、ugt2b7和ugt2b17)有助于产生大量的葡萄糖醛酸苷代谢产物(dash等人2018)。体外研究的结果表明,在临床剂量下,依达拉奉及其代谢物预计不会潜在地抑制人体内的cyp酶、ugt和转运蛋白。预计cyp酶、ugt或主要转运蛋白的抑制剂不会显著影响依达拉奉的药代动力学。
[0261]
因此,在一个实施例中,依达拉奉与本文披露的blz945给药方案组合施用,用于治疗神经退行性疾病,例如als、多发性硬化症或阿尔茨海默氏病。
[0262]
实例
[0263]
实例1:blz945作为单一药剂以及与斯巴达珠单抗组合在患有晚期实体瘤的成年患者中的安全性和功效的i/ii期、开放标签、多中心研究
[0264]
作为单一药剂或与斯巴达珠单抗组合给予的blz945的该首次人体(fih)研究的目的是表征在患有晚期实体瘤的成年患者中作为单一药剂或与斯巴达珠单抗(静脉内(i.v.)施用)组合口服施用时,blz945的安全性、耐受性、药代动力学(pk)、药效动力学和抗肿瘤活性。
[0265]
研究设计:
[0266]
这项研究是fih、开放标签、多中心、i/ii期研究,其由blz945作为单一药剂(包括单独的日本blz945单一药剂剂量递增组)以及与斯巴达珠单抗组合的i期剂量递增部分组成。可以评估blz945的替代性给药方案。将blz945口服施用,并且将斯巴达珠单抗每四周静脉内施用,直到患者出现不可接受的毒性、疾病进展,和/或在研究者或患者酌情决定下中止治疗。
[0267]
纳入标准(晚期实体瘤中剂量递增部分):
[0268]
·
i期:实体瘤反应评估标准(recist)1.1版或rano(胶质母细胞瘤)所确定的患有可测量或不可测量疾病的晚期/转移性实体瘤(包括淋巴瘤)患者,这些患者尽管已经接受了标准疗法但是仍有进展或对标准疗法不耐受,或者对其尚不存在标准疗法。
[0269]
·
患者必须具有适合活检的疾病部位,并且根据治疗机构的准则是肿瘤活检的候选者。患者必须愿意在筛选时和治疗期间进行新的肿瘤活检。在与诺华进行书面讨论后,可以考虑将胶质母细胞瘤患者视为例外。
[0270]
·
ii期:在以下选择的适应证中患有晚期/转移性肿瘤的患者,至少具有一种由recist v1.1或神经肿瘤标准rano(胶质母细胞瘤)中的反应评估或霍奇金和非霍奇金淋巴瘤研究中针对一种或多种淋巴瘤适应证的功效评估指南确定的可测量的病变
[0271]
ο在标准护理治疗期间或之后无反应或进展的晚期胰腺癌
[0272]
ο标准治疗期间或之后对标准治疗无反应或进展的晚期三阴性乳腺癌
[0273]
ο对放射治疗和替莫唑胺上无反应或进展的复发性胶质母细胞瘤,除了o6-甲基鸟嘌呤-dna甲基转移酶(mgmt)未甲基化的新诊断的胶质母细胞瘤患者,他们可能仅接受放射治疗。
[0274]
给药方案:
[0275]
按照以下日程表评估blz945给药,7天给药/7天停药(即每天施用blz945,持续7天,并暂停7天),每周一次(q1w),和4天给药/10天停药(即每天施用blz945,持续4天,并暂停10天)。对于这些日程表中的每一个,可以评估每天一次(qd)或每天两次(bid)给药。对于每天一次的施用,患者应在早晨的大约同一时间服用其剂量。对于一天两次的给药,第一次剂量应在早晨服用,并且第二次剂量应在早晨剂量后约10至12小时服用。
[0276]
在获得pk样品的当天,患者应在研究人员指示时,在临床前访视期间,在给药前pk样品之后和给药后pk样品之前服用blz945。患者应至少在饭前1小时或饭后2小时空腹服用blz945(即,禁食和饮料,水除外)。每个剂量应用一杯水服用。应该指导患者吞咽整个胶囊,而不咀嚼或打开它们。
[0277]
表6:剂量和治疗日程表
[0278]
[0279][0280]
所有接受blz945单一药剂或与斯巴达珠单抗组合处理的患者将在处理第1周期的第1天开始研究。每个周期由28天组成。
[0281]
bzl945作为单一药剂起始剂量(sa)
[0282]
为了评估blz945在各种剂量范围内的安全性、pk和抗肿瘤活性,在该研究中建议的起始剂量为7天给药/7天停药日程表的150mg。如果基于出现的pk和安全性评估认为合适,还可以并行探索每周一次的给药(q1w)或4天给药/10天停药。在可用安全性、pk和pd信息的背景下,基于dlt数据的贝叶斯逻辑回归模型(blrm)和控制剂量过量的递增(ewoc)原则,将指导剂量递增决策。使用blrm的该开放标签剂量递增研究设计是估计癌症患者中的mtd和/rp2d的公认方法。适应性blrm将以ewoc原则为指导,以控制研究中未来患者的dlt风险。欧洲药品管理局已接受贝叶斯响应适应性模型在小型数据集上的用途(“guideline on clinical trials in small populations[小群体临床试验指南]”,2007年2月13日),并得到众多出版物的认可(zacks和hersh1998年;neuenschwander等人2008年;neuenschwander等人2010年),并且其发展和适当使用是美国食品和药物管理局(fda)的关键路径计划(fda’s critical path initiative)的一个方面。一个或多个新日程表的开始剂量将等于或低于先前测试的最大剂量,并且在7天给药/7天停药日程表满足贝叶斯逻辑回归模型(blrm)的控制剂量过量的递增(ewoc)标准。
[0283]
blz945单一药剂的日本剂量递增将与正在进行的非日本剂量递增分开运行,该非日本剂量递增的起始剂量基于出现的pk和安全性评估应认为是合适的,并且满足全球剂量递增组内以及日本的具体递增blrm的ewoc标准。
[0284]
如果认为合适,还可以探讨每天两次给药日程表。累积的起始剂量(即早晨剂量加晚上剂量)将不高于每天一次施用的剂量,该剂量在剂量递增电话会议期间与参与调查人员讨论之后,使用贝叶斯分层逻辑回归模型(bhlrm)进行了测试,并证明满足ewoc标准。
[0285]
bzl945和斯巴达珠单抗组合的起始剂量
[0286]
为了施用与斯巴达珠单抗组合的blz945的安全剂量,blz945的起始剂量应满足以下要求:
[0287]
·
已在单一药剂递增组中测试的剂量
[0288]
·
在适当的单一药剂blrm下,基于出现的pk和安全性评估,比满足ewoc标准的blz945的最高调查单一药剂剂量至少低一个剂量水平被认为是合适的,并且基于组合模型的blrm符合ewoc标准。
[0289]
·
除非在起始剂量下观察到dlt,否则不少于单一药剂的起始剂量(即150mg)。
[0290]
在两种组合剂量递增中,斯巴达珠单抗将以每4周400mg的固定剂量静脉内施用,
其已被证明具有良好的耐受性。
[0291]
表7:临时剂量水平(blz945单一药剂)
[0292]
剂量水平blz945的拟议剂量*与先前剂量相比的增量-1**100mg-33%1150mg起始剂量2300mg100%3600mg100%4900mg50%
[0293]
*有可能在研究过程中添加另外的和/或中间剂量水平,为了更好地了解安全性、pk或pd,可以以低于mtd的任何剂量水平添加组。
[0294]
**剂量水平-1代表需要从起始剂量水平降低剂量的患者的治疗剂量。该研究不允许低于剂量水平-1的剂量减少。
[0295]
表8:临时剂量水平(blz945与斯巴达珠单抗组合)
[0296][0297]
*有可能在研究过程中添加另外的和/或中间剂量水平,为了更好地了解安全性、pk或pd,可以以低于mtd的任何剂量水平添加组。
[0298]
**剂量水平-1代表需要从起始剂量水平降低剂量的患者的治疗剂量。该研究不允许低于剂量水平-1的剂量减少。
[0299]
治疗持续时间
[0300]
患者可以继续使用blz945单一药剂治疗,直到患者出现不可接受的毒性,根据irrc(或根据胶质母细胞瘤患者的irano)确认的疾病进展或根据r/r淋巴瘤患者霍奇金和非霍奇金淋巴瘤研究的功效评估指南确认的进展性(代谢性)疾病,和/或在研究人员或患者酌情决定下中止治疗。
[0301]
患者可以继续使用blz945与斯巴达珠单抗组合治疗,直到患者出现不可接受的毒性,根据irrc(或根据胶质母细胞瘤患者的irano)确认的疾病进展或根据r/r淋巴瘤患者霍奇金和非霍奇金淋巴瘤研究的功效评估指南确认的进展性(代谢性)疾病,和/或在研究人员或患者酌情决定下中止治疗。在治疗的前24周中,患者不会因根据recist v1.1(或根据胶质母细胞瘤患者的rano,或根据r/r淋巴瘤患者的霍奇金和非霍奇金淋巴瘤研究的功效评估指南)的进展性疾病而退出研究。
[0302]
实例2:假期给药对alt ae的影响的建模和模拟
[0303]
在实例1的临床研究过程中,在使用单一药剂blz945治疗的所有68名患者(100%)和使用组合方案治疗的所有46名患者(100%)中,均报告了所有等级的不良事件(ae),无论与研究治疗的关系如何。怀疑与blz945单一药剂有关的最常报告的ae(》10%)是天冬氨酸转氨酶(ast)增加、恶心、呕吐、丙氨酸转氨酶(alt)增加、疲劳、淀粉酶增加、血肌酸磷酸激酶增加和食欲下降。组合治疗最常报告的可疑ae(》10%)是ast增加、alt增加、瘙痒、疲劳、恶心、皮疹和呕吐。在单一药剂组中报告了三起可疑的sae。这些sae是3级ast增加、3级无力和4级猝死。在组合组中,据报告有4位患者中有7起sae怀疑与研究治疗有关,包括3级ast增加、4级alt增加、4级免疫介导的肝炎、3级结肠炎和伴有1级发热和2级皮疹斑丘疹的2级口腔炎。
[0304]
正在进行的研究cblz945x2101已评估了单独或与斯巴达珠单抗组合施用时口服blz945的单次剂量和多剂量的初步药代动力学(pk)。blz945作为单一药剂以及与斯巴达珠单抗组合在所有测试剂量下均表现出快速吸收。blz945的平均终末消除半衰期(t1/2)范围从16.4至26.7小时,并且当作为单次剂量或多剂量,在所有剂量和给药方案中给予时以及单独或与斯巴达珠单抗组合给予时均保持一致。剂量归一化的cmax和auc0-24hr的分析表明,当单独或与斯巴达珠单抗组合给予时,blz945的暴露小于正比于600mg剂量开始的剂量。累积指数(racc)的分析表明,在给药期结束时每天一次给药7天或4天(平均racc范围为1.54至2.20),比q1w方案(平均racc范围为1.07至1.24)引起更多的累积。基于迄今为止产生的初步数据,斯巴达珠单抗似乎并未影响blz945的pk。
[0305]
基于临床前数据的食蟹猴alt建模预测,假期剂量可能会降低alt增加的可能性(见图1和2)。另外,从实例1的临床研究中得到的来自5位以150mg给药的患者和5位以300mg给药的患者的数据被用于构建群体pk-alt模型,该模型将blz945药物浓度与alt相关联。为了预测1级、2级、3级和4级alt ae的可能性,使用该模型进行了模拟。模拟了三种不同的方案:7天给药/7天停药,剂量为300mg(7天x 300mg=2100mg总剂量的blz945),以及在14天期间q1w(每周一次)内为2100mg,4天给药/10天停药。这三种方案的比较得出的结论是,需要清除期(药物假期)以使基线alt正常值恢复,并且在4天给药/10天停药的方案出现此类ae的可能性降低。
[0306]
清除期的该需要是由于与blz945相关的pk,而不是所治疗的特定疾病。实际上,表达csf-1r的巨噬细胞,尤其是肝脏中的kupffer细胞,在清除来自循环中的酶方面起着作用,该酶包括丙氨酸转氨酶(alt)、天冬氨酸转氨酶(ast)和肌酸激酶(ck)。由于csf1r kupffer细胞的消耗(csf-1r靶向化合物的类别效应),csf-1r的抑制诱导了ast和alt水平的增加。因此,这种给药/停药给药方案(例如4天给药/10天停药的给药周期或7天给药/7天停药的给药周期等)通常适用于使用blz945进行疾病的治疗;例如,使用blz945用于治疗癌症或神经退行性疾病,例如als或ms。
[0307]
实例3:c57bl/6n小鼠的mc38同系小鼠模型
[0308]
在使用mc38同系小鼠模型的c57bl/6n小鼠的另一组实验中,比较了单独以及与抗pd-1组合使用blz945每周一次给药和使用blz9454天给药/3天停药的两种不同日程表的blz945的功效(图3)。当与媒介物对照动物相比,抗pd-1治疗每周导致6/10只动物的完全缓解(cr),blz945与抗pd-1组合施用导致5/10 cr,并显著抑制肿瘤生长,对应于第10天相对于对照的%t/c为37%(p=3.90x10-2)和第14天为32%(p=1.57x10-2)。以4天给药/3天停
药的日程表与抗pd-1组合施用blz945导致4/10 cr,并在第10天导致显著的肿瘤生长抑制,对应于相对于对照的%t/c为28%(p=4.76x10-2)。在治疗开始后的第14天,存在肿瘤生长抑制的趋势,对应于相对于对照的%t/c为28%。
[0309]
按所示日程表给予200mg/kg blz945和10mg/kg抗pd-1的剂量,并在研究开始后第14天测量肿瘤体积。采用单因素方差分析(one-way anova)和事后邓尼特(dunnett)检验来计算统计学显著性,来进行治疗组对对照组的比较。
[0310]
为了测量血浆中csf1的增加作为csf-1r抑制的生物标志物,在指定日期的基线和6小时后进行血液采样(图4)。仅blz945按4天给药/3天停药的日程表单独和组合导致csf-1血浆水平的统计学显著增加(图4)。
[0311]
血浆中的小鼠csf-1水平。a.不同治疗组中csf-1水平随时间的变化。b.媒介物相对于以4天给药/3天停药的blz945,以及媒介物相对于与抗pd-1组合的以4天给药/3天停药的blz945的csf-1水平的统计分析。使用双尾、非配对、非参数mann-whitney检验计算统计学显著性,以比较治疗与对照组。
[0312]
为了获得与肿瘤相关的免疫细胞的动力学,仅使用4天给药/3天停药的日程表作为单一药剂和与抗pd-1组合进行重复研究。在治疗10天和14天后,观察到tam显著下降,并且在治疗开始后第10天,观察到treg短暂下降。
[0313]
图5通过流式细胞术在第10天(a)和第14天(b)的以4天给药/3天停药的日程表使用blz945和与抗pd-1组合进行治疗的肿瘤浸润巨噬细胞(图5a)和treg(图5b)的分析。使用双尾、非配对、非参数mann-whitney检验计算统计学显著性,以比较治疗与对照组。
[0314]
用次优剂量的抗pd-1(5mg/kg)重复功效测试,以测试组合给予时观察到的blz945的累加效应。有趣的是,仅与抗pd-1组合的4天给药/3天停药的日程表,而不是服用blz945或抗pd-1的单一药剂组都导致统计学上显著的肿瘤生长抑制作用。
[0315]
实例4:具有式(i)的化合物在单一药剂剂量组中的ast/alt升高
[0316]
在一定剂量范围内,对每周一次(q1w)给药方案和4天给药/10天停药的给药方案,比较具有式(i)的化合物的单一药剂剂量组的ast和alt升高。图6和7分别显示了ast和alt升高。不良事件通用术语标准(ctcae)用于评估ast和alt水平。出乎意料的是,与q1w给药方案相比,4天给药/10天停药的给药方案使得ast和alt的升高都得到了更好的控制。如图6和7所示,4天给药/10天停药的日程表可以允许alt/ast水平在下一次给药之前恢复到基线,而q1w剂量显示超过ast和alt水平的g2水平的峰值,即使在最低剂量为300mg。
[0317]
实例5:als小鼠模型中的pk/pd
[0318]
进行了几项研究,以了解小鼠中枢神经系统(cns)小胶质细胞清除的pk/pd关系。在第一项研究(rd-2019-00100)中,以169mg/kg blz945的剂量,每天一次(qd),连续1至5天,治疗小鼠。另外,两个剂量组连续5天接受169mg/kg blz945,然后3或7天停药(清除)。组织学分析表明,在第2天皮层中的小胶质细胞消耗了大约50%,到第5天则消耗了大约90%(图8a)。在清除组中,小胶质细胞在药物去除后3天显示出几乎完全的脑再增殖(约80%的媒介物),到第7天时又显示出完全再增殖。在指定的尸检日的最终剂量后3小时,对从各组采集的血液和脑样本进行药代动力学分析。在连续给药日中,血液和脑暴露保持恒定,这表明每日给药缺乏积累,并且脑暴露相对于血液暴露的比率约为50%。清除期后,暴露下降超过了1000倍(图8b)。
[0319]
图8:(a)尸检时通过iba1/aif-1免疫组织学染色评估皮层中的小胶质细胞消耗。分析切片的每个样品区域的小胶质细胞体的总数。值是组平均值
±
sd(n=3)。(b)在尸检当天的最后剂量后3小时,血液和脑中的blz945的暴露。值是组平均值(n=3)。
[0320]
在随访研究(rd-2019-00100)中,连续5天用blz945治疗小鼠,剂量范围为7至169mg/kg。两个最低剂量为7mg/kg和20mg/kg,对小胶质细胞消耗无效。但是,在三种更高剂量的blz945(60、100和169mg/kg)中观察到了剂量依赖性效应,它们分别显示出小胶质细胞减少25%、60%和100%(图9a)。药代动力学分析表明,随着剂量的增加,血液和脑暴露均呈线性增加。在此,在四个最低剂量下,脑与血液的暴露比率为约30%,在最高剂量下为约55%(图9b)。
[0321]
图9:小胶质细胞的剂量依赖性减少。(a)以指定剂量用blz945连续5天治疗小鼠。通过iba1/aif-1染色对样品进行组织学分析,并对每个样品区域的总小胶质细胞体进行定量。数据为组平均值
±
sd(n=3)。(b)在连续5天多剂量给药后,血液和脑中blz945的暴露。值是组平均值
±
sd(n=3)。
[0322]
在als的sod1g93a小鼠模型(最常用的啮齿动物als模型(rd-2019-00111))中检查给药。连续给药5天后,检查每日两次的给药(b.i.d.)。在用50mg/kg和80mg/kg blz945治疗后,小胶质细胞在皮质中消耗约25%和75%。以10mg/kg b.i.d给药的blz945是无效的(图10a)。类似地,在几种小胶质细胞标志物的脊髓qpcr分析表明,小胶质细胞分别以50mg/kg和80mg/kg blz945的剂量消耗了约55%和85%(图10b)。以10mg/kg给药的blz945对减少一些标志物具有小,但并不显著的作用。脑和脊髓分析显示,尸检时最终剂量后三小时,药物暴露为约血液的30%(图10 c/d)。
[0323]
图10:通过iba1/aif-1免疫组织学染色评估皮层中blz945介导的小胶质细胞消耗(a)或通过qpcr分析脊髓中blz945介导的小胶质细胞消耗(b)。值是组平均值
±
sd(n=3)。(c和d)在研究的最终剂量后3小时,血液和中枢神经系统(cns)脑和脊髓中blz945的暴露。
[0324]
实例6:blz945在als动物模型中的功效
[0325]
在als小鼠模型中(内部数据),blz945的在8周的时期内给药。测试了blz945在sod1g93a als小鼠(rd-2019-00092)中的预防或延迟疾病进展的功效。该模型动物表现出后肢无力和神经肌肉损伤,可从8至10周龄开始检测到。在此模型中,正常的体重增加也会受到损害。鉴于这些生理损伤能最好地概括临床疾病表型,因此被视为机械性读数(turner等人2013)。每天(q.d)以65mg/kg、170mg/kg,或以7天给药/7天停药的方案间歇地递送的170mg/kg的blz945向8至16周龄的动物给药。
[0326]
高剂量(170mg/kg)blz945的小胶质细胞消耗超过90%,低剂量(65mg/kg)的小胶质细胞消耗约50%。间歇给药组在给药周期的停药第7天(即无药物的7天)处死,与高剂量动物相比,其显示出小胶质细胞恢复率大于50%(图11)。在尸检当天的给药后3小时测量血液和中枢神经系统(cns)的blz945暴露(表8)。跨各剂量组的blz945脊髓暴露率(相对于血液)一致,约为0.4(表9)。
[0327]
表9跨各剂量组在血液和组织中的blz945暴露(给药后3小时)
[0328][0329]
图11:通过qpcr由iba1转录表达评估腰脊髓中小胶质细胞的消耗。在为期八周的研究的给药的最后一天,在尸检时收集样品。值是组平均值
±
sd(n=12-15)。数据表示为与sod1媒介物治疗组相比的倍数变化。通过kruskal-wallis检验与邓恩(dunn)多重比较进行统计分析
[0330]
在八周的研究期间,野生型转基因的非载体(ncar)对照动物表现出持续的体重增加(约18%),与正常衰老一致。但是,媒介物治疗的sod1g93a对照动物在研究中点时显示出最初的增速较慢,最终达到平稳状态,与疾病发作同时发生(研究结束时约有7%的增长)。相反,在整个研究过程中,连续以170mg/kg的blz945治疗的sod1g93a动物显示出恒定的体重增加,其增速与ncar小鼠相同(图12)。使用低剂量(即65mg/kg)和间歇剂量(170mg/kg,7天给药/7天停药)的blz945治疗的组在研究初期显示出与ncar小鼠相似的速率,但最终在给药的最后几周达到稳定水平,达到媒介物和高剂量组之间的中间水平(约12%)。
[0331]
图12:在为期八周的研究期内,blz945对体重变化的影响。数据表示为相对于第一给药日体重变化的百分比。值是组平均值(n=12-15)。通过混合线性效应模型对重复测量进行统计分析。*p《0.05;**p《0.01;****p《0.0001。
[0332]
后肢握力和复合肌肉动作电位(cmap),作为对神经肌肉完整性的评估,被测量为机械读数。在握力测量中,sod1g93a小鼠在第8周龄后连续失去肌力。连续或间歇地接受高剂量blz945(170mg/kg)的小鼠在整个研究期间均保持明显更大的抓地力。这是在媒介物治疗的sod1g93a和ncar对照的中间(图13a)。类似地,直至给药的第6周,与媒介物治疗的sod1g93a对照相比,低剂量blz945(65mg/kg)治疗的动物显示出明显更高的抓地力。进一步的评估显示,在研究的第二周后,通过cmap测量,用媒介物治疗的sod1g93a对照显示胫骨前(ta)肌神经支配急剧下降(图13b)。然而,在整个研究期间,连续或间歇给药(即170mg/kg)组的blz945治疗的sod1g93a动物的cmap显示下降显著减少。但是,从研究第4周开始,cmap仍低于ncar动物。在研究的第6周之前,以65mg/kg的blz945治疗的sod1g93a动物的cmap显示显著高于未治疗的对照。
[0333]
图13:(a)在八周的研究期内,blz945对握力的影响。值是组平均值
±
sd(n=12-15)。通过混合线性效应模型对重复测量进行统计分析。*p《0.05;**p《0.01;***p《0.001。(b)在八周的研究期内,blz945对ta肌肉cmap的影响。值是组平均值
±
sd(n=12-15)。通过混合线性效应模型对重复测量进行统计分析。*p《0.05;**p《0.01;***p《0.001。
[0334]
总之,与媒介物治疗的对照相比,blz945高剂量组显示出维持正常的体重增加,而低剂量和间歇剂量组显示出中等的作用。另外,在连续给药组中,blz945表现出与疾病相关的握力和肌肉神经支配性损伤的剂量依赖性延迟,而间歇组显示出与低剂量组相似的中度作用。尸检时,该功效与连续剂量组中脊髓的小胶质细胞的剂量依赖性消耗和间歇组中小
胶质细胞的部分再增殖有关(在停药期的第七天进行分析)。
[0335]
在一项为期13周的临床前研究(研究编号1779034)中,食蟹猴以30、60和200mg/kg/天blz945每天口服给药,或在7天给药/7天停药治疗周期以60和200mg/kg/天进行治疗。无论采用哪种方案,给药期均为91天,随后为无药期,总计14天。在给药前,给药期间的不同时间点和恢复时间期间收集血浆,并在给药和恢复期结束时,尸检时收集csf。测量在血浆和csf中的可溶性trem2(一种小胶质细胞活化的生物标志物)。
[0336]
在血浆中,在中连续和高连续给药(每日剂量)方案下,使用blz945的治疗以剂量和时间依赖性方式将trem2降低至给药前值的40%至45%。在停止给药后,血浆trem2在7天内恢复到基线。在循环给药(7天给药,7天停药,循环给药)方案中,中剂量和高剂量在治疗周结束时trem2血浆值均降低,且在停药治疗周结束时trem2血浆值处于对照值范围内。
[0337]
在csf中,观察到在连续给药(在高剂量下最多降低约25倍)和较小剂量的给药/停药(高剂量时最多降低约4.6倍)方案中,用blz945治疗3个月的猴子中的可溶性trem2剂量依赖性降低。csf trem2在治疗的猴子中的该显著降低表明blz945的靶标参与(包括在给药-停药方案中),并反映了其预期的药理作用。在恢复阶段结束时,可溶性trem2值在每天高的治疗组以及高给药/停药治疗组中恢复为未治疗的对照的trem2值。
[0338]
这些数据表明blz945的靶标参与,并且显示可溶性trem2可用于监测猴子在csf中央和血浆外围的blz945药理反应。
[0339]
实例7:预测的治疗剂量
[0340]
在c57b1/6和sod-1小鼠中建立了pk/pd(脑中血浆/小胶质细胞中的药物浓度)关系。als受试者的blz945 pk是基于研究cblz945x2101中的初步pk数据预测的(假设als受试者的blz945药代动力学与肿瘤学受试者的药代动力学相似)。然后将在小鼠中建立的pk/pd关系应用于als受试者中的pk,以预测als受试者(假设人和小鼠的pk/pd关系相似)中的pd(脑中的小胶质细胞)。pk/pd建模的结果表明,以每天一次的300mg blz945选择的起始剂量治疗4天,预计导致脑中小胶质细胞减少10%至12%。预计1200mg qd剂量导致脑中小胶质细胞减少40%至78%(表10)。
[0341]
表10每天一次口服施用150、300、600、800和1200mg后,第4天观察和预测的blz945 pk初步参数、安全性界限和预测的脑小胶质细胞减少
[0342][0343]
1)
来自研究cblz945x2101的初步pk参数
[0344]
2)
假设在150至300mg剂量范围内pk是剂量线性和时间依赖性的,从肿瘤学受试者的pk数据估计的第4天的pk参数
[0345]
实例8:给药/停药治疗als的临床研究
[0346]
cblz945c12201是一项多次递增剂量研究,四天治疗的起始剂量为每天300mg,并且四天治疗的最大剂量为1200mg。als患者将接受blz945的每日治疗,持续4天。以下为每日给药的三个单独的群组:分别使用300mg/天、600mg/天或1200mg/天。另外两个群组将用于研究300mg/天至1200mg/天之间的剂量。
[0347]
如上所述,在首次人类试验(cblz945x2101)中,单一药剂施用blz945通常会观察到出现恶心、呕吐。还观察到无症状的血清酶升高,包括ast、alt、ck和碱性磷酸酶升高。在针对csf-1r(fpa008和依米妥珠单抗(emactuzumab))、csf-1配体(mcs110)和csf-1r抑制剂plx3397(rugo等人2014,cassier等人2015,pognan等人2019,zhou等人2015)的单克隆抗体的临床试验中,也报告了无症状的血清酶升高。在als患者(cblz945c12201)的临床研究中,为期4天的给药方案,将用于减轻als患者诱发alt、ast和ck升高的风险。另外,给药方案的停药期间预期将留出时间来恢复小胶质细胞,该小胶质细胞通过施用blz945通过csf-1r抑制而被消耗。也可以评估另外的群组以评估7天给药。
[0348]
blz945作为用于治疗神经退行性疾病(例如als)的单一药剂的一种推荐剂量已确定为1200mg q.d.,给药4天。预期足以诱导持续的小胶质细胞抑制的间歇给药避免了由连续给药引起的副作用。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
