1.本发明属于生物质提取技术领域,具体涉及一种蝶豆花的提取方法。
背景技术:
2.花青素(anthocyanin)是普遍存在于深色植物中的一类水溶性天然色素。随着人们对合成色素危害性的认识越来越深入,在当前注重健康保健和食品安全的背景下,天然色素越来越受到重视。开发研制天然色素,代替人工合成色素作为着色剂,已经成为食品、药品、化妆品行业的发展趋势。
3.蝶豆(clitoria ternatea)是豆科蝶豆属多年生典型热带藤蔓植物,蝶豆花中含有丰富的花青素,其含量比一般植物高,且花期长(4~11月),产量高,易栽培,在热带和亚热带地区优势更明显,是花青素理想的天然原材料。另外,蝶豆蓝色花朵中的花青素主要是酰基化的飞燕草色素(ternatins),该类花青素比一般无酰化基团的花青素具有更好的耐热性和耐光性,化学性质更稳定。
4.目前,蝶豆花中花青素的提取均存在提取工艺复杂,提取效率低的问题:如中国专利cn110437197a公开了一种从蝶豆花中提取花青素的方法,包括脱脂、浸提、超滤、浓缩、醇沉、树脂吸附、梯度解吸、浓缩干燥等步骤,才能得到花青素产品;中国专利cn109400569a公开了一种蝶豆花中提取纯化花青素的方法,包括酶解、浓缩、吸附、梯度洗脱、浓缩、干燥等步骤。因此,亟需开发一种操作简单且提取效率高的蝶豆花的提取方法。
技术实现要素:
5.本发明的目的在于提供一种蝶豆花的提取方法,本发明的蝶豆花的提取方法,操作简单,提取效率高,得到的蝶豆花提取物中的花青素含量高。
6.为了实现上述发明目的,本发明提供以下技术方案:
7.本发明提供了一种蝶豆花的提取方法,包括以下步骤:
8.将蝶豆花去掉花蕊、花萼和花蒂,得到蝶豆花瓣;
9.将所述蝶豆花瓣干燥、粉碎,得到蝶豆花粉末;
10.将所述蝶豆花粉末与乙醇溶液依次进行超声提取和固液分离,得到提取液;所述乙醇溶液中乙醇的体积分数为35~80%;
11.将所述提取液去除溶剂,得到蝶豆花提取物,所述蝶豆花提取物中含有花青素。
12.优选的,所述超声提取的时间为20~50min。
13.优选的,所乙醇溶液中乙醇的体积分数为50~65%。
14.优选的,所述超声提取的料液比为1g:50~200ml。
15.优选的,所述超声提取的温度为40~70℃。
16.优选的,所述超声提取的功率为240~600w。
17.优选的,所述去除溶剂后还包括干燥。
18.优选的,所述去除溶剂的方法包括减压蒸馏。
19.优选的,所述蝶豆花粉末的粒径为0.180~0.425mm。
20.本发明提供了一种蝶豆花的提取方法,包括以下步骤:将蝶豆花去掉花蕊、花萼和花蒂,得到蝶豆花瓣;将所述蝶豆花瓣干燥、粉碎,得到蝶豆花粉末;将所述蝶豆花粉末与乙醇溶液依次进行超声提取和固液分离,得到提取液;所述乙醇溶液中乙醇的体积分数为35~80%;将所述提取液去除溶剂,得到蝶豆花提取物,所述蝶豆花提取物中含有花青素。
21.本发明与现有技术相比,具有如下有益效果:
22.本发明将蝶豆花的花瓣粉碎后用乙醇溶液超声提取,加大了样品与提取溶剂乙醇溶液的接触面积,同时本发明限定了采用蝶豆花的花瓣,去除了花蕊、花萼和花蒂,减少了脂肪和蛋白质等杂质的干扰,有利于提取到更多的花青素,且本发明的乙醇溶液更适合花青素的提取,本发明的蝶豆花提取方法,操作简单,提取效率高,得到的蝶豆花提取物中的花青素含量高。
23.本发明得到的蝶豆花提取物与水提物相比,花青素含量明显提高且组成不同,本发明采用单一ph法测定花青素含量,在ph值为1.0时,最大吸收波长是540nm,而水提物的最大吸收波长是620nm。
24.进一步地,本发明仅使用乙醇溶液进行提取,使用的试剂毒性小,对环境友好。本发明还限定了蝶豆花提取的最优超声提取时间、料液比、乙醇体积分数和超声提取温度,进一步提高提取效率,由实施例数据可知,本发明得到的蝶豆花提取物中的花青素可达到13.693mg/g。
25.本发明的蝶豆花提取物作为一个粗提混合物,已展现出较好的清除dpph自由基活性、清除abts
自由基活性和较强的还原能力。
附图说明
26.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
27.图1中a为蝶豆花的干粉,b为提取纯化后的蝶豆花青素;
28.图2中a为蝶豆花提取后不经过纯化直接烘干的样品,b为纯化过程中流失的杂质干燥后的样品,c为提取纯化后的蝶豆花青素;
29.图3中1为提取液直接烘干样品加水溶解,2为洗脱液干燥品加水溶解,3为提取纯化后的花青素样品加水溶解;
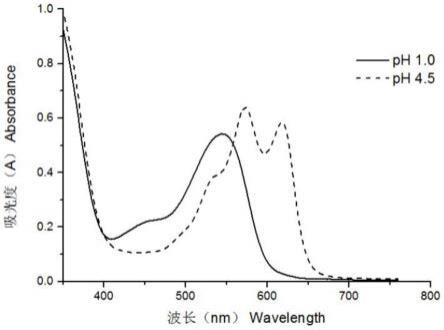
30.图4为蝶豆花中花青素在不同ph下的吸收光谱;
31.图5为蝶豆花提取物对dpph自由基清除作用结果;
32.图6为蝶豆花提取物对abts
自由基清除作用结果;
33.图7为蝶豆花提取物总还原力结果。
具体实施方式
34.本发明提供了一种蝶豆花的提取方法,包括以下步骤:
35.将蝶豆花去掉花蕊、花萼和花蒂,得到蝶豆花瓣;
36.将所述蝶豆花瓣干燥、粉碎,得到蝶豆花粉末;
37.将所述蝶豆花粉末与乙醇溶液依次进行超声提取和固液分离,得到提取液;所述乙醇溶液中乙醇的体积分数为35~80%;
38.将所述提取液去除溶剂,得到蝶豆花提取物,所述蝶豆花提取物中含有花青素。
39.在本发明中,若无特殊说明,使用的试剂、仪器设备均为本领域市售商品。
40.本发明将蝶豆花去掉花蕊、花萼和花蒂,得到蝶豆花瓣。
41.在本发明中,所述蝶豆花瓣优选为将蝶豆花去除花蕊、花萼和花蒂后得到的蝶豆花瓣,去除花蕊、花萼和花蒂后减少了脂肪和蛋白质等杂质的干扰,有利于后续的超声提取。
42.得到蝶豆花瓣后,本发明将所述蝶豆花瓣干燥、粉碎,得到蝶豆花粉末。
43.在本发明中,所述干燥的温度优选为40~60℃,更优选为50℃,所述干燥的时间优选为13~20h,更优选为16h。本发明对所述粉碎的方式没有特殊的要求,采用本领域技术人员常用的方式即可。
44.在本发明中,所述蝶豆花粉末的粒径优选为0.180~0.425mm,在本发明的具体实施例中,如过40目筛。
45.得到蝶豆花粉末后,本发明将所述蝶豆花粉末与乙醇溶液依次进行超声提取和固液分离,得到提取液。
46.在本发明中,所述超声提取的时间优选为20~50min,更优选为20~30min。
47.在本发明中,所述超声提取的料液比优选为1g:50~200ml,更优选为1g:150~200ml。
48.在本发明中,所乙醇溶液中乙醇的体积分数优选为50~65%,更优选为65%。
49.在本发明中,所述超声提取的温度优选为40~70℃,更优选为50℃。
50.在本发明中,所述超声提取的功率优选为240~600w,更优选为480w。
51.本发发明对所述固液分离的方式没有特殊的要求,如采用离心,所述离心的转速优选为6000r/min,时间优选为7min,所述离心后的上清液即为所述提取液。
52.得到提取液后,本发明将所述提取液去除溶剂,得到蝶豆花提取物。
53.在本发明中,所述去除溶剂的方法优选包括减压蒸馏,在本发明的具体实施例中,如旋转蒸发,本发明对所述旋转蒸发的具体条件没有特殊的要求,采用本领域技术人员常用的条件即可。
54.在本发明中,所述去除溶剂后优选还包括干燥,所述干燥优选为真空干燥,所述真空干燥的温度优选为50℃,真空度优选为0.1mpa。本发明对所述真空干燥的时间没有特殊的要求,使所述蝶豆花提取物干燥至恒重即可。
55.为了进一步说明本发明,下面结合附图和实施例对本发明提供的蝶豆花的提取方法进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
56.实施例1
57.1.超声提取单因素实验
58.将蝶豆鲜花的花蕊、花萼和花蒂摘除后,花瓣置于50℃干燥16h,粉碎过40目筛,得到蝶豆花粉末,密封避光存放。
59.称取蝶豆花粉末,加入乙醇溶液,摇匀后放入超声仪中提取,然后离心取上清液,
得到蝶豆花提取液,测定提取液中的花青素含量,具体提取条件如下:
60.1)料液比1:150g/ml,分别用不同乙醇体积分数(0%、20%、35%、50%、65%、80%、85%、90%、95%)的乙醇溶液为溶剂,超声功率600w,温度50℃,提取30min;
61.2)乙醇体积分数50%的乙醇溶液为溶剂,料液比分别为(1:25、1:50、1:75、1:100、1:125、1:150、1:175、1:200g/ml),超声功率600w,温度50℃,提取30min;
62.3)料液比1:150g/ml,乙醇体积分数50%的乙醇溶液为溶剂,超声功率600w,温度50℃,提取时间分别为(10、20、30、40、50min);
63.4)料液比1:150g/ml,乙醇体积分数50%的乙醇溶液为溶剂,超声功率分别为(0、240、360、480、600w),温度50℃,提取30min;
64.5)料液比1:150g/ml,乙醇体积分数50%的乙醇溶液为溶剂,超声功率600w,温度分别为(40、50、60、70、80℃),提取30min。
65.以提取液中花青素含量为考察指标,随着超声功率的增加,花青素提取量稍微增加,超声功率为0w与240w~600w时存在显著性差异(p《0.05),在480w达到最大值13.501
±
0.306mg/g后,随着超声功率的提高,提取量略微下降,而对功率进行单因素方差分析可得出各功率间差异皆不具显著性,说明超声功率为非主要因素,所以在后续实验选取480w为固定超声功率,确定正交试验的因素包括料液比、乙醇体积分数、超声温度和超声时间。
66.2.根据单因素结果,选择料液比(a)、乙醇体积分数(b)、超声温度(c)、超声时间(d)为蝶豆花青素提取量的影响因素,每个因素设置4个水平,设计l16(45)正交实验,对提取工艺进行优化设计,探讨最佳提取条件,具体因素及水平设置如表1所示,实验结果如表2所示。
67.表1正交实验因素水平表
[0068][0069]
表2正交实验结果
[0070]
[0071][0072]
表3方差分析结果
[0073][0074]
最佳提取条件的确定:
[0075]
正交实验结果见表2,从k值的计算结果中可知超声辅助提取蝶豆花青素的最佳工艺条件是a4b3c2d1,即料液比1:200,乙醇体积分数65%,超声时间20min,超声温度50℃。从极差r的大小可知,对蝶豆花青素提取量影响最大的是d(超声时间),而后依次是a(料液比)、b(乙醇体积分数)、c(超声温度),其中乙醇浓度和超声温度的r值小于空列e的r值,说明在正交实验设计所选的水平范围这两个因素相对来说是非主要因素。取这4个因素的正交数据做方差分析,结果如表3所示,正交试验所选取的料液比、乙醇体积分数、超声时间、超声温度水平对花青素提取量的影响没有显著性差异(p》0.05)。正交实验设计中提取量最高的是12号实验,即料液比1:150,乙醇体积分数80%,超声时间20min,超声温度50℃,与正
交实验优化出的差别在于料液比和乙醇体积分数的不同。
[0076]
按照正交实验优化出的超声提取条件进行验证,将得到的提取液浓缩到25~30ml后进行测定,3次重复实验得到花青素提取量分别为13.682、13.693和13.437mg/g,mean
±
sd为13.604
±
0.145mg/g,优于其他组合,说明分析结果可靠。
[0077]
将按正交实验优化出的超声提取条件得到的蝶豆花提取物进行纯化,纯化方法参照“张盼盼,贾成韬,王丽.大孔树脂纯化蓝莓果渣花青素的研究[j].安徽科技学院学报,2017,31(2):7.”,图1中的a为蝶豆花的干粉,图1中的b为提取纯化后的蝶豆花青素。图2中的a为蝶豆花提取后不经过纯化直接烘干的样品,因为杂质多,所以粘稠,不成粉末,图2中的b为纯化过程中流失的杂质干燥后的样品,图2中的c为提取纯化后的蝶豆花青素。图3中的1为提取液直接烘干样品加水溶解,2为洗脱液干燥品加水溶解,3为纯化后花青素样品加水溶解;图3的1、2、3分别对应图2中a、b、c样品加水溶解后的状态。
[0078]
花青素提取量的计算公式
[0079]
将蝶豆花粉末进行提取后,取蝶豆花提取液,加入ph值1.0的缓冲液将提取液稀释一定倍数,于40℃恒温中平衡40min后,在最大吸收波长处测定吸光度值,计算公式如式ⅰ所示:
[0080][0081]
式中:δa=a
λmax-a
700nm
;mw(矢车菊花素-3-葡萄糖苷的分子量)=449.2g/mol;df=稀释倍数;v=最终体积,ml;ε(矢车菊花素-3-葡萄糖苷的摩尔消光系数)=26900l/(mol
·
cm);l=光程,1cm;wt=产品质量(蝶豆花粉末),mg。
[0082]
测试例1
[0083]
蝶豆花青素的吸收特性研究
[0084]
取最佳工艺条件(即料液比1:200,乙醇体积分数65%,超声时间20min,超声温度50℃)的蝶豆花提取液,分别加入ph值1.0和ph值4.5的缓冲液,将提取液稀释20倍后,于40℃恒温中平衡40min,在200~760nm范围内进行波长扫描,蝶豆花花青素在不同ph值下的吸收光谱如图4所示。
[0085]
由图4可见,用ph值1.0的缓冲液稀释的提取物在540~550nm处出现了最大吸收,与其他研究中提到的植物提取物的吸收曲线相似;而当用ph值4.5的缓冲液稀释时,蝶豆花提取物为蓝色,与其他植物提取物的淡粉或淡黄色不同,在570和620nm分别出现了两个吸收峰,可见蝶豆花中花青素的存在方式与其他植物不同,单体花青素含量低,多为聚合花青素,说明聚合给蝶豆花青素带来了与其他花青素不一样的吸收特性,与聚合花青素在ph值4.5时仍能保持颜色的说法也相符,而这种特殊的存在形式说明蝶豆花青素含量的测定不适合采取用来测定总单体花青素含量的ph示差法,因为与ph示差法测定单体花青素含量基于单体或纯花青素在ph值4.5中吸光度低甚至没有的假设原理相悖。而单一ph法用来测定包含了聚合花青素和花青素降解产物的总花青素含量,能够更为合理的定量蝶豆花青素含量,提取物在ph值1.0下的吸光度与总花青素含量具有一定相关性,在一定程度上反映出提取效果,可应用于蝶豆花青素提取优化工艺中对因素水平的筛选。
[0086]
应用例1抗氧化活性测定
[0087]
将蝶豆花粉末,按实施例1的最优提取工艺进行提取,提取液离心(6000r/min)7分
钟后取上清液,回收乙醇,并于真空干燥中(50℃,真空度维持在0.1mpa)放至恒重,得到蝶豆花提取物浸膏,将蝶豆花提取物浸膏用去离子水稀释,配制系列浓度的蝶豆花提取物溶液(0.1、0.2、0.4、0.6、0.8mg/ml)。
[0088]
1.蝶豆花提取物清除dpph自由基活性
[0089]
将系列浓度的蝶豆花提取物溶液,分别与0.1mmol/l dpph乙醇溶液以体积比1:1的比例混匀,然后于室温避光放置30min,517nm波长处测定吸光度,记为a1;去离子水与dpph乙醇溶液以同样方法反应后,测定吸光度,记为a0;以无水乙醇与样品溶液以同样方法反应后,测定吸光度,记为a2。以抗坏血酸为阳性对照同法测定,计算清除率公式如式ⅱ所示:
[0090][0091]
蝶豆花提取物清除dpph自由基活性结果如图5所示,在0.1~0.8mg/ml的范围内,提取物对dpph自由基的清除率随着浓度的增加而升高。在0.1~0.4mg/ml,清除率由28.22%快速上升至85.85%,当浓度超过0.4mg/ml,清除率维持在85%以上,在0.8mg/ml时达到此范围的最大值,为87.83%。在相同实验方法下,抗坏血酸在0.002~0.01mg/ml范围内,清除率为24.32~91.75%。经graphpad prism软件计算,得到蝶豆花提取物和抗坏血酸的dpph自由基清除率ic
50
值分别为0.168mg/ml和0.004mg/ml。
[0092]
2.蝶豆花提取物清除abts
自由基活性
[0093]
将7mmol/l的abts
与2.45mmol/l的过硫酸钾溶液等体积混合均匀,避光放置12~16h,临用前用蒸馏水稀释至吸光度0.7
±
0.02范围,得abts
工作液。将系列浓度的的蝶豆花提取物溶液分别与abts
工作液以1:3的体积比例混匀,避光反应6min后于734nm波长处测定吸光度,记为a1;以去离子水代替样品,同法测定吸光度,记为a0;以去离子水代替abts
,同法测得各样品对照组的吸光度,记为a2。以抗坏血酸为阳性对照,清除率计算公式同dpph。
[0094]
蝶豆花提取物清除abts
结果如图6所示,蝶豆花提取物对abts
自由基清除率在0.1~0.8mg/ml的范围内呈现出较好的正相关性,清除率由32.48%上升至99%,在1mg/ml可达100%,经计算,蝶豆花提取物的abts
自由基清除率ic50值为0.151mg/ml,说明蝶豆花提取物因富含黄酮类花青素而具有良好的抗氧化活性。阳性对照抗坏血酸在0.006mg/ml时的abts
自由基清除率为44.69%,在0.014mg/ml达到99.71%,ic
50
值为0.007mg/ml。根据ic
50
值可知,本发明的蝶豆花提取物作为一个粗提混合物,已展现出较好的清除abts
自由基活性。
[0095]
3.蝶豆花提取物总还原力
[0096]
分别将500μl的ph=6.6的磷酸盐缓冲溶液(0.2mol/l)与200μl系列浓度的蝶豆花提取物溶液(0.6、0.8、1.0、1.2、1.4mg/ml),500μl质量浓度1%的铁氰化钾混匀后于50℃恒温中反应20min,反应后取出向其加入500μl的质量浓度10%的三氯乙酸,混匀反应10min,取出500μl反应液,加入500μl的h2o,100μl的质量浓度0.1%三氯化铁溶液,静置10min,于700nm波长处测定吸光度。以抗坏血酸为阳性对照测定各吸光度,用于表示还原能力的强度。
[0097]
抗氧化剂将铁氰化钾的fe
3
还原成fe
2
,被还原的fe
2
数量与700nm处的吸光度成
一定线性关系,用以表示还原力大小。蝶豆花提取物和抗坏血酸的总还原力测定结果如图7所示。蝶豆花提取物在0.6~1.4mg/ml范围内,吸光度由0.240上升至0.502,说明还原力上升较为平缓,而抗坏血酸在0.02~0.1mg/ml对应的吸光度为0.188~0.8,还原力上升较为快速。
[0098]
尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本发明实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
