1.本发明属于生物医学和肿瘤免疫技术领域,具体涉及一种基于细胞外囊泡负载的树突状细胞作为肿瘤疫苗及制备方法和应用。
背景技术:
2.肿瘤的免疫治疗是旨在于通过提高机体的免疫反应,控制肿瘤生长及转移的一种疗法,在近年来备受关注,并于2013年被science评为年度十大科技突破之首。肿瘤免疫治疗策略可分为非特异性治疗和特异性治疗,后者又包括肿瘤疫苗、过继性免疫细胞疗法及单抗治疗。其中肿瘤疫苗是一种经济而高效的治疗手段,利用给免疫系统直接提供肿瘤抗原或提供免疫细胞,激活抗肿瘤免疫反应,重塑肿瘤免疫微环境,最终达到抑制肿瘤发生发展的目的。
3.肿瘤疫苗在体内发挥功能的前提即高效完成抗原提呈过程,肿瘤抗原来源包括全肿瘤细胞裂解物、细胞外囊泡、纯化的蛋白质大分子等,其被抗原提呈细胞(antigen presentation cells,apc)吞噬后,抗原释放到胞质,发生交叉呈递,外源性抗原被主要组织相容复合体(mhc,major histocompatibility complex)ⅰ类分子呈递到细胞膜表面,同时apc成熟并表达共刺激因子(如cd80,cd86),mhcⅰ和cd8 t细胞表面的t细胞受体(t cell receptor,tcr)识别并将抗原提呈给t细胞,共刺激因子和t细胞表面的受体识别,进一步强化t细胞的活化,产生的细胞毒性t细胞(cytotoxic lymphocyte,ctl)特异性杀伤肿瘤细胞,抑制肿瘤的生长及转移。
4.在不断的研究发展中,肿瘤疫苗可以大致分为以下几类:
5.(1)多肽、蛋白质、核酸类的分子疫苗,主要由通过一定手段纯化得到的肿瘤特异性抗原(tumor specific antigen,tsa)或肿瘤相关抗原(tumor associated antigen,taa)多肽及蛋白,或编码tsa或taa的核酸物质作为疫苗直接对机体进行免疫,这类分子疫苗具有生产相对简单且安全的优势,但仍存在tsa或taa发现较为困难,肿瘤细胞普遍具有异质性的发展瓶颈;
6.(2)病毒载体疫苗或细菌疫苗,包含多种复杂成分,尽管发挥功能的机制并不明确,但在临床测试中仍表现出了显著的疗效;
7.(3)细胞疫苗,利用肿瘤细胞裂解物或基因修饰过的肿瘤细胞为主体的疫苗,包括利用肿瘤细胞分泌的细胞外囊泡作为疫苗,或利用肿瘤来源的抗原在体外将肿瘤抗原与自体dc或同源dc共孵育使其激活,再将激活后的dc细胞作为肿瘤疫苗回输到患者体内,从而引起后续的免疫反应,杀伤肿瘤细胞。
8.dc细胞作为最重要的抗原提呈细胞,且体外培养方法较为成熟,使dc疫苗在肿瘤疫苗中获得了大量的关注及研究,2010年provenge疫苗成为fda批准的第一个治疗性肿瘤疫苗,是由自体树突状细胞(dendritic cells,dcs)和融合蛋白在体外孵育后回输到患者体内的肿瘤疫苗,用于治疗前列腺癌,且有效延长了患者存活时间。同时针对其他恶行肿瘤
的dc疫苗也在临床试验中获得了良好的治疗效果。然而由于不同来源的肿瘤抗原孵育dc后,可能诱导不同程度的免疫效应,甚至可能引起免疫耐受,因此dc疫苗能够发挥稳定且强力的抗肿瘤效应,还需要筛选适宜来源的肿瘤抗原用以装载dc细胞。
9.目前dc细胞能够装载的肿瘤抗原可以大致分为三大类,分别为:(1)tsa或taa多肽及蛋白;(2)将编码tsa或taa的基因导入dc细胞;(3)利用肿瘤细胞裂解物或肿瘤来源的细胞外囊泡(extracellular vesicles,evs)刺激致敏dc细胞。由于tsa和taa的发现较为困难,使得第三类肿瘤抗原能够更加经济有效地产生高效的dc肿瘤疫苗。
10.研究表明肿瘤细胞裂解物的免疫原性较低,而携带亲代肿瘤细胞多种生物活性信息的evs具有更高的免疫活性,较易被dc细胞吞噬,能够有效使dc细胞的进行抗原提呈并促进自身成熟,激活ctl产生强有力的肿瘤杀伤效应。随着近年来对于肿瘤来源evs的相关研究逐年增加,对于其在肿瘤免疫领域中的关注也日益增多。然而产生evs的途径包括但不限于自然分泌、饥饿处理、紫外线照射、射线照射等,不同途径产生的evs携带的可溶性蛋白、核酸、膜蛋白及脂质等均存在一定差异。huafeng zhang利用300j/m2的紫外线照射后产生的细胞外囊泡(tumor cell-derived microparticles,t-mps)装载dc细胞后形成肿瘤疫苗,t-mps能够促进dc细胞的成熟及抗原的呈递,同时激活dc细胞分泌ⅰ型干扰素(interferon,ifn),引起t细胞的抗肿瘤免疫效应。chao wan等人发现利用20gy 6-mv x射线照射后产生的细胞外囊泡(命名为rt-mps)能够将肿瘤相关巨噬细胞(tumor associated macrophages,tam)从m2亚型极化为m1亚型,后者能够介导tams的抗肿瘤反应,同时rt-mps能够产生有效的免疫记忆效应。jingwei ma等人从机制层面验证了t-mps能够在被dc细胞吞噬后升高溶酶体ph,促使mhc
‑ⅰ
分子将抗原多肽呈递到细胞表面,并同时上调cd80和cd86共刺激因子的表达,证明了t-mps能够通过dc有效激活cd8 t细胞并产生抗肿瘤效应的完整通路。
11.硼中子俘获治疗(boron neutron capture therapy,bnct)是利用在肿瘤部位富集的含10b化合物对热中子较强的吸收能力,在细胞直径范围内产生的α粒子和li原子核,杀伤肿瘤细胞,然而针对治疗后的肿瘤复发或转移bnct仍缺乏强有力的手段。作为一种靶向放射疗法,bnct也能够引起体内的肿瘤免疫,我们课题组前期工作已经证明中子射线照射后的肿瘤细胞全裂解物能够在体内被dc有效摄取,通过致敏并招募t淋巴细胞从而杀伤肿瘤细胞,同时具有较好的免疫记忆效应。因此bnct后的细胞产生的evs可能相较于其他不同途径产生的evs在装载到dc细胞后能引起更强烈的免疫反应,从而制备经济高效的dc肿瘤疫苗。
12.肿瘤疫苗作为经济高效的能够预防或治疗肿瘤的方法之一在近年来备受关注,然而它们存在一些固有的问题,例如taa或tsa的发现困难,限制了多肽、蛋白、核酸类分子疫苗的发展,例如细胞外囊泡会介导肿瘤的发生发展,还有可能在原发灶外形成生态位,促进转移模型的建立。因此肿瘤免疫治疗迫切需要一种安全高效的肿瘤疫苗,增强免疫活性,提高肿瘤抑制效率。
技术实现要素:
13.本发明所要解决的技术问题就是提供一种基于细胞外囊泡负载的树突状细胞作为肿瘤疫苗及制备方法和应用,制备一种经济高效的dc肿瘤疫苗,能够在免疫后激活体内
的免疫系统,引起t细胞的抗肿瘤杀伤效应,同时揭示了优化后的肿瘤来源的细胞外囊泡能够引起更强烈免疫反应的机制,为肿瘤疫苗的设计与研发提供参考。
14.采用的技术方案如下:
15.一种基于细胞外囊泡负载的树突状细胞的肿瘤疫苗的制备方法,具体步骤如下:
16.步骤一、分别由紫外线照射、x射线照射、中子射线照射处理,获得经过处理的三种细胞外囊泡(mps),并分别命名为ump、xmp、bmp;
17.步骤二、将步骤一制备的三种细胞外囊泡分别与树突状细胞(bmdc)孵育24h后,收集三种细胞外囊泡负载后的树突状细胞。所述的孵育是体外孵育。
18.优选的,所述步骤一中,紫外线照射细胞外囊泡1h后,加入一定培养基,37℃、5%co2条件下继续培养72h,收集上清;4℃、离心10min,去除沉淀的细胞,收集上清;4℃、离心2min,去除沉淀的细胞碎片,收集上清;4℃、离心1h,收集沉淀,即为得到的ump;
19.处理得到xmp和bmp的方法同处理得到ump的方法,仅需改变照射条件,xmp是通过160kv、14gy剂量的x射线照射后获得,bmp则是通过bnct制备方法,以2.57
×
108cm-2
·
s-1
剂量的中子射线照射1h后获得。
20.优选的,所述bnct方法制备的bmp不仅包括细胞外囊泡本体,还包括bnct制备的外泌体、凋亡小体。
21.优选的,所述步骤二中,树突状细胞是骨髓来源的树突状细胞,三种外囊泡负载后的树突状细胞分别命名为ump@bmdc、xmp@bmdc、bmp@bmdc。
22.本发明根据上述制备方法提供了一种基于细胞外囊泡负载的树突状细胞的肿瘤疫苗。
23.优选的,所述疫苗实现免疫的方法是通过肌肉静脉注射,并在第一次注射后第7天和第21天再次注射,免疫三次。其中,效果最好的是bmp@bmdc的疫苗
24.优选的,所述疫苗接种的浓度,ump@bmdc、xmp@bmdc、bmp@bmdc均为1
×
106cells/ml。
25.本发明提供的一种基于细胞外囊泡负载的树突状细胞的肿瘤疫苗在抑制肿瘤生长或转移的应用。
26.优选的,所述肿瘤针对黑色素瘤,包括乳腺癌、直结肠癌、肺癌、肝癌、胃癌、食管癌、、膀胱癌、宫颈癌、卵巢癌、骨肉瘤、血管肉瘤、淋巴肉瘤、白血病,还包括原位肿瘤模型及肿瘤转移模型。
27.优选的,抑制肿瘤生长或转移的过程为:构建肿瘤疫苗平台,利用在体外负载mp的bmdc制成的自体dc疫苗能够在体内有效激活适应性免疫,通过dc细胞将肿瘤抗原有效呈递到细胞膜表面,与t细胞结合后引起cd8 t对肿瘤细胞的特异性杀伤,同时分泌的ⅰ型干扰素能够协同诱导产生强烈的抗肿瘤免疫效应,最终达到对肿瘤的生长或转移进行抑制的效果。
28.与现有技术相比,本发明的有益效果为:
29.经过紫外线照射、x射线照射、中子射线照射后得到的ump、xmp、bmp在体外孵育骨髓来源树突状细胞(bone marrow dendritic cells,bmdc)后显著促进了bmdc的成熟,共刺激因子cd80和cd86的表达显著升高;
30.与目前临床应用广泛的肿瘤疫苗相比,能够提供更多的肿瘤抗原表位,增加免疫
系统对肿瘤抗原的提呈能力,同时由于mps中含有的核酸成分,促进了免疫细胞产生ⅰ型干扰素,并引起后续的免疫反应,实现更强的肿瘤免疫治疗效果。
附图说明
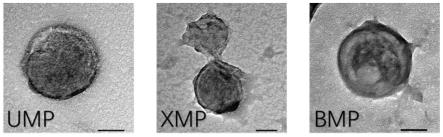
31.图1为本发明制备的ump、xmp、bmp的tem形貌图;
32.图2为ump、xmp、bmp的粒径分布及电势图;
33.图3为孵育ump、xmp、bmp后的bmdc的成熟情况(流式表征的cd80和cd86的表达)图;
34.图4为分别免疫ump、xmp、bmp、blank@bmdc、ump@bmdc、xmp@bmdc、bmp@bmdc后接种肿瘤后肿瘤体积生长情况对比图;
35.图5为分别免疫ump、xmp、bmp、blank@bmdc、ump@bmdc、xmp@bmdc、bmp@bmdc后接种肿瘤后小鼠的存活率曲线对比图;
36.图6为分别免疫ump、xmp、bmp、blank@bmdc、ump@bmdc、xmp@bmdc、bmp@bmdc后接种肿瘤后小鼠脾脏组织中的cd8 t细胞亚群分析对比图;
37.图7为分别免疫ump、xmp、bmp、blank@bmdc、ump@bmdc、xmp@bmdc、bmp@bmdc后接种肿瘤后小鼠肿瘤组织中的cd8 t细胞亚群分析对比图。
具体实施方式
38.下面结合附图、实施例对本发明实施例中的技术方案进行清楚、完整地描述,附图仅用于示例性说明;显然,所描述的实施例仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
39.实施例1
40.一种基于细胞外囊泡负载的树突状细胞的肿瘤疫苗的制备方法及其应用,具体步骤如下:
41.1)收集ump:ump为紫外线(uv)照射1h后加入一定培养基,37℃,5%co2条件下继续培养72h,收集上清,1000g,4℃,离心10min,去除沉淀的细胞,收集上清,14000g,4℃,离心2min,去除沉淀的细胞碎片,收集上清,14000g,4℃,离心1h,收集沉淀,即为得到的ump。
42.2)bca定量上述mp的蛋白含量:将收集到的mp离心后弃上清,用ripa强效裂解液充分吹打混匀,4℃下裂解过夜,使用bca定量试剂盒对mp的总蛋白量进行定量。
43.3)ump孵育后骨髓来源树突状细胞(bone marrow dendritic cells,bmdc)的成熟程度检测:首先分离得到小鼠骨髓细胞,在gm-csf和il-4共同刺激下诱导生成bmdc,将bmdc以1
×
106cells/ml的浓度接种到六孔板中,并将获得的mp以上述蛋白浓度孵育bmdc,24h后收集刺激后的bmdc,分别标记cd80和cd86共刺激因子,利用流式细胞术分析两种共刺激因子的表达情况,以此表征bmdc的成熟程度,命名为ump@bmdc。
44.4)原位肿瘤抑制模型:以1
×
106cells/ml的浓度归一化ump@bmdc,免疫小鼠,在第一次免疫后的第7天、第21天再次进行免疫,总计免疫三次,完成接种后的第7天皮下接种1
×
106cells/ml浓度的100μl肿瘤细胞悬液,即为原位肿瘤模型,持续监测肿瘤生长情况、小鼠体重及存活率信息,完成接种后的第7天尾静脉注射1
×
105cells/ml浓度的100μl肿瘤细胞悬液,即为肿瘤转移模型,持续监测小鼠体重及存活率信息。处死后将小鼠重要脏器、血
清、肿瘤样本留存做相关分析。
45.本技术中出现的英文缩写字母所指代内容:
46.mp为肿瘤细胞外囊泡,mps为其复数形式;bmdc为骨髓源树突状细胞;
47.ump为紫外照射处理得到的mp,xmp是x射线照射的mp,bmp为bnct制备的mp;
48.ump@bmdc为由ump处理bmdc后获得的孵化的树突状细胞;xmp@bmdc为由xmp处理bmdc后获得的孵化的树突状细胞;bmp@bmdc为由bmp处理bmdc后获得的孵化的树突状细胞;blank@bmdc为未经处理的bmdc;
49.bca(bicinchoninic acid)钠盐是一种稳定的水溶性复合物,是蛋白定量试剂的重要原料,bca常用于蛋白定量检测;
50.ripa是常用的一种裂解液的缩写;
51.pe和apc为常用的荧光染料。
52.实施例2
53.一种基于细胞外囊泡负载的树突状细胞的肿瘤疫苗的制备方法及其应用,具体步骤如下:
54.1)收集xmp:xmp是通过160kv、14gy剂量的x射线照射1h后加入一定培养基,37℃,5%co2条件下继续培养72h,收集上清,1000g,4℃,离心10min,去除沉淀的细胞,收集上清,14000g,4℃,离心2min,去除沉淀的细胞碎片,收集上清,14000g,4℃,离心1h,收集沉淀,即为得到的xmp。
55.2)bca定量上述mp的蛋白含量:将收集到的mp离心后弃上清,用ripa强效裂解液充分吹打混匀,4℃下裂解过夜,使用bca定量试剂盒对mp的总蛋白量进行定量。
56.3)xmp孵育后bmdc的成熟程度检测:首先分离得到小鼠骨髓细胞,在gm-csf和il-4共同刺激下诱导生成bmdc,将bmdc以1
×
106cells/ml的浓度接种到六孔板中,并将获得的mp以上述的蛋白浓度孵育bmdc,24h后收集刺激后的bmdc,分别标记cd80和cd86共刺激因子,利用流式细胞术分析两种共刺激因子的表达情况,以此表征bmdc的成熟程度,命名为xmp@bmdc。
57.4)原位肿瘤抑制模型:以1
×
106cells/ml的浓度归一化xmp@bmdc,免疫小鼠,在第一次免疫后的第7天、第21天再次进行免疫,总计免疫三次,完成接种后的第7天皮下接种1
×
106cells/ml浓度的100μl肿瘤细胞悬液,即为原位肿瘤模型,持续监测肿瘤生长情况、小鼠体重及存活率信息,完成接种后的第7天尾静脉注射1
×
105cells/ml浓度的100μl肿瘤细胞悬液,即为肿瘤转移模型,持续监测小鼠体重及存活率信息。处死后将小鼠重要脏器、血清、肿瘤样本留存做相关分析。
58.实施例3
59.一种基于细胞外囊泡负载的树突状细胞的肿瘤疫苗的制备方法及其应用,具体步骤如下:
60.1)收集bmp:bmp是以2.57
×
108cm-2
·
s-1
剂量的中子射线照射1h后加入一定培养基,37℃,5%co2条件下继续培养72h,收集上清,1000g,4℃,离心10min,去除沉淀的细胞,收集上清,14000g,4℃,离心2min,去除沉淀的细胞碎片,收集上清,14000g,4℃,离心1h,收集沉淀,即为得到的xmp。
61.2)bca定量上述mp的蛋白含量:将收集到的mp离心后弃上清,用ripa强效裂解液充
分吹打混匀,4℃下裂解过夜,使用bca定量试剂盒对mp的总蛋白量进行定量。
62.3)bmp孵育后bmdc的成熟程度检测:首先分离得到小鼠骨髓细胞,在gm-csf和il-4共同刺激下诱导生成bmdc,将bmdc以1
×
106cells/ml的浓度接种到六孔板中,并将获得的mp以上述的蛋白浓度孵育bmdc,24h后收集刺激后的bmdc,分别标记cd80和cd86共刺激因子,利用流式细胞术分析两种共刺激因子的表达情况,以此表征bmdc的成熟程度,命名为bmp@bmdc。
63.4)原位肿瘤抑制模型:以1
×
106cells/ml的浓度归一化bmp@bmdc,免疫小鼠,在第一次免疫后的第7天、第21天再次进行免疫,总计免疫三次,完成接种后的第7天皮下接种1
×
106cells/ml浓度的100μl肿瘤细胞悬液,即为原位肿瘤模型,持续监测肿瘤生长情况、小鼠体重及存活率信息,完成接种后的第7天尾静脉注射1
×
105cells/ml浓度的100μl肿瘤细胞悬液,即为肿瘤转移模型,持续监测小鼠体重及存活率信息。处死后将小鼠重要脏器、血清、肿瘤样本留存做相关分析。
64.如图1所示,分别为实施例制备的ump、xmp、bmp的tem形貌图,如图2所示为经测量的ump、xmp、bmp的粒径分布及电势对比图,
65.如图3所示,经过紫外线照射、x射线照射、中子射线照射后得到的ump、xmp、bmp在体外孵育bmdc后显著促进了bmdc的成熟,首先用三种mp孵育bmdc 24h,再利用流式抗体分别标记共刺激因子cd80和cd86,通过流式分析其表达水平,结果显示cd80和cd86的表达显著升高,其中ctrl为无刺激的空白对照组,图中cd80组中左图为流式细胞的数据,右图是其平均荧光强度的统计,图中cd86组中左图为流式细胞的数据,右图是其平均荧光强度的统计。两组中荧光强度最强的均是bmp孵育的bmdc。
66.如图4-图7所示,将小鼠分成8组,标号为1、2、3、4、5、6、7、8,同等条件和环境下,1组为ctrl空白对照组,注射pbs(磷酸缓冲盐溶液),其余2-8组分别注射ump、xmp、bmp、blank@bmdc(没有经过孵育的骨髓来源树突状细胞)、ump@bmdc、xmp@bmdc、bmp@bmdc,三次肌肉注射免疫小鼠后皮下接种肿瘤,通过监测肿瘤体积生长情况、小鼠体积及存活率评估三种dc肿瘤疫苗的治疗效果。由图4可看出,注射bmp@bmdc的第8小组的小鼠肿瘤生长最慢;由图5可以看出,注射bmp@bmdc后接种肿瘤后小鼠的存活率最长。
67.通过测量皮下肿瘤的长径和短径,代入公式肿瘤体积=长径
×
短径2
÷
2,将肿瘤体积和时间作图得到图5,结果表明bmp@bmdc即第8组的小鼠在一定时间内肿瘤最小;通过监测小鼠的存活率,对时间进行作图得到图5,结果表明bmp@bmdc即第8组小鼠的存活率相较于其他组有明显的延长。
68.将各组小鼠的脾脏或肿瘤组织取出并消化得到单细胞溶液,用cd3和cd8流式抗体分别标记脾细胞和肿瘤细胞,经过流式分析t细胞的不同分群,分别得到图6和图7,图6和图7上半部分的a图中的每张小图表示一个样本,各小图依次标记1、2、3、4、5、6、7、8,各小图的横坐标从左向右的数值为0、101、103、105、107,各纵坐标从下到上的数值为0、101、103、105、107。cd3阳性即表示为t细胞群体。图6和图7上半部分的a图纵轴表示cd8荧光在细胞中的分布,整个横轴表示表示cd3荧光在细胞中的分布,每张小图的右上角区域即表示cd8 t细胞的比例,将处理得到cd8 t细胞的比例数值标注在右上角,图6和图7下半部分的b图表示cd8细胞与cd3细胞的比率,结果表明bmp@bmdc即第8组的cd8 t相较于其他组都具有显著提升,显示出bmp@bmdc免疫小鼠后能够使小鼠产生高效的抗肿瘤免疫效应。
69.图4-图7证明三种疫苗制剂均有一定的治疗效果,其中bmp@bmdc疫苗的疗效相对更好。相同免疫条件下,肿瘤转移模型同样证明了三种疫苗的疗效,及bmp@bmdc疫苗更佳的治疗效果。另外,将免疫后的小鼠脾细胞提取后尾静脉注射到未处理过的小鼠体内从而建立过继模型,再在皮下接种肿瘤,同样监测肿瘤体积生长情况、小鼠体积及存活率,结果显示免疫后的小鼠脾脏细胞能够将免疫效应过继给未处理的小鼠,使后者产生特异性的抗肿瘤免疫。
70.由此,我们构建了一种肿瘤疫苗平台,利用在体外负载mp的bmdc制成的自体dc疫苗能够在体内有效激活适应性免疫,通过dc细胞将肿瘤抗原有效呈递到细胞膜表面,与t细胞结合后引起cd8 t对肿瘤细胞的特异性杀伤,同时分泌的ⅰ型干扰素能够协同诱导产生强烈的抗肿瘤免疫效应,最终达到对肿瘤的生长或转移进行抑制的效果。
71.本发明提供的一种基于细胞外囊泡负载的树突状细胞的肿瘤疫苗在抑制肿瘤生长及转移中均可应用。所述肿瘤主要针对黑色素瘤,但包括乳腺癌、直结肠癌、肺癌、肝癌、胃癌、食管癌、、膀胱癌、宫颈癌、卵巢癌、骨肉瘤、血管肉瘤、淋巴肉瘤、白血病,且包括原位肿瘤模型及肿瘤转移模型。
72.本发明中用到的化学试剂等物品如果没有明确说明,皆采用现有技术中常规的试剂,所用到的仪器也是采用正常标准使用的仪器,其他具体应用在此不再详细描述,其他未述及的方法采用现有技术。
73.本领域的普通技术人员将会意识到,这里所示的实验例是为了帮助读者理解本发明的原理,应理解为本发明的保护范围并不局限于这样的特别陈述和实施例。本领域的普通技术人员可以根据本发明公开的这些技术启示做出各种不脱离本发明实质的其他各方面变形,这些变形仍然在本发明的保护范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。