一株能降解亚硝酸盐的耐高盐酱曲源融合魏斯氏菌jq3及其应用
技术领域
1.本发明涉及一株能降解亚硝酸盐的耐高盐酱曲源融合魏斯氏菌jq3及其应用,属于微生物领域。
背景技术:
2.亚硝酸盐会导致组织缺氧,与胺类化合物形成对人体有很强的致癌、致畸作用的n-亚硝胺化合物。亚硝酸盐广泛地存在于发酵蔬菜等发酵食品中,日常生活中超过80%的硝酸盐与亚硝酸盐摄入与蔬菜及其发酵制品有关。在食品工业中,亚硝酸盐虽然可作为添加剂应用于食品加工中,但其使用量必须严格控制。gb 2762-2017中规定亚硝酸盐在蔬菜及其制品(腌渍蔬菜)中不可超过20 mg
·
kg-1
。因此,如何控制发酵食品中亚硝酸盐的积累是保证产品安全和绿色生产的关键。
3.乳酸菌可以通过产生乳酸和亚硝酸盐还原酶以降解亚硝酸盐,是目前被认为比物理和化学降解更安全和快速的方法。此外,乳酸菌是蔬菜发酵过程中的优势种群,产生的乳酸等有机酸不但可以调节酸度,丰富口感,还可以抑制部分有害菌的生长。但发酵蔬菜在腌制时通常会提高盐浓度,使其达到8%甚至更高,以便延长蔬菜的保质期。高盐环境会限制乳酸菌的存活和发挥作用。因此,乳酸菌在高盐环境中的生长对其降亚硝酸能力的发挥具有重要影响。但目前专利中同时具有耐盐和降亚硝酸盐的乳酸菌报道较少,且降亚硝酸盐的乳酸菌多为乳杆菌属。
4.融合魏斯氏菌(weissella confusa)是乳酸菌中魏斯氏菌属的重要菌种,是泡菜等发酵食品中的优势菌群。融合魏斯氏菌为耐盐菌,可在0~20%盐浓度下生长,是潜在的降亚硝酸盐且耐盐的食品发酵剂。但至今为止,尚无融合魏斯氏菌降解亚硝酸盐的报道。
技术实现要素:
5.本发明的目的在于提供一株耐高盐并能降解亚硝酸盐的酱曲源融合魏斯氏菌weissella confusa jq3及其应用:所述融合魏斯氏菌weissella confusa jq3,于2021年1月15日保藏于中国普通微生物菌种保藏管理中心,保藏编号为cgmcc no. 21637。
6.本发明的融合魏斯氏菌jq3菌落呈乳白色、圆形,表面光滑、边缘整齐,中间凸起;过氧化氢酶阴性,明胶液化阴性,革兰氏染色呈阳性,菌体为短棒状,成对或短链状排列;可利用0.5%半乳糖、0.5%d-海藻糖、0.5%d-核糖、木糖,不能利用七叶苷、水杨苷、棉子糖、蜜二糖、纤维二糖、阿拉伯糖。
7.本发明还提供了含有所述融合魏斯氏菌jq3的微生物制剂。
8.在一种实施方式中,所述微生物制剂含有≥1
×
107cfu/ml或1
×
107cfu/g的融合魏斯氏菌jq3。
9.本发明还提供所述融合魏斯氏菌jq3在降解亚硝酸盐方面的应用。
10.在一种实施方式中,所述应用包括但不限于将所述融合魏斯氏菌jq3或所述微生
物制剂加入至含亚硝酸盐或易产生亚硝酸盐的环境中。
11.在一种实施方式中,所述应用是将所述融合魏斯氏菌jq3添加至高盐环境的食品或食品原料中,降解亚硝酸盐。
12.在一种实施方式中,所述应用包括但不限于将所述融合魏斯氏菌jq3或所述微生物制剂加入至待发酵的或正在发酵的泡菜中。
13.在一种实施方式中,所述应用具体是:将含所述融合魏斯氏菌jq3的腌制液与芥菜混合,在25~30℃发酵至少4天。
14.在一种实施方式中,所述腌制盐的制备方法为:将食盐溶解于水,得nacl溶液,再将所述nacl溶液与融合魏斯氏菌jq3菌悬液混合,制得腌制液。
15.本发明还提供了融合魏斯氏菌jq3在生产低亚硝酸盐食品方面的应用。
16.在一种实施方式中,所述食品包括但不限于酸肉、酸鱼。
17.有益效果:本发明提供的融合魏斯氏菌是酱曲发酵过程的优势菌属,对发酵过程中高盐和低ph环境具有很好的耐受性,具有很好的降亚硝酸盐的特性。也可为许多发酵食品如泡菜、酸肉、酸鱼等的发酵剂开发提供菌种资源,对酱曲中功能微生物的分离和应用具有现实意义。
18.生物材料保藏一株融合魏斯氏菌(weissella confusa)jq3,分类命名为weissella confusa,已于2021年1月15日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏编号为cgmcc no.21637,保藏地点为北京市朝阳区北辰西路1号院3号。
附图说明
19.图1为本发明融合魏斯氏菌jq3的菌落形态图。
20.图2为本发明融合魏斯氏菌jq3的革兰氏染色图。
21.图3为本发明融合魏斯氏菌jq3的系统发育树。
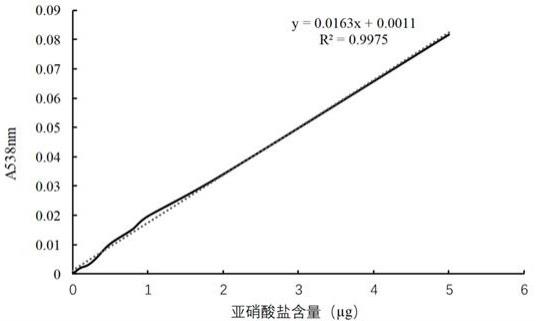
22.图4为亚硝酸盐含量的标准曲线。
23.图5为本发明融合魏斯氏菌jq3的培养时间对亚硝酸盐降解率的影响。
24.图6为本发明融合魏斯氏菌jq3的溶血实验结果图。
具体实施方式
25.下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。以下实施例是对本发明的进一步说明,而不是对本发明的限制。
26.实施例1 菌株的分离和鉴定称取10 g酱曲样品,加入90 ml无菌生理盐水,移至37℃、150 r/min的摇床内恒温摇动30 min,充分混匀后,进行梯度稀释至10-5
样液。取100 μl于含有纳他霉素0.4 g/l和万古霉素0.2 g/l的mrs筛选培养基中进行涂布,37℃生化培养箱恒温培养24~48 h。待培养基上有明显菌落长出后,无菌条件下用接种环挑取单菌落在mrs固体培养基上进行“三区划线”纯化3次,直至培养基上的菌落形态一致。
27.生理生化鉴定参考《乳酸细菌分类鉴定及实验方法》并进行适当修改。结果如下:菌落、菌体形态和生理生化特征:融合魏斯氏菌jq3菌落呈乳白色、圆形,表面光
滑、边缘整齐,中间凸起;菌体呈短棒状,成对或短链状排列。
28.过氧化氢酶阴性,明胶液化阴性,革兰氏染色呈阳性;可利用0.5%半乳糖、0.5%d-海藻糖、0.5%d-核糖、木糖,不能利用七叶苷、水杨苷、棉子糖、蜜二糖、纤维二糖、阿拉伯糖。
29.分子生物学鉴定:提取融合魏斯氏菌jq3的dna并作为模板,利用细菌16s rrna通用引物(27f、1492r)进行pcr扩增,将扩增产物进行测序,将测得的16s rrna经过bzbiocloud序列同源性比对,菌株jq3与weissella confusa的同源性超过99%,经系统发育树构建,判定该菌为融合魏斯氏菌。
30.实施例2 菌株耐盐能力探究将魏斯氏菌活化三代,调节od
600 nm
=0.6
±
0.05,以2%接种量将菌株接种到含盐量为0%、3%、6%、9%、12%、15%、18%、21%、24%、27%、30%、33%、35%的mrs液体培养基中,37℃培养24 h,测定od
600 nm
处的吸光度值,取发酵后的菌液涂布mrs固体培养基观察活菌数及菌株生长情况,以此确定菌株耐盐特性。
31.通过公式计算菌株不同盐浓度下的生长速率:生长速率(%)=(不同nacl浓度下培养液的od
600 nm-空白od
600 nm
)/(不含nacl培养液的od
600 nm-空白od
600 nm
)
×
100。
32.表1 融合魏斯氏菌jq3耐盐实验结果盐浓度/%生长速率/63.04
±
4.25629.94
±
0.08911.10
±
0.491210.38
±
0.241510.44
±
0.481810.16
±
0.212111.59
±
0.252411.00
±
0.74融合魏斯氏菌jq3在3%盐浓度下的生长效率为63.04
±
4.25%,在6%盐浓度下的生长效率为29.94
±
0.08%,在9%盐浓度下的生长效率为11.10
±
0.49%,当盐浓度超过12%时融合魏斯氏菌jq3的生长速率差别不大,当盐浓度接近盐溶解度极限值35%时融合魏斯氏菌jq3仍能存活。
33.实施例3 菌株低ph环境耐受实验将融合魏斯氏菌jq3接种于mrs液体培养基过夜培养后,在无菌条件下将菌液接种到ph 3.5、ph 3、ph 2.5的mrs液体培养基中,37℃静置培养,分别在0 h、3 h、8 h、24 h后取样梯度稀释后涂布于mrs固体平板,37℃培养24 h,计算存活率,重复三次。
34.存活率(%)=lgnn/lgnm×
100。式中nm为0 h的活菌数/(cfu/ml),nn为过不同时间取样的发酵液活菌数/(cfu/ml)融合魏斯氏菌jq3在0 h的活菌数为2.41
×
109cfu/ml,在ph 3.5的mrs液体培养基中培养3 h后活菌数为1.74
×
10
8 cfu/ml,存活率为87.83%,8 h后活菌数为1.29
×
10
7 cfu/ml,存活率为75.79%,24 h后活菌数为1.22
×
10
6 cfu/ml,存活率为64.87%。在ph 3的mrs液体培养基中可以存活3 h以上,3 h活菌数为1.73
×
10
7 cfu/ml,存活率为77.15%。在ph 2.5
的mrs液体培养基中可以存活3 h以上,3 h活菌数为6.6
×
10
5 cfu/ml,存活率为62.03%。
35.实施例4 菌株的降解亚硝酸盐能力测定将融合魏斯氏菌jq3接种于高压蒸汽灭菌后含60.17 mg/l nano2亚硝酸钠的mrs液体培养基中培养,37℃的条件下分别培养24 h、48 h、72 h之后,按照 gb 5009.33-2016《食品中亚硝酸盐与硝酸盐的测定》中的操作方法进行测定。
36.(1)亚硝酸盐标准曲线的测定:准确吸取0.00 ml、0.02 ml、0.04 ml、0.06 ml、0.10 ml、0.16 ml、0.20 ml、0.40 ml、1.50 ml、1.00 ml的亚硝酸钠标准使用液(相当于0.0 μg、0.1 μg、0.2 μg、0.3 μg、0.5 μg、0.8 μg、1.0 μg、2.0 μg、5.0 μg亚硝酸钠),分别置于50 ml带塞比色管中,于标准管和样品管中分别加入2 ml 4 g/l对氨基苯磺酸溶液,混匀,静置5 min后各加入1 ml 2 g/l盐酸萘乙二胺溶液,加水至刻度,混匀,静置30 min,用2 cm比色杯,以零管调节零点,于波长538 nm处测吸光度,绘制标准曲线,标准曲线见图4。
37.(2)试样处理:准确吸取5.0 ml发酵液,置于250 ml三角瓶中,加入12.5 ml 50 g/l饱和硼砂液,搅拌均匀,再加入约40 ml蒸馏水,将三角瓶置于沸水浴中加热15 min,取出后冷却至室温,后加入5 ml 106 g/l亚铁氰化钾溶液,混匀,再加入5 ml 220 g/l乙酸锌溶液混匀,静置约30 min,以沉淀蛋白质。将上述液体转入100 ml容量瓶中,加水至刻度,混匀。用循环水式真空泵抽滤处理液,弃去初滤液30 ml收集剩余滤液备用。
38.(3)样品测定:吸取2.00 ml上述处理液于50 ml容量瓶中,加入约40 ml水,混匀,加入2 ml 4 g/l对氨基苯磺酸溶液,混匀,避光静置5 min,再加入1 ml 2 g/l盐酸萘乙二胺溶液,混匀,并加水至刻度,避光静置15 min,用2 cm比色杯于538 nm处测吸光值,同时以等量的蒸馏水代替样品液,按同样的处理方法,做空白对照。
39.亚硝酸盐降解率的计算公式为:亚硝酸盐降解率=(初始亚硝酸盐浓度-培养n小时后培养液中亚硝酸盐浓度)
÷
初始亚硝酸盐浓度。
40.结果如图5,24 h时亚硝酸盐降解率为80.77%,48 h降解率为83.57%,72 h的降解率为90.10%。
41.实施例5 安全性实验(1)吲哚实验将融合魏斯氏菌jq3接种于蛋白胨水培养基中,37℃恒温培养24 h,向培养基中滴加2~3滴靛基质试剂并轻摇试管观察颜色变化。
42.融合魏斯氏菌jq3的吲哚实验结果为阴性,不会产生色氨酸酶,不会引起吲哚类物质的产生。
43.(2)溶血实验将融合魏斯氏菌jq3划线于哥伦比亚血琼脂平板中,37℃培养24 h,观察有无溶血圈和颜色。
44.融合魏斯氏菌jq3的溶血实验结果为α溶血。
45.(3)氨基酸脱羧酶验证实验产酪胺、组胺检测采用平板显色法。分别将组氨酸、酪氨酸加入培养基中,终浓度为2%,最终ph调节至5.5,将培养基灭菌后倒入平板内,凝固后将活化好的融合魏斯氏菌jq3划线于含有氨基酸的培养基平板,于37℃培养3 d后观察颜色变化。产腐胺、尸胺检测采用生化鉴定管的方法。将活化好的融合魏斯氏菌jq3菌悬液接种在鸟氨酸脱羧酶和赖氨酸脱
羧酶试验管中,同时接种于氨基酸脱羧酶对照管中,用5~8滴液体石蜡覆盖生化管液体表面,于37℃培养24 h,观察管内颜色。
46.融合魏斯氏菌jq3均不会产生氨基酸脱羧酶,不会生成尸胺、腐胺、组胺、酪胺等生物胺类物质。
47.(4)毒力基因检测利用参考文献《screening probiotic strains for safety: evaluation of virulence and antimicrobial susceptibility of enterococci from healthy chinese infants》中公开的引物扩增cyla、asa1、ace、esp、gele、hyl等基因对融合魏斯氏菌jq3的毒力基因进行检测。
48.扩增条件:预变性,95℃,4 min;32个循环(变性:94℃,30 s;退火:56℃,1min;延伸:72℃ 1 min);再延伸,72℃ 7 min。
49.反应体系:总反应体系为10 μl。2 μl template,上下游引物各0.2 μl,5 μl 2
×
easytap
@
pcr supermix,2.6 μl nuclease-free water。
50.融合魏斯氏菌jq3均不产生esp、ace、gele、hyl、cyla等毒力因子。
51.(5)药敏试验将活化两代的菌液用无菌生理盐水稀释至0.5麦氏浊度,涂布于mrs平板,静置5 min后将相应的药敏纸片贴在培养基表面,每个平板贴3个,每种药片设3组平行,于37℃培养24 h。用游标卡尺测量各药敏纸片抑菌圈直径大小,根据《抗微生物药物敏感性试验执行标准》评价菌株对抗生素的敏感度。
52.表2 融合魏斯氏菌jq3药敏试验结果药片名称抑菌圈直径(mm)氨苄西林25.43
±
0.75(s)头孢噻肟29.19
±
0.83(s)卡那霉素10.95
±
0.90(r)红霉素24.70
±
0.69(s)四环素24.44
±
0.40(s)氯霉素25.12
±
1.25(s)克林霉素29.41
±
0.56(s)万古霉素6.35
±
0.00(r)诺氟沙星15.82
±
0.91(i)注:s为敏感,i为中介敏感,r为耐药。
53.融合魏斯氏菌jq3对氨苄西林、头孢噻肟、红霉素、四环素、克林霉素敏感,对卡那霉素、万古霉素耐药,对诺氟沙星中介敏感。
54.实施例6 菌株在泡菜制作中的应用(1)发酵菌种菌悬液的制备:融合魏斯氏菌jq3菌液的制备:将融合魏斯氏菌jq3活化三代,调节od
600 nm
=0.6
±
0.05,以2%接种量将菌株接种到mrs肉汤培养基中,37℃静置培养16-18 h,得菌液a;将所述菌液a置于10000 r/min离心10 min后收集菌体,将菌体用质量分数为0.85%氯化钠水溶液稀释,制备成菌浓数量级为1
×
10
9 cfu/ml的菌悬液。
55.(2)原料预处理:挑选新鲜的芥菜,去除老叶,洗净,整形,晾干水分,热烫10 s放凉
备用。
56.(3)泡菜的制作:将容器清洗干净,沸水灭菌20 min,得灭菌容器。配制浓度为80g/l的食盐水;将所述nacl溶液与步骤(1)制备的融合魏斯氏菌jq3菌悬液混合,制得腌制液,使所述腌制液中的融合魏斯氏菌jq3终浓度为1
×
10
7 cfu/ml;将1500 ml所述腌制液、800 g步骤(2)所述芥菜置于灭菌容器中,30℃腌制4天,得发酵芥菜。
57.分别以自然发酵和商业菌株融合魏斯氏菌cicc24453为对照,自然发酵组按照步骤(2)~(3)的方法处理,区别在于,不接种融合魏斯氏菌jq3菌悬液;商业融合魏斯氏菌组将融合魏斯氏菌cicc24453按照步骤(1)的方法制备菌悬液,按照步骤(2)~(3)的方法将制备的菌悬液用于制备发酵芥菜。测定亚硝酸盐的含量。腌制芥菜发酵4 d后亚硝酸盐含量如表3,腌制芥菜的质构分析结果见表4。
58.表3 腌制芥菜亚硝酸盐含量发酵方式亚硝酸盐含量(mg/kg)自然发酵14.05接种商业融合魏斯氏菌cicc244536.69接种融合魏斯氏菌jq33.62融合魏斯氏菌jq3制备的发酵芥菜亚硝酸盐的含量3.62 mg/kg,低于自然发酵组亚硝酸盐含量(14.05 mg/kg),低于商业融合魏斯氏菌cicc 24453发酵组亚硝酸盐含量(6.69 mg/kg),远远低于国家标准20 mg/kg。相对于自然发酵,融合魏斯氏菌jq3的亚硝酸盐降解率为74.2%,商业融合魏斯氏菌cicc24453的亚硝酸盐降解率为52.4%,表明接种融合魏斯氏菌jq3的腌制芥菜可以大大降低腌制芥菜中的亚硝酸盐含量,且降解效果好于商业融合魏斯氏菌cicc24453。
59.表4 腌制芥菜质构分析发酵方式脆度弹性咀嚼性自然发酵112.030.6644.06接种商业融合魏斯氏菌cicc2445359.730.5920.79接种融合魏斯氏菌jq3173.540.6354.94由表4可知,在相同条件下接种融合魏斯氏菌jq3腌制芥菜质地(脆度、弹性性、咀嚼性)与自然条件发酵腌制芥菜弹性接近,其脆度与咀嚼性更好;接种商业融合魏斯氏菌cicc24453腌制芥菜的脆度、弹性、咀嚼性明显低于自然发酵;表明接种融合魏斯氏菌jq3的腌制芥菜不会明显改变原有腌制芥菜的质地。
60.综合降解亚硝酸盐数据分析,在8%盐浓度的发酵蔬菜中,与相同种属的商业融合魏斯氏菌cicc24453比较,接种融合魏斯氏菌jq3的腌制芥菜中亚硝酸盐含量明显降低,且接种融合魏斯氏菌jq3并未明显改变腌制芥菜的质地。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。