1.本发明涉及一种具有调节肠道菌群的静电纺丝微球靶向结肠体系及其制备方法与应用,属于功能化食品制备领域。
背景技术:
2.类胡萝卜素属于天然色素,具有抗炎和抗氧化等作用。但是,由于类胡萝卜素的疏水性决定了其胃肠道中的代谢命运-稳定性差和生物利用率低。红酵母红素是一种强抗氧化特性的类胡萝卜素,具有抗炎抗氧化,降血脂和保护肝脏的作用。
3.红酵母红素对人类健康具有巨大潜力,但也和其他类胡萝卜素一样存在急需解决的应用难点,比如水溶性差,对温度、氧气和光等环境条件敏感,开发有效的递送系统对提高其生物利用度和健康功能至关重要。类胡萝卜素在结肠生物利用率要高于小肠,番茄红素可重塑结肠炎小鼠的肠道微生物,改善人群的结直肠疾病。由此可见,结肠可能更适合成为类胡萝卜素发挥机体代谢调节作用的“主战场”,而其“战友”正是肠道菌群。
4.随着纳米技术的蓬勃兴起,用以制备纳米纤维材料的静电纺丝技术也得到了快速发展。目前,静电纺丝技术在生物医药领域主要应用于制备高包封率和持续缓释的天然产物体系,目前还未被完全用来构建结肠靶向纳米药物控释系统。
5.目前,纳米颗粒递送系统被认为是一种可以增加类胡萝卜素稳定性和在肠道生物利用度的载体,包括纳米乳液、纳米脂质体、蛋白质纳米颗粒。脂质体是具有双层脂质分子的封闭微泡,包裹内部水性介质。与其他载体系统相比,脂质体具有多种优势,例如能够同时携带疏水性和亲水性化合物、高封装效率和生物相容性。但是,这种纳米体系只能在小肠进行吸收释放,并不能安全稳定到达结肠部分,因此需要开发保护红酵母红素的结肠靶向体系。
技术实现要素:
6.为了解决目前存在的红酵母红素稳定性差,结肠生物利用度低等问题,本发明采用红酵母红素、壳聚糖和海藻酸钠共混静电纺丝制成壳聚糖-海藻酸钠结肠靶向红酵母红素微球体系,结合人肠道菌体外厌氧共培养等实验验证其具有一定的结肠靶向作用,并且也说明该静电纺丝微球结肠靶向体系达到了增强红酵母红素的稳定性和在结肠中的生物利用度的效果;同时红酵母红素对肠道益生菌发挥有益作用,显著提高了肠道中的有益菌的丰度,并抑制了一些致病菌的生长。
7.本发明的第一个目的是提供一种具有调节肠道菌群的静电纺丝微球靶向结肠体系,所述静电纺丝微球靶向结肠体系由壁材和芯材经静电纺丝纺织而成;所述芯材包括红酵母红素;所述壁材包括海藻酸钠和壳聚糖。
8.在一种实施方式中,所述海藻酸钠和壳聚糖的质量比为1~2:1~3。
9.在一种实施方式中,所述红酵母红素、海藻酸钠和壳聚糖的质量比为1~5:1:1。
10.本发明的第二个目的是提供一种具有调节肠道菌群的静电纺丝微球靶向结肠体系的制备方法,所述方法包括如下步骤:
11.(1)将海藻酸钠和壳聚糖溶解于nacl溶液中,调节ph值溶液至6.0~7.0;然后加入红酵母红素,搅拌、静置,得静电纺丝液;
12.(2)将步骤(1)制备得到的静电纺丝液经静电纺丝制得静电纺丝微球靶向结肠体系。
13.在一种实施方式中,步骤(1)所述海藻酸钠和壳聚糖的添加量均为100-200mg。
14.在一种实施方式中,步骤(1)所述红酵母红素的添加量为100-500mg。
15.在一种实施方式中,步骤(1)所述氯化钠溶液的浓度为0.5~0.1mol/l。
16.在一种实施方式中,步骤(1)所述搅拌是在冰水浴的条件下,使用高速分散机在5000~8000rpm下,搅拌5~10min。
17.在一种实施方式中,步骤(1)所述静置时间为15~30min,目的是为了除去静电纺丝液中的气泡。
18.在一种实施方式中,步骤(2)所述静电纺丝采用的是自组装静电纺丝装置;所述自组装静电纺丝装置由高压电源、恒速注射泵(控制溶液的流速)和接地板(放置5%cacl2溶液)的组成。
19.在一种实施方式中,步骤(2)所述静电纺丝是将静电纺丝液放入注射器,注射器放在恒速注射器泵上,并连接到金属针;电场施加在针尖(正电级)和接地的收集器之间;针尖和收集器之间的距离为15cm,溶液流速为1ml/h,环境温度为25
±
1℃;所述电场在24kv的电压下进行,静电纺丝微球靶向结肠体系在固化2h后收集,即为包含红酵母红素的静电纺丝微球靶向结肠体系(t)。
20.本发明的第三个目的是提供一种由上述所述的具有调节肠道菌群的静电纺丝微球靶向结肠体系在食品、保健品中的应用。
21.本发明的有益效果
22.(1)静电纺丝微球载体可以很好地包裹红酵母红素,避免胃和小肠的消化破坏,形成稳定的体系,到达结肠部分(保留率78%,而对比乳液的保留率只有19%)。
23.(2)体外动力学实验验证静电纺丝微球释放红酵母红素是一个复杂的过程,属于非fickian传输,其中侵蚀占主导地位。因此,静电纺丝微球可作为食品行业中红酵母红素补充剂体外释放的有前途的载体。
24.(3)人体肠道菌群共培养结果发现静电纺丝微球可以有效包载红酵母红素,并且抑制一些致病菌的生长,同时增殖许多与肠道免疫相关的菌群;其中与肠道免疫相关的菌群包括prevotella(top01),phascolarctobacterium(top06),ruminococcaceae ucg(top07),faecalibacterium(top11),lachnospiraceae ucg(top16),muribaculaceae(top17)和ruminococcaceae nk4a214(top20);致病菌包括sutterella(top03),bacteroides(top04),escherichia-shigella(top09),alistipes(top10),parabacteroides(top13),collinsella(top15)和intestinimonas(top28)。
25.(4)对于肠道菌群的代谢功能,红酵母红素增强了赖氨酸生物合成,磷酸肌醇代谢和丙氨酸、天冬氨酸和谷氨酸代谢,而谷胱甘肽代谢、苯丙氨酸代谢和酪氨酸代谢降低了。说明人体肠道菌群代谢红酵母红素后,代谢酶活力改变,主要集中在氨基酸代谢;进一步说
明静电纺丝微球对红酵母红素具有包埋和靶向结肠释放的作用。
附图说明
26.图1为本发明实施例1制备的静电纺丝微球靶向结肠体系的制备流程图(a),粒径图(b),扫描电镜图(c)和红外分析图(d)。
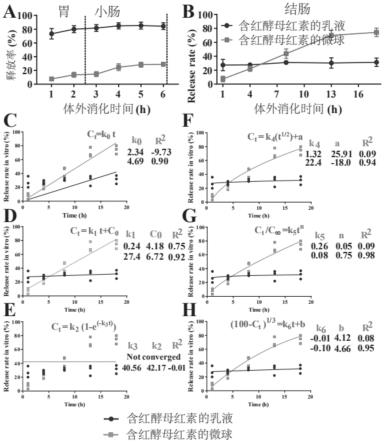
27.图2为本发明实施例1制备的静电纺丝微球靶向结肠体系的体外消化释放图;图2a为胃-小肠,图2b为结肠;图2c~h为结肠释放动力学方程:零级(c),零级线性(d),一级(e),higuchi(f),korsmeyer-peppas(g)和hixson-crowell模型(h);
28.图3为本发明实施例1制备的静电纺丝微球靶向结肠体系(包含红酵母红素的t组)和壁材(con组,不包含红酵母红素)对肠道菌群的益生作用图;多样性(a和b),门和属水平的微生物丰度变化(c);
29.图4为本发明实施例1制备的静电纺丝微球靶向结肠体系(包含红酵母红素的t组)和壁材(con组,不包含红酵母红素)对肠道菌群属水平的显著性分析图;
30.图5为本发明实施例1制备的静电纺丝微球靶向结肠体系(包含红酵母红素的t组)和壁材(con组,不包含红酵母红素)对肠道菌群属水平的特征微生物分析图;
31.图6为本发明实施例1制备的静电纺丝微球靶向结肠体系(包含红酵母红素的t组)和壁材(con组,不包含红酵母红素)对肠道菌群属水平的网络分析图;
32.图7为本发明实施例1制备的静电纺丝微球靶向结肠体系(包含红酵母红素的t组)和壁材(con组,不包含红酵母红素)对肠道菌群的代谢功能作用图;肠道菌群代谢酶的火山图分析(a),肠道菌群kegg代谢-level2水平的分析(b),肠道菌群kegg代谢-level3水平分析(c)。
具体实施方式
33.1、实验材料与仪器
34.tween80购自国药化学试剂有限公司(中国上海);胃蛋白酶,胃脂肪酶,胰蛋白酶,胰脂肪酶,猪胆盐和玉米油购自上海源叶生物科技有限公司(中国上海);海藻酸钠,壳聚糖,丁基化羟基甲苯(bht)购自上海麦克林生化科技有限公司(中国上海)。
35.2、体系封装效率的测定
36.红酵母红素的浓度通过hplc方法进行定量,首先将0.5ml样品和0.5ml的二甲亚砜混合,再加1ml萃取剂(正己烷:二氯甲烷=4:1,v/v),在摇床中震荡(200rpm,10min)后,离心(3000rpm,10min)取上清进行测定。
37.使用带有dad检测器的agilent 1260hplc系统(agilent technologies,california,usa)检测红酵母红素的浓度。在25℃下将样品(20μl)注入色谱柱(agilent sb-c
18
,4.6
×
250mm,5μm)。流动相由a(乙腈:水:甲酸(86:10:4,v/v/v))和b(乙酸乙酯:甲酸(96:4,v/v/v))组成,流速为1.0ml/min。a相在0-25min由100%线性降至0%,b相在25-30min由0%线性升至100%,a相在25-32min再线性升至100%。
38.配置0.1-100ug/ml溶于正己烷的红酵母红素标准溶液,通过吸收波长为492nm下的吸收峰面积和浓度的建立线性回归方程,绘制标准曲线。
peppas和hixson-crowell)拟合实验数据,探索了小肠缓释体系释放红酵母红素的相关机制。当释放机制不熟悉或涉及多种类型的释放情况时,这些选择性模型方程经常用于描述聚合物体系中活性成分的释放。选择具有最高决定系数(r2)的模型作为描述红酵母红素释放的最佳动力学模型。
53.零级模型(zero order model):c
t
=k0t
54.零级线性模型(zero order linear model):c
t
=k1t c0[0055][0056]
higuchi模型(higuchi model):ct=k4t
1/2
a
[0057]
korsmeyer-peppas模型(korsmeyer-peppas model):c
t
/c
∞
=k5tn[0058]
hixson-crowell模型(hixson-crowell model):
[0059]
*c
t
是时间t后释放的红酵母红素n浓度,k0,k1,k2,k3,k4,k5和k6是速率常数,c0是红酵母红素的初始浓度,c
t
/c
∞
是在时间t释放的红酵母红素分数,n是释放指数,a和b是常数。
[0060]
6、靶向结肠体系的“升结肠-横结肠-降结肠”酵解
[0061]
升结肠、横结肠、降结肠3个发酵罐依次模拟人结肠肠道串联,依照表中各个发酵液体积(接种10%的肠道菌群),每个罐子中加入5颗黏膜小球,ph自动控制系统补充1mol/l的naoh溶液和1mol/l hcl来调节ph,依靠半导体控温系统保持发酵温度恒定在37℃。为控制发酵严格的厌氧环境,每日早、中、晚对每个发酵罐通氮气以排尽发酵罐内的空气。接种培养24h之后,为维持微生物的正常生长,每日补给养料和排出300ml,以维持发酵体积不变。粪便肠道菌群接种后连续发酵7d待发酵罐内微生物趋于稳定。
[0062]
参考类胡萝卜素的人体每日摄入量15-30mg,取上述50ml小肠消化液中的肠可溶性部分(5ml)以及未消化的固体残渣接入升结肠发酵罐。继续发酵7天,在每天的同一时间点收集每个结肠的发酵液,并将样品储存在-80℃以供检测。分组设计为壁材对照组(con组),包含红酵母红素的微球组(t组)。
[0063]
表1体外结肠系统的参数设置
[0064][0065][0066]
16s rrna测序与分析使用dna试剂盒提取1ml发酵液中的dna。通过引物从全基因组扩增细菌16s rrna测序基因(v3-v4区域),扩增测序为95℃ 2分钟;然后在95℃30s、55℃ 30s、72℃ 30s进行25个循环,并在72℃下最终延伸5分钟。pcr扩增产物通过2%琼脂糖凝胶电泳检测,并采用dna试剂盒回收纯化,对纯化后的pcr产物定量检测,合格的测序文库使用novaseq测序仪进行测序。使用qiime 2.0对原始fastq文件进行处理,双端序列去除掉barcode和接头序列后进行拼接,通过dada2分析流程进行序列去噪和聚类,导出代表序列
和特征表,随后物种注释和可视化。通过rdp分类器进行分析,细菌16s rrna参考greengenes数据库。
[0067]
实施例1
[0068]
一种静电纺丝微球靶向结肠体系的制备方法,具体包括如下步骤:
[0069]
静电纺丝微球的制备工艺如图1a:
[0070]
将100mg海藻酸钠和100mg壳聚糖溶解在100ml的0.5mol/l的nacl溶液中,然后,将混合溶液的ph值调节至6.0;继续加入300mg的红酵母红素后,使用t18高速分散机在5000rpm冰水浴的条件下搅拌5min,混合均匀后静置15min以除去气泡;
[0071]
自组装静电纺丝装置由高压电源、恒速注射泵(控制溶液的流速)和接地板(放置5%cacl2溶液)的组成。将含有上述溶液的注射器放在恒速注射器泵上,并连接到金属针;电场施加在针尖(正电级)和接地的收集器之间。静电纺丝微球在24kv的电压下进行,针尖和收集器之间的距离为15cm,溶液流速为1ml/h,环境温度为25
±
1℃;静电纺丝微球固化2h后收集,即为包含红酵母红素的静电纺丝微球靶向结肠体系(t)。
[0072]
对比例1
[0073]
一种包含红酵母红素的乳液体系的制备方法,具体包括如下步骤:
[0074]
将300mg的红酵母红素溶于5g玉米油中,再加入94.5g的pbs,使用t18高速分散机(ika,germany),在5000rpm条件下搅拌5min,制备成红酵母红素乳液。
[0075]
靶向结肠体系的性能表征
[0076]
1、封装率与结构表征
[0077]
实施例1制备的包含红酵母红素的静电纺丝微球靶向结肠体系的封装效率如图1b所示,该体系的封装效率达到了82.47
±
3.83%,粒径在402.51
±
13.40nm。
[0078]
使用相机记录了负载红酵母红素微球的照片,壁材是无色透明,而包含红酵母红素的静电纺丝微球由于添加了红酵母红素而呈淡黄色。
[0079]
如图1c,扫描电镜结果发现冷冻干燥的红酵母红素微球结构完整,但冷冻干燥的壁材出现明显的凹陷和褶皱,红酵母红素可以缓解微球的塌陷并保持其完整结构,如图1b所示。
[0080]
ftir进一步分析了红酵母红素与不同体系之间的相互作用,结果如图1d所示;在2923和2853cm-1
附近出现的部分峰是由于烷基c-h基团的对称和不对称伸缩振动,而ch3基团的不对称和对称变形振动分别在1463和1366cm-1
附近观察到。研究发现,类胡萝卜素在1200
–
700cm-1
处具有指纹区,因此在约1022cm-1
处的吸收峰可能属于类胡萝卜素的反式c-h变形振动带。其他峰存在于1742cm-1
(主要归因于脂质和c-c酯基团),1650-1550cm-1
(c-c拉伸),1463cm-1
(c-h变形)。
[0081]
红酵母红素在被载体包封后,ftir光谱发生轻微变化,可能说明红酵母红素和载体的结构没有发生明显变化。壁材的光谱中1628和1435cm-1
的峰分别归因于海藻酸钠中单键coo基团的不对称和对称伸缩振动。由于壁材中的钙原子和氧原子之间存在部分共价键,氨基(-nh2)峰在1153cm-1
处显示为壳聚糖涂层珠粒中的肩峰,但是在红酵母红素微球中,该峰转移到1150cm-1
,这可能表明红酵母红素有助于壁材的羟基形成氢键。与壁材相比,红酵母红素微球的光谱中1334cm-1
移动到1327cm-1
。并且,负载红酵母红素的红酵母红素微球中存在1114和1200
–
700cm-1
附近的红酵母红素特征峰。
[0082]
总体而言,静电纺丝过程中只发生了物理嵌入,没有形成新物质,微球载体可以很好地包裹红酵母红素,形成稳定的体系。
[0083]
2、靶向结肠体系的体外“胃-小肠-结肠”消化特性及释放动力学
[0084]
研究了胃肠消化过程中不同体系对红酵母红素释放的效果,结果如图2a所示;
[0085]
结果表明,在胃期2h内,对比例1的红酵母红素乳液(82.3%)快速释放,而实施例1制备的包含红酵母红素的静电纺丝微球能够缓慢释放红酵母红素,释放率仅为13.6%;说明静电纺丝微球体系可以抵抗低ph胃酸的破坏。
[0086]
在小肠消化阶段,观察到对比例1制备的红酵母红素乳液体系,持续大量释放红酵母红素,尤其是前2h内释放率达到最高;但实施例1制备的包含红酵母红素的静电纺丝微球在接下来的4h内缓慢释放,到达小肠后的累积释放率仅仅只达到29.3%,明显低于对比例1的红酵母红素乳液,这也表明了本发明制备的包含红酵母红素的静电纺丝微球体系在模拟胃-小肠消化中的高度稳定性。这主要是由于藻酸盐在酸性条件下的不溶解性,可保护包载的生物活性物质,从而避免了红酵母红素静电纺丝微球的溶胀,因此较少量的红酵母红素会从基质中释放。
[0087]
如图2b所示,在结肠酵解过程中,红酵母红素微球呈现持续释放红酵母红素的现象,释放率在16h达到最高(74.3%),证明静电纺丝微球包载红酵母红素体系具有结肠特异性释放特性。
[0088]
监测活性物质的释放过程有助于评估其释放效果,而释放过程的数学模型对于建立更好的体外-体内相关性更加至关重要。为了建立红酵母红素在体外-体内的更优相关性,释放动力学模型,包括零级、一级、higuchi,korsmeyer-peppas和hixson-crowell模型被用来预测红酵母红素释放曲线。
[0089]
如图2c-h表示从不同体系在结肠消化阶段释放红酵母红素的动力学方程和参数。对比例1制备的红酵母红素乳液,在零级模型的情况下观察到相关系数(r2)的最大值为0.92。而实施例1制备的红酵母红素静电纺丝微球,在korsmeyer-peppas模型的情况下观察到r2的最大值为0.98。korsmeyer-peppas模型主要用于通过评估释放指数n的值来描述具有一种以上释放现象的释放机制,例如扩散、侵蚀或两者兼有。指数n已被提议作为释放行为的指标,n≤0.45对应于fickian扩散机制,0.45《n《0.89对应于非fickian传输,n=0.89对应于case ii传输,并且n》0.89对应于超级case ii传输。因此,红酵母红素静电纺丝微球释放红酵母红素是一个复杂的过程,属于非fickian传输,其中侵蚀占主导地位。因此,静电纺丝微球可作为食品行业中红酵母红素补充剂体外释放的有前途的载体。
[0090]
3、靶向结肠体系对体外“升结肠-横结肠-降结肠”菌群的影响
[0091]
shannon和simpson指数通常用于评估样本中的微生物多样性,同时shannon指数还包括了菌群的均一性,而chao1指数通常用于估计样本中的物种丰度。
[0092]
图3a中表明,菌群与常规培养基共培养平衡一周后(initial到0d之间有7d的适应期),微生物多样性变化不明显,但是chao1指数明显下降,说明适应期只对微生物多样性影响较小,但会降低微生物物种丰度。在2-7d内,con组(仅有壁材)的微生物多样性和物种总数呈上升趋势,并且降结肠的指数高于另外两个肠腔。对于处理组(包含红酵母红素的微球,即包含红酵母红素的静电纺丝微球t),除了升结肠的微生物多样性和物种总数呈下降的趋势,另外两个肠腔均为上升的趋势,且高于con组的指数。说明红酵母红素静电纺丝微
球体系可以调节肠道菌群,时间越长,影响越大,主要是在横结肠和降结肠部分。
[0093]
pca主成分分析是多维数据的降维分析,如果样品组成越相似,则它们在图3b中的聚类树距离越接近。通过bray-curtis距离算法,计算菌群的beta多样性主成分分析,结果如图3b所示,t-2d,t-4d,t-6d和con-2d,con-4d,con-6d之间分开明显,说明红酵母红素的加入对微生物的组成有一定的影响,而两个大组之间的聚类效果也良好。
[0094]
人类肠道微生物数量超过100万亿,主要由bacteroidota、firmicutes、actinobacteriota和proteobacteria组成,其丰富度占微生物群落的90%以上。相对于con组的门水平(图3c),t组在升结肠中的bacteroidetes丰度上升,firmicutes,actinobacteriota和proteobacteria丰度下降。同时,t组在横结肠中具有bacteroidetes和proteobacteria丰度降低,firmicutes丰度上升的趋势,并且t组在降结肠中的变化趋势更明显,说明红酵母红素的干预可以调节肠道菌群的组成。
[0095]
在属水平中,升结肠的con组和t组主要由prevotella,bifidobacterium,sutterella,bacteroides,lachnoclostridium和faecalibacterium组成。到了横结肠和降结肠段,bifidobacterium为主要微生物,并且其他微生物的组成更加复杂,与前面的图3a多样性结果一致。
[0096]
为了探究各个微生物属水平的显著性变化,我们对con和t组中相同天数和肠腔中高丰度的属水平微生物进行student’s t两组检验,结果如图4所示;
[0097]
相比于con组,(ⅰ)升结肠端丰度显著升高的有prevotella,dorea,lachnospiraceae_ucg,ruminiclostridium,phascolarctobacterium和dialister;而丰度显著降低的有bifidobacterium,collinsella,bacteroides,parabacteroides,desulfovibrio,parasutterella和sutterella。
[0098]
(ⅱ)横结肠端丰度显著升高的有muribaculaceae,prevotella,dorea,lachnoclostridium,lachnospiraceae ucg,anaerotruncus,ruminococcaceae nk4a214,ruminococcaceae ucg,phascolarctobacterium和parasutterella;而丰度显著降低的有collinsella,bacteroides,parabacteroides和escherichia-shigella。
[0099]
(ⅲ)降结肠中丰度显著升高的微生物更加多了,除了横结肠丰度升高的微生物,还包括了family_xiii_ad3011,blautia和negativibacillus;而丰度显著降低的与横结肠端相似。
[0100]
综合上述结果,相对于con组,t组中丰度均显著上升的有prevotella(top01),phascolarctobacterium(top06),ruminococcaceae ucg(top07),faecalibacterium(top11),lachnospiraceae ucg(top16),muribaculaceae(top17)和ruminococcaceae nk4a214(top20);而显著降低的有sutterella(top03),bacteroides(top04),escherichia-shigella(top09),alistipes(top10),parabacteroides(top13),collinsella(top15)和intestinimonas(top28)。
[0101]
(1)对t组中红酵母红素增值的微生物进行分析
[0102]
prevotella是人类肠道内的优势细菌属,摄入碳水化合物与丰富的prevotella有关;
[0103]
琥珀酸是艰难梭菌的关键代谢物,phascolarctobacterium可消耗肠道中的琥珀酸,阻止了艰难梭菌感染。
[0104]
成年人肠道菌群中phascolarctobacterium的丰度增加后,更加有利于体重减轻,并且dialister可编码肠道微生物碳水化合物活性酶的基因也有助于体重减轻。
[0105]
ruminococcaceae和胆汁酸谱受益生元饮食调节,并在慢性节律紊乱后促进昼夜节律的恢复。
[0106]
人体肠道微生物群体外发酵透明质酸促进了dialister和faecalibacterium,并产生大量的乙酸盐、丙酸盐和丁酸盐。
[0107]
乙酸生产属lachnospiraceae ucg对抑制结肠炎症息息相关。
[0108]
许多肠道病原体,包括艰难梭菌,使用肠粘膜的糖作为营养素。而muribaculaceae就可与病原体竞争这些营养物质,是健康肠道中的生态守门人;
[0109]
来自大量人群研究的全微生物组分析发现肠道中存在高丰度的ruminococcaceae nk4a214的人群患有胰岛素抵抗和2型糖尿病的几率更小。
[0110]
(2)t组中红酵母红素抑制增殖的微生物进行分析
[0111]
sutterella会损害肠道抗菌免疫反应的功能,诱导轻微的炎症反应。长期摄入富含蛋白质和动物脂肪的饮食与bacteroides有关,本研究中bacteroides的减少可能与培养基的营养组成相关。
[0112]
escherichia-shigella也是一种人体肠道中常见的致病菌。高脂肪饮食通过调节肠道微生物群和代谢物促进结直肠肿瘤发生,主要现象就是病原菌alistipes的增加。
[0113]
虾青素通过调节肠肝轴特性预防高脂饮食诱导的小鼠肝脂肪变性与显着抑制肥胖相关菌parabacteroides的生长有关。促炎的collinsella和较高的与非酒精性脂肪性肝炎有关,该菌也与肥胖和动脉粥样硬化有关,也与甘油三酯和总胆固醇水平呈正相关,与高密度脂蛋白胆固醇呈负相关,可能会影响宿主的脂质代谢。intestinimonas是调控th17-微生物的相互作用和代谢综合征小鼠的肠道炎症中的重要靶点。
[0114]
因此,靶向结肠体系可以有效包载红酵母红素,并且增殖许多与肠道免疫相关的菌群,同时抑制一些致病菌的生长。
[0115]
如图5所示,通过线性判别lda和lefse分析经红酵母红素干预的属水平特征微生物,lda的分数越高表示此微生物特征性越大。lda分数均在3以上,表明微生物具有显著性差异。
[0116]
两组的降结肠-7d和横结肠-7d中的显著性微生物都是最多的,但t组中的差异微生物数量明显多于con组。相对于con组,t组新增了lachnoclostridium和anaerotruncus(降结肠-7d);ruminococcaceae nk4a214(降结肠-4d);faecalibacterium(降结肠-2d);phascolarctobacterium(横结肠-7d);subdoligranulum(横结肠-4d);bifidobacterium(横结肠prevotella(升结肠-7d);lachnospiraceae ucg 002(升结肠-4d)。其中,lachnoclostridium,ruminococcaceae nk4a214,bifidobacterium和prevotella为肠道菌群利用红酵母红素的最明显的标志性微生物。肠道微生物组在全身炎症和免疫反应中起着重要作用,高丰度的lachnoclostridium可以调节黑色素瘤患者体内炎症因子水平并影响t细胞浸润,且显着降低死亡风险。
[0117]
通过斯皮尔曼相关性分析研究相对丰度较高的属水平微生物,并筛选具有显著性差异的微生物构建共线网络(p《0.01,correlation》0.8),通过对共现网络分析,阐述肠道生态系统的关键微生物。如图6结果表明,相对于con组,t组的相关性网络因子(球体)更多
并且相关性(球体的大小,连线)更大,说明红酵母红素干预后,肠道菌群的多样性和共现性增加。相对于con组,t组中相关性权重较大的微生物包括prevotella,bifidobacterium,faecalibacterium和phascolarctobacterium。faecalibacterium支持粘膜免疫稳态,从而可能有助于维持宿主-微生物的稳态。
[0118]
4、靶向结肠体系对体外“升结肠-横结肠-降结肠”菌群代谢功能的影响
[0119]
为进一步探究红酵母红素诱导的肠道微生物群调节代谢情况,通过picrust2预测分析肠道菌群代谢功能。kegg是基因组、生物通路、疾病和药物化学物质之间联系的集成数据库,可分为三个不同层次。
[0120]
将两组的微生物测序结果与数据库进行比对,分析具有显著性差异的代谢通路,可筛选出红酵母红素影响代谢的关键通路。如图7所示,呈现了t组与con组的6000个ko相关代谢酶丰度的差异结果,较con组,t组明显调节了ko代谢酶丰度。通过显著性分析发现(p《0.001,fdr《0.01)在level 2层次(图7b),较con组,t组主要增强氨基酸代谢、萜类和聚酮化合物的代谢和能量代谢,减弱辅因子和维生素的代谢以及异生素的生物降解和代谢。
[0121]
对level 3(图7c)层次中代谢途径进行显著性分析(p《0.001,fdr《0.01),结果表明,赖氨酸生物合成、磷酸肌醇代谢和丙氨酸、天冬氨酸和谷氨酸代谢增强,而谷胱甘肽代谢、苯丙氨酸代谢和酪氨酸代谢降低。说明人体肠道菌群代谢红酵母红素后,代谢酶活力改变,主要集中在氨基酸代谢;进一步说明静电纺丝微球对红酵母红素具有包埋和靶向结肠释放的作用。
[0122]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
