适合腺病毒载体增殖的mdck-koslc35b2细胞系及其应用
技术领域
1.本发明涉及分子生物学,具体涉及一种适合腺病毒载体增殖的mdck-koslc35b2细胞系及其应用。
背景技术:
2.重组腺病毒载体是一种复制缺陷的腺病毒载体系统,可以承载外源基因,作为基因递送载体应用于疫苗研发。人腺病毒载体5型(adenovirus5,ad5),其基因组是36kb长的线性双链dna,是临床疫苗最常用的腺病毒载体。近年来,腺病毒载体已广泛应用到埃博拉病毒、人类免疫缺陷病毒(human immunodeficiency virus,hiv)、流感病毒、恶性疟原虫、结核分枝杆菌、丙型肝炎病毒等的候选疫苗研究。我国自主研发的基于人类腺病毒5型病毒载体的重组新型冠状病毒疫苗ad5-ncov已临床应用于2019冠状病毒病(coronavirus disease 2019,covid-19)疫病预防。
3.但机体存在的针对腺病毒载体的预存免疫一直阻碍着该类疫苗的研发和应用。犬腺病毒(canine adenovirus,cav)是哺乳动物腺病毒属中致病力最强的病毒之一,分为犬腺病毒-1(cav-1)和犬腺病毒-2(cav-2)两型。犬腺病毒cav-2具有高度种属特异性,能感染进入人体但不能复制,在一定程度上避免人体预存免疫问题,展示了很好的腺病毒载体疫苗载体研发前景。同时cav-2还可作为口服疫苗载体有望解决野生动物免疫的难题。
4.由此可见,cav-2不仅是一种重要的人用基因递送的候选载体,而且是非常有价值的动物用疫苗载体工具。因此,提高cav-2病毒增殖滴度以降低疫苗成本的研究,对于重组腺病毒载体疫苗的研制尤为重要。
技术实现要素:
5.本发明的目的在于克服现有技术的不足,提供了一种适合腺病毒载体载体增殖的mdck-koslc35b2细胞系及其应用,本发明利用crispr技术特异靶向性和高效切割率的特点对细胞的slc35b2基因进行靶向突变,达到基因功能失活的效果;因其在基因组水平对细胞进行改造,双染色体均发生突变,得到的slc35b2基因功能失活的、可稳定遗传的细胞系。且该细胞系具有提高腺病毒载体增殖的效果,有利于提高腺病毒载体滴度从而达到提高临床腺病毒载体疫苗生产效率等作用。
6.为实现上述目的,本发明所设计一种适合腺病毒载体增殖的mdck-koslc35b2细胞系,所述细胞系的全基因组中slc35b2基因位于第12号染色体,所述细胞系的全基因组中,第12号的一个染色体上的slc35b2基因的第二段外显子基因序列(第二段外显子基因序列如seq idno.1所示)上连续缺少七个碱基tctgact,所述七个碱基tctgact位于slc35b2基因序列(slc35b2基因序列登入于ncbi,其登入号为gene id:481819)上的12857085-12857093的位点间;
7.第12号的另一个染色体上的slc35b2基因的第二段外显子基因序列上连续缺少十七个碱基ggtccctctgacttcgc,所述十七个碱基ggtccctctgacttcgc位于slc35b2基因序列
上的12857081-12857099的位点间(该mdck-koslc35b2细胞系通过slc35b2基因缺少,造成该基因不能正确表达,从而达到敲除slc35b2基因的目的)。
8.本发明还提供了一种上述适合腺病毒载体增殖的mdck-koslc35b2细胞系的构建方法,包括以下步骤:
9.1)稳定表达cas9蛋白的mdck细胞系的构建;
10.2)靶向slc35b2第二外显子的突变质粒lentiguide-sgrna slc35b2的构建;
11.3)靶向slc35b2的lentiguide-sgrna slc35b2慢病毒生产;
12.4)包含slc35b2基因突变的混合细胞的构建
13.5)slc35b2功能失活的mdck-koslc35b2细胞系的筛选。
14.进一步地,所述步骤1)中,稳定表达cas9蛋白的mdck细胞系的构建方法如下:
15.a.将293ft细胞铺至6孔板中,将慢病毒包装的质粒pmd2.g、pspax2、lenticas9-blast共转染293ft细胞(转染过程中,pmd2.g能形成病毒囊膜、pspax2能表达gag和pol进行病毒包装、lenticas9-blast质粒不仅含有被包装进入假病毒粒子包装信号、长末端重复序列,还含有cas9蛋白及blasticidin抗性筛选基因),转染后收集细胞培养,离心,取上清即为含有慢病毒粒子的溶液;
16.b.将mdck细胞铺至12孔板中,加入不同浓度的blasticidin抗生素,筛选出在3天时间内能够杀死全部细胞的最低浓度,并将此浓度定为后期筛选mdck细胞的敏感浓度;
17.c.将mdck铺至6孔板中,待其贴壁,以培养基和慢病毒悬液体积比1:1加入6孔板中,细胞培养,定期换新鲜完全培养基,并按照mdck细胞的敏感浓度,加入blasticidin抗生素筛选阳性细胞,按照1细胞/孔,铺入96孔板,选择在blasticidin抗生素敏感浓度下生长快速的细胞进行扩大,即为稳定表达cas9的mdck细胞系。
18.再进一步地,所述步骤2)中,靶向slc35b2第二外显子的突变质粒lentiguide-sgrnaslc35b2的构建方法如下:
19.a.根据位于犬第12号染色体(第12号染色体的序列登入于ncbi,其登入号为gene id:481819)上的序列(即slc35b2的第二个外显子序列),设计了靶向突变的sgrna序列,为gctcagaccgcgaagtcaga;
20.b.在靶向突变的sgrna序列的两端补充bsmbi酶切后的粘性末端,合成序列如下:
21.d-slc35b2-sgrna-f:5
’‑
caccgctcagaccgcgaagtcaga-3’,
22.d-slc35b2-sgrna-r:5
’‑
aaactctgacttcgcggtctgagc-3’;
23.c.将序列d-slc35b2-sgrna-f和d-slc35b2-sgrna-r进行磷酸化退火形成双链,即为含bsmbi酶切位点的靶向slc35b2第二外显子的slc35b2-sgrna双链;
24.d.使用bsmbi双酶切lentiguide-puro质粒载体,回收得到lentiguide-puro片段;并将靶向slc35b2第二外显子的slc35b2-sgrna双链与回收的lentiguide-puro片段进行连接,得到连接产物;
25.e.连接产物转化大肠杆菌感受态细胞后,得到突变质粒lentiguide-sgrna slc35b2。
26.再进一步地,所述步骤2)第c小步中,磷酸化退火反应体系为:
[0027][0028]
在37℃反应30min,95℃反应5min,85℃ramp 2℃/s 30cycle,25℃ramp 0.1℃/s 90cycle。
[0029]
再进一步地,所述步骤3)中,靶向slc35b2的lentiguide-sgrna slc35b2慢病毒生产方法如下:
[0030]
将293ft细胞铺至6孔板中,将慢病毒包装的质粒pmd2.g、pspax2、lentiguide-sgrna slc35b2共转染细胞;转染后收集细胞培养,离心,再次得到上清即为含有慢病毒粒子lentiguide-sgrna slc35b2的悬液。
[0031]
再进一步地,所述步骤4)中,slc35b2突变mdck细胞的筛选方法如下
[0032]
a.将步骤1)得到的mdck细胞传代入6孔板中,以完全培养基和包含慢病毒粒子lentiguide-sgrna slc35b2的细胞悬液体积比为1:1加入6孔板中,细胞培养24h后,定期换新鲜完全培养基,根据mdck细胞对puromycin抗生素敏感浓度,加入puromycin抗生素筛选阳性细胞,即为包含slc35b2基因突变的混合细胞;
[0033]
再进一步地,所述步骤5)中,slc35b2功能失活的mdck-ko slc35b2细胞系的筛选和鉴定的方法如下:
[0034]
将包含slc35b2基因突变的混合细胞按照1个细胞/孔铺入96孔板中,利用有限稀释法进行单克隆细胞筛选,选择单细胞克隆的孔进行扩大培养;并将增殖出的单克隆细胞;即为mdck-ko slc35b2细胞系。
[0035]
本发明还提供了一种上述适合腺病毒载体增殖的mdck-koslc35b2细胞系在制备腺病毒载体疫苗中的应用。
[0036]
本发明的原理:
[0037]
1.本发明选用的slc35b2基因为核苷酸硫酸盐基因,其编码的蛋白即为3'-磷酸腺苷-5'-磷酸硫酸盐(paps)转运蛋白1,为存在于高尔基体膜中一种特异性的paps转运蛋白,又被称为papst1。机体在正常生理生长和发育过程中,细胞蛋白、多糖等在硫酸转移酶催化下形成具有生物活性的有机硫酸化物,参与了机体许多重要的生物学过程。在硫酸基团转移过程中,高尔基体膜转运体(papst1)将paps从细胞质中转移到高尔基体腔内,递送硫酸基团用于蛋白、多糖等底物的硫酸化。有研究表明在犬肾上皮细胞(mdck)中,沉默slc35b2抑制高尔基体囊泡对paps的摄取,导致硫酸软骨素cs合成抑制同时硫酸肝素hs合成增加。
[0038]
2.本发明利用crispr技术特异靶向性和高效切割率的特点对细胞的slc35b2基因进行靶向突变,达到基因功能失活的效果;因其在基因组水平对细胞进行改造,双染色体均发生突变,得到的slc35b2基因功能失活的、可稳定遗传的细胞系。且该细胞系具有提高腺
病毒载体增殖的效果,有利于提高腺病毒载体滴度从而达到提高临床腺病毒载体疫苗生产效率等作用。
[0039]
本发明的有益效果:
[0040]
本发明在犬肾上皮细胞系mdck中完全缺失slc35b2的表达,slc35b2作为硫酸基团转运体,缺失后影响细胞内相关蛋白酪氨酸的硫酸化,扰乱细胞内环境对dna损伤修复及线粒体内稳态的调节。在腺病毒感染条件下,slc35b2基因缺失明显延缓被感染细胞的死亡,有利于腺病毒在细胞核内大量增殖,提高病毒的产量,降低临床中腺病毒载体疫苗的生产成本,利于重组腺病毒载体疫苗的研制。
附图说明
[0041]
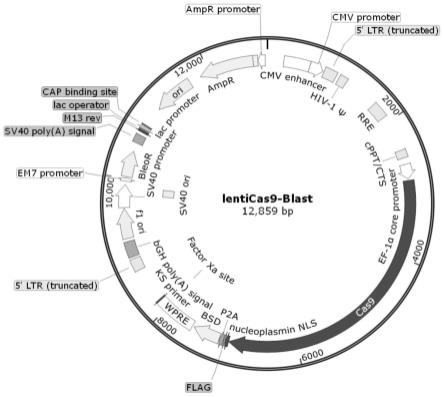
图1为lenticas9-blast载体图谱;
[0042]
图2为pspax2载体图谱;
[0043]
图3为pmd2.g载体图谱;
[0044]
图4为lentiguide-puro的载体图谱;
[0045]
图5为lentiguide-sgrna slc35b2质粒图谱;
[0046]
图6为pretrox-tet-3g逆转录病毒载体质粒图谱;
[0047]
图7为pretrox-c slc35b2-flag逆转录病毒质粒图谱;
[0048]
图8为细胞中cas9蛋白表达的检测;
[0049]
图中,第一条泳道为mdck细胞的检测结果,第二条泳道为cas9-mdck细胞的检测结果图;
[0050]
图9为靶向slc35b2的sgrna构建入lentiguide-puro载体后得到的质粒lentiguide-sgrna slc35b2的测序结果图;
[0051]
图10为mdck-ko slc35b2细胞系slc35b2序列t7e1检测图;
[0052]
图中,1号泳道为mdck-wt细胞slc35b2基因目的条带未加t7e1酶切对照,
[0053]
2号泳道为mdck-wt细胞slc35b2基因目的条带t7e1酶切,
[0054]
3号泳道为疑似突变细胞slc35b2基因目的条带未加t7e1酶切对照,4号泳道为疑似突变细胞slc35b2基因目的条带t7e1酶切;
[0055]
图11为mdck-ko slc35b2细胞slc35b2序列上的突变测序结果图;
[0056]
图12为western blot检测mdck-ko c slc35b2细胞系slc35b2基因表达情况图;
[0057]
图13为腺病毒cav-2在mdck-koslc35b2、mdck-ko c slc35b2与mdck-wt细胞上增殖的病变图,
[0058]
图中,24h、48h、72h为cav-2在细胞上的感染时间;
[0059]
图14为腺病毒cav-2在mdck-koslc35b2、mdck-ko c slc35b2与mdck-wt细胞上所增殖的病毒滴度测定结果图。
具体实施方式
[0060]
下面结合具体实施例对本发明作进一步的详细描述,以便本领域技术人员理解。
[0061]
下面为实施例需要的物质和器材
[0062]
1、细胞及质粒基因
[0063]
人胚肾细胞系(mdck)由汉恒生物科技有限公司提供,293ft细胞购自clontech公司。lenticas9-blast(图1)、pspax2质粒(图2)、pmd2.g质粒(图3)、lentiguide-puro(图4)、pretrox-tet-3g(图6)质粒均购自addgene公司。
[0064]
2、常用的生物学试剂
[0065]
dmem培养基购自gibco公司,胎牛血清购自德国pan biotech公司,phanta super-fidelity dna polymerase、dna maker dl2000、dna maker dl5000购自南京诺唯赞生物科技有限公司,bsmbⅰ限制性内切酶、t7e1enzyme购自neb公司、胶回收试剂盒、质粒提取试剂盒及去内毒素试剂盒均购自tiangen公司,blasticidin、puromycin购自sigma公司,g418购自thermo fisher公司。
[0066]
3、主要仪器设备台式低温高速离心机(eppendorf 5404r),xp基因扩增仪tc-xp-d(杭州博日科技有限公司),电热恒温水浴锅dk-s22型(上海精宏实验设备有限公司),scw-cz-650型洁净工作台(苏州宏瑞净化科技有限公司),立式双开门低温保存箱bcd-610w(博西华家用电器有限公司),dhp-9162型恒温培养箱(上海福玛实验设备有限公司),dyy-6c型核酸电泳仪(北京六一生物科技有限公司),uv-1000型台式紫外分析仪(上海佳联科技有限公式),hdl洁净工作台(北京东联哈尔仪器制造有限公司),modelix70-s8f2(olympus optical japan),立式超低温保存箱dw-86l626(青岛海尔特种电器有限公司),centrifuge 542r(eppendorf),凝胶成像系统、生物安全柜、普通光学显微镜型、恒温水浴槽dk-80型(上海精宏实验设备有限公司),恒温培养摇床zhwy一2012c(上海智城分析仪器制造有限公司)。
[0067]
实施例1适合腺病毒载体增殖的mdck-koslc35b2细胞系的构建
[0068]
1.稳定表达cas9蛋白的mdck细胞系的构建
[0069]
a.含有慢病毒粒子的溶液的制备
[0070]
将293ft细胞铺至6孔板中,将慢病毒包装的质粒pmd2.g、pspax2、lenticas9-blast按照质量比2:3:5,质粒总量按照3μg转染细胞(转染过程中,pmd2.g能形成病毒囊膜、pspax2能表达gag和pol进行病毒包装、lenticas9-blast质粒不仅含有被包装进入假病毒粒子包装信号、长末端重复序列,还含有cas9蛋白及blasticidin抗性筛选基因),转染8小时后换液,收集转染48h和转染72h的细胞培养上清,在4℃、12,000转/分钟、离心10分钟后,取上清即为含有慢病毒粒子的溶液。
[0071]
b.mdck细胞最小blasticidin抗生素杀死浓度的确定
[0072]
将mdck细胞铺至12孔板中,加入不同浓度的blasticidin抗生素,并做3个重复,筛选出在3天时间内能够杀死全部细胞的最低浓度,并将此浓度定为后期筛选mdck细胞的敏感浓度,实验中测试到的mdck细胞的敏感浓度为8.0μg/ml。
[0073]
表1:blasticidin对正常mdck细胞最低致死浓度
[0074][0075]
注释:-:细胞0%死亡, :细胞约20%死亡, :细胞约40%死亡, :细胞约60%死亡, :细胞约80%死亡, :细胞100%死亡。
[0076]
c.blasticidin抗生素筛选cas9表达阳性细胞将mdck铺至6孔板中,待其贴壁,以培养基和慢病毒悬液体积比1:1加入6孔板中,细胞培养24h后,换新鲜完全培养基。在感染慢病毒的mdck细胞和未感染的mdck细胞中,加入8μg/ml blasticidin抗生素筛选阳性细胞,每两天更换一次培养基并补加抗生素,待未感染慢病毒的mdck细胞全部死亡,将感染孔存活细胞用胰酶消化,并传代到t25细胞瓶中,待其增殖。此细胞为疑似cas9表达阳性细胞。按照1个细胞/孔,铺入96孔板,选择在8μg/ml blasticidin抗生素下生长快速的细胞进行扩大,即为疑似cas9表达阳性的细胞系。
[0077]
使用裂解液提取疑似正确的细胞系总蛋白,用g250测定蛋白的浓度。配制8%的sds-page胶,加入约100μg的蛋白在80v、120v的条件下分别电泳30min和90min。电泳完毕后,使用100v的条件湿转转膜90min。用2%bsa blocking buffer室温轻摇封闭60min,根据cas9蛋白大小以及β-actin蛋白大小将膜剪成两部分,分别加各自一抗cas9(7a9-3a3)mouse mab和β-actin(13e5)rabbit mab,室温孵育120min。用含0.05%tween-20的tbs洗膜3次后,分别加二抗anti-mouse igg(whole-molecule)-peroxidase和anti-rabbit igg(whole-molecule)-peroxidase,室温轻摇孵育60min。使用tbst洗膜5次以清洗掉多余的抗体,再用ecl化学发光试剂盒显色。显色结果为阳性的样品对应的细胞即为稳定表达cas9的mdck细胞系cas9-mdck(图8)。
[0078]
2.靶向slc35b2第二外显子的突变质粒lentiguide-sgrna slc35b2的构建
[0079]
(1)靶向slc35b2基因第二外显子sgrna序列的设计、合成
[0080]
a.根据位于犬第12号染色体(第12号染色体的序列登入于ncbi,其登入号为gene id:481819)上481819的序列,即slc35b2的第二个外显子序列,设计了靶向突变的sgrna序列为gctcagaccgcgaagtcaga。
[0081]
b.在靶向突变的sgrna序列的两端补充bsmbi酶切后的粘性末端,合成序列如下:
[0082]
d-slc35b2-sgrna-f:5
’‑
caccgctcagaccgcgaagtcaga-3’,
[0083]
d-slc35b2-sgrna-r:5
’‑
aaactctgacttcgcggtctgagc-3’;
[0084]
(2)携带靶向slc35b2的sgrna慢病毒载体构建
[0085]
c.将序列d-slc35b2-sgrna-f和d-slc35b2-sgrna-r按照如下体系,在37℃反应30min,95℃反应5min,-95℃-25℃梯度降温磷酸化退火(-0.3℃/s,每降落5℃维持温度1min)进行磷酸化、退火,即为靶向slc35b2第二外显子的突变mut-slc35b2。
sgrna slc35b2按照2:3:5,质粒总量按照3μg转染细胞;转染8小时后换液,收集转染48h和转染72h的细胞培养上清,于4
℃
、按照12000转/min、离心10分钟后,收集上清,即为含有慢病毒lentiguide-sgrna slc35b2的溶液。
[0098]
(2)cas 9-mdck细胞puromycin抗生素最小杀死浓度筛选
[0099]
将cas 9-mdck细胞铺至6孔板中,加入不同浓度的puromycin抗生素,并做3个重复,筛选出在7天时间内能够杀死全部细胞的最低浓度,并将此浓度定为后期筛选cas9-mdck细胞的敏感浓度,实验中测试到的cas9-mdck细胞的敏感浓度为2.0μg/ml。
[0100]
表2:puromycin对cas9-mdck细胞最低致死浓度
[0101][0102]
注释:-:细胞0%死亡, :细胞约20%死亡, :细胞约40%死亡, :细胞约60%死亡, :细胞约80%死亡, :细胞100%死亡。
[0103]
(3)包含slc35b2基因突变的混合细胞的构建
[0104]
将步骤1得到cas 9-mdck细胞传代入6孔板中,以完全培养基和收集的慢病毒lentiguide-sgrna slc35b2按体积比为1:1加入6孔板中,细胞培养24h后,换新鲜完全培养基。
[0105]
将感染慢病毒lentiguide-sgrna slc35b2的cas9-mdck细胞与未感染慢病毒的cas9-mdck细胞分别铺入6孔板中,根据cas9-mdck细胞对puromycin抗生素敏感浓度,加入2μg/ml puromycin抗生素筛选阳性细胞,待未感染组细胞全部死亡,将存活的感染组细胞传代,即为疑似包含slc35b2基因突变的混合细胞。
[0106]
4.利用t7e1检测感染慢病毒lentiguide-sgrna slc35b2的cas9-mdck细胞是否存在基因突变
[0107]
分别提取混合细胞与mdck野生型细胞的基因组,根据slc35b2基因组序列设计引物slc35b2-genome-f和slc35b2-genome-r扩增slc35b2基因第二个外显子所在基因组序列,并进行琼脂糖凝胶电泳回收大小为651bp的目的片段。
[0108]
slc35b2-genome-f:5'-aagccctttccagagtcatggacg-3',
[0109]
slc35b2-genome-r:5'-aaagaggcaaaaacaagacagcaa-3'
[0110]
将野生型与突变型片段回收产物在下表体系中,在37℃反应30min,95℃反应5min,95℃-25℃梯度降温磷酸化退火(-0.3℃/s,每降落5℃维持温度1min)。
[0111][0112]
将上述变性并缓慢退火后的片段如下体系,在37℃反应1h进行t7e1酶切反应,并将反应产物在浓度为2%的琼脂糖凝胶中进行电泳,切割后能产生377bp和274bp条带的样品对应的细胞即为slc35b2突变mdck细胞与野生型的混合细胞。(图10)。
[0113][0114]
5.slc35b2功能失活mdck细胞系mdck-koslc35b2的筛选和鉴定
[0115]
将slc35b2基因突变的细胞系利用有限稀释法进行单克隆,将细胞按照1个细胞/孔铺入96孔板中,选择单细胞克隆的孔进行扩大培养。并将增殖出的单克隆细胞选取一株提取基因组,并用引物slc35b2-genome-f和slc35b2-genome-r扩增slc35b2基因第二外显子所在基因组片段,并回收,将此片段在16℃反应12h连接到pmd-18t vector载体上,并用通用引物m13r-48和m13f-47测序;测序结果显示,slc35b2基因的20个单克隆在pam区域,存在两种情况的突变,其位于slc35b2基因序列上的12857085-12857093的位点间缺失七个碱基tctgact,造成该基因不能正确表达;另外一个染色体上slc35b2基因的第二段外显子基因序列上12857081-1285799的位点间缺失十七个碱基ggtccctctgacttcgc,造成该基因不能正确表达,从而达到敲除slc35b2基因的目的(图11);确定得到slc35b2功能失活的mdck-koslc35b2细胞系。
[0116]
实施例2 slc35b2基因回补细胞系mdck-ko c slc35b2的构建
[0117]
为验证cav-2在感染mdck-ko slc35b2细胞系中延缓细胞死亡的表型确实是由slc35b2基因敲除导致的,在此基因敲除细胞系基础上构建slc35b2回补细胞系,感染cav-2观察细胞死亡表型能否回复。
[0118]
1.slc35b2基因回补质粒的构建
[0119]
构建策略为以犬肝脏为模板扩增目的序列slc35b2,目的序列前端加入酶切位点bamhi ggatcc,起始密码子atg前加kozak序列gccacc来增强真核基因的翻译效率,目的序列末端终止密码子前加入flag标签及酶切位点ecori gaattc。sgrna所在位置ngg附近氨基酸突变为同义氨基酸,获得slc35b2基因回补序列c slc35b2 1341bp。bamhi及ecori双酶切pretrox-tet-3g载体,回收7372bp载体条带,连接目的条带与载体条带,构建为pretrox-c slc35b2-flag逆转录病毒质粒。
[0120]
slc35b2-tb-f1:
[0121]
5'-cgggatccgccaccatggacgccaggtggtgggcagtgg-3';
[0122]
slc35b2-tb-r1:5'-gcgaagtcaggggcacctcgtcaga-3';
[0123]
slc35b2-tb-f2:5'-tctgacgaggtgcccctgacttcgc-3';
[0124]
slc35b2-tb-r2:5'-cggaattctcacttatcgtcgtcatccttgtaatcaactt tttgcacaggggactcc-3';
[0125]
pretrox-tet3g载体的酶切及回收
[0126]
酶切反应体系
[0127][0128]
片段与载体酶切连接体系如下:
[0129]
酶切连接体系
[0130][0131][0132]
4℃连接过夜。挑菌鉴定,测序获得pretrox-c slc35b2-flag逆转录病毒质粒。
[0133]
2.pretrox-c slc35b2-flag逆转录病毒的包装
[0134]
将gp2-293细胞接种到6孔板,待细胞密度达70%时即在gp2-293中转染pretrox-c slc35b2-flag、vsvg质粒,按照1:1比例,质粒总量按照3μg转染;使用转染试剂聚乙烯亚胺(polyethylenimine,pei)进行转染,转染8小时后换液,收集转染48h和转染72h的细胞培养上清,于4℃、12000转/min、离心10分钟后,收集上清用0.45μm滤器过滤,即为含有逆转录病毒pretrox-c slc35b2-flag的溶液。
[0135]
3.mdck细胞g418抗生素最小杀死浓度筛选
[0136]
将mdck细胞铺至6孔板中,加入不同浓度的g418抗生素,并做3个重复,筛选出在7天时间内能够杀死全部细胞的最低浓度,并将此浓度定为后期筛选mdck细胞的敏感浓度,
koslc35b2细胞系更适合犬腺病毒载体的增殖,增殖滴度可提高约10倍。表明该细胞可提高腺病毒载体的增殖滴度,节约生产成本,从而提高生产效率。
[0151]
表4:细胞上清病毒含量测定
[0152]
细胞阳性孔占比10-1
10-2
10-3
10-4
10-5
10-6
reed-muenchtcid
50
mdck-wt 0h4/80/80/80/80/80/81mdck-wt 24h8/88/84/80/80/80/83mdck-wt 48h8/88/88/88/82/80/84.75mdck-wt 72h8/88/88/86/82/80/84.5mdck-koslc35b2 0h4/80/80/80/80/80/81mdck-koslc35b2 24h8/88/88/84/80/80/84mdck-koslc35b2 48h8/88/88/88/82/80/84.75mdck-koslc35b2 72h8/88/88/88/88/82/85.75mdck-ko c slc35b2 0h4/80/80/80/80/80/81mdck-ko c slc35b2 24h8/88/84/80/80/80/83mdck-ko c slc35b2 48h8/88/88/88/80/80/84.5 10-4.5
/0.1mlmdck-ko c slc35b2 72h8/88/88/88/80/80/84.5 10-4.5
/0.1ml
[0153]
其它未详细说明的部分均为现有技术。尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。