1.本发明属于作物繁育技术领域,具体涉及一种半夏人工种茎的快速繁殖方法。
背景技术:
2.半夏pinellia ternata(thunb.)breit.是天南星科多年生草本植物,是一种传统的中药材,以块茎入药,具有燥湿化痰、降逆止呕、消痞散结之功效。据统计,在558种中药处方中,半夏的使用频率位居第22位,近年来的研究还发现,半夏也有抗肿瘤的作用。随着人们对中成药需求的逐渐增加,半夏的野生资源已不能满足市场需求,目前市场上的半夏多为人工栽培提供。甘肃省西和县被农业部评为“中国半夏之乡”,总产量约占国内市场份额的2/3。西和半夏是半夏中的精品,具有粒大、色白、淀粉含量高和药用价值高等特性。生产中半夏采用块茎和珠芽进行无性繁殖方式,不仅播种量很大,繁殖系数也不高,生产成本很高。近年来西和半夏多从外地调种,导致生产中外来病虫草害在西和县集聚,田间发病率高,减产严重。同时,长期的无性繁殖使得病毒在植株中大量积累,抑制植株的正常生长,使其种茎逐年衰退,严重影响了半夏的产量和品质。利用组织培养技术,可以快速繁殖半夏优良品种,提高半夏繁殖系数,降低生产成本和土地压力,是半夏高效栽培的可行途径。有关半夏组织培养的研究报道较多,但多数研究报道中半夏的离体块茎均先通过诱导愈伤组织、丛生芽或一团类原球茎,然后再进一步诱导分化出试管块茎,存在激素浓度高、步骤复杂、试管块茎形态不完整、大小不均匀、遗传不稳定、形态发生能力的降低和甚至丧失等问题,再加之试管苗移栽需要炼苗程序复杂,影响了半夏试管苗在生产实践的应用。
技术实现要素:
3.本发明的目的是提供一种半夏人工种茎的快速繁殖方法,以解决上述问题。
4.为了达到上述目的,本发明采用的技术方案为:一种半夏人工种茎的快速繁殖方法,包括如下步骤:步骤一、萌发:将三叶半夏的块茎播于蛭石与草木灰1:1比例的营养土中萌发得到半夏植株;步骤二、选择外植体并消毒:将步骤一得到的半夏植株取总叶柄和块茎作为外植体,(1)将总叶柄切成1-2cm小段,用75%乙醇处理10s,0.1%升汞中加1滴吐温80后处理5min,2%次氯酸钠处理8min,无菌水冲洗3次;(2)将块茎切成0.3-0.4cm厚的薄片,用清水洗净后,用灭过菌的打孔器钻取块茎内部,并切去两端带皮的部分,用75%乙醇处理10s,0.1%升汞加1滴吐温80后处理5min,无菌水冲洗3次;步骤三、初代培养和诱导萌发:将步骤二得到的外植体分别平放到初代培养基中培养,先在弱光条件下诱导总叶柄的一端和块茎薄片上产生小块茎,再将小块茎置于中强光条件下诱导萌发得到试管苗;
步骤四、准备继代培养叶柄:取试管苗,剪下茎叶,取茎叶中的叶柄;步骤五、叶柄继代培养:将得到的叶柄切成0.5-2cm的小段接种到继代培养基中,先在弱光条件下诱导叶柄产生小块茎,再将小块茎置于中强光条件下萌发得到试管苗,剪下茎叶,取茎叶中的叶柄,保留小块茎,取下的叶柄重复本步骤;步骤六、小块茎二次成苗:向步骤五保留的小块茎的培养瓶中添加液体培养基,小块茎二次萌发得到试管苗;步骤七、人工种茎培育及播种:将步骤六得到的试管苗剪去茎叶,取茎叶中的叶柄,切成1.0cm小段,平放于种茎诱导培养基中,置于25℃、弱光条件的人工气候箱中培养,得到形态完整的小块茎,经萌发成苗后,剪下茎叶后将小块茎从培养瓶中取出,于室温下晾干块茎的根和剩余叶柄,得到人工种茎,将人工种茎播种于蛭石中发芽成苗。
5.为了进一步实现本发明,步骤三、步骤五和步骤七中所述弱光条件的光照时长为12-16h/d,光强为500-1000lx。
6.为了进一步实现本发明,步骤三和步骤五中所述中强光条件的光照时长为12-16h/d,光强为2000-3000lx。
7.为了进一步实现本发明,步骤六中所述的试管苗重复步骤四至步骤七。即小块茎二次成苗得到的试管苗重新进入步骤四剪下茎叶并取得叶柄,然后进入步骤五叶柄继代培养及后续步骤,并重复若干次。
8.为了进一步实现本发明,步骤七中所述的小块茎经萌发成苗后,剪下茎叶,取茎叶中的叶柄,重复步骤五至步骤七。即形态完整的小块茎萌发得到的苗剪下茎叶取得的叶柄,也可以重新进入叶柄继代培养及后续步骤,并重复若干次。
9.为了进一步实现本发明,步骤三中所述初代培养基配方为1/2ms 0.1mg/l 6-ba 0.01mg/l naa 3wt%蔗糖 0.8wt%琼脂,ph5.8。
10.为了进一步实现本发明,步骤五中所述继代培养基配方为1/2ms 0.01mg/l 6-ba 0.001mg/l naa 3wt%蔗糖 0.8wt%琼脂,ph5.8;为了进一步实现本发明,步骤六中所述的液体培养配方为1/2ms 3wt%蔗糖,ph5.8。
11.为了进一步实现本发明,步骤七中所述种茎诱导培养基配方为1/2ms 3wt%蔗糖 0.8wt%琼脂,ph5.8。
12.本发明相较于现有技术的有益效果为:本发明以叶柄为繁殖材料,直接诱导产生试管块茎并萌发成苗。在继代繁殖时采用低无机盐、低激素浓度培养基,可促使叶柄形成块茎及茎叶抽出的时间更早,缩短继代时间,提高了繁殖效率,增殖倍数达9.2。
13.为了提高繁殖的效率,在剪去叶柄用于继代繁殖的同时,向培养瓶中直接添加液体培养基,促使块茎的二次萌发成苗,二次成苗仅需15d,不仅操作简便易行,可提高繁殖效率,增殖倍数达2.99,总增殖倍数达12.19。
14.本发明采用二次成苗的叶柄诱导产生一个形态完整的块茎,经萌发成苗,块茎进一步长大成熟,可作为人工种茎使用,萌发率高达100%。
15.本发明设计的植株再生的途径是在低激素浓度下诱导叶柄一端直接产生形态完整的小块茎,与自然条件下珠芽产生的部位和的形态十分相似。块茎发生不经过愈伤组织阶段,遗传稳定性高,能够保持优良品种的特征特性,是半夏离体快速繁殖的最佳途径。同时,培养基中无机盐浓度降低,添加的激素浓度极低,生产成本大大降低。此外,经二次成苗的健壮叶柄,可直接诱导产生形态完整的小块茎,再次萌发成苗后,块茎明显长大,由此获得成熟饱满人工种茎,直接播种可以在土壤中萌发形成小植株,可省去试管苗诱导生根和驯化等步骤,便于实践操作和规模化生产,是理想的播种材料,具有广阔的生产应用前景。同时也克服了用体细胞胚制作人工种子中存在的体细胞胚发生率低、筛选难和萌发率低的难题。离体块茎具有较强的抗逆性、耐贮藏,不需特殊驯化可直接移栽于大田,成活率高,生产不受季节限制。本发明建立了增殖倍数高,遗传稳定,生产成本低的半夏快速繁殖技术体系,可为半夏工厂化育苗提供技术支撑。
附图说明
16.图1为本发明中bx
②
培养基中不同外植体诱导获得的试管苗生长状况的照片,其中,a.川子半夏块茎、b.总叶柄、c.小叶柄、d.佛焰苞中部、e.佛焰苞下部、f.珠芽;图2为本发明中不同培养基中块茎诱导获得的试管苗生长状况的照片,其中,a.bx
①
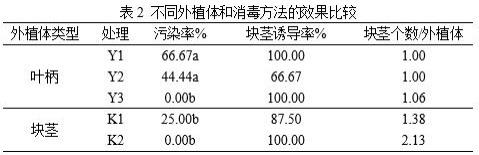
;b.bx
②
;c.bx
④
;图3为本发明中不同培养基中总叶柄诱导获得的试管苗生长状况的照片,其中,a.bx
①
;b.bx
②
;c.bx
④
;图4为本发明中不半夏同长度总叶柄诱导离体块茎诱导情况的照片,其中,a.2cm;b.1cm;c.0.5cm;d.0.2cm;图5 离体块茎的二次成苗情况,其中,a.200 mg/l水解酪蛋白;b.500 mg/l水解酪蛋白;c.200mg/l谷氨酰胺;d 1/2ms液体培养基;图6为本发明中人工种茎培育和播种生长状态的照片,其中,a.离体块茎诱导;b.人工种茎;c.人工种茎播种。
具体实施方式
17.下面结合附图和具体实施方式对本发明做进一步说明。
18.一种半夏人工种茎的快速繁殖方法,包括如下步骤:步骤一、萌发:将三叶半夏的块茎播于蛭石与草木灰1:1比例的营养土中萌发得到半夏植株;步骤二、选择外植体并消毒:将步骤一得到的半夏植株取总叶柄和块茎作为外植体,(1)将总叶柄切成1-3cm小段,用75%乙醇处理10s,0.1%升汞中加1滴吐温80后处理5min,2%次氯酸钠处理8min,无菌水冲洗3次;(2)将块茎切成0.3-0.4cm厚的薄片,用清水洗净后,用灭过菌的打孔器钻取块茎内部,并切去两端带皮的部分,用75%乙醇处理10s,0.1%升汞加1滴吐温80后处理5min,无菌
水冲洗3次;步骤三、初代培养和诱导萌发:将步骤二得到的外植体分别平放到初代培养基中培养,初代培养基配方为1/2ms 0.1mg/l 6-ba 0.01mg/l naa 3wt%蔗糖 0.7wt%琼脂,ph5.8,先在弱光条件下诱导总叶柄的一端和块茎薄片上产生小块茎,弱光条件的光照时长为12-16h/d,光强为500-1000lx,再将小块茎置于中强光条件下诱导萌发得到试管苗,强光条件的光照时长为12-16h/d,光强为2000-3000lx;步骤四、准备继代培养叶柄:取试管苗,剪下茎叶,取茎叶中的叶柄;步骤五、叶柄继代培养:将得到的叶柄切成0.5-2cm的小段接种到继代培养基中,继代培养基配方为1/2ms 0.01mg/l 6-ba 0.001mg/l naa 3wt%蔗糖 0.7wt%琼脂,ph5.8,先在弱光条件下诱导叶柄产生小块茎,弱光条件的光照时长为12-16h/d,光强为500-1000lx,再将小块茎置于中强光条件下萌发得到试管苗,强光条件的光照时长为12-16h/d,光强为2000-3000lx,剪下茎叶,取茎叶中的叶柄,保留小块茎,取下的叶柄重复本步骤;步骤六、小块茎二次成苗:向步骤五保留的小块茎的培养瓶中添加液体培养基,液体培养配方为1/2ms 3wt%蔗糖,ph5.8,小块茎二次萌发得到试管苗;步骤七、人工种茎培育及播种:将步骤六得到的试管苗剪去茎叶,取茎叶中的叶柄,切成1.0cm小段,平放于种茎诱导培养基中,种茎诱导培养基配方为1/2ms 3wt%蔗糖 0.7wt%琼脂,ph5.8,置于25℃、弱光条件的人工气候箱中培养,弱光条件的光照时长为12-16h/d,光强为500-1000lx,得到形态完整的小块茎,经萌发成苗后,剪下茎叶后将小块茎从培养瓶中取出,于室温下晾干块茎的根和剩余叶柄,得到人工种茎,将人工种茎播种于蛭石中发芽成苗。
19.其中,步骤六中的试管苗重复步骤四至步骤七。
20.其中,步骤七中的小块茎经萌发成苗后,剪下茎叶,取茎叶中的叶柄,重复步骤五至步骤七。
21.试验材料:三叶半夏pinellia ternata(thunb.)breit.的块茎采集于甘肃省清水县。块茎播于蛭石与草木灰1:1比例的营养土中,以萌发后植株的叶柄、珠芽和佛焰苞作外植体。
22.试验方法:一、初代培养1、外植体消毒试验
将总叶柄按表1中的三种方法消毒,将消毒后的总叶柄切成1-1.5cm的小段,接种到1/2ms培养基中。将块茎用清水洗净,用灭过菌的打孔器钻取块茎内部,切去两端带皮的部分,然后采用表1中块茎的两种方法消毒,将消毒后的块茎切成0.3-0.4cm的小片接种在1/2ms 3%蔗糖 0.8%琼脂,ph5.8的培养基中培养,筛选适宜的消毒方法。
23.从表2可看出,叶柄消毒方法中y3处理的污染率最低为0,即叶柄以75%乙醇10s
→
0.1%升汞5min(1滴吐温80)
→
2%次氯酸钠8min
→
无菌水冲洗3次为最佳消毒方法,块茎诱导率为100%。处理y1和y2的污染率分别为66.67%和44.44%。由此说明,仅使用75%乙醇和升汞消毒效果不理想,尽管升汞消毒的时间较长达10min。75%乙醇、升汞配合使用双氧水,污染率也很高。叶柄的消毒方法也适用于佛焰苞和叶片采用。在块茎消毒预实验时发现,块茎生长于地下,表面带菌量多,直接进行消毒污染率为100%。采用打孔器钻取内部的组织,切去两端表皮再进行消毒,污染率为0。即块茎以75%乙醇10s
→
0.1%升汞5min(1滴吐温80)
→
无菌水冲洗3次的消毒方式最佳,块茎诱导率为100%。
24.注:同列内不同字母表示经新复极差法检验在p《0.05水平差异显著,下同。
25.2、外植体的筛选将消毒好的块茎切成0.3-0.4cm厚的薄片,总叶柄、小叶柄、佛焰苞中部、佛焰苞下部切成1-2cm的小段,接种到1/2ms 6-ba 0.1mg/l naa 0.01mg/l 3%蔗糖 0.8%琼脂培养基(bx
②
)培养,筛选适宜的外植体。
26.以bx
②
为诱导培养基,以块茎、总叶柄、小叶柄、佛焰苞中部、佛焰苞下部、珠芽为外植体诱导产生试管块茎。由表3得知,块茎、总叶柄、小叶柄、佛焰苞下部之间试管块茎诱导率不存在显著性差异,其中总叶柄和佛焰苞下部诱导率高达100%。总叶柄、块茎、佛焰苞下部与佛焰苞中部和珠芽间块茎诱导率存在显著性差异。从试管块茎的诱导数量来看,总叶柄最多,为8.50个,其次是块茎7.58个,两者间并无显著性差异。结合诱导率和块茎数量两个指标分析,块茎和总叶柄是最佳的外植体。总叶柄和小叶柄诱导的试管块茎萌发后的长势健壮,块茎的长势一般(见图1)。块茎和总叶柄均可作为半夏组织培养适宜的外植体来源。
27.注:同列内不同字母表示经新复极差法检验在p《0.05水平差异显著,下同。
28.3、初代培养基的筛选以总叶柄和块茎为外植体,接种到ms 6-ba 2.0mg/l naa 0.1mg/l 3%蔗糖 0.8%琼脂培养基(bx
①
);bx
②
;ms 6-ba 0.5mg/l iaa 0.5mg/l 5%蔗糖 0.8%琼脂(bx
④
)培养基中培养,筛选适宜的初代培养基。
29.选用块茎和小叶柄为外植体,比较bx
①
、bx
②
、bx
④
培养基间诱导产生试管块茎的情况(见图2和3)。从表4可以看出,综合块茎诱导率、块茎个数及生长势各指标,对比分析三种培养基的诱导效果,不同培养基对半夏试管块茎诱导率有显著性差异。培养基bx
①
和bx
②
中块茎、总叶柄和小叶柄诱导效果显著优于bx
④
培养基。虽然bx
①
与bx
②
激素浓度差异很大,但诱导效果差异不显著,其原因可能是激素配比对诱导试管块茎的影响很大。从再生植株的遗传稳定性和生产成本考虑,以低浓度激素配比培养基1/2ms 6-ba 0.1mg/l naa 0.01mg/l 3%蔗糖 0.8%琼脂(bx
②
)为宜。高浓度激素处试管块茎数量多但个头小,形态不完整连成一体,伴随产生很多芽突,可能造成试管块茎遗传不稳定及形态发生能力的降低甚至丧失。
30.二、继代培养:1、不同长度的总叶柄对半夏试管块茎诱导的影响试验将总叶柄切成2cm、1cm、0.5cm、0.2cm四个长度的小段,接种到1/2ms 3%蔗糖 0.8%琼脂,ph5.8培养基中筛选适宜的外植体大小。
31.由表5可知,总叶柄的长度对试管块茎诱导影响显著。2cm、1cm和0.5cm长总叶柄半夏块茎的诱导率均为100%。总叶柄长0.2cm时,仅在叶柄表面产生很多米粒状突起,试管块茎的诱导率和块茎数量均为0。从诱导产生的块茎数量来看,2cm、1cm和0.5cm长总叶柄间无显著性差异,但从诱导产生的块茎的大小上来说,2cm和1cm总叶柄诱导产生的直径大于0.4cm的块茎数量最多,平均为0.92个,0.5cm叶柄仅有0.33个;2cm长度诱导产生的0.3~0.4cm块茎有1.75个,1cm叶柄有1.25个,此外,1cm叶柄还诱导产生0.2~0.3cm块茎1个。因此,1cm总叶柄诱导产生块茎的数量最多,平均为3.17个,个头较大,与2cm叶柄诱导效果差异不显著。为了提高继代扩繁的增殖倍数,接种用总叶柄的长度应为1cm。由表5可知,在
0.5cm~2cm范围内,虽然块茎诱导率都高达100%,但随着叶柄长度的增加,诱导产生的大块茎的数量增多,其原因可能是外植体越大,内源激素和营养物质含量越多,越有利于产生更多的大块茎,总叶柄太短时外植体失去形态发生能力(见图4)。因此,为了提高繁殖效率,宜选用1cm长叶柄作繁殖材料。
32.2、不同激素浓度配比对继代增殖的影响试验:以初代培养获得的试管苗的小叶柄为外植体,接种在1/2ms基本培养基,附加不同浓度的ba和naa,添加3%蔗糖和0.8%琼脂,ph5.8,筛选适宜的继代培养基(见表6和表7)。浓度的ba和naa,添加3%蔗糖和0.8%琼脂,ph5.8,筛选适宜的继代培养基(见表6和表7)。
33.以半夏总叶柄1cm小段为外植体,将其接种在添加6种不同浓度ba和naa配比的1/2ms培养基上,筛选适宜的继代培养基。由表7可以看出,ba0.01mg/l和naa0.001mg/l激素组合的试管苗生长健壮,块茎诱导率最高达100%,增殖倍数最高,与其它处理差异显著。因此,在半夏继代扩繁时选用ba0.01mg/l和naa0.001mg/l激素浓度配较佳。
34.3、二次成苗对继代增殖速率的影响:将表7中的最佳处理的试管苗地上部分全部剪掉(只剩小块茎),在培养瓶中直接添加1/2ms液体培养基或1/2ms液体培养基附加50、200、500、1000mg/l水解酪蛋白或将试管块茎转接到新的1/2ms培养基固体、并定期观察成苗情况。由表9可知,叶柄粗和平均叶柄长各处理之间差异不显著,说明二次成苗的植株均较健壮,植株高矮相当,但每块茎叶柄数和增殖倍数以转接至含3%蔗糖的1/2ms固体培养基上最高,直接向原培养瓶中添加含3%蔗糖的1/2ms液体培养基与其无显著性差异,添加培养液约4d后块茎开始长出新芽,15d后成苗(见表8)。向原有培养基中添加含3%蔗糖的1/2ms液体培养基可减少转接过程,减少污染,和琼脂用量,节约成本。因此,二次成苗的最佳方法是在原有培养基中添加含有3%蔗糖的1/
2ms的液体培养基。此外,二次成苗的植株明显较一次成苗的植株生长健壮,可用来诱导获得饱满的人工种茎。得饱满的人工种茎。
35.4、蔗糖浓度对块茎诱导和成苗的影响:将叶柄段接种在含有1%、3%、5%、7%和9%的不同浓度蔗糖的1/2ms培养基中,先进行遮光培养,待块茎成熟后(可见明显茎尖)在进行光照培养。定期观察试管块茎的形成及成苗情况。
36.叶柄接种4d后,一端开始轻微膨大;接种6后明显膨大;接种14d后形成小圆球;接种19d后开始形成芽点,接种25d后有茎尖长出;接种40d后叶片开始生长;60d后块茎长成组培苗。不同蔗糖浓度生长状况以及变化的叶柄数如表10所示。由表10和11可以看出含1%蔗糖的培养基中块茎形成较为缓慢,但其成苗速度快,且平均每个块茎抽出的叶柄数最多,为3.47个,较其他处理具有明显差异,但1%蔗糖于3%蔗糖的叶柄长度不存在显著差异,且均较其它处理叶柄长度大。由每月增殖倍数来看,1%蔗糖增殖倍数最高,为7.38,显著高于其它蔗糖浓度,因此,在半夏组织培养快速繁殖时,最佳的蔗糖浓度为1%。
37.5、继代增殖倍数继代培养由叶柄诱导产生块茎及试管苗,约需45d时间,二次成苗需15d时间,即60d叶柄继代的增殖倍数为24.4,平均每个月的增殖倍数达12.19,能够达到植物快速繁殖的标准。
38.三、人工种茎培育及播种试验将二次成苗的健壮叶柄切成1.0cm的小段,平放于接种在1/2ms 3% 蔗糖 0.7%琼脂,ph5.8培养基上,置于为25℃,光照时间12h/d,光强为500lx的人工气候箱中培养。培养约35d左右小叶柄下端产生了一个独立完整的试管块茎。增加光强至2000lx培养萌发成苗后,剪去茎叶,从培养瓶中取出,于室温下晾干块茎的根和剩余叶柄,即得成熟饱满人工种茎。试验所得的试管块茎无需炼苗,直接播种于蛭石中,萌发率高达100%,小苗生长健壮。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。