1.本发明属于动物细胞培养技术领域,具体涉及一种黄鳍鲷肌肉组织细胞系及其应用。
背景技术:
2.神经坏死病毒(nervous necrosis virus,nnv)是一种单链rna病毒,能引起鱼类病毒性神经坏死病,是对海水鱼类危害重大的病原之一,具有传播性强、感染后果严重、传播途径多、传播范围广的特性。nnv对多种鱼类具有感染性,现今已感染全球120多种鱼类,对处于苗种生产期的仔鱼和幼鱼危害很大,严重者在一周内死亡率可达100%。nnv既可以从亲鱼向受精卵垂直传播感染,也能从养殖环境、饵料等水平传播感染,造成整体海域内鱼类的大规模感染,较强的致病力和死亡率给鱼类养殖业带来沉重打击。
3.神经坏死病毒的流行和蔓延,对鱼类的人工苗种生产往往造成严重打击,给养殖户造成了巨大的经济损失。为了进一步降低鱼类病毒性神经坏死病危害我国水产养殖业的风险,养殖人员需要一种高效检测nnv病毒的手段,研究人员需要培养大量的nnv用以研究与预防,而病毒的培养需要宿主细胞。因此,研究人员需要一种对神经坏死病毒相对敏感的宿主细胞。
技术实现要素:
4.为了解决上述技术问题,本发明以黄鳍鲷肌肉组织为对象,成功构建了黄鳍鲷肌肉组织细胞系ysbm,该细胞对神经坏死病毒具有较高敏感性,能够有效帮助研究人员研究和预防鱼类病毒性神经坏死病。
5.根据本发明的第一个方面,提供一种黄鳍鲷肌肉组织细胞系ysbm,该黄鳍鲷肌肉组织细胞系ysbm于2022年5月24日保藏在中国典型培养物保藏中心,地址为湖北省武汉市武昌区八一路299号武汉大学,保藏登记入册编号为cctcc no:c2022122。
6.本发明提供的黄鳍鲷肌肉组织细胞系ysbm对神经坏死病毒具有高敏感性,不仅能用于神经坏死病毒的检测,还能用于帮助研究人员探究神经坏死病毒,促进抗神经坏死病毒药物的研发,对海水鱼类养殖中神经坏死病毒的防控与治疗具有重大意义。
7.根据本发明的第二个方面,提供一种培养上述黄鳍鲷肌肉组织细胞系ysbm的培养基,培养基为完全培养基,且含有低于8vol%的血清。
8.本发明提供的ysbm细胞对血清具有低依赖性,在低于8vol%的血清浓度条件下,细胞增殖生长状况良好。即ysbm细胞增殖生长所需的血清用量可以减少,降低了研究人员在制备和传代时的血清成本。
9.根据本发明的第三个方面,提供一种上述黄鳍鲷肌肉组织细胞系ysbm的制备方法,包括以下步骤:
10.s1、原代培养:采用原代培养液对黄鳍鲷肌肉组织进行原代培养,获得黄鳍鲷肌肉组织原代细胞;s2、传代培养:采用完全培养液对黄鳍鲷肌肉组织原代细胞进行传代培养,
获得黄鳍鲷肌肉组织传代细胞;s3、筛选细胞:给原代和/或传代细胞接种神经坏死病毒,筛选出对nnv病毒敏感的细胞,即为保藏登记入册编号为cctcc no:c2022122的ysbm细胞。
11.本发明提供的制备方法可以制得ysbm细胞,该方法培养方法简单,原料来源易得,操作步骤简单,所需设备简单常规,生产周期短,技术相对简单易操作。此外,该方法制得的ysbm细胞具有生长迅速,可连续传代的特点。
12.优选地,原代培养液为含有18~25vol%胎牛血清、350~450iu/ml青霉素、350~450μg/ml链霉素的l15培养基。
13.优选地,s1中还包括先对黄鳍鲷肌肉组织预处理:取出黄鳍鲷肌肉组织后用漂洗液冲洗并浸泡,再剪切成组织块;其中,漂洗液包括l15培养液、950~1050iu/ml青霉素、950~1050μg/ml链霉素。
14.优选地,预处理还包括:在剪切过程中,加入预处理培养液保持组织块湿润;其中,预处理培养液包括l15培养基、350~450iu/ml青霉素、350~450μg/ml链霉素。
15.根据本发明的第四个方面,提供一种上述黄鳍鲷肌肉组织细胞系ysbm的保存方法,包括以下步骤:
16.s1、取处于对数生长期的黄鳍鲷肌肉组织细胞系ysbm,经胰酶消化后离心,得细胞沉淀物;s2、将细胞沉淀和细胞冻存液混合,重悬,得到冻存混合物;s3、将冻存混合物放入程序降温盒中,冷冻降温至-70~-90℃。
17.优选地,细胞冻存液为含有15~20vol%fbs、8~12vol%dmso的l15培养液。
18.优选地,保存方法的s3中还包括,在-70~-90℃冷冻后过夜,隔天放入液氮中长期保存。
19.根据本发明的第五个方面,提供一种上述黄鳍鲷肌肉组织细胞系ysbm的复苏方法,包括以下步骤:
20.s1、通过水浴加热融化经历液氮冻存的黄鳍鲷肌肉组织细胞系ysbm;s2、对已经解冻的黄鳍鲷肌肉组织细胞系ysbm与冻存混合物中的其他物料分离;s3、用完全培养液重悬黄鳍鲷肌肉组织细胞系ysbm,然后在28℃的条件下培养黄鳍鲷肌肉组织细胞系ysbm。
21.上述冻存及复苏方法能够有效维持ysbm细胞活性,延长使用周期,冻存后的ysbm细胞复苏率90%以上。实验人员无需每次使用前都重新制备且传代,可直接使用冻存后复苏细胞进行细胞实验,大大提高工作效率,减少工作量,节省试剂,提升实验室空间和资源的使用率。使实验人员可在任意时间进行细胞实验,不受细胞传代时间的限制。此外,ysbm细胞在筛选抗神经坏死病毒药物的应用中,使用复苏即可进行试验的ysbm细胞,可以保证药物筛选实验更具可信度,减少细胞不同批次间的差异,提高实验结果一致性,促进研究人员探究神经坏死病毒的防范和治疗。
22.根据本发明的第六个方面,提供上述黄鳍鲷肌肉组织细胞系ysbm的子细胞。
23.根据本发明的第七个方面,提供上述黄鳍鲷肌肉组织细胞系ysbm子细胞的制备方法,其特征在于,采用完全培养液对黄鳍鲷肌肉组织细胞系ysbm进行传代培养:传代至第5~10代时,令完全培养基中的血清含量为15vol%、青霉素浓度为100iu/ml、链霉素浓度为100μg/ml;传代至15~20代时,控制完全培养基中的血清含量为8~10vol%;传代至20代以上时,控制完全培养基中的血清含量低于8vol%。
24.根据本发明的第八个方面,提供上述黄鳍鲷肌肉组织细胞系ysbm和/或上述黄鳍
鲷肌肉组织细胞系ysbm的子细胞在神经坏死病毒敏感性检测中的应用,上述应用不包括在疾病诊断中的应用。
25.根据本发明的第九个方面,提供上述黄鳍鲷肌肉组织细胞系ysbm和/或上述黄鳍鲷肌肉组织细胞系ysbm的子细胞在神经坏死病毒检测中的应用,上述应用不包括在疾病诊断中的应用。
26.对比现有技术,本发明的有益效果如下:
27.1.本发明制备的ysbm细胞系生长迅速,培养方法简单,可连续传代,连续传代100次以上仍然可以正常生长,且对nnv具有高敏感性,可以供研究人员进行鱼类病毒性神经坏死病的研究和检测。
28.2.冻存后的ysbm细胞复苏率90%以上,复苏细胞能够贴壁并生长分裂,并可以正常传代,细胞形态与增殖能力同冻存前无明显差异。
29.3.常规的细胞系一般需要在8vol%以上的血清浓度下才能够生长良好,而本细胞系的细胞能在5vol%的血清浓度下生长良好。基于黄鳍鲷肌肉组织细胞系ysbm的血清低依赖性,研究人员在使用和制备该细胞时能够大大降低血清的使用成本。
附图说明
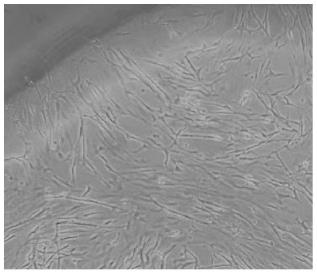
30.图1为黄鳍鲷肌肉组织原代培养细胞;
31.图2为黄鳍鲷肌肉组织细胞系ysbm第20代细胞;
32.图3为黄鳍鲷肌肉组织细胞系ysbm第80代细胞;
33.图4为黄鳍鲷肌肉组织细胞系ysbm转染pegfp-c1质粒;
34.图5为黄鳍鲷肌肉组织细胞系ysbm接种nnv后细胞病变情况,其中,左图为视野1,右图为视野2;
35.图6为电镜观察黄鳍鲷肌肉组织细胞系ysbm中病毒粒子;
36.图7为不同生长温度下黄鳍鲷肌肉组织细胞系ysbm第30代细胞的生长曲线;
37.图8为不同血清浓度下黄鳍鲷肌肉组织细胞系ysbm第30代细胞的生长曲线。
具体实施方式
38.为了使本技术领域的人员更好地理解本发明方案,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。
39.实施例1
40.细胞的制备与传代
41.在本实施例中,漂洗液包含l15培养液、1000iu/ml青霉素、1000μg/ml链霉素,ph值7.2~7.4。预处理培养液包括l15培养基、400iu/ml青霉素、400μg/ml链霉素,ph值为7.2~7.4。原代培养液包括l15培养基、20vol%胎牛血清、400iu/ml青霉素、400μg/ml链霉素,5ml/l的hepes,2.66g/l的nacl,ph值7.2~7.4。
42.(1)黄鳍鲷肌肉组织处理:取50g左右的鲜活黄鳍鲷,经pcr检测无神经坏死病毒感染,处死后用75%酒精短时浸泡鱼体,再用酒精棉球擦拭鱼体表进行消毒。在无菌条件下的超净工作台内解剖取肌肉组织,用漂洗液反复冲洗8~10次,浸泡于漂洗液,用解剖剪刀剪
成1mm3左右的组织块,剪切过程中,加入适量预处理培养液保持组织湿润。
43.(2)原代培养:将剪切好的组织小块用眼科镊送入培养瓶内,组织块间隔0.5cm为宜。然后向培养瓶内加入2ml培养基,盖好瓶盖,将培养瓶轻轻反转,瓶底朝上放置于培养箱中。每隔2~4天换一次培养基,换培养基的时候,吸走一半旧的培养基,再加入一半新的培养基。观察、记录细胞迁出情况,拍照;为补充新的营养,每2~3天按半量换液方式更换培养液,即得原代培养细胞。
44.(3)传代培养:细胞长至50~70%汇合度时,取细胞进行传代。向原代培养细胞加入0.25%胰酶室温下消化2~3min,使用完全培养液吹下贴壁细胞,将细胞悬液接种于2个培养瓶中28℃培养箱培养。以后每5~7天传代一次,传至第5~10代时,将细胞培养液中血清浓度降为15vol%,抗生素浓度降至正常使用浓度,即青霉素浓度为100iu/ml、链霉素浓度为100μg/ml;传至第15~20代时,将培养液中血清含量降至8~10vol%。传至50代时,培养基不需要添加抗生素。
45.结果表明:取原代培养细胞、第20代细胞、第80代细胞观察对比,结果如图1、图2、图3所示,可反映出连续传代的细胞仍然具有良好的生长状况,意味着本发明所述的细胞系培养方法简单,生长迅速,可连续传代。
46.实施例2
47.筛选出对神经坏死病毒敏感的ysbm细胞
48.待细胞接种铺满25cm2细胞瓶底壁后,接种病毒后,1小时后,移去病毒溶液,更换含3%胎牛血清的新鲜细胞培养液,继续培养,每天观察细胞病变。24小时后收样电镜观察病毒粒子。检测细胞对神经坏死病毒的敏感程度,从而能筛选出更为敏感的细胞,即得ysbm细胞。
49.实验结果:如图4、图5、图6所示,筛选出的ysbm细胞对神经坏死病毒比较敏感,因此可以供研究人员进行鱼类病毒性神经坏死病的研究和检测。
50.实施例3
51.细胞的冻存保种与复苏
52.细胞的冻存保种:分别取第20代、第40代、第60代、第80代的ysbm细胞中处于对数生长期的细胞,经胰酶消化后获得单细胞悬液,160g离心10min,弃掉上清液;向细胞沉淀中加入适量配置好的细胞冻存液,重悬,转移入1.8ml无菌冻存管中;将无菌冻存管放入程序降温盒中,-80℃冰箱过夜,隔天放入液氮中长期保存,所述细胞冻存液为含有15~20vol%fbs、10vol%dmso的l15培养液。
53.冻存细胞的复苏:将冻存管从液氮罐中取出,放入37℃水浴锅中快速摇晃至融化;然后在无菌条件下将解冻细胞转移至15ml离心管中,并加入适量完全培养液,160g离心5~10min,去除上清液,收集细胞;用完全培养液重悬细胞,转移至细胞培养瓶中,28℃培养箱中培养。
54.实验结果:如表1所示,不同代次细胞冻存后复苏率在90%以上,复苏细胞能够贴壁并生长分裂,并可以正常传代,细胞形态与增殖能力同冻存前无明显差异。
55.表1.不同代次的ysbm细胞冻存后的复苏率
[0056][0057][0058]
实施例4
[0059]
检测不同生长温度对细胞的生长情况
[0060]
取2.0
×
105个第30代细胞分别移至15、24、28℃培养。观察不同生长温度对细胞生长的影响,培养细胞于培养后1、3、5、7天用血球计数板进行细胞计数,绘制ysbm在不同温度下的生长曲线。
[0061]
实验结果:如图7所示,随着培养天数的变化,黄鳍鲷肌肉组织细胞系ysbm细胞浓度先增后减。当培养温度为28℃时,细胞生长情况最好,倍增时间最短,在其他温度下,黄鳍鲷肌肉组织细胞系ysbm均生长较为缓慢。所以黄鳍鲷肌肉组织细胞系ysbm的最优生长温度为28℃。
[0062]
实施例5
[0063]
检测不同血清浓度对细胞的生长情况
[0064]
在28℃下,取2.0
×
105个第30代细胞分别移至含有5vol%、10vol%、15vol%、20vol%fbs的培养基l15中,观察不同血清浓度对细胞生长的影响,所有培养细胞于培养后1、3、5、7天用血球计数板进行细胞计数,绘制细胞在不同培养条件下的生长曲线。
[0065]
实验结果:如图8所示,细胞在5vol%血清浓度培养基l15生长良好,其细胞生长密度与10vol%血清浓度相仿。因此,黄鳍鲷肌肉组织细胞系ysbm能在较低血清浓度下保持良好的生长状态。这种血清低依赖性大大降低了黄鳍鲷肌肉组织细胞系ysbm的血清使用成本。
[0066]
以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
