cd16 成纤维细胞在诊断、预防和治疗单克隆抗体耐药乳腺癌中的应用
技术领域
1.本发明涉及肿瘤分子生物学领域,更具体地,涉及cd16 成纤维细胞在诊断、预防和治疗单克隆抗体耐药乳腺癌中的应用。
背景技术:
2.乳腺癌已经成为全球发病率最高的恶性肿瘤。传统的乳腺癌治疗手段以手术、放疗、化疗及内分泌治疗为主。但是化疗在杀伤肿瘤的同时,损伤了机体的正常细胞,具有显著的副作用。近年来,单克隆抗体类药物(mab)的出现解决了这一难题。通过抗原-抗体的特异性结合,单克隆抗体类药物能够识别并结合肿瘤细胞独有的标志物,从而特异性杀伤肿瘤细胞而不损伤正常组织,不仅能够有效控制肿瘤,还大大减小了治疗的副作用,是肿瘤治疗领域的重大突破。目前,单克隆抗体药物已广泛应用于肿瘤、自身免疫病、移植物抗宿主反应等多种疾病中。
3.尽管单克隆抗体类药物为肿瘤治疗带来新希望,但仍有部分患者不能从治疗中获益。曲妥珠单抗是目前乳腺癌中应用最为广泛的单克隆抗体类药物,其针对的靶点是表皮生长因子受体2(human epidermal growth factor receptor 2,her2)。her2阳性乳腺癌患者约占乳腺癌总体人数的15%~30%,her2阳性乳腺癌具有浸润性强、进展快速、复发风险高和预后差等临床特点。针对her2分子的靶向治疗能够大大改善这部分患者的生存预后。但是,乳腺癌在患者中具有异质性这一特征,并非所有her2阳性患者都能够从抗her2靶向治疗中获益。对于靶向her2治疗反应较差的患者,这一治疗不仅延误宝贵的治疗时间,也带来了不必要的不良反应和治疗费用。值得注意的是,目前除了her2蛋白的表达量及基因扩增之外,尚无其他能够有效预测抗her2靶向治疗效果的分子标志物。单一的判断手段势可能会导致漏检、误检风险增大,无疑,这非常不利于为乳腺癌患者尽早制定正确的治疗策略,以延长患者的生存期。在目前治疗方案多样化的背景下,如何为患者制定个体化的治疗方案是乳腺癌治疗领域的重大挑战,因此,解决上述问题有重要的临床意义。
技术实现要素:
4.本发明旨在克服上述现有技术的至少一种不足,提供一种cd16 成纤维细胞在诊断、预防和治疗单克隆抗体耐药乳腺癌中的应用,通过cd16
成纤维细胞这一标志物,便于预测、诊断患者能否从抗her2靶向治疗中获益,且通过中和或敲低cd16抗原、以及干预乳腺癌细胞vav2的表达,能促进抗her2的单克隆抗体靶向治疗效果。
5.本发明的一个目的在于提供cd16
成纤维细胞作为乳腺癌单克隆抗体治疗耐药标志物的应用。
6.本发明的再一目的在于提供一种乳腺癌单克隆抗体治疗耐药标志物,为cd16
成纤维细胞。
7.本发明的又一目的在于提供cd16
成纤维细胞检测试剂在制备预测、诊断乳腺癌
单克隆抗体治疗耐药和/或预测乳腺癌单克隆抗体治疗疗效和/或预测乳腺癌患者无病生存期的产品中的应用。
8.进一步地,所述乳腺癌为her2阳性乳腺癌;和/或,所述单克隆抗体药物包括曲妥珠单抗和/或帕妥珠单抗。
9.进一步地,cd16
成纤维细胞检测试剂包含与cd16
成纤维细胞表面抗原cd16发生抗原抗体反应的抗体。更进一步地,还包括cd16
成纤维细胞提取试剂。
10.本发明的又一目的在于提供cd16
成纤维细胞在制备预测、诊断乳腺癌单克隆抗体治疗耐药和/或预后乳腺癌单克隆抗体治疗疗效和/或预测乳腺癌患者无病生存期的产品中的应用。
11.进一步地,所述产品包括cd16
成纤维细胞检测试剂盒。
12.本发明的又一目的在于提供一种预测、诊断乳腺癌单克隆抗体治疗耐药和/或预后乳腺癌单克隆抗体治疗疗效和/或预测乳腺癌患者无病生存期的试剂盒,包含与cd16
成纤维细胞表面抗原cd16发生抗原抗体反应的抗体。
13.本发明的又一目的在于提供乳腺癌结缔组织形成抑制剂在制备预防和/或治疗单克隆抗体耐药乳腺癌的产品中的应用。进一步地,乳腺癌结缔组织形成抑制剂包括cafcd16-syk-vav2-rhoa-mlc2-mrtf-a通路抑制剂;进一步地,cafcd16-syk-vav2-rhoa-mlc2-mrtf-a通路抑制剂包括cd16
成纤维细胞抗原cd16的抑制剂、syk抑制剂、vav2抑制剂、rhoa抑制剂、mlc2抑制剂和/或mrtf-a抑制剂;进一步地,cd16
成纤维细胞抗原cd16的抑制剂包括与cd16
成纤维细胞表面抗原cd16结合的中和抗体和/或cd16
成纤维细胞抗原cd16 shrna;和/或,syk抑制剂包括syk shrna;和/或,vav2抑制剂包括vav2 shrna;和/或,rhoa抑制剂包括rhoa shrna;和/或,mlc2抑制剂包括mlc2 shrna;和/或,mrtf-a抑制剂包括mrtf-a shrna。
14.本发明的又一目的在于提供一种预防和/或治疗单克隆抗体耐药乳腺癌的产品,包含乳腺癌结缔组织形成抑制剂。
15.进一步地,单克隆抗体药物包括曲妥珠单抗和/或帕妥珠单抗;进一步地,所述乳腺癌为her2阳性乳腺癌。进一步地,乳腺癌结缔组织形成抑制剂包括cafcd16-syk-vav2-rhoa-mlc2-mrtf-a通路抑制剂;进一步地,cafcd16-syk-vav2-rhoa-mlc2-mrtf-a通路抑制剂包括cd16
成纤维细胞抗原cd16的抑制剂、syk抑制剂、vav2抑制剂、rhoa抑制剂、mlc2抑制剂和/或mrtf-a抑制剂;进一步地,cd16
成纤维细胞抗原cd16的抑制剂包括与cd16
成纤维细胞表面抗原cd16结合的中和抗体和/或cd16
成纤维细胞抗原cd16 shrna;和/或,syk抑制剂包括syk shrna;和/或,vav2抑制剂包括vav2 shrna;和/或,rhoa抑制剂包括rhoa shrna;和/或,mlc2抑制剂包括mlc2 shrna;和/或,mrtf-a抑制剂包括mrtf-a shrna。
16.本发明的又一目的在于提供与cd16
成纤维细胞表面抗原cd16结合的中和抗体在制备预防和/或治疗单克隆抗体耐药乳腺癌的产品中的应用。
17.本发明的又一目的在于提供靶向cd16
成纤维细胞表面抗原cd16的shrna在制备预防和/或治疗单克隆抗体耐药乳腺癌的产品中的应用。
18.本发明的又一目的在于提供一种预防和/或治疗单抗类药物耐药乳腺癌的产品,包含与cd16
成纤维细胞表面抗原cd16结合的中和抗体和/或靶向cd16
成纤维细胞表面抗原cd16的shrna;进一步地,所述单抗类药物包括曲妥珠单抗和/或帕妥珠单抗;进一步地,
所述乳腺癌为her2阳性乳腺癌。
19.在本发明的一个以上实施例中,在乳腺癌患者肿瘤组织中首次发现一群cd16阳性的非白细胞,进一步分析证明这群细胞为肿瘤相关成纤维细胞(carcinoma-associated fibroblasts,cafs)。本发明人通过分析乳腺癌患者组织切片,发现与对曲妥珠单抗治疗敏感组患者相比,耐药组患者肿瘤标本中cd16
cafs的数目更多;并且,肿瘤组织中cd16
cafs的数目与患者的无疾病生存期显著负相关。在动物模型中,应用患者来源异种移植物(patient-derived xenograft,pdx)模型,本发明人发现cd16
cafs更多的pdxs对曲妥珠单抗的反应性更差。此外,接受乳腺癌细胞系及cd16
cafs共注射的小鼠,对曲妥珠单抗的反应性比cd16-cafs共注射的小鼠更差,并且这一现象在帕妥珠单抗的治疗中也得到了验证。因此,通过检测乳腺癌组织cd16
cafs的细胞数目,能够预测、诊断患者对单克隆抗体靶向治疗是否耐药。进一步地,本发明人还在实验中发现,在荷瘤的免疫缺陷小鼠中应用cd16的中和抗体后,能够提高小鼠对曲妥珠单抗治疗的反应性。在肿瘤细胞与成纤维细胞的共注射模型中,当成纤维细胞所表达的cd16被选择性敲除时,小鼠对曲妥珠单抗的治疗反应性升高。即通过靶向cd16
成纤维细胞及其下游通路,有利于逆转乳腺癌对单克隆抗体的耐药性,从而促进单克隆抗体耐药乳腺癌的治疗。
20.与现有技术相比,本发明的有益效果为:基于cd16
成纤维细胞在单克隆抗体敏感乳腺癌细胞、单克隆抗体耐药乳腺癌细胞中的不同分布情况,cd16
成纤维细胞可以作为一种标志物而应用于乳腺癌单克隆抗体耐药性的预测、诊断和/或乳腺癌单克隆抗体治疗疗效预测和/或乳腺癌患者无病生存期预测中,有助于及时判断不同个体的乳腺癌细胞是否有潜在单克隆抗体耐药性或已存在单克隆抗体耐药性,以便及时调整、给予适合的治疗策略,避免无效或低效果的靶向her2治疗,及时采用其他有效治疗策略,延长患者生存期。在本发明的一个以上实施例中,通过干预肿瘤细胞vav2的表达,可有效逆转cd16
成纤维细胞引起的耐药,改善乳腺癌个体对单克隆抗体的反应,提高乳腺癌对单克隆抗体治疗的敏感性,提高乳腺癌的抗her2靶向治疗效果,达到延长患者生存期的目的。
附图说明
21.图1显示:人类乳腺癌中fcγr表达细胞的综合概况。(a)流式细胞术分析人fcγrs(fcγri/cd64,fcγriia/cd32a,fcγriib/cd32b,fcγriic/cd32c和fcγriii/cd16)在cd45-群体和白细胞(包括cd3
t细胞,cd19
b细胞,cd56
nk细胞和从临床乳腺癌标本中分离的cd11b
髓样细胞)中的表达。(b)(a)(n=32)的量化。平均值
±
sem。(c)人乳腺癌组织中cd16和cd45免疫荧光染色的代表性图像(n=26)。星号表示左上角放大率较高的区域。比例尺,50μm。另请参见图9。
22.图2显示:cd16
成纤维细胞亚群与her2
乳腺癌患者的曲妥珠单抗耐药相关。(a)流式细胞术分析人乳腺癌组织中caf的cd16表达;首先对分离的细胞在前向(fsc)和侧向散射(ssc)门控以排除碎片,然后在fvd-、cd45-、epcam-、cd31-门控以分别排除死细胞、白细胞、肿瘤细胞和内皮细胞,并进一步分析cd16和pdgfrβ表达(n=68)。(b)cd16
caf(n=14)中αsma和fap水平的代表性流式细胞术图。数值表示平均值
±
sem。(c)在cd16
caf的荧光激活细胞分选(facs)之前和之后,cd16和αsma的代表性明场图像和免疫荧光染色。比例尺,50μm。(d)未经治疗的乳腺癌样本中,cd16和αsma染色的代表性免疫荧光图像。数字表示放大率
较高的区域,如右图所示。比例尺,50μm。(e)不同分子亚型的未接受新辅助治疗的患者乳腺癌组织中,每个显微镜高倍镜视野的cd16
caf数量。hr
her2-,激素受体阳性和her2阴性,n=488;her2
,her2阳性,n=231;tn,三阴性,n=95;通过kruskal-wallis检验,平均值
±
sem,*p《0.05,***p《0.001。(f)her2
乳腺癌患者无病生存的kaplan-meier曲线,在未行新辅助治疗的肿瘤中,对比cd16
cafs浸润低(≤9.1个细胞/视野)和高(》9.1个细胞/视野)的患者无病生存时间(n=231)。(g)曲妥珠单抗新辅助化疗之前(pre-)和之后(post-)的her2
乳腺癌样本中,每个视野的cd16
caf数量。病理完全缓解(pcr)、仅乳腺/淋巴结pcr或部分缓解(pr)的患者被归类为敏感(n=262),而疾病稳定(sd)或疾病进展(pd)的患者被归类为耐药(n=165)。mann-whitney u检验的平均值
±
sem,***p《0.001。另请参见图10。
23.图3显示:在患者来源的异种移植模型中,cd16
成纤维细胞损害曲妥珠单抗的功效。(a)在初始临床样品和从小鼠收获对应患者衍生的异种移植物(pdx)中,人αsma和cd16的h&e染色和免疫荧光染色的代表性图像。星号表示右下角放大倍数较高的区域。比例尺,50μm。(b)通过免疫荧光染色(n=16)定量患者原发肿瘤标本和对应pdxs中cd16
αsma
细胞的数量;ns,配对student’s t检验差异不显著。(c)通过免疫荧光染色(n=16)定量分析患者原发肿瘤标本和对应pdxs中cd16
αsma
细胞的数量;***p《0.001通过配对student’s t检验。(d和e)将具有高或低cd16
caf浸润的her2
原发性肿瘤标本植入nod scid小鼠体内;成功建立pdx后,用曲妥珠单抗治疗小鼠八周。(d)通过正电子发射断层扫描/计算机断层扫描(pet/ct)监测的肿瘤生长的代表性图像(左图)和曲妥珠单抗治疗后肿瘤大小的倍数变化(右图);圆圈表示肿瘤;每条线代表一个成功建立的pdx。(e)cd16
cafs
high
(n=7)和cd16
cafs
low
(n=18)乳腺癌样本pdx对曲妥珠单抗的反应率;根据recist标准评估治疗反应;**p《0.01,fisher精确检验。(f和g)将具有高cd16
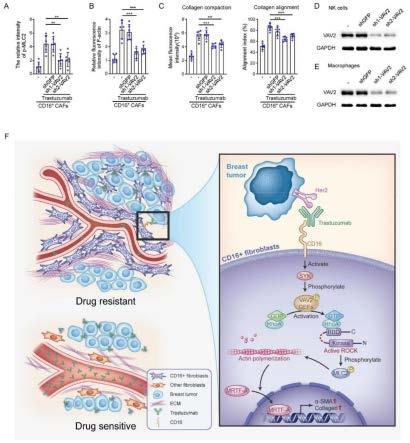
caf浸润的her2
原发性肿瘤标本植入nod scid小鼠(p-862);在成功建立pdx后,用曲妥珠单抗、抗人igg单独治疗小鼠,或,使用曲妥珠单抗的同时使用cd16中和抗体或igg治疗(曲妥珠单抗加抗cd16治疗组n=8,其他组n=7)。(f)pdxs肿瘤大小的倍数变化。(g)pdx的响应率。***通过fisher精确检验p《0.001。另请参见图11。
24.图4显示:cd16
成纤维细胞在共注射模型中损害曲妥珠单抗的功效。(a)bt-474乳腺癌细胞单独接种或与指定的caf共同注射到nod scid小鼠的乳腺脂肪垫中;当异种移植物可触知时,小鼠在不使用或使用曲妥珠单抗/igg的情况下进行治疗;显示了肿瘤生长曲线(每组n=6)。(b)cd16
caf在不使用或使用针对gfp/cd16慢病毒shrna的情况下进行转导;bt-474肿瘤细胞单独接种或与指定的caf共同注射到nod scid小鼠的乳腺脂肪垫中;当异种移植物可触及时,用曲妥珠单抗治疗小鼠;显示了肿瘤生长曲线(每组n=6)。(c)cd16-cafs在没有空载体(vec)、表达cd16-fcrγ(cd16/γ)和cd16-fcrγ
mut
(cd16/γ
mut
)的载体的慢病毒的情况下转导,或,在有空载体(vec)或表达cd16-fcrγ(cd16/γ)或cd16-fcrγ
mut
(cd16/γ
mut
)的载体的慢病毒的情况下转导;当可触及异种移植物时,在用igg、曲妥珠单抗或帕妥珠单抗治疗的nod scid小鼠中,用指定的caf接种bt-474细胞;在第43天测量肿瘤大小(每组n=6)。(d)将bt-474细胞和cd16
caf或cd16-caf共同注射到nod scid小鼠中;同时,用曲妥珠单抗和/或抗cd16中和抗体治疗荷瘤小鼠;自第36天起,每天对小鼠施用胸苷类似物5-乙炔基-2
’‑
脱氧尿苷(edu),持续7天,并在第43天处死;显示了用igg或曲妥珠单抗处理的小鼠的肿瘤中,edu标记特定caf的百分比的代表性流式细胞术图(左)和定量
(右)(每组n=5)。数值表示平均值
±
sd。平均值
±
标准差;ns,不显著;*p《0.05;**p《0.01和***p《0.001,通过单因素方差分析。另请参见图12。
25.图5显示:cd16
caf与患者的结缔组织增生、曲妥珠单抗耐药密切相关。(a和b)分析了对曲妥珠单抗新辅助治疗敏感(n=21)或耐药(n=13)的her2
乳腺癌患者治疗后肿瘤样本。(a)肿瘤切片中天狼星红染色的代表性图像(左)和量化(右)。比例尺,50μm。平均值
±
sem;***p《0.001,student’s t检验。(b)通过原子力显微镜(afm)测量的肿瘤基质硬度分布代表性图像(左)和量化(右);比例尺,5μm;平均值
±
sem;***p《0.001,student’s t检验。(c和d)收集了接受曲妥珠单抗新辅助治疗的her2
乳腺癌患者治疗前后的成对样本(n=34);cd16
caf的丰度和基质硬度分别通过免疫荧光和afm进行定量;显示了处理后(c)和处理前(d)样品中cd16
caf丰度与弹性模量之间的相关性(r,皮尔逊相关系数)。(e和f)收集接受曲妥珠单抗新辅助治疗的her2
乳腺癌患者治疗前后的成对石蜡包埋肿瘤切片(n=5患者)。(e)成对的治疗前和治疗后样本中,cd16、α-sma和ck染色的代表性免疫荧光图像。数字表示插图中放大的区域。比例尺,50μm。(f)在每个患者的三个随机选择区域中计算肿瘤细胞和最近特定caf之间的距离;显示了从肿瘤细胞到特定caf的距离的分布曲线(上)和散点图(下);每个点代表一个肿瘤细胞(平均每张图像n=98个肿瘤细胞);平均值
±
sem;***p《0.001,单因素方差分析。
26.图6显示:cd16
成纤维细胞通过增强结缔组织形成减少血管灌注和瘤内药物输送。(a-e)将bt-474细胞与cd16-或cd16
caf注射到nod scid小鼠的乳腺脂肪垫中,当异种移植物可触及时,这些小鼠用曲妥珠单抗或igg治疗;6周后,收获肿瘤(每组n=6)。(a)肿瘤切片中胶原蛋白i、胶原蛋白iii和透明质酸的微天狼星红染色和免疫组织化学染色代表性图像;比例尺,50μm。(b)afm测量的肿瘤基质刚度(硬度)分布代表性图像;比例尺,5μm。(c)小鼠在处死前通过尾静脉注射凝集素-fitc和抗cd31-pe;显示了肿瘤中cd31
血管中凝集素灌注的代表性免疫荧光图像;比例尺,50μm。(d)小鼠在处死前通过尾静脉注射hoechst和抗cd31-pe;显示了肿瘤血管中hoechst渗漏的代表性免疫荧光图像;比例尺,100μm。(e)在处死前给小鼠注射荧光标记的曲妥珠单抗和抗cd31-fitc;显示肿瘤中曲妥珠单抗药物分布的3d可视化代表性图像;比例尺,50μm。(f-i)将表达人erbb2的eo771细胞和强制表达fcγriii的小鼠成纤维细胞共同注射到免疫活性pwap-人erbb2(erbb2
)小鼠的脂肪垫中,在可触及肿瘤时用4d5或igg治疗。(f)肿瘤生长曲线(每组n=6)。(g)肿瘤中微天狼星红染色的代表性图像;比例尺,50μm。(h)(g)的量化(每组n=6)。(i)肿瘤浸润性cd49b
nk细胞和cd8
t细胞的定量(每组n=6);平均值
±
标准差;ns,不显著;*p《0.05,***p《0.001,通过单因素方差分析。参见图13和14。
27.图7显示:cd16
成纤维细胞诱导的结缔组织增生是通过syk-vav2-rhoa-rock-mlc2-mrtf-a通路触发的。(a)在存在igg或曲妥珠单抗的情况下,用带有her2标记的磁珠处理cd16-或cd16
caf。通过蛋白质印迹测定syk、vav2和mlc2的磷酸化以及rhoa的gtp结合形式、αsma和胶原蛋白i的水平(n=3)。(b)将鬼笔环肽标记的cd16-或cd16
caf嵌入fitc缀合的纤维状胶原基质中,并在存在igg或曲妥珠单抗的情况下,用her2标记磁珠处理。显示了胶原压缩水平的代表性免疫荧光图像(左)和量化(右)(n=6)。比例尺,50μm。(c)caf中f-肌动蛋白和p-mlc2染色的代表性免疫荧光图像(左)(a)和量化(右)。比例尺,50μm(n=6)。(d)用her2标记磁珠和曲妥珠单抗处理cd16-cafs,和用her2标记磁珠和曲妥珠单抗处理cd16
cafs(在没有或有针对syk、vav2、rhoa或mlc2慢病毒shrna的情况下转导);通过蛋白质印迹测定特指蛋白质(n=3)。(e)cd16-/cd16
caf在igg/曲妥珠单抗存在的情况下用her2标记磁珠处理;f-肌动蛋白和mrtf-a的代表性免疫荧光图像;比例尺,50μm。(f)(e)的量化(n=6)。(g)在存在/不存在曲妥珠单抗的情况下,用her2标记磁珠对无shrna/shgfp/mrtf-a shrna转导的cd16
caf处理。对应核(nuc)或细胞质(cyto)部分中mrtf-a、αsma和胶原蛋白i的代表性免疫印迹。组蛋白h1和gapdh分别用作核和细胞质蛋白的对照(n=3)。平均值
±
标准差;***p《0.001,单因素方差分析。另请参见图15。
28.图8显示:靶向vav2抑制cd16
成纤维细胞诱导的结缔组织增生。(a和b)对gfpshrna或vav2 shrna转导的cd16
caf,用her2标记磁珠和曲妥珠单抗处理。(a)f-肌动蛋白和p-mlc2染色的代表性免疫荧光图像。比例尺,50μm。(b)caf嵌入fitc缀合的纤维状胶原基质中,并用her2标记磁珠和曲妥珠单抗处理。细胞外胶原基质的代表性图像。比例尺,50μm。(c)bt-474细胞用celltrackertm ctdr标记,并在存在曲妥珠单抗的情况下,与用vav2 shrna转导的nk细胞共培养。显示了pi和ctdr的代表性流式细胞仪图(n=4)。数值表示ctdr
pi
细胞在总ctdr
细胞中的百分比(平均值
±
sd)。ns,通过单因素方差分析,与第三组相比无显著差异。(d)用vav2 shrna转导巨噬细胞,用cmfda标记,并在存在曲妥珠单抗的情况下,与用ctdr染色的bt-474细胞共培养。显示了ctdr和cmfda的代表性流式细胞术图(n=4)。数值表示ctdr
cmfda
细胞在总cmfda
细胞中的百分比(平均值
±
sd)。ns,通过单因素方差分析,与第三组相比没有显著差异。(e-k)将bt-474细胞接种到nod scid小鼠的脂肪垫中,其中cd16
caf转导vav2 shrna。当异种移植物可触及时,用曲妥珠单抗治疗小鼠。6周后,收获肿瘤(每组n=6)。(e)肿瘤生长曲线。(f)ivis lumina成像的代表性图像。(g)量化肿瘤中的微量天狼星红染色。(h)量化肿瘤基质的杨氏弹性模量。(i)hoechst和cd31-pe在处死前通过尾静脉注射到小鼠体内。cd31
血管的hoechst泄漏代表性图像。比例尺,100μm。(j)(i)的量化。(k)肿瘤中cd31
血管中凝集素灌注的量化。平均值
±
标准差;*p《0.05;***p《0.001,单因素方差分析。另请参见图16。
29.图9显示:人类乳腺癌中fcγr表达细胞的综合概况,与图1相关。(a)患者乳腺癌组织中cd45
细胞百分比的量化(n=32)。平均值
±
sem。(b)患者乳腺癌组织中cd16
cd45-细胞百分比的量化(n=32)。平均值
±
sem。(c)人乳腺癌组织中ck和cd32b/c染色的代表性免疫荧光图像。星号表示右上角放大率较高的区域(n=26)。比例尺,50μm。(d)人乳腺癌组织中cd16、cd45和ck染色的代表性免疫荧光图像。星号表示右上角放大率较高的区域(n=26)。比例尺,50μm。
30.图10显示:cd16
成纤维细胞亚群与her2
乳腺癌患者的曲妥珠单抗耐药相关,与图2相关。(a和b)通过流式细胞术,在乳腺癌患者的肿瘤样本中检测到作为fvd-cd45-epcam-cd31-pdgfrβ
cd16
门控的cd16
caf,如图2a(n=68)所示。(a)肿瘤标本中含/不含cd16
caf的乳腺癌患者百分比。(b)cd16
caf在总caf亚群中的比例。平均值
±
sem。(c)cd16
caf(n=14)中cd10和gpr77表达的流式细胞术分析。数值表示平均值
±
sem。(d)cd16
caf(n=14)中cd16a和cd16b表达的流式细胞术分析。数值表示平均值
±
sem。(e)对于通过facs(n=6)从乳腺癌患者肿瘤样本中分离的cd16
pdgfrβ
细胞,流式细胞术分析其αsma和cd45表达。数值表示平均值
±
sem。(f)结构化照明显微镜(sim)图像显示:从乳腺癌患者(n=3)肿瘤样本中分离的cd16
caf中cd16和n-钙粘蛋白染色。比例尺,2μm。(g)通过facs从原发性乳腺癌组织
中分离出来cd16
caf,并在培养基中维持多达10代。显示的是通过流式细胞术确定的每个传代中cd16
群体的百分比(n=15)。平均值
±
标准差;ns,单因素方差分析显示,没有显著差异。(h和i)从临床乳腺癌样本中分离出来的t细胞、b细胞、nk细胞、骨髓细胞、内皮细胞、肿瘤细胞、cd16
caf和cd16-caf。(h)通过rt-qpcr(n=3)检测特定细胞中cd16的相对表达水平。(i)通过蛋白质印迹法测定指定细胞中cd16的表达水平(n=3)。(j)未经辅助治疗的hr
her2-(激素受体阳性和her2阴性,n=488)和tn(三阴性,n=95)乳腺癌患者无病生存期kaplan-meier曲线,肿瘤样品中cd16
caf的浸润分为低(≤9.1个细胞/视野)和高(》9.1个细胞/视野)。(k)收集her2
乳腺癌患者接受曲妥珠单抗新辅助化疗前后的成对肿瘤样本;显示了来自对治疗敏感或耐药患者的肿瘤切片中h&e染色和αsma、cd16免疫荧光染色的代表性图像。星号表示右上角放大率较高的区域。比例尺,50μm。(l)收集her2
乳腺癌患者不使用曲妥珠单抗新辅助化疗前后的成对肿瘤样本;对来自对治疗敏感(n=55)或耐药(n=36)患者配对肿瘤样本进行免疫荧光染色检测,图中显示每个视野的cd16
caf数量。平均值
±
sem;ns,mann-whitney u检验不显著。
31.图11显示:在患者来源的异种移植模型中,cd16
成纤维细胞损害曲妥珠单抗的功效,与图3相关。(a)对mmtv-pymt小鼠自发性乳腺肿瘤以及balb/c或c57bl/6j小鼠同基因4t1/eo771移植物进行流式细胞术分析,获得cd45
群体和αsma
群体中fcγrⅰ,fcγrⅱ/ⅲ和fcγrvi的表达(n=每组6只)。数值表示平均值
±
sd。(b)将具有高/低cd16
caf浸润的her2
原发性肿瘤标本植入nod scid小鼠体内。成功建立pdx后,用多西紫杉醇治疗小鼠。显示了肿瘤体积的倍数变化(左)和pdx的反应率(右)。cd16
high
组n=7,cd16
low
组n=18。(c)将具有高/低cd16
caf浸润的her2
原发性肿瘤标本植入nod scid小鼠体内。成功建立pdx后,用igg治疗小鼠。评估了cd16
high
(n=7)、cd16
low
(n=18)组的肿瘤体积倍数变化(左)和pdx的反应率(右)。(d)将具有高cd16
caf浸润的her2
原发性肿瘤标本植入nod scid小鼠(p-540)。在成功建立pdx后,用曲妥珠单抗或抗人igg单独处理小鼠,以及在使用曲妥珠单抗的同时使用cd16中和抗体或igg处理,每组n=8。评估了肿瘤体积的倍数变化(左)和反应率(右)。(e)将具有低cd16
caf浸润的her2
原发性肿瘤标本植入nod scid小鼠(p-029)。在成功建立pdx后,用曲妥珠单抗或抗人igg单独处理小鼠,以及在使用曲妥珠单抗的同时使用cd16中和抗体或igg处理,每组n=8。评估了肿瘤体积的倍数变化(左)和反应率(右)。(f)将具有高cd16
caf浸润的her2
原发性肿瘤标本植入nod scid小鼠(p-133)。在成功建立pdx后,不使用或单独使用多西紫杉醇处理小鼠,以及在使用多西紫杉醇的同时使用cd16中和抗体或igg进行处理,每组n=8。评估了肿瘤体积的倍数变化(左)和反应率(右)。ns,不显著且***p《0.001,通过fisher精确检验。
32.图12显示:cd16
成纤维细胞在共注射模型中损害曲妥珠单抗的功效,与图4相关。(a)bt-474乳腺癌细胞单独接种或与指定的caf以1:3的比例共同注射到nod scid小鼠的乳腺脂肪垫中。当可触及原位异种移植物时,用pbs或多西他赛处理小鼠。显示了肿瘤生长曲线(每组n=6)。(b)cd16
caf中的shrna使cd16沉默。通过蛋白质印迹评估效率(n=3)。(c)sk-br-3乳腺癌细胞单独接种或与指定的caf以1:3的比例共同注射到nod scid小鼠的乳腺脂肪垫中。当可触及原位异种移植物时,用曲妥珠单抗或igg治疗小鼠。显示了肿瘤生长曲线(每组n=6)。(d)cd16
caf在没有/有针对gfp/cd16慢病毒shrna的情况下进行转导。sk-br-3肿瘤细胞单独接种或与指定的caf以1:3的比例共同注射到nod scid小鼠的乳腺脂肪
垫中。当可触及原位异种移植物时,用曲妥珠单抗治疗小鼠。显示了肿瘤生长曲线(每组n=6)。(e)cd16-cafs在没有空载体、表达cd16-fcrγ和cd16-fcrγ
mut
的载体的慢病毒的情况下被转导,,或,在有空载体(vec)或表达cd16-fcrγ(cd16/γ)或cd16-fcrγ
mut
(cd16/γ
mut
)的载体的慢病毒的情况下转导。通过蛋白质印迹测定指定细胞中cd16的表达(n=3)。(f)使用cck-8测定法(n=3)评估,在her2珠存在下,用igg/曲妥珠单抗处理后cd16
caf和cd16-caf的增殖。平均值
±
标准差;ns,不显著,*p《0.05和***p《0.001通过单因素方差分析。
33.图13显示:cd16
成纤维细胞通过增强结缔组织形成以减少血管灌注和瘤内药物输送,与图6相关。(a)图6a的量化(每组n=6)。(b)图6b中肿瘤基质杨氏弹性模量的量化(每组n=6)。(c)bt-474肿瘤细胞与cd16-/cd16
caf以1:3的比例共同注射到nod scid小鼠的乳腺脂肪垫中。当可触及原位异种移植物时,用pbs/多西他赛处理小鼠。6周后,处死小鼠并收获肿瘤(每组n=6)。显示了指定组中肿瘤基质杨氏弹性模量的量化。(d)图6c中肿瘤cd31
血管中凝集素灌注的量化(每组n=6)。(e)图6d中肿瘤血管hoechst渗漏的量化(每组n=6)。(f和g)bt-474肿瘤细胞与cd16-/cd16
caf以1:3的比例共同注射到nod scid小鼠的乳腺脂肪垫中。当原位异种移植物是可触及的时候,小鼠在不使用/使用多西紫杉醇的情况下进行治疗。6周后,处死小鼠并收获肿瘤(每组n=6)。(f)在处死前通过尾静脉将凝集素-fitc和抗cd31-pe注射到小鼠体内。显示了肿瘤中与cd31
血管共染色的凝集素像素数百分比(每组n=6)。(g)hoechst和pe-anti-cd31在小鼠处死前通过尾静脉注射到小鼠体内。量化肿瘤中cd31
血管的hoechst渗漏(每组n=6)。(h)图6e的量化(每组n=6)。(i和j)bt-474肿瘤细胞与cd16-/cd16
caf以1:3的比例共同注射到nod scid小鼠的乳腺脂肪垫中。当可触及肿瘤时,用多西紫杉醇(doc)和igg/曲妥珠单抗治疗小鼠。(i)在处死前给小鼠注射罗丹明-b-缀合的多西紫杉醇(购自qi yue biology,cat#q-0031418)和抗cd31-fitc。显示肿瘤中罗丹明-b-缀合多西紫杉醇药物分布的3d可视化代表性图像。比例尺,50μm。(j)(i)的量化(每组n=6)。平均值
±
标准差;ns,不显著且***p《0.001(通过单向方差分析)。
34.图14显示:表达fcγriii的成纤维细胞抑制细胞毒性效应细胞的浸润,与图6相关。(a)小鼠成纤维细胞在没有载体以及有空载体或表达fcγriii的载体的慢病毒的情况下进行转导。通过蛋白质印迹评估效率(n=3)。(b)eo771细胞在没有载体以及有携带空载体或表达人erbb2的载体的慢病毒的情况下转导。通过蛋白质印迹评估效率(n=3)。(c)将表达人erbb2的eo771细胞和强制表达fcγriii的小鼠成纤维细胞共同注射到免疫活性pwap-人erbb2(erbb2
)小鼠的脂肪垫中。当可触及肿瘤时,用4d5或igg治疗小鼠。显示了肿瘤切片中cd49b和cd8染色代表性免疫荧光图像。星号(*)表示插图中放大的区域。
35.图15显示:cd16
成纤维细胞诱导的结缔组织增生是通过syk-vav2-rhoa-rock-mlc2通路触发的,与图7相关。(a)在存在igg或曲妥珠单抗的情况下,用带有her2标记的磁珠处理cd16-或cd16
caf。通过elisa(n=5)测量指定caf上清液中的透明质酸(ha)水平。(b)图7b(n=6)中胶原排列水平的量化。(c)图7c(n=6)所示caf中的p-mlc2染色量化。(d和e)分别使用celltrackertm ctdr和cmfda标记的bt-474细胞和cd16
caf,并在不使用抗体、使用igg或使用曲妥珠单抗的情况下,bt-474肿瘤细胞与或不与cd16
caf共培养。(d)bt-474细胞的细胞毒性通过流式细胞术(n=4)进行评估。数值表示ctdr
pi
细胞在总ctdr
细胞中的百分比(平均值
±
sd)。ns,与第三组相比,单因素方差分析,差异不显著。(e)bt-474细胞
的吞噬作用通过流式细胞术(n=4)进行评估。数值表示ctdr
cmfda
细胞在总cmfda
细胞中的百分比(平均值
±
sd)。ns,与未治疗组相比,单因素方差分析,差异不显著。(f)来自人类蛋白质图谱数据集,不同类型细胞中vav1、vav2和vav3的表达谱。(g)通过蛋白质印迹法测定人外周血单个核细胞(pbmc)和cd16
caf中vav1、vav2和vav3的表达水平(n=3)。(h)在曲妥珠单抗存在的情况下,用带有her2标记的磁珠处理没有慢病毒shrna转导的cd16-caf,以及处理没有慢病毒shrna转导或有对应syk、vav2、rhoa或mlc2的慢病毒shrna所转导的cd16
caf。通过elisa测量由指定caf产生的透明质酸水平(n=5)。与没有转导的cd16
caf相比,**p《0.01和***p《0.001。(i)mrtf-a在cd16
caf中被shrna沉默。通过蛋白质印迹评估效率(n=3)。(j)图7g所示caf中αsma和胶原蛋白i的相对表达水平定量(n=3)。(k)从接受曲妥珠单抗新辅助化疗的三名her2
乳腺癌患者的肿瘤样品中,分离cd16
和cd16-caf。通过蛋白质印迹(n=3)测定对应细胞中vav2和mlc2的磷酸化以及rhoa的活化。(l)分析了接受曲妥珠单抗新辅助治疗的乳腺癌队列的在线rna-seq数据。基因集富集分析(gsea)分析显示,与完全缓解的患者相比,残留疾病患者样本中,与产生含胶原细胞外基质的相关基因显著富集。显示了归一化富集分数(nes)和错误发现率(fdr)。平均值
±
标准差;ns,不显著,通过单因素方差分析,**p《0.01和***p《0.001。
36.图16显示:靶向vav2抑制由cd16
成纤维细胞诱导的结缔组织增生,与图8相关。(a)图8a(n=6)中p-mlc2水平的量化。(b)图8a(n=6)中f-肌动蛋白水平的量化。(c)图8b(n=6)中胶原蛋白压缩(左)和排列(右)水平的量化。(d)在不使用/使用针对gfp/vav2的慢病毒shrna的情况下转导nk细胞。通过蛋白质印迹评估效率(n=3)。(e)在不使用/使用针对gfp或vav2的慢病毒shrna情况下转导巨噬细胞。通过蛋白质印迹评估效率(n=3)。(f)本研究主要发现的示意图。平均值
±
标准差;**p《0.01和***p《0.001,通过单因素方差分析。
37.图17显示:her2
患者无病生存的cox回归分析,与图2相关
具体实施方式
38.应该指出,以下详细说明都是例示性的,旨在对本技术提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本技术所属技术领域的普通技术人员通常理解的相同含义。
39.现结合具体实例对本发明作进一步的说明,以下实施例仅是为了解释本发明,但不构成对本发明的限制。在以下实施例中所用到的试验样本及试验过程包括以下内容(如果实施例中未注明的实验具体条件,通常按照常规条件,或按照试剂公司所推荐的条件;下述实施例中所用的试剂、耗材等,如无特殊说明,均可从商业途径得到)。
40.关于样本的说明:本发明实施例乳腺癌患者样本及数据来源于中山大学孙逸仙纪念医院,且其中,对于her2阳性患者,新辅助化疗方案如下:每21天给予阿霉素60mg/m2和环磷酰胺600mg/m2,共4个周期,随后每周给予紫杉醇(80mg/m2)治疗3个月。对于接受曲妥珠单抗的患者,患者同时接受曲妥珠单抗治疗,初始剂量为8mg/kg(紫杉醇治疗开始时),随后每三周给予6mg/kg剂量,持续一年。根据recist(实体瘤反应评估标准)的标准评估治疗效果。病理完全缓解(pcr)定义为在新辅助治疗后显微镜下检测到任何切除的乳房或淋巴结组织中没有任何残留的浸润性癌或导管原位癌(dcis);仅乳房/淋巴结pcr是指pcr仅限于乳房或腋窝;部分缓解(pr)是指肿瘤大小减少≥30%;疾病进展(pd)是指肿瘤增大≥20%;疾病
稳定(sd)是指肿瘤大小从《20%增长到《30%减小的范围。pcr、仅乳腺/淋巴结pcr或pr的患者被归类为敏感,而sd或pd的患者被归类为对新辅助治疗耐药。所有样本均来自患者知情同意,所有相关程序均经中山大学孙逸仙纪念医院内部审查和伦理委员会批准进行。本实施例中,cd16
和cd16-caf能通过流式细胞仪(bd influx)通过流式细胞分选方法(facs)进行分选(su et al.,2018a)。实施例1
41.一、人类乳腺癌中fcγr表达细胞的研究概况
42.尽管已经充分认识到fcγr介导的应答在mab治疗(单抗治疗)中重要作用起着,但具体是何种细胞群起到主要作用,目前仍没有定论。而对于其具体机制的研究,是有利于优化相关的癌症治疗策略的。为此,本实施例进行相关的具体研究。
43.本实施例中,通过流式细胞术分析(n=32名患者)对临床乳腺癌标本分离出的活单细胞悬液进行了检测,检测其中人fcγr的表达。结果发现cd64(fcγri)和cd32a(fcγriia)主要在髓样细胞上表达,而cd32b/c(fcγriib/iic)主要在肿瘤中的髓样细胞和b细胞上表达。此外,cd16(fcγrⅲ)在肿瘤浸润性nk细胞和髓样细胞上表达(图1a,1b和9a)。值得注意的是,观察到一部分cd32b/c
细胞和cd16
细胞是cd45-的,即表现为cd45阴性(图1a,1b和9b)。免疫荧光染色显示,在人乳腺癌组织中,一些具有核异型性的细胞角蛋白(ck)
细胞对cd32b/c呈阳性(图9c)。这些数据表明cd32b/c
cd45-细胞是肿瘤细胞,这与现有研究揭示的内容一致。
44.而依据图9d所示,cd45-cd16
细胞则表现为ck-(图9d)。
45.基于细长的形态,本发明人推测cd16
cd45-细胞可能是cafs(图1c)。
46.总体上,本实施例数据表明,在人类乳腺癌中,除了白细胞外,fcγrs还可以在一些肿瘤细胞亚群中和基质细胞中表达。
47.二、cd16
成纤维细胞亚群与her2
乳腺癌患者的曲妥珠单抗耐药相关
48.为了评估人cafs是否表达cd16,本实施例从68名乳腺癌患者的肿瘤中分离出原发性caf并进行流式细胞术。流式细胞术结果显示,在45.6%(31/68)的癌症标本中,在成纤维细胞表面标志物pdgfrβ阳性且泛淋巴细胞标志物cd45阴性、内皮标志物cd31阴性和上皮标志物epcam阴性的成纤维细胞亚群中,观察到cd16的表达(图2a和10a)。cd16
成纤维细胞占总caf群体的20.13
±
3.38%(平均值
±
sem)(图10b)。现有技术已经报道过人类肿瘤中的几个成纤维细胞亚群。为了研究这些cd16
成纤维细胞是否属于任何先前现有技术确定成纤维细胞亚群子集,本发明人检测了cd16
成纤维细胞(来源于n=14名患者)中αsma、fap、cd10和gpr77的表达。观察到超过90%的cd16
成纤维细胞表现出αsma
fap-cd10-gpr77-表型(如图2b和10c所示)。
49.因为cd16分为cd16a和cd16b两种亚型。为了进一步评估caf上cd16的亚型,本实施例使用了相应的特异性抗体进行分析。流式细胞术分析表明,pdgfrβ
细胞群中cd16和cd16a染色区域几乎完全重叠;相比之下,用cd16b特异性抗体检测到的信号则很少(图10d)。
50.接下来,本实施例评估了caf上cd16的表达在体外是否可持续的。与流式细胞分析一致,免疫染色结果显示:部分αsma
细胞高水平表达cd16(图2c)。且通过荧光激活细胞分选(facs)分离的cd16
αsma
细胞表现为双极或多极的,具有细长的形状,具有典型的活化成
纤维细胞形态(图2c)。通过流式细胞术对cd16
pdgfrβ
细胞进行表型分析显示,结果显示超过95%的分选细胞是αsma
cd45-(图10e)。且结构照明显微镜(sim)图像进一步证实了质膜上cd16信号的存在(图10f)。
51.在常规成纤维细胞培养条件(10%fbs-dmem)下,发现cd16
cafs在总体cafs中的百分比至少在10代内保持不变(图10g)。
52.为了确定乳腺癌中cd16
cafs细胞和其他细胞上cd16的相对水平,通过rt-qpcr和western blotting对临床乳腺癌标本中分离出的t细胞、b细胞、nk细胞、髓系细胞、内皮细胞、肿瘤细胞、cd16
cafs和cd16-cafs进行了检测,检测对应的cd16水平(图10h和10i)。结果显示,内皮细胞、肿瘤细胞和cd16-cafs中,检测不到cd16;cd16
成纤维细胞的cd16水平低于nk细胞和髓样细胞,但远高于t细胞和b细胞。
53.为了研究这种cd16
caf亚群的临床意义,本实施例对未治疗乳腺癌样本(n=814)中的cd16和αsma进行了双重免疫荧光染色。尽管在所有亚型乳腺癌中均可观察到cd16
caf的存在,但her2
亚型和三阴性亚型乳腺癌中cd16
caf的数量显著高于hr(激素受体)
her2-亚型乳腺癌中的cd16
caf数量(图2d和2e))。在her2
和三阴性乳腺癌亚型中,高cd16
caf浸润性肿瘤(cd16
cafhigh)的比例显著增加。
54.重要的是,cd16
caf的数量与her2
亚型的长期预后不良显著相关(图2f),但在三阴性或hr
her2-亚型中不相关(图10j)。
55.鉴于cd16在抗体介导的免疫应答中发挥着重要作用,使用cox回归模型分析了肿瘤内免疫浸润等几个危险因素对患者生存的影响。多变量分析显示,cd16
caf丰度是her2
乳腺癌的独立预后因素(图17)。为了研究cd16
cafs是否与her2
乳腺癌治疗反应相关,本实施例对接受新辅助治疗的her2
乳腺癌患者治疗前活检样本、治疗后切除样本进行了评估,获取其中cd16
cafs的浸润情况。
56.我们观察到,相比于对曲妥珠单抗新辅助治疗具有应答的患者(即对曲妥珠单抗新辅助治疗敏感的患者),对于对曲妥珠单抗新辅助治疗具有耐药性的患者,治疗前活检样本和治疗后切除样本中,cd16
caf浸润显著高于应答者(图2g和10k)。而没有曲妥珠单抗的情况下,在对新辅助化疗耐药、敏感的her2
乳腺癌患者之间,活检样本或治疗后切除样本中cd16
caf数量没有明显差异(图10l)。
57.总体上,本实施例确定了cd16
αsma
pdgfrβ
fap-cd10-gpr77-成纤维细胞这一成纤维细胞子集,且其与曲妥珠单抗耐药性、her2
乳腺癌患者的长期生存率差密切相关。
58.三、cd16
成纤维细胞损害曲妥珠单抗在体内的疗效
59.鉴于cd16
caf与her2
乳腺癌患者对曲妥珠单抗反应不佳相关,本实施例探讨了成纤维细胞中cd16是否在体内诱导曲妥珠单抗耐药。然而,在mmtv-pymt小鼠的自发性乳腺肿瘤或balb/c/c57bl/6j小鼠的同基因4t1/eo771移植物中只检测到很少的fcγr
caf(图11a)。表明人和小鼠的caf在fcγr表达谱上是不同的。
60.在此基础上,进行进一步研究。本实施例将新鲜原发性肿瘤样本(从乳腺癌患者原位切除的)原位植入免疫功能低下nod scid小鼠清除乳腺脂肪垫中,并在患者来源的异种移植物(pdx)达到100-200mm3后,每周以临床相关暴露水平静脉注射曲妥珠单抗。本发明人发现,源自富含cd16
成纤维细胞原发性肿瘤的pdx中,大多数成纤维细胞仍然是cd16阳性(图3a和3b),这与前述离体后连续传代的实验一致(图10g)。相比之下,pdx很少保留原发性
肿瘤中的cd16 αsma-细胞(图3a和3c),这与之前的报道一致,即人类白细胞在pdx植入后丢失。更重要的是,具有高cd16
caf浸润的pdx对曲妥珠单抗的反应率显著低于具有低cd16
caf浸润的pdx(图3d和3e)。相比之下,当小鼠单独接受化疗(图11b)或对照igg(图11c)治疗时,没有发现肿瘤生长的明显差异。
61.鉴于人类cd16主要在pdx的成纤维细胞中表达(图3a),本实施例在曲妥珠单抗治疗的同时应用了针对人类cd16的特异性中和抗体(购自biolegend,包括cat#302001)。结果显示,cd16的阻断显著增强了曲妥珠单抗在富含cd16
caf的pdx中的疗效(图3f、3g和11d),但在cd16
caf很少的pdx中则没有显著增强(图11e)。此外,在仅用化疗治疗且含有cd16
caf的pdx中,没有cd16中和抗体的协同作用(图11f)。
62.为了进一步评估cd16
成纤维细胞对体内曲妥珠单抗反应的影响,通过facs从乳腺癌临床样品中分离人cd16
pdgfrβ
cd45-cd31-epcam-成纤维细胞和cd16-pdgfrβ
cd45-cd31-epcam-成纤维细胞,并将这些细胞与her2
乳腺癌bt-474细胞共注射到nod scid小鼠中。在用曲妥珠单抗治疗的小鼠中,共注射bt-474细胞与cd16
caf(而不是自体cd16-caf)后,肿瘤表现为持续生长(图4a)。相比之下,在用对照igg(图4a)或单独化疗(图12a)治疗的荷瘤小鼠中,在bt-474异种移植物的大小上,没有观察到注射cd16
成纤维细胞或cd16-成纤维细胞的组别之间有任何明显差异,即表明cd16
成纤维细胞带来的差异效果是曲妥珠单抗特异性的。
63.此外,当在共注射前,通过shrna慢病毒载体沉默cd16
成纤维细胞中的cd16,则能消除cd16
成纤维细胞诱导的曲妥珠单抗耐药(图4b和12b)。而且,在使用不同的her2
人乳腺癌细胞系sk-br-3重复上述实验时,观察到类似的结果(图12c和12d)。
64.总体而言,这些数据表明成纤维细胞中的cd16信号在体内介导了对曲妥珠单抗的耐药性。
65.本实施例中用于基因沉默的慢病毒载体包括pglv2-u6-puro;靶向cd16、syk、vav2、rhoa、mlc2、mrtf-a和gfp的慢病毒shrna获自genepharma inc(中国上海),且具体地,shrna对应为:cd16:shrna1:5
’‑
gtttacttcctcctgtctagt-3’;shrna2:5
’‑
gagactggaaggaccataaat-3’。syk:shrna1:5
’‑
ccttagcatgtgactcctgaa-3’;shrna2:5
’‑
gcccacaacttgtcacccaaa-3’。vav2:shrna1:5
’‑
caataagcatcaagttcaatg-3’;shrna2:5
’‑
ccatgcagagggtgctcaaat-3’。rhoa:shrna1:5
’‑
gaaagcaggtagagttggctt-3’;shrna2:5
’‑
gtacatggagtgttcagcaaa-3’。mlc2:shrna1:5
’‑
ggctgattacgttcgggaaat-3’;shrna2:5
’‑
ggaggaggttgaccagatgtt-3’。mrtf-a:shrna1:5
’‑
gactatctcaaacggaagatt-3’;shrna2:5
’‑
gctcaagtaccaccagtacat-3’。gfp:shrna1:5
’‑
tagcgactaaacacatcaa-3’。)
66.为了研究caf上的cd16是否通过抗体隔离降低曲妥珠单抗的功效,用人cd16-fcrγ或具有突变fcrγ的cd16-fcrγ转导cd16-caf以进行相关研究。其中,对于具有突变fcrγ的cd16-fcrγ,其基于免疫受体酪氨酸的激活基序(itam)不能与syk作用而介导下游信号(图12e)。记具有突变fcrγ的cd16-fcrγ为cd16-fcrγ
mut
。
67.将bt-474细胞与有cd16-fcrγ或cd16-fcrγ
mut
过表达载体转导的或与没有cd16-fcrγ、cd16-fcrγ
mut
过表达载体转导的cd16-caf共注射到nod scid小鼠的脂肪垫中。在肿瘤可触知后,用igg、曲妥珠单抗或帕妥珠单抗(另一种抗her2抗体)处理小鼠。
68.结果发现,曲妥珠单抗功效,在与强制表达cd16-fcrγ的cd16-caf共注射的肿瘤
中显著减弱。然而,当注射的cd16-caf用cd16-fcrγ
mut
转导时,这种作用(曲妥珠单抗功效被减弱的作用)则被消除(图4c)。且类似的结果同样体现在帕妥珠单抗实验中,在帕妥珠单抗设置中得到验证(图4c)。
69.这些数据表明抗her2治疗的功效降低是归因于成纤维细胞中cd16的细胞内信号传导,而不是抗体隔离。
70.为了检测体内cd16
caf的增殖,在获取组织的前7天,每天给荷瘤小鼠服用胸苷类似物5-乙炔基-2
’‑
脱氧尿苷(edu)。流式细胞术分析显示,igg治疗肿瘤中edu标记的cd16
cafs的百分比与igg或曲妥珠单抗治疗肿瘤中edu标记的cd16-cafs的百分比相当(图4d);然而,在曲妥珠单抗治疗后,保留edu的cd16
caf的比例显著增加,且通过阻断cd16又能逆转这一趋势(图4d)。同样地,细胞计数试剂盒-8(cck-8)测定显示:曲妥珠单抗和her2微珠显著增加cd16
caf的增殖,但不增加cd16-caf的增殖(图12f)。
71.这些发现表明,曲妥珠单抗通过cd16触发cd16
caf的增殖。
72.四、cd16
成纤维细胞通过增强结缔组织生成以减少血管灌注和肿瘤内药物递送
73.成纤维细胞在协调肿瘤结缔组织形成中起重要作用。因此,本发明人对曲妥珠单抗新辅助化疗敏感或耐药的her2
乳腺癌患者进行相关评估,具体地,评估肿瘤的细胞外基质(ecm)产生和硬度。天狼星红染色显示,与单抗药敏感患者相比,耐药患者样本中的胶原蛋白水平显著增加(图5a)。通过用原子力显微镜(afm)计算新鲜肿瘤样本的杨氏弹性模量,发现耐药患者的样本具有明显更硬的基质(图5b)。重要的是,曲妥珠单抗治疗后her2
肿瘤样本中,促结缔组织增生反应的程度与其中的cd16
caf丰度密切相关(图5c)。相比之下,在初始肿瘤样本中,促结缔组织增生反应水平与cd16
cafs丰度之间没有明显的相关性(图5d)。
74.此外,获取经曲妥珠单抗新辅助化疗的her2
乳腺癌患者样本,包括对应的治疗前活检和治疗后切除样品,测量了cd16
caf和肿瘤细胞的接近程度。结果发现,在治疗后样品中,与肿瘤细胞紧密接触的cd16
caf的量显著高于cd16-caf的量。此外,曲妥珠单抗治疗后,cd16
caf与肿瘤细胞之间的距离显著降低(图5e和5f)。
75.这些数据表明,曲妥珠单抗治疗后,促结缔组织增生基质的增加与cd16
cafs相关,cd16
cafs定位于肿瘤细胞附近。
76.为了研究cd16
成纤维细胞诱导曲妥珠单抗耐药的潜在机制,使用多种方法评估了异种移植物中的胶原蛋白沉积,包括天狼星红染色以及人胶原ⅰ、胶原ⅲ和透明质酸的免疫染色。本实施例的数据表明,在曲妥珠单抗治疗的小鼠中,与共注射cd16-成纤维细胞相比,共注射cd16
成纤维细胞的肿瘤中结缔组织生成显著增加,但在igg对照组治疗的小鼠中没有该情况(图6a和13a)。
77.此外,我们发现,使用曲妥珠单抗后,cd16
的成纤维细胞(而不是cd16-的成纤维细胞)显著增加了异种移植物的杨氏弹性模量(图6b和13b)。
78.为了评估cd16
成纤维细胞在单独化疗治疗时是否还诱导结缔组织增生,本发明人每周用多西紫杉醇治疗荷瘤小鼠。结果显示,与曲妥珠单抗组别相比,没有观察到化疗后cd16
或cd16-成纤维细胞异种移植物之间在基质硬度上有明显差异(图13c)。
79.总之,我们的数据表明,cd16
成纤维细胞在曲妥珠单抗存在下可增强肿瘤结缔组织形成(即促进肿瘤结缔组织增生)。
80.据报道,结缔组织增生会导致血管受压,导致药物输送受抑制。为了评估血管压迫,给荷瘤小鼠注射凝集素-fitc和hoechst,分别分析血管灌注和通透性。在曲妥珠单抗治疗后,与含有cd16-成纤维细胞的肿瘤相比,含有cd16
成纤维细胞的肿瘤中,其凝集素灌注(图6c和13d)和hoechst通透性(图6d和13e)均显著降低。相比之下,在单独化疗后共注射cd16
或cd16-成纤维细胞的小鼠之间,异种移植物中的血管灌注和通透性水平相当(图13f和13g)。
81.为了确定血管塌陷是否会损害曲妥珠单抗的递送,我们检测了曲妥珠单抗(荧光标记)的肿瘤摄取情况,并观察到cd16
成纤维细胞的共同注射显著降低了肿瘤对曲妥珠单抗的摄取(图6e和13h)。
82.为了探索化疗药物与曲妥珠单抗联合给药,同时给荷瘤小鼠施用多西他赛和曲妥珠单抗。与共注射cd16-caf的那些组别相比,在与cd16
caf共注射的肿瘤中,伴随曲妥珠单抗治疗时,肿瘤对罗丹明-b-缀合的多西紫杉醇摄取显著降低(图13i和13j)。
83.总之,这些结果表明,在曲妥珠单抗为基础的治疗过程中,cd16
的成纤维细胞(而不是cd16-的成纤维细胞),会诱导基质结缔组织形成并减少药物传递。
84.为了评估cd16
成纤维细胞在免疫活性模型中的功能,采用pwap-人erbb2(erbb2
)小鼠进行实验,这是一种huerbb2敲入c57bl/6j的小鼠模型,具有之前描述的人her2免疫耐受性。鉴于免疫活性小鼠模型的乳腺肿瘤中不存在fcγr
caf(图11a),本发明人从正常乳腺组织中分离出小鼠成纤维细胞,并用与人类cd16同源的小鼠fcγriii转导它们(图14a)。
85.然后,将表达人erbb2的eo771细胞和表达fcγriii的成纤维细胞共注射到erbb2
小鼠的脂肪垫中(图14b)。当移植物可触知时,用4d5处理小鼠,4d5是小鼠抗人her2抗体和曲妥珠单抗的亲本药物。与nod scid小鼠实验的发现一致,接种了表达fcγriii的成纤维细胞的小鼠中,4d5的功效显著受损(图6f)。同时,胶原沉积水平显著增加(图6g和6h)。此外,肿瘤浸润nk细胞和cd8
t细胞的数量显著减少(图6i和14c)。
86.这些数据表明,对于表达fcγriii的成纤维细胞,其诱导的结缔组织增生抑制了免疫活性小鼠中细胞毒性效应细胞的浸润。
87.五、cd16
成纤维细胞诱导的结缔组织增生是通过syk-vav2-rhoa-rock-mlc2-mrtf-a通路触发的
88.动物实验数据证实,与her2标记磁珠一起培养的cd16
成纤维细胞具有显著更高水平的αsma和ⅰ型胶原(图7a),并且在加入曲妥珠单抗后分泌更多的透明质酸(15a)。接下来,我们通过将成纤维细胞嵌入fitc缀合的纤维状胶原基质中进行胶原凝胶重塑分析。与含有cd16-成纤维细胞或含经igg处理cd16
成纤维细胞的样品中随机定向原纤维分布不同,对于嵌入cd16
成纤维细胞和曲妥珠单抗的基质,则显示出明显有序排列的胶原原纤维,而且在her2标记磁珠存在的情况下,这些胶原原纤维在细胞力极周围具有更高的密度,表明了ecm的重塑(图7b和15b)。
89.此外,在用her2标记磁珠和曲妥珠单抗处理的cd16
成纤维细胞中,存在更强的肌动蛋白束(图7c)。这些数据表明cd16
成纤维细胞通过产生ecm组分和驱动收缩性来增加结缔组织形成。
90.值得注意的是,adcc和adcp已被认为是肿瘤中fcγr介导的主要影响功能。为了研究cd16
成纤维细胞是否进行adcc和adcp,在存在曲妥珠单抗的情况下将bt-474细胞与
cd16
成纤维细胞共培养。流式细胞术分析显示,曲妥珠单抗治疗后cd16
成纤维细胞的杀肿瘤活性和吞噬活性均未增强(图15d和15e)。
91.据报道,fcγr参与刺激脾酪氨酸激酶(syk)活化,随后磷酸化vav鸟嘌呤核苷酸交换因子(vav)。所述的vav蛋白有3个家族成员,包括vav1、vav2和vav3。在线细胞图谱数据库(human蛋白质图谱数据库)表明,成纤维细胞高度表达vav2而不是vav1或vav3(图15f)。
92.一致地,我们的数据显示cd16
成纤维细胞表达相当水平的vav2而不是其他两个vav成员(15g)。我们观察到,在her2标记磁珠和曲妥珠单抗治疗后,cd16
成纤维细胞中syk和vav2的磷酸化均显著增加(图7a)。
93.vav2诱导rhoa上的鸟嘌呤核苷酸交换(crespo等人,1997;van aelst和d’souza-schorey,1997)。rhoa可以激活肌球蛋白轻链2(mlc2)(fukata et al.,2001;vicente-manzanares et al.,2009),这对于成纤维细胞中的肌动蛋白聚合和ecm产生很重要(chen et al.,2008;totsukawa et al.,2009)等人,2000)。我们观察到,在曲妥珠单抗处理的cd16
caf中,gtp结合形式的rhoa和磷酸化mlc2的水平显著增加(图7a、7c和15c)。更重要的是,沉默syk、vav2、rhoa和mlc2后则分别降低了它们下游介质的激活和αsma、ⅰ型胶原蛋白和透明质酸的水平(图7d和15h)。
94.心肌素相关转录因子-a(mrtf-a)介导纤维化基因的表达(luchsinger等,2011;small,2012;small等,2010)。mlc2磷酸化诱导肌动蛋白聚合,其募集g-肌动蛋白到f-肌动蛋白应力纤维上,从而将mrtf-a从g-肌动蛋白释放到细胞核(fan等人,2007;yokota等人,2017)。
95.而本实施例的免疫荧光染色显示,用her2磁珠和曲妥珠单抗处理的cd16
成纤维细胞中,mlc2的磷酸化和mrtf-a的核转位增加(图7c、7e、7f和15c)。沉默mrtf-a消除了由曲妥珠单抗诱导的cd16
成纤维细胞中纤维化基因的上调(图7g,15i和15j)。
96.为了验证临床样本中cd16的细胞内信号通路,从三名曲妥珠单抗新辅助化疗her2
乳腺癌患者肿瘤样本中分离出cd16-caf和cd16
caf进行相关检测。western印迹显示,在cd16
cafs中p-vav2、rhoa-gtp和p-mlc2的水平显著高于cd16-cafs中的水平(15k)。此外,本实施例还分析了含有曲妥珠单抗新辅助治疗乳腺癌队列的在线rna-seq数据(数据来自geo数据库);基因集富集分析(gsea)显示,与完全缓解的患者相比,残留疾病患者样本中,与产生含胶原细胞外基质的相关基因呈显著富集(false discovery rat《0.25)(图15l)。
97.总之,这些数据表明曲妥珠单抗激活cd16
成纤维细胞中介导结缔组织增生的cd16-syk-vav2-rhoa-mlc2-mrtf-a通路。
98.六、靶向vav2抑制cd16
成纤维细胞诱导的结缔组织增生
99.已经表明,vav2对于nk细胞的adcc或巨噬细胞的adcp是非必需的。鉴于在cd16
成纤维细胞中vav2表现为高水平,且并非vav1或vav3表现为高水平,本发明人则提出:是否可以利用免疫细胞和成纤维细胞对vav家族成员的不同需求来提高曲妥珠单抗的疗效。
100.为此,本发明人使cd16
成纤维细胞中的vav2沉默,并观察到曲妥珠单抗诱导的mlc2磷酸化(图8a和16a)、肌动蛋白聚合(图8a和16b)和胶原凝胶收缩(图8b和16c)被显著抑制。相比之下,nk细胞和巨噬细胞中的敲低vav2对曲妥珠单抗分别诱导的adcc(图8c和16d)或adcp(图8d和16e)没有明显影响。
101.总的来说,这些数据表明vav2对于成纤维细胞而非免疫细胞中cd16的功能是必不
可少的。
102.为了探索vav2在体内的治疗潜力,我们将bt-474细胞和具有vav2敲低的cd16
成纤维细胞共同注射到接受曲妥珠单抗治疗的小鼠的乳腺脂肪垫中。
103.cd16
成纤维细胞的共同注射严重限制了bt-474肿瘤对曲妥珠单抗的反应性(图8e和8f)。同时,容纳cd16
成纤维细胞的异种移植物表现出显著增加的组织纤维化和基质硬度,并降低了血管通透性和灌注(图8g-8k)。但更重要的是,cd16
成纤维细胞中的vav2沉默则恢复了对应肿瘤组织对曲妥珠单抗的敏感性并显著逆转了肿瘤结缔组织形成(图8e-8k)。总之,这些数据表明靶向vav2是提高曲妥珠单抗疗效的潜在治疗方式。
104.总体上,目前,超过20种mab已被批准用于癌症适应症。成功的mab治疗,其关键在于能否准确地确定哪些患者群体能从某种治疗环境中获得最大的益处。迄今为止,现有技术报道,fcγr主要在tme中的白细胞上表达。而在本发明中,本发明人发现人类乳腺癌经常含有一部分cd16
caf。在接受含曲妥珠单抗治疗的her2
乳腺癌患者中,这种caf亚群与较差的治疗反应和长期预后相关。鉴于mab在多种疾病中的重要性,鉴定该表达fcγr成纤维细胞子集,则代表了重要的预后生物标志物和治疗靶点。
105.本发明中,caf fcγr信号的促肿瘤效应是出乎意料的。众所周知,在不同的fcγr表达效应细胞之间,配体结合后的信号参与机制是非常不同的,包括adcc、adcp、抗原呈递和适应性免疫反应调节等过程中。然而,这些先前确定的fcγr介导的功能总是抗肿瘤的。如,由两个her2特异性变量和一个抗cd16 fab片段组成的三体,在曲妥珠单抗治疗后触发表达cd16的nk细胞和γδt细胞直接裂解her2
肿瘤细胞。而本发明的数据则显示,mab与cd16结合促进成纤维细胞产生和收缩ecm;本发明提出的研究,扩展了当前对多效性fcγr反应的理解。
106.从机制上讲,本发明人发现,在曲妥珠单抗刺激后,cd16-syk-vav2-rhoa-mlc2-mrtf-a信号级联在caf中被激活。据报道,vav2对rhoa具有鸟嘌呤核苷酸交换因子活性,但对rho家族的其他两个成员rac1和cdc42不具有活性。rhoa可以通过rho相关的含卷曲螺旋的激酶(rock)激活mlc2。mlc2激活促进肌球蛋白与肌动蛋白丝的相互作用(这对于细胞骨架重排引起的收缩特性至关重要)。mrtf-a参与多种纤维化基因的表达,通过结合g-actin被隔离在胞质溶胶中,并在细胞骨架重组期间因g-actin被募集到f-actin应力纤维时而释放。本发明数据显示曲妥珠单抗-cd16参与启动了syk-vav2-rhoa-mlc2通路。mlc2磷酸化诱导细胞骨架重塑并增强成纤维细胞的收缩性。此外,肌动蛋白应力纤维的形成导致mrtf-a的核穿梭,这促进了ecm成分的产生。因此,将这些信号事件带入成纤维细胞的场景中,本发明发现了一种以前未被认识的机制,即成纤维细胞中的fcγr信号如何调节基质硬度。
107.更值得注意的是,本发明的一个实施例中,表明抑制vav2会消除成纤维细胞中的fcγr信号,而对nk细胞的adcc或巨噬细胞的adcp没有明显影响。syk相关受体通过vav蛋白激活许多信号通路,这些蛋白由3个家族成员组成;其中,vav1表达主要局限于白细胞,并在fcγr介导的免疫反应中发挥关键作用;相比之下,vav2和vav3表达式分布更广泛。我们的数据显示cd16
成纤维细胞表达高水平的vav2,但不表达vav1或vav3。更重要的是,我们证明成纤维细胞中的vav2对于体外和体内的由曲妥珠单抗-cd16信号诱导的ecm产生和收缩是必需的。此外,在先数据和本发明实验也表明单独缺乏vav2不会显著影响nk细胞的adcc或巨噬细胞的adcp。总的来说,我们的研究表明,选择性靶向vav2可以消除fcγr的有害作
用并在mab治疗期间保持其治疗功效。
108.具体地,本发明还进一步地构建复杂的动物模型以确定成纤维细胞中的fcγr功能,并证明了抑制成纤维细胞cd16后,提高了曲妥珠单抗在pdx和caf肿瘤细胞共注射异种移植模型中的功效。
109.药物递送和渗透对于抗癌药物的功效至关重要。药物转运到肿瘤会遇到各种障碍,例如曲折的脉管系统、增加的间质液压力和致密的ecm。大部分肿瘤块由ecm构成,ecm决定了肿瘤细胞的理化特性。ecm中的胶原纤维是分子扩散的主要障碍,特别是对于较大的颗粒。此外,ecm表现出快速更新的特性,这为通过阻断ecm组分合成来修饰结缔组织形成提供了可能性。在本发明中,发现一部分cd16
成纤维细胞通过生成ecm成分诱导曲妥珠单抗耐药,且对于该过程,可以通过靶向vav2有效缓解。因此,本发明还提供了一种通过修饰ecm来提高抗肿瘤药物渗透的新策略。
110.总体上,本研究表明,一部分caf上的fcγr通过诱导结缔组织形成来促进mab抗性(图16f)。而且,本发明研究结果揭示了以前未被认识到的fcγr在肿瘤ecm重塑中的作用及其潜在机制。在临床上,可将caf中的vav2确定为改善mab治疗效果的潜在治疗靶点。
111.显然,本发明的上述实施例仅仅是为清楚地说明本发明技术方案所作的举例,而并非是对本发明的具体实施方式的限定。凡在本发明权利要求书的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。