hypertension.2016;34(11):2206-19.)。已有文献报道,组蛋白去乙酰化酶hdac3的作用是通过去除组蛋白上的乙酰基,将染色质转变为紧缩状态,从而不利于转录因子的结合进而抑制基因的表达,多种研究表明维持hdac3的活性对于维持细胞稳态至关重要(seo j,guk g,park sh,jeong mh,jeong jh,yoon hg,et al.tyrosine phosphorylation of hdac3 by src kinase mediates proliferation of her2-positive breast cancer cells.journal of cellular physiology.2019;234(5):6428-36.)。如hdac3通过去乙酰化修饰降低pparγ基因的表达进而促进血管平滑肌细胞的增殖和炎症发生。(xu x,he m,liu t,zeng y,and zhang w.effect of salusin-beta on peroxisome proliferator-activated receptor gamma gene expression in vascular smooth muscle cells and its possible mechanism.cell physiol biochem.2015;36(6):2466-79.)。因此,本领域医学科研人员一直在大量实验中努力寻求hdac3在血管重构中新作用,但目前尚未取得满意的进展。
技术实现要素:
4.针对上述现有技术存在的不足,本发明的目的在于提供一种组蛋白去乙酰化酶hdac3在制备防治支架及内膜剥脱术后血管再狭窄的药物中的应用。组蛋白去乙酰化酶hdac3能够发挥其去乙酰化酶活性,调控血管平滑肌细胞的增殖与内膜新生,将hdac3作为靶标,通过抑制其在细胞内的表达与活性进而防治因血管内膜损伤而导致的再狭窄。
5.为达到上述目的,本发明通过下述技术方案实现:
6.本发明提供一种组蛋白去乙酰化酶hdac3在制备防治支架及内膜剥脱术后血管再狭窄的药物中的应用。
7.优选地,防治支架及内膜剥脱术后血管再狭窄是通过抑制组蛋白去乙酰化酶hdac3在细胞或组织中的表达和活性实现的。
8.进一步地,抑制组蛋白去乙酰化酶hdac3在细胞或组织中的表达和活性能够抑制血管损伤后内膜新生。
9.再进一步地,抑制组蛋白去乙酰化酶hdac3在细胞或组织中的表达和活性能够抑制血管平滑肌细胞增殖。
10.再进一步地,抑制组蛋白去乙酰化酶hdac3在细胞或组织中的表达和活性的方法包括基因编辑、rnai技术和hdac3抑制剂中的至少一种。
11.再进一步地,基因编辑包括基因敲除、基因修饰和单碱基编辑中的至少一种。
12.再进一步地,rnai技术通过小分子双链rna抑制组蛋白去乙酰化酶hdac3在细胞中的表达和活性;rnai技术包括靶向脂质纳米包涵体、病毒转染、干细胞修饰、单链片段抗体融合蛋白中的至少一种。
13.再进一步地,组蛋白去乙酰化酶hdac3抑制剂的给药方式包括口服给药、静脉注射给药、皮下包埋给药、药物洗脱支架给药、药物涂层球囊给药中的至少一种。
14.再进一步地,组蛋白去乙酰化酶hdac3抑制剂的给药方式包括选用药物洗脱支架给药和药物涂层球囊给药两种方式。
15.优选地,组蛋白去乙酰化酶hdac3作为靶标用于治疗冠脉搭桥术后、血管支架植入术后、以及内膜剥脱术后的血管再狭窄。
16.本发明与现有技术相比,具有如下优点及有益效果:
17.本发明研究结果证实:组蛋白去乙酰化酶hdac3是通过发挥乙酰化的作用来调控血管平滑肌细胞的增殖。本发明还发现了可以通过抑制组蛋白去乙酰化酶hdac3的表达与活性来防治手术后血管再狭窄的作用机制,并通过应用hdac3抑制剂rgfp966能够有效抑制血管平滑肌细胞的增殖从而抑制血管内膜新生。
18.基于组蛋白去乙酰化酶hdac3在血管损伤后内膜新生导致再狭窄中的作用,组蛋白去乙酰化酶hdac3的特异性抑制剂可用于制备防治因内膜损伤、冠脉搭桥术后、血管支架植入术后、血管剥脱术后再狭窄的药物。
19.综上所述,本发明对hdac3的研究表明,其能够成为干预血管平滑肌增殖并缓解内膜增生的新靶点,进而为应对血管内膜再狭窄提供新的治疗思路,其临床意义十分重大。
附图说明
20.图1为与对照组相比,在血管平滑肌细胞中过表达hdac3后,血管平滑肌细胞计数的差异变化图;
21.图2为与对照组相比,在血管平滑肌细胞中过表达hdac3后,edu实验反映的血管平滑肌细胞增殖水平的差异图;
22.图3为与对照组相比,在血管平滑肌细胞中过表达hdac3后,血管平滑肌增殖标志蛋白pcna与p-h3的表达量差异图;其中,图3a为血管平滑肌增殖标志蛋白pcna与p-h3的表达情况图,图3b为血管平滑肌增殖标志蛋白pcna与p-h3的表达量柱状图;
23.图4为与对照组相比,内膜损伤模型小鼠中受损颈动脉组织中hdac3的组织化学染色差异变化图;
24.图5为与dmso对照组相比,加入hdac3抑制剂rgfp966后的血管平滑肌细胞计数的差异变化图;
25.图6为与dmso对照组相比,加入hdac3抑制剂rgfp966后,edu实验反映血管平滑肌细胞增殖水平差异图;
26.图7为与dmso对照组相比,加入hdac3抑制剂rgfp966后,血管平滑肌增殖标志蛋白pcna与p-h3的表达量差异图;其中,图7a为血管平滑肌增殖标志蛋白pcna与p-h3的表达情况图;图7b为血管平滑肌增殖标志蛋白pcna与p-h3的表达量柱状图;
27.图8为与对照组相比,内膜损伤模型小鼠应用rgfp966后的内膜组织he染色图;
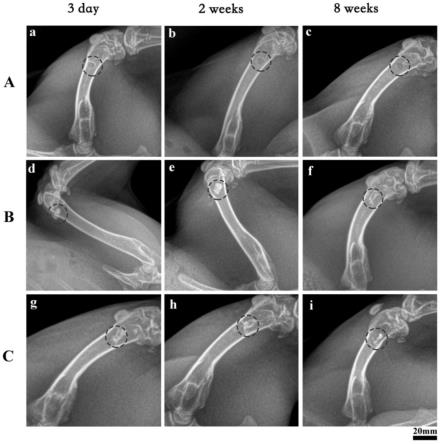
28.图9为与对照组相比,内膜损伤模型小鼠应用rgfp966后内膜新生面积的统计柱状图;
29.图10为与对照组相比,内膜损伤模型小鼠应用rgfp966后内膜厚度的统计柱状图。
具体实施方式
30.以下结合附图、实施例和实验例对本发明作进一步的详细描述。当然,本发明的保护范围并不限于下述实施例。本领域专业技术人员能够理解,在不背离本发明精神的前提下,可以对本发明进行各种变化和修饰。本发明对实验中所使用到的材料以及试验方法进行一般性和/或具体的描述。虽然为实现本发明目的所使用的许多材料和操作方法是本领域公知的,但本发明仍然在此作尽可能详细的描述。以下实施例是进一步说明本发明,而不
是限制本发明。任何依据本发明构思所作出的仅仅为形式上的而非实质性的等效变换都应视为本发明技术方案的范畴。
31.下述实施例中所述试验方法或测试方法,如无特殊说明,均为常规方法;所述试剂和材料,如无特殊说明,均从常规商业途径获得,或以常规方法制备。
32.1.原代主动脉平滑肌细胞的分离培养
33.(1)人的主动脉平滑肌细胞:本研究采用的人主动脉平滑肌分离自人主动脉血管组织,所有血管都来自华中科技大学同济医学院附属同济医院心脏大血管外科暨心肺移植中心,所获取的标本均获得患者和家属的知情同意。分离纯化后的平滑肌细胞经平滑肌特异性免疫荧光抗体验证其细胞纯度。
34.(2)组织块贴壁分离培养法:在解剖显微镜下分离出主动脉同时剥去血管外膜,纵向剪开血管并刮掉内膜细胞,将处理后的血管中膜置于培养瓶中,使用显微剪剪碎血管成1mm3的碎片,并均匀铺在培养瓶底面。竖立培养瓶,并加入含10%胎牛血清和1%双抗(青霉素和链霉素)的dme/f12完全培养基,保持该方向置于37℃培养箱中贴壁20min后旋转培养瓶,使其水平放置,并让组织块浸润在培养基中。在37℃、5%co2培养箱中培养一周后,在光学显微镜下观察组织块周围长出几个主动脉平滑肌细胞,经过细胞传代后,见到细胞呈现梭形外观,则为主动脉平滑肌细胞。
35.2.细胞传代
36.(1)提前打开紫外线照射灯,照射超净工作台半小时,同时预热dem/f12完全培养基、pbs和双抗。
37.(2)小心拿出培养箱中细胞,在显微镜下评估细胞密度和状态,大约长满则可以传代。
38.(3)用真空泵吸走上清,再用pbs清洗。
39.(4)加入1ml胰酶,使其均匀覆盖皿底部,然后置于镜下进行观察,当细胞都变圆后,轻拍细胞侧壁使其脱落,立即加入1ml完全培养基终止消化。用枪混匀细胞悬液,并转移到15ml离心管中,1000rpm离心5min。
40.(5)离心时,提前准备好培养皿并加入5ml培养基,并标记好细胞类型和日期。
41.(6)离心结束,倒掉上清,加入1ml培养基重悬细胞,按照传代比例,将悬液均分到准备好的培养皿中。
42.(7)十字混匀,再将细胞轻轻放入37℃、5%co2培养箱中。
43.3.主动脉平滑肌细胞蛋白的提取
44.(1)取出细胞,倒掉培养基,残余液体用枪头吸走,并加入pbs冲洗细胞一遍,再倒掉pbs,残余液体用枪头吸走,并加入裂解液。
45.(2)先用手摇匀,使裂解液覆盖住细胞,并放入4度摇床上裂解10min,同时取出离心管标注信息。
46.(3)用细胞刮刮下细胞蛋白到离心管中,并静置裂解10min。
47.(4)超声:15%功率,超1秒,停2秒,静置5min后,再重复超声一次,再静置10min。
48.(5)离心:12000r,30min,取上清到新的离心管中。
49.(6)变性:按照相应体积加入5
×
sds loading、蛋白上清,涡旋一会,于掌上离心机上瞬离下来后,95度水浴变性10min后,离心,再95度变性10min,后离心。
50.4.蛋白质免疫印迹
51.(1)上样与电泳:提前制作好聚丙烯酰胺凝胶,再将制好的凝胶架在电泳槽中。向凝胶架中加满内液,然后加入电泳外液使得其占电泳槽总容量的2/3外液,内液需新鲜配置。将蛋白样品加入凝胶上样孔内,恒压80-90v电泳。
52.(2)转膜:配置转膜液:称取3.03gtribase,14.4g甘氨酸,200ml甲醇和800ml双蒸水,并置于4度冰箱提前预冷。根据样品数量以及被敷蛋白的分子量大小决定裁剪pvdf膜的长度和宽度,同时于膜右上角处做标记,一般采取剪切口的方式。使用前,去除保护纸,并在甲醇中激活后备用。浸泡转膜所需海绵垫和滤纸,并利用夹子,左右摊开,夹子的黑色面(负极)朝右,依次放入海绵垫、滤纸、凝胶、pvdf膜,使得膜和凝胶之间无气泡,然后再放入滤纸、海绵垫,最后用玻璃棒来回滚动去除气泡,合上夹子。将夹子置入转膜槽中,夹的黑面对应槽的黑面,夹子的白面对应转膜槽的红面,最后加入转膜液,最好没过夹子。接通电源,恒流约0.2a。起始电压应在100-130v之间,转膜时间根据蛋白分子量来决定,分子量越大转膜时间越长。转膜结束后,打开夹子,用镊子小心夹取pvdf膜。
53.(3)封闭:转膜结束后,采用5%脱脂牛奶封闭1小时。
54.(4)一抗孵育:tbst洗pvdf膜,5分钟,洗3次,随后根据所孵蛋白分子量大小裁剪pvdf膜,加入一抗,4℃摇床孵育过夜。
55.(5)二抗孵育:回收一抗,并采用tbst洗pvdf膜,5分钟,洗3次。按照1:10000的比例稀释二抗,并室温孵育1小时。
56.(6)显影:二抗孵育结束后用tbst洗10分钟,洗3次。然后将显影液的a、b液混合均匀与pvdf膜进行反应,然后在曝光机中曝光,分析结果。
57.5.主动脉平滑肌细胞慢病毒感染以敲低hdac3
58.(1)构建慢病毒载体质粒:利用sigma网站检索hdac3过表的mrna序列,将该序列与ha载体连接,最终构建出hdac3慢病毒敲低质粒。
59.(2)配置转染试剂:10cm细胞培养皿一般给与6ml培养基,采取1/10的培养基体积作为反应体系,因此10cm皿反应体系为600ul。准备2个ep管,其中一个管中加入300ul空的dmem培养以及24ul max,混匀。另一个ep管中加入300ul不含血清dmem培养基、6ug目的质粒、3ug spex2和3ug pmd2g(spex2和pmd2g为病毒骨架质粒),混匀,然后将2个离心管中液体混匀,并静止15min。
60.(3)取出293t细胞,细胞密度40%-60%左右,然后轻轻加入上述混合液,十字混匀,放入37℃、5%co2培养箱培养。
61.(4)8h后,弃掉上清,加入6ml完全dmem培养基,并继续放入37℃、5%co2培养箱中培养;
62.(5)每24h收集一次病毒上清,然后换液,收集2次。
63.(6)将24小时和48小时病毒上清混匀,12000rpm离心30min,并用0.22um滤网过滤细胞残渣;
64.(7)取出待感染细胞,弃掉上清,加入3ml病毒上清和3ml dme/f12完全培养基,37℃、5%co2感染24小时;
65.(8)24h后,弃掉上清,换为完全培养基培养,培养48小时之后进行收蛋白。
66.6.细胞计数
67.(1)从培养箱中取出待计数的细胞,弃上清,加入pbs洗,然后6cm皿给与300ul胰酶消化,然后显微镜下观察,至细胞变圆,轻拍侧壁使细胞脱落,再加入700ul完全培养基终止反应。
68.(2)用酒精擦拭血球计数板,然后盖上盖玻片,沿玻片边缘缓慢加入上述细胞悬液,然后在显微镜下观察细胞计数板上四个大方格的细胞总数,然后四个大方格细胞总数/4
×
104数即为每毫升的细胞数,重复3次,计算其平均值,每组5个副孔。
69.7.edu增殖染色试剂盒
70.(1)爬片:按照合适密度将细胞铺在12孔板中,并提前放入细胞爬片,贴壁后进行相应的给药或病毒感染处理。
71.(2)采用完全培养基,按照1000:1的比例稀释edu溶液。
72.(3)edu孵育:进行给药或病毒感染之后的细胞,弃掉培养基,12孔板的每孔加入500μl稀释后的edu培养基,37℃、5%co2恒温培养箱孵育4小时后,弃培养基。
73.(4)pbs洗5分钟
×
2次。
74.(5)然后每孔加入500μl组织固定液,固定30分钟后,弃去。
75.(6)每孔加入500μl 2mg/ml甘氨酸中和多余醛基,孵育5分钟后弃上清。
76.(7)pbs洗5分钟
×
2次。
77.(8)每孔加入500μl 0.5%tritonx-100(pbs配置),脱色摇床上通透10分钟,pbs清洗5分钟。
78.(9)染色液的配置:
[0079][0080]
(10)提前配好染色液,然后500μl/孔,室温避光孵育30分钟。
[0081]
(11)弃掉染色液,再次使用0.5%tritonx-100(pbs配置)进行通透,每次10min,通透2次。
[0082]
(12)每孔加入500μl甲醇清洗5分钟,清洗2次,然后pbs清洗5分钟。
[0083]
(13)去离子水按100:1的比例稀释试剂f,避光放置。
[0084]
(14)加入500μl 1
×
稀释后的f反应液,避光孵育半小时后,弃染色液。
[0085]
(15)加入500μl pbs清洗,5分钟
×
3次。
[0086]
(16)取出载玻片,挑出爬片,倒置放在载玻片上,荧光显微镜下观察,拍照。
[0087]
8.内膜损伤小鼠模型构建
[0088]
(1)颈动脉钢丝损伤小鼠模型的构建:所有动物实验方案均经华中科技大学同济医院动物保护与使用委员会批准。
[0089]
(2)用戊巴比妥钠(80mg/kg,腹腔注射)麻醉小鼠。
[0090]
(3)做一个颈部中线切口,在解剖显微镜下仔细解剖左颈动脉。在分叉点近端用8-0缝线结扎颈外动脉。用血管夹阻断颈内动脉和颈总动脉血流。
[0091]
(4)在颈外动脉周围做一个横切口。用一根导丝朝着主动脉弓方向进入,旋转退出5次。
[0092]
(5)小心地取出导丝后,取出血管夹,恢复血流,然后关闭皮肤切口。
[0093]
(6)术后,小鼠腹腔注射rgfp966(selleck,货号s7229),剂量为每只每天10mg/kg,对照组小鼠接受相同剂量的dmso,治疗28天收集动物组织进行形态学和生化检测。
[0094]
9.结果
[0095]
(1)在血管平滑肌细胞中过表达hdac3后,血管平滑肌细胞的数量与增殖水平相较于对照组有明显的增长,且在过表并点突变y298h后,血管平滑肌细胞的数量与增殖水平又恢复正常水平,如图1、图2。此外,增殖标记物pcna与p-h3的相对表达水平在血管平滑肌细胞过表达hdac3后也明显上调,如图3。免疫组化实验验证了在内膜损伤模型小鼠的受损颈动脉组织中hdac3的相对表达是上升的,如图4。上述实验证明了hdac3是通过发挥乙酰化的作用来调控血管平滑肌细胞的增殖水平的。
[0096]
(2)通过给与hdac3抑制剂rgfp966,血管平滑肌细胞的数量与增殖水平相较于对照组下降,如图5、图6。增殖标记物pcna与p-h3的相对表达水平在血管平滑肌细胞中给予rgfp966后也明显下调,如图7。组织he染色显示相较于对照组,内膜损伤模型小鼠应用rgfp966后内膜新生的面积和内膜与中膜厚度比是下降的,如图8、图9、图10。上述实验证明了应用hdac3抑制剂rgfp966能够有效抑制血管平滑肌细胞的增殖与增生。
[0097]
本发明发现了hdac3可以通过发挥去乙酰化作用促进血管平滑肌细胞的增殖。本发明还发现了通过降低hdac3在血管平滑肌细胞中的表达与活性,能够抑制血管平滑肌的增殖,进而减缓血管内膜损伤后的内膜新生过程。本发明可将靶向hdac3在血管平滑肌细胞中的功能应用于防治支架及内膜剥脱术后血管再狭窄中,为临床防治此类疾病提供新的思路。
[0098]
质粒序列:
[0099]
hdac3(y298h)f:
[0100]5’‑
ctgggtggtggtggtcacactgtccgaaatgttg-3’[0101]
hdac3(y298h)r:
[0102]5’‑
caacatttcggacagtgtgaccaccaccacccag-3’[0103]
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修饰、等同替换、改进等等,均应包含在本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。