1.本发明涉及一种包含asah1开放阅读框的载体,用于治疗酸性神经酰胺酶缺乏症,如与进行性肌阵挛性癫痫相关的脊髓性肌萎缩症或法伯(farber)病。
背景技术:
2.酸性神经酰胺酶缺乏症是包括称为法伯病(fd)的罕见溶酶体贮积症和称为脊髓性肌萎缩症伴进行性肌阵挛性癫痫(sma-pme)的罕见癫痫病在内的一系列疾病。fd和sma-pme均是因酸性神经酰胺酶(asah1)基因中发生突变引起的,这导致酸性神经酰胺酶活性降低,进而导致神经酰胺积聚以及各种病理表现。fd是一种早发疾病,原因是酸性神经酰胺酶活性低于10%,而残余活性较高则是造成sma-pme的原因,sma-pme具有仅限于中枢神经系统(cns)且始于下运动神经元病的晚发表型。fd始于皮下脂肪肉芽肿、关节痛和声音嘶哑。还观察到,神经和内脏受累分别导致精神运动性迟滞和肝脾肿大。大部分fd患者表现出生长发育障碍,且活不过2岁。包括骨髓在内的受影响的组织中通常存在由泡沫组织细胞和巨噬细胞构成的结节和炎症,这突出了造血系统在疾病中的潜在作用。此外,白细胞似乎主要是在法伯病中发生失调。sma-pme在婴儿期临床表现为一种下运动神经元病,伴有肌肉无力、行走困难和震颤。癫痫伴肌阵挛发作通常在儿童晚期出现,随着病情演变还可能出现其他临床表现,如认知能力下降、脊柱侧弯和听力丧失。患者一般会在青少年时期因呼吸衰竭而死亡。
3.目前还没有治愈酸性神经酰胺酶缺乏症的方法(yu等人,2018;orphanet journal or rare diseases;13:121)。因此,目前的治疗策略仅限于症状管理和支持治疗。造血干细胞移植(hsct)显示出一些有希望的结果,在许多没有影响cns的fd患者中,其活动性和疼痛均有实质性的改善。然而,在患有经典fd并伴有cns并发症的患者中进行的hsct并没有逆转神经表型,并且随着时间的推移,患者病情恶化。还提出了离体基因疗法,其中从患者或供体中分离出造血干细胞(hsc),使用慢病毒载体通过基因矫正对其进行修饰,然后再移植至有需要的患者中。然而,由于在接受慢病毒载体/酸性神经酰胺酶转导的造血细胞的非人灵长类的大脑中未观察到显著变化,所以这种方法可能无法有效解决asah1缺乏症的神经表型(walia等人,2011;hum gene ther;22,第679
–
687页)。酶替代疗法(ert)也在开发中,包括向有需要的患者注射重组酸性神经酰胺酶。然而,ert策略在神经表型方面面临局限性,因为酶穿过血脑屏障的能力很差。
4.因此,仍然急需一种针对酸性神经酰胺酶缺乏症例如sma-pme和法伯病的有效疗法。
技术实现要素:
5.令人惊喜的是,本发明发现了包含asah1开放阅读框(orf)的腺相关(aav)载体是治疗fd和sma-pme的高效基因治疗载体。特别地,在此证明,由于本发明,cns和外周改变均得到了矫正。本发明是对目前开发的治疗方法的重大改进,因为迄今为止,还没有其他治疗
方法能够矫正这两种改变。
6.在第一方面,本发明涉及一种重组aav(raav)载体,包含asah1orf。该载体可以用于治疗酸性神经酰胺酶缺乏症的方法中。特别地,所述raav载体可以用于治疗选自法伯病(fd)和与进行性肌阵挛性癫痫相关的脊髓肌萎缩症(sma-pme)的疾病的方法中。在具体的实施方案中,所述aav载体用于治疗囊性纤维化的方法中。在具体的实施方案中,所述载体是一种能够穿过血脑屏障的aav载体。具有能穿过血脑屏障的能力的说明性aav载体包括但不限于包含aav9衣壳、aav9p1衣壳、aavpo1a1衣壳、aav10衣壳例如aavrh.10或aavcy.10衣壳、aavrh.39衣壳或进化枝f aavhsc衣壳的载体。在进一步的实施方案中,所述aav载体包含aav9衣壳、aav10衣壳例如aavrh.10或aavcy.10衣壳、aavrh.39衣壳或进化枝f aavhsc衣壳。在另一个实施方案中,所述aav载体包含aav9或aav10衣壳。在又一个实施方案中,所述aav载体包含aav9衣壳。
7.对于表达,asah1 orf包含在表达盒中,与调控序列可操作连接。这种调控序列包括但不限于启动子、内含子、增强子和多聚腺苷酸化信号。在具体的实施方案中,所述asah1 orf受遍在性启动子控制。在另一个实施方案中,所述遍在性启动子选自cag启动子、pgk启动子或β葡萄糖醛酸酶启动子。在进一步的实施方案中,所述asah1 orf受cag启动子或pgk启动子控制。在具体的实施方案中,所述启动子为cag启动子。在具体的实施方案中,所述cag启动子具有seq id no:9所示的序列,或者所述启动子为所述启动子的具有与seq id no:9有至少80%同一性特别是与seq id no:9有至少85%、至少90%、至少95%或至少99%同一性的核苷酸序列的功能变体。在具体的实施方案中,所述启动子由与seq id no:9有至少99%同一性的核酸序列组成,或者由seq id no:9所示的核酸序列组成。在具体的实施方案中,所述pgk启动子具有seq id no:3所示的序列,或者所述启动子为所述启动子的具有与seq id no:3有至少80%同一性特别是与seq id no:3有至少85%、至少90%、至少95%或至少99%同一性的核苷酸序列的功能变体。在具体的实施方案中,所述启动子由与seq id no:3有至少99%同一性的核酸序列组成,或者由seq id no:3所示的核酸序列组成。
8.在另一个实施方案中,根据包括在表达盒中的启动子,所述盒还可以包含内含子。例如,所述盒还可以包含人β珠蛋白基因的经修饰的内含子2/外显子3序列。在具体的实施方案中,如果所述启动子为pgk启动子,则所述盒还可以包含内含子,如人β珠蛋白基因的经修饰的内含子2/外显子3序列。在具体的实施方案中,所述人β珠蛋白基因的经修饰的内含子2/外显子3序列具有seq id no:4所示的序列,或者为seq id no:4所示的序列的功能变体,所述功能变体与seq id no:4有至少80%的同一性,特别是与seq id no:4有至少85%、至少90%、至少95%或至少99%的同一性。在具体的实施方案中,所述包含在盒中的内含子由与seq id no:4有至少99%同一性的核酸序列组成,或者由seq id no:4所示的核酸序列组成。
9.在又一个实施方案中,所述表达盒包含多聚腺苷酸化信号,所述多聚腺苷酸化信号选自asah1基因的多聚腺苷酸化信号、来自人β珠蛋白基因的多聚腺苷酸化信号(hbb pa)、牛生长激素多聚腺苷酸化信号、sv40多聚腺苷酸化信号和合成多聚腺苷酸(polya),如seq id no:1的合成多聚腺苷酸化信号。在具体的实施方案中,所述多聚腺苷酸化信号为hbb多聚腺苷酸化信号,如具有由seq id no:2组成的序列的hbb多聚腺苷酸化信号,或其具有与seq id no:2所示的序列有至少80%同一性特别是与seq id no:2有至少85%、至少
90%、至少95%或至少99%同一性的核苷酸序列的功能变体。
10.在具体的实施方案中,asah1 orf为来源于asah1野生型基因的人asah1 orf。在具体的实施方案中,asah1 orf的核酸序列为野生型序列或优化序列。
11.基因组中引入的表达盒两侧为适合将所述表达盒包装至aav病毒载体中的序列,称为aav反向末端重复(itr)序列。因此,所述表达盒的两侧为aav 5'-itr和aav 3'-itr,以进一步将其包装至aav载体中。在具体的实施方案中,所述表达盒两侧为aav2 5'-itr和aav2 3'-itr。
12.所述raav载体的基因组可以为单链基因组或自互补基因组。在具体的实施方案中,所述aav载体的基因组是单链的。
13.在具体的实施方案中,本发明的raav载体包含表达盒,所述表达盒依次包含:
[0014]-cag启动子;
[0015]-asah1 orf;和
[0016]-多聚腺苷酸化信号序列,如hbb多聚腺苷酸化信号。
[0017]
在具体的实施方案中,所述cag启动子具有seq id no:9所示的序列,或者所述启动子为所述启动子的具有与seq id no:9有至少80%同一性特别是与seq id no:9有至少85%、至少90%、至少95%或至少99%同一性的核苷酸序列的功能变体。在具体的实施方案中,所述启动子由与seq id no:9有至少99%同一性的核酸序列组成,或者由seq id no:9所示的核酸序列组成。
[0018]
在又一个实施方案中,本发明的raav载体包含表达盒,所述表达盒依次包含:
[0019]-pgk启动子;
[0020]-人β珠蛋白基因的经修饰的内含子2/外显子3序列;
[0021]-asah1 orf;和
[0022]-多聚腺苷酸化信号,如hbb多聚腺苷酸化信号。
[0023]
在具体的实施方案中,所述pgk启动子具有seq id no:3所示的序列,或者所述启动子为所述启动子的具有与seq id no:3有至少80%同一性特别是与seq id no:3有至少85%、至少90%、至少95%或至少99%同一性的核苷酸序列的功能变体。在具体的实施方案中,所述启动子由与seq id no:3有至少99%同一性的核酸序列组成,或者由seq id no:3所示的核酸序列组成。
[0024]
在具体的实施方案中,人β珠蛋白基因的经修饰的内含子2/外显子3序列具有seq id no:4所示的序列,或者为seq id no:4所示的序列的功能变体,所述功能变体具有与seq id no:4有至少80%的同一性,特别是与seq id no:4有至少85%、至少90%、至少95%或至少99%的同一性。在具体的实施方案中,所述包含在盒中的内含子由与seq id no:4有至少99%同一性的核酸序列组成,或者由seq id no:4所示的核酸序列组成。
[0025]
在第二方面,本发明涉及本发明的raav载体,用于通过基因疗法治疗疾病的方法中。在具体的实施方案中,本发明涉及本发明的raav载体,用于治疗酸性神经酰胺酶缺乏症的方法中。在具体的实施方案中,所述载体用于治疗囊性纤维化的方法中。在优选的实施方案中,所述酸性神经酰胺酶缺乏症为fd或sma-pme。在具体的实施方案中,所述酸性神经酰胺酶缺乏症为sma-pme。在具体的实施方案中,本发明的raav载体用于治疗fd的方法中。在又一个实施方案中,所述raav载体用于治疗fd的至少一种神经和/或外周临床表现的方法
中。在进一步的实施方案中,所述raav载体用于至少治疗fd的血液学表现的方法中。在实施方案中,所述raav载体用于治疗fd的神经和血液学表现的方法中。
[0026]
在具体的实施方案中,通过本技术定义的raav载体为raav9载体,用于通过基因疗法治疗疾病的方法中。在具体的实施方案中,本发明涉及本文所公开的raav9,用于治疗酸性神经酰胺酶缺乏症的方法中。在具体的实施方案中,所述载体用于治疗囊性纤维化的方法中。在优选的实施方案中,所述酸性神经酰胺酶缺乏症为fd或sma-pme。在具体的实施方案中,所述raav9载体用于治疗fd的方法中。在又一个实施方案中,所述raav9载体用于治疗法伯病(fd)的至少一种神经和/或外周临床表现的方法中。在进一步的实施方案中,所述raav载体用于至少治疗fd的血液学表现的方法中。在实施方案中,所述raav9载体用于治疗fd的神经和血液学表现的方法中。
[0027]
在另一个实施方案中,所述raav载体用于给药到受试者的脑脊液中,特别地通过鞘内和/或脑室内注射给药到受试者的脑脊液中。或者,所述raav载体用于外周给药,如用于血管内(例如静脉内或动脉内)给药、肌肉内给药或腹膜内给药。
[0028]
在又一个实施方案中,所述raav载体包含aav9衣壳,所述asah1 orf受cag启动子控制,并且所述raav载体用于血管内给药。在实施方案中,所述raav载体包含aav9衣壳,所述asah1 orf受cag启动子控制,并且所述raav载体用于静脉内给药。在实施方案中,所述raav载体包含aav9衣壳,所述asah1 orf受cag启动子控制,并且所述raav载体用于动脉内给药。
[0029]
在又一个实施方案中,所述raav载体包含aav9衣壳,所述asah1 orf受pgk启动子控制,并且所述raav载体用于血管内给药。在实施方案中,所述raav载体包含aav9衣壳,所述asah1 orf受pgk启动子控制,并且所述raav载体用于静脉内给药。在实施方案中,所述raav载体包含aav9衣壳,所述asah1 orf受pgk启动子控制,并且所述raav载体用于动脉内给药。
附图说明
[0030]
图1:未经治疗的asah
p361r/p361r
小鼠、野生型动物和在3周龄时以5x10
13
vg/kg用包含受cag启动子控制的hasah1转基因的raav载体静脉内治疗的asah
p361r/p361r
小鼠的kaplan-meyer生存曲线。
[0031]
图2:未经治疗的asah
p361r/p361r
小鼠、野生型动物和在7周龄时以5x10
13
vg/kg用包含受cag启动子控制的hasah1转基因的raav载体静脉内治疗的asah
p361r/p361r
小鼠的kaplan-meyer生存曲线。
[0032]
图3:对未经治疗的asah
p361r/p361r
小鼠、野生型动物和在3周龄时以5x10
13
vg/kg用包含受cag启动子控制的hasah1转基因的raav载体静脉内治疗的asah
p361r/p361r
小鼠的体重的评估。所有组的性别均衡。数据表示为平均值
±
sem,通过多重t检验比较wt pbs、asah
p361r/p361r
pbs与asah
p361r/p361r
aav-hasah1的曲线之间的差异(*p《0,05;**p《0,0001)。
[0033]
图4:对未经治疗的asah
p361r/p361r
小鼠、野生型动物和在7周龄时以5x10
13
vg/kg用包含受cag启动子控制的hasah1转基因的raav载体静脉内治疗的asah
p361r/p361r
小鼠的体重的评估。所有组的性别均衡。数据表示为平均值
±
sem,通过多重t检验比较wt pbs、asah
p361r/p361r
pbs与asah
p361r/p361r
aav-hasah1的曲线之间的差异(*p《0,05;**p《0,001;$p
《0,0001)。
[0034]
图5:治疗10周后在3周龄时注射的小鼠中的组织重量与总体重之比(mg/g)。结果表示为平均值
±
sem。通过多重t检验分析各组间的差异(*p《0.005)。
[0035]
图6:治疗6个月后在7周龄时注射的小鼠中的组织重量与总体重之比(mg/g)。结果表示为平均值
±
sem。通过多重t检验分析各组间的差异(无统计学显著差异)。
[0036]
图7:对治疗4周后包含hasah1转基因的raav载体对全血细胞计数的影响的评估。3周龄时治疗小鼠。直方图显示出未经治疗的asah
p361r/p361r
小鼠、野生型动物和以5x10
13
vg/kg用包含受cag启动子控制的hasah1转基因的raav载体静脉内治疗的asah
p361r/p361r
小鼠的结果。结果表示为平均值
±
sem。通过多重t检验分析各组间的差异(*p《0.001)。
[0037]
图8:对治疗4周后包含hasah1转基因的raav载体对全血细胞计数的影响的评估。7周龄时治疗小鼠。直方图显示出未经治疗的asah
p361r/p361r
小鼠、野生型动物和以5x10
13
vg/kg用包含受cag启动子控制的hasah1转基因的raav载体静脉内治疗的asah
p361r/p361r
小鼠的结果。结果表示为平均值
±
sem。通过多重t检验分析各组间的差异(*p《0,05;**p《0,001)。
[0038]
图9:对未经治疗的asah
p361r/p361r
小鼠、野生型动物和在3周龄时通过静脉内途径用包含hasah1转基因的raav载体治疗的asah
p361r/p361r
小鼠的肌肉力量的评估。结果表示为平均值
±
sem。通过多重t检验分析各组间的差异(*p《0,01;**p《0,0001)。
[0039]
图10:对未经治疗的asah
p361r/p361r
小鼠、野生型动物和通过静脉内途径用包含hasah1转基因的raav载体治疗的asah
p361r/p361r
小鼠的肌肉力量的评估。7周龄时治疗小鼠。结果表示为平均值
±
sem。通过多重t检验分析各组间的差异(*p《0,05;**p《0,0005)。
[0040]
图11:对未经治疗的asah
p361r/p361r
小鼠、野生型动物和出生(p0)时以1x10
13
vg/kg用包含受cag启动子控制的hasah1转基因的raav载体通过脑室内注射治疗的asah
p361r/p361r
小鼠的体重的评估。结果表示为平均值
±
sem。通过多重t检验分析各组间的差异(*p《0,05;**p《0,00001)。
[0041]
图12:对未经治疗的asah
p361r/p361r
小鼠、野生型动物和出生(p0)时以1x10
13
vg/kg用包含受cag启动子控制的hasah1转基因的raav载体通过脑室内注射治疗的asah
p361r/p361r
小鼠的肌肉力量的评估。结果表示为平均值
±
sem。通过多重t检验分析各组间的差异(*p《0,005)。
具体实施方式
[0042]
根据本发明,术语“约”在指代数值时意指该数值的 /-5%。
[0043]
在本发明的上下文中,定义为“aavx载体”或“raavx”载体的载体为一种包含血清型x衣壳的载体。例如,包含aav9衣壳或aav10衣壳的载体分别称为“aav9载体”或“aavrh10载体”,与raav载体中包含的基因组的血清型来源无关。因而,aav9载体可以为包含aav9衣壳和aav9来源的基因组(即,包含aav9 itr)的载体或者为包含aav9衣壳和其血清型来源与aav9血清型不同的基因组的假型载体。同样地,aavrh.10载体可以为包含aavrh.10衣壳和aavrh.10来源的基因组(即,包含aarh10 itr)的载体或者为包含aavrh.10衣壳和其血清型来源与aavrh.10血清型不同的基因组的假型载体。该定义经必要修改后适用于包含与aav9和aav10衣壳不同的衣壳的其他aav载体。
[0044]
表达盒
[0045]
本发明的raav载体用于递送asah1 orf。所述基因包含在包含适宜的调控元件的表达盒中。
[0046]
在具体的实施方案中,asah1 orf来自人asah1(hasah1)基因。可以使用任何功能性asah1基因。在具体的实施方案中,hasah1 orf的核酸序列如seq id no:5所示来源于智人(homo sapiens)n-酰基鞘氨醇酰胺水解酶1(asah1)转录变体1mrna序列(基因库登记号为nm_177924),或者如seq id no:6所示来源于智人n-酰基鞘氨醇酰胺水解酶1(asah1)转录变体2mrna序列(基因库登记号为nm_004315.5),特别是如seq id no:5所示来源于转录变体1。在具体的实施方案中,本发明使用的hasah1 orf的核酸序列由seq id no:5或seq id no:6所示的序列特别是seq id no:5所示的序列组成,或包含它们。
[0047]
在另一个具体的实施方案中,优化asah1 orf的核酸序列。序列优化可以包括多个核酸序列变化,包括密码子优化、gc含量增加、cpg岛数量减少、可替代开放阅读框(arf)数量减少和/或剪接供体和剪接受体位点数量减少。由于遗传密码的简并性,不同的核酸分子可以编码相同的蛋白质。众所周知,不同生物的遗传密码通常偏倚使用编码相同氨基酸的几种密码子中的一种而不是其他密码子。通过密码子优化,发生了利用给定细胞环境中存在的密码子偏倚的核苷酸序列变化,以使得所得的密码子优化的核苷酸序列比非密码子优化的序列更有可能以较高的水平表达在此给定细胞环境中。在本发明的具体的实施方案中,这种序列优化的核苷酸序列是密码子优化的,以例如通过利用人特异性密码子使用偏倚与编码相同蛋白质的非密码子优化的核苷酸序列相比提高其在人类细胞中的表达。
[0048]
在具体的实施方案中,与野生型编码序列(如seq id no:5或6特别是seq id no:5的野生型人asah1序列)相比,优化的编码序列是密码子优化的,和/或其gc含量增加和/或可替代开放阅读框数量减少,和/或剪接供体和/或间接受体位点数量减少。
[0049]
在具体的实施方案中,asah1的核酸序列与seq id no:5或6所示特别是seq id no:5所示的序列有至少70%的同一性,特别是至少75%的同一性、至少80%的同一性、至少85%的同一性、至少86%的同一性、至少86%的同一性、至少87%的同一性、至少88%的同一性、至少89%的同一性、至少90%的同一性、至少91%的同一性、至少92%的同一性、至少93%的同一性、至少94%的同一性、至少95%的同一性、至少96%的同一性、至少97%的同一性、至少98%的同一性或至少99%的同一性。
[0050]
如上文所述,除了gc含量和/或arf的数量以外,序列优化还可以包括序列中cpg岛数量减少和/或剪接供体和受体位点数量减少。当然,如本领域技术人员所熟知,序列优化是所有这些参数之间的平衡,这意味着如果至少一个上述参数得到改进,而其他一个或多个参数未改进,只要优化序列使转基因得以改进,如表达改进和/或对转基因的体内免疫反应减少,那么就认为序列被优化。
[0051]
此外,asah1 orf的核苷酸序列对人细胞密码子使用的适应性可以表示为密码子适应指数(cai)。密码子适应指数在本文定义为基因的密码子使用对高表达的人类基因的密码子使用的相对适应性的测量。每个密码子的相对适应性(w)为每个密码子的使用与同一氨基酸的最丰富密码子的使用之比。cai定义为这些相对适应性值的几何平均数。不包括非同义密码子和终止密码子(取决于遗传密码)。cai值的范围为0至1,较高的值表示最丰富密码子的比例较高(参见sharp和li,1987,nucleic acids research 15:1281-1295;还参见kim等人,gene.1997,199:293-301;zur megede等人,journal of virology,2000,74:
2628-2635)。
[0052]
在具体的实施方案中,asah1 orf的核酸序列由野生型序列(如seq id no:5或seq id no:6特别是seq id no:5所示的序列)或优化序列(如seq id no:7或seq id no:8所示的序列)组成,或者包含它们。在进一步的具体的实施方案中,asah1 orf的核酸序列由野生型序列(如seq id no:5或seq id no:6特别是seq id no:5所示的序列)组成,或者包含它们。
[0053]
raav载体的基因组包含表达盒,所述表达盒包括asah1 orf。在本发明的上下文中,“表达盒”为一种包含基因(此处为asah1 orf)的核酸序列,该基因与允许在真核细胞中表达所述基因的序列可操作连接。在本发明的raav载体中,asah1 orf可以与一个或多个表达控制序列和/或提高基因表达的其他序列可操作连接。如本文所用,术语“可操作连接”是指多核苷酸元件在功能关系上的连接。当一个核酸与另一个核酸序列处于功能关系时是“可操作连接”的。例如,启动子或另一个转录调控序列如果影响了编码序列的转录,则其与编码序列可操作连接。这种表达控制序列在本领域是已知的,如启动子、增强子、内含子和多聚腺苷酸化信号。
[0054]
在本发明的raav载体中,asah1 orf与启动子可操作连接。
[0055]
根据具体的实施方案,使用遍在性启动子。代表性的遍在性启动子包括但不限于:
[0056]-cag启动子,其包括巨细胞病毒增强子/鸡β-肌动蛋白启动子、鸡β-肌动蛋白基因的第一外显子和第一内含子以及兔β-珠蛋白基因的剪接受体(seq id no:9);
[0057]-磷酸甘油酸激酶1(pgk)启动子,如seq id no:3所示的人pgk启动子;
[0058]-巨细胞病毒增强子/启动子(cmv)(任选地与cmv增强子一起)(参见,例如,boshart等人,cell,41:521-530(1985));
[0059]-sv40早期启动子;
[0060]-逆转录病毒劳氏(rous)肉瘤病毒(rsv)ltr启动子(任选地与rsv增强子一起);
[0061]-二氢叶酸还原酶启动子;
[0062]-β-肌动蛋白启动子;和
[0063]-ef1启动子。
[0064]
在本发明的实践中使用的其他遍在性启动子包括但不限于cb7启动子、β-葡萄糖苷酶(gusb)启动子和jeti启动子。
[0065]
根据另一个实施方案,特别是如果raav载体用于治疗sma-pme的方法中,则启动子可以为驱动在神经元或胶质细胞中选择性表达的启动子。驱动在神经元中表达的代表性启动子包括但不限于降钙素基因相关肽(cgrp)的启动子,cgrp是一种已知的运动神经元来源的因子。其他的神经元选择性启动子包括胆碱乙酰转移酶(chat)、神经元特异性烯醇化酶(nse)、突触蛋白、hb9的启动子和包括神经元限制性沉默元件(nrse)的遍在性启动子。驱动在胶质细胞中选择性表达的代表性启动子包括但不限于胶质纤维酸性蛋白基因(gfap)的启动子。
[0066]
根据另一个实施方案,如果raav载体用于治疗囊性纤维化的方法中,则启动子为驱动asah1蛋白在肺上皮细胞中表达的启动子。适于驱动在肺上皮细胞中表达的代表性启动子包括但不限于遍在性启动子和驱动在内脏上皮细胞中选择性表达特别是在肺上皮细胞中选择性表达的启动子。在本发明的实践中使用的用于治疗囊性纤维化的代表性启动子
包括但不限于人表面活性蛋白b(sp-b)启动子(描述于strayer等人,2002,am j physiol lung cell mol physiol,282(3):l394-404)、人细胞角蛋白18(k18)启动子及包含该启动子的构建体(如chow等人,1997,pnas,94(26),p.14695中描述的那些)、表面活性蛋白c(sp-c)启动子(描述于zhuo等人,2006,transgenic research,15,p.543)和ctp:磷酸胆碱胞苷酰转移酶启动子(cctα)(描述于zhou等人,2004,am j respir cell mol biol 30(1),p.61)。在具体的实施方案中,用于治疗囊性纤维化的raav载体为遍在性启动子,如本文所公开的cag或pgk启动子。
[0067]
在具体的实施方案中,启动子选自cag启动子或pgk启动子。
[0068]
在进一步的具体的实施方案中,cag启动子由seq id no:9所示的序列组成,或者为seq id no:9所示的序列的功能变体,该功能变体具有与seq id no:9所示的序列有至少80%同一性特别是与seq id no:9所示的序列有至少85%、至少90%、至少95%或至少99%同一性的核苷酸序列。在具体的实施方案中,启动子由核酸序列组成,该核酸序列为cag启动子的功能变体,与seq id no:9所示的序列有至少99%的同一性。在又一个实施方案中,启动子为具有由seq id no:9组成的核酸序列的cag启动子。
[0069]
在进一步的具体的实施方案中,pgk启动子由seq id no:3所示的序列组成,或者为seq id no:3所示的序列的功能变体,该功能变体具有与seq id no:3所示的序列有至少80%同一性特别是与seq id no:3所示的序列有至少85%、至少90%、至少95%或至少96%、97%、98%或99%同一性的核苷酸序列。在具体的实施方案中,启动子由核酸序列组成,该核酸序列为pgk启动子的功能变体,与seq id no:3所示的序列有至少99%的同一性。在又一个实施方案中,启动子为具有由seq id no:3组成的核酸序列的pgk启动子。
[0070]
在本发明的上下文中,启动子的功能变体为通过一个或多个核苷酸修饰如核苷酸取代、添加或缺失而从中衍生的序列,其导致与之可操作连接的asah1 orf的表达水平相同或基本相同(例如
±
20%,如
±
10%、
±
5%或
±
1%)。
[0071]
其他调控元件可以位于启动子的下游。例如,可以提供内含子以增加表达盒的表达。是否包含此类其他调控元件取决于在表达盒中使用的启动子以及由此得到的盒的大小。在具体的实施方案中,表达盒可以包含位于启动子下游的其他调控元件,如由人β珠蛋白基因的经修饰的内含子2/外显子3序列构成的序列。在具体的实施方案中,人β珠蛋白基因的经修饰的内含子2/外显子3序列具有seq id no:4所示的序列,或者为seq id no:4所示的序列的功能变体,该功能变体与seq id no:4有至少80%的同一性,特别是与seq id no:4有至少85%、至少90%、至少95%或至少96%、97%、98%或99%的同一性。在具体的实施方案中,其他调控元件为人β珠蛋白基因的经修饰的内含子2/外显子3序列的功能变体,该功能变体由与seq id no:4有至少99%同一性的核酸序列组成。在又一个实施方案中,其他调控元件为由seq id no:4所示的序列组成的经修饰的内含子2/外显子3序列。在本发明的上下文中,人β珠蛋白基因的经修饰的内含子2/外显子3序列的功能变体为通过一个或多个核苷酸修饰如核苷酸取代、添加或缺失而从中衍生的序列,其导致与之可操作连接的asah1 orf的表达水平相同或基本相同(例如
±
20%,如
±
10%、
±
5%或
±
1%)。
[0072]
在具体的实施方案中,表达盒包含pgk启动子(如具有seq id no:3所示的序列的启动子),以及位于所述启动子的下游、asah1 orf的上游的序列,该序列由seq id no:4所示的人β珠蛋白基因的经修饰的内含子2/外显子3序列构成。
[0073]
本发明的表达盒中的多聚腺苷酸化信号可以来源于多种基因。说明性的多聚腺苷酸化信号包括但不限于asah1基因多聚腺苷酸化信号、人β珠蛋白基因(hbb)多聚腺苷酸化信号、牛生长激素多聚腺苷酸化信号和sv40多聚腺苷酸化信号。在具体的实施方案中,多聚腺苷酸化信号为hbb多聚腺苷酸化信号,如具有由seq id no:2所示的序列组成的序列的hbb多聚腺苷酸化信号。在具体的实施方案中,hbb多聚腺苷酸化信号为seq id no:2所示的序列的功能变体,该功能变体与seq id no:2有至少80%的同一性,特别是与seq id no:2有至少85%、至少90%、至少95%或至少96%、97%、98%或99%的同一性。在另一个具体的实施方案中,多聚腺苷酸化信号为hbb多聚腺苷酸化信号的功能变体,该功能变体具有与seq id no:2所示的序列有至少99%同一性的序列。在进一步的实施方案中,多聚腺苷酸化信号为由seq id no:2所示的序列组成的hbb多聚腺苷酸化信号。在本发明的上下文中,hbb多聚腺苷酸化信号的功能变体为通过一个或多个核苷酸修饰如核苷酸取代、添加或缺失从中衍生的序列,该序列导致与之可操作连接的asah1 orf转基因的表达水平相同或基本相同(例如
±
20%,如
±
10%、
±
5%或
±
1%)。
[0074]
当然,kozak序列(例如gccacc)等其他序列对本领域技术人员来说是已知的,并引入其以允许转基因的表达。
[0075]
在另一个具体的实施方案中,表达盒可以包含位于asah1 orf与多聚腺苷酸化信号之间的其他调控元件。可以在本发明中使用的代表性调控元件包括但不限于基因的3'-非翻译区域(3'-utr),如asah1基因的3'-utr、hbb基因的3'-utr、sv40的3'-utr或牛生长激素的3'-utr。或者,位于asah1 orf与多聚腺苷酸化信号之间的其他调控元件为wpre序列,如具有seq id no:10所示的核酸序列的wpre序列。
[0076]
在又一个实施方案中,表达盒依次包含:
[0077]-pgk启动子;
[0078]-人β珠蛋白基因的经修饰的内含子2/外显子3序列;
[0079]-asah1 orf;和
[0080]-多聚腺苷酸化信号。
[0081]
在进一步的具体的实施方案中,表达盒依次包含;
[0082]-seq id no:3的pgk启动子,或其功能变体;
[0083]-seq id no:4的人β珠蛋白基因的经修饰的内含子2/外显子3序列,或其功能变体;
[0084]-asah1 orf;和
[0085]-多聚腺苷酸化信号,该多聚腺苷酸化信号为seq id no:2的hbb多聚腺苷酸化信号,或其功能变体。
[0086]
在进一步的具体的实施方案中,表达盒依次包含:
[0087]-seq id no:3的pgk启动子,或其与seq id no:3有至少99%同一性的功能变体;
[0088]-seq id no:4的人β珠蛋白基因的经修饰的内含子2/外显子3序列,或其与seq id no:4有至少99%同一性的功能变体;
[0089]-asah1 orf;和
[0090]-多聚腺苷酸化信号,该多聚腺苷酸化信号为seq id no:2的hbb多聚腺苷酸化信号,或其与seq id no:2有至少99%同一性的功能变体。
[0091]
在进一步的具体的实施方案中,表达盒依次包含:
[0092]-seq id no:3的pgk启动子;
[0093]-seq id no:4的人β珠蛋白基因的经修饰的内含子2/外显子3序列,或其与seq id no:4有至少99%同一性的功能变体;
[0094]-asah1 orf;和
[0095]-多聚腺苷酸化信号,所述多聚腺苷酸化信号为seq id no:2的hbb多聚腺苷酸化信号,或其与seq id no:2有至少99%同一性的功能变体。
[0096]
在进一步的具体的实施方案中,表达盒依次包含:
[0097]-seq id no:3的pgk启动子,或其与seq id no:3有至少99%同一性的功能变体;
[0098]-seq id no:4的人β珠蛋白基因的经修饰的内含子2/外显子3序列;
[0099]-asah1 orf;和
[0100]-多聚腺苷酸化信号,该多聚腺苷酸化信号为seq id no:2的hbb多聚腺苷酸化信号,或其与seq id no:2有至少99%同一性的功能变体。
[0101]
在进一步的具体的实施方案中,表达盒依次包含:
[0102]-seq id no:3的pgk启动子,或其与seq id no:3有至少99%同一性的功能变体;
[0103]-seq id no:4的人β珠蛋白基因的经修饰的内含子2/外显子3序列,或其与seq id no:4有至少99%同一性的功能变体;
[0104]-asah1 orf;和
[0105]-多聚腺苷酸化信号,该多聚腺苷酸化信号为seq id no:2的hbb多聚腺苷酸化信号。
[0106]
在进一步的具体的实施方案中,表达盒依次包含:
[0107]-seq id no:3的pgk启动子;
[0108]-seq id no:4的人β珠蛋白基因的经修饰的内含子2/外显子3序列;
[0109]-asah1 orf;和
[0110]-多聚腺苷酸化信号,该多聚腺苷酸化信号为seq id no:2的hbb多聚腺苷酸化信号,或其与seq id no:2有至少99%同一性的功能变体。
[0111]
在进一步的具体的实施方案中,表达盒依次包含:
[0112]-seq id no:3的pgk启动子;
[0113]-seq id no:4的人β珠蛋白基因的经修饰的内含子2/外显子3序列,或其与seq id no:4有至少99%同一性的功能变体;
[0114]-asah1 orf;和
[0115]-多聚腺苷酸化信号,该多聚腺苷酸化信号为seq id no:2的hbb多聚腺苷酸化信号。
[0116]
在进一步的具体的实施方案中,表达盒依次包含:
[0117]-seq id no:3的pgk启动子,或其与seq id no:3有至少99%同一性的功能变体;
[0118]-seq id no:4的人β珠蛋白基因的经修饰的内含子2/外显子3序列;
[0119]-asah1 orf;和
[0120]-多聚腺苷酸化信号,该多聚腺苷酸化信号为seq id no:2的hbb多聚腺苷酸化信号。
[0121]
在进一步的具体的实施方案中,表达盒依次包含:
[0122]-seq id no:3的pgk启动子;
[0123]-seq id no:4的人β珠蛋白基因的经修饰的内含子2/外显子3序列;
[0124]-asah1 orf;和
[0125]-多聚腺苷酸化信号,该多聚腺苷酸化信号为seq id no:2的hbb多聚腺苷酸化信号。
[0126]
在优选的实施方案中,表达盒包含cag启动子。
[0127]
在本发明的具体的实施方案中,表达盒依次包含:
[0128]-cag启动子;
[0129]-asah1 orf;和
[0130]-多聚腺苷酸化信号。
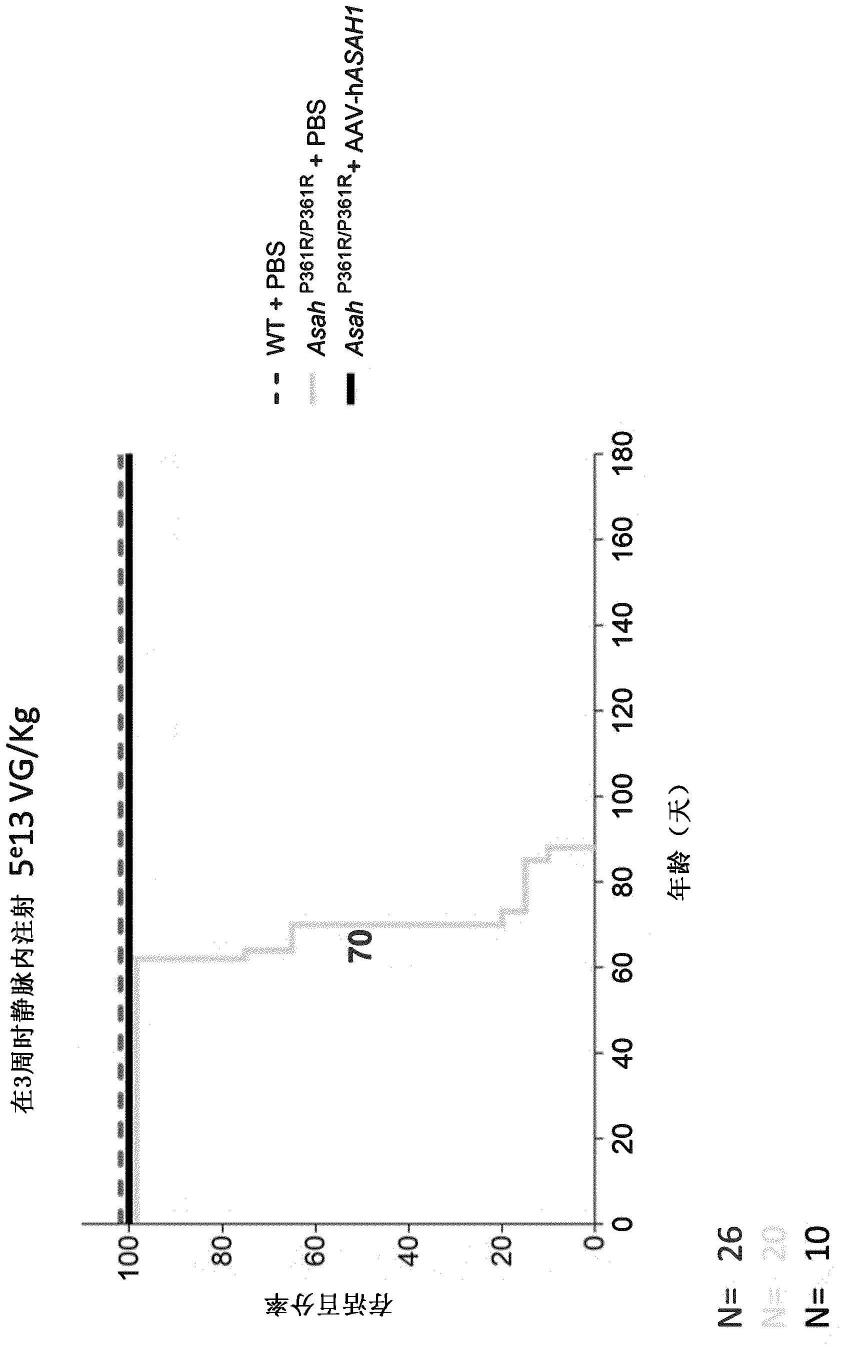
[0131]
在本发明的具体的实施方案中,表达盒依次包含:
[0132]-启动子,该启动子为seq id no:9的cag启动子,或其功能变体;
[0133]-asah1 orf;和
[0134]-多聚腺苷酸化信号,该多聚腺苷酸化信号为seq id no:2的hbb多聚腺苷酸化信号,或其功能变体。
[0135]
在进一步的具体的实施方案中,表达盒依次包含:
[0136]-启动子,该启动子为seq id no:9的cag启动子,或其与seq id no:9有至少99%同一性的功能变体;
[0137]-asah1 orf;和
[0138]-多聚腺苷酸化信号,该多聚腺苷酸化信号为seq id no:2的hbb多聚腺苷酸化信号,或其与seq id no:2有至少99%同一性的功能变体。
[0139]
在进一步的具体的实施方案中,表达盒依次包含:
[0140]-启动子,该启动子为seq id no:9所示的cag启动子;
[0141]-asah1 orf;和
[0142]-多聚腺苷酸化信号,该多聚腺苷酸化信号为seq id no:2的hbb多聚腺苷酸化信号,或其与seq id no:2有至少99%同一性的功能变体。
[0143]
在进一步的具体的实施方案中,表达盒依次包含:
[0144]-启动子,该启动子为seq id no:9所示的cag启动子,或其功能变体;
[0145]-asah1 orf;和
[0146]-多聚腺苷酸化信号,该多聚腺苷酸化信号为seq id no:2的hbb多聚腺苷酸化信号。
[0147]
在进一步的具体的实施方案中,表达盒依次包含:
[0148]-启动子,该启动子为seq id no:9所示的cag启动子;
[0149]-asah1 orf;和
[0150]-多聚腺苷酸化信号,该多聚腺苷酸化信号为seq id no:2的hbb多聚腺苷酸化信号。
[0151]
上文所述的具体的表达盒的优选实施方案包括使用asah1 orf,其中所述asah1 orf的核酸序列包含以下或由以下组成:
[0152]-seq id no:5所示的野生型序列,或其功能变体,如与seq id no:5有至少99%同一性的功能变体;
[0153]-seq id no:6所示的野生型序列,或其功能变体,如与seq id no:6有至少99%同一性的功能变体;
[0154]-由seq id no:7组成的优化序列,或其功能变体,如与seq id no:7有至少99%同一性的功能变体;
[0155]-由seq id no:8组成的优化序列,或其功能变体,如与seq id no:8有至少99%同一性的功能变体。
[0156]
在优选的实施方案中,所述asah1 orf的核酸序列包含以下或由以下组成:
[0157]-seq id no:5所示的野生型序列,或其功能变体,如与seq id no:5有至少99%同一性的功能变体;或
[0158]-由seq id no:7或seq id no:8组成的优化序列,或其功能变体,如与seq id no:7有至少99%同一性的功能变体。
[0159]
在又一个优选的实施方案中,所述asah1 orf的核酸序列包含以下或由以下组成:
[0160]-seq id no:5所示的野生型序列;或
[0161]-由seq id no:7或seq id no:8组成的优化序列。
[0162]
在又一个优选的实施方案中,所述asah1 orf的核酸序列由以下组成:
[0163]-seq id no:5所示的野生型序列;
[0164]-由seq id no:7组成的优化序列;
[0165]-由seq id no:8组成的优化序列。
[0166]
在具体的实施方案中,所述asah1 orf的核酸序列由seq id no:5所示的野生型序列组成。
[0167]
重组载体
[0168]
为了用作raav载体的基因组,本文所公开的表达盒的两侧为aav 5'-itr和aav 3'-itr序列,它们适于将表达盒包装至raav载体中。
[0169]
人细小病毒腺相关病毒(aav)是一种天然存在复制缺陷的依赖病毒,其能整合至受感染细胞的基因组中以建立潜伏感染。aav载体作为人基因疗法的潜在载体引起了人们的广泛兴趣。该病毒的有利特性之一是它与任何人类疾病都没有关联,它能够感染分裂细胞和非分裂细胞,以及来源于能够感染的不同组织的广泛细胞系。
[0170]
在本发明的上下文中,术语“腺相关病毒”(aav)和“重组腺相关病毒”(raav)可以互换使用,并且是指与野生型(wt)aav基因组相比其基因组通过将野生型(wt)基因组的一部分替换为感兴趣的转基因来修饰的aav。术语“转基因”是指其核酸序列在aav基因组中是非天然存在的基因。特别地,raav载体将用于基因疗法。如本文所用,术语“基因疗法”是指将感兴趣的遗传物质(例如dna或rna)转移至宿主中以治疗或预防遗传性或获得性疾病或病症。
[0171]
重组aav可以采用常规的分子生物技术进行工程化,这有可能优化这些粒子以用于核酸序列的细胞特异性递送,用于使免疫原性降至最低、用于调谐稳定性和粒子寿命、用于高效降解、用于精确递送至细胞核。所需的用于组装成载体的aav元件包括cap蛋白(包括vp1、vp2、vp3和高变区)、rep蛋白(包括rep 78、rep 68、rep 52和rep 40)以及编码这些蛋
已按照mccarty等人,2001和2003(引用如前)中描述的那样设计以形成分子内双链dna模板。
[0178]
在具体的实施方案中,raav基因组为单链基因组。
[0179]
raav载体中存在的基因组可以优选缺乏aav rep和cap基因,并且包含感兴趣的转基因。因此,aav基因组可以包含两侧为aav itr的感兴趣的转基因。如上文所述,感兴趣的转基因为asah1 orf,包含在表达盒中。itr可以来源于任何aav基因组,如aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aavcy.10、aavrh.10、aavrh.39、aav11、aav12或进化枝f aavhsc基因组。在具体的实施方案中,aav载体的基因组包含5'-和3'-aav2 itr。
[0180]
aav血清型衣壳与itr的任何组合均可以在本发明的上下文中实施,这意味着aav载体可以包含来源于相同血清型的衣壳和itr,或来源于第一血清型的衣壳和来源于与第一血清型不同的血清型的itr。这种具有来源于不同血清型的衣壳itr的载体也称为“假型载体”。更具体地,假型raav载体可以包括:
[0181]-包含aav1 5'-和3'-itr的基因组,以及选自aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav9p1、aavpo1a1、aavrh.10、aav11、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0182]-包含aav2 5'-和3'-itr的基因组,以及选自aav1、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav9p1、aavpo1a1、aavrh.10、aav11、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0183]-包含aav3 5'-和3'-itr的基因组,以及选自aav1、aav2、aav4、aav5、aav6、aav7、aav8、aav9、aav9p1、aavpo1a1、aavrh.10、aav11、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0184]-包含aav4 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav5、aav6、aav7、aav8、aav9、aav9p1、aavpo1a1、aavrh.10、aav11、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0185]-包含aav5 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav4、aav6、aav7、aav8、aav9、aav9p1、aavpo1a1、aavrh.10、aav11、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0186]-包含aav6 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav4、aav5、aav7、aav8、aav9、aav9p1、aavpo1a1、aavrh.10、aav11、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0187]-包含aav7 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav4、aav5、aav6、aav8、aav9、aav9p1、aavpo1a1、aavrh.10、aav11、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0188]-包含aav8 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav9、aav9p1、aavpo1a1、aavrh.10、aav11、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0189]-包含aav9 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9p1、aavpo1a1、aavrh.10、aav11、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0190]-包含aavrh.10 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav9p1、aavpo1a1、aav11、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0191]-包含aav11 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav9p1、aavpo1a1、aavrh.10、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0192]-包含aav12 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav9p1、aavpo1a1、aavrh.10、aav11、aavrh.39aav-php.b和aavhsc衣壳中的衣壳;
[0193]-包含aavrh.39 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav9p1、aavpo1a1、aavrh.10、aav11、aav12、aav-php.b和aavhsc衣壳中的衣壳;
[0194]-包含aav-php.b 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav9p1、aavpo1a1、aavrh.10、aav11、aav12、aavrh.39和aavhsc衣壳组成的组中的衣壳;或
[0195]-包含aavhsc 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav9p1、aavpo1a1、aavrh.10、aav11、aav12、aavrh.39和aav-php.b衣壳中的衣壳。
[0196]
在另一个实施方案中,假型raav载体可以包括:
[0197]-包含aav1 5'-和3'-itr的基因组,以及选自aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aavrh.10、aav11、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0198]-包含aav2 5'-和3'-itr的基因组,以及选自aav1、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aavrh.10、aav11、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0199]-包含aav3 5'-和3'-itr的基因组,以及选自aav1、aav2、aav4、aav5、aav6、aav7、aav8、aav9、aavrh.10、aav11、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0200]-包含aav4 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav5、aav6、aav7、aav8、aav9、aavrh.10、aav11、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0201]-包含aav5 5'-和3'-itr的基因组,以及选自av1、aav2、aav3、aav4、aav6、aav7、aav8、aav9、aavrh.10、aav11、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0202]-包含aav6 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav4、aav5、aav7、aav8、aav9、aavrh.10、aav11、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0203]-包含aav7 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav4、aav5、aav6、aav8、aav9、aavrh.10、aav11、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0204]-包含aav8 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav9、aavrh.10、aav11、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0205]-包含aav9 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aavrh.10、aav11、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0206]-包含aavrh.10 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aav11、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0207]-包含aav11 5'-和3'-itr的基因组,以及选自aaav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aavrh.10、aav12、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0208]-包含aav12 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aavrh.10、aav11、aavrh.39aav-php.b和aavhsc衣壳中的衣壳;
[0209]-包含aavrh.39 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aavrh.10、aav11、aav12、aav-php.b和aavhsc衣壳中的衣壳;
[0210]-包含aav-php.b 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aavrh.10、aav11、aav12、aavrh.39和aavhsc衣壳中的衣壳;
[0211]-包含aavhsc 5'-和3'-itr的基因组,以及选自aav1、aav2、aav3、aav4、aav5、aav6、aav7、aav8、aav9、aavrh.10、aav11、aav12、aavrh.39和aav-php.b衣壳中的衣壳。
[0212]
在另一个实施方案中,假型raav载体可以包括:
[0213]-包含aav1 5'-和3'-itr的基因组,以及选自aav9、aav9p1、aavpo1a1、aavrh.10、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0214]-包含aav2 5'-和3'-itr的基因组,以及选自aav9、aav9p1、aavpo1a1、aavrh.10、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0215]-包含aav3 5'-和3'-itr的基因组,以及选自aav9、aav9p1、aavpo1a1、aavrh.10、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0216]-包含aav4 5'-和3'-itr的基因组,以及选自aav9、aav9p1、aavpo1a1、aavrh.10、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0217]-包含aav5 5'-和3'-itr的基因组,以及选自aav9、aav9p1、aavpo1a1、aavrh.10、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0218]-包含aav6 5'-和3'-itr的基因组,以及选自aav9、aav9p1、aavpo1a1、aavrh.10、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0219]-包含aav7 5'-和3'-itr的基因组,以及选自aav9、aav9p1、aavpo1a1、aavrh.10、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0220]-包含aav8 5'-和3'-itr的基因组,以及选自aav9、aav9p1、aavpo1a1、aavrh.10、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0221]-包含aav9 5'-和3'-itr的基因组,以及选自aav9p1、aavpo1a1、aavrh.10、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0222]-包含aavrh.10 5'-和3'-itr的基因组,以及选自aav9、aav9p1、aavpo1a1、aavrh.10、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0223]-包含aav11 5'-和3'-itr的基因组,以及选自aav9、aav9p1、aavpo1a1、aavrh.10、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0224]-包含aav12 5'-和3'-itr的基因组,以及选自aav9、aav9p1、aavpo1a1、aavrh.10、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳;
[0225]-包含aavrh.39 5'-和3'-itr的基因组,以及选自aav9、aav9p1、aavpo1a1、aavrh.10、aav-php.b和aavhsc衣壳中的衣壳;
[0226]-包含aav-php.b 5'-和3'-itr的基因组,以及选自由aav9、aav9p1、aavpo1a1、aavrh.10、aavrh.39和aavhsc衣壳组成的组中的衣壳;
5'-和3'-itr的基因组,特别是单链基因组,以及选自aav9、aavrh.10、aavrh.39、aav-php.b和aavhsc衣壳中的衣壳。在又一个具体的实施方案中,假型raav载体包括包含aav2 5'-和3'-itr的基因组,特别是单链基因组,以及aav9衣壳。
[0245]
在另一方面,本发明提供了包含本发明raav基因组的dna质粒。生产raav要求在单个细胞(本文称为包装细胞)中存在以下组分:raav基因组、与raav基因组分开(即不在基因组中)的aav rep和cap基因,以及辅助病毒功能。例如,wo 01/83692中公开了假型raav的生产。生产可以通过用两种、三种或更多种质粒转染细胞来实现。例如,可以使用三种质粒,包括:(i)携带rep/cap盒的质粒、(ii)携带raav基因组(即,两侧为aav itr的转基因)的质粒和(iii)具有辅助病毒功能(如腺病毒辅助功能)的质粒。在另一个实施方案中,可以使用双质粒系统,包括:(i)包含rep和cap基因和具有辅助病毒功能的质粒,和(ii)包含raav基因组的质粒。
[0246]
在另一方面,本发明涉及一种包含上文所述的表达盒的质粒。可以将该质粒引入至细胞中以用于通过将raav基因组提供至所述细胞中来产生根据本发明的raav载体。
[0247]
生成包装细胞的方法为产生可稳定表达aav粒子生产所必需的所有组分的细胞系。例如,将包含缺少aav rep和cap基因的raav基因组、与raav基因组分开的aav rep和cap基因和可选择标记物例如抗新霉素基因的质粒整合至细胞的基因组中。aav基因组已通过以下程序引入至细菌质粒中,如gc加尾(samulski等人,1982,proc.natl.acad.s6.usa,79:2077-2081),添加含有限制性内切酶裂解位点的合成连接物(laughlin等人,1983,基因,23:65-73)或者通过直接平末端连接(senapathy&carter,1984,j.biol.chem.,259:4661-4666)。该方法的优点在于细胞是可选择的,并且适于大规模生产raav。适宜方法的其他示例采用腺病毒或杆状病毒而不是质粒来将raav基因组和/或rep和cap基因引入至包装细胞中。
[0248]
在例如carter,1992,current opinions in biotechnology,1533-539;和muzyczka,1992,curr.topics in microbial and immunol.,158:97-129)中对raav生产的一般原理进行了综述。在ratschin等人,mol.cell.biol.4:2072(1984);hermonat等人,proc.natl.acad.sci.usa,81:6466(1984);tratschin等人,mol.cell.biol.5:3251(1985);mclaughlin等人,j.virol.,62:1963(1988);和lebkowski等人,1988mol.cell.biol.,7:349(1988);samulski等人(1989,j.virol.,63:3822-3828);美国专利5,173,414;wo 95/13365以及相应的美国专利5,658.776;wo 95/13392;wo 96/17947;pct/us98/18600;wo 97/09441(pct/us96/14423);wo 97/08298(pct/us96/13872);wo 97/21825(pct/us96/20777);wo 97/06243(pct/fr96/01064);wo 99/11764;perrin等人(1995)vaccine 13:1244-1250;paul等人(1993)human gene therapy 4:609-615;clark等人(1996)gene therapy 3:1124-1132;美国专利5,786,211;美国专利5,871,982;和美国专利6,258,595中描述了各种方法。本发明因此还提供了生产感染性raav的包装细胞。在一个实施方案中,包装细胞可以为稳定转化的癌细胞,如hela细胞、hek293细胞、hek 293t、hek290vc和perc.6细胞(同源293系)。在另一个实施方案中,包装细胞不是转化的癌细胞,如低传代293细胞(腺病毒e1转化的人胎肾细胞)、mrc-5细胞(人胎成纤维细胞)、wi-38细胞(人胎成纤维细胞)、vero细胞(猴肾细胞)和frhl-2细胞(恒河猴胎肺细胞)。
[0249]
raav可以通过本领域的方法标准如通过柱色谱或氯化铯梯度进行纯化。从辅助病
毒中纯化raav载体的方法在本领域是已知的,并且包括在例如clark等人,hum.gene ther.,10(6):1031-1039(1999);schenpp与clark,methods mol.med.,69:427-443(2002);美国专利6,566,118和wo 98/09657中描述的方法。
[0250]
在另一方面,本发明提供了包含本技术中公开的raav的组合物。本发明的组合物包含在药学上可接受的载剂中的raav。组合物还可以包含其他成分,如稀释剂和助剂。可接受的载剂、稀释剂和助剂对接受者来说是无毒的并且在所用剂量和浓度下优选是惰性的,包括缓冲液,如磷酸盐、柠檬酸盐或其它有机酸;抗氧化剂,如抗坏血酸;低分子量多肽;蛋白质,如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,如聚乙烯吡咯烷酮;氨基酸,如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸;单糖、双糖,以及包括葡萄糖、甘露糖或糊精的其它碳水化合物;螯合剂,如edta;糖醇,如甘露醇或山梨醇;成盐反离子,如钠;和/或非离子表面活性剂,如吐温(tween)、普朗尼克(pluronics)或聚乙二醇(peg)。
[0251]
在另一方面,本发明涉及一种表达盒,所述表达盒包含如上所述的asah1 orf和调控元件(如启动子、内含子、3'-utr和多聚腺苷酸化信号),正如它们在其广泛和具体实施方案的每一个中所公开的。
[0252]
如上文所述,可以将表达盒引入至aav载体中。在可替代的实施方案中,可以将本发明的表达盒引入至另一种载体中,如另一种重组病毒载体或非病毒载体。因此,本发明还涉及一种包含本发明表达盒的载体,所述载体适于基因疗法以在感兴趣的靶细胞中表达asah1 orf,从而用于治疗呈现酸性神经酰胺酶活性水平降低的其他疾病的酸性神经酰胺酶缺乏症。在具体的实施方案中,载体为非病毒载体,如质粒、纳米粒子、脂质纳米粒子或脂质体。在另一个实施方案中,载体为重组病毒载体如上文所述的raav载体,或另一种病毒载体如腺病毒。在具体的实施方案中,包含本发明表达盒的重组病毒载体不是慢病毒。
[0253]
本发明的治疗用途
[0254]
本发明还涉及一种载体,例如如本文所公开的raav载体,用于治疗用途。
[0255]
由于本发明,可以将asah1 orf递送至有需要的受试者中。有需要的受试者可以是患有酸性神经酰胺酶缺乏症或相关疾病或与正常水平相比呈现酸性神经酰胺酶活性水平降低或神经酰胺水平增加的受试者。在具体的实施方案中,呈现神经酰胺水平增加的疾病为囊性纤维化、某些视网膜病变(如色素性视网膜炎(rp26))和遗传性失明。
[0256]
在优选的实施方案中,本发明的raav载体用于治疗酸性神经酰胺酶缺乏症例如囊性纤维化、fd或smw-pme的方法中。更具体地,本发明的raav载体用于治疗fd或sma-pme的方法中。在具体的实施方案中,本发明的raav载体用于治疗sma-pme的方法中。在特别优选的实施方案中,本发明的载体,特别是本发明的raav载体,用于治疗fd。
[0257]
在具体的实施方案中,本发明的载体,特别是本发明的raav载体,用于治疗fd的至少一种神经表现和/或至少一种外周表现。
[0258]
fd的神经表现包括中枢神经系统(cns)表现和外周神经系统(pns)表现。
[0259]
fd的cns表现包括因脑干、大脑皮层和小脑中的脑积水和脑萎缩储存病理引起的癫痫发作、发育迟缓、智力障碍,因脊髓前部的储存病理引起的肌张力减退、肌肉无力和萎缩或者因脊髓前部的储存病理引起的肌肉无力和萎缩。fd的cns表现还可以发生在脊髓的其他位置。
[0260]
fd的pns表现包括因周围神经雪旺(sschwaan)细胞的储存病理引起的肌张力减
退、肌肉无力和萎缩,从而导致坐轮椅。
[0261]
外周表现包括:
[0262]-皮下脂肪肉芽肿;
[0263]-关节痛;
[0264]-声音嘶哑;
[0265]-血液学表现,如白细胞计数和红细胞沉降率增加、血浆壳三糖苷酶和c型反应性蛋白(crp)升高、淋巴结肿大、贫血、血小板减少、存在有核红细胞;
[0266]-肺部发现:典型和减毒型fd中更常见的疾病征象之一:胸骨回缩、呼气喘鸣、失音、呼吸困难;
[0267]-眼科发现:最常见的征象是樱桃红斑、视网膜混浊、角膜混浊、黄斑变性;
[0268]-胃肠道表现:持续性腹泻;
[0269]-肝脏发现:肝肿大、胆汁淤积性黄疸、腹水、肝纤维化和肝酶升高;
[0270]-脾:脾肿大;
[0271]-软骨和骨骼发现:关节侵蚀、近关节骨侵蚀和脱矿质;和
[0272]-皮肤病学表现:皮下结节、皮损和斑块、角化过度、瘢痕疙瘩。
[0273]
在具体的实施方案中,本发明的raav载体用于治疗fd的至少一种外周表现。在进一步的具体的实施方案中,本发明的raav载体用于治疗fd的血液学表现。在又一个进一步的实施方案中,本发明的载体,特别是本发明的raav载体,用于治疗fd的神经学、脾、肺或血液学表现。在又一个进一步的实施方案中,本发明的载体,特别是本发明的raav载体,用于治疗fd的神经学、脾、肺和血液学表现。
[0274]
在优选的实施方案中,用于本发明用途的载体为raav载体,所述raav载体包含如上文定义的基因组,如单链基因组。在又一个实施方案中,用于本发明用途的载体可以为aav9、aav9p1、aavpo1a1、aavrh.10、aavrh.39、aav-php.b或进化枝f aavhsc载体,优选地aav9、aavrh.10、aavrh.39、aav-php.b或进化枝f aavhsc载体,优选地aav9或aavrh.10载体,更优选地aav9载体,包含如上文定义的基因组,如单链基因组。
[0275]
可以在有或没有全身共递送的情况下局部给药用于本发明用途的载体。在本发明的上下文中,局部给药是指例如通过鞘内注射raav载体而给药到受试者的脑脊液中。在一些实施方案中,有效量的载体通过脑内给药进行给药。在一些实施方案中,载体可以通过鞘内给药或通过脑内给药进行给药。在一些实施方案中,载体可以通过鞘内和/或脑内和/或外周(如血管,例如静脉内或动脉内,特别是静脉内)联合给药进行给药。
[0276]
如本文所用,术语“鞘内给药”是指将根据本发明的载体或包含本发明载体的组合物给药到椎管中。例如,鞘内给药可以包括在椎管的颈区、在椎管的胸区或者在椎管的腰椎区进行的注射。鞘内给药通常是通过将试剂(例如,包含本发明载体的组合物)注射至椎管的蛛网膜下腔(蛛网膜下隙)中进行的,所述蛛网膜下腔是椎管的蛛网膜与软脑膜之间的区域。蛛网网下隙被由小梁(精细的结缔组织细丝,从蛛网膜延伸并融入软脑膜)和其中含有脑脊液的互通通道组成的海绵组织占据。在一些实施方案中,鞘内给药不是给药到脊髓血管系统中。在某些实施方案中,鞘内给药在受试者的腰部进行。
[0277]
如本文所用,术语“脑内给药”是指将试剂给药到大脑中和/或大脑周围。脑内给药包括但不限于将试剂给药到端脑、髓质、脑桥、小脑、颅内腔和大脑周围的脑膜。脑内给药可
以包括给药到大脑的硬脑膜、蛛网膜和软脑膜。在一些实施方案中,脑内给药可以包括将试剂给药到大脑周围的蛛网膜下隙的脑脊液(csf)中。在一些实施方案中,脑内给药可以包括将试剂给药到大脑/前脑的脑室,例如右侧脑室、左侧脑室、第三脑室、第四脑室。在一些实施方案中,脑内给药不是给药到脑血管系统中。
[0278]
在一些实施方案中,脑内给药包括使用立体定向程序进行注射。立体定向程序在本领域是众所周知的,通常包括使用计算机和3维扫描装置,这两种装置一起用于将注射引导至特定的脑内区域,例如脑室区域。还可以使用微型注射泵(例如,购自world precision instruments)。在一些实施方案中,使用微型注射泵来递送包含本发明载体的组合物。在一些实施方案中,组合物的输注速率范围为1μl/分钟至100μl/分钟。本领域技术人员会认识到,输注速率将取决于各种因素,包括例如受试者的物种、受试者的年龄、受试者的体重/大小、载体的种类(即质粒或病毒载体、病毒载体的类型、在raav载体的情况下载体的血清型)、所需剂量、所针对的脑内区域等。因此,在某些情况下,技术人员可能会认为其它输注速率也是合适的。
[0279]
此外,由于某些raav载体(例如raav9、raavrh.10、raavrh.39或raavhsc载体)具有能穿过血脑屏障的能力,所以可以考虑通过全身途径给药。因而,给药raav载体的方法包括但不限于肌肉内、腹腔内、血管内(例如静脉内或动脉内)、皮下、鼻内、硬膜外和口腔途径。在具体的实施方案中,全身给药是血管内注射特别是静脉内注射raav载体。
[0280]
在又一个具体的实施方案中,本发明的载体为具有能穿过血脑屏障的能力的载体,如raav9、aav9p1、aavpo1a1、raavrh.10、raavrh.39或raavhsc载体,特别是如raav9、raavrh.10、raavrh.39或raavhsc载体(特别是raav9或raav10载体,更特别是raav9载体),血管内(特别是静脉内)给药raav载体,要治疗的疾病为fd。
[0281]
在进一步的实施方案中,本发明的raav载体为具有能穿过血脑屏障的能力的载体,如raav9、aav9p1、aavpo1a1、raavrh.10、raavrh.39或raavhsc载体,特别是如raav9、raavrh.10、raavrh.39或raavhsc载体(特别是raav9或raav10载体,更特别是raav9载体),通过血管内(特别是静脉内)和在csf中(特别是脑室内或鞘内)两者给药raav载体,要治疗的疾病是fd。
[0282]
在具体的实施方案中,特别是通过鞘内注射将载体给药到脑脊液中。在具体的实施方案中,鞘内递送raav载体后,使患者处于垂头仰卧位(trendelenburg)。
[0283]
可以通过标准临床技术来确定有效治疗fd或sma-pme的本发明载体的量。此外,可选地采用体内和/或体外测定来辅助预测最优剂量范围。给药到有需要受试者中的本发明载体的剂量根据几种因素而变化,这几种因素包括但不限于所治疗疾病的具体类型或阶段、受试者的年龄或获得治疗效果所必需的表达水平。本领域技术人员可以基于其在本领域的知识很容易地确定基于这些因素和其他因素所需的剂量范围。aav载体的典型剂量是至少1x108个载体基因组/千克体重(vg/kg),如至少1x109vg/kg、至少1x10
10
vg/kg、至少1x10
11
vg/kg、至少1x10
12
vg/kg至少1x10
13
vg/kg、至少1x10
14
vg/kg或至少1x10
15
vg/kg。
[0284]
此外,用于本发明用途的载体,特别是本文所公开的raav,可以与另一种疗法联合使用。说明性的非限制性的实施方案包括以下联合疗法,其中有需要的受试者可以接受:
[0285]-根据本发明的重组载体,如本发明的raav,和造血干细胞移植物;
[0286]-根据本发明的重组载体,如本发明的raav,和造血干细胞移植物,其中所述造血
干细胞已用携带asah1 orf的载体例如慢病毒载体转导;或
[0287]-给药到csf中(如通过脑室内途径)的根据本发明的重组载体,如本发明的raav,和通过外周途径(如通过血管内给药,更特别是静脉内给药)作为ert给药的重组asah1蛋白。
[0288]
包含本发明的重组载体的联合疗法的其它说明性实施方案包括但不限于:
[0289]-本发明的raav载体和编码asah1 orf的慢病毒载体;
[0290]-本发明的raav载体和作为ert给药的重组asah1蛋白质;和
[0291]-本发明的raav载体和适于治疗酸性神经酰胺酶缺乏症的任何其它物质、化合物或组合物。
[0292]
实施例
[0293]
材料与方法
[0294]
载体生产
[0295]
通过使用悬浮培养物中的hek293细胞中的三质粒转染系统生产携带在遍在性cag启动子下的野生型asah1 orf(seq id no:5)的单链血清型9aav载体,并通过亲和层析纯化。通过qpcr确定载体滴度(病毒基因组/ml)。
[0296]
通过使用悬浮培养物中的hek293细胞中的三质粒转染系统生产携带在遍在性pgk启动子(seq id no:3)下的野生型asah1 orf(seq id no:5)或优化asah1 orf(seq id no:7或seq id no:8)并含有启动子下游的人β珠蛋白基因的经修饰的内含子2/外显子3序列(seq id no:4)的单链血清型9aav载体,并通过亲和层析纯化。通过qpcr确定载体滴度(病毒基因组/ml)。
[0297]
小鼠基因分型与载体注射
[0298]
将杂合子asah1
p361r/
小鼠杂交以获得纯合子asah1
p361r/p361r
突变体小鼠(alayoubi等人,2013;embo mol med;5;第827页)。根据注射方案,在出生时或出生15天时,对一窝小鼠进行基因分型。将小鼠保持在12小时光照、12小时黑暗这样的循环中,并饲喂标准饮食,食物和水随意取用。小鼠根据国家和欧洲关于动物实验的立法进行护理和操作,并获得了机构伦理委员会的批准。
[0299]
对于基因分型,我们对基因组dna进行pcr并使用了以下引物:用于野生型asah1等位基因扩增的正向5’(cagaaggtatgcggcatcgtcatac)3’(seq id no:11)和反向5’(agggccatacagagaaaccctgtctc)3’(seq id no:12),和用于asah1敲入p361r等位基因扩增的正向5’(tcaaggcttgactttggggcac)3’(seq id no:13)和反向:5’(gctggacgtaaactcctcttcagacc)3’(seq id no:14)。
[0300]
突变体asah
p361r/p361r
小鼠分别在3周龄或出生时(p0)静脉内注射5x10
13
vg/kg的载体或脑室内注射1x10
13
vg/kg的载体。对照同窝出生小鼠接受了等量的盐水(pbs-mk、1mm mgcl2、2.5mm kcl)。每周监测存活率、一般外观、体重和肌肉力量两次。载体注射后四或十周,用氯胺酮/甲苯噻嗪混合物麻醉小鼠,收集外周血,然后进行颈椎脱位和组织解剖。在组织冷冻保存之前测量所选器官和肌肉的重量。
[0301]
免疫印迹分析
[0302]
根据制造商的方案(fisher),使用添加了蛋白酶抑制剂混合物(complete mini,roche applied science)的ripa裂解缓冲液,从组织中提取静脉内注射后4周的蛋白质。通
过sds-page电泳(1.0mm,4-12%梯度novex nupage bis-tris凝胶,life technologies)分离蛋白质样本(100μg和50μg)并转移到protran premium硝酸纤维素膜(ge healthcare)上。膜用以下抗体探测:针对人asah1 c末端的多克隆抗体(sigma)以检测β亚基、针对人asah1的单克隆抗体(bd science)以检测α亚基和针对作为内部对照的gapdh兔多克隆抗体(millipore)。用相应的二级irdye-680cw或-800cw偶联抗体(1:10,000,li-cor biosciences)孵育后,在odyssey成像系统(li-cor biosciences)上读取红外荧光。使用odyssey应用软件(li-cor biosciences,image studio lite,4.0版)测量条带强度。
[0303]
功能评估
[0304]
四肢悬垂试验或kondziella的倒置屏幕试验是一种评估小鼠肌肉力量的方法。以约35厘米的高度设置网格,并在下面放置柔软的被褥,以保护小鼠在从网格跌下时免受伤害。每周对29至90天大的小鼠的保持时间进行量化一次(3次/期,最大保持时间为180秒)。根据treat-nmd指南(协议号dmd_m.2.1.005)进行测试。
[0305]
血液分析
[0306]
在小鼠中静脉内注射载体或盐水后4周,经眶后收集血液至含有抗凝剂柠檬酸盐溶液的试管中。分析血液样本的标准血液学参数,包括使用ms9.3计数器(schloessing melet,法国)进行的白细胞(wbc、淋巴细胞、单核细胞和粒细胞)、红血细胞或红细胞(rbc)和血小板计数。
[0307]
结果
[0308]
在野生型小鼠中静脉内注射5x10
13
vg/kg血清型9载体后4周,评估来源于材料与方法部分中描述的每个表达盒的酸性神经酰胺酶α和β亚基(asah1)在脊髓、心脏和胫骨前肌(ta)中的表达水平。注射含有受pgk启动子控制的野生型或优化asah1 orf的构建体的小鼠的组织中,酸性神经酰胺酶的水平是相似的,而注射含有受cag启动子控制的野生型asah1 orf的构建体的小鼠组织中的酸性神经酰胺酶水平更高。这也表明,尽管pgk启动子的表达是有效的,但在这些组织中,cag启动子导致asah1在这些组织中的表达比pgk启动子更强。因此用含有cag启动子的构建体获得了以下结果。
[0309]
如图1所示,与平均70天龄就死亡的未经治疗的突变体小鼠相比,在3周龄时以5x10
13
vg/kg静脉内给药aav9-cag-hasah1载体将所有经治疗的asah
p361r/p361r
小鼠的存活时间延长至至少180天(注射时,n=26wt pbs、n=20asah
p361r/p361r
pbs和n=10asah
p361r/p361r
aav-hasah1小鼠)。如图2所示,与平均66天龄就死亡的未经治疗的突变体小鼠相比,在7周龄时单次静脉内注射aav9-cag-hasah1(5x10
13
vg/kg)延长了所有经治疗的asah
p361r/p361r
小鼠的存活时间(注射时,n=19wt pbs、n=10asah
p361r/p361r
pbs和n=16asah
p361r/p361r
aav-hasah1小鼠)。
[0310]
此外,图3示出了在三周龄(早期症状阶段)时用5x10
13
vg/kg的aav9-cag-hasah1静脉内治疗的突变体asah
p361r/p361r
小鼠的体重随时间逐渐增加,并且与野生型同窝小鼠相当。而未经治疗的突变体小鼠在约5周龄时开始出现生长缺陷(注射时,n=26wt pbs、n=20asah
p361r/p361r
pbs和n=10asah
p361r/p361r
aav-hasah1小鼠)。此外,图4示出了在七周龄(症状后阶段)时用aav9-cag-hasah1静脉内治疗的突变体asah
p361r/p361r
小鼠的体重挽救增加。体重演化表明随时间不断增加,而未经治疗的突变体小鼠出现生长下降,直至12周龄(注射时,n=19wt pbs、n=10asah
p361r/p361r
pbs和n=16asah
p361r/p361r
aav-hasah1小鼠)。
[0311]
通过器官检查评估asah
p361r/p361r
小鼠的疾病表型揭示了(图5)与13周龄的对照和经注射的小鼠相比,几种外周组织例如脾、肾、肝、肺和胸腺的增大。治疗十周后,在3周龄时静脉内注射ssaav9-cag-hasah1将组织重量正常化为野生型水平。与对照组织相比,中枢神经系统也受到比对照组织更重的大脑重量的影响:aav9-cag-hasah1注射将表型矫正为正常大小。还评估了在7周龄接受静脉内注射载体的小鼠中的组织重量与总体重之比(mg/g)(图6)。在治疗19周后观察到组织重量正常化为野生型水平。
[0312]
还评估了给药aav9-cag-hasah1载体对造血功能的影响(图7和图8)。如图7所示,7周龄时,未经治疗的asah
p361r/p361r
小鼠(n=10)与野生型小鼠(n=11)相比,造血功能发生改变。在治疗4周后,3周龄时静脉内注射aav9-cag-hasah1恢复了外周血中的淋巴细胞、单核细胞和粒细胞的数量(n=13)。此外,如图8所示,在7周龄时全身给药aav9-cag-hasah1将asah
p361r/p361r
小鼠(n=16)改变的血液特征矫正为野生型水平(n=6)。11周时注射后进行血细胞计数4周。未经治疗的asah
p361r/p361r
显示出更大的造血功能改变(n=2)。
[0313]
还评估了静脉内注射治疗的小鼠的肌肉力量(图9和图10)。如图9所示,在研究期间,3周时注射的asah
p361r/p361r
小鼠的肌肉力量与野生型动物相当,如使用四肢评估-悬垂试验所评估的,而未经治疗的突变体小鼠的肌肉力量随时间降低(注射时,n=9wt pbs、n=11asah
p361r/p361r
pbs和n=9asah
p361r/p361r
aav-hasah1小鼠)。图10示出了在研究期间(4至13周),在疾病症状后阶段(7周)注射ssaav9-cag-hasah1将被注射的asah
p361r/p361r
小鼠的肌肉力量恢复到野生型评分,而未经治疗的突变体小鼠的肌肉力量则随时间下降(注射时,n=9wt pbs、n=5asah
p361r/p361r
pbs和n=8asah
p361r/p361r
aav-hasah1小鼠)。结果表示为平均值
±
sem。通过多重t检验分析组间的差异(*p《0,05;$p《0,005)。
[0314]
此外,图11示出了在出生时(p0)通过脑室内(icv)注射1x10
13
vg/kg的aav9-cag-hasah1进行治疗的突变体asah
p361r/p361r
小鼠的体重随时间逐渐增加,并且与野生型同窝小鼠相当,而未经治疗的突变体小鼠在约5周龄时开始出现生长缺陷(注射时,n=32wt pbs、n=16asah
p361r/p361r
pbs和n=32asah
p361r/p361r
aav-hasah1小鼠)。
[0315]
最后,图12示出了在研究期间在出生时通过icv给药aav9-cag-hasah1进行治疗的突变体asah
p361r/p361r
小鼠的肌肉力量与野生型动物相当,如使用四肢评估-悬垂试验所评估,而未经治疗的突变体小鼠的力量不随时间增加(注射时,n=9wt pbs、n=11asah
p361r/p361r
pbs和n=11asah
p361r/p361r
aav-hasah1小鼠)。
[0316]
综上所述,本文表明,携带hasah1 orf的raav载体可以广泛地矫正与酸性神经酰胺酶缺乏相关的表型。实际上,上述结果表明了通过静脉内(iv)或脑脊液(csf)途径给药的这种载体可以大大延长它们的寿命,防止体重减轻和器官损伤,恢复肌肉力量并对血细胞组成产生积极影响。最后一个结果特别令人惊讶,因为没有预计携带hasah1 orf的raav9载体能够对血细胞组成产生影响。先前矫正血液学缺陷的尝试包括造血干细胞移植或使用慢病毒载体遗传修饰的造血细胞进行的离体基因疗法,但这些方法对神经系统中的asah1缺乏症的表现没有显着影响。在文献中,报道了在3天龄时通过慢病毒载体注射hasah1 orf的用于法伯病的基因治疗方法未能抵消生长迟缓和120天以上的存活率。因此,本文的研究结果还突出了使用raav方法进行基因替代治疗的优势,与慢病毒相比,该方法能够在症状前(3周龄)和症状后(7周龄)阶段全面矫正疾病表型。此处,提供了一种治疗策略,该治疗策略用于解决由酸性神经酰胺酶紊乱引起的多重损伤,特别是在fd中引起的那些损伤。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。