1.本公开涉及神经炎症的抑制、用于抑制神经炎症的组合物以及方法。本公开在一个或多个方式中涉及神经前体细胞、多能干细胞和/或神经元的移植的辅助、用于上述移植的辅助的组合物以及方法。本公开在一个或多个方式中涉及神经胶质细胞中的nrf2(nf-e2-related factor 2,nf-e2相关因子2)蛋白的稳定化的促进、用于上述促进的组合物以及方法。本公开在一个或多个方式中涉及保护神经细胞不发生神经炎症、以此为目的的组合物以及方法。
背景技术:
2.帕金森病是发展性的神经变性疾病,以丧失黑质纹状体的多巴胺能神经(多巴胺能神经元)为特征。目前的临床研究已确认,通过移植产前期中脑细胞,可改善帕金森病患者的运动症状。根据这样的事实,认为帕金森病的治疗方法包括细胞补充疗法。多能干细胞,特别是人工多能干细胞(ips细胞或ipsc)具有能够大量供给多巴胺能神经的可能性。因此,多能干细胞被认为是新的供体细胞源。但是,从ips细胞等干细胞分化出的神经前体细胞以及多巴胺能神经细胞在移植到脑内后的残存率(生存率)极低(专利文献1)。
3.小胶质细胞是在中枢神经系统(脑或脊髓)中存在的神经胶质细胞的一种。小胶质细胞也称为microglia或霍特加氏(hortega)细胞。小胶质细胞被认为是巨噬细胞那样的免疫活性细胞。小胶质细胞具有成为免疫反应的起点的抗原呈递作用、对异物的天然免疫作用、对异物和废物的吞噬作用、神经回路的形成辅助、产生对周围的细胞造成影响的各种物质等各种作用、效果。小胶质细胞通过外部刺激或应力等而成为活性状态,产生抗氧化物质或营养因子等有用的物质。但是,小胶质细胞因病理性活化而分泌炎症性细胞因子或趋化因子、核酸、谷氨酸等兴奋性氨基酸、活性氧种、蛋白酶等,伤害周围的细胞,由此成为神经炎症的起点。因此,小胶质细胞可能成为中枢神经系统的神经变性的原因(专利文献2)。
4.报道了对于作为蛋白磷酸化酶的dyrk1a蛋白的磷酸化活性具有抑制能力的化合物对神经新生或神经细胞增殖具有效果(专利文献3和4)。dyrk是表示双特异性酪胺酸磷酸化调节激酶(dual specificity tyrosine-phosphorylation-regulated kinase)的酶的总称。现有技术文献
5.专利文献专利文献1:日本特开2018-76385号公报专利文献2:wo2018/029793专利文献3:wo2015/083750专利文献4:wo2018/043674
技术实现要素:
发明要解决的技术问题
6.本公开在一个方式中提供了用于抑制神经炎症的药物组合物。本公开在一个方式中提供了用于辅助神经前体细胞、多能干细胞和/或神经元的移植的药物组合物。本公开在一个方式中提供了用于促进神经胶质细胞中的nrf2蛋白的稳定化的药物组合物。本公开在一个方式中提供了用于保护神经细胞不发生神经炎症的药物组合物。用于解决技术问题的手段
7.本公开在一个方式中涉及用于抑制神经炎症的药物组合物,其含有具有对dyrk1a蛋白的磷酸化活性的抑制能力的化合物或其制药上允许的盐作为有效成分。
8.本公开在另一方式中涉及用于辅助神经前体细胞、多能干细胞和/或神经元的移植的药物组合物,其含有具有对dyrk1a蛋白的磷酸化活性的抑制能力的化合物或其制药上允许的盐作为有效成分。
9.本公开在另一方式中涉及用于促进神经胶质细胞中的nrf2蛋白的稳定化的药物组合物,其含有具有对dyrk1a蛋白的磷酸化活性的抑制能力的化合物或其制药上允许的盐作为有效成分。
10.本公开在另一方式中涉及用于保护神经细胞不发生神经炎症的药物组合物,其含有具有对dyrk1a蛋白的磷酸化活性的抑制能力的化合物或其制药上允许的盐作为有效成分。
11.本公开在另一方式中涉及抑制神经炎症的方法,其包括以有效量向对象给药本公开所涉及的药物组合物的步骤。本公开在另一方式中涉及用于使被移植的细胞的存活率(日语:生存率)提高的方法,其包括在移植神经前体细胞、多能干细胞和/或神经元之前、同时或之后以有效量向受体给药本公开所涉及的药物组合物的步骤。本公开在另一方式中涉及促进神经胶质细胞中的nrf2蛋白的稳定化,保护神经细胞不发生神经炎症的方法,其包括以有效量向对象给药本公开所涉及的药物组合物的步骤。本公开在另一方式中涉及伴随神经炎症的疾病的改善、发展抑制和/或治疗的方法,其包括以有效量向对象给药本公开所涉及的药物组合物的步骤,所述伴随神经炎症的疾病选自额颞叶变性、肌萎缩侧索硬化和多发性硬化。发明效果
12.根据本公开所涉及的药物组合物,在一个或多个实施方式中能够抑制神经炎症。根据本公开所涉及的药物组合物,在一个或多个实施方式中能够提高移植的神经前体细胞、干细胞和/或神经元移植后的存活率。根据本公开所涉及的药物组合物,在一个或多个实施方式中能够促进提高神经胶质细胞中的nrf2蛋白的稳定化。根据本公开所涉及的药物组合物,在一个或多个实施方式中能够保护神经细胞不发生神经炎症。
附图说明
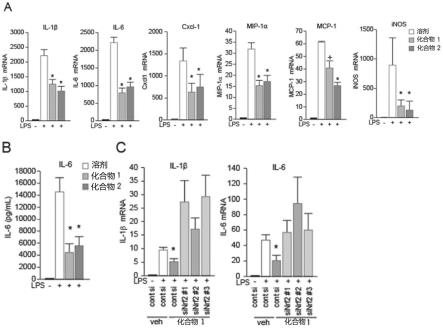
13.图1涉及神经胶质细胞中的p21和nrf2的诱导。图1的a是用化合物1处理小胶质细胞时的免疫印迹分析的结果。图1的b是用化合物1和2处理的神经胶质细胞的代表性图像。图1的c是cd11b阳性细胞的核中的nrf2的信号强度的定量化的例子。图2涉及神经炎症(小胶质细胞的细胞因子的产生)的抑制。图2的a是用qpcr评价脂多糖(lps)处理时的细胞因子、趋化因子以及inos的mrna的产生的结果。图2的b是将由lps刺激产生的细胞因子用elisa定量化的结果。图2的c是在nrf2存在下或不存在下与所示细胞因子的产生相关的qpcr分析的结果。图3涉及神经元的移植效率的提高。图3的a是实验方案。图3的b是移植到小鼠的纹状体组织中的来自ipsc的多巴胺能神经元(da神经元)的代表性图像。图3的c表示移植细胞的定量分析的结果。图4涉及由神经炎症引起的神经变性的抑制。图4的a是实验方案。图4的b是处理后的动物的黑质的代表性图像。图4的c是将黑质致密部(snpc)的th阳性细胞的数量定量化的结果。图4的d是末次lps注射起第1天的纹状体组织的利用qpcr的神经胶质活化的定量分析结果。图4的e和图4的f是用qpcr(e)和elisa(f)分析由第1天的纹状体组织表示的细胞因子和趋化因子的水平的结果。图5涉及神经保护功能(来自ips细胞的神经元的移植效率提高以及细胞炎症引起的细胞变性的抑制效果)的机制。图5的a是来自hipsc的多巴胺能神经前体细胞的代表性图像。图5的b是hnuclei的数量的定量分析。图5的c是基于pcr的定量。
具体实施方式
14.本公开基于以下见解:对dyrk1a蛋白的磷酸化活性具有抑制能力的化合物能够抑制神经炎症。另外,本公开基于以下见解:对dyrk1a蛋白的磷酸化活性具有抑制能力的化合物能够提高移植到脑中的神经元的定植率(日语:定着率)(生存率、残存率(日语:残存率))。此外,本公开基于以下见解:对dyrk1a蛋白的磷酸化活性具有抑制能力的化合物能够促进神经胶质细胞中的nrf2蛋白的稳定化,保护神经细胞不发生神经炎症。
15.对dyrk1a蛋白的磷酸化活性具有抑制能力的化合物发挥能够抑制神经炎症的效果的机制的详细情况尚不明确,但推测如下。通常情况下,起到支撑神经的效果的小胶质细胞在受到损伤或神经炎症等应激时活化,释放炎症性细胞因子或活性氧种,使神经元变性。此时,如果抑制dyrk1a,则细胞周期蛋白d1和p21稳定化,nrf2的分解停止,nrf2稳定化。该nrf2抑制产生炎症诱发性细胞因子的基因的表达,抑制小胶质细胞的过度活化。认为通过抑制成为神经炎症起点的小胶质细胞的活化,从而抑制神经炎症,发挥移植效率的提高和/或神经细胞保护的效果。然而,本公开不被解释为限于这些机制。
16.[神经炎症抑制剂]本公开涉及一种用于抑制神经炎症的药物组合物(以下,也称为本公开所涉及的神经炎症抑制剂),其含有对dyrk1a蛋白的磷酸化活性具有抑制能力的化合物或其制药上允许的盐作为有效成分。
本公开所涉及的神经炎症抑制剂在一个或多个实施方式中能够通过抑制小胶质细胞的过度活化、抑制神经炎症。本公开所涉及的神经炎症抑制剂在一个或多个实施方式中能够通过促进神经胶质细胞中的nrf2蛋白的稳定化抑制小胶质细胞的过度活化、抑制神经炎症。在本公开中,神经胶质细胞是指支持神经元(神经细胞)的非神经元细胞,在一个或多个实施方式中可列举小胶质细胞、星形胶质细胞、少突胶质细胞,优选为小胶质细胞。nrf2是对维持生物体的恒定性重要的转录因子。在本公开中,nrf2蛋白的稳定化在一个或多个实施方式中是指nrf2蛋白的分解被抑制,nrf2蛋白的细胞内量增加。nrf2的稳定化在一个或多个实施方式中能够参照实施例确认。
[0017]
本公开所涉及的神经炎症抑制剂在一个或多个实施方式中能够应用公知的制剂技术,制成适于给药方式的剂型。作为其给药方式,不限定于这些,例如可举出:基于片剂、胶囊剂、颗粒剂、散剂、丸剂、锭剂、糖浆剂、液剂等剂型的经口给药。或者,可举出:基于注射剂、液剂、气雾剂、栓剂、贴剂、膏剂、洗剂、搽剂、软膏剂、滴眼剂等剂型的非经口给药。这些制剂不限于这些,能够通过公知的方法而使用赋形剂、润滑剂、粘合剂、崩解剂、稳定剂、矫味矫臭剂和稀释剂等添加剂来制造。本公开的药物组合物在一个或多个实施方式中可以进一步包含药物上允许的载体、防腐剂、表面活性剂、ph调节剂、稀释剂、上述的添加剂或其它药物上允许的成分。
[0018]
作为所述赋形剂,不限于这些,能够举出:淀粉、马铃薯淀粉、玉米淀粉等淀粉、乳糖、结晶纤维素、磷酸氢钙等。作为所述润滑剂,不限于这些,能够举出:乙基纤维素、羟丙基纤维素、羟丙基甲基纤维素、紫胶、滑石、巴西棕榈蜡、石蜡等。作为所述粘合剂,不限于这些,能够举出:聚乙烯吡咯烷酮、聚乙二醇和与所述赋形剂相同的化合物。作为所述崩解剂,不限于这些,能够举出:与所述赋形剂相同的化合物以及交联羧甲基纤维素钠、羧甲基淀粉钠、交联聚乙烯吡咯烷酮等化学修饰的淀粉/纤维素类。作为所述稳定剂,不限于这些,能够举出:如对羟基苯甲酸甲酯和对羟基苯甲酸丙酯的对羟基苯甲酸酯;如氯丁醇、苯甲醇和苯乙醇的醇类;苯扎氯铵;如苯酚、甲酚的酚类;硫柳汞;脱氢乙酸;以及山梨酸。作为所述矫味矫臭剂,不限于这些,能够举出:通常使用的甜味剂、酸味剂、香料等。
[0019]
在液剂的制造中,作为溶剂,不限于这些,能够使用乙醇、苯酚、氯甲酚、纯化水、蒸馏水等,根据需要也能够使用表面活性剂或乳化剂等。作为所述表面活性剂或乳化剂,并不限定于这些,能够举出聚山梨醇酯80、硬脂酸聚烃氧(40)酯、聚桂醇等。
[0020]
本公开所涉及的神经炎症抑制剂可举出向患有伴随神经炎症的疾病的对象给药。作为伴随神经炎症的疾病,在一个或多个实施方式中可举出:额颞叶变性、肌萎缩侧索硬化和多发性硬化。对象可举出人、人以外的动物。作为所述动物,在一个或多个实施方式中例如可举出:小鼠、大鼠、豚鼠、仓鼠、兔、猫、狗、绵羊、猪、牛、马、山羊、猴等哺乳类。
[0021]
本公开所涉及的神经炎症抑制剂的给药量能够根据症状、年龄、给药方法等而有所不同。使用方法并不限定于这些,但能够间歇地或持续地以经口、经皮、粘膜下、皮下、肌肉内、血管内、脑内或腹腔内方式给药,以使有效成分的化合物的体内浓度为100nm~1mm之间的任一种。
作为非限定性实施方式,在经口给药的情况下,可举出:对于对象(如果是人则为成人),每1天,换算成有效成分的化合物,下限为0.01mg(优选为0.1mg),上限为2000mg(优选为500mg,更优选为100mg),分为1次或数次,根据症状进行给药。作为非限定性实施方式,可举出:在静脉内给药的情况下,对于对象(如果是人则为成人),每1天,作为下限为0.001mg(优选0.01mg),作为上限为500mg(优选50mg),分1次或数次,根据症状进行给药。
[0022]
因此,本公开在另一方式中涉及一种抑制神经炎症的方法,其包括以有效量向对象给药本公开所涉及的神经炎症抑制剂的步骤。另外,本公开在另一方式中涉及抑制小胶质细胞的过度活化、抑制神经炎症的方法,其包括以有效量向对象给药本公开所涉及的神经炎症抑制剂的步骤。另外,本公开在另一方式中涉及通过促进nrf2蛋白的稳定化、抑制小胶质细胞的过度活化、从而抑制神经炎症的方法,所述方法包括以有效量向对象给予本公开所涉及的神经炎症抑制剂的步骤。此外,本公开在另一方式中涉及伴随神经炎症的疾病的改善、发展抑制和/或治疗的方法,其包括以有效量向对象给药本公开所涉及的神经炎症抑制剂的步骤。
[0023]
[移植辅助剂]本公开在一个方式中涉及一种用于辅助神经前体细胞、多能干细胞和/或神经元的移植的药物组合物(以下,也称为本公开所涉及的移植辅助剂),其含有对dyrk1a蛋白的磷酸化活性具有抑制能力的化合物或其制药上允许的盐作为有效成分。在本公开中,细胞的移植在一个或多个实施方式中是指将细胞移植到移植对象(受体)的特定部位,使其在移植的部位和/或其周边部位生存(定植),和/或根据周边环境适当地分化。作为移植的特定部位,在一个或多个实施方式中可举出:神经系统、中枢神经系统(例如,脑、脊髓)、末梢神经系统或这些的组织。在本公开中,“辅助的移植”在一个或多个实施方式中是指移植后被移植的细胞的存活率、定植率和/或残存率提高。细胞的存活率、定植率和/或残存率提高在一个或多个实施方式中能够参照实施例加以确认。在本公开中,“移植神经前体细胞、多能干细胞和/或神经元”在一个或多个实施方式中可以是移植这些细胞自身,也可以是以包含其它细胞的方式移植,也可以是在器官(脏器)、组织、集合体的一部分中包含神经前体细胞、干细胞和/或神经元的方式的移植。
[0024]
在本公开中,“神经前体细胞”是指能够分化为神经细胞的细胞,其分化阶段没有特别限制。本公开中使用的神经前体细胞在一个或多个实施方式中可以是神经干细胞。本公开中使用的神经前体细胞在一个或多个实施方式中可以是从人等哺乳动物的脑组织中分离的细胞。本公开中使用的神经前体细胞在一个或多个实施方式中可以是使胚胎干细胞(es细胞)和人诱导多能干细胞(ips细胞)等多能干细胞分化诱导而得到的细胞(有时分别称为来自es细胞的细胞,来自ips细胞的细胞。)。本公开中使用的多能干细胞在一个或多个实施方式中可列举能够分化为神经细胞的多能干细胞、神经干细胞。作为多能干细胞,在一个或多个实施方式中包括:es细胞、ips细胞、来自通过核移植而得的克隆胚胎的核移植胚胎干(ntes)细胞、精子干细胞(gs细
胞)、胚胎生殖细胞(eg细胞)、培养成纤维细胞以及来自骨髓干细胞的多能干细胞(muse细胞)等。作为神经元(神经细胞),没有特别限定,在一个或多个实施方式中可举出由神经前体细胞诱导分化而得到的神经元。作为移植的神经前体细胞和神经元,在一个或多个实施方式中可举出:由多能干细胞诱导分化的多巴胺能神经元前体细胞和由多能干细胞诱导分化的多巴胺能神经元。
[0025]
本公开所涉及的移植辅助剂能够以在向移植对象(受体)移植之前、移植的同时或移植之后向受体给药的方式使用。或者,移植辅助剂也可以在移植前添加到要移植的细胞中。作为受体,可举出人或人以外的动物。作为所述动物,在一个或多个实施方式中例如可举出:小鼠、大鼠、豚鼠、仓鼠、兔、猫、狗、绵羊、猪、牛、马、山羊、猴等哺乳类。移植的细胞也能够设为上述的人或人以外的动物的细胞。受体与移植细胞的种属可以相同,也可以不同。
[0026]
本公开所涉及的移植辅助剂的给药量根据给药的目的、给药方法、给药对象的状况(性别、年龄、体重、病情等)而有所不同,但在对人给药的情况下,在一个或多个实施方式中也可以以每1天给药10~1200mg或100~1200mg有效成分的方式使用。或者,也可以与上述本公开所涉及的神经炎症抑制剂相同。
[0027]
作为本公开所涉及的移植辅助剂的给药途径,能够设为与移植部或移植细胞直接接触,或者以经口、经皮、粘膜下、皮下、肌肉内、血管内、脑内或腹腔内方式给药。作为通常使用的给药方式,例如,可以举出:溶剂、片剂、胶囊剂、颗粒剂、细粒剂、散剂、舌下片、糖浆剂、悬浊液等。也可以将形成为液剂的形式的移植辅助剂作为注射剂而非经口给药。上述给药剂型能够通过在所允许的通常的载体、赋形剂、粘合剂、稳定剂等中配合本公开所涉及的有效成分来制造。当本公开所涉及的移植辅助剂用作注射剂时,能够添加所允许的缓冲剂、增溶剂、等渗剂等。
[0028]
在使用本公开所涉及的移植辅助剂时,在一个或多个实施方式中移植后的神经元在对象中的生存率、定植率和/或残存率能够得以提高。因此,本公开所涉及的移植辅助剂在一个或多个实施方式中能够在用于再生医疗的器官(脏器)、组织或细胞的移植中使用。另外,本公开所涉及的移植辅助剂在一个或多个实施方式中能够在脑梗塞、脊髓梗塞、脑出血、脊髓出血、脸部神经麻痹、四肢神经麻痹、路易小体型痴呆、唐氏综合症、抑郁症、神经变性疾病、阿尔茨海默病、帕金森病以及亨廷顿病等显示发展性神经脱落的神经变性疾病等神经疾病的手术(治疗)中的移植中使用。
[0029]
因此,本公开在另一方式中涉及一种使被移植的细胞的存活率提高的方法,其包括在移植神经前体细胞、多能干细胞和/或神经元之前、同时或之后以有效量向受体给药本公开所涉及的移植辅助剂的步骤。另外,本公开在另一方式中涉及一种神经前体细胞、多能干细胞和/或神经元的移植方法,其包括在移植之前、同时或之后以有效量向受体给药本公开所涉及的移植辅助剂的步骤。
[0030]
[nrf2稳定剂]
本公开在一个方式中,涉及一种用于促进神经胶质细胞中的nrf2蛋白的稳定化的药物组合物(以下,也称为本公开所涉及的nrf2稳定剂),其含有对dyrk1a蛋白的磷酸化活性具有抑制能力的化合物或其制药上允许的盐作为有效成分。本公开所涉及的nrf2稳定剂在一个或多个实施方式中能够促进神经胶质细胞中的nrf2蛋白的稳定化。本公开所涉及的nrf2稳定剂在一个或多个实施方式中通过促进神经胶质细胞中的nrf2蛋白的稳定化,能够抑制神经胶质细胞的过度活化。由于小胶质细胞的活化成为神经炎症的起点,因此本公开所涉及的nrf2稳定剂在一个或多个实施方式中能够抑制神经胶质细胞的活化,能够抑制神经炎症。
[0031]
本公开所涉及的nrf2稳定剂的给药形式、剂型、给药量等能够设为与本公开所涉及的神经炎症抑制剂相同。
[0032]
本公开所涉及的nrf2稳定剂可举出向患有伴随神经炎症的疾病的对象给药。作为伴随神经炎症的疾病,在一个或多个实施方式中可举出:额颞叶变性、肌萎缩侧索硬化和多发性硬化。对象可举出人、人以外的动物。
[0033]
因此,本公开在其他实施方式中,涉及一种促进神经胶质细胞中的nrf2蛋白的稳定化的方法,其包括以有效量向对象给药本公开所涉及的nrf2稳定剂的步骤。此外,本公开在其他实施方式中,涉及一种促进神经胶质细胞中的nrf2蛋白的稳定化,抑制神经炎症的方法,其包括以有效量向对象给药本公开所涉及的nrf2稳定剂的步骤。此外,本公开在其他实施方式中,涉及一种伴随神经炎症的疾病的改善、发展抑制和/或治疗的方法,其包括以有效量向对象给药本公开所涉及的nrf2稳定剂的步骤。
[0034]
[神经细胞保护剂]本公开在一个方式中,涉及一种用于保护神经细胞不发生神经炎症的药物组合物(以下,也称为本公开所涉及的神经细胞保护剂),其含有对dyrk1a蛋白的磷酸化活性具有抑制能力的化合物或其制药上允许的盐作为有效成分。本公开所涉及的神经细胞保护剂在一个或多个实施方式中通过促进神经胶质细胞中的nrf2蛋白的稳定化,能够抑制神经胶质细胞的过度活化。由于小胶质细胞的活化成为神经炎症的起点,通过抑制神经胶质细胞的活化,能够抑制神经炎症,实现神经细胞的保护。
[0035]
本公开所涉及的神经细胞保护剂的给药形式、剂型、给药量等能够设为与本公开所涉及的神经炎症抑制剂相同。
[0036]
本公开所涉及的神经细胞保护剂可举出向患有伴随神经炎症的疾病的对象给药。作为伴随神经炎症的疾病,在一个或多个实施方式中可举出:额颞叶变性、肌萎缩侧索硬化和多发性硬化。对象可举出人、人以外的动物。
[0037]
因此,本公开在其他实施方式中,涉及一种保护神经细胞不发生神经炎症的方法,其包括以有效量向对象给药本公开所涉及的神经细胞保护剂的步骤。此外,本公开在其他实施方式中,涉及一种通过抑制神经炎症来保护神经细胞的方法,其包括以有效量向对象给药本公开所涉及的神经细胞保护剂的步骤。
此外,本公开在其他实施方式中,涉及一种通过抑制神经胶质细胞的活化并抑制神经炎症来保护神经细胞的方法,其包括以有效量向对象给药本公开所涉及的神经细胞保护剂的步骤。此外,本公开在其他实施方式中,涉及一种伴随神经炎症的疾病的改善、发展抑制和/或治疗的方法,其包括以有效量向对象给药本公开所涉及的神经细胞保护剂的步骤。
[0038]
[有效成分]本公开所涉及的药物组合物(神经炎症抑制剂、移植辅助剂、nrf2稳定剂和神经细胞保护剂)的有效成分(也称为本公开所涉及的有效成分)是对dyrk1a蛋白的磷酸化活性具有抑制能力的化合物或其制药上允许的盐作为有效成分。对dyrk1a蛋白的磷酸化活性具有抑制能力的化合物在一个或多个实施方式中能够使用在wo2018/043674和wo2015/107945中公开的化合物。这些文献的内容作为构成本公开的一部分的内容而被引用。dyrk1a通过将细胞周期蛋白d1磷酸化,促进细胞周期蛋白d1和p21的分解。
[0039]
本公开中的对dyrk1a蛋白的磷酸化活性具有抑制能力的化合物在一个或多个实施方式中可举出选自由下式(i)至(iii)所示的化合物组成的组中的至少一种。式(i)中,r1和r2各自独立地为氢原子或碳原子数1~6的烃链,r3为-ch
2-ch
2-或-ch=ch-,r4为氢原子、卤原子或碳原子数1~6的烷基,式(ii)以及(iii)中,r5、r6、r7及r8分别独立地为氢原子、卤原子、羧基、氨基、羟基、碳原子数1~4的烷基或被卤原子取代的碳原子数1~4的烷基。
[0040]
通式(i)中,r1在一个或多个实施方式中为碳原子数1~6的烷基,在进一步的一个或多个实施方式中为甲基、乙基或丙基。通式(i)中,r2在一个或多个实施方式中为碳原子数1~6的烷基,在进一步的一个或多个实施方式中为甲基。通式(i)中,r4在一个或多个实施方式中为氢原子。
[0041]
所述通式(i)所示的化合物在一个或多个实施方式中是所示的化合物。
[0042]
通式(ii)和(iii)中,r5、r6、r7和r8在一个或多个实施方式中为氢原子。
[0043]
所述通式(ii)和(iii)所示的化合物在一个或多个实施方式中是
所示的化合物。
[0044]
在本公开中,“制药上允许的盐”包括药理上和/或药物上允许的盐,例如可举出:无机酸盐、有机酸盐、无机碱盐、有机碱盐和酸性或碱性氨基酸盐等。
[0045]
作为所述无机酸盐的优选例,例如可举出:盐酸盐、氢溴酸盐、硫酸盐、硝酸盐、磷酸盐等,作为有机酸盐的优选例,例如可举出:乙酸盐、琥珀酸盐、富马酸盐、马来酸盐、酒石酸盐、柠檬酸盐、乳酸盐、硬脂酸盐、苯甲酸盐、甲磺酸盐、对甲苯磺酸盐等。
[0046]
作为所述无机碱盐的优选例,例如可举出:钠盐、钾盐等碱金属盐、钙盐、镁盐等碱土金属盐、铝盐、铵盐等。作为所述有机碱盐的优选例,例如可举出:二乙胺盐、二乙醇胺盐、葡甲胺盐、n,n
′‑
二苄基乙二胺盐等。
[0047]
作为所述酸性氨基酸盐的优选例,例如可举出:天冬氨酸盐、谷氨酸盐等。作为所述碱性氨基酸盐的优选例,例如可举出:精氨酸盐、赖氨酸盐、鸟氨酸盐等。
[0048]
在本公开中,“化合物的盐”能够包括通过将化合物放置在大气中吸收水分而可能形成的水合物。另外,在本公开中,“化合物的盐”能够包括化合物吸收其他种类的溶剂而可能形成的溶剂化物。
[0049]
在本公开中,烷基在一个或多个实施方式中可举出:直链、支链或环状的烷基。在本公开中,“碳原子数1~4的烷基”在一个或多个实施方式中是指碳原子数为1、2、3或4个的直链或支链烷基、或者碳原子数为3或4个的环状的烷基。作为碳原子数为1、2、3或4个的直链或支链的烷基,在一个或多个实施方式中可举出:甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基等。作为碳原子数为3或4个的环状的烷基,在一个或多个实施方式中可举出:环丙基、环丁基等。
[0050]
在本公开中,“碳原子数1~6的烃链”是指通过从碳原子数为1、2、3、4、5或6个的脂肪族烃中除去任意一个氢原子而衍生的一价基团。烃链在一个或多个实施方式中可以是直链结构、支链结构或环状结构,可举出:烷基、烯基、苯基或环烷基。在本公开中,“碳原子数1~6的烷基”在一个或多个实施方式中可举出:甲基、乙基、1-丙基、2-丙基、2-甲基-1-丙基、2-甲基-2-丙基、1-丁基、2-丁基、1-戊基、2-戊基、3-戊基、2-甲基-1-丁基、3-甲基-1-丁基、2-甲基-2-丁基、3-甲基-2-丁基、2,2-二甲基-1-丙基、1-己基、2-己基、3-己基、2-甲基-1-戊基、3-甲基-1-戊基、4-甲基-1-戊基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、2-甲基-3-戊基、3-甲基-3-戊基、2,3-二甲基-1-丁基、3,3-二甲基-1-丁基、2,2-二甲基-1-丁基、2-乙基-1-丁基、3,3-二甲基-2-丁基或2,3-二甲基-2-丁基等。在本公开中,卤原子在一个或多个实施方式中可举出:氟原子、氯原子、溴原子和碘原子。
[0051]
本公开可涉及以下一个或多个实施方式;[1]一种用于抑制神经炎症的药物组合物,其含有对dyrk1a蛋白的磷酸化活性具有抑制能力的化合物或其制药上允许的盐作为有效成分。
[2]根据[1]所述的药物组合物,其用于辅助神经前体细胞、多能干细胞和/或神经元的移植。[3]根据[1]所述的药物组合物,其用于促进神经胶质细胞中的nrf2蛋白的稳定化。[4]根据[1]所述的药物组合物,其用于保护神经细胞不发生神经炎症。[5]根据[1]所述的药物组合物,其用于伴随神经炎症的疾病的改善、发展抑制和/或治疗,所述伴随神经炎症的疾病选自额颞叶变性、肌萎缩侧索硬化和多发性硬化。[6]根据[1]至[5]中任一项所述的药物组合物,其中,对dyrk1a蛋白的磷酸化活性具有抑制能力的化合物为选自由下式(i)至(iii)所示的化合物组成的组中的至少一种,式(i)中,r1和r2各自独立地为氢原子或碳原子数1~6的烃链,r3为-ch
2-ch
2-或-ch=ch-,r4为氢原子、卤原子或碳原子数1~6的烷基,式(ii)以及(iii)中,r5、r6、r7及r8分别独立地为氢原子、卤原子、羧基、氨基、羟基、碳原子数1~4的烷基或被卤原子取代的碳原子数1~4的烷基。[7]一种抑制神经炎症的方法,其包括以有效量向对象给药[1]至[6]中任一项所述的药物组合物的步骤。[8]一种使被移植的细胞的存活率、定植率和/或残存率提高的方法,其包括在移植神经前体细胞、多能干细胞和/或神经元之前、同时或之后以有效量向受体给药[1]至[6]中任一项所述的药物组合物的步骤。[9]一种促进神经胶质细胞中的nrf2蛋白的稳定化的方法,其包括以有效量向对象给药[1]至[6]中任一项所述的药物组合物的步骤。[10]一种保护神经细胞不发生神经炎症的方法,其包括以有效量向对象给药[1]至[6]中任一项所述的药物组合物的步骤。[11]一种伴随神经炎症的疾病的改善、发展抑制和/或治疗的方法,其包括以有效量向对象给药[1]至[6]中任一项所述的药物组合物的步骤,所述伴随神经炎症的疾病选自额颞叶变性、肌萎缩侧索硬化和多发性硬化。实施例
[0052]
以下,通过实施例更详细地说明本公开,但是这些实施例仅是示例性的,本公开并不限于这些实施例。需要注意的是,在本公开中引用的所有文献被全部组入并作为本公开的一部分。
[0053]
化合物1下述化合物1通过wo2018/043674中公开的方法合成。需要说明的是,对于dyrk1a
的体外激酶活性中,化合物1的ic
50
为76.95nm。化合物1
[0054]
化合物2下述化合物2通过wo2015/083750中公开的方法合成。需要说明的是,对于dyrk1a的体外激酶活性中,化合物2的ic
50
为32.95nm。化合物2
[0055]
统计将由三次以上的实验得到的结果表示为平均值
±
sem。统计上的显著性差异是继双侧非配对学生检验或一维组间方差分析(anova)之后,使用tukey-kramer比较检验而确定的。将不足0.05的p值视为具有显著性差异,并以单一的星号(*)表示,不足0.01的p值以双重星号(**)表示。
[0056]
图像分析将细胞接种于96孔的purecoat胺涂布板上,在每次特定的实验中根据需要进行处理。免疫标记完成后,使用具备harmony软件的opera phenix(perkin elmer社制造)自动获得图像(物镜20倍的倍率,2
×
2ccd像素,每孔25场),并进行分析。为了获得图像,还使用荧光显微镜(bz-9000,keyence社制造)或共焦显微镜(sp-8,leica社制造)。
[0057]
动物模型每天1次,以1mg/kg向8~9周龄的c57black/6j小鼠中腹腔内注射lps(o55:b5)(sigma社制造,l2880)4天。将来自hipsc的多巴胺(da)能神经前体细胞移植到4周龄的scid小鼠的纹状体中。药物处理在lps或ipsc移植前1小时进行。
[0058]
试剂脂多糖(lps)从sigma-aldrich购入。小分子化合物溶解于二甲亚砜(dmso,nacalaitesque社制造)中,制成体外测定用的50mm的储备溶液。sirna从ambion或dharmacon购入。使用了免疫印迹用兔多克隆抗nrf2(mbl)、免疫细胞化学用兔多克隆抗nrf2(abcam)、小鼠单克隆抗p21(abcam)和兔多克隆抗细胞周期蛋白d1(cell signaling)、大鼠抗cd11b(abcam)、鸡多克隆抗th(abcam)、兔多克隆抗iba1(wako)、山羊多克隆抗gfap(millipore)、大鼠抗nurr1(由kan研究所提供)、小鼠单克隆抗hnuclei(abcam)以及兔多克隆hrp结合抗gapdh(mbl)。
[0059]
细胞培养小胶质细胞细胞株bv-2以添加了10%胎牛血清(nichirei bioscience)、100u/ml青霉素、100μg/ml链霉素的高葡萄糖dulbecco改良eagle培养基(dmem),nacalaitesque)维持。原代海马以及皮层神经元培养物由胚胎第18天的小鼠制备,并以补充了2%b27补充剂、100u/ml青霉素、100μg/ml链霉素以及0.5mm的l-谷氨酰胺的neurobasal培养基(life technologies)维持。多巴胺能神经元培养由胚胎第13天的小鼠的腹侧中脑制备,并以添加了10%胎牛血清、2%b27补充剂、10ng/ml的gdnf、100u/ml青霉素和100μg/ml链霉素的neurobasal培养基(life technologies)维持。为了除去神经胶质细胞,在培养第2天添加5μm的胞嘧啶β-d-阿拉伯呋喃糖苷、10μm的5-氟尿嘧啶和10μm尿苷(全部为sigma-aldrich制)。混合培养物由新生仔鼠(p1~p4)获得,并维持在t75或t175烧瓶中。每3~4天更换培养基,直至细胞汇合。小胶质细胞是通过剧烈振荡或cd11b阳性选择(invitrogen)的任一种而得到的。为了进行共培养实验,由胚胎第13天的mge(medial ganglionic eminence)制备小鼠的神经胶质细胞培养,在pll被覆皿中培养。将培养物用胰蛋白酶传代两次,用于与来自ipsc的神经元的共培养实验。1039a1ips细胞如以前记载那样建立和维持(nakagawa.et al.,sci rep 4,3594,2014)。多巴胺能前体细胞的诱导是以上述说明的方式执行的(doi.et al.,stem cell reports 2,337-350,2014,kikuchi et al.,nature548,592-596,2017)。简单地说,hips细胞1039a1接种于laminin511上,在含有8%ksr、y27632(wako)、a-83-01(wako)和ldn193178(stemgent)的gmem培养基中分化。添加了purmorphamine(wako)、fgf8(wako,第1天至第7天)和chir99021(wako,第3天至第12天)。挑选corin 细胞后,将细胞再接种到神经球培养用的低粘附96孔板中,在添加了b27补充剂、2mm的l-谷氨酰胺(invitrogen)、10ng/ml的gdnf、200μm抗坏血酸,20ng/ml的bdnf(全部为wako制造)以及400μm的dbcamp(sigma-aldrich)的neurobasal培养基中进一步维持两周。为了避免凋亡,以最初铺板时添加30μm的y27632(wako)。
[0060]
免疫细胞化学将细胞用4%多聚甲醛固定10分钟后,用0.2%tritonx-100进行10分钟透明处理。用pbs洗涤后,将细胞用5%正常驴血清(jackson immunoresearch laboratories)/1%bsa(sigma a7906)/pbs封闭,并用各一次抗体标记。用pbs洗涤后,用与一次抗体对应的荧光标记二次抗体标记。使用hoechst33342检测核。
[0061]
rna提取以及定量rt-pcr用rneasy试剂盒(qiagen)提取总rna后,使用iscript(bio-rad)合成cdna。使用sybrgreenextaq(takara)实施定量pcr。基因的引物使用primerbank设计(wang et al.,2012)
[0062]
免疫印迹使用包含蛋白酶抑制剂混合物(nacalaitesque)和磷酸酶抑制剂混合物(nacalaitesque)的ripa缓冲液(和光),从细胞培养样品中提取总蛋白。在4℃下,以15000rpm离心分离15分钟后,收集上清,使用pierce 660nm protein assay kit(thermo scientific)测定蛋白浓度。接着,用5~20%梯度sds/page凝胶(atto)分离蛋白,通过电转印而转印到聚偏氟乙烯膜(millipore)上。膜以blocking one(nakalaitesque)封闭,然后用所示的抗体进行探测。使用immunostar化学发光(wako)和chemidoc成像系统(bio-rad)
进行检测。
[0063]
体外酶活性实验如以前记载的那样实施体外激酶活性实验(ogawa et al.,nat commun 1,86,2010)。
[0064]
药物处理研究化合物1最初以100mg/ml的浓度溶解于dmso中,用生理盐水中的10%tween80(聚山梨酯80(hx2),hof corporation社制造)稀释成期望的浓度,以0.05ml/kg的量送至皮下。化合物2悬浮于0.5%羧甲基纤维素(nacalaitesque)中,以所希望的浓度以0.1ml/kg的量经口给药。将药物处理动物用异氟烷麻醉以采血,然后用生理盐水灌注。脑匀浆是用5倍量的生理盐水,使用beads crusherμt-12系统(taitec)来制备。血清和脑匀浆中的目标化合物、多巴胺的浓度由使用了搭载有agilent1290纳米流动hplc系统(agilent technologies)的agilent 6420 q-tof质谱仪的lc/ms进行分析。在多巴胺的测定中,为了防止氧化,添加50mg/ml抗坏血酸。
[0065]
免疫组织化学利用pbs灌注成体小鼠的脑,用4%多聚甲醛固定,用30%蔗糖/pbs平衡化后,将40μm切片用振动切片机(leica)或恒冷箱切片机(leica)切断成20μm切片。使用histoone(nakalaitesque)回收抗原后,用指定的抗体对组织进行染色。
[0066]
[实验例1:p21和nrf2的诱导]确认了化合物1和2在神经胶质细胞中诱导p21和nrf2。图1的a是用化合物1处理小胶质细胞bv-2时的免疫印迹分析的结果。以指定浓度、指定时间、化合物1处理bv-2细胞。用所示抗体对处理后的试样进行免疫印迹分析。如图4的a所示,在bv-2细胞中,通过化合物1,细胞周期蛋白d1、p21和nrf2以时间依赖性和体积依赖性的方式上调。图1的b是用化合物1和2处理的神经胶质细胞的代表性图像。细胞被抗nrf2(伪色)、cd11b(品红,小胶质细胞)和gfap(绿,星形细胞)抗体可视化。比例尺=25μm。图1的c是cd11b阳性细胞的核中的nrf2的信号强度的定量化的例子。神经胶质细胞以所示时间用所示浓度的化合物1、2进行了处理。由图1的b和c确认了通过化合物1或2,在cd11b阳性小胶质细胞中诱导nrf2的表达。进而,在用p21 sirna处理过的细胞中,即使用化合物1或2处理,nrf2表达也不增加,但在用对照sirna处理过的细胞中,用化合物1或2处理时,nrf2表达增加(未显示数据)。因此,认为化合物1或2的处理是通过稳定化细胞周期蛋白d1/p21复合物来介导nrf2的诱导。
[0067]
[实验例2:化合物1和2通过稳定nrf2而抑制神经炎症]研究了化合物1和2是否抑制小胶质细胞的细胞因子产生。图2的a是用qpcr评价lps处理时的细胞因子、趋化因子以及inos的mrna的产生的结果。*p《0.05。图2的b是将由lps刺激产生的细胞因子用elisa定量化的结果。*p《0.05。如这些所示,lps刺激可显著地诱导炎症诱发性细胞因子基因表达,但这些上调通
过化合物1或2处理而被有效地抑制。进一步地,抑制了一些趋化因子和inos mrna表达的诱导(图2的a)。图2的c是nrf2存在下或不存在下与由化合物1所致的所示细胞因子的产生相关的qpcr分析的结果。在用nrf2 sirna处理过的细胞中,未观察到抑制细胞因子产生。*p《0.05。这些结果表明,化合物1或2的处理能够有效地抑制神经炎症。进一步地,这些结果强烈表明基于化合物1和2的神经炎症的抑制(细胞因子产生的抑制)是nrf2介导的。
[0068]
[实验例3:ipsc来源细胞的移植效率的提高效果(体内)]由人ipsc制作多巴胺能神经元(da神经元),移植到小鼠脑中,确认了化合物2的处理使得来自ipsc的da神经元的定植效率提高。图3表示其概要。图3的a是实验方案。受体(小鼠)在来自hipsc的da神经元的移植手术前1小时给药化合物2。给药连续进行4天,直至预想到强的小神经胶质活化的手术后4天后,动物保持4周的未处理的状态。图3的b是移植到纹状体组织中的细胞的代表性图像。箭头表示以th或nurr1(均为多巴胺能标记物)共标记的来自ipsc的细胞。比例尺=50μm。移植的da神经元通过hnuclei染色进行鉴定,存活的来自ipsc的da神经元通过th和nurr1多巴胺能标记物的共染色进行定量。图3的c表示移植细胞的定量分析结果。hnuclei和th或nurr1的双重阳性细胞的数量相对于hnuclei阳性细胞的数量进行标准化。对于各条件,n=7和5。*p《0.05,**p《0.01。图3的结果示出了利用化合物2的处置能够改善移植4周后的来自ipsc的da神经元的存活率。
[0069]
[实验例4:抑制神经炎症引起的神经变性的效果(体内)]确认了化合物2能够减少由神经炎症引起的神经变性。图4表示其概要。图4的a是实验方案。通过腹腔将lps给药于小鼠而诱导神经炎症。在向小鼠注射lps前1小时给药药物(化合物2)。药物以指定的用量1日1次经口给药。给药后第1天评价神经胶质的活化和细胞因子的产生。在第7天和第14天评价多巴胺能神经的变性(图4的b和图4的c)。图4的b是处理后的动物的黑质的代表性图像。th(绿)、iba1(灰度)和gfap(品红)分别设为da神经元、小神经胶质和星形细胞的标记物。比例尺=200μm。图4的c是将黑质致密部(snpc)的th阳性细胞的数量定量化的结果。对n=5~6只动物在各条件下进行分析。误差棒表示sem。*p《0.05。确认了通过化合物2的给药,能够抑制神经胶质的活化(图4的d)和细胞因子产生(图4的e和图4的f)。图4的d是末次lps注射起第1天的纹状体组织的利用qpcr的神经胶质活化的定量分析结果。误差棒表示sem。*p《0.05。图4的e和图4的f是用qpcr(e)和elisa(f)对第一天的纹状体组织分析所示细胞因子和趋化因子的水平的结果。误差棒表示sem。*p《0.05。重要的是,多巴胺能神经元的损失在通过化合物2的给药而被救助(图4的b和图4的c),即,化合物2能够减少由神经炎症引起的神经变性。
[0070]
[实验例5:通过神经胶质细胞的神经保护机制(体外)]用化合物2确认实验例1和2所示的神经保护功能(提高ips细胞移植的效果和抑制由细胞炎症引起的细胞变性的效果)的作用点为神经胶质细胞。为了确认经由神经胶质细胞保护神经,建立了共培养系统。将来自hipsc的多巴胺能神经前体细胞和从13日胚小鼠脑分离的神经胶质培养液混合共培养。混合神经胶质培养液中含有gfap阳性和iba1阳性细胞,但不含th阳性细胞。通过h2o2处理对混合神经胶质培养液诱导氧化应激(图5)。通过免疫染色(图5的a和b)以人核的数量评价神经细胞的存活。nurr1和th的多巴胺能标记物通过qpcr进行评价(图5的c)。图5的a是来自hipsc的多巴胺能神经前体细胞的代表性图像。使用抗hnuclei(绿)、抗nurr1(红)和抗th(灰度)的抗体将来自hipsc的da神经元可视化。比例尺=50μm。图5的b是hnuclei的数量的定量分析。数据被标准化为没有h2o2处理的对照条件。*p《0.05。图5的c是基于qpcr的定量。nurr1和th分别用作初期分化和成熟中的多巴胺能神经元的标记物。如图5所示,通过h2o2处理产生的氧化应激,使da神经元的存活降低,但存活量依赖于化合物2的添加量而增加。但是,该化合物2对神经元的保护在没有神经胶质的情况下不发生,仅在与神经胶质共培养时发生。这些强烈地表示化合物2的神经保护功能的发挥经由神经胶质细胞。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。