1.本发明涉及中药材繁育技术领域,具体涉及一种祁源黄精高效离体快繁的方法。
背景技术:
2.多花黄精隶属百合科黄精属,是一种集药用、食用和观赏等价值于一身的多年生草本药用植物,在我国已有2000多年的用药历史。多花黄精根茎作为我国传统大宗药材,含有丰富的黄精多糖、甾体皂苷及人体中必需的氨基酸和微量元素等多种化学成分,具有补气养阴、健脾、润肺、益肾、抑制肿瘤细胞等功效,在提高人体免疫力、调节血糖血脂和美颜方面均具有良好功效。随着多花黄精的药用价值和保健价值越来越被人们所认识,黄精原料的需求量也越来越大。缺乏优良品种及有效的品种化繁殖技术是限制多花黄精产业发展的瓶颈问题。
3.祁源黄精作为选育的多花黄精新品种(审定编号:皖品鉴登字第1806007)具有叶片大,根茎产量高且有效成分含量高等优势,在研制新药和开发保健品方面也具有广阔的应用前景。
4.由于祁源黄精母本植株较少,生产上主要采用播种和根茎进行繁殖,前者存在繁殖过程繁琐,需要特定处理且繁殖周期长,繁殖受季节和材料限制等问题;后者存在繁殖材料有限,根茎需求量大的问题,很难满足祁源黄精的育种需求。植物组织培养技术因其具有取材少,繁殖效率高,繁殖周期短,繁殖不受季节和时间限制等优势,在中药材种苗繁育中有着重要的应用价值和应用前景。利用种子、叶片及块茎等外植体对多花黄精进行组培快繁的研究已有报道,例如公布号为cn107864861a的中国专利申请文献中公开了一种多花黄精的组培快繁方法,包括依次进行沙藏、35~40℃温水浸泡和赤霉素处理对多花黄精种子进行预处理,以打破种子休眠;将预处理的种子接种于种子丛生芽诱导培养基中,直接将种子诱导为丛生芽,所述的种子丛生芽诱导培养基的组成包括:ms培养基 6-ba 1.5~2.5mg/l ga
3 0.5~1.5mg/l 琼脂6.5~7g/l 蔗糖30~35g/l,ph值为5.5~6.0;将丛生芽分割并进行增殖培养以扩大丛生芽数量,生根培养、炼苗移栽,得到多花黄精种苗。本发明提供的方法能够有效的打破多花黄精种子休眠,将种子的萌芽期缩短至5个月,达到繁殖周期缩短,萌芽率提高到85~90%的效果;公布号为cn109169286a的中国专利申请文献公开了一种多花黄精组织培养方法,采用多花黄精的幼嫩块茎为材料,采用植物组织培养技术,通过多花黄精块茎诱导愈伤组织,愈伤组织增殖分化,低温处理打破多花黄精芽休眠,达到快速高效的多花黄精种苗生产要求,适合多花黄精种苗的规模化生产;但由于品种再生能力的差异性,已有的多花黄精组培快繁研究成果很难直接在祁源黄精上直接套用,且在应用过程中存在污染严重,繁殖效率低和繁殖系数低等问题,很难满足祁源黄精的工厂化繁殖需求。因此,针对上述祁源黄精繁育所存在的诸多问题,急需开发一种祁源黄精高效离体快繁的方法,以满足对祁源黄精的快速繁殖和品种改良的需求。
技术实现要素:
5.本发明所要解决的技术问题在于提供一种祁源黄精高效离体快繁的方法。
6.本发明通过以下技术手段实现解决上述技术问题:
7.一种祁源黄精高效离体快繁的方法,包括以下步骤:
8.s1、以多花黄精新品种祁源黄精的成熟种子为外植体,经表面消毒处理后,接种于含有不定芽诱导培养基的培养装置中进行不定芽的启动培养;
9.s2、不定芽启动培养2周后,将培养物转至恒温培养室中进行不定芽的诱导培养;
10.s3、不定芽诱导培养4周后,将诱导出不定芽点的成熟胚转接于增殖培养基中进行不定芽的增殖培养;
11.s4、增殖培养4周后,将增殖后的不定芽丛转接于伸长培养基中进行不定芽的伸长培养;
12.s5、待不定芽伸长至2-3cm并伴有2-3个叶片时将其从不定芽丛上分离;将分离后剩下的芽丛组织切成切块,继续接种于增殖培养基中进行芽体扩增培养;将分离的伸长芽接种于不定根诱导培养基中进行不定根的诱导培养,培养4周后获得完整的祁源黄精再生植株。
13.有益效果:本发明所提供的一种祁源黄精高效离体快繁的方法,具体涉及以公司选育的多花黄精新品种——祁源黄精的成熟种子为外植体,通过直接诱导不定芽再生来实现对祁源黄精种苗的快速繁殖。具有所需材料少,再生效率高,不定芽诱导率最高达85.3%,平均每个外植体可产生6.8个不定芽,增殖培养后,平均每个外植体可产生18.4个不定芽;不定根诱导率最高达到94.8%;且能实现对获得不定芽丛组织进行进一步的扩大繁殖,为祁源黄精的工厂化快速繁殖和遗传改良提供了重要的技术支撑。
14.优选地,在s1中,所述表面消毒处理是指将祁源黄精成熟种子分装于塑料培养瓶中,于流水下冲洗35-45min后置于无菌操作台中,用无菌水冲洗3-4遍;然后用75%无水乙醇进行1-2次表面消毒,每次消毒时间是55-65s,再用无菌水冲洗5-6遍;然后用20%(v/v)次氯酸钠溶液消毒15-20min,再用无菌水冲洗5-6遍;然后用过滤灭菌后的低温等离子体活化水浸种5-10min,然后用无菌滤纸吸干种子表面水分。
15.优选地,所述低温等离子体活化水是以空气为离子源,通过介质阻挡放电装置处理双蒸水1min得到的。
16.优选地,在s1中,所述不定芽诱导培养基为:dkw 5.0-8.0mg/l6-ba 0.25-1.0mg/l tdz 10-50μm褪黑素 1.5%-2.5%(w/v)蔗糖 0.7%(w/v)琼脂,ph=5.8。
17.优选地,在s1中,所述培养装置为玻璃培养皿、玻璃培养瓶、塑料培养瓶中的一种。
18.优选地,在s1中,所述培养装置为玻璃培养皿或玻璃培养瓶。
19.优选地,在s1中,所述培养装置为玻璃培养皿。
20.优选地,在s1中,所述不定芽的启动培养在温度为4℃的黑暗条件的恒温培养箱中进行。
21.优选地,在s3中,所述增殖培养基为:dkw 0.5-2.0mg/l6-ba 0.05-0.3mg/l tdz 0.05-0.2mg/l iaa 3.0%(w/v)蔗糖 0.7%(w/v)琼脂,ph=5.8。
22.优选地,在s4中,所述伸长培养基为:dkw 0.2-1.0mg/lga3 0.1-0.5mg/l zt 3.0%(w/v)蔗糖 0.7%(w/v)琼脂,ph=5.8。
23.优选地,在s5中,所述不定根诱导培养基为1/4dkw 0.2~2.0mg/liba 10~50μm褪黑素 2.0%(w/v)蔗糖 0.7%(w/v)琼脂,ph=5.8。
24.优选地,s2中不定芽的诱导培养、s3中不定芽的增殖培养、s4中不定芽的伸长培养、s5中不定根的诱导培养均在温度为20-25℃,光照强度为2000-3000lx,光周期为16/8h(光照/黑暗)的恒温培养室中进行。
25.本发明的优点在于:本发明所提供的一种祁源黄精高效离体快繁的方法,具体涉及以公司选育的多花黄精新品种——祁源黄精的成熟种子为外植体,通过直接诱导不定芽再生来实现对祁源黄精种苗的快速繁殖。具有所需材料少,再生效率高,不定芽诱导率最高达85.3%,平均每个外植体可产生6.8个不定芽,增殖培养后,平均每个外植体可产生18.4个不定芽;不定根诱导率最高达到94.8%;且能实现对获得不定芽丛组织进行进一步的扩大繁殖,为祁源黄精的工厂化快速繁殖和遗传改良提供了重要的技术支撑。
附图说明
26.图1为本发明实施例2中接种于不定芽诱导培养基上的祁源黄精成熟种子;
27.图2为本发明实施例2中启动培养2周的祁源黄精种子;
28.图3为本发明实施例2中诱导培养4周的祁源黄精成熟种胚不定芽;
29.图4为本发明实施例2中增殖培养4周的祁源黄精成熟种胚不定芽;
30.图5为本发明实施例2中伸长培养4周的祁源黄精成熟种胚不定芽;
31.图6为本发明实施例2中生根培养4周的祁源黄精成熟种胚不定芽。
具体实施方式
32.为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
33.下述实施例中所用的试验材料和试剂等,如无特殊说明,均可从商业途径获得。
34.实施例中未注明具体技术或条件者,均可以按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。
35.实施例1
36.一种祁源黄精高效离体快繁的方法,具体操作如下:
37.(1)外植体表面消毒:将祁源黄精成熟种子分装于300ml塑料培养瓶中经流水冲洗40min后置于无菌操作台中,用无菌水冲洗4遍,用75%无水乙醇进行1次表面消毒,消毒60s,然后用无菌水冲洗6遍;之后用20%(v/v)次氯酸钠溶液消毒15min,再用无菌水冲洗6遍,然后用过滤灭菌后的低温等离子体活化水(空气为离子源,通过介质阻挡放电装置处理双蒸水1min)浸泡5min,然后用无菌滤纸吸干种子表面水分,备用。
38.(2)不定芽启动培养:将步骤(1)消毒后的祁源黄精成熟种子接种于装有不定芽诱导培养基的玻璃培养皿中于温度为4℃,黑暗的恒温培养箱中进行不定芽的启动培养。其中所述的不定芽诱导培养基为dkw 5.0mg/l 6-ba 0.25mg/l tdz 50μm褪黑素 1.5%(w/v)蔗糖 0.7%(w/v)琼脂,ph=5.8。培养2周后,种子污染率为13.6%,萌动率为68.7%。
39.(3)不定芽诱导培养:将步骤(2)中启动培养2周后的培养物转至温度为22℃,光照强度为2500lx,光周期为16/8h(光照/黑暗)的恒温培养室中进行不定芽的诱导培养。光照培养4周后,种胚伴有不定芽形成,不定芽诱导率为59.2%,平均每个外植体产生3.1个不定芽。
40.(4)不定芽增殖培养:将步骤(3)诱导的带有不定芽点的成熟胚转接于装有不定芽增殖培养基的培养瓶中于温度为22℃,光照强度为2500lx,光周期为16/8h(光照/黑暗)的恒温培养室中进行不定芽的增殖培养。其中所述的不定芽增殖培养基为:dkw 0.5mg/l 6-ba 0.05mg/l tdz 0.1mg/l iaa 3.0%(w/v)蔗糖 0.7%(w/v)琼脂,ph=5.8。光照培养4周后,平均每个外植体产生6.5个不定芽,不定芽的增殖系数为2.1。
41.(5)不定芽伸长培养:将上述步骤(4)中增殖后的不定芽丛转接于装有伸长培养基的培养瓶中于温度为22℃,光照强度为2500lx,光周期为16/8h(光照/黑暗)的恒温培养室中进行不定芽的伸长培养。其中所述的伸长培养基为:dkw 0.2mg/l ga3 0.1mg/l zt 3.0%(w/v)蔗糖 0.7%(w/v)琼脂,ph=5.8。光照培养4周后,不定芽平均高度为1.9cm。
42.(6)芽体扩增与不定根诱导培养:待不定芽伸长后,将2~3cm长并伴有2~3个叶片的伸长芽从芽丛分离;将步骤(5)中伸长芽分离后剩下的芽丛组织切成0.25cm2大小的切块,接种于步骤(4)的增殖培养基中进行芽体扩增培养;同时将步骤(5)中获得的2~3cm长并伴有2~3个叶片的伸长芽从芽丛分离后,转接于装有不定根诱导培养基的培养瓶中于温度为22℃,光照强度为2500lx,光周期为16/8h(光照/黑暗)的恒温培养室中进行不定根的诱导培养,其中所述的不定根诱导培养基为1/4dkw 0.2mg/l iba 10μm褪黑素 2.0%(w/v)蔗糖 0.7%(w/v)琼脂,ph=5.8。光照培养2周后,外植体基部有不定根形成,光照培养4周后,不定根诱导率高达78.6%,平均每个外植体产生2.5个不定根,平均根长4.3cm。
43.实施例2
44.一种祁源黄精高效离体快繁的方法,具体操作如下:
45.(1)外植体表面消毒:将祁源黄精成熟种子分装于300ml塑料培养瓶中,经流水冲洗40min后置于无菌操作台中,用无菌水冲洗4遍,用75%无水乙醇进行2次表面消毒,每次消毒60s,然后用无菌水冲洗6遍;之后用20%(v/v)次氯酸钠溶液消毒20min,再用无菌水冲洗6遍;然后用过滤灭菌后的低温等离子体活化水(空气为离子源,通过介质阻挡放电装置处理双蒸水1min)浸泡7.5min,然后用无菌滤纸吸干种子表面水分,备用。
46.(2)不定芽启动培养:将步骤(1)消毒后的祁源黄精成熟种子接种于装有不定芽诱导培养基的玻璃培养皿中(图1)于温度为4℃,黑暗的恒温培养箱中进行不定芽的启动培养。其中所述的不定芽诱导培养基为dkw 6.0mg/l 6-ba 0.5mg/l tdz 25μm褪黑素 2.0%(w/v)蔗糖 0.7%(w/v)琼脂,ph=5.8。启动培养2周后,外植体萌动(图2),外植体污染率为0%,且萌动率为93.5%。
47.(3)不定芽诱导培养:将步骤(2)中启动培养2周后的培养物转至温度为22℃,光照强度为2500lx,光周期为16/8h(光照/黑暗)的恒温培养室中进行不定芽的诱导培养。光照培养4周后,如图3所示,诱导出不定芽;不定芽的诱导率高达85.3%,平均每个外植体产生6.8个不定芽。
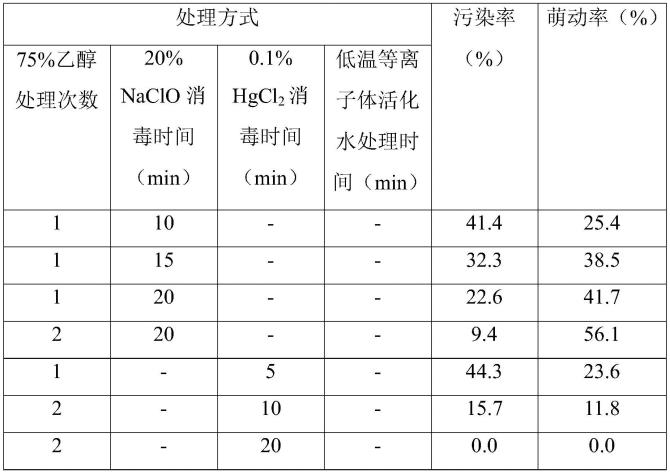
48.(4)不定芽增殖培养:将步骤(3)诱导的带有不定芽点的成熟胚转接于装有不定芽增殖培养基的培养瓶中于温度为22℃,光照强度为2500lx,光周期为16/8h(光照/黑暗)的
恒温培养室中进行不定芽的增殖培养。其中所述的不定芽增殖培养基为:dkw 1.0mg/l 6-ba 0.1mg/l tdz 0.05mg/l iaa 3.0%(w/v)蔗糖 0.7%(w/v)琼脂,ph=5.8。光照培养4周后,不定芽增殖(图4);平均每个外植体产生18.4个不定芽,增殖系数为2.7。
49.(5)不定芽伸长培养:将步骤(4)中增殖后的不定芽丛转接于装有伸长培养基的培养瓶中于温度为22℃,光照强度为2500lx,光周期为16/8h(光照/黑暗)的恒温培养室中进行不定芽的伸长培养。其中所述的不定芽伸长培养基为:dkw 0.5mg/l ga3 0.25mg/l zt 3.0%(w/v)蔗糖 0.7%(w/v)琼脂,ph=5.8。光照培养4周后,不定芽伸长(图5);平均不定芽长度为2.5cm。
50.(6)芽体扩增与不定根诱导培养:将步骤(5)中获得的2~3cm长并伴有2~3个叶片的伸长芽从芽丛分离,将伸长芽分离后剩下的芽丛组织切成1.0cm2大小的切块,接种于步骤(4)的增殖培养基中进行芽体扩增培养;同时将步骤(5)中获得的2~3cm长并伴有2~3个叶片的伸长芽从芽丛分离后,转接于装有不定根诱导培养基的培养瓶中于温度为22℃,光照强度为2500lx,光周期为16/8h(光照/黑暗)的恒温培养室中进行不定根的诱导培养,其中所述的不定根诱导培养基为1/4dkw 1.0mg/l iba 25μm褪黑素 2.0%(w/v)蔗糖 0.7%(w/v)琼脂,ph=5.8。光照培养1周,茎段基部有根源基形成,光照培养4周后,茎段基部伴有健壮根系形成(图6);其中,94.8%的茎段基部伴有健壮根系形成,平均每个外植体产生4.6条不定根,不定根的平均长度为3.4cm。
51.实施例3
52.为了寻求祁源黄精种子消毒的最佳方案,本实施例测试了不同表面消毒方法(75%乙醇消毒次数、体积分数为20%次氯酸钠溶液消毒时间、0.1%(w/v)氯化汞溶液消毒时间及低温等离子体活化水处理时间)对祁源黄精成熟种子污染率及萌动率的影响。发明人仅改变表面消毒方法,消毒后的祁源黄精种子启动培养及不定芽诱导过程与培养条件均与实施例2相同。具体处理如下表1所示。启动培养2周后统计污染率和萌动率。研究结果表明在所测试的消毒处理中,不同表面消毒方式对祁源黄精成熟种子污染及萌动均具有重要的影响。在同等浓度消毒剂的条件下,75%乙醇消毒2次的效果要好于消毒1次的效果;同时随着20%(v/v)次氯酸钠溶液消毒时间的延长种子污染率逐渐降低,萌动率逐渐升高;而对于0.1%(w/v)hgcl2溶液而言,随着消毒时间的延长,种子污染率逐渐降低,萌动率逐渐降低,种子经0.1%(w/v)hgcl2溶液消毒20min,祁源黄精种子的污染率和萌动率均为0%。推测原因可能是长时间浸泡在0.1%(w/v)hgcl2溶液中虽然可以杀菌,但对植物组织具有一定的毒害作用,因此在后续的研究中,并未采用0.1%(w/v)hgcl2溶液作为消毒剂。进一步研究发现,低温等离子体活化水处理能够在降低祁源黄精种子污染率的同时提高种子的萌动率。将其与体积分数为20%naclo溶液结合使用在降低种子污染率的同时,能够显著提高种子的萌动率,其中祁源黄精种子经75%乙醇消毒2次(每次60s)后用体积分数为20%naclo溶液消毒20min,再用低温等离子体活化水处理7.5min时种子污染率最低(0.0%),种子萌动率最高为93.5%。
53.表1不同消毒处理方式对祁源黄精种子污染率和萌动率的影响
[0054][0055][0056]
实施例4
[0057]
由于培养容器内的微环境对植物离体再生具有重要意义,且培养容器的类型会影响容器内的透光率、湿度和气体成分。为了测试启动培养阶段和培养容器类型对祁源黄精种子萌动和不定芽诱导的影响,将实施例2中消毒后的祁源黄精种子接种在装有40ml不定芽诱导培养基的不同类型容器中(玻璃培养皿,塑料培养瓶及玻璃培养瓶)放置在实施例2中相同的温室条件进行不定芽的诱导培养。培养2周和6周后分别统计种子萌动率、不定芽诱导率及平均不定芽个数。研究发现:启动培养对祁源黄精种子萌发和不定芽的诱导具有一定的促进作用,推测原因启动培养过程中的低温和黑暗处理更利于打破祁源黄精种子的休眠,从而促进种子的萌动,而萌动后的种子更易于形成不定芽。培养容器类型对祁源黄精种子的萌动没有显著影响,但培养容器类型却能够直接影响祁源黄精种子不定芽的诱导。在启动培养的前提下,接种在不同类型培养容器中的祁源黄精种子继续培养4周后(共计培养6周),不定芽的诱导率及不定芽的个数以接种在玻璃培养皿中最佳,玻璃培养瓶中其次。培养6周后,玻璃培养皿中不定芽的诱导率高达85.3%,平均每个外植体产生6.8个不定芽。玻璃培养容器的萌发反应好于塑料瓶的可能是塑料培养容器透气性差,不利于光合作用自养过程中再生枝消耗的co2的补充。同时,塑料培养容器也限制了有害气体乙烯的释放。因此,在启动培养和不定芽诱导阶段,主要以玻璃培养皿作为培养容器。
[0058]
表2启动时间和培养容器类型对祁源黄精种子萌动及不定芽诱导的影响
[0059][0060]
实施例5
[0061]
为了测试诱导培养中激素种类和浓度对不定芽诱导的影响,发明人将实施例2中消毒后的祁源黄精种子接种在添加有不同种类和浓度植物生长调节剂的不定芽诱导培养基中放置在实施例2中相同的温室条件进行不定芽的诱导培养。培养2周和6周后分别统计种子萌动率、不定芽诱导率及平均不定芽个数。研究发现:培养基中低浓度褪黑素和细胞分裂素(6-ba和tdz)的添加能够促进种子的萌动,并相应的提高不定芽的诱导率,高浓度的褪黑素和细胞分裂素的使用会导致其促进作用相应的降低。此外,培养基低浓度蔗糖的使用有利于种子的萌动。因此,添加有2.0%(w/v)蔗糖,6.0mg/l 6-ba,0.5mg/l tdz和25μm褪黑素的培养基更利于祁源黄精种子的萌动和不定芽的诱导,种子萌动率高达93.5%,不定芽诱导率高达85.3%,平均每个外植体产生6.8个不定芽。
[0062]
表3培养基中植物生长调节剂及蔗糖浓度对祁源黄精不定芽诱导的影响
[0063]
[0064]
结合不定芽的诱导结果,发明人进一步测试了培养中植物生长调节剂的种类和浓度对不定芽增殖的影响。发明人将实施例2中的黄精不定芽丛转接于添加有不同浓度6-ba、tdz和iaa的培养基中进行不定芽的增殖培养,培养条件与实施例2相同。研究结果表明:培养基中低浓度6-ba与低浓度tdz的联合使用能够提高不定芽的增殖系数,在此基础上,低浓度iaa的联合使用能够进一步提高不定芽的增殖系数。在所测试的培养基中,培养基中添加1.0mg/l 6-ba,0.1mg/l tdz和0.05mg/l iaa不定芽的增殖效果最好,平均每个外植体产生18.4个不定芽,增殖系数高达2.7。
[0065]
表4植物生长调节剂种类和浓度对祁源黄精不定芽增殖的影响
[0066][0067]
实施例6
[0068]
为了测试培养中ga3和zt对不定芽伸长的影响,发明人将实施例2中增殖后不定芽丛转接于添加有ga3和zt的伸长培养基进行不定芽的伸长培养。培养条件与实施例2相同,培养4周后统计不定芽的高度。研究结果(表5)表明培养基中ga3和zt的添加能够促进不定芽的伸长,且随着浓度的增加促进效用逐渐降低。同时进一步研究发现zt和ga3在不定芽伸长中存在协同效应。当实施例2中增殖后的不定芽转接于添加有0.5mg/lga3和0.25mg/l zt的培养基中时不定芽的伸长效果最佳,平均不定芽长2.5cm。
[0069]
表5 ga3和zt对祁源黄精不定芽长的影响
[0070]
ga3(mg/l)zt(mg/l)平均不定芽长(cm)
‑‑
0.80.2-1.20.5-2.01.0-1.7-0.11.5-0.252.3-0.51.80.20.11.90.50.252.51.00.52.2
[0071]
在获得伸长不定芽的基础上,发明人进一步测试了培养中iba和褪黑素浓度对不定根形成的影响。研究结果如表6所示。研究发现培养基中iba和褪黑素的使用能够大大提高不定根的诱导效果,且随着培养基中褪黑素浓度的增加,不定根的诱导率呈现先增加后降低的现象,iba对黄精而言是随浓度增加不定根诱导率逐渐增加,根长逐渐降低;培养基中添加1.0mg/l iba和25μm褪黑素时不定根的诱导情况最佳,不定根诱导率高达94.8%。
[0072]
表6培养基中iba和褪黑素浓度对祁源黄精不定根形成的影响
[0073][0074][0075]
实施例7
[0076]
与实施例2的不同在于:
[0077]
(1)外植体表面消毒:将祁源黄精成熟种子分装于300ml塑料培养瓶中,经流水冲洗35min后置于无菌操作台中,用无菌水冲洗3遍,用75%无水乙醇进行2次表面消毒,每次消毒55s,然后用无菌水冲洗6遍;之后用20%(v/v)次氯酸钠溶液消毒20min,再用无菌水冲洗6遍;然后用过滤灭菌后的低温等离子体活化水(空气为离子源,通过介质阻挡放电装置处理双蒸水1min)浸泡7.5min,然后用无菌滤纸吸干种子表面水分,备用;
[0078]
不定芽的诱导培养、不定芽的增殖培养、不定芽的伸长培养、不定根的诱导培养均
在温度为20℃,光照强度为3000lx,光周期为16/8h(光照/黑暗)的恒温培养室中进行,其余步骤均与实施例2相同。
[0079]
实施例8
[0080]
与实施例2的不同在于:
[0081]
(1)外植体表面消毒:将祁源黄精成熟种子分装于300ml塑料培养瓶中,经流水冲洗45min后置于无菌操作台中,用无菌水冲洗4遍,用75%无水乙醇进行2次表面消毒,每次消毒65s,然后用无菌水冲洗5遍;之后用20%(v/v)次氯酸钠溶液消毒20min,再用无菌水冲洗5遍;然后用过滤灭菌后的低温等离子体活化水(空气为离子源,通过介质阻挡放电装置处理双蒸水1min)浸泡10min,然后用无菌滤纸吸干种子表面水分,备用;
[0082]
不定芽的诱导培养、不定芽的增殖培养、不定芽的伸长培养、不定根的诱导培养均在温度为25℃,光照强度为2000lx,光周期为16/8h(光照/黑暗)的恒温培养室中进行,其余步骤均与实施例2相同。
[0083]
以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。