1.本发明属于化妆品原料开发技术领域,具体涉及一种樟芝提取物的制备方法及其作为抗氧化化妆品原料的应用。
背景技术:
2.皮肤对化学、物理和生物的侵袭具有持续的接触和防御屏障作用。维持皮肤细胞完整性以及所有免疫机制的细胞活动,都涉及一系列产生自由基和活性氧(ros)的化学反应。内源性和外源性抗氧化机制通过中和这些生物活性分子发挥作用。这种中和作用的失衡可能产生多种后果:自由基和ros与各种皮肤病病因有关,也与皮肤衰老过程和皮肤肿瘤的发生有关。在过去几十年中,抗氧化已经越来越受到人们的重视。
3.当今世界上化妆品的发展趋势是追求
″
天然、绿色、安全、有效。随着人们对大自然的崇尚以及回归自然的需求,研发出越来越多的植物化妆品。因此,化妆品的发展也正在从矿物油时代转变成天然成分时代,尤其是作用温和、刺激性小、安全有效的植物提取物化妆品越来越受到人们的喜爱。具有抗氧化活性的植物提取物不仅给予化妆品本身少使用有机合成抗氧化剂的安全性,更给予皮肤多种益处:辅助抗老化、修护光损伤、减轻黄褐斑、抑制黑色素瘤和皮肤癌以及抗脱发等。
4.樟芝(taiwanofungus camphoratus),别名牛樟菇和牛樟芝,是我国台湾特有的珍稀食用和药用真菌,可产三萜、多糖、甾醇、苯环类化合物等多种活性成分;樟芝培养物具有保肝、抗癌、调节免疫力、抗氧化和抗炎症等药理活性。近年来,许多学者研究发现,樟芝菌丝体产物具有与子实体相近的药理活性功能。野生樟芝生长极为缓慢,数量稀缺价格昂贵,现多以人工培养的方式来取代,并藉由不同培养方式达到提高菌丝体产量的目的。樟芝皿式培养,是一种可控性强、单位间交叉感染率低,单位面积产量高,菌体品质稳定,易于量化生产的人工栽培樟芝菌丝体的方式,成本低、活性物质丰富且含量高,从皿培菌丝体中提取不同性味抗氧化活性成分,并选择不同配比协同增效作为化妆品原料具有很好的应用前景。
技术实现要素:
5.本部分的目的在于概述本发明的实施例的一些方面以及简要介绍一些较佳实施例。在本部分以及本技术的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
6.作为本发明其中一个方面,一种樟芝提取物的制备方法,其由以下步骤组成,
7.将樟芝皿培菌丝体粉碎,加入乙醇水溶液超声提取后过滤,将得到的滤液减压浓缩去除乙醇,冷冻干燥至恒重,得到樟芝皿培醇提物,过滤得到的滤渣挥干乙醇,之后加水煮沸提取后过滤,将滤液减压浓缩,冻干,得到樟芝皿培水提物;将所述樟芝皿培醇提物与所述樟芝皿培水提物按照质量比4:1混合,得到樟芝提取物。
8.作为本发明所述的樟芝提取物的制备方法的一种优选方案:所述加入乙醇水溶液,为加入体积分数为95%的乙醇水溶液。
9.作为本发明所述的樟芝提取物的制备方法的一种优选方案:所述加入乙醇水溶液超声提取后过滤,其中,樟芝皿培菌丝体与所述乙醇水溶液的料液体积比为1∶8~10,提取次数为1~3次。
10.作为本发明所述的樟芝提取物的制备方法的一种优选方案:所述超声提取,超声条件为40khz,25℃,提取时间为1~1.5h。
11.作为本发明所述的樟芝提取物的制备方法的一种优选方案:所述加入乙醇水溶液超声提取后过滤,其中,所述过滤,为采用纱布、筛网、滤布或硅藻土进行过滤。
12.作为本发明所述的樟芝提取物的制备方法的一种优选方案:所述加水煮沸提取后过滤,为加入滤渣20倍质量的水煮沸提取2~2.5h,提取次数为1~5次。
13.作为本发明所述的樟芝提取物的制备方法的一种优选方案:所述冷冻干燥至恒重,其温度为:冷肼温度-45℃以下,真空度为:10pa,冷冻干燥时间大于12小时。
14.本发明的有益效果:本发明提供一种樟芝提取物的制备方法及其作为抗氧化化妆品原料的应用,以樟芝皿培菌丝体为原料,将富含活性小分子物质的醇提物和富含活性多糖和蛋白的水提物进行合理配伍,发现水提物和醇提物1:4具有协同增效作用,其抗氧化活性最佳,对于作为抗氧化活性化妆品原料有很好的应用前景。
附图说明
15.为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
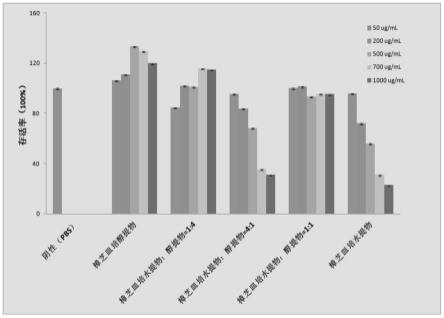
16.图1为本发明樟芝提取物对raw264.7细胞增值率/毒性的影响。
17.图2为樟芝皿培提取物对dpph.清除作用。
18.图3为樟芝皿培提取物清除abts
.的作用。
具体实施方式
19.为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合具体实施例对本发明的具体实施方式做详细的说明。
20.在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
21.其次,此处所称的
″
一个实施例
″
或
″
实施例
″
是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的
″
在一个实施例中
″
并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
22.实施例1:
23.实验材料:
24.样品提取及制备:称取干燥至恒重的樟芝j1(t.camphoratus j1)皿培菌丝体
100g,粉碎后加8倍质量的95%乙醇超声40khz提取1h,滤布(300目)过滤,滤液减压浓缩去除酒精后,冷冻干燥,冷肼温度-45℃以下,真空度为:10pa,冷冻干燥时间超过12小时至恒重,得到樟芝皿培醇提物;残渣挥干乙醇后,加20倍质量的水煮沸提取2h,滤布(300目)过滤后,滤液减压浓缩,冻干,得到樟芝皿培水提物。
25.精确称取樟芝皿培醇提物和樟芝皿培水提物按照不同质量比混合,将各提取物样品于eppendorf离心管中,无菌条件下加入pbs溶液配成浓度为5mg/ml的溶液,12000
×
g离心30min,上清为母液备用,实验前加入pbs溶液分别稀释成相应浓度进行实验。
26.实验方法:
27.细胞毒性实验:
28.选择生长良好的对数生长期小鼠raw264.7细胞,消化后,用含10%fbs的无色1640培养基制为5
×
104个/ml细胞悬液,接种在96孔板中,每孔加200μl细胞悬液。在37℃、5%co2恒温培养箱培氧24h,在完全贴壁后吸除培养基,加含上述配置好的不同提取物、阴性对照为pbs,阳性对照为lps(10μg/ml),每个样品4个复孔。在37℃、5%co2恒温培养箱培养48h后,吸掉培养基,称取25mg/ml的alamarblue
tm
,然后配置成0.0075mg/ml浓度的alamarblue
tm
试剂,将配置好的试剂吸取200μl于96孔板中,培养2-6h,阴性对照组试剂颜色显著改变后再用酶标仪测570nm、600nm处吸光度,由下述公式算出上述样品对细胞增殖的抑制率。
29.存活率=[(117216
×d570
(样品)-80586
×d600
(样品))/(117216
×d570
(空白)-80586
×d600
(空白))]
[0030]
清除dpph
·
自由基能力:
[0031]
(1)称取4mg dpph试剂,用无水乙醇定容至100ml配成0.1mmol/l的dpph
·
溶液,贮存于棕色瓶中备用;
[0032]
(2)取80%乙醇的样品溶液0.2ml,分别加入2.8ml dpph
·
反应液作为样品组;空白组取0.2ml 80%乙醇溶液,并加入2.8ml dpph
·
反应液,混匀后,置于暗处室温反应30min,测定其在517nm处的吸光度值;
[0033]
(3)阳性组:10mg/ml维生素c溶液。
[0034]
清除率计算如下所示:
[0035]
dpph清除率(%)=(a
2-a1/a2)
×
100
[0036]
式中,a1是样品液在517nm处的吸光度值,a2是对照品在517nm处的吸光度值。
[0037]
其中阳性的浓度均为10mg/ml。
[0038]
等价抗氧化能力(trolox equivalent antioxidantcapacity,teac)法测定abts自由基清除能力:
[0039]
参照brand-williams et al(1995)方法,将5ml的7mmol/l abts和88μl的140mmol/l k2s2o8混合,在30oc恒温避光的条件下静置过夜,形成abts
.储备液。使用前用20mmol/l pbs(ph 4.5)稀释成工作液,其在30℃和734nm处的吸光度为0.70。取0.1ml的标准品或样品于试管中,加入3.9ml abts稀释工作液,混合10s并室温下混匀20min,734nm波长下测定吸光度,以trolox为标准品计算抗氧化活性。以0.2mg/ml维生素c为阳性对照。
[0040]
实验结果:
[0041]
细胞毒性试验:实验结果如图1所示,图1为阴性对照组(pbs)、樟芝皿培醇提物组、
樟芝皿培水提物∶樟芝皿培醇提物的质量比=1∶4组、樟芝皿培水提物∶樟芝皿培醇提物的质量比=4∶1组、樟芝皿培水提物∶樟芝皿培醇提物的质量比=1∶1组、樟芝皿培水提物组在各实验浓度下对raw264.7细胞增值率的影响,上述各樟芝提取物实验组的总浓度分别为50μg/ml、200μg/ml、500μg/ml、700μg/ml、1000μg/ml。从图1看出,细胞经樟芝皿培醇提物和樟芝皿培醇提物∶樟芝皿培水提物质量比=4∶1的样品处理后,在浓度50-1000μg/ml范围,存活率与阴性对照组相似,表明在所选取的浓度范围中对raw264.7细胞生长未出现抑制作用,未表现出细胞毒性。而其他样品在高浓度情况下会对细胞产生毒性,因此后续可以选用樟芝皿培醇提物和樟芝皿培醇提物∶樟芝皿培水提物=4∶1这两种样品做活性实验。
[0042]
抗氧化能力:
[0043]
dpph清除作用:
[0044]
dpph
·
现已被广泛应用于天然提取物自由基清除能力的检测brand-williams et al(1995),实验结果如图2所示,图2为樟芝皿培醇提物组、樟芝皿培水提物组、樟芝皿培水提物∶樟芝皿培醇提物的质量比=1∶4组,在总浓度分别为0.2mg/ml、0.4mg/ml、0.6mg/ml、0.8mg/ml、1.0mg/ml下,对dpph.清除作用。由图2可知,阳性对照v
c 10mg/ml对dpph.清除率达到87.15%。樟芝皿培醇提物∶樟芝皿培水提物质量比=4∶1组对dpph
·
的清除能力明显好于樟芝皿培醇提物组,且呈剂量依赖性。当樟芝皿培水提物∶樟芝皿培醇提物的质量比=1∶4组在总浓度为1.0mg/ml时,dpph
·
清除能力达到34.66%,ic
5o
值为3.81mg/ml,而水提物对dpph
·
自由基的清除能力较差,ic
50
值为12.14mg/ml,而对dpph
·
自由基的清除能力最差,ic
50
值仅为31.30mg/ml,由此可以看出,将樟芝皿培醇提物和水提物按4:1的质量比复配,对dpph
·
自由基的清除能力会大大提升,显示樟芝皿培醇提物和水提物按4∶1的质量比混合对于dpph清除有协同作用。等价抗氧化能力(trolox equivalent antioxidantcapacity,teac)法测定abts自由基清除能力:图3为樟芝皿培醇提物组、樟芝皿培水提物组、樟芝皿培水提物∶樟芝皿培醇提物的质量比=1∶4组,在总浓度分别为0.2mg/ml、0.4mg/ml、0.6mg/ml、0.8mg/ml、1.0mg/ml下,清除abts.的作用。图3结果表明,提取物表现出良好的抗氧化能力,且呈剂量依懒性,樟芝皿培水提物∶樟芝皿培醇提物的质量比=1∶4组在总浓度为1.0mg/ml时,对abts
·
自由基的清除能力为93.77μmol trolox/l,而醇提物为52.74μmol trolox/l,水提物为52.74μmol trolox/l,表明樟芝皿培醇提物和樟芝皿培水提物按4∶1的质量比复配对于abts自由基清除有协同作用。而阳性对照vc在0.2mg/ml时,自由基的清除能力为141.80μmol trolox/l。
[0045]
实验结果显示,将樟芝皿培醇提物和樟芝皿培水提物进行复配,即樟芝皿培醇提物∶樟芝皿培水提物按照质量比4∶1混合在浓度范围50ug/ml-1000ug/ml无细胞毒性,且对于dpph清除作用及清除abts
.能力有显著提升,因此将樟芝皿培醇提物和水提物进行有效复配后,抗氧化活性会显著提高,显示协同作用。因此该复配提取物可以作为抗氧化功能的化妆品原料进行进一步的开发。
[0046]
本研究以樟芝皿培菌丝体为主要原料,比较醇提物、水提物及不同配比的毒性及体外抗氧化活性,樟芝皿培菌丝体醇提物与水提物4∶1的配比无毒性且抗氧化活性较好,可以作为化妆品抗氧化原料添加,为研制开发高附加值的樟芝产品提供基础。
[0047]
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术
方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。