1.本发明涉及生化检测技术领域,具体涉及一种便携式快速细菌抗生素敏感性测试方法及其装置。
背景技术:
2.抗生素的过量使用会导致病原微生物产生耐药性,使得抗生素能杀死细菌的有效剂量不断增加,对其它生物也有可能产生一定的毒性,对生态环境及人类健康造成潜在威胁。体外抗菌药物敏感性试验(antibiotics susceptibility testing,ast),是指在体外测定药物抑菌或杀菌能力的试验。目前,临床微生物实验室进行体外抗生素敏感性测试的主要方法有扩散法和稀释法。在稀释法中,细菌被接种于一系列浓度的抗生素中,通过目视检查浊度来鉴定阻止细菌生长的最低抗生素浓度,即最低抑菌浓度(minimum inhibitoryconcentration,mic)。在扩散法中,具有抗生素梯度的条带或圆形纸片被应用于接种菌落的琼脂表面,抗生素对细菌的mic由可见抑菌圈决定。这些方法既存在需要过夜孵育及过多人力消耗的缺点,又无法进行数字化分析。
3.微流控液滴技术是指在封闭的微通道网络中生成和操控纳升至皮升级液滴,具有超高通量、低消耗、可精确操控、自动化等优点。目前已经报道了一些基于液滴技术的细菌抗生素敏感性测试方法 (avesar,et al.,2017;azizi,et al.,2018)。这类方法将细菌限制在纳升级空间中生长,有利于富集代谢产物,从而提高检测灵敏度、减少孵育时间;通过在液滴中添加指示剂标记阴性和阳性液滴,可实现数字化计数和数字化分析不同抗生素浓度对细菌的抑制效果。微流控芯片是使用最广泛的液滴生成平台,具有均匀的粒径分布、可调的液滴组成、高通量以及与下游分析集成等优点。然而,制造微流控芯片和操作微流体对于实验条件和技能的要求仍然很高。此外,微流控液滴技术在调整液滴尺寸和吞吐量方面存在响应缓慢 (几秒甚至几分钟)和低灵活性的问题。
技术实现要素:
4.本发明的目的在于克服现有技术的不足,提供了一种便携式快速细菌抗生素敏感性测试装置及其方法,该方法利用声波驱动的微液滴产生技术、细菌活性荧光标记、智能手机荧光显微拍照及数字图像处理、数据分析技术等进行细菌抗生素敏感性测试。
5.为实现上述目的,本发明所设计一种便携式快速细菌抗生素敏感性测试方法,包括以下步骤:
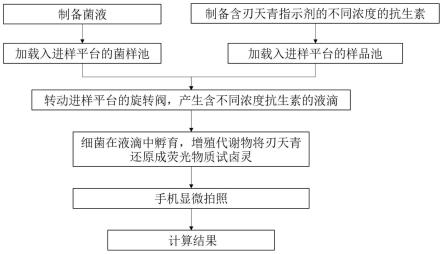
6.1)样品添加
7.a.将待检测菌样加入进样切换平台的菌样池中;
8.b.将含有不同浓度梯度抗生素的混合液分别加入进样切换平台的样品池中,其中,每个混合液中,均含相同量的刃天青的抗生素溶液;且抗生素的浓度分别为0和n个待测浓度;其中,抗生素的混合液是由大肠杆菌悬液和抗生素按体积比1:1混合而成;
9.c.将矿物油加入液滴收集池的每个凹槽中(包括n 2个样品槽和1个清洗废液槽);
10.2)微液滴的制作
11.控制第一旋转阀和第二旋转阀开启和关闭,在尖端毛细管振动条件下,从而在对应的样品槽的矿物油内产生多滴微液滴;当该样品槽中微液滴收集完毕,然后再次控制控制第一旋转阀和第二旋转阀开启和关闭,直至液滴收集池的n 2个样品槽分别收集完成不同组合的微液滴,其中,该组合分别为:
12.第一组为全阴性对照组:由抗生素浓度为0的混合液形成的微液滴,
13.第二组为正常生长对照组:由待检测菌样和抗生素浓度为0的混合液形成的微液滴,
14.第三组至第n 2组分别为:由待检测菌样和不同待测浓度的抗生素的混合液形成的微液滴;
15.3)孵育
16.将液滴收集池置于孵育器中孵育(使待检测菌样的细菌在微液滴中孵育,孵育时间与细菌种类有关,需要足够的孵育时间使细菌增殖,其代谢物与刃天青反应,产生可观察到的荧光强度,刃天青的荧光强度可以判断液滴内细菌的有无和存活状态);
17.4)拍照
18.将液滴收集池由插口插入智能手机荧光显微成像单元的黑色壳体中;将智能手机放在装置上方,手机摄像头正对通光孔,打开手机照相机,调节透镜外套筒(即为调焦套筒),拍摄微液滴的荧光图像,移动液滴收集池,拍摄不同抗生素浓度的微液滴荧光图像;
19.5)敏感性测定
20.对每张微液滴荧光图像进行二值化,利用分水岭算法识别微液滴,记录微液滴在图像中的坐标位置;再对荧光图像进行灰度化,读取微液滴中心的灰度值作为液滴的荧光强度值;然后将微液滴中心的荧光强度值v
滴
与荧光阈值v
th
进行比较:
21.若该微液滴中心的荧光强度值v
滴
≥v
th
时,该微液滴判别为阳性微液滴;
22.若该微液滴中心的荧光强度值v
滴
<v
th
时,该微液滴判别为阴性微液滴;
23.然后根据不同浓度组的阳性微液滴数占总液滴数比例,与正常生长对照组比较,得到抗生素浓度与细菌存活率曲线,从而推断细菌抗生素敏感性,其中,
[0024]vth
=v
mean
nσ
[0025]
公式中,v
th
为根据全阴性对照组液滴的荧光强度值设定的荧光阈值;
[0026]vmean
为全阴性对照组中液滴荧光强度的平均值;
[0027]
σ为该组中液滴荧光强度的标准差;
[0028]
n为系数,根据实际情况取1~6。
[0029]
进一步地,所述步骤1)第b小步中,混合液中,刃天青的含量为2~20μg/ml。
[0030]
再进一步地,所述步骤1)中,进样切换平台的洗液池中加入水。
[0031]
再进一步地,所述步骤2)中,微液滴的制作具体步骤如下:
[0032]
①
转动第一旋转阀关闭菌样通道,转动第二旋转阀使样品池中抗生素浓度为0的混合液(即仅含有刃天青的溶液)流入进样切换平台的s形混合通道;打开便携式数字信号发生器,使蜂鸣片产生声波信号,带动尖端毛细管振动,从而在对应的样品槽的矿物油内产生多个微液滴,形成全阴性对照组(第一组)(毛细管尖端没入矿物油中产生微液滴,调节电信号的幅值和频率,使液滴大小合适,在液滴收集池的样品槽中产生足够量的微液滴);
[0033]
②
将毛细管尖端没入液滴收集池的另一样品槽的矿物油中;通过转动第一旋转阀和第二旋转阀使待检测菌样和样品池中抗生素浓度为0的混合液同时流入进样切换平台的s形混合通道;打开数字信号发生器,产生足够量的微液滴,形成正常生长对照组(第二组);
[0034]
③
将毛细管尖端没入液滴收集池的另一样品槽的矿物油中;通过转动第一旋转阀和第二旋转阀使待检测菌样和某一样品池中含待测浓度抗生素的混合液同时流入进样切换平台的s形混合通道汇聚;打开数字信号发生器,产生足够量的微液滴;形成第三组;
[0035]
④
当该样品槽的微液滴收集完毕时,旋转第二旋转阀重复上述步骤
③
的工序,直至液滴收集池的其它样品槽装满(样品池的数量为n 1,样品槽的数量为n 2),即得到在每个样品槽收集的含有待检测菌样和不同浓度抗生素的微液滴;形成第四组~第n 2组。
[0036]
再进一步地,所述微液滴的制作过程中,每组微液滴制作完毕后需要清洗,清洗步骤如下:
[0037]
每个样品槽的微液滴收集完毕时,暂停数字信号发生器,转动第一旋转阀关闭菌样通道,转动第二旋转阀接通洗液池,打开数字信号发生器,用水清洗s形混合通道、进样软管和尖端毛细管;清洗后的废液流入洗液槽。
[0038]
本发明还提供了一种便携式快速细菌抗生素敏感性测试系统,所述系统包括声波驱动的微液滴产生单元、旋转切换进样单元和智能手机荧光显微成像单元;
[0039]
所述微液滴产生单元包括便携式数字信号发生器和液滴收集池,所述便携式数字信号发生器通过导线与蜂鸣片连接;所述液滴收集池上表面设置有1个洗液槽和若干个样品槽(每个槽内装载有连续相,连续相为加有表面活性剂的矿物油,用于产生和收集微液滴)。
[0040]
所述蜂鸣片上粘接有尖端毛细管,所述尖端毛细管竖直设置在液滴收集池上方;所述尖端毛细管的进样端连接有进样软管(与外接分散相的装载器连接);
[0041]
所述旋转切换进样单元包括进样切换平台,所述进样切换平台表面两端分别设置有菌样池和洗液池,所述菌样池和洗液池之间设置有第一旋转阀和第二旋转阀;所述第二旋转阀周围设置有多个样品池,所述进样切换平台侧面开设有混合通道出口,所述混合通道出口与进样切换平台内部的s形混合通道连接,所述s形混合通道有个入口,分别与第一旋转阀和第二旋转阀连接,所述第二旋转阀分别与样品池和洗液池连通;所述混合通道出口与进样软管连接。
[0042]
所述智能手机荧光显微成像单元包括黑色壳体,所述黑色壳体侧壁开设有插口,所述液滴收集池由插口水平插入黑色壳体内,所述液滴收集池下方设置有导光器,所述液滴收集池上方由下至上依次设置有发射光滤光片和显微放大镜,所述组合透镜显微放大镜上方黑色壳体顶部开设有通光孔。
[0043]
进一步地,所述样品池的个数为6~10个(根据实际需要选择)。
[0044]
再进一步地,所述第一旋转阀和第二旋转阀顶面均开设有第一插孔和第二插孔。
[0045]
再进一步地,所述显微放大镜包括放透镜外套筒和透镜内套筒且透镜外套筒和透镜内套筒螺纹连接,所述透镜外套筒底部设置第一透镜,所述透镜内套筒顶部设置有第二透镜(外套筒可旋转并上下调节位置,以实现调焦)。
[0046]
再进一步地,所述导光器包括水平设置有导光板,所述导光板一端设置led光源,所述led光源与导光板之间设置有激发光滤光片。
[0047]
本发明的原理:
[0048]
1.本发明的声波驱动的微液滴生成技术具有操作简单、成本低、可便携、液滴尺寸可大范围调节等优点,尤其是在生成液滴和调整液滴尺寸方面响应快,可以有效利用样品和增加检测的动态范围。当分散相是细菌悬浮液时,细菌就会被随机包裹在单分散的液滴中并在其中分裂繁殖。
[0049]
2.本发明选用的刃天青是一种氧化还原指示剂,其在氧化状态下呈现紫蓝色无荧光性,而在还原状态下,转变为呈粉红或红色荧光的还原产物试卤灵(激发波段为530-570nm,激发峰570nm;发射波段为580-610nm,发射峰585nm),在微液滴中加入刃天青试剂,细菌增殖代谢物可使微液滴从无荧光的紫蓝色变成有荧光的粉红色。
[0050]
3.智能手机上配备的高分辨率相机可作为检测器,特别适合光学信号的检测;结合编写的手机应用程序,可以图像采集、数据处理分析、结果展示于一体,构成了一个经济有效、便携和快速的分析设备,即使在资源有限的情况下,也可进行即时分析。
[0051]
本发明的有益效果:
[0052]
本发明采用了基于微液滴的细菌孵育方式,不需要细菌的过夜培养孵育,减少了时间和人力的消耗;采用声波驱动生成液滴,设备简单,成本低,液滴大小可控,检测动态范围广;旋转切换进样方便快捷,可操作性强;利用智能手机进行荧光显微成像和后续处理,便携性强,并可快速得到检测结果。
[0053]
综上所述,本发明结构简单,所需材料易获取,可操作性强。与现有抗生素敏感性检测技术相比,不需要细菌的过夜孵育,提高了效率;声波驱动的微液滴产生技术,便携快速、液滴大小可控、检测动态范围广;基于智能手机获取和处理数据,可快速便捷的实现数字化分析。
附图说明
[0054]
图1为便携式快速细菌抗生素敏感性测试系统的整体示意图;
[0055]
图2为微液滴产生单元的示意图;
[0056]
图3为液滴收集池的示意图;
[0057]
图4为进样切换平台的立体图
[0058]
图5为样切换平台的分解结构图;
[0059]
图6为智能手机荧光显微成像单元的结构示意图;
[0060]
图中,图6a为智能手机荧光显微成像单元的剖视图;
[0061]
图6b为智能手机荧光显微成像单元的另一面的剖视图;
[0062]
图7为细菌抗生素敏感性测试流程图;
[0063]
图8为具体实施例2检测结果;其中:
[0064]
图8a为全阴性对照组的微液滴荧光强度直方图;
[0065]
图8b为细菌存活率与抗生素浓度的关系曲线图;
[0066]
图8c为不同抗生素浓度梯度样品组的微液滴荧光强度直方图。
[0067]
图中,微液滴产生单元1、便携式数字信号发生器1.1、液滴收集池1.2、洗液槽1.21、样品槽1.22、蜂鸣片1.3、尖端毛细管1.4、进样软管1.5、旋转切换进样单元2、进样切换平台2.1、菌样池2.2、洗液池2.3、第一旋转阀2.4、第二旋转阀2.5、样品池2.6、混合通道
出口2.7、s形混合通道2.8、智能手机荧光显微成像单元3、黑色壳体3.1、插口3.11、通光孔3.12、导光器3.2、导光板3.21、led 光源3.22、激发光滤光片3.23、发射光滤光片3.3、显微放大镜3.4、透镜内套筒3.41、透镜外套筒3.42、第一透镜3.43、第二透镜3.44。
具体实施方式
[0068]
下面结合具体实施例对本发明作进一步的详细描述,以便本领域技术人员理解。
[0069]
实施例1
[0070]
如图1~6所示的便携式快速细菌抗生素敏感性测试系统,包括声波驱动的微液滴产生单元1、旋转切换进样单元2和智能手机荧光显微成像单元3;其中,
[0071]
微液滴产生单元包括便携式数字信号发生器1.1和液滴收集池 1.2,便携式数字信号发生器1.1通过导线与蜂鸣片1.3连接;液滴收集池1.2上表面设置有1个洗液槽1.21和若干个样品槽1.22;蜂鸣片1.3上粘接有尖端毛细管1.4,尖端毛细管1.4竖直设置在液滴收集池1.2上方;尖端毛细管1.4的进样端连接有进样软管1.5;
[0072]
旋转切换进样单元2包括进样切换平台2.1,进样切换平台2.1 表面两端分别设置有菌样池2.2和洗液池2.3,菌样池2.2和洗液池 2.3之间设置有第一旋转阀2.4和第二旋转阀2.5;第一旋转阀2.4 和第二旋转阀2.5顶面均开设有第一插孔2.41和第二插孔2.51;
[0073]
第二旋转阀2.5周围设置有6个样品池2.6,进样切换平台2.1 侧面开设有混合通道出口2.7,混合通道出口2.7与进样切换平台 2.1内部的s形混合通道2.8连接,s形混合通道2.8有2个入口,分别与第一旋转阀2.4和第二旋转阀2.5连接,第二旋转阀2.5分别与样品池2.6连通;混合通道出口2.7与进样软管1.5连接。
[0074]
智能手机荧光显微成像单元3包括黑色壳体3.1,黑色壳体3.1 侧壁开设有插口3.11,液滴收集池1.2由插口3.11水平插入黑色壳体3.1内,液滴收集池1.2下方设置有导光器3.2,
[0075]
导光器3.2包括水平设置有导光板3.21,导光板3.21一端设置 led光源3.22,led光源3.22与导光板3.21之间设置有激发光滤光片3.23;
[0076]
液滴收集池1.2上方由上至下依次设置有发射光滤光片3.3和显微放大镜3.4,显微放大镜3.4包括放透镜外套筒3.42和透镜内套筒3.41,且透镜外套筒3.42和透镜内套筒3.41螺纹连接,透镜外套筒3.42底部设置第一透镜3.43,透镜内套筒3.41顶部设置有第二透镜3.44;
[0077]
显微放大镜3.4上方黑色壳体3.1顶部开设有通光孔3.12;led 光源3.22发出的光经过激发光滤光片3.23作为荧光物质的激发光;激发光由一侧进入导光板3.21,均匀照明位于其上方的液滴收集池 1.2;激发出的荧光经发射光滤光片3.3、显微放大镜3.4、通光孔3.12进入手机摄像头;
[0078]
上述进样切换平台2.1由3d打印制作而成。
[0079]
实施例2
[0080]
如图7所示的利用上述便携式快速细菌抗生素敏感性测试系统检测大肠杆菌对氨苄青霉素敏感性的方法,包括以下步骤:
[0081]
1)样品添加
[0082]
a.将浓度为1.0
×
105cfu/ml的大肠杆菌悬液加入进样切换平台2.1的菌样池2.2
中;
[0083]
b.将含有不同浓度梯度抗生素(即氨苄青霉素,下同)的混合液分别加入进样切换平台2.1的6个样品池2.6中,其中,每个混合液中,刃天青的含量均为10μg/ml;
[0084]
抗生素的梯度浓度为0μg/ml、1μg/ml、2μg/ml、4μg/ml、 8μg/ml和16μg/ml(大肠杆菌悬液和抗生素在s形混合通道内按体积比1:1混合后,抗生素的浓度分别变为0μg/ml、0.5μg/ml、1 μg/ml、2μg/ml、4μg/ml和8μg/ml);
[0085]
c.将水加入进样切换平台2.1的洗液池2.3中;
[0086]
d.将矿物油加入液滴收集池1.2的每个凹槽中(包括6个样品槽和1个清洗废液槽);
[0087]
2)微液滴的制作
[0088]
①
转动第一旋转阀2.4关闭菌样通道,转动第二旋转阀2.5使样品池2.6中抗生素浓度为0的混合液流入进样切换平台2.1的s 形混合通道2.8;打开便携式数字信号发生器1.1,使蜂鸣片1.3产生声波信号,带动尖端毛细管1.4振动,调节声波信号的频率,从而在对应的样品槽1.22的矿物油内产生多个体积为2nl的微液滴,形成全阴性对照组;
[0089]
②
将毛细管尖端没入液滴收集池1.2的另一样品槽1.22的矿物油中;通过转动第一旋转阀2.4和第二旋转阀2.5使待检测菌样和样品池2.6中抗生素浓度为0的混合液同时流入进样切换平台2.1 的s形混合通道2.8;打开数字信号发生器1.1,产生足够量的体积为2nl的微液滴,形成正常生长对照组(第二组);
[0090]
③
将毛细管尖端没入液滴收集池1.2的另一样品槽1.22的矿物油中;通过转动第一旋转阀2.4和第二旋转阀2.5使待检测菌样和某一样品池2.6中含待测浓度抗生素的混合液同时流入进样切换平台2.1的s形混合通道2.8汇聚;打开数字信号发生器1.1,产生足够量的体积为2nl的微液滴;形成第三组;
[0091]
④
当该样品槽1.22的微液滴收集完毕时,旋转第二旋转阀2.5 重复上述步骤
③
的工序,直至液滴收集池的其它样品槽装满,即得到在每个样品槽均收集的含有待检测菌样和不同浓度抗生素的微液滴;形成第四组~第七组;
[0092]
上述每组微液滴制作完毕后需要清洗,清洗步骤如下:
[0093]
每个样品槽1.22的微液滴收集完毕时,暂停数字信号发生器 1.1,转动第一旋转阀2.4关闭菌样通道,转动第二旋转阀2.5接通洗液池2.3,打开数字信号发生器1.1,用水清洗s形混合通道2.8、进样软管1.5和尖端毛细管1.4;清洗后的废液流入洗液槽1.21。
[0094]
3)孵育
[0095]
将液滴收集池1.2置于孵育器中孵育5小时;
[0096]
4)拍照
[0097]
将液滴收集池1.2由插口3.11插入智能手机荧光显微成像单元 3的黑色壳体3.1中;将智能手机放在装置上方,手机摄像头正对通光孔3.12,打开手机照相机,调节透镜外套筒3.42(即为调焦套筒),拍摄微液滴的荧光图像,移动液滴收集池1.2,拍摄不同抗生素浓度的微液滴荧光图像;
[0098]
5)敏感性测定
[0099]
对每张微液滴荧光图像进行二值化,利用分水岭算法识别微液滴,记录微液滴在图像中的坐标位置;再对荧光图像进行灰度化,读取微液滴中心的灰度值作为液滴的荧光
强度值;然后将微液滴中心的荧光强度值v
滴
与荧光阈值v
th
进行比较,
[0100]
若该微液滴中心的荧光强度值v
滴
≥v
th
时,该微液滴判别为阳性微液滴;
[0101]
若该微液滴中心的荧光强度值v
滴
<v
th
时,该微液滴判别为阴性微液滴
[0102]
根据不同浓度组的阳性微液滴数占总液滴数比例,与正常生长对照组比较,得到抗生素浓度与大肠杆菌存活率曲线,从而推断大肠杆菌抗生素敏感性,
[0103]vth
=v
mean
nσ
[0104]
其中,v
th
为根据全阴性对照组液滴的荧光强度值设定的荧光阈值;
[0105]vmean
为全阴性对照组中液滴荧光强度的平均值;
[0106]
σ为该组中液滴荧光强度的标准差;
[0107]
n为系数,根据实际情况取1~6。
[0108]
本次实验结果如图7所示:根据全阴性对照组液滴的荧光强度 v
mean
=4.9,σ=1.7,n取3,则阈值v
th
=10.0;由各浓度组液滴的荧光强度直方图,可以求得各组阳性液滴占总液滴数的比例,得到大肠杆菌存活率与氨苄青霉素浓度的关系曲线,即检得大肠杆菌对氨苄青霉素敏感性。
[0109]
其它未详细说明的部分均为现有技术。尽管上述实施例对本发明做出了详尽的描述,但它仅仅是本发明一部分实施例,而不是全部实施例,人们还可以根据本实施例在不经创造性前提下获得其他实施例,这些实施例都属于本发明保护范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。