1.本发明涉及一种抗体-药物缀合物及包含它的抗癌用组合物。
现有技术
2.组织因子(tissue factor,tf)在大多数人癌细胞中表达,临床研究证实了其表达与恶性度为正相关。另外,由本发明者们制作出了以组织因子为目标的抗体,以及包含抗组织因子抗体与细胞毒剂的抗体-药物缀合物(adc)(专利文献1及2,以及非专利文献1)。
3.现有技术文献
4.专利文献
5.专利文献1:国际公开第2015/115656号
6.专利文献2:国际公开第2019/087994号
7.专利文献3:日本特开第2018/188455号公报
8.非专利文献
9.非专利文献1:koga y.等,int j cancer,2015年9月15日,137卷,6号,1457~1466页
技术实现要素:
10.发明所要解决的课题
11.本发明目的为提供一种在生物体内发挥出抗肿瘤效果的、包含抗组织因子抗体和细胞毒剂的抗体-药物缀合物。
12.用于解决课题的手段
13.本发明者们为了达成前述目的反复钻研,制作出了一种adc(以下也称为“hu1084-peg12-mmae”),是在抗组织因子抗体上经由由马来酰亚胺-聚乙二醇12-缬氨酸-瓜氨酸-对氨基苄醇形成的接头结合了细胞毒剂单甲基澳瑞他汀e(mmae)而成的。
14.此外还制作出了一种adc(以下也称为“hu1084-mmae”),是在抗组织因子抗体上经由由马来酰亚胺基己酰基-缬氨酸-瓜氨酸-对氨基苄醇形成的接头结合了细胞毒剂mmae而成的。
15.另外还制作出了一种adc(以下也称为“hu1084-dxd”),是在抗组织因子抗体上经由由马来酰亚胺基己酰基-甘氨酸-甘氨酸-苯丙氨酸-甘氨酸形成的接头结合了细胞毒剂dxd而成的(关于接头及dxd可参考专利文献3)。
16.而且,对于这些adc分析其对人胰腺癌细胞株(bxpc-3、psn-1、hpaf-ii)的杀细胞效果,结果在任一种人胰腺癌细胞之中,hu1084-peg12-mmae或hu1084-mmae都表达出比hu1084-dxd还高的杀细胞效果。尤其,对于psn-1,hu1084-dxd完全没有显示出杀细胞效果。
17.这样的结果提示了对人胰癌,含有抗组织因子抗体及mmae的adc是有效的。然而,使用移植了人胰癌组织的裸小鼠(pdx模型)来进行评估时,结果惊讶地发现,与前述在体外的结果相反,在体内hu1084-dxd对来自人的胰癌组织显示出显著的肿瘤增殖抑制效果,甚
至还可观察到肿瘤退缩,而完成了本发明。
18.即,本发明涉及一种adc,是dxd经由由马来酰亚胺基己酰基-甘氨酸-甘氨酸-苯丙氨酸-甘氨酸所形成的接头结合于抗组织因子抗体而成的,更具体而言,提供以下各项。
19.<1>一种缀合物,是结合组织因子的抗体与由下述式表示的接头和药物结合而成的。
[0020][0021]
<2>如<1>所述的缀合物,其中,前述结合组织因子的抗体的解离速率常数kd为1
×
10-4
(1/s)以上,且结合速率常数ka为1
×
104(1/ms)以上。
[0022]
<3>如<1>或<2>所述的缀合物,其中,前述结合组织因子的抗体为保有重链可变区与轻链可变区的抗体,
[0023]
该重链可变区作为cdr1~3分别包含:序列号1~3所记载的氨基酸序列;或在序列号1~3所记载的氨基酸序列的至少任一者之中替换、缺失、添加和/或插入一个或数个氨基酸而得的氨基酸序列,
[0024]
该轻链可变区作为cdr1~3分别包含:序列号5~7所记载的氨基酸序列;或在序列号5~7所记载的氨基酸序列的至少任一者之中替换、缺失、添加和/或插入一个或数个氨基酸而得的氨基酸序列。
[0025]
<4>如<1>或<2>所述的缀合物,其中,前述结合组织因子的抗体为保有重链可变区与轻链可变区的抗体,
[0026]
该重链可变区包含:序列号4所记载的氨基酸序列;对比于序列号4所记载的氨基酸序列有80%以上的同源性的氨基酸序列;或在序列号4所记载的氨基酸序列的至少任一者之中替换、缺失、添加和/或插入一个或数个氨基酸而得的氨基酸序列,
[0027]
该轻链可变区包含:序列号8所记载的氨基酸序列;对比于序列号8所记载的氨基酸序列有80%以上的同源性的氨基酸序列;或在序列号8所记载的氨基酸序列的至少任一者之中替换、缺失、添加和/或插入一个或数个氨基酸而得的氨基酸序列。
[0028]
<5>如<1>~<4>中任一项所述的缀合物,其中,前述接头和药物相对于每个抗体的平均结合数为3~8个。
[0029]
<6>一种抗癌用组合物,其中,包含如<1>~<5>中任一项所述的缀合物。
[0030]
<7>一种抗胰癌用组合物,其中,包含如<1>~<5>中任一项所述的缀合物。
[0031]
另外,本发明还涉及一种前述缀合物的使用,用于制造抗癌用组合物(抗胰癌用组
合物等);前述缀合物的使用,用于抗癌用途;一种癌的治疗方法,是将有效量的前述缀合物施与对象。
[0032]
此外,在本发明中,“组织因子(tissue factor,tf)”是指血液凝固因子的其中一个,是也被称为f3、cd142、tfa、凝血因子iii(coagulation factor iii)、促凝血酶原激酶、组织促凝血酶原激酶的蛋白质。组织因子是跨膜型的糖蛋白质,已知是外源性血液凝固反应的起始因子。组织因子优选为人组织因子。人组织因子的氨基酸序列例如,如ncbi reference sequence:np_001984所揭示。然而,基因的dna序列会因为其突变等而在自然界中(即非人工地)发生突变,被其编码的蛋白质的氨基酸序列也会随着被改变。所以,本发明所涉及的“组织因子”,并不限于由前述典型的氨基酸序列所形成的蛋白质,也包含这样的天然的突变体。
[0033]“结合速率常数”(ka)及“解离速率常数”(kd),是两分子间的结合解离反应的速率常数。分别如后述实施例所揭示般,可通过例如利用表面等离子体共振法(spr)的测定来确定。抗体与抗原间的结合的spr测定是公知的,只要是本领域技术人员,就能够根据公知技术求得抗体的结合速率常数ka及解离速率常数kd。在spr测定中,可以在以一定浓度让分析物(analyte)流过的相(结合相)由ru的变化量求得结合速率常数,然后可以在运转缓冲液(running buffer)流过的相(解离相)中由ru的变化量求得解离常数。测定可通过循环动力学(single-cycle kinetics)来进行。另外,分析可通过二价分析(bivalent analysis)来进行。对实测到的spr传感图的近似曲线的曲线拟合,可通过kinetic titration 1:1interaction model来进行。曲线拟合的细节可参考karlsson,r.,katsamba,p.s.,nordin,h.,pol,e.and myszka,d.g.(2006)."analyzing a kinetic titration series using affinity biosensors.",anal.biochem.349(1):136-47。
[0034]
抗体的结合速率常数ka及解离速率常数kd,另外还可例如使用由ge healthcare公司售卖的biacore(注册商标)等spr装置,依照该制造商的使用手册求得。更具体而言,spr测定装置中也搭载了计算ka及kd的程序,由spr传感图可计算出ka及kd。例如,使用biacore t200 evaluation software来分析通过biacore(注册商标)装置所得到的spr传感图,采用bivalent analyte model作为fitting model,导出fitting curve,能够以抗体或adc的动力学参数的形式计算出ka或kd、kd。
[0035]
发明的效果
[0036]
依据本发明,可提供一种在生物体内发挥出抗肿瘤效果的、包含抗组织因子抗体和细胞毒剂的抗体-药物缀合物。
附图说明
[0037]
图1a为表示抗体-药物缀合物及药物单剂对人胰腺癌细胞株(bxpc-3)的杀细胞效果的分析结果图。图中,纵轴代表人胰腺癌细胞株的存活率,横轴代表药物在细胞株培养基的添加浓度(各药物换算)(关于图的纵轴及横轴的标识,在以下的图1b~1e中也同样)。
[0038]
图1b为表示抗体-药物缀合物及药物单剂对人胰腺癌细胞株(psn-1)的杀细胞效果的分析结果图。
[0039]
图1c为表示抗体-药物缀合物及药物单剂对人胰腺癌细胞株(bxpc-3)的杀细胞效果的分析结果图。图中,“anti-tf adc mmae”表示hu1084-mmae,“control adc mmae”表示
改变hu1084-mmae当中hu1084的cdr区域的氨基酸,变得无法识别人组织因子。包含这些mmae的抗体-药物缀合物中的接头和药物相对于每个抗体的平均结合数(dar)为3~4。“anti-tf adc dxd”表示hu1084-dxd,“control adc dxd”表示改变hu1084-dxd当中hu1084的cdr区域的氨基酸,变得无法识别人组织因子。包含这些dxd的抗体-药物缀合物中的dar为7~8(关于这些标识,在图1d及1e中也同样)。
[0040]
图1d为表示抗体-药物缀合物及药物单剂对人胰腺癌细胞株(hpaf-ii)的杀细胞效果的分析结果图。
[0041]
图1e为表示抗体-药物缀合物及药物单剂对人胰腺癌细胞株(psn-1)的杀细胞效果的分析结果图。
[0042]
图2a为表示通过使用抗组织因子抗体的免疫染色对移植了人胰癌组织(人胰脏肿瘤组织片,型号:pan-02-jck(实验动物中央研究所))的裸小鼠(no,2)身上形成的肿瘤组织进行了分析的结果的显微镜照片。图中的比例尺表示200μm。
[0043]
图2b为表示通过使用抗组织因子抗体的免疫染色对移植了人胰癌组织(人胰脏肿瘤组织片,型号:pan-04-jck(实验动物中央研究所))的裸小鼠(no,4)身上形成的肿瘤组织进行了分析的结果的显微镜照片。图中的比例尺表示200μm。
[0044]
图2c为表示通过使用抗组织因子抗体的免疫染色对移植了人胰癌组织(人胰脏肿瘤组织片,型号:pan-08-jck(实验动物中央研究所))的裸小鼠(no,8)身上形成的肿瘤组织进行了分析的结果的显微镜照片。图中的比例尺表示200μm。
[0045]
图3a为表示在前述裸小鼠(no,2)身上的抗体-药物缀合物的抗肿瘤效果的分析结果图。图中,纵轴代表肿瘤大小,横轴代表开始施与抗体-药物缀合物之后的天数(关于图的纵轴及横轴的标识,在以下的图3b~3e中也同样)。
[0046]
图3b为表示前述裸小鼠(no,4)身上的抗体-药物缀合物的抗肿瘤效果的分析结果图。图中,纵轴代表肿瘤大小,横轴代表开始施与抗体-药物缀合物之后的天数。
[0047]
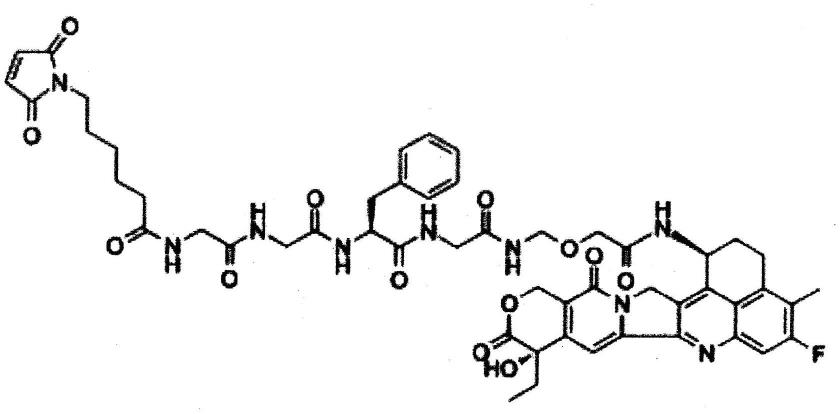
图3c为表示前述裸小鼠(no,8)身上的抗体-药物缀合物的抗肿瘤效果的分析结果图。图中,纵轴代表肿瘤大小,横轴代表开始施与抗体-药物缀合物之后的天数。
[0048]
图3d为表示前述裸小鼠(no,8)身上的抗体-药物缀合物的抗肿瘤效果的分析结果图。图中,“anti-tf-mmae”及“anti-tf-dxd”分别表示hu1084-mmae(dar:3)及hu1084-dxd(dar:8)。另外还一并表示了通过使用抗组织因子抗体的免疫染色对前述裸小鼠(no,8)身上形成的肿瘤组织进行了分析的结果。该显微镜照片中的比例尺表示200μm。
[0049]
图3e为表示移植了人胰癌组织(人胰脏肿瘤组织片,型号:pan-14-jck(实验动物中央研究所))的裸小鼠(no,14)身上的抗体-药物缀合物的抗肿瘤效果的分析结果图。另外还一并表示了通过使用抗组织因子抗体的免疫染色对前述裸小鼠(no,14)身上形成的肿瘤组织进行了分析的结果。该显微镜照片中的比例尺表示200μm。
具体实施方式
[0050]
<抗体-药物缀合物>
[0051]
如后述实施例所揭示般,表明了结合组织因子的抗体与细胞毒剂dxd经由由马来酰亚胺基己酰基-甘氨酸-甘氨酸-苯丙氨酸-甘氨酸形成的接头结合成的缀合物(抗体-药物缀合物、adc),在生物体内对癌显示出显著的肿瘤增殖抑制效果,进而显示出肿瘤退缩效
果。所以,本发明提供了该抗体-药物缀合物。
[0052]
(结合组织因子的抗体)
[0053]
本发明中的“抗体”,包括免疫球蛋白所有的型(igg、ige、igm、igd、iga、igy等)及亚型(igg1、igg2、igg3、igg4、iga1、iga2等)。“抗体”包括多克隆抗体、单克隆抗体,而且意思还包括抗体的功能性片段的形态。“多克隆抗体”是含有对应不同的表位的不同抗体的抗体制备物。“单克隆抗体”意指由实质上均匀的抗体的集合所得到的抗体(包括抗体片段)。与多克隆抗体相对地,单克隆抗体是识别抗原上的单一决定簇的抗体。本发明的抗体优选为单克隆抗体。本发明的抗体,是由自然环境的成分分离出来和/或回收到的(即分离后的)抗体。
[0054]
该抗体可通过杂交瘤法来制作,另外还可通过重组dna法来制作。
[0055]
杂交瘤法具代表性的例子,可列举kohler及milstein的方法(kohler&milstein,nature,256:495(1975))。此方法中,细胞融合步骤所使用的抗体生产细胞,是被抗原(组织因子、其部分肽、于这些上融合了fc蛋白质等的蛋白质、或表达它们的细胞等)免疫的动物(例如大鼠、小鼠、仓鼠、兔、猴、山羊)的脾脏细胞、淋巴细胞、外周血白血球等。由未经免疫的动物预先分离出上述细胞或淋巴细胞等,并在培养基中使其与抗原发生作用,藉此得到的抗体生产细胞也可拿来使用。骨髓瘤细胞可使用公知的各种细胞株。抗体生产细胞及骨髓瘤细胞,只要这些细胞可融合,则可源自于不同动物,但优选为源自于相同动物。杂交瘤是通过例如由经过抗原免疫的小鼠所得到的脾脏细胞与小鼠骨髓瘤细胞之间的细胞融合所产生,然后通过筛选可得到能产生对组织因子有特异性的单克隆抗体的杂交瘤。对应于组织因子的单克隆抗体,可通过培养杂交瘤,并且从施与了杂交瘤的哺乳动物的腹水来取得。
[0056]
重组dna法,是由杂交瘤或b细胞等克隆编码了本发明的抗体的dna,装入适当的载体并导入宿主细胞(例如cho细胞、hek细胞等的哺乳类细胞株、大肠菌、酵母细胞、昆虫细胞、植物细胞等),以重组抗体的形式来生产本发明的抗体的手段(例如p.j.delves,antibody production:essential techniques,1997wiley、p.shepherd and c.dean monoclonal antibodies,2000oxford university press、vandamme a.m.et al.,eur.j.biochem.192:767-775(1990))。在编码了本发明的抗体的dna的表达中,可将编码重链或轻链的dna分别装入各个表达载体来转化宿主细胞,或可将编码重链及轻链的dna装入单一的表达载体来转化宿主细胞(参考国际公开第94/11523号)。本发明的抗体,通过培养上述宿主细胞,并由宿主细胞内或培养液分离、纯化,能够以实质上纯粹且均匀的形态取得。抗体的分离、纯化,可使用通常多肽纯化所使用的方法。只要使用转基因动物制作技术制作出装入了抗体基因的转基因动物(牛、山羊、绵羊、猪等),就能够由该转基因动物的乳汁大量取得来自抗体基因的单克隆抗体。
[0057]
本发明的抗体只要能结合组织因子即可,其来源、种类、形状等并未受到特别限定。具体而言,包括了来自非人动物的抗体(例如大鼠抗体、小鼠抗体、骆驼抗体)、来自人的抗体、嵌合抗体、人源化抗体、及这些抗体的功能性片段。在将本发明的抗体作为药物施与人的情况下,从减少副作用的观点看来,希望为嵌合抗体或人源化抗体。
[0058]
在本发明中“嵌合抗体”,是指将某生物种的抗体的可变区和不同于该生物种的抗体的恒定区连结而成抗体。嵌合抗体可通过例如从如上述般制作出的单克隆抗体的基因将
能与抗原结合的抗体可变部(可变区)切下,并与来自人骨髓的抗体恒定部(恒定区)基因结合,将其装入表达载体,导入宿主并使其生产抗体而获得(例如日本特开平8-280387号公报、美国专利第4816397号公报、美国专利第4816567号公报、美国专利第5807715号公报)。
[0059]
嵌合抗体的恒定区,通常是使用来自人的抗体的恒定区。例如在重链方面,可利用cγ1、cγ2、cγ3、cγ4、cμ、cδ、cα1、cα2、及cε作为恒定区。另外,在轻链方面,可使用cκ或cλ作为恒定区。这些恒定区的氨基酸序列、以及编码它的碱基序列是公知的。另外,为了改善抗体本身的稳定性或抗体产生的稳定性,可让来自人的抗体的恒定区中一个或数个氨基酸发生替换、缺失、添加和/或插入。
[0060]
在本发明中“人源化抗体”,是指将来自非人(大鼠等)的抗体的抗原结合部位(cdr)的基因序列移植(cdr-grafting)至来自人的抗体基因而成的抗体,其制作方法为重叠延伸pcr等,是公知的(例如欧洲专利申请公开第239400号说明书、欧洲专利申请公开第125023号说明书、国际公开第90/07861号、国际公开第96/02576号)。抗体的可变区,通常是由被四个骨架区(fr)夹着的三个cdr所构成。cdr是实质上确定抗体的结合特异性的区域。cdr的氨基酸序列富有多样性,而另一方面,构成fr的氨基酸序列多在具有不同结合特异性的抗体之间也表达出高同源性。因此一般而言,通过cdr的移植,可将某抗体的结合特异性移植至其他抗体。另外,从维持cdr功能的观点看来,来自非人的cdr移植至人fr时,可选择与来自该非人动物的fr同源性高的人fr。也就是说,cdr内的氨基酸不仅会识别抗原,还与cdr附近的fr的氨基酸配位,也和维持cdr的环状结构有关,因此优选利用由和要移植的cdr邻接的fr的氨基酸序列同源性高的氨基酸序列所形成的人fr。
[0061]
与来自非人动物的fr同源性高的公知的人fr的检索,可利用例如可在因特网上使用的抗体特化检索系统(http://www.bioinf.org.uk/abysis/)来进行。为了和以此方式得到的人fr的序列一致,也可在来自非人的抗体的cdr以外的序列中导入突变。或者,在可取得编码由检索所得到的人fr的氨基酸序列的基因(cdna)的情况下,也可在该序列中导入来自非人的cdr。突变的导入等,可使用核酸合成、定点诱变等该领域公知的技术来进行。
[0062]
通过定性或定量地测定、评估以此方式制作出的人源化抗体对抗原的结合活性,可适当地选择出在经由cdr连结时该cdr会形成良好的抗原结合部位的来自人的抗体的fr。另外还可根据需要依照sato,k.et al.,cancer res,1993,53,851-856等所记载的方法来替换fr的氨基酸残基,让人源化抗体的cdr形成适当的抗原结合部位,进一步通过测定、评估替换该氨基酸后的突变型抗体对抗原的结合活性,可选择出具有所希望的性质的突变fr序列。
[0063]
在本发明中抗体的“功能性片段”,也被称为抗原结合片段,是抗体的一部分(部分片段),能够特异性地识别组织因子。具体而言,可列举fab、fab’、f(ab’)2、可变区片段(fv)、二硫键fv、单链fv(scfv)、sc(fv)2、双特异性抗体、多特异性抗体、及它们的聚合物等。
[0064]
此处“fab”意指由一个轻链及重链的一部分所形成的免疫球蛋白的一价抗原结合片段。可通过抗体的木瓜蛋白酶消化、还有重组方法来获得。“fab
’”
包含了抗体的铰链区的一个或更多的半胱氨酸,因为在重链ch1区的羧基末端添加了几个残基,而与fab有所不同。“f(ab’)2”意指由两者的轻链与两者的重链部分所形成的免疫球蛋白的二价抗原结合片段。
[0065]“可变区片段(fv)”是具有完整的抗原识别及结合部位的最小抗体片段。fv是重链可变区及轻链可变区通过非共价键稳固地连结成的二聚物。“单链fv(scfv)”包含了抗体的重链可变区及轻链可变区,这些区域存在于单一多肽链中。“sc(fv)2”是将两个重链可变区及两个轻链可变区以接头等结合而形成单链。“双特异性抗体”是指具有两个抗原结合部位的小抗体片段,该片段包含了在同一个多肽链之中结合于轻链可变区的重链可变区,并且各区域会与其他链的互补区域成对。“多特异性抗体”是对于至少两个不同抗原具有结合特异性的单克隆抗体。例如,可通过两个重链为具有不同特异性的两个免疫球蛋白重链/轻链对的同时表达来制备。
[0066]
本发明的抗体,包括了其氨基酸序列经过修饰且没有降低所希望的活性(对抗原的结合活性等)的抗体。这样的氨基酸序列突变体,例如可通过在编码后述人源化1084抗体的抗体链的dna上导入突变,或可通过肽合成来制作。这样的修饰,包括了例如抗体的氨基酸序列内残基的替换、缺失、添加和/或插入。抗体的氨基酸序列被改变的部位,只要具有与改变前的抗体同等的活性,可为抗体的重链或轻链的恒定区,另外还可为可变区(fr及cdr)。cdr以外的氨基酸的改变,被认为对于与抗原的结合活性的影响相对较少,而现在,改变cdr的氨基酸以提高对抗原的结合活性的抗体,其筛选手段是公知的(pnas,102:8466-8471(2005)、protein engineering,design&selection,21:485-493(2008)、国际公开第2002/051870号、j.biol.chem.,280:24880-24887(2005)、protein engineering,design&selection,21:345-351(2008)、mabs.mar-apr;6(2):437-45(2014))。另外,现在还可通过利用统合计算化学系统等(例如molecular operating enviroment,加拿大ccg公司制)来模拟对抗原的结合活性提高后的抗体(参考例如http://www.rsi.co.jp/kagaku/cs/ccg/products/application/protein.html)。此外,如protein eng des sel.2010aug;23(8):643-51所记载般,得知了重链可变区的cdr1及轻链可变区的cdr3在与抗原的结合活性方面并无关联的例子,另外同样地,molecular immunology 44:1075-1084(2007)报告了在大部分的抗体中,轻链可变区的cdr2和对抗原的结合活性无关。像这样,在抗体对抗原的结合活性方面,即使重链可变区及轻链可变区各自的cdr1~3全部都不要,也可发挥出同等的活性。实际上,在biochem biophys res commun.2003jul 18;307(1):198-205、j mol biol.2004jul 9;340(3):525-42、j mol biol.2003aug 29;331(5):1109-20中,报告了通过保有原本抗体的至少1个cdr来维持对抗原的结合活性的例子。然而,只要是本领域技术人员,则为了维持以及提升该抗体对抗原的结合活性的目的,不仅是fr,cdr的氨基酸序列也可改变。
[0067]
关于本发明的抗体,被改变的氨基酸数目优选为10个氨基酸以内(例如9个氨基酸以内、8个氨基酸以内、7个氨基酸以内、6个氨基酸以内),更优选为5个氨基酸以内(例如4个氨基酸以内),进一步为3个氨基酸以内(例如2个氨基酸以内、1个氨基酸)。氨基酸的改变优选为保守的替换。“保守的替换”,意指以具有化学上同样的侧链的其他氨基酸残基来替换。具有化学上同样的氨基酸侧链的氨基酸残基的群组,在本发明的所属技术领域是公知的。例如,能够以酸性氨基酸(天门冬氨酸
·
谷氨酸)、碱性氨基酸(赖氨酸
·
精氨酸
·
组氨酸)、中性氨基酸来分类,中性氨基酸当中又分成具有烃链的氨基酸(甘氨酸
·
丙氨酸
·
缬氨酸
·
亮氨酸
·
异亮氨酸
·
脯氨酸)、具有羟基的氨基酸(丝氨酸
·
苏氨酸)、含硫的氨基酸(半胱氨酸
·
甲硫氨酸)、具有酰胺基的氨基酸(天门冬酰胺
·
谷氨酰胺)、具有亚胺基的氨
基酸(脯氨酸)、具有芳香族基的氨基酸(苯丙氨酸
·
酪氨酸
·
色氨酸)。
[0068]
另外,具有由改变后的氨基酸序列对比于后述人源化1084抗体的抗体链在氨基酸序列等级上有80%以上的同源性的氨基酸序列所形成的抗体链的抗体,只要具有与改变前的抗体同等的活性,则也包括在本发明的抗体内。该同源性只要至少80%就可以,优选为85%以上,更优选为90%以上,进一步为95%以上(例如96%以上、97%以上、98%以上、99%以上)。另外,序列的同源性,可利用blastp(氨基酸水平)的程序(altschul et al.j.mol.biol.,215:403-410,1990)来确定。该程序是以由karlin及altschul所开发的算法blast(proc.natl.acad.sci.usa,87:2264-2268,1990,proc.natl.acad.sci.usa,90:5873-5877,1993)为基础。在通过blastp分析氨基酸序列的情况,参数定为例如score=50,word length=3。另外,在使用gapped blast程序来分析氨基酸序列的情况下,可如altschul等(nucleic acids res.25:3389-3402,1997)所记载的内容来进行。在使用blast与gapped blast程序的情况下,使用各程序的默认参数。这些分析方法的具体手段是公知的。另外,“具有同等的活性”,意指对抗原的结合活性与对象抗体(代表性地来说,为人源化1084抗体)同等(例如70%以上,优选为80%以上,更优选为90%以上)。
[0069]
另外,本发明的抗体的改变,可为例如改变了糖基化部位的数目或位置等的抗体在翻译后工序的改变。藉此可提升例如抗体的adcc活性。抗体的糖基化,典型来说为n-连接或o-连接。抗体的糖基化,会大幅依赖于让抗体表达所使用的宿主细胞。糖基化模式的改变,可通过导入或去除和糖生产相关的特定酶等公知方法来进行(日本特开2008-113663号公报、美国专利第5047335号、美国专利第5510261号、美国专利第5278299号、国际公开第99/54342号)。此外,在本发明中,为了增加抗体的稳定性等目的,可通过将脱酰胺化的氨基酸或与脱酰胺化的氨基酸邻接的氨基酸替换为其他氨基酸来抑制脱酰胺化。另外还可将谷氨酸替换成其他氨基酸来增加抗体的稳定性。本发明也提供像这样稳定化了的抗体。
[0070]
另外,本发明的抗体可具有内化能力(可参考专利文献1)。“内化”意指抗体与细胞表面的抗原形成免疫复合物之后,被吸收进到细胞内的现象。抗体是否具有内化能力,可通过例如使结合了标识物质的抗体与表面表达组织因子的细胞接触,确认该标识物质是否转移至细胞内的方法;使结合了具有细胞毒性的物质的抗体与表面表达出组织因子的细胞接触后,确认是否被诱导细胞死亡或细胞增殖阻碍的方法等来判断。
[0071]
本发明的抗体,另外还可具有选自adcc活性及cdc活性的至少1种细胞毒活性。“adcc活性(抗体依赖的细胞毒活性)”,意指在抗体结合于目标细胞的细胞表面抗原时,通过效应细胞(nk细胞、单核细胞等免疫细胞)进一步结合于该抗体的fc区域,该细胞会被激活,伴随于此,释放出因子而将目标细胞杀伤的活性。另一方面,“cdc活性(补体依赖的细胞毒活性)”,意指抗体结合于目标细胞时,补体系统激活,结果将目标细胞溶解的活性。
[0072]
从一旦结合于组织因子之后迅速解离,成为adc时,渗透至实体瘤内部的能力高,还有从抗肿瘤效果高的倾向的观点看来(可参考专利文献2),本发明所涉及的抗体的解离速率常数kd优选为1
×
10-4
(1/s)以上,更优选为2
×
10-4
(1/s)以上,进一步优选为3
×
10-4
(1/s)以上,更优选为4
×
10-4
(1/s)以上,进一步优选为5
×
10-4
(1/s)以上,更优选为6
×
10-4
(1/s)以上,进一步优选为7
×
10-4
(1/s)以上,更优选为8
×
10-4
(1/s)以上,进一步优选为9
×
10-4
(1/s)以上,更优选为10
×
10-4
(1/s)以上,进一步优选为15
×
10-4
(1/s)以上。另外,从相同观点看来,结合速率常数ka优选为1
×
104(1/ms)以上,更优选为2
×
104(1/ms)以上,进
一步优选为3
×
104(1/ms)以上,更优选为4
×
104(1/ms)以上,进一步优选为5
×
104(1/ms)以上,更优选为6
×
104(1/ms)以上。此外,作为kd及ka的组合,分别优选为1
×
10-4
(1/s)以上及1
×
104(1/ms)以上,更优选为3
×
10-4
(1/s)以上及2
×
104(1/ms)以上,进一步优选为10
×
10-4
(1/s)以上及3
×
104(1/ms)以上,更优选为15
×
10-4
(1/s)以上及6
×
104(1/ms)以上。此外,kd及ka的上限,可为免疫而得到抗体的它们的范围。另外,kd值优选为1~100nm,更优选为10~50nm,进一步优选20~40nm。
[0073]
作为这样的本发明的抗体,可列举专利文献2所记载的来自大鼠的杂交瘤no.1084株所产生的单克隆抗体(大鼠1084抗体)。另外,如后述实施例所揭示般,可列举使来自该大鼠的抗体人源化后的抗体(人源化1084抗体)作为本发明的抗体更合适的例子,更具体的例子可列举以下。
[0074]
结合组织因子的抗体,保有了重链可变区与轻链可变区,
[0075]
该重链可变区作为cdr1~3分别包含:序列号1~3所记载的氨基酸序列;或在序列号1~3所记载的氨基酸序列的至少任一者之中替换、缺失、添加和/或插入一个或数个氨基酸而得的氨基酸序列,
[0076]
该轻链可变区作为cdr1~3分别包含:序列号5~7所记载的氨基酸序列;或在序列号5~7所记载的氨基酸序列的至少任一者之中替换、缺失、添加和/或插入一个或数个氨基酸而得的氨基酸序列。
[0077]
结合组织因子的抗体,保有了重链可变区与轻链可变区,
[0078]
该重链可变区包含:序列号4所记载的氨基酸序列;对比于序列号4所记载的氨基酸序列有80%以上的同源性的氨基酸序列;或在序列号4所记载的氨基酸序列的至少任一者之中替换、缺失、添加和/或插入一个或数个氨基酸而得的氨基酸序列,
[0079]
该轻链可变区包含:序列号8所记载的氨基酸序列;对比于序列号8所记载的氨基酸序列有80%以上的同源性的氨基酸序列;或在序列号8所记载的氨基酸序列的至少任一者之中替换、缺失、添加和/或插入一个或数个氨基酸而得的氨基酸序列。
[0080]
此外,同源性或氨基酸的改变个数如上述般,只要是本领域技术人员,就能够以在组织因子上的结合活性等作为指标来适当地调整。另外,可改变的部位也如上述般,只要是本领域技术人员就能够适当地选择,优选可列举大鼠1084抗体的cdrs与人源化1084抗体的cdrs当中氨基酸不同的部位,更具体而言,可列举选自重链可变区cdr2的n末端算起的第11~13、15及16位,轻链可变区cdr1的n末端算起的第4位,以及轻链可变区cdr2的n末端算起的第4位中至少1个部位(例如1、2、3、4、5、6或7个部位)。另外,在这些部位上的氨基酸可为任意氨基酸(所谓xaa)。
[0081]
(接头和药物)
[0082]
在本发明的adc之中,上述抗体与由下述式表示的接头和药物结合(cas编号:1599440-13-7)。
[0083][0084]
本发明所涉及的接头,如上述般,由马来酰亚胺基己酰基(mc,maleimidocaproyl)-甘氨酸(gly)-甘氨酸(gly)-苯丙氨酸(phe)-甘氨酸(gly)形成。另外,药物是由下述式表示的抗肿瘤性化合物(dxd,cas编号:1599440-33-1)。
[0085][0086]
此外,已知dxd具有喜树碱结构,因此在酸性的水性溶剂中(例如ph3左右),平衡会偏向形成内酯环的结构(闭环体),另一方面,在碱性的水性溶剂中(例如ph10左右),平衡会偏向内酯环开环的结构(开环体)。导入了对应于这样的闭环结构及开环结构的依沙替康(exatecan)残基的adc,也可期待同等的抗肿瘤效果,而应理解任一者皆被包含在本发明的范围。
[0087]
该接头和药物,只要是本领域技术人员,就能够使用公知的方法适当地合成。另外还能够以市售品(例如medchemexpress公司,制品型号:hy-13631e,商品名:deruxtecan)的形式购买到。
[0088]
本发明所涉及的抗组织因子抗体与上述接头和药物的“结合”,如下述式所表示般,意指经由由该抗体中的硫醇基(sh基、巯基)与接头末端的马来酰亚胺基发生反应所形成的硫醚基的结合。此外,于下述式中,“mab”表示本发明所涉及的抗组织因子抗体,“dxd”表示本发明所涉及的药物。
[0089][0090]
本发明的adc中,其每一抗体分子上的药物结合数,需考虑其有效性、安全性,让该
数到达一定数目来设定反应的原料、试剂的使用量等的反应条件而实施。然而,与低分子化合物的化学反应不同,通常会以不同结合数的药物组合而成的混合物的形式获得。药物在一个抗体分子上的结合数为平均值,即,以平均药物结合数来指定以及标识。所以,在本发明说明书中,只要没有特别注明,药物的结合数也意指平均值。
[0091]
每一抗体分子上的药物结合数,如后述实施例所揭示般,可通过调整所使用的还原剂的种类及其浓度、接头和药物相对于抗体的浓度(摩尔超额率等),以及结合反应的温度或时间来控制。作为“还原剂”,只要是可使抗体中的二硫键还原性地裂解并发生上述经由硫醇基的结合,就无特别限制,可列举例如二硫苏糖醇(dtt、dl-dtt)、2-巯基乙胺、巯基乙醇、tcep。
[0092]
在本发明中,每一抗体上的药物平均结合数,优选为3~8个,更优选为4~8个,进一步优选为5~8个,更优选为6~8个,进一步优选为7~8个,特别优选为8个。此外,每一抗体分子上的药物结合数,如后述实施例所揭示般,只要是本领域技术人员,就能够使用将dtnb等的硫醇基比色定量的试剂求得。
[0093]
另外,本发明的adc,会因为放置在大气中或者进行再结晶而吸收水分,而有时带着吸附的水或者变成水合物,这样的含水的化合物及盐也包括在本发明内。
[0094]
构成本发明的adc的原子当中的1种以上,也能够以非天然的比例含有原子同位素。原子同位素可列举例如2h、3h、
125
i、
14
c。另外,为了在生物影像等技术领域中进行检测,本发明的adc也可与标识物质结合。标识物质可依照所使用的检测方法等的种类适当地选择,可列举例如放射性标识物质、荧光性标识物质、顺磁性标识物质、超顺磁性标识物质、酶标识物质。另外,这样的标识物质与adc的结合可为直接,也可以为间接。作为间接结合,可列举经由结合有标识物质的二次抗体、结合有标识物质的聚合物(蛋白质a、蛋白质b等)的结合。
[0095]
更具体而言,可利用正子发射核种作为标识adc的放射性同位素。例如,可通过如
64
cu、
18
f、
55
co、
66
ga、
68
ga、
76
br、
89
zr及
124
i般的正子发射核种来标识抗体。在以这些正子发射核种来标识adc时,可利用公知的方法(nucl med biol.1999;26(8):943-50.、j nucl med.2013;54(11):1869-75.等)。另外,被正子发射核种标识的adc,在被施与对象之后,通过pet(正子断层摄影装置),由体外测量由该放射性核种发出的放射线,以计算机断层扫描的手段转换成影像。以此方式可追踪施与对象的adc在肿瘤组织中的渗透等。
[0096]
<抗癌用组合物>
[0097]
如后述实施例所揭示般,本发明的adc会在生物体内表达出显著的肿瘤增殖抑制效果,甚至还可发挥出肿瘤退缩效果。所以,本发明提供一种用来治疗癌的组合物(抗癌用组合物),是包含本发明的adc。
[0098]
本发明对象的“癌”,可列举例如实体瘤,更具体而言,可列举胰癌、淋巴肿瘤、肺癌、头颈癌、前列腺癌、膀胱癌、乳癌、食道癌、胃癌、大肠癌、子宫癌、卵巢癌、皮肤癌、甲状腺癌、胸腺癌、肾脏癌、精巢癌、阴茎癌、肝脏癌、胆道癌、脑肿瘤、骨软部肿瘤、后腹膜肿瘤、血管/淋巴管肉瘤。另外,此癌可以为原发性的,也可以为转移性的。
[0099]
本发明的组合物除了adc之外,还可包含药理学上容许的其他成分。这样的其他成分,可列举例如担体、乳化剂、湿润剂、ph缓冲化剂、赋形剂、崩解剂、缓冲剂、等渗剂、悬浮剂、增容剂、无痛剂、稳定剂、保存剂、防腐剂。更具体而言,药理学上容许的其他成分,在注
射剂等的液状制剂的情况,可列举水溶液(生理盐水、注射用水、磷酸盐缓冲液、葡萄糖水溶液、甘油水溶液等)、氢氧化铝等作为例子。另外,在冷冻干燥制剂的情况,可列举糖(甘露醇、乳糖、蔗糖等)、白蛋白等作为例子,然而并不限于这些。此外,本发明的组合物可为在施与前可混合上述成分的试剂盒方式。另外,在作为注射剂使用的情况,可为被装入注射筒的形态。
[0100]
本发明的组合物,可仅包含本发明的adc作为有效成分,也可包含该adc及至少一种其他癌治疗剂。本发明的adc也可与其他癌治疗剂一起施与,通过这样的方式可增强抗癌效果。以此目的使用的其他抗癌剂,可分开或者连续地与本发明的adc同时施与对象,或可改变各施与间隔来施与。这样的癌治疗剂,可列举例如免疫检查点抑制药(抗pd-1抗体等)、吉西他滨(gemcitabine)、s-1、厄洛替尼(erlotinib)、5-fu、甲酰四氢叶酸(leucovorin)、爱莱诺迪肯(irinotecan)(cpt-11)、奥沙利铂(oxaliplatin)、埃布尔杉(abraxane)、卡铂(carboplatin)、紫杉醇(paclitaxel)、培美曲塞(pemetrexed)、索拉非尼(sorafenib)、长春花碱、lh-rh类似物(亮丙瑞林(leuprorelin)、戈舍瑞林(goserelin)等)、雌莫司汀磷酸酯(estramustine phosphate)、雌激素撷抗剂(泰莫西芬(tamoxifen)、雷洛昔芬(raloxifene)等)、芳香化酶阻碍剂(阿那曲唑(anastrozole)、来曲唑(letrozole)、依西美坦(exemestane)等)、国际公开第wo2003/038043号所记载的药剂,只要是具有抗肿瘤活性的药剂则不受限定。
[0101]
<癌的治疗方法>
[0102]
本发明另外还提供一种治疗癌的方法,是将有效量的本发明的adc或包含该adc的组合物施与对象。
[0103]
在该方法之中,所施与的adc及组合物如上述般。作为被施与这些的“对象”,只要是以该治疗为必要的人,则特别没有限制,可为罹患上述癌的患者,或有罹患危险的人,另外还可为有癌复发危险的人。另外,对象可为人或非人哺乳动物。非人哺乳动物并无特别限制,可列举家畜、宠物、实验用动物,更具体而言,可列举猴、小鼠、大鼠、仓鼠、豚鼠、牛、猪、马、兔、绵羊、山羊、猫、狗。
[0104]
在本发明中“治疗”,意指完全康复、治愈、缓解、改善症状或状态、降低进展(恶化)速度。另外,“有效量”意指让该治疗有效的药剂量。
[0105]
本发明的adc或组合物的施与方法,可以根据施与对象的年龄、体重、性别、健康状态等而不同,能够以非口服施与(例如静脉内施与、动脉内施与、皮内施与、肌肉内施与、腹腔内施与、局部施与)、口服施与的任一种施与途径来施与。合适的施与方法为非口服施与,更优选为静脉内施与。施与可通过例如注入或弹丸注射。
[0106]
本发明的adc或组合物的施与量,可以根据依照对象的年龄、体重、性别、健康状态、症状发展程度及所施与的组合物的成分而变动,一般而言,在静脉内施与的情况,以所含有的药物量来换算,成人每1kg体重1天0.001~1000mg,优选为0.01~100mg。施与次数可为例如1次、或以1天~1年1次的间隔(例如每1周、每10~30天、每1月、每3~6月、每半年、每1年)施与多次。
[0107]
实施例
[0108]
以下基于实施例更具体地说明本发明,然而本发明并不受以下的实施例限定。
[0109]
[抗组织因子抗体的制备]
[0110]
在本实施例之中,由专利文献2所记载的来自大鼠的杂交瘤no.1084株来产生单克隆抗体(大鼠1084抗体),使其人源化,将其作为抗组织因子抗体来使用。
[0111]
具体而言,首先依照kabat的定义来确定大鼠1084抗体的各cdr区域的序列。所定出的大鼠1084抗体的各序列如以下所述。
[0112]
重链可变区cdr1~3的氨基酸序列
…
序列号9~11
[0113]
重链可变区的氨基酸序列
…
序列号12
[0114]
轻链可变区cdr1~3的氨基酸序列
…
序列号13~15
[0115]
轻链可变区的氨基酸序列
…
序列号16。
[0116]
接下来,依照human monoclonal antibody(springer protocols)的chapter 7(123-138)记载的方法,将大鼠1084抗体的骨架区等替换为来自人的骨架区。人源化的1084抗体的各氨基酸序列如以下所述。
[0117]
重链可变区cdr1~3的氨基酸序列
…
序列号1~3
[0118]
重链可变区的氨基酸序列
…
序列号4
[0119]
轻链可变区cdr1~3的氨基酸序列
…
序列号5~7
[0120]
轻链可变区的氨基酸序列
…
序列号8。
[0121]
此外,人源化1084抗体与大鼠1084抗体会有一部分的cdr区域的序列不同。这是因为,该部分由于并未露出分子表面,因此并非与抗原识别部位,而是与人源化的骨架区发生交互作用,有助于结构稳定化,所以采用了人的序列,而并非大鼠的序列。
[0122]
另外,前述可变区以外的序列(恒定区),使用了利妥昔单抗(由抗人cd20人
·
小鼠嵌合抗体所形成的单克隆抗体,cas登录编号:174722-31-7,drugbank:db00073)的序列。分别将具有来自利妥昔单抗序列的人源化1084抗体的重链及轻链的氨基酸序列揭示于序列号17及18。
[0123]
然后,依照常法制作出编码人源化1084抗体的载体,使用cho细胞(制品名;expicho expression system(thermofisher公司制)),使该抗体一过性地表达,进行纯化。
[0124]
[抗体-药物缀合物(adc)的制备]
[0125]
使用前述所制作出的人源化1084抗体,依照以下所揭示的方法制备出下述表1所揭示的4种adc。
[0126][0127]
(hu1084-dxd3的制备)
[0128]
首先,制作还原处理时使用的缓冲液。制备出含5mm edta(ph8.0)的杜氏磷酸缓冲生理盐水(dpbs)作为缓冲液a。另外,制备出100mm磷酸二氢钠、150mm氯化钠、5mm edta(ph8.0)作为缓冲液b。
[0129]
接下来,在含抗体的dpbs溶液中添加0.5m edta(ph8.0),并调整成最终edta浓度为5mm。然后,将最终抗体浓度成为1mg/ml的液量定为反应液总量,将其中1/6量的缓冲液b
与抗体溶液混合,最后,以缓冲液a将最终抗体浓度调整成1mg/ml。
[0130]
将该还原反应用混合液,使用恒温槽在37℃下预保温15分钟。然后添加混合液总量的1/100的还原剂(2-巯基乙胺-hcl溶液,sigma-aldrich公司制,终浓度20mm),使用恒温槽在37℃下保温30分钟。
[0131]
反应结束后,迅速将样品移至冰上,使用vivaspin turbo15(sartorius公司制,gottingen,germany),以缓冲液a进行缓冲液置换,进行还原剂的除去。缓冲液置换可重复至将原本的反应液稀释100万倍以上。
[0132]
接下来,将抗体溶液最终浓度成为0.5mg/ml的液量定为反应液总量,将其中1/6量的缓冲液b、含有被还原的抗体的抗体溶液、由变成游离的硫醇基作计算的必要量的3倍摩尔量的接头dxd(medchemexpress公司,制品型号:hy-13631e,商品名:deruxtecan)混合,并通过缓冲液a调整成抗体最终浓度为0.5mg/ml。将混合液通过颠倒混合来和缓地搅拌,然后在4℃下静置18小时。
[0133]
此外,接头dxd是由下述式表示的化合物。
[0134][0135]
最后,再度使用vivaspin turbo 15,以dpbs进行缓冲液置换。在此缓冲液置换的过程中,也可重复至将原本的反应液稀释100万倍以上。
[0136]
以此方式制备出的adc,在无菌条件下使用pvdf膜0.22μm过滤单元来进行过滤处理,然后以灭菌后的dpbs调整成抗体浓度为2mg/ml,并进行分注,到使用时为止冷冻保存于-80℃。冷冻只有这一次,解冻后迅速使用于各实验。
[0137]
(hu1084-dxd8的制作)
[0138]
除了将还原反应用混合液的预保温温度定为26℃,将添加至该混合液的还原剂定为dl-dtt溶液(sigma-aldrich公司制,终浓度35mm),并将该添加后的保温温度定为26℃之外,与前述(hu1084-dxd3的制备)所记载的方法同样地制备出adc。
[0139]
[hu1084-peg12-mmae3的制作]
[0140]
除了使用下述接头peg12-mmae(mal-peg12-vc-pabc-mmae,由日本国立研究开发法人理化学研究所的真锅史乃博士提供)来代替接头dxd之外,与前述(hu1084-dxd3的制备)所记载的方法同样地制备出adc。此外,接头peg12-mmae是由下述式表示的化合物。
[0141][0142]
[hu1084-peg12-mmae8的制作]
[0143]
除了使用前述接头peg12-mmae来代替接头dxd之外,与前述(hu1084-dxd8的制作)所记载的方法同样地制备出adc。
[0144]
[hu1084-mmae3的制作]
[0145]
除了使用下述接头mmae(mal-vc-pabc-mmae,商品名:vcmmae,制造商:medchemexpress,型号:hy-15575)来代替接头dxd之外,与前述(hu1084-dxd3的制备)所记载的方法同样地制备出adc。此外,接头mmae是由下述式表示的化合物。
[0146][0147]
[hu1084-mmae8的制作]
[0148]
除了使用前述接头mmae来代替接头dxd之外,与前述(hu1084-dxd8的制作)所记载的方法同样地制备出adc。
[0149]
此外,这些adc中的接头和药物相对于每个抗体的平均结合数(dar),是使用比色定量硫醇基的试剂dtnb(5,5
’‑
二硫双(2-硝基苯甲酸),5,5
’‑
dithiobis(2-nitrobenzoic acid))来进行。即,分别在利用还原剂进行抗体还原之后以及添加接头化合物之后添加该试剂。然后,通过测定吸光度(λmax=412nm)来定量游离的硫醇基。然后,根据前述还原后与添加后的游离的硫醇基数目计算出dar。
[0150]
[杀细胞效果]
[0151]
对于上述制备出的adc,依照以下方法来评估在体外对人胰腺癌细胞的杀细胞效果。
[0152]
培养液使用添加了10%牛胎儿血清及青霉素-链霉素-氨苄青霉素b(
×
100)悬浮液的rpmi-1640。将人胰腺癌bxpc-3、psn-1及hpaf-ii分别调整成5000细胞/ml、2000细胞/ml及5000细胞/ml,以100μl/孔接种至96孔板,在co2保温箱内(37℃)静置一晚。
[0153]
以培养液将各adc、dxd单剂及mmae单剂调整成终浓度(mmae及dxd换算)0.1、0.3、1、3、10、30、100nm等,以100μl/孔添加至各接种了人胰腺癌的96孔板后,在co2保温箱内(37
℃)静置6天。然后,以抽吸器将含有药剂的培养液除去,通过cell counting kit-8(同仁化学公司制),依照附属的实验手册进行活细胞数的测定。试剂的反应时间定为3小时,吸光度的测定是通过spectramax paradigm(molecular devices公司制)来进行。将杀细胞效果的结果表示于图1a~1e。
[0154]
由图1a所示的结果可知,mmae、hu1084-peg12-mmae3、hu1084-peg12-mmae8、dxd、hu1084-dxd3、及hu1084-dxd8对bxpc-3的ic50值分别为0.62
±
0.04nm、0.05
±
0.00nm、0.05
±
0.00nm、2.58
±
0.26nm、0.27
±
0.02nm、及0.20
±
0.01nm。
[0155]
由图1b所示的结果可知,mmae、hu1084-peg12-mmae3、hu1084-peg12-mmae8、dxd、hu1084-dxd3、及hu1084-dxd8对psn-1的ic50值分别为0.73
±
0.04nm、6.29
±
1.04nm、0.35
±
0.12nm、7.92
±
0.84nm、n.d.、及n.d.。
[0156]
另外,由图1c~1f所示的结果可知,在三种人胰腺癌细胞的细胞株之中,游离态mmae的ic50值比游离态dxd低30~50倍。即,mmae对这些人胰腺癌细胞株的杀细胞效果显著较高。另外,包含这些药剂的各adc之中,也是mmae的杀细胞效果高了数倍。
[0157]
如以上所述,在任一种人胰腺癌细胞之中,由mmae接头(接头peg12-mmae或接头mmae)及抗组织因子抗体所形成的缀合物,皆显示出比由接头dxd及抗组织因子抗体所形成的缀合物还高的杀细胞效果,尤其在hu1084-dxd3及hu1084-dxd8的情况,对于psn-1求得ic50都没有达成(皆为n.d.)。
[0158]
[抗肿瘤效果]
[0159]
(患者肿瘤组织移植(pdx)模型的制作)
[0160]
接下来,对于各adc,依照以下的方法评估在体内对人胰癌细胞的抗肿瘤效果。
[0161]
在所有的实验中,使用了驯化1周的5周龄裸小鼠(balb/c nu/nu,雌性,日本charles river)。将3~5mm见方的人胰肿瘤组织片(型号:pan-02-jck、pan-04-jck、pan-08-jck、pan-14-jck(实验动物中央研究所))移植至各裸小鼠的皮下,并将所形成的肿瘤定为passage1(p1)。此外,各人胰肿瘤组织来源不同(各罹患胰肿瘤的人)。将p1肿瘤切碎,修整成3~5mm见方,并移植至小鼠皮下,得到p2肿瘤。重复此操作,进行肿瘤的传代。抗肿瘤效果的检讨使用了p4~p6。
[0162]
(免疫组织化学染色)
[0163]
通过过度麻醉让小鼠安乐死之后,迅速将肿瘤组织摘出,包埋于冰冻切片包埋剂(oct compound)中,并在-80℃下冷冻保存。使用冷冻切片机将6μm的肿瘤组织制成薄切片,贴附于载玻片上,并且风干30分钟。通过4%多聚甲醛(pfa)-dpbs溶液在室温下进行固定处理15分钟,以dpbs洗涤后,以3%过氧化氢甲醇溶液在室温下处理30分钟,进行内源性过氧化物酶的钝化。然后以dpbs洗涤,并通过5%脱脂牛乳-dpbs溶液在室温下进行封闭处理1小时。同样地以dpbs洗涤,将来自山羊的抗组织因子多克隆抗体(r&d systems公司)以5%脱脂牛乳溶液进行1/500稀释,并使其在室温下反应1小时。以dpbs洗涤后,将hrp标识抗山羊多克隆抗体(mbl公司制)以5%脱脂牛乳溶液进行1/500稀释,并使其在室温下反应1小时。以dpbs洗涤后,使二氨基联苯胺(dab)在室温下反应3分钟,再度以dpbs洗涤,在室温下利用苏木精溶液进行核染色10分钟。以流水洗涤10分钟让颜色分明,并利用乙醇及二甲苯来进行脱水、透明处理。最后,将盖玻片盖上,并使用mount-quick(封片胶)来进行组织的封入。观察是使用了virtual slide system(olympus公司制)来进行。将染色的结果表示于图2a
~2c、图3d及3e。
[0164]
如图2a~2c所示般,在胰癌pdx模型的三例(no,2、4及8)之中,确认了组织因子的表达。任一个模型皆观察到一部分组织因子阴性的癌细胞集团,为组织因子的表达不均匀的肿瘤。另外,如图3e所示般,no,14也与前述三例同样地,为组织因子的表达不均匀的肿瘤。尤其胰癌pdx模型no,8及no,14,与no,2及4相比,为组织因子的表达水平较低、而且其表达更不均匀的肿瘤,不表达组织因子的癌在全体当中存在50%或其以上。
[0165]
(使用pdx模型的治疗实验)
[0166]
在pdx模型的平均肿瘤大小成为200~300mm3的时间点,随机进行小鼠的分组,在各施与组通过尾静脉施与开始治疗实验。将各adc以10mg/kg每周施与1次,合计3次,并且每周进行1次肿瘤大小与体重的测定。肿瘤大小是使用电动光标尺来测定皮下肿瘤的长径与短径,并由“肿瘤的长径
×
短径
×
短径
×
1/2”来计算。在肿瘤大小超过2000mm3的时间点,或在肿瘤部观察到溃疡等的时间点,以人道终点来考虑,则利用异氟醚的过度麻醉来进行小鼠的安乐死。n数定为3~4。另外还制作出施与dpbs来代替adc的小鼠以作为阴性对照组。
[0167]
如图3a~c所示般,在任一个pdx模型之中,皆与上述体外的结果相反,在施与由接头dxd及抗组织因子抗体形成的缀合物的情况下,观察到肿瘤退缩或肿瘤增殖抑制效果。
[0168]
另一方面,在施与由mmae接头(接头peg12-mmae或接头mmae)及抗组织因子抗体形成的缀合物的情况下,如图3c所示,对移植了人胰脏肿瘤组织片pan-08-jck的pdx模型no.8施与hu1084-peg12-mmae8时,观察到肿瘤增殖抑制效果。另外,如图3f所示,对移植了人胰脏肿瘤组织片pan-14-jck的pdx模型no.14施与hu1084-mmae3时,观察到肿瘤增殖抑制效果。然而,其效果的程度,与施与由接头dxd及抗组织因子抗体形成的缀合物的情况相比为较差。
[0169]
这样,判明了由抗组织因子抗体及接头dxd形成的adc,在体内对癌发挥出高的肿瘤退缩或肿瘤增殖抑制效果。尤其令人惊讶地观察到了一部分组织因子阴性的癌细胞集团,即使对于组织因子表达不均匀的肿瘤,前述adc显示出高肿瘤增殖抑制效果等。
[0170]
发挥出这样的效果的理由未必确定,而本发明者们推测如下。即,推测dxd的疏水性高,即使在以adc的形式攻击了组织因子阳性的癌细胞之后,也会以游离状态被释放到细胞外,并通过邻接的组织因子阴性癌细胞的细胞膜。然后,容易侵入细胞内,能够将该癌细胞也杀死(旁观者效应)。在体内形成的固体癌几乎在组织因子的表达方面都是异质的癌组织,由此强烈暗示了由抗组织因子抗体及接头dxd形成的adc的有效性。
[0171]
此外,虽然图中并未表示,在使用接头mmae的情况下,与图3a~3c所示的接头peg12-mmae及接头dxd不同,dar为3的情况的肿瘤增殖抑制效果比dar为8的情况还高。另外,在所有的治疗实验中,并未观察到adc施与组有显著的体重减少。
[0172]
[表面等离子体共振分析]
[0173]
通过表面等离子体共振(spr、制品名:biacore t200(ge healthcare公司制))来分析人源化1084抗体的解离常数及结合常数。
[0174]
具体而言,首先将1mg/ml的重组人组织因子抗原添加至10mm醋酸钠液(ph5.0)中,并调整成最终浓度为20μg/ml。接下来,将接触时间设定在120秒,在cm5感应芯片(ge healthcare公司制)上通过氨基偶联法使前述抗原固相化。另一方面,将人源化1084抗体以hbs-n溶液(ge healthcare公司制)进行溶液置换,将抗体浓度调整成320nm、160nm、80nm、
40nm及20nm。然后,使用这些稀释抗体,通过循环动力学(single-cycle kinetics)测定抗体的结合动力学。此外,抗体的接触时间与解离测定时间分别设定为120秒与600秒。传感图的分析是通过1:1结合来进行。将所得到的结果揭示于表2。
[0175]
[表2]
[0176][0177]
产业上的可利用性
[0178]
如以上说明般,依据本发明,可提供一种在生物体内发挥出抗肿瘤效果的、包含抗组织因子抗体和细胞毒剂的抗体-药物缀合物。所以,本发明在抗癌剂的开发及癌的治疗等方面是有用的。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。