1.本发明涉及氨基酸介导的基因递送及其用途。
背景技术:
2.许多中枢神经系统疾病与异常基因表达相关。在过去几十年中,基因疗法已经成为治疗各种中枢神经系统疾病的重要手段。然而,用于将基因递送到中枢神经系统中的安全且有效的策略是非常有限的。目前,基因治疗中基因递送的主要方法通常使用病毒载体,然而病毒作为天然存在病原体,其在基因治疗中具有一系列潜在风险。此外,几种反义寡核苷酸药物已经用于治疗神经退行性疾病神经退行性疾病,然而反义寡核苷酸药物在中枢神经系统中的递送效率依然有限且缺乏细胞特异性,因而往往需要长时间重复高剂量给药以进行有效治疗。尽管其他非病毒载体(例如阳离子聚合物、脂质体、无机纳米载体等)已经引起广泛关注,但是由于血脑屏障和脑组织的异质性,通过这些非病毒载体实现高效率和低细胞毒性的治疗仍然具有挑战性。因此,开发新的递送策略,例如核酸材料的新载体,对于神经障碍的治疗,特别是对于神经退行性疾病神经退行性疾病的基因治疗具有重要意义。
3.许多神经系统疾病与基因的异常表达有关,基因疗法为这些神经系统疾病的治疗带来了曙光。近年来,越来越多的研究发现星形胶质细胞功能障碍可引起一系列中枢神经系统疾病。因而,星形胶质细胞的功能和相关疾病之间的关系已经受到研究者们广泛的关注。
4.目前,中枢神经系统中基因递送的主要方法是使用病毒载体。然而,病毒载体的若干缺陷限制了它们在神经系统疾病治疗中的应用,特别是在临床中,例如有限的外源基因装载能力,以及强烈的免疫原性和潜在的致癌风险等。因此,非病毒基因递送方法的开发已成为中枢神经系统基因递送的重要研究方向。目前使用的非病毒方法通常具有低递送效率、高细胞毒性和缺乏细胞类型特异性等缺点。寻找可以满足高递送效率、低细胞毒性和细胞类型特异性的基于非病毒的载体对基因治疗具有迫切需要。
技术实现要素:
6.本发明聚焦于提高核酸材料(例如寡核苷酸或质粒载体)向脑组织中的递送效率。通过局部注射,优选地,与立体定位注射、免疫荧光染色、共聚焦显微镜等手段组合,单链寡核苷酸被有效地递送到脑细胞中,并且质粒载体也被递送到小鼠脑中的星形胶质细胞中。并且使用这些策略,我们已经实现了体内星形胶质细胞中基因的敲除和敲入。本发明首先发现氨基酸可以直接用作将核酸递送到活生物体的组织或器官,特别是中枢神经系统中。
7.首先,本发明提供一种用于递送至活生物体中的递送系统,其中所述递送系统包含氨基酸及核酸。
8.核酸选自寡核苷酸和质粒。寡核苷酸可以是短长度的单链dna、rna,例如反义rna和sirna。
9.优选地,递送系统包含氨基酸和一种或多种质粒。
10.优选地,氨基酸是甘氨酸、γ-氨基丁酸(gaba)、脯氨酸、丙氨酸、丝氨酸、天冬酰胺、谷氨酰胺、肌氨酸、瓜氨酸、羟基脯氨酸、铃兰氨酸、甜菜碱、亚牛磺酸、组氨酸或苏氨酸。氨基酸可以是l-型或d-型。优选地,氨基酸是l-脯氨酸、d-丙氨酸、l-丝氨酸、l-谷氨酰胺、d-谷氨酰胺、甘氨酸、γ-氨基丁酸(gaba)、l-组氨酸或l-苏氨酸。氨基酸可以是以氨基酸为基本单元组成的肽类。优选地,肽类是双甘甘肽或n-l-亮氨酰甘氨酸。
11.在递送之前,将核酸溶解在包含氨基酸的溶液中。或者,分别递送核酸和氨基酸溶液。
12.本发明的递送系统可以直接递送到活生物体的组织或器官中。活生物体包括但不限于植物和动物。动物是无脊椎动物或脊椎动物。优选地,动物是鸟、鸡、鸭、鹅。优选地,动物是哺乳动物,例如小鼠、大鼠、猫、兔、犬、马、牛、绵羊、山羊、猪、树鼩、猴、黑猩猩、人类等。
13.优选地,组织或器官是中枢神经系统,包括脑和脊髓。
14.脑涉及但不限于中脑、丘脑、下丘脑、脑干、小脑、外侧苍白球、大脑皮层和海马。
15.优选地,本发明的递送系统可以经由本发明的递送系统直接递送到中脑、丘脑、下丘脑、脑干、小脑、外侧苍白球、大脑皮层和海马内的星形胶质细胞中。
16.优选地,本发明的递送系统可以经由本发明的递送系统直接进入小脑内的伯格曼胶质细胞(bergmann glia)、velate星形胶质细胞(velate astrocyte)和篮状/星状中间能神经元(basket/stellate interneuron)。
17.优选地,星形胶质细胞通过本发明的递送系统摄取质粒具有浓度依赖性。递送系统的溶液中氨基酸的浓度可高达300mm。优选地,递送系统的溶液中氨基酸的浓度在50mm-300mm的范围内。
18.优选地,甘氨酸特异性地促进星形胶质细胞摄取质粒载体。优选地,gaba特异性地促进星形胶质细胞摄取质粒载体。
19.浓度为300mm的甘氨酸溶液的渗透压大致等于生理盐水的渗透压,并且溶液的渗透压与浓度成比例。在本发明中,确定了不同浓度的甘氨酸溶液的ph值保持稳定并维持在ph=6左右。
20.类似地,l-脯氨酸、d-丙氨酸、l-丝氨酸、l-谷氨酰胺、d-谷氨酰胺、l-组氨酸和l-苏氨酸的溶液都促进星形胶质细胞摄取质粒载体。
21.优选地,除了氨基酸之外,本发明的递送系统还包含氨基酸转运蛋白的选择性抑制剂。例如,星形胶质细胞通过包含甘氨酸和比托哌汀(bitopertin,甘氨酸转运蛋白1的选择性抑制剂)的递送系统摄取质粒的效率比只包含甘氨酸的递送系统高3-4倍。
22.本发明的递送系统有效地将携带crispr/cas9系统的超大质粒载体递送至星形胶质细胞,并成功地敲除转基因小鼠基因组的基因。
23.本发明的递送系统还成功地将外源基因敲入星形胶质细胞基因组中以实现外源基因的永久表达。
24.同时,piggybac转座子系统用于成功地将外源基因egfp整合到星形胶质细胞基因组中以实现外源基因的永久表达。
25.本发明的递送系统可以促进多种质粒载体的有效共转染,而无需使用特异性启动子、病毒载体和转基因小鼠。优选地,本发明的递送系统可以实现两种或三种质粒载体向星形胶质细胞中的有效共转染。
26.本发明的递送系统可用于基因治疗,用于治疗神经系统疾病,特别是中枢神经系统疾病。例如,所述疾病可以是神经退行性疾病,包括阿尔茨海默病(ad)、帕金森病(pd)、亨廷顿病(hd)、肌萎缩性侧索硬化(als)和脊髓小脑共济失调。所述疾病可以是神经遗传疾病,例如先天性脊髓性肌萎缩症。所述疾病可以是脑和/或脊髓中的肿瘤,例如神经胶质瘤。
27.多个质粒载体的有效共转染为同时操纵多个基因在星形胶质细胞中的表达提供了有力的工具。
28.其次,本发明提供了氨基酸作为将核酸递送到活生物体中的媒介的用途。
29.核酸选自寡核苷酸和质粒。寡核苷酸可以是短长度的单链dna、rna,例如反义rna和sirna。
30.优选地,递送媒介是包含氨基酸的溶液。
31.优选地,本发明的递送媒介可以同时递送一种或多种质粒。
32.优选地,氨基酸是甘氨酸、γ-氨基丁酸(gaba)、脯氨酸、丙氨酸、丝氨酸、天冬酰胺、谷氨酰胺、肌氨酸、瓜氨酸、羟基脯氨酸、铃兰氨酸、甜菜碱、亚牛磺酸、天冬酰胺、谷氨酰胺、肌氨酸、瓜氨酸、羟基脯氨酸、铃兰氨酸、甜菜碱、亚牛磺酸、组氨酸或苏氨酸。氨基酸可以是l-型或d-型。优选地,氨基酸是l-脯氨酸、d-丙氨酸、l-丝氨酸、l-谷氨酰胺、d-谷氨酰胺、l-谷氨酰胺、d-谷氨酰胺、甘氨酸、γ-氨基丁酸(gaba)、l-组氨酸或l-苏氨酸。氨基酸可以是以氨基酸为基本单元组成的肽类。优选地,肽类是双甘甘肽或n-l-亮氨酰甘氨酸。氨基酸可以是以氨基酸为基本单元组成的肽类。优选地,肽类是双甘甘肽或n-l-亮氨酰甘氨酸。
33.在递送之前,将核酸溶解在包含氨基酸的溶液中。或者,分别递送核酸和氨基酸溶液。
34.核酸可以直接递送到活生物体的组织或器官中。活生物体包括但不限于植物和动物。动物是无脊椎动物或脊椎动物。优选地,动物是鸟、鸡、鸭、鹅。优选地,动物是哺乳动物,例如小鼠、大鼠、猫、兔、犬、马、牛、绵羊、山羊、猪、树鼩、猴、黑猩猩、人类等。
35.优选地,组织或器官是中枢神经系统,包括脑和脊髓。
36.脑涉及但不限于中脑、丘脑、下丘脑、脑干、小脑、外侧苍白球、大脑皮层和海马。
37.优选地,可以通过本发明的载体将核酸直接递送到中脑、丘脑、下丘脑、脑干、小脑、外侧苍白球、大脑皮层和海马内的星形胶质细胞中。
38.优选地,可以通过本发明的载体将核酸直接递送到小脑内的伯格曼胶质细胞(bergmann glia)、velate星形胶质细胞(velate astrocyte)和篮状/星状中间能神经元(basket/stellate interneuron)中。
39.优选地,星形胶质细胞通过本发明的载体摄取质粒是浓度依赖性的。氨基酸的浓度可以高达300mm。优选地,氨基酸的浓度在50mm-300mm的范围内。
40.优选地,甘氨酸特异性地促进质粒载体的星形胶质细胞摄取。优选地,gaba特异性地促进质粒载体的星形胶质细胞摄取。
41.浓度为300mm的甘氨酸溶液的渗透压大致等于生理盐水的渗透压,并且溶液的渗透压与浓度成比例。在本发明中,确定了不同浓度的甘氨酸溶液的ph值保持稳定并维持在ph=6左右。
42.类似地,l-脯氨酸、d-丙氨酸、l-丝氨酸、l-谷氨酰胺、d-谷氨酰胺、l-组氨酸和l-苏氨酸的溶液都促进星形胶质细胞摄取质粒载体。
43.优选地,本发明的载体还包含氨基酸转运蛋白的选择性抑制剂。例如,星形胶质细胞通过包含甘氨酸和比托哌汀(bitopertin,甘氨酸转运蛋白1的选择性抑制剂)构成的递送媒介摄取质粒的效率比仅含有甘氨酸的递送媒介高3-4倍。
44.本发明的载体有效地将携带crispr/cas9系统的超大质粒递送至星形胶质细胞,并成功地敲除转基因小鼠基因组的基因。
45.本发明的载体还成功地将外源基因敲入星形胶质细胞基因组以实现外源基因的永久表达。
46.本发明的载体可以促进多种质粒载体的有效共转染,而无需特异性启动子、病毒载体和转基因小鼠。优选地,本发明的递送系统可以实现两种或三种质粒载体向星形胶质细胞中的有效共转染。
47.多个质粒载体的有效共转染为同时操纵多个基因在星形胶质细胞中的表达提供了有力的工具。
48.本发明的载体可用于治疗神经系统疾病,尤其是中枢神经系统疾病的基因治疗。例如,所述疾病可以是神经退行性疾病,包括阿尔茨海默病(ad)、帕金森病(pd)、亨廷顿病(hd)、肌萎缩性侧索硬化(als)和脊髓小脑共济失调。所述疾病可以是神经遗传疾病,例如先天性脊髓性肌萎缩症。所述疾病可以是脑和/或脊髓中的肿瘤,特别是例如神经胶质瘤。
49.多个质粒载体的有效共转染为同时操纵多个基因在星形胶质细胞中的表达提供了有力的工具。
50.第三,本发明提供了通过使用氨基酸作为媒介将核酸递送到活生物体中的方法。
51.核酸选自寡核苷酸和质粒。寡核苷酸可以是短长度的单链dna、rna,例如反义rna和sirna。
52.优选地,递送媒介是包含氨基酸的溶液。
53.优选地,本发明的递送系统可以同时递送一种或多种质粒。
54.在递送之前,将核酸溶解在包含氨基酸的溶液中。或者,分别递送核酸和氨基酸溶液。
55.优选地,氨基酸是甘氨酸、γ-氨基丁酸(gaba)、脯氨酸、丙氨酸、丝氨酸、天冬酰胺、谷氨酰胺、肌氨酸、瓜氨酸、羟基脯氨酸、铃兰氨酸、甜菜碱、亚牛磺酸、组氨酸或苏氨酸。氨基酸可以是l-型或d-型。优选地,氨基酸是l-脯氨酸、d-丙氨酸、l-丝氨酸、l-谷氨酰胺、d-谷氨酰胺、甘氨酸、γ-氨基丁酸(gaba)、l-组氨酸或l-苏氨酸。氨基酸可以是以氨基酸为基本单元组成的肽类。优选地,肽类是双甘甘肽或n-l-亮氨酰甘氨酸。
56.核酸可以直接递送到活生物体的组织或器官中。活生物体包括但不限于植物和动物。动物是无脊椎动物或脊椎动物。优选地,动物是鸟、鸡、鸭、鹅。优选地,动物是哺乳动物,例如小鼠、大鼠、猫、兔、犬、马、牛、绵羊、山羊、猪、树鼩、猴、黑猩猩、人类等。
57.优选地,组织或器官是中枢神经系统,包括脑和脊髓。
58.脑涉及但不限于中脑、丘脑、下丘脑、脑干、小脑、外侧苍白球、大脑皮层和海马。
59.优选地,可以通过本发明的载体将核酸直接递送到中脑、丘脑、下丘脑、脑干、小脑、外侧苍白球、大脑皮层和海马内的星形胶质细胞中。
60.优选地,可以通过本发明的载体将核酸直接递送到小脑内的伯格曼胶质细胞(bergmann glia)、velate星形胶质细胞(velate astrocyte)和篮状/星状中间神经元
(basket/stellate interneuron)中。
61.优选地,星形胶质细胞通过本发明的载体摄取质粒是浓度依赖性的。氨基酸的浓度可以高达300mm。优选地,氨基酸的浓度在50mm-300mm的范围内。
62.优选地,甘氨酸特异性地促进质粒载体的星形胶质细胞摄取。优选地,gaba特异性地促进质粒载体的星形胶质细胞摄取。
63.浓度为300mm的甘氨酸溶液的渗透压大致等于生理盐水的渗透压,并且溶液的渗透压与浓度成比例。在本发明中,确定了不同浓度的甘氨酸溶液的ph值保持稳定并维持在ph=6左右。
64.类似地,l-脯氨酸、d-丙氨酸、l-丝氨酸、l-谷氨酰胺、d-谷氨酰胺、l-组氨酸和l-苏氨酸的溶液都促进星形胶质细胞摄取质粒载体。
65.优选地,本发明的递送媒介还包含氨基酸转运蛋白的选择性抑制剂。例如,星形胶质细胞通过包含甘氨酸和比托哌汀(bitopertin,甘氨酸转运蛋白1的选择性抑制剂)的递送媒介摄取质粒的效率比仅仅含有甘氨酸的递送媒介高3-4倍。
66.本发明的载体有效地将携带crispr/cas9系统的超大质粒载体递送至星形胶质细胞,并成功地敲除转基因小鼠基因组的基因。
67.本发明的载体还成功地将外源基因敲入星形胶质细胞基因组以实现外源基因的永久表达。
68.本发明的载体可以促进多种质粒载体的有效共转染,而不使用特异性启动子、病毒载体和转基因小鼠。优选地,本发明的递送系统可以实现两种或三种质粒载体向星形胶质细胞中的有效共转染。
69.多个质粒载体的有效共转染为同时操纵多个基因在星形胶质细胞中的表达提供了有力的工具。
70.第四,本发明首先提供了递送系统用于将核酸递送到活生物体中的用途。
71.核酸选自寡核苷酸和质粒。寡核苷酸可以是短长度的单链dna、rna,例如反义rna和sirna。
72.优选地,递送系统包含氨基酸和一种或多种质粒。
73.在递送之前,将核酸溶解在包含氨基酸的溶液中。或者,分别递送核酸和氨基酸溶液。
74.优选地,氨基酸是甘氨酸、γ-氨基丁酸(gaba)、脯氨酸、丙氨酸、丝氨酸、天冬酰胺、谷氨酰胺、肌氨酸、瓜氨酸、羟基脯氨酸、铃兰氨酸、甜菜碱、亚牛磺酸、组氨酸或苏氨酸。氨基酸可以是l-型或d-型。优选地,氨基酸是l-脯氨酸、d-丙氨酸、l-丝氨酸、l-谷氨酰胺、d-谷氨酰胺、甘氨酸、γ-氨基丁酸(gaba)、l-组氨酸或l-苏氨酸。氨基酸可以是以氨基酸为基本单元组成的肽类。优选地,肽类是双甘甘肽或n-l-亮氨酰甘氨酸。
75.本发明的递送系统可以直接递送到活生物体的组织或器官中。活生物体包括但不限于植物和动物。动物是无脊椎动物或脊椎动物。优选地,动物是鸟、鸡、鸭、鹅。优选地,动物是哺乳动物,例如小鼠、大鼠、猫、兔、犬、马、牛、绵羊、山羊、猪、树鼩、猴、黑猩猩、人类等。
76.优选地,组织或器官是中枢神经系统,包括脑和脊髓。
77.脑涉及但不限于中脑、丘脑、下丘脑、脑干、小脑、外侧苍白球、大脑皮层和海马。
78.优选地,本发明的递送系统可以经由本发明的递送系统直接递送到中脑、丘脑、下
丘脑、脑干、小脑、外侧苍白球、大脑皮层和海马内的星形胶质细胞中。
79.优选地,本发明的递送系统可以经由本发明的递送系统直接进入小脑内的伯格曼胶质细胞(bergmann glia)、velate星形胶质细胞(velate astrocyte)和篮状/星状中间能神经元(basket/stellate interneuron)。
80.优选地,星形胶质细胞通过本发明的递送系统摄取质粒具有浓度依赖性。递送系统溶液中氨基酸的浓度可高达300mm。优选地,递送系统的溶液中氨基酸的浓度在50mm-300mm的范围内。
81.优选地,甘氨酸特异性地促进质粒载体的星形胶质细胞摄取。优选地,gaba特异性地促进质粒载体的星形胶质细胞摄取。
82.类似地,l-脯氨酸、d-丙氨酸、l-丝氨酸、l-谷氨酰胺、d-谷氨酰胺、l-组氨酸和l-苏氨酸的溶液都促进星形胶质细胞摄取质粒载体。
83.优选地,除了氨基酸之外,本发明的递送系统还包含氨基酸转运蛋白的选择性抑制剂。例如,星形胶质细胞通过包含甘氨酸和比托哌汀(bitopertin,甘氨酸转运蛋白1的选择性抑制剂)的递送系统摄取质粒的效率比包只含甘氨酸的递送系统高3-4倍。
84.本发明的递送系统有效地将携带crispr/cas9系统的超大质粒递送至星形胶质细胞,并成功地敲除转基因小鼠基因组的基因。
85.本发明的递送系统还成功地将外源基因敲入星形胶质细胞基因组中以实现外源基因的永久表达。
86.本发明的递送系统可以促进多种质粒载体的有效共转染,而不使用特异性启动子、病毒载体和转基因小鼠。优选地,本发明的递送系统可以实现两种或三种质粒载体向星形胶质细胞中的有效共转染。
87.多个质粒载体的有效共转染为同时操纵多个基因在星形胶质细胞中的表达提供了有力的工具。
88.本发明的递送系统可用于基因治疗,用于治疗神经系统疾病,特别是中枢神经系统疾病。例如,所述疾病可以是神经退行性疾病,例如癫痫、阿尔茨海默病(ad)、帕金森病(pd)、亨廷顿病(hd)、肌萎缩性侧索硬化(als)和脊髓小脑性共济失调。所述疾病可以是神经遗传疾病,例如先天性脊髓性肌萎缩症。所述疾病可以是脑和/或脊髓中的肿瘤。
89.第五,本发明首先提供了递送系统在基因治疗中用于治疗神经系统疾病,特别是中枢神经系统疾病的用途。例如,所述疾病可以是神经退行性疾病,例如阿尔茨海默病(ad)、帕金森病(pd)、亨廷顿病(hd)、肌萎缩性侧索硬化(als)和脊髓小脑共济失调。所述疾病可以是神经遗传疾病,例如先天性脊髓性肌萎缩症。所述疾病可以是脑和/或脊髓中的肿瘤,例如神经胶质瘤。
90.本发明的递送系统可以直接递送到动物的神经系统,特别是中枢神经系统中。动物是无脊椎动物或脊椎动物。优选地,动物是鸟、鸡、鸭、鹅。优选地,动物是哺乳动物,例如小鼠、大鼠、猫、兔、犬、马、牛、绵羊、山羊、猪、树鼩、猴、黑猩猩、人类等。
91.优选地,神经系统是中枢神经系统,包括脑和脊髓。
92.脑涉及但不限于中脑、丘脑、下丘脑、脑干、小脑、外侧苍白球、大脑皮层和海马。
93.优选地,本发明的递送系统可以经由本发明的递送系统直接递送到中脑、丘脑、下丘脑、脑干、小脑、外侧苍白球、大脑皮层和海马内的星形胶质细胞中。
94.优选地,本发明的递送系统可以经由本发明的递送系统直接进入小脑内的伯格曼胶质细胞(bergmann glia)、velate星形胶质细胞(velate astrocyte)和篮状/星状中间神经元(basket/stellate interneuron)。
95.优选地,星形胶质细胞通过本发明的递送系统摄取质粒具有浓度依赖性。递送系统溶液中氨基酸的浓度可高达300mm。优选地,递送系统的溶液中氨基酸的浓度在50mm-300mm的范围内。
96.优选地,甘氨酸特异性地促进星形胶质细胞摄取质粒载体。优选地,gaba特异性地促进星形胶质细胞摄取质粒载体。
97.浓度为300mm的甘氨酸溶液的渗透压大致等于生理盐水的渗透压,并且溶液的渗透压与浓度成比例。在本发明中,确定了不同浓度的甘氨酸溶液的ph值保持稳定并维持在ph=6左右。
98.类似地,l-脯氨酸、d-丙氨酸、l-丝氨酸、l-谷氨酰胺、d-谷氨酰胺、l-组氨酸和l-苏氨酸的溶液都促进星形胶质细胞摄取质粒载体。
99.优选地,除了氨基酸之外,本发明的递送系统还包含氨基酸转运蛋白的选择性抑制剂。例如,星形胶质细胞通过包含甘氨酸和比托哌汀(bitopertin,甘氨酸转运蛋白1的选择性抑制剂)的递送系统摄取质粒的效率比只包含甘氨酸的递送系统高3-4倍。
100.本发明的递送系统有效地将携带crispr/cas9系统的超大质粒递送至星形胶质细胞,并成功地敲除转基因小鼠基因组的基因。优选地,递送系统是包含甘氨酸的递送系统。
101.本发明的递送系统还成功地将外源基因整合到星形胶质细胞基因组中以实现外源基因的永久表达。
102.特别地,转座子系统被递送到星形胶质细胞中,从而实现外源基因在成年小鼠星形胶质细胞中的永久表达。
103.本发明的递送系统可以促进多种质粒载体的有效共转染,而无需使用特异性启动子、病毒载体和转基因小鼠。优选地,本发明的递送系统可以实现两种或三种质粒载体向星形胶质细胞中的有效共转染。
104.多个质粒载体的有效共转染为同时操纵多个基因在星形胶质细胞中的表达提供了有力的工具。
105.可以根据待治疗的疾病选择通过本发明的递送系统递送到动物神经系统(特别是中枢神经系统)中的基因。
106.第六,本发明提供了用于将crispr/cas9系统递送到中枢神经系统中以便敲除动物中的一种或多种基因的递送系统。特别地,可以将用于递送crispr/cas9系统的递送系统递送到星形胶质细胞中。
107.递送系统包含氨基酸和crispr/cas9系统。
108.crispr/cas9系统在递送前溶解于包含氨基酸的溶液中。或者,crispr/cas9系统和氨基酸溶液分别递送。
109.优选地,氨基酸是甘氨酸、γ-氨基丁酸(gaba)、脯氨酸、丙氨酸、丝氨酸、天冬酰胺、谷氨酰胺、肌氨酸、瓜氨酸、羟基脯氨酸、铃兰氨酸、甜菜碱、亚牛磺酸、组氨酸或苏氨酸。氨基酸可以是l-型或d-型。优选地,氨基酸是l-脯氨酸、d-丙氨酸、l-丝氨酸、l-谷氨酰胺、d-谷氨酰胺、甘氨酸、γ-氨基丁酸(gaba)、l-组氨酸或l-苏氨酸。氨基酸可以是以氨基酸为
基本单元组成的肽类。优选地,肽类是双甘甘肽或n-l-亮氨酰甘氨酸。优选地,氨基酸是甘氨酸。
110.动物是无脊椎动物或脊椎动物。优选地,动物是鸟、鸡、鸭、鹅。优选地,动物是哺乳动物,例如小鼠、大鼠、猫、兔、犬、马、牛、绵羊、山羊、猪、树鼩、猴、黑猩猩、人类等。
111.因此,本发明中用于递送crispr/cas9系统的递送系统可用于肿瘤、神经退行性疾病(例如阿尔茨海默病(ad)、帕金森病(pd)、亨廷顿病(hd)、肌萎缩性侧索硬化(als)和脊髓小脑性共济失调)和神经遗传疾病(例如先天性脊髓性肌萎缩)的基因治疗。肿瘤可以在脑和/或脊髓中,例如神经胶质瘤。
112.第七,本发明提供了用于将转座子系统递送到星形胶质细胞中的递送系统,其中所述递送系统包含氨基酸。
113.将转座子系统递送到星形胶质细胞中,从而实现外源基因在成年小鼠星形胶质细胞中的永久表达。
114.优选地,转座子系统是piggybac转座子系统。可以通过piggybac转座子系统构建用于长期追踪成年小鼠星形胶质细胞的多色标记技术。
115.优选地,氨基酸是甘氨酸、γ-氨基丁酸(gaba)、脯氨酸、丙氨酸、丝氨酸、天冬酰胺、谷氨酰胺、肌氨酸、瓜氨酸、羟基脯氨酸、铃兰氨酸、甜菜碱、亚牛磺酸、组氨酸或苏氨酸。氨基酸可以是l-型或d-型。优选地,氨基酸是l-脯氨酸、d-丙氨酸、l-丝氨酸、l-谷氨酰胺、d-谷氨酰胺、甘氨酸、γ-氨基丁酸(gaba)、l-组氨酸或l-苏氨酸。氨基酸可以是以氨基酸为基本单元组成的肽类。优选地,肽类是双甘甘肽或n-l-亮氨酰甘氨酸。
116.在递送前将转座子质粒溶解在包含氨基酸的溶液中。或者,单独递送转座子质粒和氨基酸溶液。
117.递送系统溶液中氨基酸的浓度可高达300mm。优选地,递送系统的溶液中氨基酸的浓度在50mm-300mm的范围内。
118.第八,本发明提供了用于将表达一种或多种荧光蛋白的一种或多种载体递送到星形胶质细胞中的递送系统。
119.递送系统是包含氨基酸和表达一种或多种荧光蛋白的一种或多种载体的溶液。优选地,载体是质粒。
120.优选地,氨基酸是甘氨酸、γ-氨基丁酸(gaba)、脯氨酸、丙氨酸、丝氨酸、天冬酰胺、谷氨酰胺、肌氨酸、瓜氨酸、羟基脯氨酸、铃兰氨酸、甜菜碱、亚牛磺酸、组氨酸或苏氨酸。氨基酸可以是l-型或d-型。优选地,氨基酸是l-脯氨酸、d-丙氨酸、l-丝氨酸、l-谷氨酰胺、d-谷氨酰胺、甘氨酸、γ-氨基丁酸(gaba)、l-组氨酸或l-苏氨酸。氨基酸可以是以氨基酸为基本单元组成的肽类。优选地,肽类是双甘甘肽或n-l-亮氨酰甘氨酸。优选地,氨基酸是甘氨酸。
121.优选地,递送系统包含两种或三种质粒。荧光蛋白可以是rfp(红色)、yfp或gfp(绿色)或cfp或bfp(蓝色)。
122.本发明通过同时表达两种或三种荧光蛋白成功地构建了用于针对星形胶质细胞的新的“脑彩虹”多色标记技术。
123.本发明的载体和递送系统既有效又安全。
124.l-脯氨酸可诱导大量星形胶质细胞摄取质粒载体并表达绿色荧光蛋白,而高浓度
的l-脯氨酸溶液不会引起脑组织细胞凋亡。
125.星形胶质细胞不仅为神经元提供结构和能量支持,而且在血脑屏障中起重要作用。它们还参与神经元的发育和脑的炎症反应。最近,星形胶质细胞在神经回路中的作用也引起了越来越多的关注。与它们的各种功能相对应,星形胶质细胞在不同的脑区甚至相同的脑区内在形态和结构上可能差异很大。在本发明中,甘氨酸转染系统用于同时表达两种或三种质粒载体。多个质粒载体的有效共转染为同时操纵多个基因在星形胶质细胞中的表达提供了有力的工具。
126.我们还发现,不同星形胶质细胞对不同质粒载体的摄取使得各种荧光蛋白的表达非常不同。使用该结果,我们通过同时表达两种或三种荧光蛋白成功地构建了用于星形胶质细胞的新的“脑彩虹”多色标记技术。与先前的“脑彩虹”策略相比,不需要构建具有特异性启动子的转基因小鼠或病毒载体,这显著降低了多色标记星形胶质细胞所需的经济和时间成本。为研究星形胶质细胞之间以及星形胶质细胞与其他脑细胞之间的相互作用提供了方便和直接的可视化工具。
127.氨基酸是一组有机分子,其由碱性氨基(-nh2)、酸性羧基(-cooh)和每个氨基酸独特的有机r基团(或侧链)组成。当与其他氨基酸连接在一起时,一些氨基酸形成蛋白质。必需氨基酸不能由身体制备,因此它们必须来自食物。9种必需氨基酸是:组氨酸、异亮氨酸、亮氨酸、赖氨酸、甲硫氨酸、苯丙氨酸、苏氨酸、色氨酸和缬氨酸。非必需氨基酸是体内能够产生的氨基酸。非必需氨基酸包括:丙氨酸、精氨酸、天冬酰胺、天冬氨酸、半胱氨酸、谷氨酸、谷氨酰胺、甘氨酸、脯氨酸、丝氨酸和酪氨酸。
128.脑是具有非常复杂的结构和功能的器官。脑组织的不同部分都具有其独特的功能。大脑的不同部分之间的交互的复杂且精确的协调控制许多不同的行为,诸如认知、感觉、运动和情绪。即使在宏观层次结构相似的部分,细胞类型的组成、细胞之间的相互作用和微观水平的分子表达也存在相当大的差异。长期以来,星形胶质细胞通常被认为是一类具有相似形态和功能的细胞类型。然而,近年来,对星形胶质细胞多样性的研究引起了许多关注。
129.树鼩主要分布于南亚、东南亚和中国西南部。它们由于成体体积小、脑体质量比高、繁育周期短、繁育简单和成本低等特点,成为视觉、肝炎病毒感染和神经系统疾病等方面的新兴实验动物,并得到了广泛的研究。
130.小胶质细胞是存在于脑中的先天免疫细胞。越来越多的证据表明,活化的小胶质细胞是多种神经毒性因子的慢性来源,包括tnf、一氧化氮、白细胞介素-1和活性氧物质(ros)。ibal(离子钙结合衔接分子-1)蛋白是小胶质细胞特异性标记蛋白。当脑组织受损时,小胶质细胞增殖,并发生一系列形态学变化。因此,通过ibal蛋白的免疫荧光染色观察小胶质细胞变化通常用于评估脑组织的炎症或损伤。
131.sgrna可以指导核酸内切酶(cas9蛋白)准确切割靶基因序列,因此它具有治疗中枢神经系统疾病的潜力。尽管其具有巨大的应用潜力,但将与crispr/cas9系统相关的基因有效且低毒性地递送至中枢神经系统仍然具有挑战性。目前,成年小鼠脑中的基因编辑主要通过将sgrna递送至靶基因的病毒载体来实现,但这种方法需要构建组成型表达cas9蛋白的转基因小鼠。由于病毒颗粒的大小限制,病毒载体难以装载cas9蛋白这类较大开放阅读框序列(orf)的基因,这显著限制了crispr/cas9系统在中枢神经系统中的应用。同时,由
于病毒载体的固有免疫原性以及crispr-cas9和sgrna的长期表达,容易引起脱靶效应,从而诱导潜在的致癌风险。因此,在中枢神经系统中,通过构建病毒载体或转基因小鼠,使用crispr-cas9系统的基因敲低仍然具有挑战性。
132.转座子。非病毒载体核酸递送由于其方便且直接的制备方法和高生物安全性而在遗传研究和治疗中具有巨大潜力。通过非病毒载体递送的标准质粒dna通常不能整合宿主基因组,因此这些基因载体仅在细胞中瞬时表达。然而,一些遗传性或慢性疾病的治疗需要长期的基因表达。实现外源基因的长期甚至永久稳定表达的方法之一是使用转座子系统,其是可以在载体和宿主基因组之间或基因组内转移的遗传元件。通常,转座酶在转座子的两端识别特异性反向末端重复(ir),并从其原始位置切割转座子元件以将它们重新整合到其他位置。利用转座子的这些特征,在转座子两端的末端重复序列irs之间插入靶基因可以将外源基因整合到宿主基因组中,并实现外源基因的延长或甚至永久表达。
附图说明
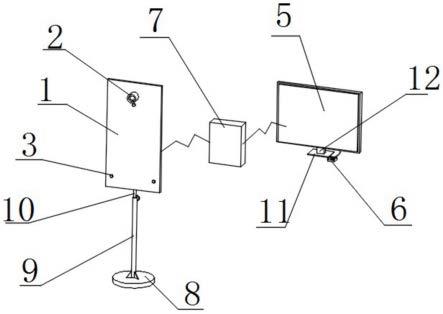
134.图1显示了由氨基酸介导的质粒载体递送的施用方法的示意图。
135.图2显示甘氨酸溶液促进中脑中质粒载体的细胞摄取。
136.图3显示甘氨酸转染策略特异性地促进质粒载体的星形胶质细胞摄取。
137.图4示出了通过转基因小鼠(aldh111-egfp x ai9)对甘氨酸转染策略介导的递送的细胞特异性的验证。
138.图5显示了不同浓度的甘氨酸转染策略的递送效率和组织损伤。
139.图6显示了通过免疫荧光染色的小胶质细胞的变化。
140.图7显示了使用甘氨酸转染策略的质粒载体的细胞摄取效率取决于甘氨酸浓度。
141.图8显示甘氨酸转染策略促进不同脑区中星形胶质细胞摄取质粒载体。
142.图9显示甘氨酸转染策略促进小脑皮层中质粒载体的细胞摄取。
143.图10显示了甘氨酸转染策略在树鼩中的应用。
144.图11显示氨基酸促进星形胶质细胞摄取质粒载体。
145.图12显示l-脯氨酸转染系统促进不同脑区域中星形胶质细胞的质粒摄取。
146.图13显示了l-脯氨酸递送系统对中枢神经系统的安全性的评估。
147.图14显示glyt1选择性抑制剂bitopertin通过甘氨酸转染系统增加质粒载体的摄取效率3-4倍。
148.图15显示甘氨酸转染策略促进两种质粒载体的同时递送。
149.图16显示了使用甘氨酸转染策略同时递送三种质粒载体。
150.图17显示星形胶质细胞细胞体颜色的不同定量。
151.图18显示了通过多色策略可视化的星形胶质细胞的独特“区域”。
152.图19显示l-脯氨酸转染系统促进使用双重质粒载体和三种质粒载体的有效共转染。
153.图20显示了用于敲除eyfp基因的基因靶向载体的构建。
154.图21显示了使用甘氨酸转染策略在星形胶质细胞中大质粒载体的表达。
155.图22显示了通过crispr-cas9系统敲除ai3转基因小鼠的eyfp基因的示意图。
156.图23显示了使用甘氨酸转染策略在星形胶质细胞中有效的eyfp基因敲除。
157.图24显示了通过测序分析验证eyfp基因的敲除。
158.图25显示了通过piggybac转座子系统将外源基因整合到基因组中的示意图。
159.图26显示了通过piggybac转座子系统将egfp基因整合到星形胶质细胞的基因组中。
160.图27显示了在成年小鼠脑的星形胶质细胞中piggybac转座子介导的长期egfp表达。
具体实施方式
162.特定实施例和示例的描述是通过说明而非限制的方式提供的。本领域技术人员将容易地认识到可以改变或修改各种非关键参数以产生基本上类似的结果。
163.实施例
164.实施1:甘氨酸转染系统在小鼠中脑内的质粒传递
165.如图1所示,将表达cre重组酶的质粒(pbt140)溶液(1.5μg/ul)和甘氨酸溶液(300mm)注射到包含cre-loxp系统的ai9小鼠的中脑中。cre重组酶将删除loxp序列之间的翻译终止序列,从而消除终止序列对荧光蛋白tdtomato的表达的抑制(图2a)。
166.5天后,观察到注射部位周围的大量细胞在切片中表达tdtomato。该结果表明,由甘氨酸溶液组成的转染系统可以有效地促进中脑细胞对质粒的摄取,并且没有可见的组织坏死,表明转染系统具有低毒性(图2b)。此外,在高倍显微镜下对表达荧光蛋白的细胞的结构和形态的比较分析显示,在该转染系统下成功转染的所有细胞都是星形胶质细胞。aldh111-egfp转基因小鼠是在星形胶质细胞中特异性表达荧光蛋白(gfp)的报告系。通过比较aldh111-egfp小鼠中的星形胶质细胞和在ai9小鼠中在甘氨酸转染系统中表达的星形胶质细胞,甘氨酸转染系统处于密集表达区域。表达细胞的密度达到67.7%(图2c)。
167.荧光蛋白tdtomato在星形胶质细胞特异性标记的aldh111-egfp转基因小鼠中表达(图3)。通过激光共聚焦显微镜成像分析,发现表达tdtomato的所有细胞都是在aldh111-egfp小鼠中标记的星形胶质细胞,表明甘氨酸溶液特异性地促进星形胶质细胞摄取质粒。
168.如图4a所示,构建了aldh111-egfp小鼠和ai9小鼠的杂交小鼠(aldh111-egfp x ai9),其均在星形胶质细胞中特异性表达egfp,并通过cre重组酶表达荧光蛋白tdtomato。cre重组酶即使在极小或短期表达的情况下也能够切割loxp位点,因此它可以连续表达荧光蛋白tdtoamto,从而消除一些细胞表达弱并且不能准确观察到的问题。将甘氨酸转染系统注射到aldh111-egfp x ai9杂交小鼠中,并且表达tdtomato荧光蛋白的细胞仍然都是星形胶质细胞,这再次证明该转染方法具有细胞特异性(图4b)。
169.示例2。甘氨酸递送系统对中枢神经系统损伤的评价
170.为了评估甘氨酸转染系统是否会对脑组织造成局部或大规模组织损伤,我们使用具有不同甘氨酸浓度的转染系统并在注射后5天观察切片。核损伤是评价细胞毒性的重要机制。当大量细胞死亡和组织坏死时,细胞核将出现浓缩、染色质浓缩和变形以及核碎裂和溶解。
171.如图5所示,300mm的甘氨酸转染系统诱导大量星形胶质细胞的表达。细胞形态正常,未观察到可见的组织坏死。当使用较高浓度的转染系统(500mm和1000mm)时,注射部位周围的大量细胞的细胞核凝聚,并且组织损伤严重。同时,很少的星形胶质细胞被表达,并
且只有少数分散在受损组织周围。这些损伤的原因一方面可能是局部组织中甘氨酸的超高浓度,或者可能是在正常生理条件下甘氨酸转染系统的渗透压超过300mm引起的。相比之下,在300mm甘氨酸转染系统下,细胞转染效率高,并且对脑组织的损伤不明显,表明甘氨酸转染系统既有效又安全。
172.为了评估甘氨酸递送系统是否会导致明显的炎症反应和组织损伤,我们观察了小胶质细胞的变化。小胶质细胞是脑中的先天免疫细胞。越来越多的证据表明,活化的小胶质细胞是多种神经毒性因子的慢性来源,包括tnfα、一氧化氮、白细胞介素-1和活性氧物质(ros)。
173.为了评估甘氨酸转染系统是否会激活小胶质细胞,我们使用小胶质细胞特异性标记蛋白ibal进行荧光免疫染色。如图6a、6b和6c所示,在注射路径周围的有限区域(约100μm)中存在小胶质细胞活化和细胞增殖,而在远离注射路径的区域中,尽管也存在大量星形胶质细胞表达tdtomato,但小胶质细胞未被显著活化(图6d),表明由脑组织中的注射电极引起的机械损伤引起一定程度的炎症反应,这继而活化小胶质细胞。相反,甘氨酸转染系统不引起显著的炎症反应和组织损伤。
174.示例3。星形胶质细胞摄取甘氨酸浓度依赖性质粒
175.将等体积的300mm、200mm、100mm和50mm的甘氨酸转染系统注射到小鼠的中脑组织中。5天后,通过激光共聚焦显微镜和imagej软件分析荧光蛋白的表达。如图7a和7b所示,当甘氨酸浓度降低时,质粒载体上星形胶质细胞的摄取效率显著降低。当使用50mm浓度的甘氨酸时,只有少数星形胶质细胞摄取并表达绿色荧光蛋白(egfp)。
176.此外,将质粒载体pbt140(表达cre重组酶)注射到ai9转基因小鼠的中脑中,并通过imagej软件计数表达荧光蛋白tdtomato的星形胶质细胞。如图7c和7d所示,当使用300mm的甘氨酸转染系统时,表达的星形胶质细胞的平均数量高达8000,并且当使用200mm的系统时,细胞数量显著减少。这些结果表明甘氨酸浓度的变化对星形胶质细胞摄取质粒的效率具有显著影响,并且随着甘氨酸浓度的降低,摄取效率显著降低。
177.示例4。甘氨酸转染系统促进不同脑区星形胶质细胞摄取质粒
178.由于脑组织功能和结构的巨大差异,有必要探索甘氨酸转染系统对促进不同脑区中星形胶质细胞摄取质粒的效率的作用。
179.我们尝试使用甘氨酸来促进质粒(pbt140,其表达cre重组酶)在成年ai9小鼠的不同脑区中的摄取。这些脑区包括下丘脑(图8a)、丘脑(图8b)、下丘脑的视前区(图8c)、纹状体外侧苍白球(图8d)、海马体(图8e)、脑干(图8f)、大脑皮层(图8g)和小脑皮层(图9)。结果显示tdtomato荧光蛋白在下丘脑、丘脑、外侧苍白球和脑干中的大量星形胶质细胞中表达,而海马体和皮层中仅有少数细胞表达荧光蛋白tdtomato。同时,神经元存在于海马中表达的细胞中。有趣的是,在小脑中,甘氨酸转染系统可以有效地促进质粒摄取(图9a),并且存在多种细胞类型(图9b),包括围绕浦肯野细胞的伯格曼胶质细胞、围绕颗粒细胞的velate星形胶质细胞和位于小脑皮层分子层中的篮状/星状中间神经元。
180.示例5。在其他物种中使用甘氨酸转染系统
181.以中国树鼩为实验对象。将300mm的甘氨酸转染系统注射到树鼩的中脑中,以递送表达tdtomato荧光蛋白的质粒载体。如图10a和图10b所示,树鼩中脑中的许多星形胶质细胞摄取并表达质粒载体。有趣的是,当将甘氨酸转染系统(两种荧光蛋白载体:egfp和
tdtoamto)注射到树鼩的纹状体中时,发现许多神经元表达两种荧光蛋白(图10c)。这些结果表明,使用甘氨酸转染系统可以促进其他物种的星形胶质细胞对质粒载体的摄取。
182.示例6。其他氨基酸促进星形胶质细胞摄取质粒载体
183.测试了其他氨基酸,包括丝氨酸、丙氨酸、组氨酸、γ-氨基丁酸、脯氨酸、、天冬酰胺、谷氨酰胺、鸟氨酸、瓜氨酸、肌氨酸、羟基脯氨酸、β-丙氨酸、牛磺酸、亚牛磺酸、甜菜碱、铃兰氨酸、赖氨酸、苏氨酸和以氨基酸为基本单元组成的肽类,包括双甘氨肽,二甘氨酰甘氨酸,l-丙氨酰-l-氨基丙酸,甘氨酰-l-组氨酸,组氨酰甘氨酸,n-l-亮氨酰甘氨酸。发现这些氨基酸可以有效地促进星形胶质细胞摄取质粒载体。从各种氨基酸的转染效率的分析可以看出,除丙氨酸外,l型氨基酸的效率远高于d型氨基酸的效率(请参见图11)。
184.也带正电荷的组氨酸、赖氨酸和精氨酸在递送效率方面具有显著差异,并且苏氨酸、丝氨酸、赖氨酸等的基因递送效率也具有巨大差异。这些结果表明,氨基酸溶液向基因载体的递送效率可能与其物理和化学性质无关,但可能与氨基酸在脑中的生物学功能有关(比例尺=200μm)。
185.示例7。l-脯氨酸转染系统促进不同脑区星形胶质细胞摄取质粒
186.l-脯氨酸转染系统用于促进成年ai9小鼠的不同脑区中质粒(pbt140,其表达cre重组酶)的摄取。这些脑区包括下丘脑、丘脑、海马、脑干、大脑皮层和小脑。结果显示tdtomato荧光蛋白在下丘脑、丘脑和脑干中的大量星形胶质细胞中表达,而海马体和皮层中仅有少数细胞表达荧光蛋白tdtomato。有趣的是,在小脑中,l-脯氨酸转染系统可以有效地促进质粒摄取(图12),并且存在多种细胞类型,包括围绕浦肯野(purkinje)细胞的bergman神经胶质细胞、围绕颗粒细胞的velate星形胶质细胞和位于小脑皮层的分子层中的篮状/星状中间神经元(图12)。
187.示例8。l-脯氨酸递送系统对中枢神经系统损伤的评价
188.为了评估高浓度的l-脯氨酸溶液是否诱导星形胶质细胞摄取质粒载体可能引起可见的中枢神经系统损伤,使用小胶质细胞特异性标记蛋白iba1进行荧光免疫染色。图13显示,与1
×
pbs对照组相比,测试组中iba1蛋白免疫荧光染色和iba1标记的小胶质细胞的荧光强度没有显著增加,表明300mm的l-脯氨酸溶液不会引起显著的组织损伤。
189.在细胞凋亡期间,基因组染色体被核酸酶随机切割,并产生大量粘性3
′‑
oh末端。在脱氧核糖核苷酸末端转移酶(tdt)的作用下,荧光分子可以标记到dna片段的3
′
末端,而正常细胞由于dna断裂几乎没有3
′‑
oh末端,因此tunel法是检测细胞凋亡的常用方法。为探讨高浓度l-脯氨酸溶液(300mm)对脑组织细胞凋亡的影响,采用tunel法检测注射脯氨酸脑片的细胞凋亡情况。发现l-脯氨酸可以诱导大量星形胶质细胞摄取质粒载体并表达绿色荧光蛋白,但几乎没有发现tunel荧光标记的细胞,表明高浓度的l-脯氨酸溶液不会引起脑组织细胞凋亡(图13)。
190.示例9。glyt1选择性抑制剂bitopertin通过甘氨酸转染系统增加质粒载体的摄取效率3-4倍
191.星形胶质细胞glyt1在脑组织的细胞外间隙中甘氨酸的清除中起重要作用。因此,我们使用glyt1的选择性抑制剂bitopertin来抑制星形胶质细胞对甘氨酸的清除。发现细胞摄取质粒载体的效率增加3-4倍,可能是由于通过甘氨酸抑制星形胶质细胞(图14)。通过甘氨酸转运蛋白去除细胞外甘氨酸延长了高浓度甘氨酸溶液的作用时间,从而改善了星形
胶质细胞对质粒载体的摄取。
192.示例10。甘氨酸转染系统促进双质粒载体的有效共转染
193.选择绿色荧光蛋白和tdtomato荧光蛋白的质粒载体作为标记。如图15a所示,将两种质粒载体同时注射到中脑中。5天后,通过灌注获取脑组织。通过荧光显微镜观察脑切片显示两种荧光蛋白都高度表达。每个星形胶质细胞可以被赋予独特的颜色标记。因此,甘氨酸转染系统不仅实现了两种质粒的有效转染,而且开发了非常方便和简单的星形胶质细胞“脑彩虹”标记技术。从图15b的三维显示可以看出,因为每个星形胶质细胞具有与相邻细胞不同的颜色,所以我们可以清楚地区分每个星形胶质细胞的“结构域”范围。为了检查两种质粒的共转染效率,我们计数了总共918个表达荧光蛋白的星形胶质细胞(图15c)。统计结果显示,两种质粒具有高达87.6%的共转染效率,表明甘氨酸转染系统可以同时诱导两种质粒载体的有效共转染。
194.示例11。甘氨酸转染系统促进三种质粒载体的有效共转染
195.在egfp和tdtomato质粒载体的基础上,添加tagbfp载体以测试三种质粒载体通过甘氨酸转染系统的有效共转染。结果显示,所有三种质粒载体都高度表达(图16a)。同时,利用双质粒载体构建的“脑彩虹”多色标记策略在rgb显示模式下的最大颜色组合为255
×
255,引入bfp蓝色通道后,将颜色模式扩展到三维信息,在rgb显示模式下达到255
×
255
×
255。可区分颜色的数量显著扩大。
196.共聚焦显微镜用于捕获不同颜色的星形胶质细胞,并对在多个脑切片上标记的593个星形胶质细胞进行统计分析(图16b)。几乎一半的标记细胞表达三种质粒载体(47%),并且仅表达两种质粒载体的星形胶质细胞占32.3%(图16c)。这些结果表明甘氨酸转染系统可以有效地促进星形胶质细胞同时摄取和表达多种质粒载体,并为成年小鼠星形胶质细胞中多个基因的同时操作和研究提供了有效的基因表达工具。它还表明,使用甘氨酸转染系统构建的脑“彩虹”策略具有用于多色标记的优异潜力。
197.为了进一步分析由使用甘氨酸转染系统构建的三质粒“脑彩虹”标记策略产生的颜色分布,使用共聚焦显微镜进行捕获,并使用imagj软件获得每个星形胶质细胞细胞体的颜色,其以rgb模式呈现。如图17a所示,每个通道的特定值直接绘制在三维坐标图上。可以看出,在整个三维坐标中,存在分布在不同区域中的一定数量的细胞,但是大多数细胞集中在较暗的区域中。结果与双质粒载体的表达相似。使用rgb模式的三维坐标绘制方法可以直接反映每个星形胶质细胞的特定颜色,但每个细胞的颜色亮度取决于多种因素,如成像深度、细胞形态和细胞表达活性。因此,rgb模式可以被变换为用于显示的二维hsb模式(色调-饱和度-亮度模式)(如图17b所示)。不同星形胶质细胞的颜色分布在色调环的每个区域中。另一种呈现方式是通过具有三个轴的三元图,每个轴表示不同的颜色百分比,其可以反映不同细胞中每种荧光蛋白表达的相对比例。如图17c所示,由大多数细胞(85.5%)表达的tagbfp(蓝色通道)的量分布在最高荧光强度(表达最多tagbfp的细胞)的50%以下。如图17d所示,三种荧光蛋白在荧光强度中的分布也略有不同。
198.示例12。甘氨酸转染系统构建的“脑彩虹”多色标记策略可以有效地区分相邻星形胶质细胞的“领地”。
199.鉴于星形胶质细胞的独特且复杂的三维结构,不同星形胶质细胞之间的明确区分可以促进对与星形胶质细胞“领地”内的神经元的相互作用和相邻星形胶质细胞之间的相
互作用的相关研究。
200.用甘氨酸转染系统构建了一种简单方便的“脑彩虹”多色技术。如图18a和18b所示,在局部区域中,相邻的星形胶质细胞被标记为不同的颜色,每个星形胶质细胞的“领地”是清楚可辨别的。即使在相邻星形胶质细胞彼此接触的极小空间中,单色标记通常难以准确地确定区分微小结构是否属于一个细胞或多个细胞。然而,多色标记可以清楚地区分(图18c和18d)。
201.示例13。l-脯氨酸转染系统促进双重质粒载体的有效共转染,l-脯氨酸转染系统促进三种质粒载体的有效共转染
202.如图19a所示,用300mm l-脯氨酸溶液在小鼠中脑中同时表达两种质粒载体(p-egfp-c1和p-tdtomato-n1),两种荧光蛋白在大量星形胶质细胞中表达,同时,星形胶质细胞由于荧光表达的差异而显示不同的颜色(比例尺=200μm)。如图19b所示,在表达荧光蛋白的所有星形胶质细胞中,91.8%的细胞表达tdtomato,97.9%的细胞表达egfp,并且共表达比率达到89.7%。图19c-19d显示了不同星形胶质细胞的细胞颜色分布。细胞体的两种类型的荧光强度分布在整个亮度区域,但主要分布在较暗区域。具有rgb值小于50的细胞体荧光强度的细胞数量分别占60.9%(绿色)和58.3%(红色)。图19e显示了三种质粒载体(浓度分别为1μg/ul的p-egfp-c1、p-tdtomato-n1和p-tagbfp-n)在具有300mm l-脯氨酸溶液的小鼠中脑中的同时表达(比例尺=50μm)。
203.示例14。超大质粒载体在星形胶质细胞中的表达
204.1.构建px330-u6-sgrna-cbh-hspcas9-mcherry质粒
205.px330-u6-sgrna-cbh-hspcas9-mcherry质粒敲除ai3小鼠的eyfp基因并表达红色荧光mcherry荧光蛋白。
206.质粒p-egfp-c1、pbt140、pcag-pbase和pbcag-egfp购自addgene平台。px330-u6-sgrna-cbh-hspcas9-mcherry由xingxu huang实验室的jiankui zhou提供。
207.将px330-u6-chimeric_bb-cbh-hspcas9-mcherry质粒用作载体,并将sgrna靶结合序列插入u6启动子后面的bbsi限制性位点处。sgrna的靶序列是eyfp sgrna1-s:cac cgg gcg agg agc tgt tca ccg,eyfp sgrna1-a:aaa ccg gtg aac agc tcc tcg cc。首先,使用消化系统(bbsi核酸内切酶2μl,载体质粒1-2μg,加入消化缓冲液,最后加入ddh2o至50μl)进行载体质粒的消化,反应在37℃下进行30分钟至1小时。使用takara minibest dna片段纯化试剂盒ver4.0试剂盒纯化消化产物,并通过1%琼脂糖凝胶电泳检测消化。使用t4连接酶将回收的消化片段与靶序列连接。酶连接反应体系为:100ng片段,1μl 5mm靶序列杂合双链,0.2-1μlt4连接酶,连接缓冲液,加入ddh2o至10μl),并在恒温下反应15-30分钟。细菌转化后,挑取单菌落并进行测序。同时,将500μl细菌溶液与等体积的50%无菌甘油混合,然后根据测序结果选择相应的细菌溶液用于质粒提取。构建的px330-u6-sgrna-cbh-hspcas9-mcherry质粒如图20所示。
208.2.超大质粒载体在星形胶质细胞中的表达
209.选择大小为约10,000个碱基对的px330-u6-sgrna-cbh-hspcas9-cmv-mcherry载体,以通过u6启动子表达sgrna,通过spb9启动子表达spcas9蛋白,并通过cmv启动子表达mcherry荧光。甘氨酸转染系统用于递送px330-u6-sgrna-cbh-hspcas9-cmv-mcherry载体。如图21a所示,在荧光共聚焦显微镜下,大量星形胶质细胞表达荧光蛋白mcherry,表明载体
可以在甘氨酸转染系统下被星形胶质细胞有效摄取。此外,与其他荧光蛋白(egfp、eyfp、tdtomato、tagbfp)不同,表达的mcherry荧光蛋白在星形胶质细胞中会聚成小颗粒(图21b)。使用imagej软件的分析显示这些小颗粒具有约1-3μm的直径。
210.示例15。使用crispr-cas9系统敲除ai3转基因小鼠的eyfp基因
211.选择ai3小鼠(rcl-eyfp)作为报告小鼠,并使用crispr/cas9系统靶向敲除其星形胶质细胞基因组中的eyfp基因。如图22所示,使用甘氨酸转染系统递送两种质粒载体(表达cre重组酶的pbt140载体和表达crispr/cas9系统的px330-u6-sgrna-cbh-hspcas9-mcherry载体),并且当cre重组酶载体在星形胶质细胞中表达时,可以切除eyfp基因序列前面的翻译终止序列“stop”,从而成功实现eyfp基因的表达,并且当靶向eyfp基因的crispr/cas9载体在细胞中同时表达时,eyfp基因被敲除。因此,即使存在cre重组酶,活性eyfp荧光蛋白也不能有效表达。
212.首先,构建靶向eyfp基因的合适的sgrna。如图20a所示,通过1%琼脂糖凝胶电泳,可以看出消化的质粒载体产生约5kb的条带(泳道1)。因为在载体px330-u6-sgrna-cbh-hspcas9-mcherry中,除了用于在mcherry荧光蛋白序列中插入新sgrna的sgrna位置中的两个bbsi限制性核酸内切酶位点之外,还存在bbsi消化位点,其在消化后产生两个相似大小的片段。此外,我们通过细菌液体测序(图20b)证实,成功构建了靶向eyfp基因的px330-u6-sgrna(eyfp)-cbh-hspcas9-mcherry载体。
213.接下来,为了确认设计的sgrna-eyfp是否可以有效地靶向和切除来自ai3转基因小鼠的星形胶质细胞中的eyfp基因。根据设计方法(图22),首先将两种质粒载体pbt140和px330-u6-sgrna(ctrl)-cbh-hspcas9-mcherry注射到8周龄的ai3转基因小鼠中。如图23a所示,eyfp和mcherry荧光蛋白均高度表达,并且表达mcherry荧光蛋白的大多数(平均88.7%)星形胶质细胞也表达eyfp荧光蛋白(图23d),表明作为对照组的crispr/cas9载体的表达不影响eyfp荧光蛋白的表达。还同时注射两种质粒载体pbt140和px330-u6-sgrna(eyfp)-cbh-hspcas9-mcherry,如图23b和23c所示,大多数(平均89.8%)表达mcherry的星形胶质细胞不表达eyfp荧光蛋白,并且进一步的统计分析显示sgrna(eyfp)表达可以有效地敲除ai3转基因小鼠星形胶质细胞的eyfp基因。
214.因此,为了进一步验证crispr/cas9的去除效率,我们对靶位置的基因组进行了测序。如图24a所示,我们设计了一对引物pcag-f和eyfp-r,以通过pcr扩增含有sgrna靶位点的序列。在cre重组酶切割后,扩增的片段将被缩短。通过pcr条件的优化,获得300bp的截止值用于测序分析(图24b)。测序结果显示在图24c中。在表达cre重组酶的星形胶质细胞中,检测到插入突变、缺失突变和点突变。点突变对荧光蛋白的结构具有有限的影响,这可能是表达mcherry荧光蛋白的少量(10.2%)星形胶质细胞也可以看到eyfp荧光的原因。
215.示例16。piggybac转座系统敲入c57bl/6小鼠egfp基因
216.piggybac转座子系统需要两种质粒载体来表达转座酶(pcag-pbase质粒载体)和携带具有末端重复序列的外源基因的转座子(pbcag-egfp质粒载体)(图25)。首先,注射常见质粒载体(p-egfp-c1)。由于普通载体不能整合到细胞的基因组中,因此外源质粒dna只能瞬时表达并最终被细胞中的核酸酶降解。如图26a所示,表达25天后,绿色荧光蛋白(egfp)的强度显著降低,仅为5天时荧光表达的约十分之一(图26b)。相反,当使用piggybac转座子系统时,在表达25天后,与5天相比,荧光蛋白表达更高(图26c和图26d)。荧光强度增
加的原因是通过转座子系统,egfp基因整合到基因组中,并且egfp的持续和稳定表达增加了细胞中荧光蛋白的总量。
217.为了进一步研究piggybac转座子系统实现外源基因的长期或甚至永久表达的能力,在注射后分别观察pb质粒载体表达两个月(图27a)和六个月(图27b)。发现甚至长达半年,egfp表达保持稳定和持续。这些结果充分证明使用甘氨酸转染系统可以诱导piggybac转座子系统在成年小鼠的星形胶质细胞中永久表达外源基因。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。