1.本发明属于微生物制剂技术领域,具体涉及一种具有降脂抗炎和抗氧化功能的益生菌制剂的制备方法和应用。
背景技术:
2.随着现代生活水平的提高,肥胖已是涉及全球的健康问题,其发病率显著增加。根据世界卫生组织提供的数据约19亿年龄在18岁或以上的人处于超重状态;其中,约有6.5亿人被诊断患有肥胖。肥胖个体更易患非酒精性脂肪性肝病,糖尿病,心血管疾病等营养代谢性疾病。肥胖源于基因与环境因素(如饮食、食物成分及生活方式)之间的复杂相互作用,其中能量摄入和消耗之间的长期失衡以及体内脂肪过度增加是主要诱因。由于肥胖病因的复杂性,目前还没有有效且安全的解决方案。因此,日常干预措施,对于有效预防超重和肥胖是非常必要的。
3.研究表明,肥胖及其并发症伴随着肠道微生物菌群的变化。肠道微生物菌群丰度及其细菌基因组(微生物组)改变会影响宿主营养获取、能量调节和脂肪储存。肠道微生物菌群可以通过三种方式调节肥胖:第一,影响能量吸收,微生物菌群发酵肠道内不易消化纤维增加了宿主对饮食中能量的摄取;第二,改变肠道通透性诱导或预防代谢内毒素血症,健康人体肠道微生物菌群维持肠道屏障的完整性,而肥胖患者的微生物菌群通过增加肿瘤坏死因子α(tnf-α) 和白细胞介素1β(il-1β)的释放增加肠道炎症,改变肠道通透性,破坏肠道屏障完整性,进一步引起全身炎症;第三,肠道微生物菌群代谢物的调节和分泌,肠道微生菌物群产生的短链脂肪酸(scfas)通过减少全身炎症或通过向大脑发出信号来激活刺激肠道诱导饱腹感激素肽yy和胰高血糖素样肽-1 (glp-1)的营养物质的特定受体。此外,scfas能靶向作用于脂肪细胞,促进脂肪分解和瘦素的释放。这些作用机制同时发挥作用或相互关联。因此,通过直接改变肠道微生物菌群的组成在对抗肥胖方面变得很有吸引力。
4.益生菌的定义是“活的微生物,当摄入足够量时,会给宿主带来健康益处”,这种益处可以是直接的也可以是通过与其他微生物的相互作用产生,这种潜在的有益影响是菌株本身带来的而不是物种特异性。益生元通常以碳水化合物为基础,由宿主的微生物群选择性发酵,并以其对健康的有益影响当结合益生菌菌株和益生元底物时即为合生元。从这个意义上说,益生菌菌株、益生元和合生元被用于食品生产或作为补充剂,以积极地改变宿主的微生物群,从而可能有助于临床预防或治疗肥胖。
技术实现要素:
5.本部分的目的在于概述本发明的实施例的一些方面以及简要介绍一些较佳实施例。在本部分以及本技术的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
6.本发明具有降脂抗炎和抗氧化功能的益生菌制剂,由以下菌株组成:
7.植物乳杆菌(lactiplantibacillusplantarum)d4-2,保藏于广东省微生物菌种保藏中心,地址为广州市先烈中路100号大院59号楼5楼,保藏编号为:gdmcc no:1.3457,保藏日期为2022年06月30日。
8.戊糖乳杆菌(lactiplantibacilluspentosus)w6-9,藏于广东省微生物菌种保藏中心,地址为广州市先烈中路100号大院59号楼5楼,保藏编号为: gdmcc no:1.3456,保藏日期为2022年06月30日。
9.卷曲乳杆菌lactobacillus crispatusdc529,保藏于广东省微生物菌种保藏中心,地址为广州市先烈中路100号大院59号楼5楼,卷曲乳杆菌 lactobacillus crispatus dc529,保藏号为gdmcc no:62094,保藏日期为 2021年12月15日。
10.乳酸片球菌pediococcus acidilactici dc413,保藏于广东省微生物菌种保藏中心,地址为广州市先烈中路100号大院59号楼5楼,保藏号为gdmcc no: 1.2969,保藏日期为2021年12月31日。
11.植物乳杆菌d4-2、戊糖乳杆菌w6-9、卷曲乳杆菌dc529、乳酸片球菌dc413、菊粉、海藻糖、半乳甘露聚糖、纤维素粉和上述益生菌代谢产物干物质;其中,植物乳杆菌d4-1活菌数为109~10
12
cfu/g、戊糖乳杆菌w6-9活菌数为109~ 10
12
cfu/g、卷曲乳杆菌dc529活菌数为109~10
12
cfu/g、乳酸片球菌dc413活菌数为109~10
12
cfu/g。进一步地,所述复合益生菌制剂中活菌数量比为1:2~1: 0.5~1:0.5~1。
12.本发明还提供了上述复合益生菌制剂的制备方法,包括以下步骤:
13.1)将上述四株益生菌活化:植物乳杆菌d4-1、戊糖乳杆菌w6-9、卷曲乳杆菌dc529、乳酸片球菌dc413分别接种到新鲜的液态培养基中进行培养培养得到四种细菌悬液,具体流程:斜面菌种培养
→
一级液体种子培养
→
二级液体种子培养;
14.2)固体复合益生菌制剂:将上述四种益生菌二级种子液 8000-10000rmp/min,离心10min,分别收集上清发酵液和沉淀。向沉淀中加入 1-2倍质量的冻干保护剂(3-7%菊粉、3-7%海藻糖)混合均匀,冷冻干燥。干燥后的菌粉按1:(2~1):(0.5~1):(0.5~1)混合均匀。上清发酵液首先进行减压浓缩,然后进行低温喷雾干燥,进风温度为100℃,出风温度60℃,获得干燥粉末。将发酵液干粉与益生菌干粉按0.5~2:1比例混合,最后加入半乳甘露聚糖和纤维素粉,搅拌均匀;或者,
15.液体复合益生菌制剂:将上述四种益生菌二级种子液按1:(1~2):(0.5~1): (0.5~1)比例混合均匀,8000-10000rmp/min,离心10min,分别收集沉淀和上清发酵液备用。首先对上清发酵液进行减压浓缩,将发酵浓缩液与益生菌沉淀按1~3:1比例混合,最后加入菊粉、海藻糖、半乳甘露聚糖和纤维素粉,搅拌均匀。
16.本发明的有益效果:本发明中植物乳杆菌d4-2、戊糖乳杆菌w6-9、卷曲乳杆菌dc529和乳酸片球菌dc413在体内、外实验中均具有高效降解胆固醇、降脂抗炎、抗氧化能力,可用于日常降脂护肝保健产品的开发应用。
17.本发明中将四种益生菌及其代谢产物与多种益生元按一定比例混合,一方面多种益生元为益生菌提供充足的营养物质,促进益生菌在肠道内的增殖和定植;另一方面,上述益生菌组合将益生菌发酵产物包括在内,增加了该组合的抗菌能力,同时发酵液中含有大量的短链脂肪酸、吲哚衍生物等直接影响肠道脂质代谢和屏障完整性,也避免了发酵液的废弃。
附图说明
18.为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
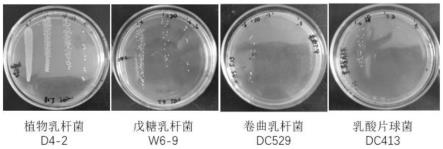
19.图1为植物乳杆菌d4-2、戊糖乳杆菌w6-9、卷曲乳杆菌dc529和乳酸片球菌dc413在mrs固体培养基上形态;
20.图2植物乳杆菌d4-2、戊糖乳杆菌w6-9、卷曲乳杆菌dc529和乳酸片球菌dc413体外降解胆盐效果;
21.图3高脂饮食模式下饲喂益生菌制剂对小鼠体重影响;
22.图4高脂饮食模式下饲喂益生菌制剂对小鼠腹脂沉积影响;
23.图5高脂饮食模式下饲喂益生菌制剂对小鼠肝脏脂质代谢影响;
24.图6高脂饮食模式下饲喂益生菌制剂对小鼠血清中胆固醇和甘油三酯影响;
25.图7高脂饮食模式下饲喂益生菌制剂对小鼠肝脏脂质抗氧化能力影响;
26.图8高脂饮食模式下饲喂益生菌制剂对小鼠肝脏中促炎细胞因子影响。
27.图9为实施例3实验流程图。
具体实施方式
28.为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合具体实施例对本发明的具体实施方式做详细的说明。
29.在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
30.其次,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
31.实施例1:
32.各益生菌菌株体外降胆固醇能力效果评价
33.益生菌复苏培养:植物乳杆菌b3-1、植物乳杆菌d4-2、植物乳杆菌y4-10、植物乳杆菌y2-4、植物乳杆菌y9-16、植物乳杆菌z5-1;乳酸片球菌dc16、乳酸片球菌dc68、乳酸片球菌dc171、乳酸片球菌dc258、乳酸片球菌dc288、乳酸片球菌dc413;卷曲乳杆菌dc7、卷曲乳杆菌dc44、卷曲乳杆菌dc290、卷曲乳杆菌dc316、卷曲乳杆菌dc529、卷曲乳杆菌dc571;唾液乳杆菌y8-2;约氏乳杆菌e3-7;干酪乳杆菌h2-5;戊糖乳杆菌w6-9;副干酪乳杆菌a4-3;罗伊氏乳杆菌dc112等24株分别挑单菌落于mrs培养基中37℃培养24h(厌氧环境),od=1.5时按1%(v/v)接种于新鲜培养基中37℃培养24h(厌氧环境),将培养好的菌液放置4℃冰箱备用。
34.mrs-胆固醇培养基配制:胆固醇0.1g,牛胆盐0.2g,tween-801ml,冰乙酸5ml,溶于1000ml mrs培养基。
35.降解胆固醇能力评价:将mrs胆固醇培养基按5ml每支分装到试管中,接种活化的
益生菌(1
×
108cfu/ml),未接种的作为实验对照,置于37℃厌氧环境培养12h,培养结束后,在4℃,4000rpm条件下离心10min。采用邻苯二甲醛法测定胆固醇含量。a0和a1分别为发酵前后上清液中的胆固醇含量。并计算出植物乳杆菌对胆固醇的降解率。胆固醇降解率计算公式如下所示:胆固醇降解率(%)=(a0-a1)/a0
×
100。表1所示,24株益生菌与mrs 胆固醇培养基作用24h后,各株益生菌的胆固醇降解率。其中植物乳杆菌d4-2、戊糖乳杆菌w6-9、卷曲乳杆菌dc529和乳酸片球菌dc413胆固醇降解能力最突出。
36.表1. 24株益生菌体外胆固醇降解能力评价
[0037][0038]
实施例2:
[0039]
体外降胆固协同作用效果评价:
[0040]
益生菌复苏培养:植物乳杆菌d4-2、戊糖乳杆菌w6-9、卷曲乳杆菌dc529 和乳酸片球菌dc413(图1),分别挑单菌落于mrs培养基中37℃培养24h(厌氧环境),od=1.5时按1%(v/v)接种于新鲜培养基中37℃培养24h(厌氧环境),将培养好的菌液放置4℃冰箱备用。
[0041]
胆盐水解酶(bsh)固体培养基配制:琼脂2%,牛胆盐0.3%,巯基乙酸钠0.2%,氯化钙0.37g/l,溶于1000ml mrs培养基。
[0042]
产胆盐水解酶能力评价:将直径4mm大小滤纸圆片,用灭菌镊子轻压放到胆盐水解酶固体培养基上,吸取益生菌培养液10μl添加到滤纸片上,37℃厌氧条件下培养24h,以滤纸片添加mrs液体培养基作为对照,观察培养后滤纸片周围是否有白色沉淀物,如果有白色沉淀产生,可初步证实该菌株具有胆盐水解酶活性(图2),结果显示四株益生菌均具有bsh,bsh将结合胆盐酶解为游离胆盐,游离胆盐水溶性差在肝脏中与胆固醇结合形成胆汁酸,进入胆汁酸代谢通路,从而降低宿主胆固醇含量。
[0043]
降解胆固醇协同作用效果评价:将mrs胆固醇培养基按5m l每支分装到试管中,按表2的浓度接种活化的益生菌,未接种的作为实验对照,置于37℃厌氧环境培养12h,培养结束后,胆固醇降解率按实例1方法计算。loeweadditivity模型分析益生菌两两相互作用效果,ci值描述药物之间相互作用程度的参数,当ci》1表示药物之间的相互作用为拮抗,当0《ci《1表示药物之间的相互作用为协同,当ci=1表示药物之间无相互作用。结果如表2 所示,植物乳杆菌d4-2 卷曲乳杆菌dc529组,ci=0.78;植物乳杆菌d4-2 戊糖乳杆菌w6-9组,
ci=0.84;植物乳杆菌d4-2 乳酸片球菌dc413组,ci=0.81;卷曲乳杆菌dc529 戊糖乳杆菌w6-9组,ci=0.79,说明益生菌之间存在协同效应。
[0044]
表2.益生菌降解胆固醇协同作用效果(12h)
[0045][0046]
四种益生菌复配降解胆固醇效果评价:将mrs胆固醇培养基按5m l每支分装到试管中,按每种益生菌0.2
×
108cfu/ml的浓度接种,未接种的作为实验对照,置于37℃厌氧环境培养12h,培养结束后,胆固醇降解率按实例1 方法计算。四种益生菌复配体外胆固醇降解率为98.9
±
0.4(%)。
[0047]
实施例3:
[0048]
高脂饮食模式下饲喂本发明益生菌制剂对小鼠效果评价
[0049]
试验设计:
[0050]
将四株益生菌活化:植物乳杆菌d4-1、戊糖乳杆菌w6-9、卷曲乳杆菌dc529、乳酸片球菌dc413分别接种到新鲜的液态培养基中进行培养培养得到四种细菌悬液,具体流程:斜面菌种培养
→
一级液体种子培养
→
二级液体种子培养,得到二级种子液;为方便计算,以下益生菌组合中菌体沉淀(固体)与液体混合时按1g=1ml进行换算。
[0051]
益生菌组合1:固体复合益生菌组合:将上述四种益生菌二级种子液(每个种子液含活菌数量:1
×
10
11
cfu/ml,体积为1l)分别以8000rmp/min,离心 10min,分别收集上清发酵液和沉淀;向所述沉淀中加入沉淀2倍质量的冻干保护剂,冻干保护剂含有7wt%菊粉(4g)、7wt%海藻糖(4g),溶剂为水,混合均匀,冷冻干燥得到益生菌干粉,干燥后的益生菌干粉按质量比1:1:1:1混合均匀。上清发酵液首先进行减压浓缩,然后进行低温喷雾干燥,进风温度为 100℃,出风温度60℃,获得发酵液干燥粉末。将发酵液干燥粉末与益生菌干粉按0.5:1质量比混合得到混合粉末,最后加入混合粉末2倍质量的半乳甘露聚糖和1倍质量的纤维素粉),搅拌均匀。
[0052]
益生菌组合2:液体复合益生菌组合:将上述四种益生菌二级种子液(1
ꢀ×
10
11
cfu/ml,1l)按活菌体积1:1:1:1比例混合均匀,8000rmp/min,离心10min,分别收集沉淀和上清发酵液备用。首先对上清发酵液进行减压浓缩至原始体积的1/2(2l),将发酵浓缩液与益生菌沉淀再次混合得到混合液,最后在混合液中加入菊粉(4g)、海藻糖(4g)、半乳甘露聚糖(150g)和纤维素粉(50g),搅拌均匀。
[0053]
实验分组如下表所示:
[0054][0055]
实验流程如图9所示:
[0056]
体重变化:
[0057]
每周固定时间称重并记录。结果如图3所示,图3为高脂饮食模式下饲喂益生菌组合对小鼠体重影响,*表示与i组进行差异分析,#代表与ii组进行差异分析。***p《0.001;*p《0.05;##p《0.01,与高脂组相比,无论是固体益生菌组合1或者液体益生菌组合2都能显著降低小鼠体重。
[0058]
腹脂沉积:
[0059]
剖检后将腹部及肠系膜处脂肪全部摘除,称重。腹脂率=腹部及肠系膜处脂肪/体重,结果如图4所示,图4为高脂饮食模式下饲喂益生菌组合对小鼠腹脂沉积影响,*表示与i组进行差异分析,#代表与ii组进行差异分析。 ***p《0.001;#p《0.05,与高脂组相比,饲喂益生菌组合能显著降低小鼠腹脂率,证明了饲喂益生菌组合能减少高脂饮食中小鼠腹部脂质沉积。
[0060]
肝脏脂质代谢:
[0061]
剖检后将小鼠肝脏完整取出称重,计算肝脏指数,图5为高脂饮食模式下饲喂益生菌组合对小鼠肝脏脂质代谢影响,(a)肝脏指数(b)肝脏油红染色,放大倍数400
×
,*表示与i组进行差异分析,#代表与ii组进行差异分析。 **p《0.01;#p《0.05,如图5a所示,与高脂组相比,饲喂益生菌组合显著降低小鼠肝脏系数。制作肝脏冰冻切片并进行油红o染色,结果如图5b所示,与高脂组相比,饲喂益生菌组合显著降低小鼠肝脏脂滴含量,说明饲喂益生菌组合能有效阻止缓解肝脏脂质代谢紊乱。
[0062]
血清中tg、tc含量:
[0063]
饲养周期结束后每只小鼠眼球采血,处理后获得血清,检测血清中tg、tc 含量。图6为高脂饮食模式下饲喂益生菌组合对小鼠血清中胆固醇(a)和甘油三酯(b)影响,如图6所示,*表示与i组进行差异分析,#代表与ii组进行差异分析。***p《0.001;**p《0.01,#p《0.05,与高脂组相比,饲喂益生菌组合显著降低小鼠血清中tg、tc含量显著降低,说明饲喂益生菌组合能有效降低小鼠血液循环中脂质累积。
[0064]
肝脏脂质抗氧化:
[0065]
肝脏剪取1g研磨,3000rmp/min,离心20min取上清检测肝脏抗氧化酶(谷胱甘肽过氧化物酶,gsh-px)活力,同时检测脂质过氧化产物丙二醛(mda) 的水平以间接判断细胞受自由基攻击的严重程度。图7为高脂饮食模式下饲喂益生菌组合对小鼠肝脏脂质抗氧化能力影响,(a)谷胱甘肽过氧化物酶(b) 丙二醛,*表示与i组进行差异分析,#代表与ii组进行差异分析。***p《0.001; **p《0.01;*p《0.05;##p《0.01;#p《0.05,如图7所示,与高脂组相比,饲喂益生菌组合显著降低小鼠肝脏抗氧化酶活力均显著升高,mda的水平显著降低,说
明饲喂益生菌组合能显著提高小鼠肝脏抗氧化活性。
[0066]
肝脏炎症反应:
[0067]
取肝脏脂质抗氧化实验中小鼠肝脏研磨上清检测促炎细胞因子tnf-α、 il-1β含量。结果图8所示,*表示与i组进行差异分析,#代表与ii组进行差异分析。***p《0.001;**p《0.01;*p《0.05;#p《0.05,与高脂组相比,饲喂益生菌组合显著降低小鼠肝脏促炎细胞因子的释放,说明饲喂益生菌组合能缓解小鼠肝脏炎症反应。
[0068]
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。