1.本发明涉及肿瘤基因检测技术领域,特别涉及一种基因组不稳定性评分作为脑膜转移瘤标志物的用途。
背景技术:
2.脑膜转移瘤(meningeal metastases,mm)是全身癌症的严重并发症,具有较高死亡率。其原发灶多为肺癌、乳腺癌、结直肠癌和中枢神经系统原发性肿瘤等,肿瘤细胞侵犯软脑膜并随脑脊液循环弥漫性或多发性种植生长。mm是一种毁灭性的并发症,进展迅速,没有治愈的办法,姑息治疗以延长生存期和稳定神经症状为主,一旦发生颅内高压或脑疝,患者死亡率极高。目前缺乏对mm患者的预后、颅内高压或脑疝发生风险进行评估和预测的标志物,迫切地需要开展更多相关研究,以筛选出更有效的mm标志物。
3.近年来有大量研究表明,从血浆中提取的无细胞dna(cell-free dna,cfdna)可以作为反映实体肿瘤基因组图谱的替代物,用于肿瘤的诊断、辅助精准治疗、疾病监测和耐药机制的鉴定。液体活检具有以下多重优势:可多次微创取样、克服肿瘤异质性、提供动态监测、复发检测等。然而,由于血脑屏障的存在,血浆中只有少量来自中枢神经系统恶性肿瘤的cfdna。脑脊液作为中枢神经系统特有的循环液体,充满于脑室和脊髓中,可与病灶处肿瘤细胞直接接触,有望成为中枢神经系统恶性肿瘤液体活检的突破点。
4.基因组不稳定性(genomic instability,gi)对于肿瘤发生和发展具有非常复杂的影响,包括驱动基因的扩增、抑癌基因的缺失、基因大片段重排、染色体外dna和微核形成等,其与疾病发生、转移、不良预后和治疗抵抗有关。造成gi的原因是多种多样的,包括有丝分裂错误、复制压力、同源重组缺陷(homologous recombination deficiency,hrd)、端粒异常和断裂-融合-桥周期等。研究报道,许多肿瘤(如乳腺癌、卵巢癌、结直肠癌等)的进展可由gi驱动,使肿瘤持续产生新的遗传学变异,为肿瘤细胞提供选择性生长优势。在传统治疗模式下,携带不稳定基因组的肿瘤预后普遍较差,但同时基因组不稳定性也有望被转化为治疗靶点。在基因组不稳定性的肿瘤中诱导基因组损伤,有望应用合成致死原理(如parp抑制剂)建立新的治疗方案。
5.然而,目前几乎没有实体肿瘤mm患者基因组不稳定性的针对性研究。因此,依托快速发展的cfdna高通量测序技术,建立可用于mm基因组不稳定性诊断的基因组不稳定性评分(gi_score),对mm患者的预后、颅内高压或脑疝发生风险进行更准确的评估和预测,以及协助开发潜在的临床治疗策略,具有至关重要的意义。
技术实现要素:
6.本发明为了解决上述技术问题,提供一种基因组不稳定性评分作为脑膜转移瘤标志物的用途。
7.本发明是按照以下技术方案实现的。
8.一种基因组不稳定性评分,所述基因组不稳定性评分等于脑脊液cfdna胚系杂合
突变位点中突变等位基因频率超过上、下四分位数的突变数所占的比例。
9.进一步的,所述基因组不稳定性评分依托543个癌症相关基因的靶向深度测序获得的突变数据计算得到。
10.一种上述基因组不稳定性评分作为脑膜转移瘤预后标志物的应用。
11.一种测定上述基因组不稳定性评分的物质在制备诊断脑膜转移瘤的基因组不稳定性的产品中的应用。
12.进一步的,基因组不稳定性评分大于等于0.07被定义为存在基因组不稳定。
13.一种测定上述基因组不稳定性评分的物质在制备评估脑膜转移瘤患者预后的产品中的应用。
14.一种测定上述基因组不稳定性评分的物质在制备预测脑膜转移瘤患者颅内高压或脑疝发生风险的产品中的应用。
15.一种在基因组不稳定性的肿瘤中诱导基因组损伤的物质在制备治疗脑膜转移瘤产品中的应用,所述基因组不稳定性的肿瘤由上述诊断脑膜转移瘤的基因组不稳定性的产品进行确定。
16.本技术具有以下有益效果。
17.本发明通过计算、对比脑膜转移瘤患者配对血浆和脑脊液cfdna的gi_score发现脑脊液cfdna(约66.1%)而非血浆cfdna(约6%)存在大量的基因组不稳定性,即脑膜转移灶的基因组不稳定性显著增加。同时,全基因组测序(wgs)的结果验证了基于gi_score的gi分组的可靠性。gi分组后的分析结果表明gi促进肺腺癌发生脑膜转移,导致不良预后,并与低karnofsky功能状态(kps)评分和严重的高颅内压相关。本发明揭示gi可能作为一个新的脑膜转移瘤预后标志物,可以用以进行mm的基因组不稳定性诊断,预后评估,以及脑膜转移瘤患者颅内高压或脑疝发生风险预测,并可能协助开发潜在的临床治疗策略,具有广阔的应用前景。
附图说明
18.图1是本发明基于543个癌症相关基因的靶向深度测序的脑脊液和血浆cfdna基因组稳定性分析图(其中,a-e:5例基因组不稳定患者的结果图;f-j:5例基因组稳定性患者的结果图);
19.图2是本发明八个样本的低深度wgs拷贝数分析图(其中,a-e,h:6名基因组不稳定患者脑脊液cfdna基因拷贝数变化图;f,g:2名基因组稳定患者脑脊液cfdna基因拷贝数变化图;i:患者p48基因组稳定的配对血浆cfdna基因拷贝数变化图);
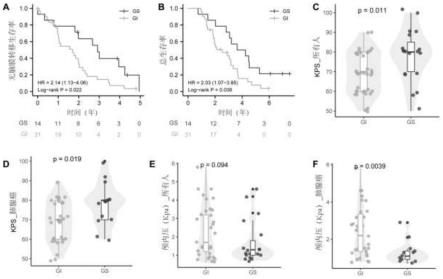
20.图3是本发明基因组不稳定性与患者生存以及其他临床性状之间的关系图(其中,a:肺腺癌脑膜转移患者中gi与gs组的无脑膜转移生存期对比图;b:肺腺癌脑膜转移患者中gi与gs组的总生存期对比图;c:所有患者中gi和gs组间kps评分对比图;d:45名原发肿瘤为肺腺癌的患者中gi和gs组间kps评分对比图;e:所有患者中gi和gs组间颅内压对比图;f:45名原发肿瘤为肺腺癌的患者中gi和gs组间颅内压对比图);
21.图4是本发明基因组不稳定性评分以及gi分组在血浆和脑脊液中的对比分布图(其中,a:脑脊液和血浆组中的基因组不稳定性评分对比图;b:基因组不稳定患者在脑脊液与血浆中的对比分布图);
22.图5是本发明gi组和gs组间的基因特征比较图(其中,a:gi组和gs组的基因突变总数对比图;b:gi组和gs组的拷贝数变异(cnvs)数量的对比图;c:gi组与gs组中tp53的突变率对比图;d:tp53突变与基因组不稳定性评分的关系图;e-h:分别为gi组与gs组中tp53/egfr、tp53/kmt2c、tp53/erbb2、tp53/rb1共突变的分布图;i-j:tp53/egfr共突变和tp53/kmt2c、tp53/erbb2、tp53/rb1共突变与gi的关系图;k-l:tp53/egfr共突变和tp53/kmt2c、tp53/erbb2、tp53/rb1共突变与患者总生存的关系图)。
具体实施方式
23.下面结合附图和实施例对本发明进行进一步的说明。
24.一、实验方法
25.1.临床样本收集
26.本发明共收集来自于2012年6月至2018年9月期间,在天津医科大学肿瘤医院接受治疗的56名mm患者的血液、脑脊液。56名mm患者的原发肿瘤包括45例肺腺癌、7例乳腺癌、1例结直肠癌、1例胃癌、1例肺鳞癌和1例小细胞肺癌。
27.2.dna的制备
28.①
血浆cfdna提取
29.将从外周血淋巴细胞和血浆的离心(1600g,10分钟)获得的上清血浆转移到2ml离心管中,以16000g进一步离心10分钟。通过magmax
tm
无细胞dna分离试剂盒(life technologies,usa)提取血浆cfdna。按照制造商的方案,使用tiangen whole blood dna试剂盒(tiangen,china)从外周血淋巴细胞中提取dna。使用qubit dsdna hs测定试剂盒或qubit dsdna br测定试剂盒(life technologies,usa)定量dna浓度。
30.②
脑脊液cfdna提取
31.将从脑脊液离心(3000g,15分钟)获得的上清液转移到5ml离心管中,然后以16000g离心10分钟。采用magmax
tm
无细胞dna分离试剂盒和dynabeadsmyone硅烷分离试剂盒中提取脑脊液cfdna和沉渣dna。通过qubit dsdna hs试剂盒或qubit dsdna br试剂盒定量dna浓度。
32.3.文库准备和二代测序(ngs)
33.通过covaris m220聚焦超声波仪(covaris,usa)将基因组dna剪切成150-200bp片段,然后使用kapa文库制备试剂盒(kapa biosystems,usa)建立片段化dna文库。通过含有543个癌症相关基因的nimblegenseqcap ez文库(roche,usa)捕获dna文库,然后进行novaseq 6000配对末端测序。平均测序深度为5884
×
,平均dna文库投入量为1551ng。
34.4.测序数据分析
35.生成的原始测序数据通过trimmomatic进行质量过滤,然后使用burrows-wheeler aligner(bwa)与人类参考基因组hg19进行比对。生成的sam文件使用novosort进行排序并转换为bam文件。随后,采用基因组分析工具包gatk v3.7对潜在的插入缺失进行局部重新排列,以及通过去除重复读取进行突变注释过程的校准。vardect和freebayes分别用于snv、插入缺失和复杂变异的检测。在突变注释过程中采用肿瘤-正常配对样本区分体细胞变异和胚系变异。针对低深度wgs数据,利用ichorcna软件对致病基因的cnv进行分析。
36.5.基因组不稳定性评分(gi_score)的计算
37.首先以外周血白细胞为参考,筛选出所有样本血浆、脑脊液和组织中共有的单核苷酸多态性位点,并且是白细胞中突变等位基因频率(af)大于0.2且小于0.8的突变位点,作为本发明用于后续基因组稳定性分析的总突变位点。gi_score等于这些突变中af超过上、下四分位数的突变数(gi突变)所占的比例。
38.公式为:
39.6.统计分析
40.所有统计分析均在r语言4.1.2中进行。r包“cutoff”确定gi_score对应总生存率的临界值。采用pearson’sχ2、fisher's精确检验对不同gi评分组的临床病理特征进行对比分析。在检查正态分布的假设之后,使用wilcox检验来评估gi_score与样本类型之间的相关性。通过kaplan
–
meier方法估计无脑膜转移生存期和总生存期。p《0.05被认为具有统计学意义。
41.二、实验结果
42.1.本发明计算出基因组不稳定性评分(gi_score)后,结合患者生存数据,根据r包“cutoff”的结果,设定gi_score≥0.07为基因组不稳定(gi),gi_score《0.07为基因组稳定(gs)。最终66.1%(37/56)的脑脊液cfdna和6%(3/56)的血浆cfdna被定义为gi组,剩余样本被定义为gs组。
43.本发明绘制了基因组不稳定性分析的可视化图(参见图1),可以看到gi组和gs组之间发生突变的等位基因频率(af)存在明显差异。在gi组中af大于上、下四分位数的突变基因数显著高于gs组。
44.2.wgs是确定基因组不稳定性的金标准。为了进一步验证患者的基因组不稳定性分组的可靠性,本发明收集56名mm患者中8例脑脊液和1例配对血浆样本,进行低深度wgs(10
×
)测序分析。结果显示:75%(6/8)的mm患者csf呈gi(图2a-e,h),25%(2/8)的mm患者csf呈gs(图2f,g)。同一患者配对脑脊液和血浆比较,发现脑脊液为gi,血浆为gs。(图2h,i),上述结果与基于543个癌症相关基因的靶向深度测序的脑脊液和血浆的gi_score分组的结果完全一致。
45.3.本发明比较gi_score与脑膜转移瘤(mm)患者性别、年龄、原发肿瘤类型、颅内压和karnofsky功能状态(kps)等临床指标的相关性。结果显示,gi_score与mm患者的预后显著相关,gi组无脑膜转移生存期(mfs)和总生存期(os)均低于gs组(mfs:中位数2.9vs 1.7年,p=0.021,os:中位数3.9vs 2.5年,p=0.038)(图3a-b)。gi组kps评分显著低于gs组(中位数70vs 80,p《0.011),提示gi组的mm患者的健康状态更差(图3c-d)。在45例肺腺癌mm患者中,gi组患者的颅内压显著高于gs组患者(平均数2.43vs 1.29kpa,p=0.0039),提示gi组的mm患者更易发生颅内高压,脑疝的发生风险也随之增加(图3e-f)。gi与性别、年龄、原发肿瘤类型等其他临床病理指标无显著相关性(p》0.05)。
46.4.为了探究比较mm患者脑脊液和血浆cfdna之间基因组不稳定状态的差异,本发明对比了所有配对脑脊液和血浆cfdna的gi_score。结果表明,脑脊液中基因组不稳定性评分显著增加(图4a);脑脊液中gi组占比显著高于血浆(66.07%vs.6%,p《0.0001)(图4b),提示原发肿瘤在转移至脑膜形成mm的过程中可能发生克隆进化。
47.5.最后,本发明对比了gi组的mm样本和gs组的mm样本之间的基因特征。结果表明,
gi组基因突变总数目显著高于gs组,且主要源于基因cnv的差异(图5a,b)。基因差异突变分析的结果表明,tp53突变更多发生在gi组(图5c,p《0.01),且与较高的gi_score相关(图5d,p《0.01)。基因共突变分析的结果显示,tp53/erfr、tp53/rb1、tp53/erbb2和tp53/kmt2c共突变更多发生在gi组(图5e-h,p《0.05),并且与较高的gi_score(图5i-j,p《0.001)和较差的预后相关(图5k-l,p《0.05)。
48.本具体实施方式的实施例均为本发明的较佳实施例,并非依此限制本发明的保护范围,故:凡依本发明的结构、形状、原理所做的等效变化,均应涵盖于本发明的保护范围之内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。