胰岛素化合物与glp-1受体激动剂的复方制剂及其医药用途
技术领域
1.本公开涉及药物组合物领域,特别涉及一种胰岛素化合物与glp-1受体激动剂的复方制剂及其医药用途。
背景技术:
2.糖尿病的患病率正在呈快速上升趋势,已成为继心血管疾病和肿瘤之后的另一个严重危害居民健康的重要慢性非传染性疾病。糖尿病及其各种急慢性并发症所引起的致残性和致死性已成为当前威胁人类健康的世界第三大疾病,严重影响患者的生活质量。
3.胰岛素是一种由51个氨基酸构成的多肽,所述氨基酸在2条氨基酸链上分配:a链(具有21个氨基酸)和b链(具有30个氨基酸)。所述链通过2个二硫桥连接在一起。多年来已经采用胰岛素制剂进行糖尿病治疗。wo2018024186a1描述了一种人胰岛素类似物的酰化衍生物,是一种具有较长作用时间且初始作用是平缓降血糖的基础胰岛素。
4.胰高血糖素样肽1(glp-1)是一种内分泌激素,其在口服摄取葡萄糖或脂肪后提高胰岛素应答。glp-1一般调节胰高血糖素的浓度,减缓胃排空,刺激胰岛素(原)的生物合成,提高针对胰岛素的敏感性,并刺激不依赖胰岛素的糖原生物合成。cn101987868b描述了一种短效glp-1类似物,为人工合成的含有棕榈酸结构的glp-1衍生物,主肽链由40个氨基酸组成。具有较高的开发价值,其具有一个结构为hooc(ch2)
14-co-亲脂性取代基和下述氨基酸序列的c端lys的α氨基或ε氨基通过酰胺键的方式连接:
5.his-aib-glu-gly-thr-phe-thr-ser-asp-val-ser-ser-tyr-leu-glu-glu-glu-ala-ala-lys-glu-phe-ile-ala-trp-leu-val-arg-gly-gly-pro-ser-ser-gly-ala-pro-pro-pro-ser-lys。
6.cn101861333a描述了胰岛素类似物与利拉鲁肽的复方制剂,由于利拉鲁肽与胰岛素竞争锌离子,需要在制剂配制过程中提高锌离子浓度并给予胰岛素类似物和锌离子足够的作用时间。
7.由于不同的多肽类似物其稳定性和活性各不相同,本领域中仍然需要开发稳定性和活性优异的胰岛素与glp-1类似物的复方制剂。
技术实现要素:
8.本公开提供了一种药物组合物,其包含胰岛素化合物、glp-1受体激动剂和锌离子,其中锌离子的含量为每6个胰岛素化合物分子4-8个锌离子,所述glp-1受体激动剂具有如下式所示的结构并且具有一个结构通式为r1(ch2)
n-co-的亲脂性取代基:
9.x
1-x
2-glu-gly-thr-phe-thr-ser-asp-x
10-ser-x
12-x
13-x
14-glu-x
16-x
17-ala-x
19-x
20-x
21-phe-ile-x
24-trp-leu-x
27-x
28-x
29-x
30-x
31-x
32-x
33-x
34-x
35-x
36-x
37-x
38-x
39-lys其中,r1选自ch
3-或者hooc-,n为8-25之间的整数,x1、x2、x
10
、x
12
、x
13
、x
14
、x
16
、x
17
、x
19
、x
20
、x
21
、x
24
、x
27
、x
28
、x
29
、x
30
、x
31
、x
32
、x
33
、x
34
、x
35
、x
36
、x
37
、x
38
、x
39
各自独立的选自任意天然的氨基酸或非天然氨基酸或由其组成的肽段。
10.在一些实施方案中,结构通式为r1(ch2)
n-co-的亲脂性取代基和glp-1类似物的氨基酸残基的氨基通过酰胺键的方式连接,其中r1选自ch
3-或者hooc-,n为8-25的整数。
11.在一些实施方案中,结构通式为r1(ch2)
n-co-的亲脂性取代基和glp-1类似物c端lys的ε氨基通过酰胺键的方式连接,其中r1选自ch
3-或者hooc-,n为8-25的整数。
12.在一些实施方案中,结构通式为r1(ch2)
n-co-的亲脂性取代基和glp-1类似物c端lys的α氨基通过酰胺键的方式连接,其中r1选自ch
3-或者hooc-,n为8-25的整数,例如14。
13.在一些实施方案中,glp-1类似物的氨基酸序列中x1选自l-his、d-his;x2选自ala、d-ala、gly、val、leu、ile、lys、aib;x
10
选自val、leu;x
12
选自ser、lys、arg;x
13
选自tyr、gln;x
14
选自leu、met;x
16
选自gly、glu、aib;x
17
选自gln、glu、lys、arg;x
19
选自ala、val;x
20
选自lys、glu、arg;x
21
选自glu、leu;x
24
选自val、lys;x
27
选自val、lys;x
28
选自lys、glu、asn、arg;x29选自gly、aib;x
30
选自arg、gly、lys;x
31
选自gly、ala、glu、pro、lys;x
32
选自lys、ser;x
33
选自lys、ser;x
34
选自gly、ala、sar;x
35
选自gly、ala、sar;x
36
选自pro、gly;x
37
选自pro、gly;x38选自pro、gly;x
39
选自ser、tyr。
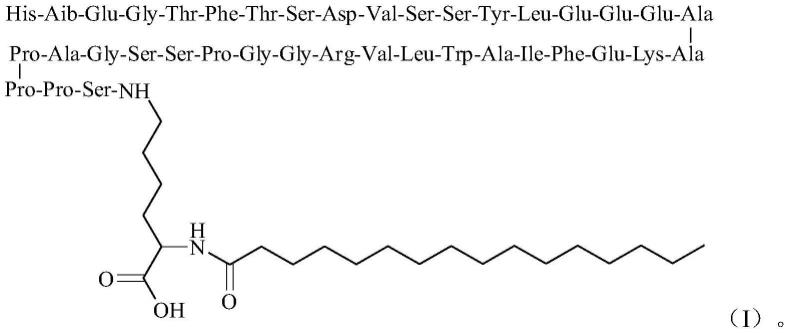
14.本公开提供了一种药物组合物,其包含胰岛素化合物、glp-1受体激动剂和锌离子,其中锌离子的含量为每6个胰岛素化合物分子4-8个锌离子,所述glp-1受体激动剂具有如式(i)所示的结构:
[0015][0016]
在一些实施方案中,锌离子的含量为每6个胰岛素化合物分子4个、5个、6个、7个或8个锌离子,例如每6个胰岛素化合物分子5个锌离子。
[0017]
在一些实施方案中,锌离子的含量为每6个胰岛素化合物分子4-7个锌离子、4-6个锌离子或5-7个锌离子。
[0018]
在一些实施方案中,药物组合物的ph为6.5-8.5、6.6-8.5、6.7-8.5、6.8-8.5、6.9-8.5、7.0-8.5、7.1-8.5、7.2-8.5、7.3-8.5、7.4-8.5、7.5-8.5、7.6-8.5、7.7-8.5、7.8-8.5、7.9-8.5、8.0-8.5、8.1-8.5、8.2-8.5、8.3-8.5、8.4-8.5、6.5-8.4、6.6-8.4、6.7-8.4、6.8-8.4、6.9-8.4、7.0-8.4、7.1-8.4、7.2-8.4、7.3-8.4、7.4-8.4、7.5-8.4、7.6-8.4、7.7-8.4、7.8-8.4、7.9-8.4、8.0-8.4、8.1-8.4、8.2-8.4、8.3-8.4、6.5-8.3、6.6-8.3、6.7-8.3、6.8-8.3、6.9-8.3、7.0-8.3、7.1-8.3、7.2-8.3、7.3-8.3、7.4-8.3、7.5-8.3、7.6-8.3、7.7-8.3、7.8-8.3、7.9-8.3、8.0-8.3、8.1-8.3、8.2-8.3、6.5-8.2、6.6-8.2、6.7-8.2、6.8-8.2、6.9-8.2、7.0-8.2、7.1-8.2、7.2-8.2、7.3-8.2、7.4-8.2、7.5-8.2、7.6-8.2、7.7-8.2、7.8-8.2、7.9-8.2、8.0-8.2、8.1-8.2、6.5-8.1、6.6-8.1、6.7-8.1、6.8-8.1、6.9-8.1、7.0-8.1、7.1-8.1、7.2-8.1、7.3-8.1、7.4-8.1、7.5-8.1、7.6-8.1、7.7-8.1、7.8-8.1、7.9-8.1、8.0-8.1、
6.5-8.0、6.6-8.0、6.7-8.0、6.8-8.0、6.9-8.0、7.0-8.0、7.1-8.0、7.2-8.0、7.3-8.0、7.4-8.0、7.5-8.0、7.6-8.0、7.7-8.0、7.8-8.0、7.9-8.0、6.5-7.9、6.6-7.9、6.7-7.9、6.8-7.9、6.9-7.9、7.0-7.9、7.1-7.9、7.2-7.9、7.3-7.9、7.4-7.9、7.5-7.9、7.6-7.9、7.7-7.9、7.8-7.9、6.5-7.8、6.6-7.8、6.7-7.8、6.8-7.8、6.9-7.8、7.0-7.8、7.1-7.8、7.2-7.8、7.3-7.8、7.4-7.8、7.5-7.8、7.6-7.8、7.7-7.8、6.5-7.7、6.6-7.7、6.7-7.7、6.8-7.7、6.9-7.7、7.0-7.7、7.1-7.7、7.2-7.7、7.3-7.7、7.3-7.8、7.4-7.7、7.5-7.7、7.6-7.7、6.5-7.6、6.6-7.6、6.7-7.6、6.8-7.6、6.9-7.6、7.0-7.6、7.1-7.6、7.2-7.6、7.3-7.6、7.4-7.6、7.5-7.6、6.5-7.5、6.6-7.5、6.7-7.5、6.8-7.5、6.9-7.5、7.0-7.5、7.1-7.5、7.2-7.5、7.3-7.5、7.4-7.5、6.5-7.4、6.6-7.4、6.7-7.4、6.8-7.4、6.9-7.4、7.0-7.4、7.1-7.4、7.2-7.4、7.3-7.4、6.5-7.3、6.6-7.3、6.7-7.3、6.8-7.3、6.9-7.3、7.0-7.3、7.1-7.3、7.2-7.3、6.5-7.2、6.6-7.2、6.7-7.2、6.8-7.2、6.9-7.2、7.0-7.2、7.1-7.2、6.5-7.1、6.6-7.1、6.7-7.1、6.8-7.1、6.9-7.1、7.0-7.1、6.5-7.0、6.6-7.0、6.7-7.0、6.8-7.0、6.9-7.0、6.5-6.9、6.6-6.9、6.7-6.9、6.8-6.9、6.5-6.8、6.6-6.8、6.7-6.8、6.5-6.7、6.6-6.7、或者6.5-6.6。
[0019]
在一些实施方案中,药物组合物的ph为7.0-8.0,例如7.3-7.8。
[0020]
在一些实施方案中,药物组合物的ph为约6.5、约6.6、约6.7、约6.8、约6.9、约7.0、约7.1、约7.2、约7.3、约7.4、约7.5、约7.6、约7.7、约7.8、约7.9、约8.0、约8.1、约8.2、约8.3、约8.4、约8.5,例如约7.5。
[0021]
在一些实施方案中,药物组合物还包含:稳定剂、渗透压调节剂、防腐剂、ph调节剂中的至少一种。
[0022]
在一些实施方案中,所述稳定剂选自醋酸锌、氯化锌、硫酸锌和葡萄糖酸锌中的一种或多种。
[0023]
在一些实施方案中,所述渗透压调节剂选自甘露醇、山梨醇、乳糖、右旋糖、海藻糖、氯化钠、甘油或其任意混合物。
[0024]
在一些实施方案中,所述防腐剂选自苯酚、甲酚、间甲酚、对羟基苯甲酸酯或其任意混合物。
[0025]
在一些实施方案中,所述ph调节剂选自盐酸、乙酸、硫酸、磷酸、氢氧化钠、tris、碳酸盐和磷酸盐中的一种或多种。
[0026]
在一些实施方案中,药物组合物包含胰岛素化合物、glp-1受体激动剂、甘油、苯酚、醋酸锌。
[0027]
在一些实施方案中,所述胰岛素化合物选自天然胰岛素、胰岛素类似物和胰岛素衍生物。
[0028]
在一些实施方案中,天然胰岛素选自人胰岛素、牛胰岛素和猪胰岛素。
[0029]
在一些实施方案中,胰岛素类似物包含相对于人胰岛素的少于10个氨基酸修饰(置换、缺失、添加(包括插入)及其任何组合),或者相对于人胰岛素的少于9、8、7、6、5、4、3、2或1个修饰。胰岛素类似物的实例包括但不限于:des(b30)-人胰岛素;asp(b28)-人胰岛素;asp(b28)des(b30)-人胰岛素;lys(b3)glu(b29)-人胰岛素;lys(b28)pro(b29)-人胰岛素;gly(a21)arg(b31)arg(b32)-人胰岛素;glu(a14)his(b25)-人胰岛素;his(a14)his(b25)-人胰岛素;glu(a14)his(b25)des(b30)-人胰岛素;his(a14)his(b25)des(b30)-人胰岛素;glu(a14)his(b25)des(b27)des(b28)des(b29)des(b30)-人胰岛素;glu(a14)his
(b25)glu(b27)des(b30)-人胰岛素;glu(a14)his(b16)his(b25)des(b30)-人胰岛素;his(a14)his(b16)his(b25)des(b30)-人胰岛素;his(a8)glu(a14)his(b25)glu(b27)des(b30)-人胰岛素;his(a8)glu(a14)glu(b1)glu(b16)his(b25)glu(b27)des(b30)-人胰岛素;以及his(a8)glu(a14)glu(b16)his(b25)des(b30)-人胰岛素。
[0030]
在一些实施方案中,胰岛素类似物选自gly(a21)arg(b31)arg(b32)-人胰岛素、lys(b3)glu(b29)-人胰岛素、asp(b28)-人胰岛素、lys(b28)pro(b29)-人胰岛素、des(b30)-人胰岛素。
[0031]
在一些实施方案中,胰岛素衍生物选自德谷胰岛素、地特胰岛素和具有如下式(ii)所示结构的化合物:
[0032]
s-w-x-y-z
[0033]
(ii)
[0034]
其中s为b链第30位苏氨酸缺失的人胰岛素;-w-x-y-z为胰岛素类似物的酰化修饰基团;
[0035]
其中w为具有-oc(ch2)nco-的二酰基结构,其中n为2~10之间整数,该结构以其酰基之一和母体胰岛素或其类似物的a-链或b-链n-末端氨基酸残基的α-氨基或b-链上存在的赖氨酸残基的ε-氨基形成酰胺键;
[0036]
x为含羧酸基团的二氨基化合物,该化合物以其氨基之一与w中的一个酰基连接形成酰胺键;
[0037]
y为-a(ch2)
m-,其中m为6-32的整数,例如10-16的整数,例如12-14的整数,a不存在或为co-;
[0038]
z为-cooh。
[0039]
在一些实施方案中,所述胰岛素衍生物具有如下式(ii)所示的结构:
[0040]
s-w-x-y-z
[0041]
(ii)
[0042]
其中s为b链第30位苏氨酸缺失的人胰岛素;-w-x-y-z为胰岛素类似物的酰化修饰基团;
[0043]
w与b-链上存在的赖氨酸残基的ε-氨基形成酰胺键;
[0044]
n为2-5的整数,例如2;以及
[0045]
x为-hn(ch2)pch(cooh)nh-,p为2-10的整数,例如2-6的整数,例如2-4的整数,例如4。
[0046]
在一些实施方案中,所述胰岛素衍生物为赖氨酸b29(n
ε-(n
α-十六烷脂肪二酸-l-赖氨酸-n
ε-氧代丁酰基))des(b30)人胰岛素。
[0047]
在一些实施方案中,药物组合物包含:赖氨酸b29(n
ε-(n
α-十六烷脂肪二酸-l-赖氨酸-n
ε-氧代丁酰基))des(b30)人胰岛素、glp-1受体激动剂和锌离子,其中锌离子的含量为每6个胰岛素化合物分子4-8个锌离子。
[0048]
在一些实施方案中,药物组合物包含:赖氨酸b29(n
ε-(n
α-十六烷脂肪二酸-l-赖氨酸-n
ε-氧代丁酰基))des(b30)人胰岛素、glp-1受体激动剂和锌离子,其中锌离子的含量为每6个胰岛素化合物分子5-7个锌离子。
[0049]
在一些实施方案中,药物组合物包含:赖氨酸b29(n
ε-(n
α-十六烷脂肪二酸-l-赖氨
酸-n
ε-氧代丁酰基))des(b30)人胰岛素、glp-1受体激动剂和锌离子,其中锌离子的含量为每6个胰岛素化合物分子5个锌离子。
[0050]
在一些实施方案中,药物组合物包含:赖氨酸b29(n
ε-(n
α-十六烷脂肪二酸-l-赖氨酸-n
ε-氧代丁酰基))des(b30)人胰岛素、glp-1受体激动剂、锌离子、甘油和苯酚,其中锌离子的含量为每6个胰岛素化合物分子4-8个锌离子,例如每6个胰岛素化合物分子5-7个锌离子,例如每6个胰岛素化合物分子5个锌离子。
[0051]
本公开提供一种药物组合物,其包含:人胰岛素,glp-1受体激动剂,和醋酸锌;可选地,进一步包含甘油和/或苯酚。所述glp-1受体激动剂例如为式(i)所示的结构。所述人胰岛素例如为赖氨酸b29(n
ε-(n
α-十六烷脂肪二酸-l-赖氨酸-n
ε-氧代丁酰基))des(b30)人胰岛素。
[0052]
在一些实施方案中,所述药物组合物包含:
[0053]
0.3-1.2mmol/l赖氨酸b29(n
ε-(n
α-十六烷脂肪二酸-l-赖氨酸-n
ε-氧代丁酰基))des(b30)人胰岛素,
[0054]
0.1-1mg/mlglp-1受体激动剂,和
[0055]
0.1-1.2mmol/l醋酸锌;
[0056]
可选地,进一步包含10-30mg/ml甘油,和/或1-10mg/ml苯酚;
[0057]
在一些实施方案中,所述药物组合物包含:
[0058]
0.4-0.8mmol/l赖氨酸b29(n
ε-(n
α-十六烷脂肪二酸-l-赖氨酸-n
ε-氧代丁酰基))des(b30)人胰岛素,
[0059]
0.24-0.4mg/mlglp-1受体激动剂,和
[0060]
0.4-0.8mmol/l醋酸锌;
[0061]
可选地,进一步包含10-30mg/ml甘油,和/或1-10mg/ml苯酚;
[0062]
上述药物组合物的ph为7.0-8.0,优选为7.3-7.8。
[0063]
在一些实施方案中,药物组合物包含:
[0064]
0.6mmol/l赖氨酸b29(n
ε-(n
α-十六烷脂肪二酸-l-赖氨酸-n
ε-氧代丁酰基))des(b30)人胰岛素,
[0065]
0.24-0.4mg/mlglp-1受体激动剂,和
[0066]
0.5mmol/l醋酸锌,
[0067]
可选地,进一步包含19.7mg/ml甘油,和/或5.7mg/ml苯酚,
[0068]
所述药物组合物的ph为7.0-8.0,优选为7.3-7.8。
[0069]
在一些实施方案中,药物组合物包含:
[0070]
0.6mmol/l赖氨酸b29(n
ε-(n
α-十六烷脂肪二酸-l-赖氨酸-n
ε-氧代丁酰基))des(b30)人胰岛素,
[0071]
0.24mg/ml glp-1受体激动剂,
[0072]
0.5mmol/l醋酸锌,
[0073]
19.7mg/ml甘油,和
[0074]
5.7mg/ml苯酚,
[0075]
药物组合物的ph为7.0-8.0,优选为7.3-7.8。
[0076]
在一些实施方案中,药物组合物包含:
[0077]
0.6mmol/l赖氨酸b29(n
ε-(n
α-十六烷脂肪二酸-l-赖氨酸-n
ε-氧代丁酰基))des(b30)人胰岛素,
[0078]
0.32mg/ml glp-1受体激动剂,
[0079]
0.5mmol/l醋酸锌,
[0080]
19.7mg/ml甘油,和
[0081]
5.7mg/ml苯酚,
[0082]
药物组合物的ph为7.0-8.0,优选为7.3-7.8。
[0083]
在一些实施方案中,药物组合物包含:
[0084]
0.6mmol/l赖氨酸b29(n
ε-(n
α-十六烷脂肪二酸-l-赖氨酸-n
ε-氧代丁酰基))des(b30)人胰岛素,
[0085]
0.4mg/ml glp-1受体激动剂,
[0086]
0.5mmol/l醋酸锌,
[0087]
19.7mg/ml甘油,和
[0088]
5.7mg/ml苯酚,
[0089]
药物组合物的ph为7.0-8.0,优选为7.3-7.8。
[0090]
一些实施方案中,上述药物组合物的ph可以为约7.5。
[0091]
在一些实施方案中,药物组合物为用于胃肠外给药的可溶性药物组合物,例如为注射液、冻干制剂,或所述冻干制剂复溶得到的溶液。在一些具体实施方案中,药物组合物为注射剂。
[0092]
本公开还提供了一种药物组合物,其包含胰岛素化合物和glp-1受体激动剂,所述胰岛素化合物是赖氨酸b29(n
ε-(n
α-十六烷脂肪二酸-l-赖氨酸-n
ε-氧代丁酰基))des(b30)人胰岛素,所述glp-1受体激动剂具有如式(i)所示的结构:
[0093][0094]
可选地,所述药物组合物中还含有醋酸锌。
[0095]
在一些实施方案中,本公开的药物组合物中glp-1受体激动剂不与胰岛素化合物竞争锌离子。
[0096]
在一些实施方案中,本公开的药物组合物于2-8℃稳定至少3个月、至少6个月、至少12个月、至少18个月或至少24个月。
[0097]
在一些实施方案中,本公开药物组合物于25℃下或室温下稳定至少7天、至少14天、至少28天、至少30天、至少1个月、至少2个月、至少3个月、至少6个月、至少12个月、至少18个月或至少24个月。
[0098]
在一些实施方案中,本公开的药物组合物在40℃、30天放置条件下,以质量计,胰岛素化合物的最大单杂低于0.90%、0.85%、0.80%、0.75%、0.70%、0.65%、0.60%、0.55%、或0.50%;a21脱酰胺低于1.5%、1.4%、1.3%、1.2%、1.1%、1.0%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、或0.3%;b3脱氨低于0.5%、0.45%、0.4%、0.35%、0.3%、0.25%、0.2%、0.15%、或0.1%;和/或总杂低于5.5%、5.4%、5.3%、5.2%、5.1%、5.0%、4.9%、4.8%、4.7%、4.6%、4.5%、4.4%、4.3%、4.2%、4.1%、4.0%、3.9%、3.8%、3.7%、3.6%、3.5%、3.4%、3.3%、3.2%、3.1%、或3.0%。
[0099]
在一些实施方案中,本公开的药物组合物在40℃、30天放置条件下,以质量计,glp-1受体激动剂的最大单杂低于1.5%、1.4%、1.3%、1.2%、1.1%、1.0%、0.9%、或0.8%;总杂低于6.5%、6.0%、5.5%、5.0%、4.9%、4.8%、4.7%、4.6%、4.5%、4.4%、4.3%、4.2%、4.1%、或4.0%。
[0100]
在一些实施方案中,本公开的药物组合物在40℃、30天放置条件下,以质量计,高分子蛋白不超过0.6%、0.55%、0.5%、0.45%、0.4%、0.35%、或0.3%。
[0101]
在一些实施方案中,本公开的药物组合物在25℃、30天放置条件下,以质量计,胰岛素化合物的最大单杂低于0.80%、0.75%、0.70%、0.65%、0.60%、0.55%、或0.50%;a21脱酰胺低于0.5%、0.4%、0.3%、0.2%、或0.1%;b3脱氨低于0.4%、0.35%、0.3%、0.25%、0.2%、0.15%、或0.1%;和/或总杂低于3.0%、2.5%、2.0%、1.5%、或1.0%。
[0102]
在一些实施方案中,本公开的药物组合物在25℃、30天放置条件下,以质量计,glp-1受体激动剂的最大单杂低于0.8%、0.7%、0.6%、0.5%、或0.4%;总杂低于3.5%、3.4%、3.3%、3.2%、3.1%、或3.0%。
[0103]
在一些实施方案中,本公开的药物组合物在25℃、30天放置条件下,以质量计,高分子蛋白不超过0.35%、0.3%、0.25%、或0.2%。
[0104]
本公开还提供了一种制备上述药物组合物的方法,其包括:
[0105]
(1)将胰岛素化合物溶解在5-15mm naoh溶液中,加入提供锌离子的稳定剂,调节ph获得胰岛素化合物母液;
[0106]
(2)取5-15mm naoh溶液,加入glp-1受体激动剂,调节ph,获得glp-1受体激动剂母液;
[0107]
(3)将胰岛素化合物母液与glp-1受体激动剂母液混合,调节ph。
[0108]
在一些实施方案中,胰岛素化合物母液与glp-1受体激动剂母液混合之前无需间隔一段时间例如48小时、24小时、12小时、6小时、4小时或2小时。
[0109]
在一些实施方案中,胰岛素化合物母液配制过程中无需添加额外的锌离子,即处方量以外的锌离子。
[0110]
本公开还提供了一种组合或产品,包含式(i)所示glp-1受体激动剂和赖氨酸b29(n
ε-(n
α-十六烷脂肪二酸-l-赖氨酸-n
ε-氧代丁酰基))des(b30)人胰岛素,可选地,所述组合或产品中进一步包含锌离子,所述锌离子例如为醋酸锌。
[0111]
本公开还提供了一种试剂盒,所述试剂盒包括第一药物组合物和第二药物组合物,其中第一药物组合物包括式(i)所示glp-1受体激动剂,第二药物组合物包括赖氨酸b29(n
ε-(n
α-十六烷脂肪二酸-l-赖氨酸-n
ε-氧代丁酰基))des(b30)人胰岛素,优选的,所述第二药物组合物中进一步包含锌离子,其中锌离子的含量为每6个胰岛素化合物分子4-8个锌
离子。
[0112]
本公开还提供了前述本公开任意的药物组合物、产品、组合、试剂盒在制备用于治疗糖尿病的药物中的用途,所述糖尿病例如为2型糖尿病。
[0113]
本公开还提供了前述本公开任意的药物组合物、产品、组合、试剂盒用于治疗糖尿病,所述糖尿病为例如为2型糖尿病。
[0114]
本公开还提供了前述本公开任意的药物组合物、产品、组合、试剂盒治疗糖尿病的方法,其包括向有其需要的对象施用治疗有效量的上述药物组合物,所述糖尿病例如为2型糖尿病。
[0115]
本公开还提供了式(i)所示glp-1受体激动剂与胰岛素化合物联合在制备用于治疗糖尿病(例如2型糖尿病)的药物中的用途,所述胰岛素化合物例如为赖氨酸b29(n
ε-(n
α-十六烷脂肪二酸-l-赖氨酸-n
ε-氧代丁酰基))des(b30)人胰岛素或其锌复合物。
附图说明
[0116]
图1:锌离子筛震摇20d硫黄素t检验结果。
具体实施方式
[0117]
术语
[0118]
为了更容易理解本公开,以下具体定义了某些技术和科学术语。除显而易见在本公开中的它处另有明确定义,否则本公开使用的所有其它技术和科学术语都具有本公开所属领域的一般技术人员通常理解的含义。
[0119]
本公开中,组合物中锌离子的含量可以常规的摩尔浓度(mol/l)表示,也可以每6个胰岛素化合物分子对应几个锌离子来表述,例举性的如锌离子含量为每6个胰岛素化合物分子4-8个锌离子,4-8个锌离子/6个胰岛素化合物分子,或者4-8zn
2
/6ins。
[0120]
本公开中,术语“胰岛素化合物”是指天然胰岛素或其具有胰岛素活性的类似物或衍生物的肽。
[0121]
本公开中,“天然胰岛素”是指天然存在的胰岛素,例如人胰岛素、牛胰岛素或猪胰岛素。
[0122]
本公开中,术语“胰岛素类似物”意指经修饰的人胰岛素,其中该胰岛素的一个或多个氨基酸残基已经被其他氨基酸残基置换,并且/或者其中一个或多个氨基酸残基已从该胰岛素中删除,并且/或者其中一个或多个氨基酸残基已被添加和/或插入到该胰岛素中。
[0123]
本公开中,“des(b30)”或“b(1-29)”是指缺乏b30氨基酸的天然胰岛素b链或其类似物;“a(1-21)”是指天然胰岛素a链。例如,a21gly,b28asp,desb30人胰岛素是人胰岛素的一种类似物,其中a链中位置21处的氨基酸被甘氨酸置换,b链中位置28处的氨基酸被天冬氨酸置换,并且b链中位置30处的氨基酸缺失。
[0124]
本公开中,术语“胰岛素衍生物”是指经化学修饰的亲本胰岛素或其类似物,其中所述修饰是连接酰胺、碳水化合物、烷基、酰基、酯、peg化等形式。例如本公开的胰岛素衍生物的一个实例是赖氨酸b29(n
ε-(n
α-十六烷脂肪二酸-l-赖氨酸-n
ε-氧代丁酰基))des(b30)人胰岛素。
[0125]
术语“受体激动剂”是指与受体结合并引发天然配体的典型响应的化合物。术语“glp-1受体激动剂”式子能够与glp-1受体结合并能够将其激活的化合物,例如glp-1类似物。术语“glp-1类似物”是指以人glp-1(7-37)肽为母体,包括glp-1(7-36)酰胺和glp-1(7-37),进行部分氨基酸的替换或在c端的延伸得到新的glp-1肽,任选地被利用亲脂性取代基对glp-1肽的氨基酸残基进行化学修饰而得到的化合物,该glp-1肽具备人glp-1的功能。
[0126]
术语“糖尿病”包括1型糖尿病、2型糖尿病、妊娠糖尿病(妊娠期间)和引起高糖血症的其它状况。该术语可用于以下代谢病症:其中胰腺产生不足量的胰岛素,或其中身体的细胞不能对胰岛素作出适当的反应因而阻止细胞吸收葡萄糖,从而导致葡萄糖积聚在血液中。1型糖尿病,也称为胰岛素-依赖性糖尿病(iddm)和青年发病型糖尿病,由β-细胞破坏引起,通常导致绝对胰岛素缺乏。2型糖尿病,也称为非-胰岛素依赖性糖尿病(niddm)和成人发病型糖尿病,与主要的胰岛素抵抗和因而相对胰岛素缺乏和/或伴有胰岛素抵抗的主要胰岛素分泌缺乏有关。
[0127]
本公开中所述药物组合物的溶液形式,若无特殊说明,其中的溶剂均为水。
[0128]“冻干制剂”表示液体或溶液形式的药物组合物或液体或溶液制剂经真空冷冻干燥步骤之后获得的制剂或药物组合物。
[0129]“药物组合物”或“药物制剂”表示含有一种或多种本公开所述化合物或其生理学上/可药用的盐或前体药物与其他化学组分的混合物,所述其他组分例如生理学/可药用的载体和赋形剂。药物组合物的目的是保持多肽活性成分的稳定性,促进对生物体的给药,利于活性成分的吸收进而发挥生物活性。本公开中,“药物制剂”和“药物组合物”、“制剂”并不互相排斥。
[0130]
本公开所用术语“约”是指数值在由本领域一般技术人员所测定的具体值的可接受误差范围内,所述数值部分取决于怎样测量或测定(即测量体系的限度)。例如,在本领域每一次实行中“约”可意味着在1内或超过1的标准差。或者,“约”可意味着至多20%的范围。此外,特别对于生物学系统或过程而言,该术语可意味着至多一个数量级或数值的至多5倍。除非另外说明,否则当具体值在本技术和权利要求中出现时,“约”的含义应该假定为在该具体值的可接受误差范围内。
[0131]
本公开所述的药物组合物能够达到一种稳定的效果:其中的蛋白或多肽在贮藏后基本上保留其物理稳定性和/或化学稳定性和/或生物学活性的药物组合物,优选地,药物组合物在贮藏后基本上保留其物理和化学稳定性以及其生物学活性。贮藏期一般基于药物组合物的预定保存期来选择。目前有多种测量蛋白质稳定性的分析技术,可测量在选定温度贮藏选定时间段后的稳定性。
[0132]
稳定的药物多肽制剂是在下述情况下没有观察到显著变化的制剂:在冷藏温度(2-8℃)保存至少3个月、优选6个月、更优选1年,且甚至更优选地最多达2年。另外,稳定的液体制剂包括这样的液体制剂:其在包括25℃和40℃在内的温度保存包括1个月、3个月、6个月在内的时段后表现出期望的特征。稳定性的典型的可接受的标准如下:通过视觉分析,药物多肽制剂是无色的,或澄清至稍微乳白色。所述制剂的浓度、ph和重量克分子渗透压浓度具有不超过
±
10%变化。通常观察到不超过约10%、优选不超过约5%的截短。通常形成不超过约10%、优选不超过约5%的聚集。
[0133]
如果在目检颜色和/或澄清度后,或者通过uv光散射、尺寸排阻色谱法(sec)和动
态光散射(dls)测得,蛋白或多肽没有显示出显著的聚集增加、沉淀和/或变性,那么所述蛋白或多肽在药物制剂中“保留它的物理稳定性”。蛋白构象的变化可以通过荧光光谱法(其确定蛋白三级结构)和通过ftir光谱法(其确定蛋白二级结构)来评价。
[0134]
如果蛋白或多肽没有显示出显著的化学改变,那么所述蛋白或多肽在药物制剂中“保留它的化学稳定性”。通过检测和定量化学上改变的形式的蛋白,可以评估化学稳定性。经常改变蛋白化学结构的降解过程包括水解或截短(通过例如尺寸排阻色谱法和sds-page等方法来评价)、氧化(通过例如与质谱法或maldi/tof/ms结合的肽谱法等方法来评价)、脱酰胺作用(通过例如离子交换色谱法、毛细管等电聚焦、肽谱法、异天冬氨酸测量等方法来评价)和异构化(通过测量异天冬氨酸含量、肽谱法等来评价)。
[0135]
如果蛋白或多肽在给定时间的生物活性是在制备药物制剂时表现出的生物活性的预定范围内,那么所述蛋白或多肽在药物制剂中“保留它的生物活性”。
[0136]
实施例
[0137]
以下结合实施例进一步描述本公开,但这些实施例并非限制着本公开的范围。本公开实施例中未注明具体条件的实验方法,通常按照常规条件,如冷泉港的抗体技术实验手册,分子克隆手册;或按照原料或商品制造厂商所建议的条件。未注明具体来源的试剂,为市场购买的常规试剂。
[0138]
实施例1防腐剂和渗透压调节剂的考察
[0139]
本发明实施例中采用的胰岛素化合物为赖氨酸b29(n
ε-(n
α-十六烷脂肪二酸-l-赖氨酸-n
ε-氧代丁酰基))des(b30)人胰岛素(以下简称ins-a),其结构如下所示:
[0140][0141]
使用的glp-1受体激动剂的结构如下所示:
[0142][0143]
首先按照如下工艺配制复方制剂:
[0144]
(1)分别配制各辅料母液备用;
[0145]
(2)将处方量的ins-a溶解在适量10mm naoh溶液中,向ins-a主药溶液中加入处方量辅料母液,补加适量注射用水,调节ph获得ins-a母液;
[0146]
(3)取7.5mm naoh溶液,加入处方量的glp-1受体激动剂原料药,搅拌分散溶解,调
节ph,定容至目标体积,获得glp-1受体激动剂母液;
[0147]
(4)将ins-a母液与glp-1受体激动剂母液混合,搅拌均匀,调节ph,定容至制剂溶液的目标体积;
[0148]
(5)中控、过滤、灌装、加塞、包装。
[0149]
为了筛选适合于复方制剂的防腐剂和稳定剂,本实施例设计了以下制剂:制剂1中防腐剂为苯酚、渗透压调节剂为甘油;制剂2中防腐剂为苯酚和间甲酚,渗透压调节剂为甘油;制剂3中防腐剂为苯酚,渗透压调节剂为甘油和氯化钠;于25℃及40℃放置5天、10天、30天(5d、10d、30d)考察制剂稳定性。制剂组成如下表1、结果如下表2-3:
[0150]
表1.防腐剂和稳定剂的制剂筛选
[0151][0152][0153]
表2.防腐剂和稳定剂的制剂筛选考察结果
[0154][0155]
表3.防腐剂和稳定剂的制剂筛选考察结果
[0156][0157]
[0158]
实验结果表明,相较于制剂1(不含氯化钠和间甲酚),制剂3(含氯化钠)和制剂2(含间甲酚)最大单杂、总杂、高分子蛋白增长较快,表明不加入氯化钠和间甲酚的制剂1具有更优的稳定性。
[0159]
实施例2制剂ph的考察
[0160]
因两种活性成份在水中溶解性差,在碱性溶液中易溶,因此选择低浓度氢氧化钠溶液作为溶媒,在此基础上进行ph筛选。首先选择溶液的ph为6.5、7.0、8.0进行初筛,根据实验结果,再对7.0、7.5、8.0、8.5四个ph进行详细考察。ph为6.5、7.0、8.0的制剂组成如表4,理化结果如表5,液相结果如表6;ph为7.0、7.5、8.0、8.5的制剂组成如表7,考察结果见表8、表9:
[0161]
表4.ph筛选(6.5、7.0、8.0)制剂组成
[0162][0163]
表5.ph筛选(6.5、7.0、8.0)考察结果
[0164][0165]
[0166]
表6.ph筛选(6.5、7.0、8.0)考察结果(续)
[0167][0168]
备注:
[0169]
[1]在实验过程中,ph在调节至6.0的过程中,出现乳光现象,ph调节至6.5时,溶液恢复正常。制剂4、制剂5、制剂6的ph分别为6.5、7.0、8.0。
[0170]
试验结果表明,不同ph的样品,理化性质无明显变化。40℃30d结果显示,随着ph的升高,高分子蛋白、样品最大单杂、b3脱氨略微增大,单杂、总杂和a21脱氨增长明显更加缓慢,且ph6.5时ins-a含量明显降低。考察结果表明,制剂的质量在7.0~8.0相对较好,故选择ph 7.0、7.5、8.0、8.5进行下一步考察。
[0171]
根据上述结果,筛选溶液ph为7.0、7.5、8.0及8.5,考察其稳定性情况。
[0172]
表7.ph筛选(7.0、7.5、8.0、8.5)制剂组成
[0173][0174]
表8ph筛选(7.0、7.5、8.0、8.5)考察结果
[0175][0176][0177]
表9ph筛选(7.0、7.5、8.0、8.5)考察结果(续)
[0178][0179]
试验结果表明,ph在7.0~8.0之间,最大单杂、总杂、高分子蛋白、主药含量差别不大;ph=8.0~8.5之间,b3脱氨、高分子蛋白、最大单杂及总杂增长速率较快,且ph8.5时,glp-1受体激动剂含量明显降低;ph=7.3-7.8时,总杂最小,各杂质及高分子蛋白增长适中,溶液较为稳定。
[0180]
实施例3锌离子浓度的考察
[0181]
锌离子参与制剂中的二六聚体及多六聚体的形成。加入量过少,胰岛素化合物分子不能充分与其结合,易造成样品不稳定,同时影响药物的长效机制;加入量过多易引起蛋白聚集,故对锌离子浓度进行筛选。在保持ins-a、glp-1受体激动剂、99.7%甘油、苯酚及ph不变的条件下,分别对5.0zn
2
/6ins、6.5zn
2
/6ins、8.0zn
2
/6ins、8.5zn
2
/6ins(“xx zn
2
/xx ins”指的是锌离子与ins-a分子的摩尔比)浓度的锌离子加入量进行筛选,其制剂组成如表10,结果如下表11:
[0182]
表10锌离子筛选制剂组成
[0183][0184]
注:
[0185]
[1]制剂11为6.5zn
2
/6ins;制剂12为5.0zn
2
/6ins;制剂13为8.0zn
2
/6ins;制剂14为8.5zn
2
/6ins。“xx zn
2
/xx ins”指的是锌离子与ins-a分子的摩尔比。
[0186]
[2]制剂14在加锌后,调ph至7.5出现明显白色乳光,浑浊,出现蛋白聚集,与锌离子浓度过高有关,该制剂舍弃。
[0187]
[3]醋酸锌的质量体积浓度以二水醋酸锌计。
[0188]
表11锌离子筛考察结果
[0189][0190]
试验结果表明,5.0zn
2
/6ins、6.5zn
2
/6ins、8.0zn
2
/6ins浓度锌离子条件下,glp-1受体激动剂的总杂及最大单杂无明显变化。40℃及25℃放置条件下,各制剂ins-a最大单杂、a21脱氨、b3脱氨及总杂、高分子蛋白无明显差异。硫黄素t检验结果(图1)表明,震摇过程中6.5zn
2
/6ins(制剂11)和8.0zn
2
/6ins(制剂13)制剂蛋白的纤维化程度明显增大,表明锌离子浓度过高容易引起蛋白聚集,不利于制剂稳定。
[0191]
锌离子浓度筛选结果表明,5.0zn
2
/6ins更优,为对该结果进行进一步验证,又开展了聚体研究。
[0192]
实施例4聚体研究实验
[0193]
有文献报道,同类产品xultophy复方制剂中利拉鲁肽会与德谷胰岛素竞争性的结合锌离子形成双七聚体,故其制剂中加锌量为8.5zn
2
/6ins(德谷胰岛素分子与5zn
2
结合;剩余的3.5zn
2
供利拉鲁肽竞争性结合),且德谷胰岛素中间体配制完成后需放置48h充分平衡后再加入利拉鲁肽溶液。本实施例研究了glp-1受体激动剂对锌离子是否有竞争作用,用于聚体研究的制剂如表12,结果如表13。
[0194]
表12glp-1受体激动剂注射液聚体研究制剂组成
[0195][0196]
[1]醋酸锌的质量体积浓度以二水醋酸锌计。
[0197]
表13glp-1受体激动剂注射液聚体研究结果
[0198]
制剂编号151617181920av
mw(kda)
17.8617.317.1317.2117.7117.69
[0199]
聚体研究结果表明,不同制剂glp-1受体激动剂注射液中,glp-1受体激动剂分子大小为17kda左右,均以四聚体的形式存在,无明显差异。综上,glp-1受体激动剂不与锌离子结合,故ins-a中间体配制完成后不需要间隔48h,也不需要提供额外的锌离子。
[0200]
实施例5长期加速稳定性实验
[0201]
按照实施例1所述方法配制表14的处方,并在25℃
±
2℃和rh60%
±
5%条件下放置1、2、3和6个月,加速条件实验结果如表15-16所示。
[0202]
表14.制剂处方
[0203]
[0204]
[1]醋酸锌的质量体积浓度以二水醋酸锌计。
[0205]
表15
[0206][0207]
表16.加速稳定性
[0208][0209]
按照实施例1所述方法配制表14的处方,并在5℃
±
3℃、rh60%
±
5%条件下放置3、6、9和12个月,长期稳定性实验结果如表17-18所示。
[0210]
表17
[0211][0212]
表18.长期稳定性
[0213][0214]
长期稳定性实验结果表明,表14处方是稳定的。
[0215]
虽然为了清楚的理解,已经借助于附图和实例详细描述了上述发明,但是描述和实例不应当解释为限制本公开的范围。本文中引用的所有专利和科学文献的公开内容通过引用完整地清楚结合。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。