1.本发明属于海洋环境保护领域,一种我国近海可形成厘米级大小囊体的球形棕囊藻phaeocystis globosa的快速检测方法。
背景技术:
2.球形棕囊藻phaeocystis globosa是一种全球广布的微藻,在热带和温带近海海域常发生有害赤潮,其生活史较为复杂,分为游离单细胞和胶质囊体两个阶段,当海水中出现大量的囊体意味着球形棕囊藻赤潮的暴发。球形棕囊藻赤潮暴发时产生的有毒物质常造成海洋生物的死亡;产生的囊体表面的胶状物质阻塞海洋鱼类的呼吸器官导致其窒息死亡;赤潮消亡时,高生物量的球形棕囊藻细胞分解消耗大量氧气,造成水体缺氧,严重海洋生物的生存。自从1997年在我国东南沿海首次暴发后,球形棕囊藻赤潮已成为我国东南沿海最为严重的赤潮灾害。我国东南沿海的球形棕囊藻赤潮具有一个独特的特征,即赤潮过程中球形棕囊藻可以形成厘米级大小的囊体。形成的厘米级大小的囊体常堵塞沿岸的核电冷源系统,对核电安全产生造成不利影响。
3.海水中囊体出现前,球形棕囊藻以游离单细胞方式存在。球形棕囊藻游离单细胞直径约为3-9μm,在形态上难以与其它藻类区分,因此常规显微观察和计数方法不适用于球形棕囊藻游离细胞的定量检测。其它检测手段,包括色素分析、流式细胞计数、荧光原位杂交等,由于特异性低,检出限高,灵敏度差等缺点,也不适用于球形棕囊藻游离单细胞定量检测,限制对赤潮早期的监测预警。
4.球形棕囊藻具有复杂的遗传多样性和多样化的形态学特征,通过多年研究,发现我国东南沿海分布的球形棕囊藻中,部分藻株可形成厘米级大小的囊体,而其它的藻株形成的囊体小于3毫米(王锦秀等,2019,六株球形棕囊藻的色素组成特征研究,海洋与湖沼,50(3):611-620;胡晓坤等,2019,北部湾海域球形棕囊藻遗传多样性分析,海洋与湖沼,50(3):601-610)。其中仅可形成厘米级大小囊体的球形棕囊藻是我国近海球形棕囊藻赤潮的致灾种。因此,急需一种特异检测可形成厘米级囊体的球形棕囊藻,且检出限低的定量检测技术,为我国东南沿海球形棕囊藻赤潮的发生和发展过程的监测、以及为预防球形棕囊藻赤潮暴发所带来的危害提供技术支持。
技术实现要素:
5.本发明目的在于提供一种检测速度快、灵敏性高、特异性检测可形成厘米级大小囊体的球形棕囊藻的定量方法。
6.为实现上述目的,本发明采用技术方案为:
7.一种用于检测可形成厘米级大小囊体的球形棕囊藻的特异性引物和探针,所述特异性的引物和探针为:
8.上游引物:pg-f 5
′‑
gtcgtaggttaaggcttcaa-3
′
9.下游引物:pg-r 5
′‑
agtcgctaacagtagaaagaatag-3
′
10.探针:pg-pr 5
′‑
tgcggcccaaacattttcagct-3
′
。
11.所述探针的5
′
端连接texas red荧光染料。
12.一种特异性引物和探针的应用,所述特异性引物和探针在检测可形成厘米级大小囊体的球形棕囊藻中的应用。
13.一种检测可形成厘米级大小囊体的球形棕囊藻的试剂盒,所述的试剂盒包含有权利要求1所述的特异性引物和探针。
14.一种检测球形棕囊藻的方法,以样品中藻基因组总dna为模板,利用可形成厘米级大小囊体的球形棕囊藻的特异性引物和探针通过荧光定量pcr扩增和荧光信号对样品中的可形成厘米级大小囊体的球形棕囊藻进行检测。
15.所述荧光定量pcr体系为:反应总体积为10μl,包括基因组dna 1μl,2
×
probe qpcr mix buffer(takara,takara商业化产品,无中文)5μl,上游引物、下游引物、探针各0.2μl(浓度10μm),灭菌去离子水3.4μl。
16.所述荧光定量pcr条件为95℃预变性30s;95℃变性5s,60℃退火/延伸30s,40个循环,收集texas red荧光。
17.本发明所具有的优点:
18.本发明的检测方法以线粒体atp8为目标基因,该基因在细胞内的拷贝数稳定,且具有分辨可形成厘米级大小囊体的球形棕囊藻和其它球形棕囊藻的能力。本发明的检测方法针对可形成厘米级大小囊体的球形棕囊藻的线粒体atp8的序列设计特异性引物和taqman探针,采用荧光定量pcr技术手段进行检测。
19.本发明具有以下的优点:
20.1.特异性高,本发明的qpcr方法可对球形棕囊藻种下水平建立的定量检测方法,特异性定量检测我国近海可形成厘米级大小囊体的球形棕囊藻;
21.2.灵敏度高,本发明的qpcr方法最低检测限达到1个细胞水平,可对海域中低丰度的可形成厘米级大小囊体的球形棕囊藻进行检测,进而有助于棕囊藻赤潮早期的预测预警;
22.3.检测范围广,本发明的的qpcr方法检出限范围在30cells/l-3
×
108cells/l,检测范围广,达到7个数量级,满足野外调查的需求;
23.4.检测速度快,本发明的qpcr方法易操作,节省时间,可在短时间内得到结果。
附图说明
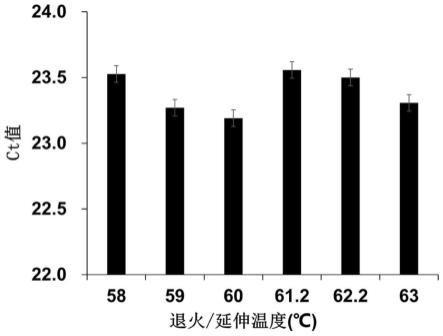
24.图1为本发明实例提供qpcr反应退火/延伸温度图。
25.图2为本发明实例提供的工作曲线。
26.图3为本发明实施例提供的种间特异性验证图。
27.图4为本发明实施例提供的种内特异性验证图。
28.图5为本发明实施例提供的检出限图。
具体实施方式
29.以下结合实例对本发明的具体实施方式做进一步说明,应当指出的是,此处所描述的具体实施方式只是为了说明和解释本发明,并不局限于本发明。
30.实施例1
31.检测可形成厘米级大小囊体的球形棕囊藻方法的建立:
32.1.1引物、探针的设计
33.从genbank中获取6株定鞭藻(chrysochromulina parva nc036938、chrysochromulina sp.kj201908、pavlova lutheri hq908424,pavlova sp.mn564259、phaeocystis antarctica jn131834和phaeocystis globosa kc967226)线粒体atp8的序列信息,进行序列比对。根据比对结果,利用primer 5.05软件设计线粒体atp8序列的扩增引物(上游引物:pg-atp8-f5
’‑
tgcctcaattcgatttatttact-3’,下游引物:pg-atp8-r 5
’‑
gaagcyyctaaagtattrcctaa-3’);
34.取对数生长期的可形成厘米级囊体的球形棕囊藻和其它不形成厘米级囊体的球形棕囊藻的藻液20ml,经直径47mm,孔径0.4μm聚碳酸酯纤维滤膜(http04700)过滤,压力不超过0.05mpa,-80℃保存直至dna提取;采用传统的ctab法提取总dna;
35.利用合成的上述线粒体atp8扩增引物对对提取的dna样品进行pcr扩增,反应体系为:反应总体积20μl,包括1μl总dna,灭菌去离子水8.2μl,4μl 5
×
rtaq buffer(mg 2 ),4μl 5
×
pcr solution buff er,1.6μl dntp mix(2.5mmol/l),上、下游引物各0.4μl,以及0.4μl超保真taq dna polymerase(5u/ml,北京全式金生物技术有限公司,中国)。反应条件为:98℃预变性2min;98℃变性20s,58℃退火20s,72℃延伸20s,32个循环;72℃延伸5min;
36.pcr反应产物经1%的琼脂糖凝胶电泳、纯化后测序;
37.通过比对测序结果并根据比对的结果,利用beacon designer 8.14软件设计针对可形成厘米级囊体的球形棕囊藻的特异性引物和探针;
38.其序列信息为:
39.上游引物:pg-f 5
′‑
gtcgtaggttaaggcttcaa-3
′
40.下游引物:pg-r 5
′‑
agtcgctaacagtagaaagaatag-3
′
41.探针:pg-pr 5
′‑
tgcggcccaaacattttcagct-3
′
42.1.2反应体系优化
43.通过设置不同的引物、探针比例(400nm:400nm,400nm:300nm,400nm:200nm,400nm:100nm,300nm:300nm,300nm:200nm,300nm:100nm,200nm:200nm,200nm:100nm,and 100nm:100nm),比较不同比例下相同dna模板的qpcr反应的扩增效率,每个梯度3个平行,以确定反应的最佳引物、探针比。
44.结果见表1,由结果可知,引物、探针比为200nm:200nm时,qpcr反应的ct值最低,扩增效率最高,因此选择200nm:200nm作为反应的引物、探针比。
45.表1不同引物、探针比条件下qpcr反应ct值
[0046][0047]
1.3反应条件优化
[0048]
为了进一步提高反应的扩增效率,设置不同的退火/延伸温度(58,59,60,61.2,62.2和63℃),比较在最适反应体系时,不同温度条件下含有相同dna模板的qpcr反应的扩增效率,每个温度梯度3个平行。
[0049]
结果表明,在60℃时,反应的ct值最低,扩增效率最高(参见图1),因此选择60℃作为反应的退火/延伸温度。
[0050]
实施例2
[0051]
取中国科学院海洋研究所保种的可形成厘米级大小囊体的球形棕囊藻pg2016株系对数生长期藻液和小球藻对数生长期藻液,于显微镜下计数。将可形成厘米级大小囊体的球形棕囊藻pg2016株系藻液用灭菌海水梯度稀释至在108、107、106、105、104、103和102cells/l几个梯度,每个梯度设4个平行,每个平行100ml混合藻液(小球藻藻密度为1
×
108cells/l,加入小球藻作为保护藻,为了保护dna提取过程中目标藻—可形成厘米级囊体的球形棕囊藻pg2016株系dna的损失,有利于提高方法的灵敏度)经直径47mm,孔径0.4μm聚碳酸酯纤维滤膜(http04700)过滤,压力不超过0.05mpa,-80℃保存直至dna提取;
[0052]
采用传统的ctab法提取总dna;
[0053]
qpcr体系液为10μl,反应液组成如下:3.4μl h2o、5μl 2
×
probe qpcr mix buffer、0.2μl上游引物(10μm)、0.2μl下游引物(10μm)、0.2μl探针(10μm)、1μl dna溶解液;其特异性引物、探针序列如下:
[0054]
上游引物:pg-f 5
′‑
gtcgtaggttaaggcttcaa-3
′
,
[0055]
下游引物:pg-r 5
′‑
agtcgctaacagtagaaagaatag-3
′
,
[0056]
探针:pg-pr 5
′‑
tgcggcccaaacattttcagct-3
′
;
[0057]
qpcr反应程序如下:95℃反应30s,再进行40个循环(95℃反应5s、60℃反应30s);
[0058]
根据所得的ct值建立方法的工作曲线(参见图2)。结果表明利用上述构建的可形成厘米级大小囊体的球形棕囊藻的快速定量检测试剂盒,线性良好(r2=0.9997),扩增效率符合qpcr方法的要求(e=105%)。
[0059]
实施例3
[0060]
特异性验证
[0061]
选取中国科学院海洋研究所保种的甲藻(太平洋亚历山大藻、链状裸甲藻、东海原
甲藻、米氏凯伦藻、海洋原甲藻、微小原甲藻、剧毒卡尔藻、前沟藻、锥状斯氏藻等)、硅藻(中肋骨条藻、三角褐指藻、多纹拟菱形藻等)、针胞藻(卡盾藻、赤潮异弯藻)、海金藻(抑食金球藻)、金藻(球等鞭金藻)、绿藻(小球藻、扁藻、盐藻、隐藻等)、定鞭藻(南极棕囊藻、p.rex、p.cordata、p.jahnii)作为阴性对照,以两株中国科学院海洋研究所保种的分离自南海可形成厘米级囊体的球形棕囊藻pg2016株系和mel70株系作为阳性样品,进行种间的特异性验证。
[0062]
以多株中国科学院海洋研究所保种的分离于世界沿海海域的不能形成厘米级囊体的球形棕囊藻,包括北大西洋加勒比海ccmp628株系、北大西洋墨西哥湾ccmp629株系、大西洋北美海域ccmp2754株系、欧洲北海沿岸rcc736株系、英吉利海峡rcc2055株系和中国南海mel43和pg2017株系作为阴性对照,与两株分离自南海可形成厘米级囊体的球形棕囊藻pg2016株系和mel70株系作为阳性样品,进行种内的特异性验证。
[0063]
提取上述各藻的dna,而后利用上述实施例记载的试剂盒以及相应的方法通过荧光定量pcr扩增和荧光信号对上述各藻进行检测。
[0064]
结果表明,无论是不同物种间(附图3),还是种内(附图4),本发明的可形成厘米级大小囊体的球形棕囊藻的快速定量检测方法均只能检测到可形成厘米级大小囊体的目标球形棕囊藻pg2016株系和mel70株系的荧光信号,而检测不到非目标藻的荧光信号,说明方法的特异性良好。
[0065]
实施例4
[0066]
检出限
[0067]
为了减少dna提取过程中可形成厘米级大小囊体的球形棕囊藻pg2016株系的dna损失,将大约5
×
107小球藻细胞添加到含有1.98
×
108细胞的可形成厘米级大小囊体的球形棕囊藻pg2016株系藻液中(3个平行),然后收集这些混合微藻用于dna提取。用上述实施例2记载方法提取dna,并将其溶解在30μl te缓冲液中。然后通过稀释原始dna溶液制备一系列dna溶液(4、16、64、6.4
×
102、6.4
×
103、6.4
×
104、2.56
×
105、1.02
×
106、4.10
×
107和1.64
×
108倍)。在每种浓度下,将1μl dna溶液(n=3)作为模板用于qpcr反应,而后利用上述实施例记载的试剂盒以及相应的方法进行扩增,分别建立检测上限和下限(参见图5)。
[0068]
结果表明,其检测范围在0.92-9.43
×
106个细胞范围内(对应野外样品的细胞浓度约为30cells/l-3
×
108cells/l),说明该方法的检测范围广。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。