1.本发明属于药物控制释放技术领域,具体涉及一种采用聚多巴胺包覆提高小分子药物稳定释放的方法。
背景技术:
2.小分子化合物作为新药研发的重要材料来源,具有显而易见的优势。其一,小分子药物对于体内不同的生物分子具有一定的靶向性,能够特异性的抑制或激活特定的分子信号通路,对于致病机理清楚的疾病在治疗上具有明确的指向性。其二,小分子化合物易于制造、储存和管理。此外,从生物化学的角度来看,小分子化合物表现出快速、可逆、特异性以及剂量依赖性的特点,使其能够在体内进行精确的时间和疗效控制。
3.然而,小分子药物易于组织渗透的特性导致其扩散迅速,且容易造成全身非病变部位的广泛分布。这样增加了药物有效剂量的同时也放大了其全身作用导致的毒副作用。特别是在治疗胃肠道疾病的过程中,口服药物全身分布不利于药物在消化道内停留。为此,开发一种有效地稳定释放小分子药物的方法是当前研究的重要课题。
4.为稳定释放小分子药物,一种有效地方式是对其进行包覆和修饰。虽然小分子药物的修饰被大量的文献报道,然而当前文献还没有报道过一种生物兼容性好、同时能稳定有效释放药物的方法。
技术实现要素:
5.本发明要解决的技术问题是在胃肠道复杂酸性环境下,口服药物能够停留在胃肠道中,并在消化道内稳定释放小分子药物,从而降低其全身分布造成的潜在毒副作用的技术问题,提供一种提高小分子药物稳定释放的方法。本发明的方法是采用在人体内广泛分布的黑色素类似物聚多巴胺作为小分子药物的包覆剂以提高小分子药物稳定释放的方法,且聚多巴胺修饰的小分子药物具有非常良好的生物兼容性。
6.为了解决上述技术问题,本发明的技术方案具体如下:
7.本发明提供一种提高小分子药物稳定释放的方法,其是采用聚多巴胺作为小分子药物的包覆剂以提高小分子药物稳定释放的方法。
8.在上述技术方案中,优选的是,所述聚多巴胺是采用多巴胺盐酸盐在碱性条件下聚合生成的。
9.在上述技术方案中,优选的是,所述小分子药物为p53的靶向小分子抑制剂pifithrin-α,其分子量为367.3道尔顿。
10.在上述技术方案中,优选的是,所述方法包括以下步骤:
11.步骤1、制备聚多巴胺包覆的小分子药物;
12.步骤2、利用透析方法检测所制备的聚多巴胺包覆的小分子药物的控释性能。
13.在上述技术方案中,进一步优选的是,所述步骤1包括以下步骤:
14.步骤1.1制备均匀聚苯乙烯微球
15.取彩色单分散聚苯乙烯微球,重复离心、弃上清、超声的操作步骤至得到均匀聚苯乙烯微球;
16.步骤1.2将tris和dd h2o加入到烧瓶里,超声,接着加入步骤1.1的聚苯乙烯微球,最后加入盐酸多巴胺和dd h2o,搅拌,得到聚苯乙烯微球包裹了一层黑色素形成的纳米粒子沉淀,超纯水洗涤并保留沉淀;
17.步骤1.3接着将tris和dd h2o、及步骤1.2得到的沉淀和超纯水、及30mg盐酸多巴胺和dd h2o直接加入到烧瓶里,搅拌,反应结束后离心、去上清、水洗,得到黑色素纳米颗粒,并将其加入到超纯水中超声分散;
18.步骤1.4将十二烷基硫酸钠、超纯水和二甲苯,超声震荡乳化后获得乳化剂,随后将步骤1.3的黑色素纳米颗粒分散液加入到乳化剂中,室温搅拌后,加入乙醇继续搅拌,停止反应后,离心弃去上清,用乙醇清洗后,加入四氢呋喃,搅拌,离心弃去上清,最后依次用四氢呋喃、乙醇、超纯水洗涤;
19.步骤1.5将小分子药物用溶剂溶解,将步骤1.4获得的黑色素纳米颗粒离心后去上清并用溶剂溶解,取小分子药物溶液和黑色素纳米颗粒溶液进行搅拌,反应结束后离心,收集上清,沉淀用超纯水清洗,最后通过烘干体系中的溶剂,最终得到聚多巴胺包覆的小分子药物。
20.在上述技术方案中,进一步优选的是,所述步骤2包括以下步骤:
21.首先将步骤1获得的聚多巴胺包覆的小分子药物悬浮在去离子水中,然后将此悬浮液转移到透析袋中,并将透析袋的两端密封,然后浸入具有不同ph值的释放缓冲液的试管中,接下来将试管放置在摇动的水浴或气浴摇床中,然后在设定好的时间间隔,吸取释放缓冲液用以检测药物浓度,同时将新鲜的释放缓冲液补充到试管中,使用荧光分光光度计测定释放介质中的小分子药物的含量。
22.本发明的有益效果是:
23.本发明的方法采用简单、绿色的合成方法,得到聚多巴胺包覆的小分子药物,所采用的原料价格低廉易得,合成方法简单。
24.本发明的方法仅仅通过简单的小分子药物和多巴胺盐酸盐的质量比,实现对小分子药物进行可控包覆。
25.从药物释放的角度,本发明适用于需要长时间给药的作用环境,药物释放时间更长,且具有一定的抗酸性,有利于口服状态下不被胃酸分解(图2)。
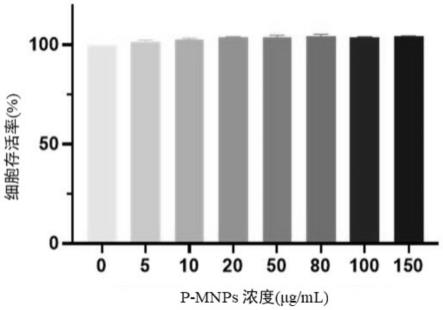
26.从生物兼容性和安全性角度考虑,黑色素在体内广泛分布,其具有良好的生物兼容性,而且黑色素在体内本身能被体内广泛存在的黑色素酶以及过氧化氢所降解,聚多巴胺是黑色素的一个重要的组成部分,对小分子药物进行包覆后,对其生物兼容性进行考察,通过细胞毒性试验(mtt)考察,发现其对细胞的生长、发育和复制均无不良影响,在150μg/ml的高浓度条件下,细胞的存活率仍然超过90%。以上实验数据说明,聚多巴胺包覆的小分子药物具有非常良好的生物兼容性(图3)。
27.从小分子药物的作用效果角度考虑,通过考察小鼠口服未包覆与包覆聚多巴胺的pftα对肠道上皮细胞p53表达的抑制效果,发现未包覆聚多巴胺的pftα在小鼠肠上皮中未能抑制p53基因下游pten的表达,而包覆聚多巴胺的pftα-mnps能够抑制小鼠肠上皮细胞中pten的表达(图4)。
附图说明
28.下面结合附图和具体实施方式对本发明作进一步详细说明。
29.图1为实施例1制备的pftα-mnps的tem图。
30.图2为不同ph环境下pftα-mnps的药物释放图。
31.图3为不同浓度的pftα-mnps作用于ht29细胞24小时后的细胞毒性图。
32.图4为pftα和pftα-mnps在体内抑制pten表达的检测图。
具体实施方式
33.本发明要解决的技术问题是在胃肠道复杂酸性环境下,口服药物能够停留在胃肠道中,并在消化道内稳定释放小分子药物,从而降低其全身分布造成的潜在毒副作用。为解决以上技术问题,本发明提供了一种采用在人体内广泛分布的黑色素类似物
‑‑‑
聚多巴胺作为小分子药物的包覆剂以提高小分子药物稳定释放的方法。进一步的该方法包括以下步骤:步骤1、制备聚多巴胺包覆的小分子药物;步骤2、利用透析方法检测所制备的聚多巴胺包覆的小分子药物的控释性能。用于本发明的方法的p53靶向小分子抑制剂,其分子量为367.3道尔顿。用于本发明的方法的聚多巴胺是采用多巴胺盐酸盐在碱性条件下聚合生成的聚多巴胺。
34.下面以p53靶向小分子抑制剂pifithrin-α为例,具体说明本发明的方法制备过程如下:
35.具体的实验步骤和实验条件如下:
36.步骤(1):制备均匀聚苯乙烯微球:
37.1.移液枪取1.5ml彩色单分散聚苯乙烯微球(红色,300nm),每个1.5ml ep管750μl。
38.2.离心(12000r/min,5min),弃去上清,注意不要吸到沉淀,每管加入1ml dd h2o,不用枪吹打,超声,离心去上清;重复该步骤3次。
39.3.最后一次去上清后,加入1ml dd h2o,超声。
40.步骤(2):准备多巴胺:取30mg盐酸多巴胺(189.64)和3ml dd h2o;
41.1.36mg tris和25ml dd h2o直接加入到烧瓶里,超声溶解。
42.2.先将洗好的聚苯乙烯微球加入到烧瓶中,再加溶解好的多巴胺溶液,承装聚苯乙烯微球和多巴胺溶液的ep管大约各用1ml超纯水冲洗以免有残留,25摄氏度,搅拌12h,得到沉淀物,即聚苯乙烯微球包裹了一层黑色素形成的纳米粒子。
43.3.12h后,离心(11000r/min,5min),去上清,用超纯水洗三次(每管大约20ml),超声,重复,注意不要倒掉沉淀,沉淀朝下。
44.4.将36mg tris和25ml dd h2o直接加入到烧瓶里、及前一步获得的离心好的沉淀和3ml超纯水、及30mg盐酸多巴胺和3ml dd h2o,大约每管各用1ml冲洗,25摄氏度,搅拌12h。
45.5.12h后,离心弃去上清,用超纯水洗三次后,得黑色素纳米颗粒(melanin nanoparticle,mnp),并用2.5ml超纯水超声分散。
46.6.将0.3g十二烷基硫酸钠、28ml超纯水和0.3ml二甲苯,加入到离心管中,超声震荡乳化,获得乳化剂。
47.7.将乳化剂加入到100ml圆底烧瓶中,然后边搅拌边加入先前获得的2.5ml黑色素纳米颗粒(mnp),少量超纯水润洗,室温搅拌6h。
48.8.6h后加入60ml乙醇继续搅拌5min,停止反应后,离心弃去上清,用乙醇洗三次,弃掉乙醇后,加入30ml四氢呋喃(分3-4次直接用四氢呋喃溶,超声,用枪吸取加入烧瓶),搅拌4h。
49.9.4h后,离心弃去上清,用四氢呋喃洗三次,每次约20ml,再用乙醇洗三次,每次20-30ml,再用超纯水洗3次,每次30ml(离心(11000r/min,5min))。
50.10.步骤9的mnps最后再分次加入30ml超纯水,分次加入烧瓶中,常温搅拌12h。
51.11.12h后,用超纯水洗三次,加入适量超纯水配成5ml体系。
52.步骤(3):装载小分子药物:
53.1.载药:20mg pifithrin-α(pftα) 1ml dmso溶解,取3ml mnp离心(11000r/min,5min),弃上清,加入1ml dmso溶解,将1ml pft-α和2ml mnp加入10ml圆底烧瓶,再用1mldmso润洗,反应体系3ml,搅拌48h。
54.2.搅拌后离心(11000r/min,10min),收集上清,沉淀pftα-mnps用超纯水洗一次后,再加入3ml超纯水。
55.步骤(4)利用透析方法检测所制备的聚多巴胺包覆的小分子药物的控释性能。
56.实施例1
57.pftα-mnps的制备
58.首先制备均匀聚苯乙烯微球:
59.1.移液枪取1.5ml彩色单分散聚苯乙烯微球(红色,300nm),每个1.5ml ep管750μl。
60.2.离心(12000r/min,5min)、弃去上清,注意不要吸到沉淀,然后每管加入1ml dd h2o,不用枪吹打,超声,离心去上清;重复该步骤3次。
61.3.最后一次去上清后,加入1ml dd h2o,超声分散均匀。
62.其次准备多巴胺:
63.取30mg盐酸多巴胺(189.64)放入5ml ep管中,加入3ml dd h2o,超声溶解成3ml多巴胺溶液;
64.第三制备mnps纳米颗粒球壳载药系统;
65.将36mg tris和25ml dd h2o直接加入到烧瓶里,超声溶解。将第一步超声分散好的1ml聚苯乙烯微球溶液加入到烧瓶中,并用1ml超纯水洗涤承装聚苯乙烯微球溶液的ep管并将洗涤后的超纯水加入到烧瓶中(该步骤是防止原承装聚苯乙烯微球溶液的ep上有残留),待聚苯乙烯微球溶液完全分散好后,或者超声使之完全分散好后,接着加入第二步制备好的3ml多巴胺溶液,并用1ml超纯水洗涤承装多巴胺溶液的ep管并将洗涤后的超纯水加入到烧瓶中(该步骤是防止原承装多巴胺溶液的ep上有残留),25摄氏度,搅拌12h,得到沉淀物,即聚苯乙烯微球包裹了一层黑色素形成的纳米粒子,此后用超纯水洗三次并保留沉淀。
66.将36mg tris和25ml dd h2o、及上述步骤得到的沉淀和3ml超纯水、及30mg盐酸多巴胺和3ml dd h2o直接加入到烧瓶里,25摄氏度条件下搅拌,12h后,离心弃去上清,用超纯水洗三次后,得到黑色素纳米颗粒(melanin nanoparticle,mnp),并用2.5ml超纯水超声分
散。
67.在50ml离心管中加入0.3g十二烷基硫酸钠和28ml超纯水,超声溶解后,加入0.3ml二甲苯,继续超声振荡形成稳定的乳化剂,随后在干净的100ml烧瓶中加入前面配制好的乳化剂,然后边搅拌边加入先前获得的2.5ml黑色素纳米颗粒,室温搅拌6h后加入60ml乙醇继续搅拌5min,停止反应后,离心弃去上清,用乙醇洗三次,弃掉乙醇后,加入30ml四氢呋喃,搅拌4h,离心弃去上清,用四氢呋喃洗三次,再用乙醇洗三次,每次20-30ml,再用超纯水洗3次,每次30ml(离心(11000r/min,5min)),将得到的mnps最后再分次加入30ml超纯水,分次加入烧瓶中,常温搅拌12h。12h后,用超纯水洗三次,加入适量超纯水配成5ml体系。
68.最后制备pftα-mnps;
69.将pftα装载进上述制备的mnps纳米颗粒球壳中:将20mg pftα使用1ml dmso溶解。同时另取3ml先前制备的mnps纳米颗粒球壳离心(11000r/min,5min)后去上清加入1ml dmso溶解。将1ml pftα和2ml mnps纳米颗粒球壳溶液加入10ml圆底烧瓶,再用1mldmso润洗,反应体系3ml,搅拌48h后离心(11000r/min,10min),收集上清,沉淀pftα-mnps用超纯水清洗,最后通过烘干体系中的溶剂,最终得到pftα-mnps。
70.图1为所制备的pftα-mnps粒子,通过tem图片可知粒子的粒径在300-500nm之间。
71.实施例2
72.pftα-mnps的控释性能
73.(1)pftα-mnps的制备同实施例1;
74.(2)利用透析方法检测pftα-mnps药物的控释性能。
75.首先将1mg pftα-mnps完全悬浮在去离子水中,然后将此悬浮液转移到透析袋中,并将这些袋的两端密封,准备4份相同的样品,然后分别将4份样品浸入具有不同ph值(分别为ph值为4.5、6.0、6.8、7.4)的释放缓冲液的试管中。这些释放缓冲液中包涵不同ph环境的刺激,释放缓冲液具体为含有2%tween 80的pbs缓冲液。接下来将管分别放置在37℃下以120rpm摇动的水浴或气浴摇床中。然后在设定好的时间间隔,即2h检测一次,共检测12h,,吸取适量(2ml左右)释放缓冲液用以检测药物浓度,同时将新鲜释放缓冲液补充到试管中。使用荧光分光光度计测定释放介质中的pftα量。由图2可知,本发明适用于需要长时间给药的作用环境,药物释放时间更长,且具有一定的抗酸性,有利于口服状态下不被胃酸分解。
76.实施例3
77.pftα-mnps的生物相容性
78.(1)pftα-mnps的制备同实施例1;
79.(2)将1*105/孔的ht-29肠上皮细胞接种到96孔板中,培养24小时。待细胞贴壁后,采用不同浓度(分别是0、5、10、20、50、80、100、150μg/ml)的pftα-mnps处理细胞24小时。根据mtt检测试剂盒的用户指南进行操作,采用biotek gen5系统(biotek,usa),在490nm波长下通过光密度d(λ)测量。图3为不同浓度的pftα-mnps作用于ht29细胞24小时后的细胞毒性图,由图可知,发现pftα-mnps对细胞的生长、发育和复制均无不良影响,在150μg/ml的高浓度条件下,细胞的存活率仍然超过90%。以上实验数据说明,聚多巴胺包覆的小分子药物具有非常良好的生物兼容性(图3)。
80.实施例4
81.比较pftα和pftα-mnps在体内抑制pten表达的检测
82.(1)pftα-mnps的制备同实施例1;
83.(2)将8周龄的雌性balb/c小鼠饲养在每笼中3-5只小鼠,并在纳入研究之前适应环境1周。小鼠接受3%dss在饮用水中补充5天,然后是正常水。本实验一共四组,分别为正常对照组(接受不含3%dss的正常水,后一直接受正常水)、pbs组(接受3%dss在饮用水中补充5天后,在第5,7和9天,口服pbs处理)、pftα组(接受3%dss在饮用水中补充5天后,在第5,7和9天,口服10mg kg-1
pftα处理)和pftα-mnps组(接受3%dss在饮用水中补充5天后,在第5,7和9天,口服10mg kg-1
pftα-mnps处理),每组6只小鼠。对照组仅向健康小鼠提供正常水。对于其它处理组pbs组、pftα组、pftα-mnps组分别在第5,7和9天,小鼠口服pbs、pftα(10mg kg-1
)、pftα-mnps(10mg kg-1
)。最后在第11天,对动物进行安乐死。取出小鼠肠道组织,检测肠道组织中p53基因下游pten的表达水平。图4为pftα和pftα-mnps在体内抑制pten表达的检测图,由图可知,通过考察小鼠口服未包覆与包覆聚多巴胺的pftα对肠道上皮细胞p53表达的抑制效果,发现未包覆聚多巴胺的pftα在小鼠肠上皮中未能抑制p53基因下游pten的表达,而包覆聚多巴胺的pftα-mnps能够抑制小鼠肠上皮细胞中pten的表达。
84.显然,上述实施例仅仅是为清楚地说明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也无法对所有的实施方式予以穷举。而由此所引伸出的显而易见的变化或变动仍处于本发明创造的保护范围之中。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。