使用tgf
β
敲除细胞系及由其产生的组合物的方法
1.相关申请的交叉引用
2.本技术要求于2020年3月24日提交的美国临时申请序列号62/994,004的权益,该申请通过援引并入本文。
3.序列表
4.本技术包含经由efs-web以电子方式递交给美国专利及商标局(united states patent and trademark office)的序列表,该序列表是标题为“0541-000008wo01_st25.txt”、大小为3千字节且创建于2021年3月23日的ascii文本文件。由于电子提交了序列表,电子递交的序列表充当37 cfr
§
1.821(c)要求的纸印本和
§
1.821(e)要求的计算机可读形式(crf)两者。该序列表中所含的信息通过援引并入本文。
技术实现要素:
5.在一方面,本披露描述了一种用于产生靶生物制剂的方法,该方法包括培养过表达该靶生物制剂的tgfβ1敲除细胞系和纯化该靶生物制剂。如本文所用,“生物制剂”是指由活生物体产生或含有活生物体的组分的产物。示例性生物制剂可以包含例如重组蛋白(包括例如单克隆抗体、糖蛋白、肽激素或毒素)、核糖核蛋白、非肽激素(包括例如类固醇激素或类花生酸激素)、糖脂、亚细胞器、血液组分等。还设想了示例性生物制剂的组合,包括例如重组糖蛋白或从血液组分中分离的亚细胞器。
6.在另一方面,本披露描述了包含通过如本文披露的方法产生的靶生物制剂的组合物。
7.在又一方面,本披露描述了一种包含靶生物制剂的组合物,其中该组合物包含小于0.5纳克/毫升(ng/ml)tgfβ1蛋白、小于0.1ng/ml tgfβ1蛋白、小于0.01ng/ml tgfβ1蛋白、小于0.05ng/ml(50皮克/毫升(pg/ml))tgfβ1蛋白、小于0.02ng/ml(20pg/ml)tgfβ1蛋白、小于0.01ng/ml(10pg/ml)tgfβ1蛋白、小于0.005ng/ml(5pg/ml)tgfβ1蛋白、小于1pg/ml tgfβ1蛋白、小于0.5pg/ml(500飞克/毫升(fg/ml))tgfβ1蛋白、小于0.01pg/ml(100fg/ml)tgfβ1蛋白、小于0.05pg/ml(50fg/ml)tgfβ1蛋白、小于0.005pg/ml(5fg/ml)tgfβ1蛋白、或小于0.001pg/ml(1fg/ml)tgfβ1蛋白。
8.在一些实施例中,该靶生物制剂包含tgfβ超家族配体。在一些实施例中,该靶生物制剂包含抗体。在一些实施例中,该靶生物制剂包含生物药物,即用于治疗受试者的疾病或病症的生物制剂。
9.如本文所用,“重组蛋白”是指由重组dna的表达产生的蛋白质。
10.如本文所用,“抗体”包括多克隆抗体;单克隆抗体;抗体片段,还被称为抗原结合片段;和单结构域抗体,包括来自骆驼科(例如,骆驼和美洲驼)和软骨鱼纲(例如,须鲨和护士鲨)的抗体。抗体片段的实例包括例如通过蛋白水解消化和/或还原二硫键产生的fab、fab'、fd、fd'、fv、dab和f(ab')2片段和由fab表达文库产生的片段。
11.词语“优选的”和“优选地”是指在某些情况下可以提供某些益处的本发明的实施例。然而,在相同或其他情况下,其他实施例也可以是优选的。此外,叙述一个或多个优选实
施例不意味着其他实施例是没用的,并且不旨在将其他实施例排除在本发明的范围之外。
12.术语“包含”及其变型在这些术语出现在说明书和权利要求书中时不具有限制意义。此类术语将被理解为意味着包括所声明的步骤或要素或步骤或要素的组,但不排除任何其他步骤或要素或步骤或要素的组。
[0013]“由
…
组成”意指包括并且限于短语“由
…
这组成”之后的任何内容。因此,短语“由
…
组成”指示所列举的要素是要求的或强制性的,并且可以不存在其他要素。“基本上由
…
组成”意指包括短语之后所列的任何要素,并且限于不干扰或有助于所列举要素的本披露中指定的活性或作用的其他要素。因此,短语“基本上由
…
组成”指示所列举的要素是要求的或强制性的,但是其他要素是任选的并且可以存在或可以不存在,这取决于它们是否实质上影响所列举要素的活性或作用。
[0014]
除非另外说明,否则“一个/种(a/an)”、“该”和“至少一个”可互换使用,并且意指一个或多于一个。
[0015]
如本文所用,除非上下文另外明确指明,否则术语“或”通常采用其包括“和/或”的常用意义。
[0016]
术语“和/或”意指所列举的要素的一个或所有或所列举的要素的任两个或更多个的组合。
[0017]
同样在本文中,通过端点叙述的数值范围包括该范围内所包含的所有数值(例如,1至5包括1、1.5、2、2.75、3、3.80、4、5等)。
[0018]
在本文中,“多达”某一数值(例如,多达50)包括该数值(例如,50)。
[0019]
术语“在
…
范围中”或“在
…
范围内”(和类似的声明)包括所声明范围的端点。
[0020]
对于本文披露的包括不连续的步骤的任何方法,这些步骤可以按任何可行顺序实施。并且,如果适宜,两个或更多个步骤的任何组合可以同时实施。
[0021]
所有标题旨在方便读者并且不应当用来限制该标题后续文本的意思,除非如此说明。
[0022]
在整个说明书中,提及“一个实施例(one embodiment)”、“一个实施例(an embodiment)”、“某些实施例(certain embodiments)”或“一些实施例(some embodiments)”等意指结合该实施例描述的特定特征、配置、组合物或特性包括在本披露的至少一个实施例中。因此,此类短语在本说明书全篇各处的出现不一定都指本披露的同一实施例。此外,特定的特征、配置、组合物或特性可以在一个或多个实施例中以任何合适的方式组合。
[0023]
除非另外指示,否则在说明书和权利要求书中使用的表示组分的量、分子量等的所有数字均应理解为在所有情况下由术语“约”修饰。如本文中结合所测量的量使用,术语“大约”是指所测量的量的变化,如技术人员在进行测量和执行与测量目标和所用测量设备的精度相称的谨慎程度时所预期的那样。因此,除非另外指示相反含义,否则在说明书和权利要求书中阐述的数值参数是近似值,可以根据本发明所寻求获得的所需特性而变化。至少,并不是试图将等同原则限制在权利要求书的范围内,每个数值参数至少应该根据报告的有效数位的数量并通过应用普通的舍入技术来解释。
[0024]
虽然阐述本发明的广泛范围的数值范围和参数是近似值,但是在具体实例中阐述的数值是尽可能精确地报告。然而,所有数值固有地含有一个范围,该范围必然是其各自的
测试测量中存在的标准偏差所产生的。
[0025]
本发明的以上概述不旨在描述本发明的每个所披露的实施例或每一个实施方式。以下描述更加特别地示例了说明性实施例。在整个申请中的若干个地方,通过实例列表提供了指导,这些实例能以各种组合使用。在每种情况下,所述列表仅用作代表组,而不应解释为排他性列表。
附图说明
[0026]
图1示出了示例性基因组pcr的结果,表明cho-s tgfβ1敲除(ko)pcr产物的tgfβ1基因组序列中的遗传突变。样品1是cho-s野生型(wt)pcr产物;样品2是cho-s tgfβ1 ko pcr产物。来自cho-s tgfβ1 ko dna(样品2)的pcr扩增子表现出比来自野生型cho-s基因组dna(样品1)的pcr扩增子大了大约64个碱基对的条带。
[0027]
图2示出了通过dna测序验证将64个碱基对(bp)插入物(用括号指示)引入了cho-s tgfβ1 ko细胞的tgfβ1基因组序列中。易错非同源末端连接(nhej)双链修复机制,通过插入和缺失(indel)在氨基酸51处引入了终止密码子(以
“‑”
示出并以灰色突出显示)。dna序列的正链(以5'至3’示出)是seq id no:1。dna序列的负链(以3'至5’示出)是seq id no:2。氨基酸序列是seq id no:3。
[0028]
图3示出了示例性elisa结果,指示与野生型cho细胞系(cho-s wt)相比,tgfβ1 ko cho细胞系(cho-s tgfβ1 ko)产生显著减少量的tgfβ1,如通过酶联免疫吸附测定(elisa)测量的。可检测量的tgfβ1存在于cho-s wt细胞、hek293 wt、和表达重组hgdf-15的hek293细胞(hek wt hgdf-15)的条件培养基中。cho-s tfgβ1敲除样品(cho-s tgfβko)的条件培养基中存在的tgfβ1的量低于可检测范围。在表达重组hgdf-15的稳定cho-s tgfβ1 ko细胞(cho-s tgfβ1 ko hgdf-15)中,tgfβ1水平也低于检测限。图3的结果的量化在表1中示出。表1还显示表达重组htgfβ1的cho-s tgfβ1 ko细胞(cho-s tgfβ1 ko htgfβ1)具有比亲本细胞系显著更高水平的tgfβ1。在图3和表1中,“*”指示测量值低于测定的检测限。
[0029]
图4a示出了包含更高水平的tgfβ1污染的重组hgdf15蛋白可以导致du145人前列腺癌细胞系中smad2的激活。图4a的每条泳道的内容物在表2a中描述。图4b示出了在cho-s tgfβ1敲除细胞中制备的重组hgdf15在用于处理du145细胞时不激活smad-2的磷酸化。图4b的每条泳道的内容物在表2b中描述。单独的重组人tgfβ1蛋白(1ng/ml,泳道2)、来自hek293细胞的重组人gdf-15(2μg/ml,泳道6)、和来自cho-s野生型细胞的重组人gdf-15(2μg/ml,泳道8)全部诱导smad-2的磷酸化。smad-2的磷酸化可以用鸡抗tgfβ1抗体处理来挽救,这表明smad-2的这种磷酸化是tgfβ1依赖性的。在tgfβ1 ko cho-s细胞系中产生的重组人gdf-15在2μg/ml剂量下在du145细胞中未显示任何smad-2磷酸化,从而表明tgfβ1蛋白污染已去除(泳道4)。
[0030]
图5示出了tgfβ1对成骨细胞分化产生负面影响。将mc3t3-e1前成骨细胞用重组小鼠wnt-3a蛋白处理,该蛋白来自已知具有相对高水平的tgfβ1污染(78皮克(pg)tgfβ1蛋白/每微克(μg)wnt-3a蛋白)的批次(圆圈)。在存在饱和剂量(50μg/ml)的鸡抗tgfβ1封闭抗体(三角形)的情况下,将相同剂量的小鼠wnt-3a蛋白添加到mc3t3-e1细胞中。通过在三天处理之后量化细胞内碱性磷酸酶活性来测量成骨细胞分化。
[0031]
图6示出了tgfβ1对wnt-3a诱导的成骨细胞分化产生负面影响。用重组人wnt-3a蛋
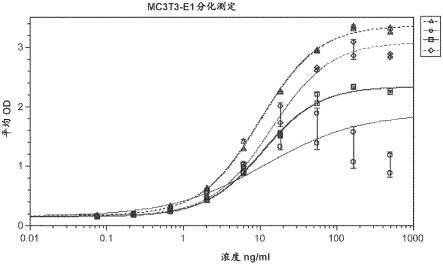
白处理的mc3t3-e1前成骨细胞表现出成骨细胞分化的剂量应答性诱导,这通过在添加wnt-3a蛋白之后三天碱性磷酸酶活性增加来说明。这种影响的半数有效剂量(ed50)是1.78ng/ml(圆圈)。在将20ng/ml恒定剂量的重组人wnt-3a蛋白添加到mc3t3-e1细胞中持续三天时,产生了相对高水平的碱性磷酸酶活性(平线和三角形)。如果将20ng/ml相同稳定剂量的重组人wnt-3a蛋白添加到细胞中,并且将重组人tgfβ1的剂量滴定添加到此稳定20ng/ml剂量的人wnt-3a蛋白(正方形)中,在53.3飞克/毫升(fg/ml)的百分之50(%)中和剂量(nd50)的tgfβ1下观察到wnt-3a介导的成骨细胞分化的抑制。
[0032]
图7示出了具有相对较高水平的tgfβ1蛋白(参见表3)的hwnt3a蛋白在最高剂量的hwnt3a蛋白下显示出mc3t3-e1分化的抑制,而从cho-s tgfβ1 ko系纯化的hwnt3a蛋白在较高的hwnt3a剂量下没有显示出这种分化抑制。来自cho-s tgfβ1 ko系的批次#dlgc02(圆圈)显示出s形曲线,在通过碱性磷酸酶活性测定所测定的成骨细胞分化中具有剂量应答性增加。前三个剂量的两个cho-s wt衍生批次(rsk51(正方形)和rsk69(三角形))在最高的三个hwnt3a剂量(1.67μg/ml、0.556μg/ml、和0.185μg/ml)中显示出骨诱导活性的显著降低,这指示tgfβ1抑制活性。当mc3t3-e1细胞在相同剂量下用批次#dglc02(衍生自cho-s tgfβ1 ko系的hwnt3a蛋白)(圆圈)处理时,没有观察到这种活性“下降”。
[0033]
图8示出了具有高或低水平的tgfβ1蛋白的hwnt3a蛋白在hek293 tcf9分泌的碱性磷酸酶(seap)wnt-应答报告基因测定中显示出相似的活性。来自cho-s tgfβ1 ko细胞(批次#dlgc02,圆圈)、cho-s wt(批次#rsk51,正方形)、和cho-s wt(批次#rsk69,三角形)的hwnt3a蛋白全部显示出相当的活性。这些批次的ed50:rsk51=145ng/ml,rsk69=191ng/ml,和dlgc02=221ng/ml。
[0034]
图9示出了在mc3t3-e1测定中,具有高水平tgfβ1污染的hwnt3a蛋白在高hwnt3a剂量下产生的骨诱导活性比从tgfβ1 ko cho-s细胞纯化的hwnt3a蛋白更低。来自从野生型cho-s细胞纯化的hwnt3a(hwnt3a,批次rsk 51,圆圈)的剂量应答曲线在最高的四个hwnt3a剂量下显示活性明显降低。在存在10μg/ml静态剂量的tgfβ1封闭抗体的情况下,将来自相同批次的相同剂量的hwnt3a添加到mc3t3-e1细胞中(hwnt3a,批次rsk51 10μg/ml的tgfβ1封闭抗体,三角形)时,高剂量hwnt3a处理剂量的影响被“挽救”至更高的水平。从已知具有较低水平的tgfβ1污染(4.97pg的tgfβ1/μg的hwnt3a,参见表3)的tgfβ1 ko cho-s细胞纯化的hwnt3a蛋白(hwnt3a,批次dlgc02,正方形)在高hwnt3a剂量下显示的活性下降比从具有远远更高水平的tgfβ1(114.6pg的tgfβ1/μg的hwnt3a,参见表3)的野生型cho-s细胞纯化的hwnt3a(hwnt3a,批次rsk51,菱形)更不明显得多。在添加10μg/ml的tgf1封闭抗体(三角形)的情况下,纯化的hwnt3a批次dlg02(正方形)中低水平的tgfβ1水平可以被进一步挽救至更高的活性水平,从而显示细胞培养生产培养基中使用的血清中存在的甚至相对较低水平的tgfβ1污染可以在骨诱导细胞生物测定中产生不想要的脱靶效应。
具体实施方式
[0035]
本披露描述了包含靶生物制剂和微少tgfβ1污染的组合物、用于制备这些组合物的方法、以及用于使用这些组合物的方法。在一些方面,用于制备该组合物的方法包括培养过表达该靶生物制剂的tgfβ1敲除细胞系和纯化该靶生物制剂。
[0036]
有时,由宿主细胞系产生的内源性蛋白可以与由该细胞系产生的靶蛋白共纯化。
如果内源性蛋白质具有非常强力的生物活性,即使是非常低水平的污染也可以对产品的性能产生负面影响。中国仓鼠卵巢(cho)细胞经常被制药和生物技术公司用于制造重组抗体和其他蛋白质。
[0037]
一种由cho细胞产生的可以对靶蛋白的性能产生负面影响的内源性蛋白是tgfβ1(beatson等人biotechnol bioeng[生物技术与生物工程]108,2759-2764(2011))。在非常敏感的测定(如mc3t3-e1成骨细胞分化测定)中,tgfβ1可以在低至飞克/毫升(fg/ml)的浓度范围内引发生物学影响。(参见,例如图5和图6。)
[0038]
由于tgfβ1对细胞增殖和健康的重要性,预期在cho细胞中敲除tgfβ1对细胞产生负面影响(strutz等人kidney int[国际肾脏杂志]59,579-592(2001))。例如,与野生型细胞相比,这些细胞是否会生病或表现出较差的生长动力学是不可预测的。
[0039]
然而,如本文进一步所述,在cho细胞中敲除tgfβ1确实允许不产生tgfβ1的cho细胞繁殖。尽管在敲除细胞系中观察到稍慢的生长参数,但该细胞系已被用于成功产生hwnt3a、hbmp10、和hgdf15重组蛋白。
[0040]
此外,相比于先前用于从包含重组蛋白的组合物中去除tgfβ1的抗体柱,使用不产生tgfβ1的细胞可以更完全地消除tgfβ1。另外,使用抗体去除tgfβ1对去除潜在tgfβ1不是有效的,并且潜在tgfβ1可以被激活而产生具有生物活性的成熟tgfβ1(shi等人nature[自然]474,343-349(2011))。
[0041]
此外,使用tgfβ1敲除系来产生重组蛋白比单独去除tgfβ1抗体更具成本效益,因为否则需要数毫克的抗tgfβ1抗体才能有效去除tgfβ1。
[0042]
因此,在一些实施例中,本披露描述了用于通过消除细胞产生tgfβ1的能力来使将tgfβ1引入蛋白质生产过程中最小化的方法。总体而言,与用抗tgfβ1抗体去除tgfβ1相比,消除细胞产生tgfβ1的能力提供了一种成本更低的替代方案,提供了对潜在和成熟tgfβ1蛋白两者的消融,并且与用单独的抗tgfβ1抗体进行去除相比,使得tgfβ1污染的去除更一致。
[0043]
组合物
[0044]
在一方面,本披露描述了包含靶生物制剂和非常低水平的tgfβ1的组合物。示例性生物制剂可以包含例如重组蛋白(包括例如单克隆抗体、糖蛋白、肽激素或毒素)、核糖核蛋白、非肽激素(包括例如类固醇激素或类花生酸激素)、糖蛋白、糖脂、亚细胞器、血液组分等。还设想了示例性生物制剂的组合,包括例如重组糖蛋白或从血液组分中分离的亚细胞器等。在一些实施例中,该靶生物制剂包含生物药物,即用于治疗受试者的疾病或病症的生物制剂。
[0045]
在一些实施例中,该组合物可以优选地由tgfβ1敲除细胞系产生,包括例如本文所述的tgfβ1敲除细胞系。在一些实施例中,可以进一步纯化由tgfβ1敲除细胞系产生的组合物以去除tgfβ1,包括例如用抗tgfβ1抗体进行去除。在一个示例性实施例中,包括抗tgfβ1抗体的抗体柱可以用于去除tgfβ1。抗tgfβ1抗体可以用于去除在tgfβ1敲除细胞系的细胞培养期间引入的tgfβ1(包括例如作为胎牛血清(fbs)的组分)。
[0046]
靶生物制剂可以包含蛋白质,包括例如可用于研究或疗法的重组蛋白。从包含可用于研究或疗法的蛋白质的组合物中最小化或消除tgfβ1可以是重要的,因为tgfβ1具有许多功能(包括需要的和不需要的)。这些功能可以在例如免疫肿瘤学和再生医学工作流程中具有重要影响。参见,例如(glick cancer biol ther[癌症生物学与治疗]3,276-283
(2004),park等人cancer discov[癌症发现]6,1366-1381(2016),tamayo等人int j mol sci[国际分子科学杂志]19,3928(2018),wu等人bone res[骨研究]4,16009(2016))。
[0047]
在一些实施例中,当靶生物制剂包含蛋白质时,该蛋白质可以包含tgfβ超家族配体。示例性tgfβ超家族配体包括wingless型mmtv整合位点家族蛋白(wnt)、骨形态发生蛋白(bmp)、激活素、和生长分化因子(gdf)。
[0048]
靶生物制剂可以来自或衍生自任何合适的物种,包括例如小鼠、人、大鼠等。
[0049]
wnt可以包括例如wnt1、wnt2、wnt2b、wnt3、wnt3a、wnt4、wnt5a、wnt5b、wnt6、wnt7a、wnt7b、wnt8a、wnt8b、wnt9a、wnt9b、wnt10a、wnt10b、wnt11、或wnt16、或其组合。包含wnt蛋白的组合物中低水平的tgfβ1污染可以是特别有益的,这是因为由于制造重组wnt蛋白很困难,wnt蛋白制剂中的wnt蛋白浓度通常较低。因此,这些低浓度组合物的使用者典型地必须添加相对较高体积的wnt蛋白制剂,从而导致相应地添加更多污染的tgfβ1。
[0050]
bmp可以包括例如bmp2、bmp3、bmp4、bmp5、bmp6、bmp7、bmp8a、bmp8b、bmp10、bmp11、或bmp15、或其组合。包含bmp的组合物中低水平的tgfβ1污染是特别重要的,因为虽然bmp促进间充质干细胞向成骨细胞分化,但tgfβ1抑制成骨细胞分化。(参见,例如wu等人bone res.[骨研究]4:16009(2016),以及实例3和4。)bmp具有多种临床应用。例如,bmp2和bmp7被批准用于治疗性临床用途,以用于不连骨折愈合、脊柱融合、和口腔手术。
[0051]
gdf可以包括例如gdf1、gdf3、gdf5、gdf6、gdf8、gdf9、gdf10、gdf11、或gdf15、或其组合。包含gdf的组合物中低水平的tgfβ1污染对于准确确定gdf的作用是特别重要的(olsen等人plos one[共科学图书馆-综合]12,e0187349(2017))。
[0052]
在一些实施例中,靶生物制剂可以包括具有治疗性用途的蛋白质,包括例如抗体。在一些实施例中,抗体可以是单克隆抗体。抗体可以靶向免疫检查点途径的蛋白质。例如,示例性抗体可以靶向ctla-4或pd-1途径或两者的蛋白质。示例性抗体包括纳武单抗(抗pd1)、派姆单抗(抗pd1)、阿替利珠单抗(抗pd-l1)、德瓦鲁单抗(抗pd-l1)、阿维鲁单抗(抗pd-l1)、曲美木单抗(抗ctla-4)、或伊匹单抗(抗ctla-4)、或其组合、或其生物仿制药。包含靶向pd-1途径的蛋白质的抗体的组合物中低水平的tgfβ1污染可以是特别重要的,因为已经发现产生tgfβ1的细胞上调pd-1信号传导途径的多种组分,从而抑制了抗肿瘤免疫性(park等人cancer discov[癌症发现]6,1366-1381(2016))。
[0053]
另外的示例性抗体可以包括单克隆抗体,诸如贝伐珠单抗、曲妥珠单抗、阿达木单抗(humira)、英夫利昔单抗、利妥昔单抗、及其生物仿制药。其他具有治疗性作用的示例性非抗体靶生物制剂包括例如依那西普、阿法依泊汀、聚乙二醇非格司亭(pegfilgrastim)、非格司亭(filgrastim)等。
[0054]
在一些实施例中,该组合物包含小于0.5ng/ml tgfβ1蛋白、小于0.1ng/ml tgfβ1蛋白、小于0.01ng/ml tgfβ1、小于0.05ng/ml(50pg/ml)tgfβ1蛋白、小于0.02ng/ml(20pg/ml)tgfβ1蛋白、小于0.01ng/ml(10pg/ml)tgfβ1蛋白、小于0.005ng/ml(5pg/ml)tgfβ1蛋白、小于1pg/ml tgfβ1蛋白、小于0.5pg/ml(500fg/ml)tgfβ1蛋白、小于0.01pg/ml(100fg/ml)tgfβ1蛋白、小于0.05pg/ml(50fg/ml)tgfβ1蛋白、小于0.005pg/ml(5fg/ml)tgfβ1蛋白、或小于0.001pg/ml(1fg/ml)tgfβ1蛋白。
[0055]
在一些实施例中,该组合物包含不可检测水平的tgfβ1。在一些实施例中,该组合物包含不可检测水平的tgfβ1,如使用quantikine elisa试剂盒(目录号#dβ100b,r&d系统
公司,明尼阿波利斯,明尼苏达州(r&d systems,minneapolis,mn))测量。quantikine elisa试剂盒使用定量夹心酶免疫测定技术来检测天然和重组tgfβ1,并且表现出人tgf-β1的最小可检测浓度,范围为1.7pg/ml至15.4pg/ml(平均值4.61pg/ml)。最小可检测浓度可以通过将两个标准偏差添加到二十个零标准重复的平均光密度(o.d.)值并计算相应浓度来确定。
[0056]
在一个示例性实施例中,该组合物可以包含在0.05mg/ml至0.1mg/ml范围内的wnt或bmp和浓度小于0.02ng/ml(20pg/ml)的tgfβ1。在这些水平下,在许多测定中不再观察到tgfβ1污染对wnt在mc3t3-e1细胞中的作用的负面影响。
[0057]
在另一个示例性实施例中,该组合物可以包含在0.05mg/ml至0.1mg/ml范围内的wnt或bmp和浓度小于0.001pg/ml(1fg/ml)tgfβ1蛋白的tgfβ1。在这些水平下,预期在图6的碱性磷酸酶(alp)活性测定中不再观察到tgfβ1污染对wnt在mc3t3-e1细胞中的作用的负面影响。(此测定中重组tgfβ1的nd50是53fg/ml。)
[0058]
在一些实施例中,该组合物可以是冻干的。此类组合物可以包含缓冲液,例如碳酸氢盐,以用于在使用或施用之前重构,或者缓冲液可以包含在冻干组合物中,以用于例如用水重构。可以在注射器中提供冻干的组合物,任选地与用于重构的缓冲液组合包装,使得重构的组合物可以立即施用于患者。
[0059]
在一些实施例中,该组合物可以包含至少40μg/ml、至少50μg/ml、至少100μg/ml、至少150μg/ml、或至少200μg/ml的靶生物制剂。在一些实施例中,该组合物可以包含多达50μg/ml、多达100μg/ml、多达150μg/ml、多达200μg/ml、多达300μg/ml、或多达400μg/ml的靶生物制剂。
[0060]
在一些实施例中,该组合物可以是药物组合物。这些药物组合物可以以适于所选择的施用途径的多种形式配制。该组合物将取决于施用模式和剂量单位而变化。例如,对于肠胃外施用,可以使用等渗盐水。对于局部施用,可以使用乳膏,包括载剂诸如二甲基亚砜(dmso),或典型地在局部乳膏中发现的不阻断或抑制肽活性的其他药剂。其他合适的载剂包括但不限于醇、磷酸盐缓冲盐水、和其他平衡盐溶液。本发明的化合物可以以多种方式施用,包括但不限于静脉内、局部、口服、皮下、腹膜内、以及肌内递送。在一些方面,本发明的组合物可以被配制用于靶生物制剂的控释或缓释。在一些方面,用于控释或缓释的配制品适用于皮下植入。在一些方面,用于控释或缓释的配制品包括贴剂。
[0061]
在一些实施例中,包括当组合物是药物组合物时,该组合物可以包含作为活性剂的靶生物制剂和药学上可接受的载剂。活性剂可以被配制在药物组合物中,并且然后以适于所选择的施用途径的多种形式施用于脊椎动物,特别是哺乳动物,诸如人类患者、伴侣动物、或家养动物。
[0062]
药学上可接受的载剂可以包括例如赋形剂、稀释剂、溶剂、辅助成分、稳定剂、蛋白质载剂、或生物化合物。蛋白质载剂的非限制性实例包括匙孔血蓝蛋白(klh)、牛血清白蛋白(bsa)、卵清蛋白、海藻糖等。可以充当载剂的生物化合物的非限制性实例包括糖胺聚糖、蛋白聚糖、和白蛋白。载剂可以是合成化合物诸如二甲基亚砜,或合成聚合物诸如聚亚烷基二醇。可以采用卵清蛋白、人血清白蛋白、其他蛋白质、聚乙二醇等作为载剂。在一些实施例中,药学上可接受的载剂包括至少一种非天然存在的化合物或天然产物。
[0063]
tgfβ1敲除细胞系
[0064]
在一方面,本披露描述了一种tgfβ1敲除细胞系和制备此细胞系的方法。
[0065]
该细胞系可以包括任何合适的细胞系。在一些实施例中,该细胞系可以包括cho细胞系。tgfβ1敲除cho细胞系的开发和表征在实例1中描述。示例性cho细胞系包括例如cho-s系、chok1系、cho-dxb11细胞系、和cho-dg44系。在一些实施例中,该细胞系可以包括人胚胎肾(hek)细胞系,包括例如hek 293细胞系。在一些实施例中,该细胞系可以包括ns0细胞系。在一个示例性实施例中,该细胞系可以包括tgfβ1 ko cho细胞系,如实例1中所述。
[0066]
该敲除细胞系可以使用任何合适的手段制备。例如,如实例1中所述,可以使用基于crispr的基因编辑来制备该细胞系。在一些实施例中,基于crispr的基因编辑可以包括基于crispr/cas9的基因编辑。另外或可替代地,基于crispr的基因编辑可以包括crispr和非cas9 crispr核酸内切酶,包括例如cas-clover、mad7、cas12a(也称为cpf1)、xcas9、spcas9-ng等。其他基因编辑技术,诸如talen、大范围核酸酶、锌指核酸酶、转座子、和同源重组也可以适用于制备敲除细胞系。
[0067]
使用tgfβ1敲除细胞系的方法
[0068]
如本文所述的tgfβ1敲除细胞系可以用于产生包含靶生物制剂和微量tgfβ1的组合物。因为生长tgfβ1敲除细胞系的细胞培养基可能包含一些tgfβ1,所以可能无法产生不含tgfβ1的组合物;然而,在一个优选实施例中,由tgfβ1敲除细胞系产生的组合物不包含足够的tgfβ1而实质上影响靶生物制剂的活性或作用。
[0069]
在一些方面,用于制备包含靶生物制剂的组合物的方法包括培养过表达该靶生物制剂的tgfβ1敲除细胞系和纯化该靶生物制剂。
[0070]
靶生物制剂可以通过任何合适的手段纯化。纯化重组蛋白的示例性方法例如在wingfield,curr protoc protein sci.[当前蛋白质科学协议]2015;80:6.1.1-6.1.35和结构基因组学联盟等人,nat methods[自然方法]5:135-146(2008)中讨论。纯化单克隆抗体的示例性方法描述于corsiero,mater.methods[材料与方法]2016;6:1481中。
[0071]
在由tgfβ1敲除细胞系产生的组合物包含一些tgfβ1的情况下-包括当tgfβ1添加到细胞培养物中时(例如,作为胎牛血清的组分)-纯化靶生物制剂可以包括使用抗tgfβ1抗体(如果需要的话)。在一个示例性实施例中,包括抗tgfβ1抗体的抗体柱可以用于去除组合物中的tgfβ1,包括例如在tgfβ1敲除细胞系的细胞培养期间引入的tgfβ1。
[0072]
在一些实施例中,tgfβ1敲除细胞系用于提供一种组合物,该组合物包含小于0.5ng/ml tgfβ1蛋白、小于0.1ng/ml tgfβ1蛋白、小于0.01ng/ml tgfβ1、小于0.05ng/ml(50pg/ml)tgfβ1蛋白、小于0.02ng/ml(20pg/ml)tgfβ1蛋白、小于0.01ng/ml(10pg/ml)tgfβ1蛋白、小于0.005ng/ml(5pg/ml)tgfβ1蛋白、小于1pg/ml tgfβ1蛋白、小于0.5pg/ml(500fg/ml)tgfβ1蛋白、小于0.01pg/ml(100fg/ml)tgfβ1蛋白、小于0.05pg/ml(50fg/ml)tgfβ1蛋白、小于0.005pg/ml(5fg/ml)tgfβ1蛋白、或小于0.001pg/ml(1fg/ml)tgfβ1蛋白。
[0073]
在一些实施例中,该组合物包含不可检测水平的tgfβ1。在一些实施例中,该组合物包含不可检测水平的tgfβ1,如使用quantikine elisa试剂盒(目录号#dβ100b,r&d系统公司,明尼阿波利斯,明尼苏达州(r&d systems,minneapolis,mn))测量。quantikine elisa试剂盒使用定量夹心酶免疫测定技术来检测天然和重组tgfβ1,并且表现出人tgf-β1的最小可检测浓度,范围为1.7pg/ml至15.4pg/ml(平均值4.61pg/ml)。最小可检测浓度可以通过将两个标准偏差添加到二十个零标准重复的平均o.d.值并计算相应浓度来确定。
[0074]
在一些实施例中,tgfβ1敲除细胞系用于提供一种组合物,该组合物包含至少40μg/ml、至少50μg/ml、至少100μg/ml、至少150μg/ml、或至少200μg/ml的靶生物制剂。在一些实施例中,该组合物可以包含多达50μg/ml、多达100μg/ml、多达150μg/ml、多达100μg/ml、多达300μg/ml、或多达400μg/ml的靶生物制剂。靶生物制剂的示例性范围包括40μg/ml至400μg/ml;100μg/ml至300μg/ml;和40μg/ml至100μg/ml。
[0075]
在一些实施例中,tgfβ1敲除细胞系可以用于提供具有本披露的组合物部分中所述的一种或多种另外特征的组合物。
[0076]
使用组合物的方法
[0077]
在另一方面,本披露描述了使用由tgfβ1敲除细胞系产生的组合物的方法,该组合物包括例如具有如本披露的组合物部分中所述的一种或多种特征的组合物。
[0078]
在一些实施例中,该组合物可以用于研究。例如,该组合物可以用于测试靶生物制剂的活性。如实例5中所述,由包含wnt3a作为靶生物制剂的tgfβ1敲除细胞系产生的组合物可以在测试wnt3a的活性的测定中使用。
[0079]
在一些实施例中,该组合物可以用于治疗受试者。如本文所用,术语“受试者”包括但不限于人类和非人类脊椎动物。在优选实施例中,受试者是哺乳动物,特别是人。受试者可以是“个体”、“患者”、或“宿主”。非人类脊椎动物包括家畜、伴侣动物、和实验室动物。非人类受试者还包括非人灵长类动物以及啮齿类动物,诸如但不限于大鼠或小鼠。非人类受试者还包括但不限于鸡、马、牛、猪、山羊、狗、猫、豚鼠、仓鼠、貂、以及兔。
[0080]
如本文所用,“治疗(treat)”、“治疗(treating)”或“治疗(treatment)”可以包括治疗性和/或预防性治疗。如本文所用,“治疗障碍”不旨在是绝对术语。治疗可以改进预后或降低症状的频率或严重程度。治疗的令人希望的作用包括预防疾病的发生或复发,缓解疾病的症状,减少疾病的任何直接或间接病理学结果,降低疾病进展速率,改善或减轻疾病状态,以及缓和或改进预后。在一些情况下,症状的频率和严重程度可以降低至非病理学水平。在一些情况下,接受本发明组合物的个体的症状的频率或严重程度仅是患有该障碍的未治疗个体所经历的症状的90%、80%、70%、60%、50%、40%、30%、20%、10%、5%、或1%。
[0081]
精确的剂量和治疗持续时间可以根据所治疗的疾病而变化,并且可以使用已知的测试方案或通过从体内或体外测试数据外推来凭经验确定。浓度和剂量值还可以随着待减轻的病状的严重程度而变化。对于任何特定的受试者,可以根据个体需要以及管理或监督组合物施用的人员的专业判断而随着时间调整具体的剂量方案。
[0082]
示例性方法方面
[0083]
a1.一种用于产生靶生物制剂的方法,其中该方法包括:
[0084]
培养过表达该靶生物制剂的tgfβ1敲除细胞系;和
[0085]
纯化该靶生物制剂。
[0086]
a2.如方面a1所述的方法,其中该方法进一步包括将包含编码该靶生物制剂的基因的载体引入该tgfβ1敲除细胞系中。
[0087]
a3.如方面a1或a2所述的方法,其中该靶生物制剂包含重组蛋白。
[0088]
a4.如方面a1至a3中任一项所述的方法,其中该靶生物制剂包含tgfβ超家族配体。
[0089]
a5.如方面a1至a4中任一项所述的方法,其中该靶生物制剂包含wnt、骨形态发生
蛋白(bmp)、激活素、或生长分化因子(gdf)、或其组合。
[0090]
a6.如方面a1至a5中任一项所述的方法,其中该靶生物制剂包含wnt1、wnt2、wnt2b、wnt3、wnt3a、wnt4、wnt5a、wnt5b、wnt6、wnt7a、wnt7b、wnt8a、wnt8b、wnt9a、wnt9b、wnt10a、wnt10b、wnt11、或wnt16、或其组合。
[0091]
a7.如方面a1至a6中任一项所述的方法,其中该靶生物制剂包含bmp2、bmp3、bmp4、bmp5、bmp6、bmp7、bmp8a、bmp8b、bmp10、bmp11、或bmp15、或其组合。
[0092]
a8.如方面a1至a7中任一项所述的方法,其中该靶生物制剂包含gdf1、gdf3、gdf5、gdf6、gdf8、gdf9、gdf10、gdf11、或gdf15、或其组合。
[0093]
a9.如方面a1至a8中任一项所述的方法,其中该靶生物制剂选自wnt3a、wnt5a、gdf15、bmp4、或bmp2、或其组合。
[0094]
a10.如方面a1至a9中任一项所述的方法,其中该靶生物制剂包含抗体。
[0095]
a11.如方面a10所述的方法,其中该抗体包括单克隆抗体。
[0096]
a12.如方面a1至a11中任一项所述的方法,其中该靶生物制剂包含生物药物。
[0097]
a13.如方面a1至a12中任一项所述的方法,其中该靶生物制剂包含小鼠蛋白。
[0098]
a14.如方面a1至a12中任一项所述的方法,其中该靶生物制剂包含人类蛋白。
[0099]
a15.如方面a1至a14中任一项所述的方法,其中该细胞系包括中国仓鼠卵巢(cho)细胞系。
[0100]
a16.如方面a1至a15中任一项所述的方法,其中该方法进一步包括将该组合物暴露于抗tgfβ1抗体。
[0101]
a17.如方面a16所述的方法,其中抗体柱包括抗tgfβ1抗体。
[0102]
a18.一种组合物,该组合物包含通过如方面a1至a17中任一项所述的方法产生的靶生物制剂。
[0103]
a19.如方面a18所述的组合物,其中该组合物包含小于0.5ng/ml tgfβ1蛋白、小于0.1ng/ml tgfβ1蛋白、小于0.01ng/ml tgfβ1、小于0.05ng/ml(50pg/ml)tgfβ1蛋白、小于0.02ng/ml(20pg/ml)tgfβ1蛋白、小于0.01ng/ml(10pg/ml)tgfβ1蛋白、小于0.005ng/ml(5pg/ml)tgfβ1蛋白、小于1pg/ml tgfβ1蛋白、小于0.5pg/ml(500fg/ml)tgfβ1蛋白、小于0.01pg/ml(100fg/ml)tgfβ1蛋白、小于0.05pg/ml(50fg/ml)tgfβ1蛋白、小于0.005pg/ml(5fg/ml)tgfβ1蛋白、或小于0.001pg/ml(1fg/ml)tgfβ1蛋白。
[0104]
a20.如方面a18或a19所述的组合物,其中该组合物包含不可检测水平的tgfβ1。
[0105]
a21.如方面a20所述的组合物,其中tgfβ1的水平使用quantikine elisa试剂盒(目录号#dβ100b,r&d系统公司,明尼阿波利斯,明尼苏达州)来测量。
[0106]
a22.如方面a18至a21中任一项所述的组合物,其中该组合物包含至少40μg/ml、至少50μg/ml、至少100μg/ml、至少150μg/ml、或至少200μg/ml的该靶生物制剂。
[0107]
a23.如方面a18至a21中任一项所述的组合物,其中该组合物包含多达50μg/ml、多达100μg/ml、多达150μg/ml、多达200μg/ml、多达300μg/ml、或多达400μg/ml的该靶生物制剂。
[0108]
示例性组合物方面
[0109]
b1.一种组合物,该组合物包含靶生物制剂,
[0110]
其中该靶生物制剂包含tgfβ超家族配体,并且
[0111]
其中该组合物包含小于0.5ng/ml tgfβ1蛋白、小于0.1ng/ml tgfβ1蛋白、小于0.01ng/ml tgfβ1、小于0.05ng/ml(50pg/ml)tgfβ1蛋白、小于0.02ng/ml(20pg/ml)tgfβ1蛋白、小于0.01ng/ml(10pg/ml)tgfβ1蛋白、小于0.005ng/ml(5pg/ml)tgfβ1蛋白、小于1pg/ml tgfβ1蛋白、小于0.5pg/ml(500fg/ml)tgfβ1蛋白、小于0.01pg/ml(100fg/ml)tgfβ1蛋白、小于0.05pg/ml(50fg/ml)tgfβ1蛋白、小于0.005pg/ml(5fg/ml)tgfβ1蛋白、或小于0.001pg/ml(1fg/ml)tgfβ1蛋白。
[0112]
b2.一种组合物,该组合物包含靶生物制剂,
[0113]
其中该靶生物制剂包含生物药物,并且
[0114]
其中该组合物包含小于0.5ng/ml tgfβ1蛋白、小于0.1ng/ml tgfβ1蛋白、小于0.01ng/ml tgfβ1、小于0.05ng/ml(50pg/ml)tgfβ1蛋白、小于0.02ng/ml(20pg/ml)tgfβ1蛋白、小于0.01ng/ml(10pg/ml)tgfβ1蛋白、小于0.005ng/ml(5pg/ml)tgfβ1蛋白、小于1pg/ml tgfβ1蛋白、小于0.5pg/ml(500fg/ml)tgfβ1蛋白、小于0.01pg/ml(100fg/ml)tgfβ1蛋白、小于0.05pg/ml(50fg/ml)tgfβ1蛋白、小于0.005pg/ml(5fg/ml)tgfβ1蛋白、或小于0.001pg/ml(1fg/ml)tgfβ1蛋白。
[0115]
b3.如方面b1或b2所述的组合物,其中该组合物包含不可检测水平的tgfβ1。
[0116]
b4.如方面b3所述的组合物,其中tgfβ1的水平使用quantikine elisa试剂盒(目录号#dβ100b,r&d系统公司,明尼阿波利斯,明尼苏达州)来测量。
[0117]
b5.如方面b1至b4中任一项所述的组合物,其中该组合物包含至少40μg/ml、至少50μg/ml、至少100μg/ml、至少150μg/ml、或至少200μg/ml的该靶生物制剂。
[0118]
b6.如方面b1至b5中任一项所述的组合物,其中该组合物包含多达50μg/ml、多达100μg/ml、多达150μg/ml、多达200μg/ml、多达300μg/ml、或多达400μg/ml的该靶生物制剂。
[0119]
b7.如方面b1至b6中任一项所述的组合物,其中该靶生物制剂包含重组蛋白。
[0120]
b8.如方面b1至b7中任一项所述的组合物,其中该靶生物制剂包含抗体。
[0121]
b9.如方面b8所述的组合物,其中该抗体包括单克隆抗体。
[0122]
b10.如方面b1至b7中任一项所述的组合物,其中该靶生物制剂包含wnt、骨形态发生蛋白(bmp)、激活素、或生长分化因子(gdf)、或其组合。
[0123]
b11.如方面b10所述的组合物,其中该靶生物制剂包含wnt1、wnt2、wnt2b、wnt3、wnt3a、wnt4、wnt5a、wnt5b、wnt6、wnt7a、wnt7b、wnt8a、wnt8b、wnt9a、wnt9b、wnt10a、wnt10b、wnt11、或wnt16、或其组合。
[0124]
b12.如方面b10所述的组合物,其中该靶生物制剂包含bmp2、bmp3、bmp4、bmp5、bmp6、bmp7、bmp8a、bmp8b、bmp10、bmp11、或bmp15、或其组合。
[0125]
b13.如方面b10所述的组合物,其中该靶生物制剂包含gdf1、gdf3、gdf5、gdf6、gdf8、gdf9、gdf10、gdf11、或gdf15、或其组合。
[0126]
b14.如方面b10所述的组合物,其中该靶生物制剂选自wnt3a、wnt5a、gdf15、bmp4、或bmp2、或其组合。
[0127]
b15.如方面b1至b14中任一项所述的组合物,其中该靶生物制剂包含小鼠蛋白。
[0128]
b16.如方面b1至b14中任一项所述的组合物,其中该靶生物制剂包含人类蛋白。
[0129]
b17.如方面b1至b16中任一项所述的组合物,其中该靶生物制剂包含生物药物。
[0130]
b18.如方面b1至b17中任一项所述的组合物,其中该组合物包括药物组合物。
[0131]
示例性tgfβ1敲除细胞系和制备方法方面
[0132]
c1.一种tgfβ1敲除细胞系,其中该tgfβ1敲除细胞系在编码tgfβ1的核苷酸中包含突变或缺失。
[0133]
c2.如方面c1所述的tgfβ1敲除细胞系,其中该tgfβ1敲除细胞系包括中国仓鼠卵巢(cho)细胞系或人胚胎肾(hek)细胞系。
[0134]
c3.如方面c1或c2所述的tgfβ1敲除细胞系,其中该tgfβ1敲除细胞系包含引入这些编码tgfβ1的核苷酸中的终止密码子。
[0135]
c4.如方面c1至c3中任一项所述的tgfβ1敲除细胞系,其中该tgfβ1敲除细胞系过表达靶生物制剂。
[0136]
c5.如方面c4所述的tgfβ1敲除细胞系,其中该靶生物制剂包含tgfβ超家族配体、重组蛋白、核糖核蛋白、非肽、糖蛋白、糖脂、亚细胞器、血液组分、生物药物、或其组合。
[0137]
c6.一种制备如方面c1至c5中任一项所述的tgfβ1敲除细胞系的方法。
[0138]
c7.如方面c6所述的方法,其中该方法包括基于crispr的基因编辑。
[0139]
c8.如方面c7所述的方法,其中该方法包括基于crispr-cas9的基因编辑。
[0140]
c9.如方面c7或c8所述的方法,其中该方法包括对这些编码tgfβ1的核苷酸进行基于crispr的基因编辑。
[0141]
c10.如方面c6至c9中任一项所述的方法,其中该方法包括将包含编码靶生物制剂的基因的载体引入该tgfβ1敲除细胞系中
[0142]
本发明通过以下实例来说明。应理解,特定实例、材料、量和程序应根据如本文所阐述的本发明的范围和精神来宽泛地解释。
[0143]
实例
[0144]
以下实例中使用的所有试剂、原材料、和溶剂均购自商业供应商(诸如西格玛奥德里奇公司,圣路易斯,密苏里州(sigma aldrich,st.louis,mo)),并且除非另外指示,否则无需进一步纯化即可使用。
[0145]
实例1
[0146]
此实例描述了tgfβ1敲除细胞系的开发和表征。
[0147]
使用crispr/cas9基因编辑技术来在宿主中国仓鼠卵巢(cho)细胞系中进行定向基因修饰。选择特定指导rna来引导cas9酶的核酸酶活性以靶向宿主细胞基因组中的已知序列,从而“敲除”cho tgfβ1基因的功能,使细胞无法产生这种蛋白质。
[0148]
如以下进一步所述,在基因编辑过程之后,通过个体克隆的基因组序列分析确认了这些细胞不能产生tgfβ1。通过使用quantikine elisa试剂盒(r&d系统公司,明尼阿波利斯,明尼苏达州)筛选tgfβ1的存在获得了进一步的确认。
[0149]
tgfβ1敲除(ko)细胞系的生成
[0150]
由明尼苏达州明尼阿波利斯的b-mogen生物技术公司(b-mogen biotechnologies,inc.)使用来自加利福尼亚州门洛帕克的synthego公司(synthego corporation,menlo park,ca)的grna(5'-caagaccatcgacatggagc-3’)进行tgfβ1的敲除。使用quantikine elisa试剂盒(r&d系统公司,明尼阿波利斯,明尼苏达州)分离克隆并测试tgfβ1和tgfβ2。重新分离具有最低tgfβ1水平的克隆。然后使用pcr扩增靶克隆的靶区域,并且选择在靶区域中显示终止密码子的克隆(在本文中被称为cho-s tgfβ1 ko)用于进一步
测试。
[0151]
基因组序列分析
[0152]
使用quick-dna microprep试剂盒(目录号d3020,zymo研究公司,尔湾,加利福尼亚州(zymo research,irvine,ca))制备cho-s野生型(wt)和cho-s tgfβ1敲除(ko)基因组dna。使用gotaq g2 hot start(目录号m7422,普洛麦格公司,麦迪逊,威斯康星州(promega,madison,wi))对基因组dna样品进行pcr以扩增目的区域。
[0153]
pcr引物:
[0154]
正向:5'-gctcccctatttaagaacac-3'(seq id no:4)
[0155]
反向:5'-gctctgccggtggtttcctc-3'(seq id no:5)
[0156]
pcr方案:
[0157]
步骤1:95℃,持续2分钟
[0158]
步骤2:95℃,持续30秒
[0159]
步骤3:57℃,持续30秒
[0160]
步骤4:72℃,持续40秒
[0161]
将步骤2至步骤4重复35次
[0162]
步骤5:72℃,持续2分钟
[0163]
将pcr产物在1%琼脂糖凝胶上运行,并且在透射仪上拍摄图像,从而使溴化乙锭染色可视化。结果在图1中示出,并且指示在cho-s tgfβ1 ko细胞的tgfβ1基因组序列中引入了基因突变。
[0164]
从凝胶上切下来自cho-s tgfβ1 ko的pcr产物的条带,纯化并测序(测序引物:5
’‑
ttcagggctctctcctaacc-3’(seq id no:6))。结果在图2中示出。序列分析确认了在tfgβ1基因的开头附近具有64个碱基对(bp)插入物,从而易错非同源末端连接(nhej)双链修复机制,通过indel在氨基酸51处引入了终止密码子。
[0165]
tgfβ1elisa数据
[0166]
将cho-s细胞、cho-s tgfβ1 ko细胞、表达重组hgdf-15的cho-s tgfβ1 ko细胞、和表达重组htgfβ1的cho-s tgfβ1 ko细胞铺板到ex-cell acr cho培养基(目录号c5467,西格玛奥德里奇公司,圣路易斯,密苏里州)中,该培养基含有4mm l-谷氨酰胺、1%pen strep、和2.5mm nabr并置于33℃培养箱中。
[0167]
将hek293ebna细胞和表达重组hgdf-15的hek293ebna铺板到置于37℃培养箱中的含有4mm l-谷氨酰胺和1%pen strep的ex-cell acr cho培养基(目录号c5467,西格玛奥德里奇公司,圣路易斯,密苏里州)中。
[0168]
在第3天收集条件培养基并使用人tgfβ1quantikine elisa试剂盒(目录号#dβ100b,r&d系统公司,明尼阿波利斯,明尼苏达州)进行分析。
[0169]
结果在图3中示出。可检测量的tgfβ1存在于野生型cho-s wt细胞、hek wt、和表达重组hgdf-15的hek293细胞的条件培养基中。(图3和表1。)cho-s tgfβ1 ko样品和表达hgdf-15的cho-s tgfβ1 ko细胞的条件培养基中存在的tgfβ1的量低于可检测范围。(图3和表1。)表达重组htgfβ1的cho-s tgfβ1 ko细胞具有比亲本细胞系显著更高水平的tgfβ1(表1)。
[0170]
表1.
[0171]
样品ng/ml tgfβ1cho-s wt1.4850hek293wt0.3193hek293wt hgdf-150.2260cho-s tgfβ1 ko*cho-s tgfβ1 ko hgdf-15*cho-s tgfβ1 ko htgfβ11216.1796
[0172]
*低于检测限
[0173]
实例2
[0174]
此实例描述了tgfβ1污染对du145人前列腺癌细胞系中gdf15激活smad2的影响。
[0175]
将du145细胞血清饥饿2小时,之后添加蛋白质处理(具有或没有tgfβ1封闭抗体),持续1小时,然后向细胞中添加hgdf15蛋白,再持续1小时。然后裂解细胞并通过蛋白质印迹分析进行分析。使用的抗体是兔抗磷酸化smad2抗体(细胞信号传导技术公司,丹佛斯,马塞诸塞州(cell signaling technology,danvers,ma))和小鼠抗helf-4e抗体(r&d系统公司,明尼阿波利斯,明尼苏达州)(用作上样对照)。
[0176]
结果在图4a中示出。在培养基的3.6pg/ml tgfβ1污染水平下检测到smad2磷酸化。图4a的每条泳道的内容物在表2a中描述。
[0177]
另外的结果也在图4b中示出。图4b的每条泳道的内容物在表2b中描述。在用2μg/ml从cho-s野生型细胞纯化的重组人gdf-15处理的du145细胞中检测到smad2磷酸化,但在用2μg/ml从cho-s tgfβ1敲除cho-s细胞系纯化的重组gdf-15处理du145细胞时没有检测到。
[0178]
表2a.
[0179]
[0180][0181]
表2b
[0182]
[0183][0184]
实例3
[0185]
此实例描述了tgfβ1对通过wnt-3a进行的成骨细胞分化的影响。
[0186]
来自已知具有相对高水平的tgf1污染(78pg tgfβ1/微克(μg)wnt-3a蛋白)的批次的重组小鼠wnt-3a蛋白在更高浓度的wnt-3a下导致的mc3t3-e1前成骨细胞向成骨细胞中的分化较少(图5中的圆圈)。当在存在饱和剂量(50μg/ml)的鸡抗tgfβ1封闭抗体(目录号af-101-na,r&d系统公司,明尼阿波利斯,明尼苏达州)的情况下向mc3t3-e1前成骨细胞添加相同剂量的小鼠wnt-3a蛋白时,观察到成骨细胞分化的挽救,其中碱性磷酸酶活性反弹至预测的稳定期。结果在图5中示出。
[0187]
这些结果表明中和纯化小鼠wnt-3a蛋白中的tgfβ1去除了成骨细胞分化的负调节因子。
[0188]
实例4
[0189]
此实例描述了tgfβ1对wnt-3a介导的碱性磷酸酶(alp)表达增加的影响。
[0190]
将mc3t3/e1成骨细胞以1x 104个细胞/孔接种过夜。第二天,去除培养基(将mc3t3/e1成骨细胞留在板上),并且添加新的包含wnt-3a或wnt-3a和tgfβ1的培养基。在存在wnt-3a或wnt-3a和tgfβ1的情况下,将细胞再温育3天,并且测量碱性磷酸酶(alp)活性(pacifici等人,exp.cell res.[实验细胞研究]1991;195,38-46)。结果在图6中示出。
[0191]
单独用重组人wnt-3a蛋白处理的mc3t3-e1前成骨细胞表现出成骨细胞分化的剂量应答性诱导,这通过在添加wnt-3a蛋白之后三天alp活性增加来说明。(图6,圆圈)。
[0192]
在将20ng/ml恒定剂量的重组人wnt-3a蛋白添加到mc3t3-e1细胞中持续三天时,产生了相对高水平的alp活性。(图6,平线和三角形。)如果将20ng/ml相同稳定剂量的重组人wnt-3a蛋白添加到细胞中,并且添加重组人tgfβ1的剂量滴定(图6,正方形),在53.3fg/ml的50%中和剂量(nd50)的tgfβ1下观察到wnt-3a介导的成骨细胞分化的抑制。
[0193]
实例5
[0194]
此实例描述了在设计用于测量hwnt3a的影响的测定中,从cho wt和cho tgfβ1 ko细胞系纯化的人wnt3a(hwnt3a)的tgfβ1污染的影响。
[0195]
cho tgfβ1 ko细胞系如实例1中所述而制备。所有表达hwnt3a的cho-s或cho-s tgf1 ko系都是通过转染表达hwnt3a的dna表达质粒制备的,并且用嘌呤霉素选择以选择过表达hwnt3a的克隆稳定整合的细胞系。与从稳定过表达hwnt3a的tgfβ1敲除cho-s细胞系(cho-s tgfβ1 ko wnt3a)分离的hwnt3a中观察到的降低水平的tgfβ1蛋白相比,从稳定表达hwnt3a的cho-s wt细胞纯化的重组人wnt3a显示相对高水平的tgfβ1蛋白。结果在表3中示出。批次#rsk69具有165pg tgfβ1蛋白/μg hwnt3a蛋白,并且批次#rsk51具有114.6pg tgfβ1蛋白/μg hwnt3a蛋白。相比之下,从cho-s tgfβ1 ko系(批次#dlgc02)纯化的hwnt3a蛋白具有4.97pg tgfβ1蛋白/μg hwnt3a蛋白。从tgfβ1 ko系纯化的hwnt3a蛋白中tgfβ1蛋
白水平低是由于使用了包含在细胞培养基中的2%胎牛血清(fbs);包含fbs是培养产生活性重组wnt蛋白的细胞所必需的。这种tgfβ1蛋白的来源不是细胞衍生的,而是来自细胞培养期间使用的血清。
[0196]
表3
[0197][0198][0199]
在mc3t3-e1成骨细胞分化测定中,来自从野生型cho-s细胞纯化的批次的hwnt3a蛋白在最高水平的hwnt3a处理下显示抑制作用(图7和图9)。在较高剂量的从野生型cho-s细胞纯化的hwnt3a(1.66μg/ml、0.556μg/ml、和0.185μg/ml)下观察到骨诱导活性降低,但在用衍生自cho-s tgfβ1 ko细胞的hwnt3a处理mc3t3-e1细胞没有观察到(图7和图9)。较高剂量的wnt3a蛋白下的活性“下降”是由于tgfβ1污染,并且可以用tgfβ1功能封闭抗体逆转(参见,例如图5和图9)。此外,如图9所示,在mc3t3-e1测定中,具有高水平tgfβ1污染的hwnt3a蛋白在高hwnt3a剂量下产生的骨诱导活性比从tgfβ1 ko cho-s细胞纯化的hwnt3a蛋白或从cho-s tgfβ1 ko细胞纯化的hwnt3a更低。
[0200]
与从cho-s wt细胞纯化的hwnt3a相比,从cho-s tgfβ1 ko细胞纯化的重组hwnt3a显示明显更低水平的tgfβ1(参见表3)。从cho-s tgfβ1 ko细胞纯化的重组hwnt3a中这种低水平的tgfβ1污染由细胞培养期间产生活性wnt蛋白所必需的2%血清产生。添加tgfβ1封闭抗体挽救了表达hwnt3a的cho-s tgfβ1 ko细胞中由血清产生的较低水平tgfβ1污染的抑制作用(图9)。这些数据表明,与从表达hwnt3a的cho-s wt细胞纯化的hwnt3a相比,从cho-s tgfβ1 ko细胞纯化的hwnt3a含有显著更少的tgfβ1污染。另外,这些数据进一步表明,对mc3t3-e1成骨细胞分化的抑制作用与纯化的hwnt3a蛋白中tgfβ1污染的相对量相关。
[0201]
有趣的是,tgfβ1污染并不影响所有测定系统。例如,在hek293wnt报告基因测定中未检测到从cho-s wt和cho-s tgfβ1 ko细胞纯化的hwnt3a蛋白之间的主要功能差异,如以下进一步所述。
[0202]
生成了在seap报告基因上游并入九个t细胞因子(tcf)结合元件的稳定细胞系(korinek等人science[科学]275,1784-1787(1997))。wnt蛋白与此hek293细胞系的细胞表面上的wnt受体结合,导致一系列细胞内事件,最终导致β-连环蛋白与tcf转录因子结合,从而产生报告基因seap。seap被分泌到培养基中,并且seap活性测定提供了wnt途径活性的指示。重组tgfβ1蛋白先前已在此wnt报告基因测定中进行了测试,但未激活此wnt特异性测定。
[0203]
结果在图8中示出。这些结果并不是令人意外的;在此hek293wnt报告基因中tgfβ1蛋白的滴定在此wnt报告基因系统中没有显示任何影响。这些数据表明tgfβ1污染是细胞和测定环境依赖性的,并非所有的生物活性测定都将显示对tgfβ1污染的敏感性。
[0204]
本文引用的所有专利、专利申请、以及出版物和电子可得材料(包括,例如,提交到例如genbank和refseq中的核苷酸序列,以及提交到例如swissprot数据库、pir、prf、pdb中的氨基酸序列,以及来自genbank和refseq中的注释编码区的翻译)的完整披露内容通过援引并入。在本技术的披露内容和通过援引并入本文的任何文件的披露内容之间存在任何不一致性的情况下,本技术的披露内容应当占据主导。仅出于清楚理解起见给出以上详细说明和实例。不应将其理解成不必要的限制。本发明不限于所示和所述的精确细节,因为将在权利要求定义的本发明内包含对于本领域技术人员而言显而易见的变体。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。