含硼环状发光化合物和包含该化合物的色彩转换膜
1.相关申请的交叉引用
2.本技术要求于2020年3月20日提交的美国临时申请no.62/992,776的权益,其全部内容通过引用并入本文。
技术领域
3.本发明涉及用于色彩转换膜的化合物、背光单元、和包括该背光单元的显示装置。
背景技术:
4.在颜色再现中,域(gamut)或色域(color gamut)为如电视或显示器等装置上可用颜色的特定完整子集。例如,开发了通过使用纯光谱原色实现的宽域(wide-gamut)色空间的adobe
tm
红绿蓝(rgb),以提供更宽的色域并且提供通过显示器查看的更逼真的可见颜色的表示。认为的是,可以提供更宽色域的装置可以使显示器能够呈现更鲜艳的色彩。
5.随着高清大屏幕显示器越来越普及,对更高性能、更薄和功能强大的显示器的需求也在增加。目前的发光二极管(led)通过蓝光光源激发绿色磷光体、红色磷光体或黄色磷光体以获得白色光源而获得。然而,目前绿色和红色磷光体的发射峰的半峰全宽(fwhm)相当大,通常为大于40nm,导致绿色和红色光谱重叠并且呈现无法彼此完全区分的颜色。这种重叠导致了色彩再现差和色域的劣化。
6.为了校正色域的劣化,已经开发了使用含有量子点的膜与led组合的方法。然而,量子点的使用存在问题。首先,镉系量子点毒性极强,并且由于健康安全问题而在许多国家被禁止使用。其次,非镉系量子点将蓝色led光转换为绿光和红光的效率非常低。第三,量子点需要昂贵的封装工艺来防护水分和氧气。最后,由于在生产过程期间难以控制尺寸均匀性,因此使用量子点的成本高。
技术实现要素:
7.本文所述的光致发光复合物可以用于改善电视、电脑显示器、智能装置和任何其它利用彩色显示器的装置中可区分颜色之间的对比度。本发明的光致发光复合物提供具有良好的蓝光吸光度和窄的发射带宽的新型色彩转换染料复合物,其中发射带的半峰全宽[fwhm]小于40nm。在一些实施方案中,光致发光复合物吸收第一波长的光并且发射比第一波长更高的第二波长的光。本文公开的光致发光复合物可以与用于发光设备的色彩转换膜一起使用。本发明的色彩转换膜通过减少色谱内的重叠来减少颜色劣化,从而产生高品质的颜色再现。
[0008]
一些实施方案包括一种光致发光复合物,其包含吸收蓝光的唑衍生物、连接基团(例如,包含未取代的酯或取代的酯的连接基团)和二吡咯亚甲基硼(bodipy)部分。在一些实施方案中,所述连接基团可以将所述唑衍生物共价连接至所述bodipy部分。在一些实施方案中,所述唑衍生物吸收第一激发波长的光并将能量转移到所述bodipy部分。在一些实施方案中,所述bodipy部分吸收来自所述唑衍生物的能量并发射第二更高波长的光能。在
一些实施方案中,所述光致发光复合物的发射量子产率大于70%。
[0009]
在一些实施方案中,光致发光复合物可以具有半峰全宽[fwhm]为至多40nm的发射带。
[0010]
在一些实施方案中,光致发光复合物可以具有斯托克斯位移(stokes shift),即蓝光吸收部分的激发峰和bodipy部分的激发峰之差等于或大于45nm。
[0011]
在一些实施方案中,唑衍生物可以为以下通式:
[0012][0013]
在一些实施方案中,z可以是氮(nr
10
)。在一些实施方案中,z可以为硫(s)。在一些实施方案中,z可以为氧(o)。在一些实施方案中,r9可以是h或连接基团(例如,未取代的酯连接基团或取代的酯连接基团)。在一些实施方案中,r
10
可以是h、取代的芳基或连接基团(例如,未取代的酯连接基团或取代的酯连接基团)。
[0014]
在一些实施方案中,bodipy衍生物可以为以下通式:
[0015][0016]
其中r
1-r8如下文更详细地描述,l表示连接基团,例如包含未取代的酯或取代的酯的连接基团。
[0017]
一些实施方案包括一种色彩转换膜,其包括色彩转换层;其中所述色彩转换层包括树脂基质;和分散在所述树脂基质中的本文所述的光致发光复合物。在一些实施方案中,色彩转换膜可以包括在1μm~约200μm之间的厚度。在一些实施方案中,本发明的色彩转换膜可以吸收400nm~约480nm范围内的蓝光并且发射510nm~约560nm波长范围内的光。另一实施方案记载一种色彩转换膜,其可以吸收400nm~约480nm范围内的蓝光并且发射575nm~约645nm波长范围内的光。在一些实施方案中,色彩转换膜可以进一步包括透明基材层。在一些实施方案中,透明基材层包括两个相对的表面,其中色彩转换层设置在所述相对的表面中之一上。
[0018]
一些实施方案包括一种色彩转换膜的制备方法,所述方法包括:将前述光致发光
复合物和粘结剂树脂的至少一种溶解在溶剂中;并且将混合物施加到透明基材的相对的表面中之一上。
[0019]
一些实施方案包括一种背光单元,其包括本文所述的色彩转换膜。其它实施方案包括一种显示装置,其包括本文所述的背光单元。
附图说明
[0020]
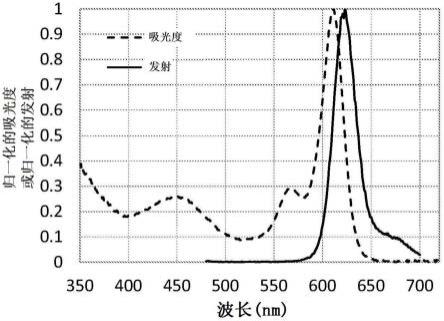
图1为描绘光致发光复合物plc-1的一个实施方案的吸收和发射光谱的图。
[0021]
图2为描绘光致发光复合物plc-5的一个实施方案的吸收和发射光谱的图。
具体实施方式
[0022]
本发明描述了一种光致发光复合物及其在色彩转换膜中的用途。该光致发光复合物可以用于改善和提高色彩转换膜内的一个以上的期望的发射带宽的透射。在一些实施方案中,光致发光复合物可以同时提高期望的第一发射带宽的透射并且减少第二发射带宽的透射。例如,色彩转换膜可以提高两种以上的颜色之间的对比度或强度,从而增加彼此之间的区别。本发明描述了一种光致发光复合物,其可以提高两种颜色之间的对比度或强度,从而增加它们彼此之间的区别。
[0023]
如本文所用,当将化合物或化学结构称为“取代的”时,其可以包括一个以上的取代基。取代的基团源自未取代的母体结构,其中母体结构上的一个以上的氢原子已经由一个以上的取代基独立地替代。在一种以上的形式中,取代基可以独立地选自任选地取代的烷基、烯基、酮、芳基或c
3-c7杂烷基。
[0024]
如本文所用的术语“烷基”是指不具有c=c或c≡c基的烃基。“烯基”部分是指具有至少一个碳-碳双键(-c=c-)的基团,并且“炔基”部分是指具有至少一个碳-碳三键(-c≡c-)的基团。无论饱和或不饱和,烷基、烯基、或炔基部分都可以为支链、直链或环状的。
[0025]
烷基部分可以具有1~6个碳原子(不论其在本文中出现在何处,数值范围如“1~6”是指在给定范围内的各整数):例如,“1~6个碳原子”意指烷基可以具有1个碳原子、2个碳原子、3个碳原子等直至包括6个碳原子,但本定义也涵盖其中没有指定数值范围的术语“烷基”的出现。本文指定的化合物的烷基可以命名为“c
1-c6烷基”或类似的名称。仅举例而言,“c
1-c6烷基”表示在烷基链中存在一至六个碳原子,即,烷基链选自甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基和叔丁基。因此,c
1-c6烷基包括c
1-c2烷基、c
1-c3烷基、c
1-c4烷基、c
1-c5烷基。烷基可以为取代的或未取代的。典型的烷基包括甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、戊基、己基、环丙基、环丁基、环戊基、和环己基等。
[0026]
典型的烯基包括乙烯基、丙烯基、丁烯基等。
[0027]
如本文所用的术语“杂烷基”是指如本文所定义的烷基,其中一个以上的构成碳原子已经由氮、氧或硫替代。实例包括但不限于-ch
2-o-ch3、-ch
2-ch
2-o-ch3、-ch
2-nh-ch3、-ch
2-n(ch3)-ch3、-ch
2-ch
2-nh-ch3、-ch
2-ch
2-n(ch3)-ch3、-ch
2-s-ch
2-ch3、-ch
2-ch
2-s(o)-ch3。另外,至多2个杂原子可以是连续的,例如,举例为-ch
2-nh-o-ch3等。
[0028]
术语“芳香族”是指具有包含4n 2π个电子的离域π电子系的平面环,其中n为整数。芳香族环可以由五个、六个、七个、八个、九个或超过九个原子形成。芳香族可以为任选地取代的。术语“芳香族”同时包括碳环芳基(例如,苯基)和杂环芳基(或“杂芳基”或“杂芳香
族”)基团(例如,吡啶)。该术语包括单环或稠环多环(即,共享相邻的碳原子对的环)基团。
[0029]
术语“烃环”是指仅包含碳和氢并且可以为饱和的单环或多环基团。单环烃环包括具有3~12个碳原子的基团。单环基团的示例性实例包括以下部分:
[0030]030]
等。多环基团的示例性实例包括以下部分:[二环辛烷]、[二环戊烷]、[二环庚烷]、[二环庚烷]、[二环癸烷]、[十氢化萘]、[八氢并环戊二烯]、[八氢茚]、[六氢化茚]、[1,2,3,4-四氢化萘]、[2,3-二氢-1h-茚]、[1,1-二甲基-2,3-二氢-1h-茚]、[2’,3
’‑
二氢螺环[环戊烷-1,1
’‑
茚]、或[1,2,3,3a-四氢并环戊二烯]等。
[0031]
如本文所用的术语“芳基”意指芳香族环,其中形成环的原子各自为碳原子。芳基环可以由五个、六个、七个、八个或大于八个的碳原子形成。芳基可以为取代的或未取代的。芳基的实例包括但不限于苯基、萘基、菲基等。
[0032]
术语“芳烷基”意指用如本文记载的芳基取代的如本文记载的烷基残基。非限制性芳烷基包括苄基、苯乙基等。
[0033]
术语“杂芳基”是指包括一个以上的选自氮、氧和硫的环杂原子的芳基,其中杂芳基在其环体系中具有4~10个原子,条件是该基团的环不包含两个相邻的氧或硫原子。理解的是,杂芳基环可以在环中具有另外的杂原子。在具有两个以上的杂原子的杂芳基中,这些两个以上的杂原子可以彼此相同或不同。杂芳基可以为任选地取代的。含n的杂芳基部分是
指其中环的骨架原子中至少之一为氮原子的芳基。杂芳基的示例性实例包括以下部分:吡咯、咪唑、吡啶等。
[0034]
如本文所用的术语“卤素”意指氟、氯、溴、和碘。
[0035]
如本文所用的术语“键”、“键合的”、“直接键”或“单键”意指当通过键连接的原子被认为是更大结构的一部分时,两个原子、或至两个部分之间的化学键。
[0036]
如本文所用的术语“部分”是指分子的特定链段或官能团。化学部分通常被认为是嵌入或附加到分子中的化学实体。
[0037]
如本文所用的术语“氰基”或“腈”是指包含-cn官能团的任意有机化合物。
[0038]
术语“酯”是指具有式-coor的化学部分,其中r选自烷基、环烷基、芳基、杂芳基(通过环碳键合)和杂环族(通过环碳键合)。本文所述的化合物上的任何羟基或羧基侧链都可以为酯化的。任何合适的方法可以用于制备这种酯,并且可以容易地在参考资料中找到。
[0039]
如本文所用的术语“醚”是指包含连接至两个烷基或芳基的氧原子的化学部分,其中通式为r-o-r
′
,其中术语烷基和芳基如本文所定义。
[0040]
如本文所用的术语“酮”是指包含连接至两个烷基或芳基的羰基(碳-氧双键)的化学部分,其中通式为rc(=o)r
′
,其中术语烷基和芳基如本文所定义。
[0041]
如本文所用的术语“唑”或“唑衍生物”是指具有下式的化学部分:
[0042][0043]
如本文所用的术语“bodipy”是指具有下式的化学部分:
[0044][0045]
bodipy部分可以由与二取代的硼原子、通常为bf2单元复合的二吡咯亚甲基构成。bodipy核的iupac名称为4,4-二氟-4-硼杂-3a,4a-二氮杂-s-引达省。
[0046]
术语“可以”或“可以是”的使用应被理解为“为”或“不为”的表达,或者选择性地“做”或“不做”或“将会”或“将不会”等。例如,陈述“吸收蓝光的唑衍生物和bodipy部分间隔的距离可以是约以上”应被解释为,例如,“在一些实施方案中,吸收蓝光的唑衍生物和
bodipy部分间隔的距离为约以上”,或“在一些实施方案中,吸收蓝光的唑衍生物和bodipy部分间隔的距离不为约以上”。
[0047]
本发明涉及光致发光复合物,其吸收第一波长的光能并发射第二更高波长的光能。本发明的光致发光复合物包含通过连接基团联接的吸收发光部分和发射发光部分,从而调谐它们的距离以将吸收发光部分的能量转移到受体发光部分,其中受体发光部分然后以大于吸收的第一波长的第二波长发射。
[0048]
本发明的光致发光复合物包含:吸收蓝光的唑衍生物;连接基团;和二吡咯亚甲基硼(bodipy)部分。在一些实施方案中,连接基团可以将唑衍生物共价连接至bodipy部分。在一些实施方案中,唑衍生物吸收第一激发波长的光并将能量转移到bodipy部分,然后bodipy部分发射第二波长的光能,其中第二波长的光能高于第一波长。据信,从激发的唑衍生物到bodipy部分的能量转移通过荧光共振能量转移(forster resonance energy transfer)(fret)发生。这种观点是由于光致发光复合物的吸收/发射光谱,其中有两个主要吸收带,一个在蓝光吸收带(唑衍生物),一个在bodipy吸收带,并且只有一个发射带位于bodipy部分发射波长(参见图1和2)。
[0049]
在一个实施方案中,光致发光复合物可以具有高的发射量子产率。在一些实施方案中,发射量子产率可以大于15%、大于20%、大于25%、大于30%、大于35%、大于40%、大于45%、大于50%、大于55%、大于60%、大于65%、大于70%、大于75%、大于80%、大于85%、大于90%、或大于95%;和/或高达100%。在一些实施方案中,发射量子产率可以大于50%、或55%、或60%、或65%、或70%、或75%、或80%、或85%、或90%、或95%;并且可以高达或接近100%。发射量子产率可以通过将发射的光子数除以吸收的光子数来测量,这与发光部分的发射效率等效。在一些实施方案中,吸收发光部分的发射量子产率可以大于80%。在一些实施方案中,量子产率可以大于0.8(80%)、0.81(81%)、0.82(82%)、0.83(83%)、0.84(84%)、0.85(85%)、0.86(86%)、0.87(87%)、0.88(88%)、0.89(89%)、0.9(90%)、0.91(91%)、0.92(92%)、0.93(93%)、0.94(94%)、或0.95(95%);和/或高达1(100%)。膜中的量子产率测量可以通过分光光度计,例如,quantaurus-qy分光光度计(humamatsu,inc.,campbell,ca,usa)来进行。
[0050]
在一些实施方案中,光致发光复合物具有发射带,其半峰全宽(fwhm)可以小于40nm。fwhm为在发射强度为发射带最大发射强度的一半时发射带的宽度(以纳米为单位)。在一些实施方案中,光致发光复合物具有小于或等于约35nm、小于或等于约30nm、小于或等于约25nm、或者小于或等于约20nm的发射带fwhm值。
[0051]
在一些实施方案中,光致发光复合物的斯托克斯位移可以等于或大于45nm。如本文所用,术语“斯托克斯位移”意指蓝光吸收部分的激发峰和bodipy部分的发射峰之间的距离。
[0052]
本发明的光致发光复合物可以具有可调谐的发射波长。bodipy部分上的不同取代模式可以将发射波长,例如最大发射波长或峰值发射波长,调谐至510nm~约560nm之间,或约610nm~约645nm之间,或由这些值中的任何一个限定的范围内的任何波长。
[0053]
在一些实施方案中,蓝光吸收部分的最大峰值吸收可以在约400nm~约470nm波长之间。在一些实施方案中,峰值吸收可以在约400nm~约405nm、约405nm~约410nm、约410nm
~约415nm、约415nm~约420nm、约420nm~约425nm、约425nm~约430nm、约430nm~约435nm、约435nm~约440nm、约440nm~约445nm、约445nm~约450nm、约450nm~约455nm、约455nm~约460nm、约460nm~约465nm、约465nm~约470nm,或由这些值中的任何一个限定的范围内的任何波长。
[0054]
在一些实施方案中,光致发光复合物的发射峰可以在510nm~560nm之间。在一些实施方案中,发射峰可以在510nm~约515nm、约515nm~约520nm、约520nm~约525nm、约525nm~约530nm、约530nm~约535nm、约535nm~约540nm、约540nm~约545nm、约545nm~约550nm、约550nm~约555nm、约555nm~约560nm之间,或由这些值中的任何一个限定的范围内的任何波长。
[0055]
在其它实施方案中,光致发光复合物的发射峰可以在610nm~645nm之间。在一些实施方案中,发射峰可以在610nm~约615nm、约615nm~约620nm、约620nm~约625nm、约625nm~约630nm、约630nm~约635nm、约635nm~约640nm、约640nm~约645nm之间,或由这些值中的任何一个限定的范围内的任何波长。
[0056]
其它实施方案包括光致发光复合物,其中吸收蓝光的唑衍生物和bodipy部分的空间距离通过连接基团来调整,以将吸收蓝光的唑衍生物的发射能量转移到bodipy部分。
[0057]
本发明描述了一种光致发光复合物,其中所述光致发光复合物可以包含吸收蓝光的唑衍生物、连接基团和bodipy部分。连接基团共价连接吸收蓝光的唑衍生物和bodipy部分。在一些实施方案中,唑衍生物吸收第一激发波长的光能并将能量转移到bodipy部分,其中bodipy部分吸收来自唑衍生物的能量并发射第二更高波长的光能。在一些实施方案中,光致发光复合物的发射量子产率为70-100%。
[0058]
一些实施方案包括以下通式的吸收蓝光的唑衍生物:
[0059][0060]
其中z可以选自nr
10
、o或s;r9为h或取代的酯连接基团;r
10
为h、取代的芳基、或取代的酯连接基团。
[0061]
在一些实施方案中,z为s。在一些实施方案中,z为o。在一些实施方案中,z为r
10
。在一些实施方案中,r
10
为h。在一些实施方案中,r
10
为取代的芳基。在一些实施方案中,r
10
为取代的苯基。在一些实施方案中,r
10
为氟苯基,例如在一些实施方案中,r
10
为连接基团,例如取代的酯连接基团。
[0062]
在一些实施方案中,唑衍生物可以为其中z可为nr
10
,r9可为h,r
10
可为未取代的酯连接基团的化合物。
[0063]
在一些实施方案中,唑衍生物可以为其中z可为nr
10
,r9可为h,r
10
可为取代的酯连
接基团的化合物。
[0064]
在一些实施方案中,唑衍生物可以为其中z可为nr
10
,r9可为未取代的酯连接基团,r
10
可为取代的芳基的化合物。
[0065]
在一些实施方案中,唑衍生物唑衍生物可以为其中z可为s,r9可为取代的酯连接基团的化合物。
[0066]
在一些实施方案中,其中z为nr
10
,r
10
可为取代的芳基,其中取代的芳基可以选自以下结构:
[0067]
连接基团共价连接吸收蓝色的唑衍生物与bodipy部分。可以改变连接基团以调节吸收蓝光的唑衍生物和bodipy部分之间的空间距离。通过调整唑衍生物和bodipy之间的空间距离,可以调整量子产率。
[0068]
在一些实施方案中,l可以表示连接基团。
[0069]
连接基团,例如l,可以包含取代的酯连接基团。取代的酯连接基团可以包含以下结构之一:
[0070][0071]
或者,连接基团,例如l,可以包含未取代的酯连接基团。未取代的酯连接基团可以包含以下结构之一:
[0072][0073]
本发明的光致发光复合物可以包含bodipy部分。bodipy部分可以具有以下通式:
[0074][0075]
r1可以是h、烷基、烯基、炔基或烷氧基-3-氧丙烯-1-基。在一些实施方案中,r1是h。在一些实施方案中,r1是烷基,例如c
1-6
烷基(例如甲基、乙基、丙基、异丙基、c4烷基、c5烷基或c6烷基)。在一些实施方案中,r1是烯基,例如c
2-6
烯基(例如乙烯基、丙烯基、c4烯基、c5烯基、c6烯基)。在一些实施方案中,r1是炔基,例如c
2-6
炔基(例如乙炔基、丙炔基、c4炔基、c5炔基、c6炔基)。在一些实施方案中,r1是烷氧基-3-氧丙烯-1-基,例如,在一些实施方案中,r1是甲氧基-3-氧丙烯-1-基,例如,在一些实施方案中,r1是乙氧基-3-氧丙烯-1-基,例如,在一些实施方案中,r1是丙氧基-3-氧丙烯-1-基。对于r1的烷氧基-3-氧基-丙烯-1基酯,也设想了其它烷氧基。r6可以是h、烷基、烯基、炔基或烷氧基-3-氧丙烯-1-基。在一些实施方案中,r6是h。在一些实施方案中,r6是烷基,例如c
1-6
烷基(例如甲基、乙基、丙基、异丙基、c4烷基、c5烷基或c6烷基)。在一些实施方案中,r6是烯基,例如c
2-6
烯基(例如乙烯基、丙烯基、c4烯基、c5烯基、c6烯基)。在一些实施方案中,r6是炔基,例如c
2-6
炔基(例如乙炔基、丙炔基、c4炔基、c5炔基、c6炔基)。在一些实施方案中,r6是烷氧基-3-氧丙烯-1-基,例如甲氧基-3-氧丙烯-1-基、乙氧基-3-氧丙烯-1-基、丙氧基-3-氧丙烯-1-基等。在一些实施方案中,r6是乙氧基-3-氧丙烯-1-基。
[0076]
r3可以是h或烷基,例如c
1-6
烷基或c
1-c2烷基。在一些实施方案中,r3是h。在一些实施方案中,r3是c
1-c2烷基。在一些实施方案中,r3是甲基。
[0077]
r4可以是h或烷基,例如c
1-6
烷基或c
1-c2烷基。在一些实施方案中,r4是h。在一些实施方案中,r4是c
1-c2烷基。在一些实施方案中,r4是甲基。
[0078]
r2可以是h、烷基、烯基、炔基、-cn、烷基酯(例如,-c(o)och2ch3)、或芳基酯(例如,-cooch2ar)。在一些实施方案中,r2是h。在一些实施方案中,r2是烷基,例如c
1-6
烷基(例如甲
基、乙基、丙基、异丙基、c4烷基、c5烷基或c6烷基)。在一些实施方案中,r2是烯基,例如c
2-6
烯基(例如乙烯基、丙烯基、c4烯基、c5烯基、c6烯基)。在一些实施方案中,r2是炔基,例如c
2-6
炔基(例如乙炔基、丙炔基、c4炔基、c5炔基、c6炔基)。在一些实施方案中,r2是-cn。在一些实施方案中,r2是烷基酯(例如,-c(o)och2ch3)。在一些实施方案中,r2是芳基酯(例如,-cooch2ar)。
[0079]
r5可以是h、烷基、烯基、炔基、-cn、烷基酯(例如,-c(o)och2ch3)、或芳基酯(例如,-cooch2ar)。在一些实施方案中,r5是h。在一些实施方案中,r5是烷基,例如c
1-6
烷基(例如甲基、乙基、丙基、异丙基、c4烷基、c5烷基或c6烷基)。在一些实施方案中,r5是烯基,例如c
2-6
烯基(例如乙烯基、丙烯基、c4烯基、c5烯基、c6烯基)。在一些实施方案中,r5是炔基,例如c
2-6
炔基(例如乙炔基、丙炔基、c4炔基、c5炔基、c6炔基)。在一些实施方案中,r5是-cn。在一些实施方案中,r5是烷基酯(例如,-c(o)och2ch3)。在一些实施方案中,r5是芳基酯(例如,-cooch2ar)。
[0080]
r2和r3可以连接在一起以形成另外的单环烃环结构或多环烃环结构;
[0081]
r4和r5可以连接在一起以形成另外的单环烃环结构或多环烃环结构;
[0082]
r7可以是h或烷基,例如c
1-6
烷基(例如甲基、乙基、丙基、异丙基、c4烷基、c5烷基或c6烷基)。在一些实施方案中,r7是h。在一些实施方案中,r7是甲基(-ch3)。
[0083]
r8可以是h或烷基,例如c
1-6
烷基(例如甲基、乙基、丙基、异丙基、c4烷基、c5烷基或c6烷基)。在一些实施方案中,r8是h。在一些实施方案中,r8是甲基(-ch3)。
[0084]
l是连接基团,例如取代的酯连接基团。
[0085]
在一些实施方案中,r7和r8是甲基。
[0086]
在一些实施方案中,r1、r3、r4和r6是c
1-c2烷基。
[0087]
在一些实施方案中,r1、r3、r4和r6是甲基。
[0088]
在一些实施方案中,r1和r6是:
[0089][0090]
在一些实例中,本发明的bodipy部分可以是其中r1、r3、r4和r6各自是甲基;r2和r5是氰基;r7和r8各自是甲基;且l包含连接基团的bodipy部分。
[0091]
在一些实施方案中,本发明的bodipy部分可以是其中r1、r3、r4和r6各自是甲基;r2和r5是取代的酯基,其中取代的酯基包含烷基链;r7和r8各自是甲基;且l包含连接基团的bodipy部分。
[0092]
在其它实施方案中,本发明的bodipy部分可以是其中r1、r3、r4和r6各自是甲基;r2和r5是芳基酯基;r7和r8是甲基;且l包含连接基团的bodipy部分。
[0093]
在一些实施方案中,本发明的bodipy部分可以包含bodipy部分,其中r1和r6可以是烯基,r2和r3连接在一起以形成单环烃环结构,r4和r5连接在一起以形成单环烃环结构,并且r7和r8可以是h或甲基。
[0094]
在一些实施方案中,本发明的bodipy部分可以包含bodipy部分,其中r1和r6可以是烯基,r2和r3连接在一起以形成多环烃环结构,r4和r5连接在一起以形成多环烃环结构,并且r7和r8可以是h或甲基。
[0095]
在一些实施方案中,r2和r5可以为取代的酯,其中取代的酯为芳基酯。芳基酯可以为以下结构:
[0096]
在一些实施方案中,r2和r5可以为取代的酯,其中取代的酯为烷基酯。烷基酯可以为以下结构:
[0097]
在一些实施方案中,r1和r6可以为取代的烯基。取代的烯基可以为以下结构:
[0098]
在一些实施方案中,r2和r3可以连接在一起以形成另外的单环烃环结构或多环烃环结构。在各实施方案中,其中r1和r2连接在一起以形成单环烃环结构,该结构可以选自以下:[环丁烷]、[环戊烷]、[环己烷]、[环庚烷]、[环辛烷]、[环己烯]、[环己-1,4-二烯]、[环戊烯]、[环己-1,3-二烯]、或[环十二烷]等。在一些实施方案中,其中r2和r3连接在一起以形成多环烃环结构,该结构可以选自以下:[二环辛烷]、[二环戊烷]、[二环庚烷]、[二环[4.1.0]庚烷]、[1s,5s二环[3.3.1]壬烷]、[十氢化萘]、[八氢并环戊二烯]、
[八氢茚]、[六氢化茚]、[1,2,3,4-四氢化萘]、[2,3-二氢-1h-茚]、[1,1-二甲基-2,3-二氢-1h-茚]、[2’,3
’‑
二氢螺环[环戊烷-1,1
’‑
茚]、或[1,2,3,3a-四氢并环戊二烯]等。
[0099]
在一些实施方案中,r4和r5可以连接在一起以形成另外的单环烃环结构或多环烃环结构。在各实施方案中,其中r5和r6连接在一起以形成单环烃环结构,该结构可以选自以下:[环丁烷]、[环戊烷]、[环己烷]、[环庚烷]、[环辛烷]、[环己烯]、[环己-1,4-二烯]、[环戊烯]、[环己-1,3-二烯]、或[环十二烷]等。在一些实施方案中,其中r4和r5连接在一起以形成多环烃环结构,该结构可以选自以下:[二环辛烷]、[二环戊烷]、[二环庚烷]、[二环[4.1.0]庚烷]、[1s,5s二环[3.3.1]壬烷]、[十氢化萘]、[八氢并环戊二烯]、[八氢茚]、[六氢化茚]、[1,2,3,4-四氢
化萘]、[2,3-二氢-1h-茚]、[1,1-二甲基-2,3-二氢-1h-茚]、[2’,3
’‑
二氢螺环[环戊烷-1,1
’‑
茚]、或[1,2,3,3a-四氢并环戊二烯]等。
[0100]
光致发光复合物可以包含具有以下化学式的bodipy部分:
[0101][0102]
其中r1和r2可以连接在一起以形成另外的单环烃环结构或多环烃环结构;
[0103]
r3和r4可以是h;
[0104]
r5和r6可以连接在一起以形成另外的单环烃环结构或多环烃环结构;
[0105]
r7和r8独立地选自h、甲基或醚基;并且
[0106]
l表示包含取代的酯连接基团的连接基团。
[0107]
在一些实施方案中,r1和r2可以连接在一起以形成多环烃环结构;r3和r4是甲基;r5和r6可以连接在一起以形成多环烃环结构;r7和r8可以选自h、甲基或醚基r;并且l是连接基团。
[0108]
在一些实施方案中,r1和r2可以连接在一起以形成另外的单环烃环结构或多环烃环结构。在各实施方案中,其中r1和r2连接在一起以形成单环烃环结构,该结构可以选自以下:[环丁烷]、[环戊烷]、[环己烷]、[环庚烷]、[环辛烷]、[环己烯]、[环己-1,4-二烯]、[环戊烯]、[环己-1,
3-二烯]、或[环十二烷]等。在一些实施方案中,其中r1和r2连接在一起以形成多环烃环结构,该结构可以选自以下:[二环辛烷]、[二环戊烷]、[二环庚烷]、[二环[4.1.0]庚烷]、[1s,5s二环[3.3.1]壬烷]、[十氢化萘]、[八氢并环戊二烯]、[八氢茚]、[六氢化茚]、[1,2,3,4-四氢化萘]、[2,3-二氢-1h-茚]、[1,1-二甲基-2,3-二氢-1h-茚]、[2’,3
’‑
二氢螺环[环戊烷-1,1
’‑
茚]、或[1,2,3,3a-四氢并环戊二烯]等。
[0109]
在一些实施方案中,r5和r6可以连接在一起以形成另外的单环烃环结构或多环烃环结构。在各实施方案中,其中r5和r6连接在一起以形成单环烃环结构,该结构可以选自以下:[环丁烷]、[环戊烷]、[环己烷]、[环庚烷]、[环辛烷]、[环己烯]、[环己-1,4-二烯]、[环戊烯]、[环己-1,3-二烯]、或[环十二烷]等。在一些实施方案中,其中r5和r6连接在一起以形成多
环烃环结构,该结构可以选自以下:[二环辛烷]、[二环戊烷]、[二环庚烷]、[二环[4.1.0]庚烷]、[1s,5s二环[3.3.1]壬烷]、[十氢化萘]、[八氢并环戊二烯]、[八氢茚]、[六氢化茚]、[1,2,3,4-四氢化萘]、[2,3-二氢-1h-茚]、[1,1-二甲基-2,3-二氢-1h-茚]、[2’,3
’‑
二氢螺环[环戊烷-1,1
’‑
茚]、或[1,2,3,3a-四氢并环戊二烯]等。
[0110]
在一些实施方案中,吸收蓝光的唑衍生物和bodipy部分间隔的距离可以是约以上。连接基团可以维持吸收蓝光的唑衍生物和bodipy部分之间的距离。
[0111]
在一些实施方案中,光致发光复合物包含连接基团,其中连接基团共价吸收蓝光的唑衍生物与bodipy部分。在一些实施方案中,连接基团可以包含唑衍生物和bodipy部分之间的单键。
[0112]
在一些实施方案中,连接基团可以包含任选取代的c
2-c
16
酯基。当连接基团包含取代的酯基时,连接基团可以是:
[0113][0114]
在一些实施方案中,连接基团可以包含未取代的酯基。当连接基团包含未取代的酯基时,连接基团可以是:酯基时,连接基团可以是:
[0115]
本发明的光致发光复合物可以由以下结构表示,其出于说明的目的而提供并且决不构成限制:
[0116]
[0117]
和/或
[0118]
在一些实施方案中,光致发光复合物包含吸收蓝光的唑衍生物。吸收蓝光的唑衍生物可以包含有机发光团。在一些实施方案中,唑衍生物可以在400nm~约480nm、约400nm~约410nm、约410nm~约420nm、约420nm~约430nm、约430nm~约440nm、约440nm~约450nm、约450nm~约460nm、约460nm~约470nm、约470nm~约480nm的范围内、或由这些值中的任何一个限定的范围内的任何波长的光中具有最大吸光度。在一些实施方案中,光致发光复合物的最大吸光度峰可以为约450nm。在其它实施方案中,吸收蓝光的唑衍生物的最大吸光度峰可以为约405nm。在另外的其它实施方案中,吸收蓝光的唑衍生物的最大吸光度峰可以为约480nm。
[0119]
一些实施方案包括色彩转换膜,其包括:色彩转换层,该色彩转换层包含树脂基质
和分散在树脂基质中的如上所述的光致发光复合物。在一些实施方案中,色彩转换膜可描述为包含本文所述的复合物的组合。
[0120]
一些实施方案包括可以为约1μm~约200μm厚的色彩转换膜。在一些实施例中,色彩转换膜的厚度为约1μm~约2μm、约2-3μm、约3-4μm、约4-5μm、约5-6μm、约6-7μm、约7-8μm、约8-9μm、约9-10μm、约1-5μm、约5-10μm、约10-15μm、约15-20μm、约20-40μm、约40-80μm、约80-120μm、约120-160μm、约160-200μm,或由这些值中的任何一个限定的范围内的任何厚度。
[0121]
在一些实施方案中,色彩转换膜可吸收400nm~约480nm波长范围内的光并且可发射约510nm~约560nm或约610nm~约645nm范围内的光。在其它实施方案中,色彩转换膜可发射510nm~约560nm范围、610nm~约645nm范围或其任何组合的光。
[0122]
在一些实施方案中,色彩转换膜可以进一步包括透明基材层。透明基材层具有两个相对的表面,其中色彩转换层可以设置在透明层的将与发光源相邻的表面上并设置为与该表面物理接触。透明基材没有特别限制,并且本领域技术人员能够从本领域使用的透明基材中选择。透明基材的一些非限制性实例包括pe(聚乙烯)、pp(聚丙烯)、pen(聚萘二甲酸乙二醇酯)、pc(聚碳酸酯)、pma(聚丙烯酸甲酯)、pmma(聚甲基丙烯酸甲酯)、cab(乙酸丁酸纤维素)、pvc(聚氯乙烯)、pet(聚对苯二甲酸乙二醇酯)、petg(乙二醇改性聚对苯二甲酸乙二醇酯)、pdms(聚二甲基硅氧烷)、coc(环烯烃共聚物)、pga(聚乙交酯或聚乙醇酸)、pla(聚乳酸)、pcl(聚己内酯)、pea(聚己二酸乙二醇酯)、pha(聚羟基烷酸酯)、phbv(聚(3-羟基丁酸酯-共-3羟基戊酸酯))、pbe(聚对苯二甲酸丁二醇酯)和ptt(聚对苯二甲酸丙二醇酯)等。
[0123]
在一些实施方案中,透明基材可以具有两个相对的表面。在一些实施方案中,色彩转换膜可以设置在相对的表面中之一上并设置为与该表面物理接触。在一些实施方案中,透明基材的其上未设置色彩转换膜的一侧可以与光源相邻。基材可以在色彩转换膜的制备期间起到支承体的作用。所使用的基材的种类没有特别限制,并且材料和/或厚度没有限制,只要其为透明的并且能够起到支承体的作用即可。本领域技术人员可以确定使用哪种材料和厚度作为支承基材。
[0124]
一些实施方案包括一种色彩转换膜的制备方法,其中所述方法包括:将本文记载的光致发光化合物和粘结剂树脂溶解在溶剂中;并且将混合物施加到透明基材的表面上。
[0125]
可以与光致发光复合物使用的粘结剂树脂包括例如丙烯酸系树脂、聚碳酸酯树脂、乙烯-乙烯醇共聚物树脂、乙烯-乙酸乙烯酯共聚物树脂及其皂化产物、as树脂、聚酯树脂、氯乙烯-乙酸乙烯酯共聚物树脂、聚乙烯醇缩丁醛树脂、聚乙烯基膦酸(pvpa)、聚苯乙烯树脂、酚醛树脂、苯氧基树脂、聚砜、尼龙、纤维素树脂和乙酸纤维素树脂。在一些实施方案中,粘结剂树脂可以为聚酯树脂和/或丙烯酸系树脂。
[0126]
可以用于溶解或分散复合物和树脂的溶剂可以包括烷烃类,如丁烷、戊烷、己烷、庚烷和辛烷;环烷烃类,如环戊烷、环己烷、环庚烷和环辛烷;醇类,如乙醇、丙醇、丁醇、戊醇、己醇、庚醇、辛醇、癸醇、十一醇、双丙酮醇、糠醇;cellosolves
tm
如甲基cellosolve
tm
、乙基cellosolve
tm
、丁基cellosolve
tm
、甲基cellosolve
tm
乙酸酯、和乙基cellosolve
tm
乙酸酯;丙二醇类及其衍生物,如丙二醇单甲醚、丙二醇单乙醚、丙二醇单丁醚、丙二醇单甲醚乙酸酯、丙二醇单乙醚乙酸酯、丙二醇单丁醚乙酸酯、和二丙二醇二甲醚;酮类,如丙酮、甲基戊基酮、环己酮和苯乙酮;醚类,如二氧六环和四氢呋喃;酯类,如乙酸丁酯、乙酸戊酯、丁酸乙
酯、丁酸丁酯、草酸二乙酯、丙酮酸乙酯、2-羟基丁酸乙酯、乙酰乙酸乙酯、乳酸甲酯、乳酸乙酯和3-甲氧基丙酸甲酯;卤代烃类,如氯仿、二氯甲烷和四氯乙烷;芳香烃类,如苯、甲苯、二甲苯和甲酚;以及高极性溶剂,如二甲基甲酰胺、二甲基乙酰胺和n-甲基吡咯烷酮。
[0127]
一些实施方案包括背光单元,其中该背光单元可以包括上述色彩转换膜。
[0128]
其它实施方案可以描述一种显示装置,其中该显示装置可以包括本文所述的背光单元。
[0129]
除非另有说明,否则在说明书和实施方案中使用的所有表示成分的量、性质(如分子量)、反应条件等的数字应理解为在所有情况下都由术语“约”修饰。因此,除非有相反的说明,否则说明书和所附实施方案中所述的数值参数为近似值,其可以根据寻求获得的期望特性而变化。无论如何都不是试图限制等效原则的应用。对于实施方案的范围,每个数值参数应至少根据报告的有效数字的数量并且通过应用普通的舍入技术来解释。
[0130]
对于公开的过程和/或方法,在所述过程和方法中执行的功能可以以不同的顺序实现,如上下文所示。此外,概述的步骤和操作仅作为实例提供,并且一些步骤和操作可以为任选的,组合成更少的步骤和操作,或者扩展成另外的步骤和操作。
[0131]
本发明有时可以说明包含在不同其它部件内或与不同其它部件连接的不同部件。此类描述的架构仅仅是示例性的,并且可以实施实现了相同或相似功能的许多其它架构。
[0132]
在本发明和所附实施方案中使用的术语(例如,所附实施方案的主体)通常旨在作为“开放”术语(例如,术语“包括”应解释为“包括但不限于”术语“具有”应解释为“至少具有”,术语“包含”应解释为“包含但不限于”等)。另外,如果引入了特定数量的要素,这可能被解释为至少是指所叙述的数量,这可能会由上下文指示(例如,没有其他修饰语的仅“两个叙述项”表述意味着两个以上的叙述项的至少两个叙述项)。如在本发明中所使用的,呈现两个或多个选择性的转折性词语和/或短语应被理解为考虑包括术语之一、术语中的任一个或两个术语的可能性。例如,短语“a或b”:将被理解为包括“a”或“b”或“a和b”的可能性。
[0133]
除非本文另有说明或与上下文明显矛盾,在描述本发明的上下文中(尤其是在以下实施方案的上下文中)使用的术语“一(a)”、“一(an)”、“该(the)”和类似的指示词应被解释为涵盖单数和复数两者。本文提供的任何和所有实例或示例性语言(例如,“例如”)的使用仅旨在更好地阐明本发明,并且不对任何实施方案的范围构成限制。说明书中的任何语言都不应被解释为表示任何未体现的要素对本发明的实践是必不可少的。
[0134]
本文公开的替代要素或实施方案的分组不应被解释为限制。每个组成员可以单独地或以与组中的其它成员或本文中找到的其它要素的任何组合来引用和体现。出于方便和/或可专利性的原因,预计组中的一个或多个成员可能会被包含在组中或从组中删除。当任何这样的包含或删除发生时,说明书被视为包含修改后的组,从而满足在所附实施方案中使用的所有马库什组的书面描述。
[0135]
本文描述了某些实施方案,包括发明人已知的用于实施本发明的最佳方式。当然,这些描述的实施方案的变化对于本领域普通技术人员在阅读上述描述后将变得显而易见。发明人期望本领域技术人员适当地采用这样的变化,并且发明人旨在以不同于本文具体描述的方式来实践本发明。因此,实施方案包括适用法律所允许的实施方案中记载的主题的所有修改和等同物。此外,除非在本文中另有说明或与上下文明显矛盾,否则上述要素的所
有可能的变体中的任何组合均被考虑。最后,应当理解,本文公开的实施方案是对实施方案的原理的说明。可以采用的其它修改在实施方案的范围内。因此,作为示例而非限制,可以根据本文的教导使用替代实施方案。因此,实施方案不限于精确地如所示和描述的实施方案。
[0136]
实施方案
[0137]
实施方案1一种光致发光复合物,其包括:
[0138]
以下通式的吸收蓝光的唑衍生物:
[0139][0140]
其中z是nr
10
、o或s;r9选自h、未取代的酯连接基团、或取代的酯连接基团;r
10
选自h、取代的芳基、未取代的酯连接基团、或取代的酯连接基团。
[0141]
连接基团,其中所述连接基团为未取代的酯或取代的酯;和
[0142]
二吡咯亚甲基硼(bodipy)部分;
[0143]
其中所述连接基团共价连接所述唑衍生物和bodipy部分,其中所述唑衍生物吸收第一激发波长的光能并将能量转移到所述bodipy部分,其中所述bodipy部分吸收来自所述唑衍生物的能量并发射第二更高波长的光能,并且其中所述光致发光复合物的发射量子产率大于80%。
[0144]
实施方案2实施方案1的唑衍生物,其中z是nr
10
,r9是h,r
10
是未取代的酯连接基团。
[0145]
实施方案3实施方案1的唑衍生物,其中z是nr
10
,r9是h,r
10
是取代的酯连接基团。
[0146]
实施方案4实施方案1的唑衍生物,其中z是nr
10
,r9是未取代的酯连接基团,r
10
是取代的芳基。
[0147]
实施方案5实施方案1的唑衍生物,其中z是s,r9是取代的酯连接基团,r
10
是h。
[0148]
实施方案6实施方案4的唑衍生物,其中取代的芳基是:
[0149]
实施方案7实施方案1的光致发光复合物,其中所述bodipy部分为以下通式:
[0150][0151]
其中r1和r6独立地选自h、饱和或不饱和的烷基、或烯基;
[0152]
r3和r4独立地选自h或c
1-c2烷基;
[0153]
r2和r5独立地选自h、饱和烷基、不饱和烷基、氰基(-cn)、烷基酯或芳基酯;
[0154]
r2和r3可以连接在一起以形成另外的单环烃环结构或多环烃环结构;
[0155]
r4和r5可以连接在一起以形成另外的单环烃环结构或多环烃环结构;
[0156]
r7和r8可以独立地选自h、甲基;和
[0157]
l表示包含取代的酯连接基团的连接基团。
[0158]
实施方案8实施方案7的bodipy部分,其中r1、r3、r4和r6是甲基,r2和r5是氰基,r7和r8是甲基,l是连接基团。
[0159]
实施方案9实施方案7的bodipy部分,其中r1、r3、r4和r6是甲基,r2和r5选自取代的酯,r7和r8是甲基,l是连接基团。
[0160]
实施方案10实施方案7的bodipy部分,其中r1、r3、r4和r6是甲基,r2和r5是芳基酯,r7和r8是甲基,l是连接基团。
[0161]
实施方案11实施方案7的bodipy部分,其中r1和r6各自是烯基,r2和r3连接在一起以形成单环烃环结构,r4和r5连接在一起以形成单环烃环结构,r7和r8各自是甲基,l是连接基团。
[0162]
实施方案12实施方案7的bodipy部分,其中烯基是以下结构:
[0163]
实施方案13实施方案1的光致发光复合物,其中所述bodipy部分为以下通式:
[0164][0165]
r1和r2连接在一起以形成另外的多环烃环结构;
[0166]
r3和r4是甲基;
[0167]
r5和r6连接在一起以形成另外的多环烃环结构;
[0168]
r7和r8可以独立地选自h、甲基或醚基;和
[0169]
l表示包含取代的酯连接基团的连接基团。
[0170]
实施方案14实施方案13的bodipy部分,其中r1和r2连接在一起以形成多环烃环结构,r3和r4是甲基,r5和r6可以连接在一起以形成多环烃环结构,r7和r8选自h或甲基(-ch3),l是连接基团。
[0171]
实施方案15实施方案1、2、3、4、5、6、7、8、9、10、11、12、13和14的光致发光复合物,其中未取代的酯连接基团是以下:
[0172]
实施方案16实施方案1、2、3、4、5、6、7、8、9、10和11的光致发光复合物,其中连接基团的取代的酯选自以下结构中的一个:团的取代的酯选自以下结构中的一个:
[0173]
实施方案17实施方案1、2、3、4、5、6、7、8、9、10、11、12、13和14的光致发光复合物,其中所述光致发光复合物选自以下结构中的一个:
[0174]
[0175][0176]
实施方案18一种色彩转换膜,其包括:
[0177]
透明基材层;
[0178]
色彩转换层,其中所述色彩转换层包括树脂基质,和
[0179]
至少一种光致发光复合物,其中所述至少一种光致发光化合物包含分散在所述树脂基质中的实施方案1、2、3、4、5、6、7、8、9、10、11、12和13的光致发光化合物。
[0180]
实施方案19实施方案18的色彩转换膜,其进一步包括单线态氧猝灭剂。
[0181]
实施方案20实施方案18的色彩转换膜,其进一步包括自由基清除剂。
[0182]
实施方案21实施方案18的色彩转换膜,其中所述膜的厚度在10μm~200μm之间。
[0183]
实施方案22实施方案18的色彩转换膜,其中所述膜吸收约400nm~约480nm波长范围内的光并且发射510nm~约560和575nm~约645nm波长范围内的光。
[0184]
实施方案23实施方案18、19、20和21的色彩转换膜的制备方法,所述方法包括:
[0185]
将实施方案1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16和17的光致发光复合物和粘结剂树脂溶解在溶剂中;并且
[0186]
将混合物施加到透明基材的相对的表面中之一上。
[0187]
实施方案24一种背光单元,其包括实施方案18、19、20和21的色彩转换膜。
[0188]
实施方案25一种显示装置,其包括实施方案24的背光单元。
[0189]
实施例
[0190]
已经发现,与在色彩转换膜中使用的其它形式的染料相比,本文所述的光致发光复合物的实施方案具有改进的性能。这些益处通过以下实施例进一步证明,这些仅旨在说明本公开内容,而不旨在以任何方式限制范围或基本原理。
[0191]
实施例1.比较例1(ce-1):
[0192][0193]
ce-1:将0.75g的4-羟基-2,6-二甲基苯甲醛(5mmol)和1.04g的2,4-二甲基吡咯(11mmol)溶解在100ml的无水二氯甲烷中。将溶液脱气30分钟。然后,加入一滴三氟乙酸。将溶液在氩气气氛下在室温下搅拌过夜。向所得溶液中加入ddq(2.0g)并将混合物搅拌过夜。第二天过滤溶液,然后用二氯甲烷洗涤,得到二吡咯甲烷(1.9g)。接下来,将1.0g的二吡咯甲烷溶解在60ml的thf中。将5ml的三甲胺加入至该溶液中,然后脱气10分钟。在脱气后,缓慢加入5ml的三氟硼-二乙醚,随后在70℃下加热30分钟。将所得溶液装载到硅胶上,并且通过使用二氯甲烷作为洗脱剂的快速色谱法纯化。收集所需的级分,并且在减压下干燥,以得到0.9g的橙色固体(产率为76%)。lcms(apci ):c
21h24
bf2n2o(m h)的计算值=369;实测值:369。1h nmr(400mhz,氯仿-d)δ6.64(s,2h),5.97(s,2h),4.73(s,1h),2.56(s,6h),2.09(s,6h),1.43(s,6h)。
[0194]
实施例1.2比较例2(ce-2):其为wakamiya,atsushi等人,chemistry letters,37(10),1094-1095;2008中所述的制备。
[0195]
实施例2光致发光复合物的合成:
[0196]
实施例2.1:plc-1
[0197][0198]
化合物1.1(4-(4-((4-(7-(4-(二苯基氨基)苯基)苯并[c][1,2,5]噻二唑-4-基)苯基)(苯基)氨基)苯基)-4-氧代丁酸):
[0199][0200]
步骤1:化合物1.1.1(4-(4-((4-(7-(4-(二苯基氨基)苯基)苯并[c][1,2,5]噻二唑-4-基)苯基)(苯基)氨基)苯基)-4-氧代丁酸甲酯):使300ml的3颈圆底烧瓶中装入搅拌棒,且用氩气吹扫。在室温下伴随搅拌向该烧瓶中加入4,4'-(苯并[c][1,2,5]噻二唑-4,7-二基)双(n,n-二苯基苯胺)(根据us 9,399,730b2制备,1.00mmol,623mg)、无水dcm(20ml),之后加入zncl2(1.0m的et2o溶液,6.0mmol,6.00ml)。借由注射器向该搅拌的混合物中加入4-氯-4-氧代丁酸甲酯(5.0mmol,0.616ml)。将反应混合物在室温下搅拌24小时,然后在氩气下加热至50℃达2天。将反应混合物冷却至室温,且用dcm(250ml)和水(100ml)分配。将各层分离,将水层用dcm(2
×
20ml)萃取,将合并的有机层用盐水(20ml)洗涤,经mgso4干燥,过滤且真空浓缩。通过使用乙酸乙酯/dcm梯度(100%dcm(1cv)
→
10%etoac/dcm(10cv))在硅胶上的快速色谱法纯化。得到248mg化合物1.1.1(产率为34%)。ms(apci):c
47h36
n4o3s(m-h)的计算值=735;实测值=7735。1h nmr(400mhz,氯仿-d)δ7.95(d,j=8.2hz,2h),7.88(t,j=7.8hz,4h),7.77(s,2h),7.37(t,j=7.7hz,2h),7.33
–
7.22(m,6h),7.24
–
7.15(m,8h),7.12(d,j=8.5hz,2h),7.07(t,j=7.4hz,2h),3.71(s,3h),3.27(t,j=6.7hz,2h),2.76(t,j=6.7hz,2h)。
[0201]
步骤2:化合物1.1(4-(4-((4-(7-(4-(二苯基氨基)苯基)苯并[c][1,2,5]噻二唑-4-基)苯基)(苯基)氨基)苯基)-4-氧代丁酸):使250ml的3颈圆底烧瓶中装入搅拌棒,且用
氩气冲洗。向化合物1.1.1中加入koh(3.26mmol,183mg),之后加入水(5ml)。该烧瓶装有翅片空气冷凝器,且在氩气下伴随剧烈搅拌在铝加热块中加热至95℃。加热反应混合物,直至lcms显示没有起始材料(2小时)。在1l锥形瓶中装入搅拌棒和碎冰(500ml未包装的)。伴随搅拌将温热的反应混合物加入至该瓶中。通过加入6n hcl水溶液至ph为3.5
–
4(ph试纸)来沉淀产物。用水将该混合物稀释至总体积为750ml,且搅拌数小时,升温至室温。将产物通过过滤分离,且真空干燥以得到定量产率。ms(apci):c
46h34
n4o3s(m-h)的计算值=721;实测值=721。该产物具有足够的纯度以用于下一步骤中。
[0202]
化合物1.2(3,3'-(7,7-二氟-14-(4'-羟基-[1,1'-联苯]-4-基)-1,3,4,7,10,11,12,13-八氢-2h-6l4,7l4-[1,3,2]二氮杂硼杂苯并[4,3-a:6,1-a']二异吲哚-5,9-二基)(2e,2'e)-二丙烯酸二乙酯):
[0203][0204]
化合物1.2.1(3,3'-((4-溴苯基)亚甲基)双(4,5,6,7-四氢-2h-异吲哚-1-羧酸二乙酯)):使500ml圆底烧瓶中装入搅拌棒,且用氩气冲洗。向该烧瓶中加入4,5,6,7-四氢-2h-异吲哚-1-羧酸乙酯(10.0mmol,1.933g)和4-溴苯甲醛(6.00mmol,1110mg)。加入无水二氯甲烷(200ml),之后加入p-tsoh(0.1g)。将烧瓶密封且在氩气下在室温下搅拌过夜。将反应混合物蒸发至干燥且将残余物不经进一步纯化来进行皂化。ms(apci):c
29h33
brn2o4(m-h)的计算值=551;实测值551。
[0205]
化合物1.2.2(14-(4-溴苯基)-7,7-二氟-5,9-二碘-1,3,4,7,10,11,12,13-八氢-2h-6l4,7l4-[1,3,2]二氮杂硼杂苯并[4,3-a:6,1-a']二异吲哚):使1l圆底烧瓶中装入搅拌棒。向该烧瓶中加入naoh(6.00g)和水(30ml)。将该混合物搅拌以获得溶液,且将烧瓶用氩气冲洗。将化合物1.2.1(假设5.0mmol)加入至反应烧瓶中,之后加入乙醇(200标准酒精
度(proof),300ml)。该烧瓶装配有翅片空气冷凝器,且在氩气氛围下在90℃的油浴中加热。加热过夜后,将反应混合物冷却至室温,且转移至1l锥形瓶中。在冰水浴中伴随搅拌,用6n的hcl水溶液将ph调节至4。用水将混合物稀释至总体积为1l,且借由抽滤收集沉淀物。将潮湿的沉淀物置于3l的2颈圆底烧瓶中,且在烧瓶中装入搅拌棒。将烧瓶用氩气冲洗。在水(300ml)中制备碳酸氢钠(188.2mmol,15.81g)的溶液,且将该溶液加入至反应烧瓶中。伴随搅拌加入甲醇(900ml)以得到溶液。在氩气氛围下,伴随剧烈搅拌向烧瓶中加入碘(58.8mmol,14.92g)。将反应混合物在室温下搅拌过夜。将沉淀的中间物滤出并水洗。将产物通过抽吸,然后在50℃的真空烘箱中来干燥。将干燥的沉淀物在装有搅拌棒的经氩气冲洗的1l的2颈圆底烧瓶中溶解于无水二氯甲烷(500ml)中。将烧瓶用隔膜密封,且在氩气氛围下冷却至-10℃(水-冰/甲醇浴)。伴随剧烈搅拌借由注射器向该烧瓶中加入bf3·
oet2(571.2mmol,70.5ml)。该烧瓶装配有滴液漏斗,且将无水三乙胺(331.5mmol,46.2ml)置于滴液漏斗中。伴随剧烈搅拌经5分钟滴加三乙胺。移除冷却浴,且将反应混合物在氩气氛围下搅拌,并且升温至室温。将反应搅拌过夜。通过加入1n的hcl水溶液(200ml)来淬灭反应。将各层分离,且将有机层依次用1n的hcl水溶液(200ml)、饱和碳酸氢钠水溶液(3
×
200ml)和盐水(200ml)洗涤。将有机层经mgso4干燥,过滤,且通过旋转蒸发浓缩。向该粗制的紫黑色液体中加入甲醇。将该混合物在硅藻土上浓缩至干燥,然后使用己烷/甲苯梯度(80%甲苯/己烷
→
100%甲苯)通过快速色谱法纯化而得到1.888g的期望产物(产率为64%)。ms(apci):c
23h20
bbrf2i2n2(m-h)的计算值=705;实测值705。
[0206]
化合物1.2.3(3,3'-(14-(4-溴苯基)-7,7-二氟-1,3,4,7,10,11,12,13-八氢-2h-6l4,7l4-[1,3,2]二氮杂硼杂苯并[4,3-a:6,1-a']二异吲哚-5,9-二基)(2e,2'e)-二丙烯酸二乙酯):使250ml的2颈圆底烧瓶中装入搅拌棒且装配回流冷凝器,且用氩气冲洗。向该烧瓶中加入化合物1.2.2(0.500mmol,353mg)、pd(dppf)cl2(0.067mmol,49mg)和苯基硼酸(5.05mmol,616mg)。加入无抑制剂的thf(20ml)和甲苯(20ml),之后加入1.0m的k2co3水溶液(5.05mmol,5.05ml)。烧瓶中的氧气通过真空/回充氩气循环吹扫三次。将烧瓶在70℃的油浴中加热4小时。加入另一部分的苯基硼酸(5.05mmol,616mg)和k2co3水溶液(5.05ml),且将该反应在70℃下加热另外2小时。将反应混合物冷却至室温,且用乙酸乙酯(150ml)分配。将混合物用饱和碳酸氢钠水溶液(3
×
25ml)和盐水(25ml)洗涤。将反应混合物经mgso4干燥,过滤,且在旋转蒸发仪上浓缩至干燥。通过使用乙酸乙酯/己烷梯度(30%乙酸乙酯/己烷(1cv)
→
100%乙酸乙酯/己烷(10cv))的快速色谱法纯化粗产物。将含有产物的级分真空浓缩,且用甲醇研磨以移除共洗脱的杂质。得到178mg化合物1.2.3(产率为55%)。ms(apci):c
33h34
bbrf2n2o4(m-h)的计算值=649;实测值:649。
[0207]
化合物1.2(3,3'-(7,7-二氟-14-(4'-羟基-[1,1'-联苯]-4-基)-1,3,4,7,10,11,12,13-八氢-2h-6l4,7l4-[1,3,2]二氮杂硼杂苯并[4,3-a:6,1-a']二异吲哚-5,9-二基)(2e,2'e)-二丙烯酸二乙酯):使250ml的2颈圆底烧瓶中装入搅拌棒且装配回流冷凝器,且用氩气冲洗。向该烧瓶中加入化合物1.2.3(0.263mmol,171mg)、pd(dppf)cl2(0.067mmol,49mg)和苯基硼酸衍生物(5.05mmol,616mg)。加入无抑制剂的thf(20ml)和甲苯(20ml),之后加入1.0m的k2co3水溶液(5.05mmol,5.05ml)。烧瓶中的氧气通过真空/回充氩气循环吹扫三次。将烧瓶在80℃的油浴中加热4小时。加入另一部分的苯基硼酸衍生物(5.05mmol,616mg)和k2co3水溶液(5.05ml),且将该反应在70℃下加热另外2小时。将反应混合物冷却至
室温,且用乙酸乙酯(150ml)分配。将混合物用饱和碳酸氢钠水溶液(3
×
25ml)和盐水(25ml)洗涤。将反应混合物经mgso4干燥,过滤,且在旋转蒸发仪上浓缩至干燥。通过使用乙酸乙酯/己烷梯度(30%乙酸乙酯/己烷(1cv)
→
100%乙酸乙酯/己烷(10cv))的快速色谱法纯化粗产物。将含有产物的级分真空浓缩,且用甲醇研磨以移除共洗脱的杂质。得到158mg化合物1.2(产率为90%)。ms(apci):c
39h39
bf2n2o5(m-h)的计算值=663;实测值:663。(m-h)=983;实测值:983。
[0208]
plc-1(3,3'-(14-(4'-((4-(4-((4-(7-(4-(二苯基氨基)苯基)苯并[c][1,2,5]噻二唑-4-基)苯基)(苯基)氨基)苯基)-4-氧杂丁酰基)氧)-3,5-二甲基-[1,1'-联苯]-4-基)-7,7-二氟-1,3,4,7,10,11,12,13-八氢-2h-6l4,7l4-[1,3,2]二氮杂硼杂苯并[4,3-a:6,1-a']二异吲哚-5,9-二基)(2e,2'e)-二丙烯酸二乙酯):在40ml螺旋盖小瓶中装入化合物1.2(0.060mmol,42mg)和化合物1.1(0.120mmol,87mg)、dmap(0.182mmol,22mg)和搅拌棒。将小瓶用螺旋盖式隔膜密封,且用氩气冲洗。向该小瓶中加入无水thf(6ml),之后加入dic(0.182mmol,38mg)。在室温下在氩气下搅拌过夜后,加入水(35ml),且将所得的沉淀物滤出并水洗。将湿的沉淀物溶于dcm中,与水分离,经mgso4干燥,过滤,且真空浓缩。将产物通过使用乙酸乙酯/dcm梯度(100%dcm(1cv)
→
10%乙酸乙酯/dcm(10cv))的快速色谱法纯化。将含有产物的级分真空浓缩而得到54mg(产率为65%)的plc-1。ms(apci):c
73h75
bf2n2o6(m-h)的计算值=1395;实测值:1395。
[0209]
实施例2.2:plc-2:
[0210][0211]
化合物2.1.1 5-(4,7-双(4-(二苯基氨基)苯基)-2h-苯并[d][1,2,3]三唑-2-基)戊酸甲酯
[0212][0213]
步骤1:4,7-二溴-2h-苯并[d][1,2,3]三唑:向42ml搅拌中的去离子水溶液中加入
2.85g(41.4mmol,1.1当量)亚硝酸钠。然后将该溶液缓慢加入至42ml冷却的冰乙酸中。在混合约10分钟后,加入10g(37.6mmol,1当量)3,6-二溴苯-1,2-二胺。在加入完成后,移除冷却浴。在室温下搅拌约2小时后,将溶液过滤。然后将收集的沉淀物在室温真空烘箱下干燥过夜。获得为米黄色粉末的期望产物(9.3g,产率为89%)。1h nmr(400mhz,dmso-d6):δ6.64(s,1h),5.01(s,2h)。
[0214]
步骤2:5-(4,7-二溴-2h-苯并[d][1,2,3]三唑-2-基)戊酸甲酯:在小烧瓶中混合2g(7.2mmol,1当量)4,7-二溴-2h-苯并[d][1,2,3]三唑、15.5ml(21mmol,15当量)5-溴戊酸甲酯。加入20ml n,n'-二甲基甲酰胺。然后加入5g(36mmol,5当量)碳酸钾。将溶液在75℃下加热约1.5小时。将反应置于500g冰水上,且用300ml二氯甲烷萃取。将反应在硅胶上干燥,且经由使用己烷:乙酸乙酯(9:1)作为洗脱剂的硅胶色谱法纯化。获得作为澄清的粘稠液体的期望产物(1.8g,产率为64%)。1h nmr(400mhz,tce-d2):δ7.38(s,2h),4.72(t,2h),3.58(s,3h),2.31(t,2h),2.11(p,2h),1.59(m,3h)。
[0215]
步骤3:5-(4,7-双(4-(二苯基氨基)苯基)-2h-苯并[d][1,2,3]三唑-2-基)戊酸甲酯:在小烧瓶中混合1.8g(4.6mmol,1当量)5-(4,7-二溴-2h-苯并[d][1,2,3]三唑-2-基)戊酸甲酯、10ml正丁醇、3ml甲苯和3ml去离子水。用氩气使溶液鼓泡约30分钟。随后,加入3.99g(13.81mmol,3当量)(4-(二苯基氨基)苯基)硼酸,之后加入6g(56.61mmol,12.30当量)碳酸钾。然后加入1.06g(0.920mmol,0.2当量)四(三苯基膦)钯(0)。将溶液在110℃下加热约3小时。将反应在硅胶上干燥,且经由使用己烷:乙酸乙酯(9:1)作为洗脱剂的硅胶色谱法纯化。获得为黄色粉末的期望产物,化合物2.1.1(300mg,产率为10%)。1h nmr(400mhz,tce-d2):δ7.95(d,4h),7.55(s,2h),7.23(t,8h),7.12(m,12h),7.00(t,4h),4.73(t,2h),3.53(s,3h),2.32(t,2h),2.13(p,2h),1.66(p,2h)。
[0216]
化合物2.1(5-(4,7-双(4-(二苯基氨基)苯基)-2h-苯并[d][1,2,3]三唑-2-基)戊酸):向100ml的2颈圆底烧瓶中装入5-(4,7-双(4-(二苯基氨基)苯基)-2h-苯并[d][1,2,3]三唑-2-基)戊酸甲酯(化合物2.1.1,0.425mmol,306mg),并悬浮在无水乙醇(80ml)中。将该烧瓶装配翅片回流冷凝器,且用氩气冲洗。将反应混合物用氢氧化钾(12.7mmol,713mg)处理,加热至90℃,且在氩气下在该温度下搅拌6小时。将反应冷却至室温,且将反应混合物蒸发至干燥。将粗产物分散在水(250ml)中,且用6n的hcl酸化至ph~1。酸化后通过自水中沉淀分离出粗酸而得到289mg(产率为96%)的化合物2.1。该酸无需进一步纯化即用于下一步骤中。ms(apci):化学式c
47h39
n5o2(m-)的计算值=705;实测值:705。
[0217]
化合物2.2:
[0218][0219]
化合物2.2.1(4,5-二氢-1h-苯并[g]吲哚):将dmso(50ml)、koh(3.36g)和nh2oh.hcl(4.17g)的混合物在室温下搅拌30分钟,然后加入在dmso(25ml)中的1-四氢萘酮(7.3g)。将混合物在70℃下搅拌另外30分钟。然后加入koh(8.41g),并且将所得混合物加热至140℃,并且在4小时内滴加1,2-二氯乙烷(9.9g)在dmso(25ml)中的溶液。在冷却至室温后,将该溶液倒入200ml饱和nh4cl溶液中,并且将该溶液用乙酸乙酯(200ml
×
3)萃取。收集有机相并且用na2so4干燥,浓缩至10ml,然后用10ml二氯甲烷和50ml己烷稀释。使用二氯甲烷/己烷(0%
→
30%)的洗脱剂对该溶液进行快速色谱法(硅胶),并且收集第二主级分。在减压除去溶剂后,获得浅黄色固体化合物2.2.1(3.5g,产率为41%)。lcms(apci ):c
12h12
n(m h)的计算值:170;实测值170。
[0220]
化合物2.2.2(4-(双(4,5-二氢-1h-苯并[g]吲哚-2-基)甲基)-3,5-二甲基苯酚):将化合物2.2.1(0.34g,2mmol)、4-羟基-2,5-二甲基苯甲醛(0.15g,1mmol)与一滴三氟乙酸在1,2-二氯乙烷(20ml)中的混合物脱气10分钟,然后在30℃下搅拌20小时。在冷却至室温后,将混合物过滤,并且收集固体作为化合物2.2.2(0.2g,产率为43%)。lcms(apci ):c
33h31
n2o(m h)的计算值:471;实测值:471。
[0221]
化合物2.2:在用冰水浴冷却的0℃下向化合物2.2.2(200mg,0.42mmol)在20ml二氯甲烷的溶液中加入四氯对苯醌(100mg,0.45mmol)。将混合物搅拌20分钟。然后,向所得混合物中加入0.5ml三甲胺,随后加入0.8ml的bf
3-醚化物。整体在室温下搅拌过夜,然后装载在硅胶上,并且通过使用二氯甲烷/己烷(0%
→
80%)的洗脱剂的快速色谱法纯化。收集所需的红色发光级分。在去除溶剂后,获得金属深红色固体化合物2.2(150mg,产率为72%)。lcms(apci ):c
33h28
bf2n2o(m h)的计算值:517;实测值:517。
[0222]
plc-2:((t-4)-[2-[(4,5-二氢-2h-苯并[g]吲哚-2-亚基-κn)-(3,5-二甲基-4-(5-(4,7-双(4-(二苯基氨基)苯基)-2h-苯并[d][1,2,3]三唑-2-基)戊酸酯)苯基)甲基]-4,5-二氢-1h-苯并[g]吲哚根合-κn]二氟硼):在40ml螺旋盖小瓶中装入搅拌棒、化合物2.1(0.050mmol,32mg)和化合物2.2(0.060mmol,42mg),以及dmap:ptsoh 1:1盐(0.200mmol,
59mg)。用氩气冲洗小瓶,且加入无水二氯甲烷(20ml)。加入二异丙基碳二亚胺(0.300mmol,47μl),且将反应在氩气下在室温下搅拌过夜。第二天早晨,加入无水四氢呋喃(10ml)且声处理30秒。加入另一部分的化合物2.1,且在氩气下在50℃下搅拌过夜。通过在硅胶上进行快速色谱法(100%己烷(1cv)
→
50%dcm/己烷(0cv)
→
100%dcm(6cv)
→
10%etoac/dcm(10cv))来纯化粗产物。将含有产物的级分收集且蒸发至干燥而得到43mg(产率为65%)的plc-2。ms(apci):化学式c
80h64
bf2n7o2(m-)的计算值=1203;实测值:1203。1h nmr(400mhz,氯仿-d)δ8.80(d,j=8.0hz,2h),8.01(d,j=8.8hz,4h),7.61(s,2h),7.45(t,j=7.7hz,2h),7.35
–
7.27(m,10h),7.25
–
7.15(m,14h),7.07
–
7.01(m,4h),6.84(s,2h),6.29(s,2h),4.88(t,j=7.0hz,2h),2.90(t,j=7.2hz,4h),2.68(t,j=7.3hz,2h),2.63(t,j=7.0hz,4h),2.34(p,j=7.9,7.3hz,2h),2.18(s,3h),1.90(p,j=7.7,7.1hz,2h)。
[0223]
实施例2.3:plc-3
[0224][0225]
化合物3.1(4-(6',6'-二氟-6'h-5'l4,6'l4-二螺环[环戊烷-1,12'-茚并[2',1':4,5]吡咯并[1,2-c]茚并[2',1':4,5]吡咯并[2,1-f][1,3,2]二氮杂硼烷-16',1
”‑
环戊烷]-14'-基)-3,5-二甲基苯酚):步骤1;(1-(2-溴苯基)环戊-1-醇):使烘箱干燥的250ml的
2颈圆底烧瓶装有气体连接器和搅拌棒,并且用氩气冲洗。将烧瓶用隔膜密封,并且用注射器装入镁屑(145mmol,3.525g)和无水thf(100ml)。使烘箱干燥的100ml的2颈圆底烧瓶装有气体连接器并且用氩气冲洗。将该烧瓶用隔膜密封,并且装入无水thf(60ml)。向100ml的烧瓶中加入1,5-二溴戊烷(70.0mmol,8.30ml)。将250ml的烧瓶在0℃的冰水浴中冷却,并且在剧烈搅拌5分钟下通过注射器加入1,5-二溴戊烷的溶液。移除冰水浴并且用室温水浴代替,并且将反应混合物在室温下搅拌。随着在室温下搅拌4小时,反应变得轻微混浊。使1000ml的2颈圆底烧瓶装有气体连接器和搅拌棒,并且用氩气冲洗。第二个颈部用隔膜密封并且加入无水thf(60ml)。在室温搅拌下向该烧瓶中加入2-溴苯甲酸乙酯(50.0mmol,7.94ml)。将该烧瓶在冰水浴中冷却至0℃,并且在剧烈搅拌~5分钟内通过套管加入双格式试剂的溶液。将反应混合物在0℃下搅拌15分钟,然后在室温下搅拌3小时。将反应混合物冷却至0℃,用饱和氯化铵溶液(50ml)淬灭。将反应混合物用水(500ml)进一步稀释并且用乙酸乙酯(3
×
150ml)萃取。将合并的有机层用盐水(150ml)洗涤,用mgso4干燥,过滤,并且蒸发至干燥而得到浅黄色油。该油对于下一步骤足够纯。得到11.145g(产率为92%)。ms(apci):c
11h13
bro(m h)的计算值=241;实测值:241。
[0226]
步骤2:(3-(1-(2-溴苯基)环戊基)-1-甲苯磺酰基-1h-吡咯/2-(1-(2-溴苯基)环戊基)-1-甲苯磺酰基-1h-吡咯)使250ml的2颈圆底烧瓶装有搅拌棒,并且装配有气体连接器。用氩气冲洗该烧瓶,并且将1-(2-溴苯基)环戊-1-醇(10.0mmol,2.412g)加入至烧瓶中。在室温搅拌下加入无水二氯甲烷(100ml)并且加入1-甲苯磺酰基-1h-吡咯(11.0mmol,2.434g)。一次性向经搅拌的混合物中加入氯化铝(11.5mmol,1.533g)。将反应在氩气下在室温下搅拌过夜。在剧烈搅拌下用水(30ml)淬灭反应。将各层分离,并且水层用二氯甲烷(3
×
25ml)萃取。将合并的有机层用盐水(25ml)洗涤,用mgso4干燥,过滤,并且蒸发至干燥。粗产物通过在硅胶上的快速色谱法(100%己烷(1cv)
→
15%etoac/己烷(10cv))来纯化。两种可能的异构体在硅胶上以单峰形式洗脱,并且还与未反应的1-甲苯磺酰基-1h-吡咯共洗脱,1.311g。通过1h nmr估计~1.05g产物,产率为23%。该混合物无需进一步纯化即可用于下一步骤。ms(apci):c
22h22
brno2s(m h)的计算值=444;实测值:444。
[0227]
步骤3:(2-(1-(2-溴苯基)环戊基)-1-甲苯磺酰基-1h-吡咯)使40ml螺旋盖小瓶装有搅拌棒。向该小瓶中加入来自步骤2(估计为2.37mmol,1.05g)的混合物。用氩气冲洗该小瓶。向该小瓶中加入碳酸钾(4.86mmol,672mg)、pd(pph3)4(0.0711mmol,82mg)、和无水二甲基甲酰胺(6ml)。通过真空/回填氩循环(3
×
),将小瓶中的氧气吹扫干净。将反应混合物在氩气下在110℃的加热块中搅拌过夜。第二天早上,加入更多的碳酸钾(4.86mmol,672mg)和pd(pph3)4(0.0711mmol,82mg),并且在110℃下继续加热另外24小时。将反应混合物冷却至室温,用水(100ml)稀释,并且用醚(3
×
50ml)萃取。将合并的有机层用水(3
×
25ml)、盐水(25ml)洗涤,用mgso4干燥,过滤,并且蒸发至干燥。粗反应混合物通过在硅胶上的快速色谱法(10%dcm/己烷(1cv)
→
50%dcm/己烷(10cv))来纯化。所需产物与1-甲苯磺酰基-1h-吡咯共洗脱,通过1h nmr估计的产量为549mg,产率为64%。所需异构体和1-甲苯磺酰基-1h-吡咯的混合物无需进一步纯化即送入下一步骤。ms(apci):c
22h21
no2s(m h)的计算值=364;实测值:364。
[0228]
步骤4:(1'h-螺环[环戊烷-1,4'-茚并[1,2-b]吡咯])使100ml的2颈圆底烧瓶装有搅拌棒并且装配有翅片式冷凝器和气体连接器。用氩气冲洗该烧瓶,并且加入来自步骤3
(估计为1.8mmol,819mg混合物)的混合物,随后加入四氢呋喃(经bht抑制的,50ml)和甲醇(15ml)。向该烧瓶中加入koh(18.0mmol,1.01g)。将第二个颈部塞住,并且将烧瓶放置在加热块中。将反应混合物在氩气下在65℃下搅拌12小时。将溶剂蒸发至干燥并且将残余物分散在饱和氯化铵(25ml)和水(100ml)中。将产物滤出、水洗、干燥并且通过在硅胶上的快速色谱法(100%己烷(1cv)
→
20%etoac/己烷(10cv))来纯化。将包含产物的级分蒸发至干燥,得到279mg(产率为74%),不含任何污染物。ms(apci):c
15h15
n(m h)的计算值=210;实测值:210。1h nmr(400mhz,氯仿-d)δ8.24(s,1h),7.33(dt,j=7.5,1.0hz,1h),7.24
–
7.17(m,2h),7.08(td,j=7.2,1.7hz,1h),6.81(t,j=2.5hz,1h),6.19(dd,j=2.7,1.8hz,1h),2.16
–
2.02(m,6h),1.89
–
1.74(m,2h)。
[0229]
化合物3.1(4-(6',6'-二氟-6'h-5'l4,6'l4-二螺环[环戊烷-1,12'-茚并[2',1':4,5]吡咯并[1,2-c]茚并[2',1':4,5]吡咯并[2,1-f][1,3,2]二氮杂硼烷-16',1
”‑
环戊烷]-14'-基)-3,5-二甲基苯酚):使250ml的2颈圆底烧瓶装有翅片式冷凝器、搅拌棒、和气体连接器。用氩气冲洗该烧瓶,并且加入1'h-螺环[环戊烷-1,4'-茚并[1,2-b]吡咯](来自上述步骤4的产物)(1.31mmol,275mg)和4-羟基-2,6-二甲基苯甲醛(0.683mmol,103mg),随后加入无水二氯乙烷(50ml)。搅拌溶液并且用氩气喷洒30分钟,然后通过注射器加入三氟乙酸(0.1%v/v,50μl),并且氩气喷洒继续另外10分钟。移除喷雾针,并且将反应混合物在氩气下在室温下搅拌过夜。第二天早上,将反应混合物用冰水浴冷却至0℃,并且在搅拌下加入四氯对苯醌(0.655mmol,161mg)。将反应在0℃下搅拌20分钟,此时氧化完成。向反应中加入bf3·
oet2(14.67mmol,1.8ml)和三乙胺(8.78mmol,1.2ml),并且将混合物在0℃下搅拌并且缓慢加温至室温持续4小时。移除水浴并且由加热块代替,并且将反应在40℃下加热6小时。将反应混合物蒸发至干燥,并且用甲醇(10ml)和水(200ml)来处理。将沉淀物在室温下搅拌30分钟,然后滤出,用水洗涤。干燥沉淀物并且通过在硅胶上的快速色谱法(100%dcm(4cv)
→
5%etoac/dcm(5cv)
→
5%etoac/dcm来纯化。将柱洗脱直至已经洗脱了尾产物)。将包含产物的级分蒸发至干燥而得到314mg(产率85%)。ms(apci):c
39h35
bf2n2o(m-)的计算值=596;实测值:596。
[0230]
plc-3:(4-(6',6'-二氟-6'h-5'l4,6'l4-二螺环[环戊烷-1,12'-茚并[2',1':4,5]吡咯并[1,2-c]茚并[2',1':4,5]吡咯并[2,1-f][1,3,2]二氮杂硼杂苯-16',1
”‑
环戊烷]-14'-基)-3,5-二甲基苯基4-(4-((4-(7-(4-(二苯基氨基)苯基)苯并[c][1,2,5]噻二唑-4-基)苯基)(苯基)胺基)苯基)-4-氧代丁酸酯):由化合物3.1(0.100mmol,60mg)和化合物1.1(0.400mmol,289mg)以类似于化合物2的方式合成plc-3。粗产物通过在硅胶上的快速色谱法(30%dcm/己烷(1cv)
→
50%dcm/己烷(8cv)
→
100%dcm(8cv))来纯化。将含有产物的级分蒸发至干燥而得到84mg(产率为65%)的plc-3。ms(apci):化学式:c
85h67
bf2n6o3s(m-)的计算值=1300;实测值:1300。
[0231]
实施例2.4:plc-4
[0232][0233]
plc-4((t-4)-[2-[(4,5-二氢-2h-苯并[g]吲哚-2-亚基-kn)-(3,5-二甲基-4-(4-(4-((4-(7-(4-(二苯基氨基)苯基)苯并[c][1,2,5]噻二唑-4-基)苯基)(苯基)氨基)苯基)-4-氧代丁酸酯)苯基)甲基]-4,5-二氢-1h-苯并[g]吲哚根合-kn]二氟硼):在40ml螺旋盖小瓶中装入搅拌棒、化合物2.2(0.100mmol,60mg)、化合物1.1(0.150mmol,51mg),以及dmap:ptsoh 1:1盐(0.200mmol,59mg)。用氩气冲洗小瓶,且加入无水二氯甲烷(20ml)。加入二异丙基碳二亚胺(0.300mmol,47μl),且将反应在氩气下在室温下搅拌过夜。第二天早晨,加入无水四氢呋喃(10ml)且声处理30秒。加入另一部分的化合物1.1(0.150mmol,51mg),且在氩气下在50℃下搅拌过夜。粗产物通过在硅胶上的快速色谱法(100%dcm(5cv)
→
5%etoac/dcm(5cv),然后10%etoac/己烷(1cv)
→
20%etoac/己烷(0cv)
→
50%etoac/己烷(10cv),和最终5%etoac/甲苯(1cv)
→
15%etoac/甲苯(10cv))来纯化。将含有产物的级分蒸发至干燥而得到40mg(产率为33%)的plc-4。ms(apci):化学式:c
79h59
bf2n6o3s(m-)的计算值=1220;实测值:1220。
[0234]
实施例2.5:plc-5
[0235][0236]
化合物5.1[5,5-二氟-10-(4-羟基-2,6-二甲基苯基)-1,3,7,9-四甲基-5h-4l4,5l4-二吡咯并[1,2-c:2',1'-f][1,3,2]二氮杂硼杂苯-2,8-二羧酸二苄酯]:
[0237][0238]
向250ml的圆底烧瓶中,将40ml(241mmol)3-氧代丁酸叔丁酯溶于80ml乙酸中。将混合物在冰水浴中冷却至约10℃。经1小时加入亚硝酸钠(18g,262mmol),同时将温度保持在15℃下。移除冷却浴,且将混合物在室温下搅拌3.5小时。将不溶物滤出而得到肟的粗制溶液,该粗制溶液无需进一步纯化即用于下一步骤。接下来,将50g锌粉(0.76mol)分批加入至13.7ml(79mmol)的3-氧代丁酸苄酯和100ml乙酸的混合物中。将所得混合物在油浴中搅拌且加热至60℃。缓慢加入粗制的2-(羟基氨基)-3-氧代丁酸叔丁酯溶液。然后将温度升至75℃且搅拌1小时。接下来,将反应混合物倒入水(4l)中。将沉淀物收集且过滤而得到2,4-二甲基-1h-吡咯-3-羧酸苄酯,将其自meoh中重结晶为白色固体,得到15g,基于3-氧代丁酸苄酯的产率为65%。1h nmr(400mhz,cdcl3):8.88(br,s,1h,nh),7.47-7.33(m,5h,c=ch),5.29(s,2h,ch2),2.53,2.48(2s,6h,2ch3),1.56(s,9h,3ch3)。
[0239]
接下来,在25ml小瓶中,将1g(4.36mmol)2,4-二甲基-1h-吡咯-3-羧酸苄酯、0.524g(4.36mmol)mgso4的混合物溶于8ml无水dce中,且在氩气的存在下在室温下搅拌15
分钟。分多个小部分加入0.327g 2,6-二甲基4-羟基苯甲醛(2.18mmol);最后用特氟龙盖密封。将所得混合物继续用氩气吹扫15分钟,且加入tfa (3滴,催化量)。将反应混合物在65℃下搅拌16小时。tlc和lcms显示已消耗了起始材料。向粗产物中一次性加入0.544g(2.398mmol)ddq。将所得混合物在室温下搅拌1/2小时。tlc和lcms显示已消耗了起始材料。将所得混合物通过短路径硅藻土过滤;将滤液浓缩至干燥,将残余物再溶解于50ml dce中,在室温下与三甲胺(1.4ml,19mmol)一起搅拌15分钟,然后冷却至0℃。缓慢加入3ml的bf3·
oet2(18.36mmol)。将所得混合物在室温下搅拌1/2小时,然后加热至86℃达45分钟。然后将反应混合物用150ml chcl3稀释,用50ml盐水淬灭。将有机层分离,且经mgso4干燥,移除溶剂且旋转蒸发。将残余物在硅胶柱上使用ch2cl2/etoac作为洗脱剂进行层析,得到1g纯的5,5-二氟-10-(4-羟基-2,6-二甲基苯基)-1,3,7,9-四甲基-5h-414,514-二吡咯并[1,2-c:2',1'-f][1,3,2]二氮杂硼杂苯-2,8-二羧酸二苄酯),即化合物5.1,为橙红色固体,基于2,6-二甲基-4-羟基苯甲醛的产率为72%。lcms(apci-):c
37h35
bf2n2o5(m-)的计算值:636.26;实测值:636。1h nmr(400mhz,氯仿-d)δ7.42
–
7.28(m,4h),6.66(d,j=0.7hz,1h),5.29(d,j=11.3hz,2h),2.82(s,3h),2.04(d,j=5.4hz,3h),1.72(s,3h)。
[0240]
plc-5:(10-(4-((5-(4,7-双(4-(二苯基氨基)苯基)-2h-苯并[d][1,2,3]三唑-2-基)戊酰基)氧)-2,6-二甲基苯基)-5,5-二氟-1,3,7,9-四甲基-5h-4l4,5l4-二吡咯并[1,2-c:2',1'-f][1,3,2]二氮杂硼杂苯-2,8-二羧酸二苄酯):由化合物2.1(0.050mmol,32mg)和化合物5.1(0.060mmol,42mg)以类似于化合物2的方式制备plc-5。粗产物通过在硅胶上的快速色谱法(100%己烷(1cv)
→
50%dcm/己烷(0cv)
→
100%dcm(6cv)
→
10%etoac/dcm(10cv))来纯化。将含有产物的级分蒸发至干燥而得到43mg(产率为65%)的plc-5。ms(apci):化学式:c
84h72
bf2n7o6(m-)的计算值=1323;实测值:1323。1h nmr(400mhz,氯仿-d)δ8.00(d,j=8.7hz,4h),7.61(s,2h),7.39
–
7.26(m,17h),7.23
–
7.15(m,13h),7.07
–
7.02(m,4h),6.90(s,2h),5.26(s,4h),4.86(t,j=7.0hz,2h),2.82(s,6h),2.65(t,j=7.3hz,2h),2.32(p,j=7.6,7.1hz,2h),2.06(s,6h),1.86(p,j=7.2hz,2h),1.67(s,6h)。
[0241]
实施例2.6:plc-6
[0242][0243]
化合物6.1.1 4-(4-(4,7-双(4-(二苯基氨基)苯基)-2h-苯并[d][1,2,3]三唑-2-基)苯基)丁酸甲酯
[0244][0245]
步骤1:4,7-二溴-2h-苯并[d][1,2,3]三唑:向42ml搅拌中的去离子水溶液中加入2.85g(41.4mmol,1.1当量)亚硝酸钠。然后将该溶液缓慢加入42ml冷却的冰乙酸中。在混合
约10分钟后,加入10g(37.6mmol,1当量)3,6-二溴苯-1,2-二胺。在加入完成后,移除冷却浴。在室温下搅拌约2小时后,将溶液过滤。然后将收集的沉淀物在室温真空烘箱下干燥过夜。获得作为米黄色粉末的期望产物(9.3g,产率为89%)。
[0246]
步骤2:4,4'-(2h-苯并[d][1,2,3]三唑-4,7-二基)双(n,n-二苯基苯胺):在氩气下向配备有冷凝器的2颈烧瓶中加入2g(7.2mmol,1当量)4,7-二溴-2h-苯并[d][1,2,3]三唑。加入10ml正丁醇、3ml甲苯和3ml水。将混合物加热至45℃(在同时鼓泡时)达30分钟。加入5.22g(18mmol,2.50当量)(4-(二苯基氨基)苯基)硼酸,之后加入9.19g(87mmol,12当量)碳酸钠。将溶液温度升至110℃。然后加入1.67g(0.144mmol,0.2当量)四(三苯基膦)钯(0)。加入总共5g另外的硼酸、2g碱和0.5g催化剂。在约4.5小时后,冷却反应。将反应倒入200ml甲醇中。搅拌几分钟,沉淀物析出。使用己烷:乙酸乙酯(9:1)进行柱色谱法。获得作为亮橙黄粉末的期望产物(1.74g,产率为40%)。
[0247]
步骤3:4-(4-(4,7-双(4-(二苯基氨基)苯基)-2h-苯并[d][1,2,3]三唑-2-基)苯基)丁酸甲酯:在氩气下向配备有冷凝器的2颈烧瓶中加入150mg(583mmol,1当量)来自先前步骤的4,4'-(2h-苯并[d][1,2,3]三唑-4,7-二基)双(n,n-二苯基苯胺)。随后,加入2ml无水甲苯,之后加入248mg(1.2mmol,2当量)磷酸钾。在氩气下的单独小瓶中,加入44mg(53μmol,0.1当量)三(二亚苄基丙酮)二钯(0)和55mg(117μmol,0.2当量)二叔丁基(2',4',6'-三异丙基-3,4,5,6-四甲基-[1,1'-联苯]-2-基)磷烷。使用氩气吹扫小瓶15分钟。然后加入2ml无水甲苯。将该烧瓶在120℃下加热3分钟。将第一烧瓶置于120℃的加热块中。然后将装有配体和催化剂的小瓶中的内容物转移至该烧瓶中。在反应约2小时后,冷却反应。使用己烷:乙酸乙酯(9:1)的梯度进行柱色谱法。获得作为橙色粉末的期望产物,即化合物6.1.1(120mg,26%)。1h nmr(400mhz,tce-d2)δ8.25(d,2h),8.04(d,4h),7.61(s,2h),7.24(m,10h),7.14(m,12h),7.01(t,4h),3.59(s,1h),2.67(t,2h),2.28(t,2h),1.91(p,2h)。
[0248]
化合物6.1(4-(4-(4,7-双(4-(二苯基氨基)苯基)-2h-苯并[d][1,2,3]三唑-2-基)苯基)丁酸):向100ml的2颈圆底烧瓶中装入4-(4-(4,7-双(4-(二苯基氨基)苯基)-2h-苯并[d][1,2,3]三唑-2-基)苯基)丁酸甲酯(化合物6.1.1,0.179mmol,140mg),且悬浮在无水乙醇(80ml)中。将该烧瓶装配翅片回流冷凝器,且用氩气冲洗。将反应混合物用氢氧化钾(12.7mmol,713mg)处理,且加热至90℃,在氩气下在该温度下搅拌6小时。将反应冷却至室温,且将反应混合物蒸发至干燥。粗沉淀物以定量产率分离出,得到化合物6.1,该化合物6.1无需进一步纯化即用于下一步骤。ms(apci):化学式:c
52h41
n5o2(m-h)的计算值=765;实测值:765。
[0249]
plc-6(10-(4-((4-(4-(4,7-双(4-(二苯基氨基)苯基)-2h-苯并[d][1,2,3]三唑-2-基)苯基)丁酰基)氧)-2,6-二甲基苯基)-5,5-二氟-1,3,7,9-四甲基-5h-4l4,5l4-二吡咯并[1,2-c:2',1'-f][1,3,2]二氮杂硼杂苯-2,8-二羧酸二苄酯):在40ml螺旋盖小瓶中装入搅拌棒、化合物5.1(0.055mmol,35mg)、化合物6.1(0.050mmol,38mg)和dmap:ptsoh 1:1盐(0.200mmol,59mg)。用氩气冲洗小瓶,且加入无水二氯甲烷(20ml)。加入二异丙基碳二亚胺(0.300mmol,47μl),且将反应在氩气下在室温下搅拌过夜。第二天早晨,加入无水四氢呋喃(10ml)且声处理30秒。加入另外部分的化合物6.1,且在氩气下在50℃下搅拌过夜。粗产物通过在硅胶上的快速色谱法(60%dcm/己烷(1cv)
→
100%dcm(5cv)
→
100%dcm(等度))来纯化。将含有产物的级分蒸发至干燥而得到57mg(产率为83%)的plc-6。ms(apci):化学
式:c
89h74
bf2n7o6(m-)的计算值=1385;实测值:1385。1h nmr(400mhz,四氯乙烷-d2)δ8.41
–
8.37(m,2h),8.18
–
8.12(m,4h),7.71(s,2h),7.43(d,j=8.5hz,2h),7.41
–
7.29(m,18h),7.28
–
7.20(m,12h),7.13
–
7.06(m,4h),6.97(s,2h),5.27(s,4h),2.89
–
2.80(m,8h),2.64(t,j=7.5hz,2h),2.17
–
2.09(m,8h),1.71(s,6h)。
[0250]
实施例2.7:plc-7
[0251][0252]
化合物7.1(5,5-二氟-10-(4-羟基-2,6-二甲基苯基)-1,3,7,9-四甲基-5h-4l4,5l4-二吡咯并[1,2-c:2',1'-f][1,3,2]二氮杂硼杂苯-2,8-二腈:
[0253][0254]
化合物7.1.1(氰基-2,4-二甲基吡咯):
[0255]
步骤1:将7.6ml的25%hbr/acoh缓慢加入至19.76g固体n-boc-gly-n'-甲氧基-n'-甲酰胺(90.4mmol)中。将溶液在室温下搅拌45分钟。接下来,将200ml二乙醚加入至溶液中,得到白色沉淀。将沉淀物过滤而得到18.03g甘氨酸n'-甲氧基-n'-甲酰胺hbr盐,产率为100%。lcms(m h):119。1h nmr(dmso-d6)δ8.04(3h,s),3.9(s,2h),3.72(s,3h),3.17(s,3h)。
[0256]
步骤2:将含有溶于1l干乙醇中的14.85g 3-氨基巴豆腈(180.8mmol)和17.95g甘氨酸n'-甲氧基-n'-甲酰胺hbr盐(90.4mmol)的溶液在氩气下在室温下搅拌16小时。将所得溶液真空浓缩至体积为50ml。将固体残余物用40ml冷etoh洗涤,得到16.71g白色固体。该固体无需进一步纯化即用于步骤3中。lcms(m h)184。1h nmr(dmso-d6)δ6.9(br,1h),3.89(s,2h),3.78(s,1h),3.7(s,3h),3.12(s,3h),2.03(s,3h)。
[0257]
步骤3:在氮气氛围下,在-10℃下,向含有溶于150ml干thf的3.89g步骤2的白色粉末(21.2mmol)的溶液中加入7.5ml的3.0m memgbr的et2o溶液(1.1当量)。将溶液搅拌50分钟。接下来,在氮气氛围下在-10℃下加入15ml的3.0m memgbr的et2o溶液(2.1当量)且搅拌另外2小时。在此之后,将溶液用200ml水淬灭,且用acoet萃取。将有机层用盐水洗涤,且经na2so4干燥。过滤且真空蒸发。产物为黄色固体,其无需进一步纯化即用于步骤4中。
[0258]
步骤4:向在75ml的etoh中包含2.67g来自步骤3的黄色固体(19.3mmol)的浆料中加入273mg的naoet(4.01mmol,0.2当量)。将浆料在室温下搅拌30分钟。接下来,将溶液真空蒸发且将残余物取出放入100ml水中,且用acoet萃取。将有机层用盐水洗涤且经mgso4干燥。过滤,真空蒸发,且通过硅胶快速色谱法(正己烷:acoet 3:1为洗脱剂)纯化滤液。得到2.09g(90%)的3-氰基-2,4-二甲基吡咯,化合物7.1.1,为白色固体。lcms(apci ):c7h9n2(m h)的计算值=121;实测值:121。1h nmr(cdcl3)δ8.06(bs,1h),6.37(1h,s),2.37(s,3h),2.13(s,3h)),3.74(1h,s),2.10(3h,s),2.02(3h,s)。
[0259]
化合物7.1.2((z)-5-((4-氰基-3,5-二甲基-2h-吡咯-2-亚基)-(4-羟基-2,6-二甲基苯基)甲基)-2,4-二甲基-1h-吡咯-3-腈)用两(2)步过程合成:步骤1:在氩气氛围下,
将1.12g 4-羟基-2,6-二甲基苯甲醛(7.49mmol)溶于85ml二氯甲烷/etoh(9:1)中。加入1.8g 2,4-二甲基-1h-吡咯-3-腈(化合物7.1.1,14.98mmol)。接下来,用氮气吹扫溶液30分钟,且加入tfa(5滴)。将反应混合物在室温下搅拌16小时。在减压下移除tfa和溶剂。粗产物无需进一步纯化即用于步骤2中。lcms(m h=373)。
[0260]
步骤2:将8g的ddq(35.2mmol)加入到包含溶于50ml chcl3加5ml etoh中的步骤1的粗产物的溶液中。将溶液在室温下搅拌1小时。在减压下移除溶剂。将深色残余物再溶解于50ml chcl3中,通过硅胶的短柱,使用ch2cl2/etoac(1:1)作为洗脱剂,得到2.35g作为灰白色固体的化合物7.1.2。两个步骤的总产率为85%。lcms(apci ):c
23h23
n4o(m h)的计算值=371;实测值:371。
[0261]
化合物7.1(5,5-二氟-10-(4-羟基-2,6-二甲基苯基)-1,3,7,9-四甲基-5h-4l4,5l4-二吡咯并[1,2-c:2',1'-f][1,3,2]二氮杂硼杂苯-2,8-二腈):向在50ml无水甲苯中含有2.35g化合物15.2[(z)-5-((4-氰基-3,5-二甲基-2h-吡咯-2-亚基)-(4-羟基-2,6-二甲基苯基)甲基)-2,4-二甲基-1h-吡咯-3-腈](6.38mmol)的溶液中加入8ml三乙胺(52.2mmol),之后加入10ml bf
3-醚化物(81mmol)。将溶液在室温下搅拌16小时,然后在80℃下加热1小时。接下来,将溶液冷却至室温,且加入25ml naoh水溶液(1m),形成水层,将该水层分离。将水层用4n的hcl水溶液中和,然后用etoac萃取。将合并的有机层经mgso4干燥且移除溶剂。将残余物在硅胶柱上使用己烷/etoac(1:1)作为洗脱剂进行层析,得到1.05g产物(产率为39%)。lcms(apci ):c
23h22
bf2n4o(m h)的计算值=419;实测值:419。1h nmr(400mhz,氯仿-d)δ6.73(s,2h),2.73(s,6h),2.05(s,6h),1.64(s,6h)。
[0262]
plc-7(4-(2,8-二氰基-5,5-二氟-1,3,7,9-四甲基-5h-4l4,5l4-二吡咯并[1,2-c:2',1'-f][1,3,2]二氮硼烷-10-基)-3,5-二甲基苯基4-(4-(4,7-双(4-(二苯基氨基)苯基)-2h-苯并[d][1,2,3]三唑-2-基)苯基)丁酸酯):在40ml螺旋盖小瓶中装入搅拌棒、化合物7.1(0.055mmol,35mg)和化合物6.1(0.050mmol,38mg),以及dmap:ptsoh 1:1盐(0.200mmol,59mg)。用氩气冲洗小瓶,且加入无水二氯甲烷(20ml)。加入二异丙基碳二亚胺(0.300mmol,47ul),且将反应在氩气下在室温下搅拌过夜。第二天早晨,加入无水四氢呋喃(10ml)且声处理30秒。加入另外部分的化合物2.1,且在氩气下在50℃下搅拌过夜。粗产物通过在硅胶上的快速色谱法(80%dcm/己烷(1cv)
→
100%dcm(5cv)
→
100%dcm(等度))来纯化。将含有产物的级分蒸发至干燥而得到21mg(产率为36%)的plc-7。ms(apci):化学式:c
75h60
bf2n9o2(m-)的计算值=1167;实测值:1167。
[0263]
实施例2.8:plc-8
[0264][0265]
化合物8.1(4,7-二溴-2-(4-氟苯基)-2h-苯并[d][1,2,3]三唑):
[0266][0267]
步骤1:将单过硫酸氢钾(78.88g,127.96mmol)加入至2-硝基苯胺(10.58g,76mmol)在h2o(210ml)中的溶液、dcm(590ml)的混合物中,且将所得混合物在40℃下搅拌48小时。在冷却至室温后,分离反应。将水层用dcm(150ml
×
2)再次萃取,合并dcm层,用1n的hcl水溶液、水和盐水洗涤,然后经mgso4干燥,且浓缩至干燥。将褐色固体用etoh研成粉末,过滤,然后风干,得到6.61g浅棕色固体产物。产率为57%。产物无需进一步纯化即用于下一步骤。lcms(apci ):c6h4n2o3(m )的计算值:152.11;实测值:152。
[0268]
步骤2:将1-硝基-2-亚硝基苯(1.4g,9.2mmol)、4-氟苯胺(1.02g,9.2mmol)在acoh(50ml)中的混合物在室温下搅拌16小时。将混合物倒入冰水中,通过过滤收集棕色固体,将产物水洗数次,然后在真空烘箱中干燥至干,得到2.0g浅棕色固体产物。产率为89%。产物无需进一步纯化即用于下一步骤。lcms(apci ):c
12
h8fn3o2(m )的计算值:245.21;实测值:245。
[0269]
步骤3:将甲脒亚磺酸(2.9g,26.89mmol)加入至(e/z)-1-(4-氟苯基)-2-(2-硝基苯基)二氮烯(2.0g,8.15mmol)在etoh(50ml)中的混合物中,之后加入4n的naoh水溶液(42ml),将所得混合物在85℃下搅拌16小时。在冷却至室温后,将溶液倒入冰水中,通过过滤收集棕色固体,将产物水洗数次,然后在真空烘箱中干燥至干,得到1.61g浅棕色固体产物。产率为93%。产物无需进一步纯化即用于下一步骤。lcms(apci ):c
12
h8fn3(m )的计算值:213.22;实测值:213。1h nmr(400mhz,cdcl3):8.33(d,j=9.16hz,2h),7.92(d,j=9.5hz,2h),7.42(d,j=9.9hz,2h),7.24(d,j=2.92hz,2h)。
[0270]
步骤4:将溴(0.93ml,18.16mmol)滴加至2-(4-氟苯基)-2h-苯并[d][1,2,3]三唑(1.55g,7.26mmol)在48%hbr(20ml)中的混合物中,将所得混合物在130℃下搅拌16小时。在冷却至室温后,将溶液倾析且丢弃;将烧瓶中的剩余物加入至冰水中,将产物萃取至乙酸乙酯:thf(1:1)中。将有机层分离,经mgso4干燥,且浓缩。将滤液浓缩至干燥。将粗产物通过sio2柱色谱法纯化,用己烷:乙酸乙酯(95:5)洗脱,得到1.96g化合物8.1。产率为73%。lcms(apci ):c
12
h6br2fn3(m )的计算值:371.01;实测值:371。1h nmr(400mhz,cdcl3):8.41(d,j=9.2hz,2h),7.47(s,2h)),7.52(dd,j=10.1hz,2hz,2h)。
[0271]
化合物8.2(4,4'-(2-(4-氟苯基)-2h-苯并[d][1,2,3]三唑-4,7-二基)双(n,n-二
1,3,7,9-四甲基-5h-4l4,5l4-二吡咯并[1,2-c:2',1'-f][1,3,2]二氮杂硼杂苯-2,8-二羧酸二苄酯):在250ml的2颈圆底烧瓶装配翅片冷凝器、搅拌棒和气体适配器。将烧瓶用氩气冲洗,加入化合物8.5(0.050mmol,39mg)和化合物5.1(0.055mmol,35mg),以及dmap:ptsoh 1:1盐(0.200mmol,59mg)。用氩气冲洗小瓶,且加入无水二氯甲烷(20ml)。加入二异丙基碳二亚胺(0.300mmol,47μl),且将反应在氩气下在室温下搅拌过夜。粗产物通过在硅胶上的快速色谱法(80%dcm/己烷(1cv)
→
100%dcm(5cv)
→
100%dcm(等度))来纯化。将含有产物的级分蒸发而得到63mg(产率为90%)的plc-8。ms(apci):化学式:c
89h73
bf3n7o6(m-)的计算值=1403;实测值:1403。1h nmr(400mhz,四氯乙烷-d2)δ8.41
–
8.37(m,2h),8.15(d,j=8.8hz,4h),7.71(s,2h),7.46
–
7.30(m,20h),7.28
–
7.19(m,11h),7.13
–
7.06(m,4h),6.97(s,2h),5.27(s,4h),2.90
–
2.81(m,8h),2.64(t,j=7.5hz,2h),2.17
–
2.09(m,8h),1.71(s,6h)。
[0276]
实施例2.9:plc-9
[0277][0278]
plc-9(4-(2,8-二氰基-5,5-二氟-1,3,7,9-四甲基-5h-4l4,5l4-二吡咯并[1,2-c:2',1'-f][1,3,2]二氮杂硼杂苯-10-基)-3,5-二甲基苯基4-(4-((4-(7-(4-(二苯基氨基)苯基)-2-(4-氟苯基)-2h-苯并[d][1,2,3]三唑-4-基)苯基)(苯基)氨基)苯基)丁酸酯):在250ml的2颈圆底烧瓶装配翅片冷凝器、搅拌棒和气体适配器。将烧瓶用氩气冲洗,然后加入化合物7.1(0.055mmol,35mg)和化合物8.5(0.050mmol,39mg),以及dmap:ptsoh 1:1盐(0.200mmol,59mg)。用氩气冲洗小瓶,且加入无水二氯甲烷(20ml)。加入二异丙基碳二亚胺(0.300mmol,47μl),且将反应在氩气下在室温下搅拌过夜。粗产物通过在硅胶上的快速色谱法(80%dcm/己烷(1cv)
→
100%dcm(5cv)
→
100%dcm(等度))来纯化。将含有产物的级分蒸发至干燥而得到39mg(59%产率)。ms(apci):化学式:c
75h59
bf3n9o2(m-)的计算值=1185;实测值:1185。1h nmr(400mhz,四氯乙烷-d2)δ8.48
–
8.42(m,2h),8.16
–
8.11(m,4h),7.71(s,2h),7.37
–
7.30(m,5h),7.30
–
7.19(m,10h),7.18(s,3h),7.10(td,j=7.1,1.4hz,3h),7.06(s,2h),2.79
–
2.72(m,8h),2.67(t,j=7.5hz,2h),2.13(s,8h),1.63(s,6h)。
[0279]
实施例3色彩转换膜的制造
[0280]
基本上以下列方式制备玻璃基材。将尺寸为1英寸
×
1英寸的1.1mm厚的玻璃基材切割成一定尺寸。然后将玻璃基材用洗涤剂和去离子(di)水洗涤,用新鲜的di水冲洗,并且超声处理约1小时。然后将玻璃浸入异丙醇(ipa),并且超声处理约1小时。然后将玻璃基材浸入丙酮,并且超声处理约1小时。然后将玻璃从丙酮浴中取出,并且在室温下用氮气干燥。
[0281]
制备聚(甲基丙烯酸甲酯)(pmma)(通过gpc测量的平均m.w.120,000,购自milliporesigma,burlington,ma,usa)共聚物在环戊酮(纯度99.9%)中的20wt%溶液。将制备的共聚物在40℃下搅拌过夜。[pmma]cas:9011-14-7;[环戊酮]cas:120-92-3
[0282]
将上述制备的20%pmma溶液(4g)在密封容器中加入至3mg的如上所述制备的光致发光复合物中,并且混合约30分钟。然后将pmma/发光物溶液以1000rpm旋涂到制备的玻璃基材上持续20秒,然后以500rpm旋涂5秒。所得湿涂层的厚度为约10μm。在旋涂之前,将样品用铝箔覆盖以防止样品暴露于光下。以此方式分别针对发射/fwhm和量子产率各自制备三个样品。将经旋涂的样品在真空烘箱中在80℃下烘烤3小时,以将残留的溶剂蒸发。干燥涂膜的厚度为约2μm。
[0283]
将1英寸
×
1英寸样品插入shimadzu,uv-3600uv-vis-nir分光光度计(shimadzu instruments,inc.,columbia,md,usa)中。所有设备操作均在充满氮气的手套箱内进行。plc-1的所得吸收/发射光谱如图1所示,而plc-5的所得吸收/发射光谱如图2所示。
[0284]
使用fluorolog分光荧光计(horiba scientific,edison,nj,usa)确定如上所述制备的1英寸
×
1英寸膜样品的荧光光谱,其中激发波长设置为各自的最大吸收波长。最大发射和fwhm如表1所示。
[0285]
使用quantarus-qy分光光度计(hamamatsu inc.,campbell ca,usa)确定如上所述制备的1英寸
×
1英寸样品的量子产率,所述分光光度计在各自的最大吸收波长下激发。结果报告在表1中。
[0286]
膜表征的结果(吸收峰波长、fwhm和量子产率)在下表1中示出。
[0287]
表1.
[0288]
[0289]
[0290]
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。