1.本发明涉及儿茶酚胺及其代谢产物检测技术领域,尤其是涉及一种血浆和尿液中儿茶酚胺及其代谢产物的检测方法。
背景技术:
2.儿茶酚胺(catecholamines,cas)是一种含有儿茶酚和胺基的神经类物质。它是人体内重要的神经递质和激素,主要包括肾上腺素(epinephrine,e)、去甲肾上腺素(norepinephrine,ne)和多巴胺(dopamine,da)。cas是由肾上腺髓质、肾上腺神经元以及肾上腺外嗜铬体合成与分泌的单胺类神经递质,是具有较强的生理活性的内源性物质,在大脑和神经信号传导中起着重要的作用。血浆和尿液中cas及其代谢物水平与人体多种生理、病理现象有密切关系。临床研究发现,cas及其代谢物的体内水平与人体多种生理、病理现象有密切关系,对心血管系统、神经系统、内分泌系统、肾脏、平滑肌组织等生理活动起着调节作用。儿茶酚胺的代谢物主要包括变肾上腺素(metanphrine,mn)、去甲肾上腺素(normetanephrine,nmn)、3-甲氧酪胺(3-methoxytyramine,3-mt)、香草扁桃酸(vanillylmandelic acid,vma)和高香草酸(homovanillic acid,hva)。多巴胺、肾上腺素和去甲肾上腺素通过儿茶酚-o-甲基转移酶(comt)形成代谢物3-mt、mn和nmn。
3.嗜铬细胞瘤(pheochromocytoma,pcc)起源于肾上腺髓质嗜铬细胞,分泌生产儿茶酚胺;副神经节瘤(paraganglioma,pgl)起源于肾上腺外嗜铬细胞,位于胸、腹和盆腔脊柱旁交感神经链,也可来源于沿颈部和颅底分布的舌咽、迷走神经的副交感神经节,后常不产生ca。pcc占80%~85%,pgl占15%~20%,二者合称ppgls(pheochromocytomas or paragangliomas),是继发性高血压的少见类型,在普通门诊高血压患者中的患病率为0.2%~0.6%。副神经节瘤的临床表现多为顽固性高血压,有的患者伴有发作性多汗、心悸、头痛、震颤、皮肤苍白等症状和/或体位性低血压;有的首发症状为麻醉时出现高血压或高血压危象;有的患者可因严重心血管并发症而致死亡。
4.目前国内外对于生物样本中儿茶酚胺的测定方法主要包括高效液相色谱法(hplc)、毛细管电泳法(ce)、电化学和荧光光度法(fl)等。毛细管电泳法、电化学和荧光光度法等方法简单,但是灵敏度差,易被干扰,多化合物联检表现出不足。因此,如何改进生物样本中儿茶酚胺及其代谢产物的测定方法是目前亟待解决的问题。
5.有鉴于此,特提出本发明。
技术实现要素:
6.本发明的目的在于提供一种血浆和尿液中儿茶酚胺及其代谢产物的检测方法,以缓解现有技术中缺少一种选择性良好,灵敏度高,能够对儿茶酚胺及其代谢产物快速准确分析方法的问题。
7.为解决上述技术问题,本发明特采用如下技术方案:
8.根据本发明的一个方面,本发明提供了一种血浆和尿液中儿茶酚胺及其代谢产物
的检测方法,所述儿茶酚胺及其代谢产物包括:3-mt、mn、nmn、da、e和ne;
9.所述检测方法包括将经过固相萃取的样本采用lc-ms/ms检测;
10.所述固相萃取中使用如下洗脱液洗脱:所述洗脱液含有体积比为(95~100):(5~1)的乙腈和水;以体积百分比计,所述洗脱液还含有1~5%甲酸。
11.优选地,将样本、内标工作液和稀释液混合后进行固相萃取;所述样本和稀释液的体积比为500:(100~500);所述样本包括校准品工作液、质控品工作液、血浆样本或尿液样本;所述稀释液为20~50mm的乙酸铵溶液;或,20~50mm的甲酸铵溶液,所述甲酸铵溶液中还含有甲酸,以体积百分数计,所述甲酸含量为0.05~0.2%;
12.优选地,所述稀释液为50mm的乙酸铵溶液;
13.优选地,所述血浆样本或所述尿液样本经水稀释后再与所述稀释液混合;
14.优选地,所述样本和稀释液的体积比为500:300。
15.优选地,所述lc-ms/ms检测以da-d4、e-d6、ne-d6、nmn-d3、mn-d3和3-mt-d4作为内标;
16.优选地,所述内标工作液中da-d4、e-d6、ne-d6、nmn-d3、mn-d3和3-mt-d4的目标浓度为:3-mt-d4:0.2μg/ml;mn-d3:0.3μg/ml;nmn-d3:0.5μg/ml;da-d4:0.1μg/ml;e-d6:0.05μg/ml;和ne-d6:1.5μg/ml。
17.优选地,所述校准品工作液中各物质的目标浓度为:
18.校准品s1:3-mt:10pg/ml、mn:20pg/ml、nmn:20pg/ml、da:25pg/ml、e:50pg/ml和ne:125pg/ml;
19.校准品s2:3-mt:25pg/ml、mn:50pg/ml、nmn:50pg/ml、da:62.5pg/ml、e:125pg/ml和ne:312.5pg/ml;
20.校准品s3:3-mt:100pg/ml、mn:200pg/ml、nmn:200pg/ml、da:250pg/ml、e:500pg/ml和ne:1250pg/ml;
21.校准品s4:3-mt:600pg/ml、mn:1200pg/ml、nmn:1200pg/ml、da:1500pg/ml、e:3000pg/ml和ne:7500pg/ml;
22.校准品s5:3-mt:1800pg/ml、mn:3600pg/ml、nmn:3600pg/ml、da:4500pg/ml、e:9000pg/ml和ne:22500pg/ml;
23.校准品s6:3-mt:4000pg/ml、mn:8000pg/ml、nmn:8000pg/ml、da:10000pg/ml、e:20000pg/ml和ne:50000pg/ml。
24.优选地,所述质控品工作液包括血浆质控品工作液和/或尿液质控品工作液;
25.优选地,所述血浆质控品工作液的基质为含有bsa的缓冲液,按照质量体积比计,bsa的浓度为1~5%;所述缓冲液优选为pbs缓冲液;
26.优选地,所述血浆质控品工作液的基质为按照质量体积比计含1%bsa的pbs缓冲液;
27.优选地,所述血浆质控品工作液包括低值血浆质控品工作液和高值血浆质控品工作液;
28.所述低值血浆质控品工作液中各物质的目标浓度为:3-mt:40pg/ml、mn:80pg/ml、nmn:80pg/ml、da:100pg/ml、e:200pg/ml和ne:500pg/ml;
29.所述高值血浆质控品工作液中各物质的目标浓度为:3-mt:200pg/ml、mn:400pg/
ml、nmn:400pg/ml、da:500pg/ml、e:1000pg/ml和ne:2500pg/ml;
30.优选地,所述尿液质控品工作液以人工尿液、生理盐水或缓冲液作为基质;
31.优选地,所述尿液质控品工作液以缓冲液作为基质,优选以pbs缓冲液作为基质;
32.优选地,所述尿液质控品工作液包括低值尿液质控品工作液和高值尿液质控品工作液;
33.所述低值尿液质控品工作液中各物质的目标浓度为:3-mt:400pg/ml、mn:800pg/ml、nmn:800pg/ml、da:1000pg/ml、e:2000pg/ml和ne:5000pg/ml;
34.所述高值尿液质控品工作液中各物质的目标浓度为:3-mt:3000pg/ml、mn:6000pg/ml、nmn:6000pg/ml、da:7500pg/ml、e:15000pg/ml和ne:37500pg/ml。
35.优选地,所述洗脱液还含有抗氧化剂;
36.优选地,所述抗氧化剂包括bht;
37.优选地,以体积百分比计,所述洗脱液中bht的含量不超过0.05%;
38.所述洗脱液包括体积比为(95~100):(5~1)的乙腈和水;以体积百分比计,所述洗脱液还含有2~5%甲酸和0~0.01%bht;
39.优选地,洗脱液体积比为98:2的乙腈和水,以体积百分比计,洗脱液还含2%甲酸和0.01%bht。
40.优选地,所述固相萃取依次包括活化、上样、淋洗、洗脱、氮吹和复溶;
41.优选地,所述活化包括先使用第一活化液活化,再使用第二活化液活化;所述第一活化液包括甲醇,所述第二活化液包括20~50mm的乙酸铵溶液;
42.优选地,所述第二活化液为20mm乙酸铵溶液;
43.优选地,所述淋洗包括先使用第一淋洗液淋洗,再使用第二淋洗液淋洗;所述第一淋洗液包括20~50mm的乙酸铵溶液,所述第二淋洗液包括甲醇;
44.优选地,所述第一淋洗液为20mm乙酸铵溶液;
45.优选地,用于所述复溶的复溶液为水或含有甲酸的水溶液;以体积百分比计,所述含有甲酸的水溶液中甲酸的浓度为0.1~1%;
46.优选地,所述复溶液还含有抗氧化剂;
47.优选地,所述抗氧化剂包括柠檬酸、绿原酸、抗坏血酸、焦亚硫酸钠、硫代硫酸钠、焦性没食子酸或谷胱甘肽。
48.优选地,以体积百分比计,所述复溶液为含有0.1%甲酸的水溶液。
49.优选地,液相色谱采用梯度洗脱程序,所述梯度洗脱程序为:
50.0.00min,流动相a 95%,流动相b 5%;
51.0.80min,流动相a 95%,流动相b 5%;
52.3.00min,流动相a 70%,流动相b 30%;
53.3.60min,流动相a 10%,流动相b 90%;
54.4.20min,流动相a 10%,流动相b 90%;
55.4.21min,流动相a 95%,流动相b 5%;
56.5.00min,流动相a 95%,流动相b 5%;
57.按照体积百分比计,流动相a为0.05~0.2%甲酸水溶液;流动相b为0.05~0.2%甲酸甲醇溶液;
58.优选地,按照体积百分比计,流动相a为0.1%甲酸水溶液;流动相b为0.1%甲酸甲醇溶液;
59.优选地,流速为0.5~1ml/min;
60.优选地,色谱柱采用c18柱,优选采用c18 3.0*100mm,3.5μm色谱柱;
61.优选地,柱温为35~45℃。
62.优选地,质谱条件如下:离子化模式:电喷雾电离正离子模式;采集模式:多反应监测;气帘气:30psi;离子源气体1:60psi;离子源气体2:40psi;离子源喷雾电压:1500v;离子源温度:500℃;碰撞气:6unit。
63.优选地,质谱离子信息如下:
64.化合物q1q3dwell timedpepcecxpda-1*154.191164083110da-2154.1137.110408158e-1*16610716808269e-2166135.110808239ne-1*152.110716758249ne-21521351075817.59nmn-1*166134.116738239nmn-2166121.110738239mn-1*180148.1168514249mn-21801651085142393-mt-1*168.191164033493-mt-2168.1119.110403259da-is158141.116508169e-is190.1172.216408159mn-is183.1123.116808259nmn-is169.1137.1168082593-mt-is172.195.116558359ne-is175.9158.216158159
65.化合物通道标*作为定量离子。
66.与现有技术相比,本发明具有如下有益效果:
67.本发明提供的血浆和尿液中儿茶酚胺及其代谢产物的检测方法检测的目标物质包括3-mt、mn、nmn、da、e和ne。本发明采用固相萃取法对样本进行预处理,通过优化固相萃取方法,可以去除尿液和血浆中的大部分干扰及杂质,氮吹复溶后,采用lc-ms/ms法进行分析,能够得到更准确的结果。因血浆内儿茶酚胺及其代谢物含量较低,相比于hplc-ecd和hplc-fld,lc-ms/ms方法能够高效、高灵敏度分离和检测待测物质。
68.本发明采用先固相萃取处理样本,然后lc-ms/ms方法快速测定人血浆和尿液中儿茶酚胺及其代谢物的浓度,该方法具有灵敏度高,特异性强,重复性好,准确度高等优点。该检测方法中3-mt、mn、nmn、da、e和ne的相关系数r均≥0.990;低值质控品重复性的变异系数(cv)≤15%,高值质控品重复性的变异系数(cv)≤15%;准确度的相对偏差(b)≤
±
15%,
加标回收率为85%~125%。该检测方法能够满足方法验证过程中对线性,重复性,准确度、残留等要求,对检测儿茶酚胺及其代谢物有重要意义。
附图说明
69.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
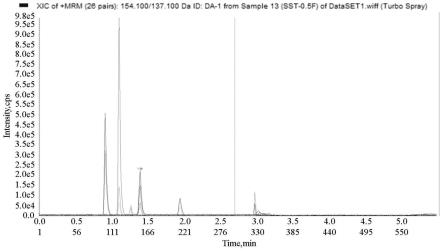
70.图1为本发明实施例1提供的检测方法检测样本的谱图;
71.图2为本发明实施例13提供的检测方法检测样本的谱图;
72.图3为本发明实施例14提供的检测方法检测样本的谱图。
具体实施方式
73.下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
74.根据本发明的一个方面,本发明提供了一种血浆和尿液中儿茶酚胺及其代谢产物的检测方法,该方法是以非诊断和治疗为目的的。其中儿茶酚胺包括多巴胺(dopamine,da)、肾上腺素(epinephrine,e)和去甲肾上腺素(norepinephrine,ne);儿茶酚胺的代谢产物包括变肾上腺素(metanphrine,mn)、去甲肾上腺素(normetanephrine,nmn)和3-甲氧酪胺(3-methoxytyramine,3-mt)。
75.本发明提供的检测方法主要包括样本前处理部分和lc-ms/ms检测部分,通过固相萃取的前处理方法可以去除血浆和尿液中的大部分干扰及杂质,然后采用液相色谱质谱联用(lc-ms/ms)法进行分析,能够得到更准确的结果。
76.在一些可选的实施方式中,将样本、内标工作液和稀释液混合后进行固相萃取,样本包括校准品工作液、质控品工作液、血浆样本或尿液样本,其中血浆样本或尿液样本优选先经水稀释后再与所述稀释液混合。样本和稀释液的体积比为500:(100~500);例如可以为但不限于为500:100、500:200、500:300、500:400或500:500,优选为500:300,更优选为取500μl样本,使用300μl所述稀释液稀释。
77.所述稀释液为20~50mm的乙酸铵溶液,例如可以为但不限于为20、30、40或50mm;所述稀释液或者为20~50mm的甲酸铵溶液,例如可以为但不限于为20、30、40或50mm,且所述甲酸铵溶液中还含有甲酸,以体积百分数计,所述甲酸含量为0.05~0.2%,例如可以为但不限于为0.05%、0.1%、0.15%或0.2%。所述稀释液优选为50mm的乙酸铵溶液。
78.固相萃取步骤依次包括活化、上样、淋洗、洗脱、氮吹和复溶。
79.在一些可选的实施方式中,所述活化包括先使用第一活化液活化spe柱,再使用第二活化液活化spe柱;所述第一活化液包括甲醇,所述第二活化液包括20~50mm的乙酸铵溶液。第二活化液中乙酸铵的浓度例如可以为但不限于为20、30、40或50mm,优选为20mm。
80.在一些可选的实施方式中,所述淋洗包括先使用第一淋洗液淋洗spe柱,再使用第
二淋洗液淋洗spe柱;所述第一淋洗液包括20~50mm的乙酸铵溶液,所述第二淋洗液包括甲醇。第一淋洗液中乙酸铵的浓度例如可以为但不限于为20、30、40或50mm,优选为20mm。
81.本发明固相萃取步骤中,洗脱包括使用洗脱液洗脱,所述洗脱液含有体积比为(95~100):(5~1)的乙腈和水,例如可以为但不限于为95:5、96:4、97:3、98:2、99:1或100:1;以体积百分比计,所述洗脱液还含有1~5%甲酸,例如可以为但不限于为1%、2%、3%、4%或5%的甲酸。所述洗脱液优选还含有抗氧化剂,所述抗氧化剂优选包括bht(2,6-二叔丁基-4-甲基苯酚);本发明通过实验发现,当洗脱液中含有bht时可以获得更多响应,且对化合物没有影响,因此优选洗脱液中含有bht;以体积百分比计,所述洗脱液中bht的含量不超过0.05%;例如可以为但不限于为0.01%、0.02%、0.03%、0.04%或0.05%。
82.在一些可选的实施方式中,所述洗脱液包括体积比为(95~100):(5~1)的乙腈和水;以体积百分比计,所述洗脱液还含有2~5%甲酸和0~0.01%bht;0表示所述洗脱液中不含有bht;洗脱液更优选的组成如下:含有体积比为98:2的乙腈和水;以体积百分比计还含有2%甲酸和0.01%bht。
83.用于复溶的复溶液可选地为水或含有甲酸的水溶液;以体积百分比计,所述含有甲酸的水溶液中甲酸的浓度为0.1~1%,例如可以为但不限于为0.1%、0.2%、0.5%、0.8%或1%,优选为0.1%。所述复溶液中还可选地含有抗氧化剂,所述抗氧化剂包括但不限于柠檬酸、绿原酸、抗坏血酸、焦亚硫酸钠、硫代硫酸钠、焦性没食子酸或谷胱甘肽。
84.需要说明的是,本文中“溶液”或“水溶液”如无特别说明,所述溶液中均以水作为溶剂或主要溶剂。
85.在一些可选的实施方式中,以da-d4、e-d6、ne-d6、nmn-d3、mn-d3和3-mt-d4作为lc-ms/ms检测的内标,内标工作液中各成分的目标浓度优选为:3-mt-d4:0.2μg/ml;mn-d3:0.3μg/ml;nmn-d3:0.5μg/ml;da-d4:0.1μg/ml;e-d6:0.05μg/ml;和ne-d6:1.5μg/ml。
86.在一些可选的实施方式中,标准曲线设置六个浓度点,配制的校准品工作液包括校准品s1~s6,校准品工作液中各物质的目标浓度依次为:
87.校准品s1:3-mt:10pg/ml、mn:20pg/ml、nmn:20pg/ml、da:25pg/ml、e:50pg/ml和ne:125pg/ml;
88.校准品s2:3-mt:25pg/ml、mn:50pg/ml、nmn:50pg/ml、da:62.5pg/ml、e:125pg/ml和ne:312.5pg/ml;
89.校准品s3:3-mt:100pg/ml、mn:200pg/ml、nmn:200pg/ml、da:250pg/ml、e:500pg/ml和ne:1250pg/ml;
90.校准品s4:3-mt:600pg/ml、mn:1200pg/ml、nmn:1200pg/ml、da:1500pg/ml、e:3000pg/ml和ne:7500pg/ml;
91.校准品s5:3-mt:1800pg/ml、mn:3600pg/ml、nmn:3600pg/ml、da:4500pg/ml、e:9000pg/ml和ne:22500pg/ml;
92.校准品s6:3-mt:4000pg/ml、mn:8000pg/ml、nmn:8000pg/ml、da:10000pg/ml、e:20000pg/ml和ne:50000pg/ml。
93.在一些可选的实施方式中,该检测方法还包括检测质控品,以用于对检测结果进行质量控制,质控品工作液包括血浆质控品工作液和/或尿液质控品工作液。
94.在一些可选的实施方式中,血浆质控品工作液的基质为含有bsa的缓冲液,按照质
量体积比计,bsa的浓度为1~5%,例如可以为但不限于为1%、2%、3%、4%或5%,缓冲液可选地为pbs缓冲液。血浆质控品工作液的基质优选为按照质量体积比计含1%bsa的pbs缓冲液。以含有牛血清蛋白的缓冲液作为血浆样本的替代基质,具有易于获得、成本低、质量易于控制等优点。
95.在一些可选的实施方式中,血浆质控品工作液包括低值血浆质控品工作液和高值血浆质控品工作液;低值血浆质控品工作液中各物质的目标浓度为:3-mt:40pg/ml、mn:80pg/ml、nmn:80pg/ml、da:100pg/ml、e:200pg/ml和ne:500pg/ml;高值血浆质控品工作液中各物质的目标浓度为:3-mt:200pg/ml、mn:400pg/ml、nmn:400pg/ml、da:500pg/ml、e:1000pg/ml和ne:2500pg/ml。
96.在一些可选的实施方式中,所述尿液质控品工作液以人工尿液、生理盐水或缓冲液作为基质,优选以缓冲液作为基质,更优选以pbs缓冲液作为基质。上述基质作为人尿液样本的替代基质具有稳定性好又易于获得,以及方便保存的优点。
97.在一些可选的实施方式中,尿液质控品工作液包括低值尿液质控品工作液和高值尿液质控品工作液;低值尿液质控品工作液中各物质的目标浓度为:3-mt:400pg/ml、mn:800pg/ml、nmn:800pg/ml、da:1000pg/ml、e:2000pg/ml和ne:5000pg/ml;高值尿液质控品工作液中各物质目标浓度为:3-mt:3000pg/ml、mn:6000pg/ml、nmn:6000pg/ml、da:7500pg/ml、e:15000pg/ml和ne:37500pg/ml。
98.需要说明的是,本文中“目标浓度”表达的是在配制工作液时对其中各溶质目标浓度的期望,而非各溶质的实际浓度。在实际操作中,工作液的配制由于操作、仪器以及容器等因素会产生误差,其实际浓度与预配制的理论浓度会产生偏差。在实际操作中通常会使用更高一级的校准品对工作液进行校正与赋值,经更高一级的校准品赋值后的工作液的标示浓度可能会与目标浓度产生偏差,这种偏差是本领域可接受的,经高一级的校准品赋值后的工作液呈现出的浓度也属于上述目标浓度的设置方式,属于本发明的保护范围。
99.本发明还优化了lc-ms/ms检测步骤中色谱和质谱的检测条件。
100.色谱条件优选如下:
101.在一些可选的实施方式中,液相色谱采用梯度洗脱程序,所述梯度洗脱程序为:
102.0.00min,流动相a 95%,流动相b 5%;
103.0.80min,流动相a 95%,流动相b 5%;
104.3.00min,流动相a 70%,流动相b 30%;
105.3.60min,流动相a 10%,流动相b 90%;
106.4.20min,流动相a 10%,流动相b 90%;
107.4.21min,流动相a 95%,流动相b 5%;
108.5.00min,流动相a 95%,流动相b 5%。
109.其中,按照体积百分比计,流动相a为0.05~0.2%甲酸水溶液,例如可以为但不限于为0.05%、0.1%、0.15%或0.2%的甲酸水溶液;流动相b为0.05~0.2%甲酸甲醇溶液,例如可以为但不限于为0.05%、0.1%、0.15%或0.2%的甲醇溶液。按照体积百分比计,流动相a优选为0.1%甲酸水溶液;流动相b优选为0.1%甲酸甲醇溶液。
110.在一些可选的实施方式中,色谱柱采用c18柱,更优选采用c18 3.0*100mm,3.5μm。采用c18柱,能够使6个化合物出峰时间分开,分离度好,且色谱柱寿命长,峰型好,定量准
确,同时流动相长时间使用对峰型影响小。柱温优选为35~45℃,例如可以为但不限于为35、40或45℃,更优选为40℃。流速优选为0.5~1ml/min,更优选为0.5ml/min。
111.质谱条件优选如下:
112.离子化模式:电喷雾电离正离子模式;采集模式:多反应监测;气帘气:30psi;离子源气体1:60psi;离子源气体2:40psi;离子源喷雾电压:1500v;离子源温度:500℃;碰撞气:6unit。
113.离子信息优选如下:
114.化合物q1q3dwell timedpepcecxpda-1*154.191164083110da-2154.1137.110408158e-1*16610716808269e-2166135.110808239ne-1*152.110716758249ne-21521351075817.59nmn-1*166134.116738239nmn-2166121.110738239mn-1*180148.1168514249mn-21801651085142393-mt-1*168.191164033493-mt-2168.1119.110403259da-is158141.116508169e-is190.1172.216408159mn-is183.1123.116808259nmn-is169.1137.1168082593-mt-is172.195.116558359ne-is175.9158.216158159
115.化合物通道标*作为定量离子。
116.采用液相色谱串联质谱(lc-ms/ms)法,利用特定的色谱柱及特定的流动相可以将儿茶酚胺3项(da、e和ne)和3项代谢物项(3-mt、mn和nmn)进行快速的分离,同时通过固相萃取的前处理方法得到上机样本进行检验,能够取得5分钟内快速分离六个化合物,前处理操作简单快速,血浆和尿液样本处理干净,干扰小的技术效果。在一些实施例中,通过优化固相萃取试剂提高了化合物响应,尤其针对4500md质谱提高响应。
117.上述血浆和尿液中儿茶酚胺及其代谢产物的检测方法具有灵敏度高,特异性强,重复性好和准确度高的优点,该方法多巴胺的线性范围是25~10000pg/ml,肾上腺素的线性范围是50~20000pg/ml,去甲肾上腺素的线性范围是125~50000pg/ml,去甲变肾上腺素的线性范围是20~8000pg/ml,变肾上腺素的线性范围是20~8000pg/ml,3-甲氧酪氨的线性范围是10~4000pg/ml,相关系数r均≥0.990;低值质控品重复性的变异系数(cv)≤15%,高值质控品重复性的变异系数(cv)≤15%;校准品c1准确度的相对偏差(b)≤
±
20%,校准品c2-c6准确度的相对偏差(b)≤
±
15%,加标回收率为85%~115%。
118.下面结合优选实施例进一步说明本技术的技术方案和有益效果。
119.实施例1
120.(一)校准品和质控品配制
121.1.化合物及内标储备液的配制
122.精密称取da、e、ne适量,用5%1m hcl-甲醇溶解、定容,分别配制成1mg/ml的储备液,置于-80℃冰箱中保存。
123.精密称取内标da-d4、e-d6、ne-d6、nmn-d3、mn-d3、3-mt-d4适量,用5%1mhcl-甲醇溶解、定容,分别配制成0.1mg/ml的储备液,置于-80℃冰箱中保存。
124.nmn和mn的1.0mg/ml溶液直接作为储备液使用,3-mt的1.0mg/ml溶液作为储备液使用,均置于-80℃冰箱中保存。
125.2.校准品的配制
126.精密移取化合物储备液适量,用5%1m hcl-甲醇稀释成适当质量浓度的次级储备液。精密移取次级储备液,加入适量0.05m hcl水溶液,制成校准品最高浓度c6,再由c6和适量0.05m hcl水溶液按照不同稀释倍数配制c1~c5,具体配制方法见下表。
127.表1
[0128][0129]
表2
[0130][0131][0132]
3.质控品配制
[0133]
由c6和适量0.05m hcl水溶液按照不同稀释倍数配制质控品qcⅰ、qcⅱ和qcⅲ,具体配制方法见下表。
[0134]
表3
[0135][0136][0137]
4.内标配制
[0138]
精密移取适量内标储备液,配制内标,具体配制方法见下表。
[0139]
表4
[0140][0141]
(二)其他试剂配制
[0142]
1.稀释液a配制:精密称量5g牛血清白蛋白,用500ml 1
×
pbs溶液溶解,混合均匀,过滤,即得到1%bsa溶液。
[0143]
2.稀释液b配制:量取10
×
pbs溶液100ml,加入900ml超纯水,混合均匀,即得到1
×
pbs溶液。
[0144]
3.稀释液c配制:50mm乙酸铵。
[0145]
4.活化液(第二活化液)/淋洗液(第一淋洗液)配制:精密称量0.77g乙酸铵,用500ml超纯水溶解,混合均匀,即得到20mm乙酸铵溶液。
[0146]
5.洗脱液配制:乙腈/水:98/2(含有2%甲酸,0.01%bht)。
[0147]
6.复溶液配制:0.1%甲酸水溶液。
[0148]
7.流动相a:移取0.5ml甲酸加入到500ml超纯水中,混合均匀,超声5min,去除气泡。
[0149]
8.流动相b:移取0.5ml甲酸加入到500ml甲醇中,混合均匀,超声5min,去除气泡。
[0150]
(三)样品处理方法
[0151]
1.校准品工作液的配制:s1~s6溶液的配制:取校准品c1~c6各50μl,分别加入纯化水450μl,涡旋混匀,即得。
[0152]
表5校准品工作液浓度
[0153][0154]
2.质控品工作液配制
[0155]
2.1血浆质控品工作液的配制:取质控品qcⅰ50μl,再加入稀释液a 450μl,混合均匀,即得p-lqc;取质控品qcⅱ50μl,再加入稀释液a 450μl,混合均匀,即得p-hqc。
[0156]
2.2尿液质控品工作液的配制:取质控品qcⅱ100μl,再加入稀释液b 400μl,混合均匀,即得u-lqc;取质控品qcⅲ100μl,再加入稀释液b 400μl,混合均匀,即得u-hqc。
[0157]
表6质控品工作液浓度
[0158]
pg/ml血-lqc血-hqc尿-lqc尿-hqc3-mt402004003000mn804008006000nmn804008006000da10050010007500e2001000200015000ne5002500500037500
[0159]
3.较准品/质控品/待测样品预处理:
[0160]
待检测样本:血浆样本恢复至室温;尿液样本恢复至室温,移取10μl尿液,加入990μl超纯水,混合均匀。
[0161]
准确吸取500μl校准品s1~s6/质控品工作溶液/待测样本于1.5ml离心管中,加入50μl内标,混合均匀,再加入稀释液c 300μl,混合均匀。
[0162]
4.上机样本制备:
[0163]
(1)spe板活化:在固相萃取装置内放入废液槽,将96孔固相萃取板(agela cleanert pwcx 96well microplates)放入装置上,先往每个小孔内加入300μl甲醇,正压抽干,然后加入300μl 20mm乙酸铵(活化液),正压抽干。
[0164]
(2)加载样品:将经预处理的样本全部加入步骤(1)中的96孔固相萃取板,正压抽干。
[0165]
(3)淋洗:向96孔固相萃取板中加入500μl 20mm乙酸铵(淋洗液1),正压抽干;再加入500μl甲醇,正压抽干。
[0166]
(4)洗脱:将废液槽取出,换成样品收集板,加入150μl洗脱液,正压压下,洗脱两次,合并收集,总洗脱体积300μl。
[0167]
(5)氮吹:上步的收集板置于氮吹仪中,25℃氮气吹干。
[0168]
(6)复溶:精密移取100μl复溶液,分别加到吹干的各孔中。
[0169]
(7)震荡:盖上96孔板垫/封口膜,置于96孔板混匀仪中,1500rpm充分震荡3min,混合均匀。
[0170]
(8)检测:将96孔板置于lc-ms/ms中,进行检测。
[0171]
(四)lc-ms/ms分析
[0172]
1.液相方法
[0173]
表7
[0174][0175][0176]
2.质谱参数
[0177]
表8质谱参数
[0178][0179]
3.离子信息
[0180]
表9
[0181][0182]
化合物通道标*作为定量离子。
[0183]
采用上述检测方法检测样本的图谱如图1所示,化合物出峰依次是去甲肾上腺素、肾上腺素、去甲变肾上腺素、多巴胺、变肾上腺素、3-甲氧基酪胺。
[0184]
实施例2~6
[0185]
实施例2~6与实施例1的区别仅为稀释液c分别依次为20mm乙酸铵、20mm甲酸铵(含0.1%甲酸)和50mm甲酸铵(含0.1%甲酸),结果见下表。
[0186]
表10
[0187][0188]
实施例7~9
[0189]
实施例7~9与实施例1的区别仅在于复溶液分别依次为水、0.5%甲酸水溶液和1%甲酸水溶液,结果见下表。
[0190]
表11
[0191]
复溶液daenenmnmn3-mt0.5%甲酸水溶液3.84e 054.70e 041.05e 062.14e 042.47e 052.39e 051%甲酸水溶液3.83e 074.99e 041.05e 062.20e 042.88e 052.41e 05水2.26e 051.35e 045.79e 052.17e 052.18e 052.17e 05
[0192]
实施例10~12
[0193]
实施例10~12与实施例1的区别仅在于较准品/质控品/待测样品预处理步骤中稀释液c的加入量分别依次为100μl、200μl、和500μl,结果见下表。
[0194]
表12
[0195]
化合物300μl100μl200μl500μlda9.42e 058.93e 059.98e 054.12e 05e8.29e 057.47e 058.16e 055.21e 05ne1.28e 069.88e 051.34e 069.74e 05nmn2.71e 062.20e 062.38e 062.21e 06mn1.97e 062.01e 062.04e 061.10e 063-mt2.16e 062.18e 062.22e 061.23e 06
[0196]
实施例13~14
[0197]
实施例13~14与实施例1的区别仅在于色谱柱分别依次为酰胺柱(amide 2.5μm,2.1*100mm)和五氟苯基柱(f5 2.6μm,3.0*100mm)。
[0198]
实施例13的图谱如图2所示,化合物出峰依次是3-甲氧基酪胺、变肾上腺素、多巴胺、去甲变肾上腺素、肾上腺素和去甲肾上腺素。
[0199]
实施例14的图谱如图3所示,化合物出峰依次是去甲肾上腺素、肾上腺素、去甲变肾上腺素、多巴胺、变肾上腺素、3-甲氧基酪胺。
[0200]
实施例15
[0201]
实施例15与实施例1的区别仅在于洗脱液不含有bht,结果见下表。
[0202]
表13
[0203]
洗脱液daenenmnmn3-mt乙腈/水/甲酸 bht5.58e 048.79e 046.44e 045.88e 043.62e 043.23e 04乙腈/水/甲酸5.93e 041.09e 058.77e 045.74e 043.39e 043.26e 04
[0204]
效果例1
[0205]
线性
[0206]
1.验证方案:按照高通量检测人血浆和尿液中儿茶酚胺及其代谢物含量的方法,处理待测产品校准品s1~s6溶液,每个浓度重复测试3次。
[0207]
2.接受标准:线性回归的相关系数r应≥0.990。
[0208]
3.实验结果:
[0209]
表14
[0210]
[0211][0212]
4.结论:多巴胺、肾上腺素、去甲肾上腺素、去甲变肾上腺素、变肾上腺素和3-甲氧酪氨的线性回归的相关系数r均≥0.990,满足接受标准。
[0213]
效果例2
[0214]
重复性
[0215]
1.验证方法:使用已配制好的高低浓度样品,按照高通量检测血浆和尿液中儿茶酚胺及其代谢物含量的方法,每个样本重复测定10次。计算重复性的变异系数(cv)。
[0216]
2.接受标准:低值质控品的变异系数cv≤15%,高值质控品的变异系数cv≤15%。
[0217]
3.实验结果:
[0218]
表15
[0219][0220]
表16
[0221][0222]
4.结论:低值样本的变异系数cv≤15%,高值样本的变异系数cv≤15%,满足接受标准。
[0223]
效果例3
[0224]
准确度
[0225]
1.验证方案:
[0226]
血加标回收样本1配制:取质控品qcⅰ50μl,再加入人血浆450μl。
[0227]
血加标回收样本2配制:取质控品qcⅱ50μl,再加入人血浆450μl。
[0228]
尿加标回收样本1配制:取质控品qcⅱ100μl,再加入稀释尿液400μl。
[0229]
尿加标回收样本2配制:取质控品qcⅲ100μl,再加入稀释尿液400μl。
[0230]
2.接受标准:加标回收,靶值
±
15.0%范围内。
[0231]
3.实验结果:
[0232]
表17
[0233]
[0234][0235]
表18
[0236][0237]
表19
[0238]
[0239][0240]
表20
[0241][0242]
表21
[0243][0244][0245]
表22
[0246][0247]
4.结论:血加标回收样本1,血加标回收样本2,尿加标回收样本1,尿加标回收样本2,回收率基本在15%,满足接受标准。
[0248]
效果例4
[0249]
残留
[0250]
1.验证方案:分别取一定量残留工作液样品(c6)和空白溶液,进行前处理;通过先注射残留工作液样品,再连续注射5个空白溶液,并通过5个分析批的重复实验来评价残留。
[0251]
2.接受标准:空白基质的峰面积<20.0%lloq峰面积,内标不高于5%。
[0252]
3.实验结果:
[0253]
表23
[0254][0255][0256]
表24
[0257]
e化合物峰面积占比内标峰面积占比c63.91e 06/1.90e 06/c11.41e 04/2.58e 06/blank11.44e 0310.2%1.21e 030.0%blank21.11e 037.9%1.34e 030.1%blank34.19e 023.0%5.26e 030.2%
[0258]
表25
[0259]
ne化合物峰面积占比内标峰面积占比c61.03e 07/4.23e 06/c14.81e 04/6.29e 06/blank11.01e 032.1%1.31e 040.2%blank21.30e 032.7%9.26e 030.1%blank32.81e 035.8%1.13e 040.2%
[0260]
表26
[0261]
nmn化合物峰面积占比内标峰面积占比c61.85e 06/6.80e 05/c15.93e 03/7.79e 05/blank13.77e 026.3%4.04e 030.5%blank21.73e 022.9%1.43e 030.2%blank31.30e 022.2%2.18e 030.3%
[0262]
表27
[0263]
mn化合物峰面积占比内标峰面积占比c67.18e 06/1.94e 06/c13.08e 04/2.53e 06/blank14.55e 0314.8%3.89e 030.2%blank21.43e 034.7%n/an/ablank31.19e 033.9%5.38e 030.2%
[0264]
表28
[0265][0266][0267]
4.结论:空白基质的峰面积均<20.0%lloq峰面积,满足接受标准,内标不超过5%,满足接受标准。
[0268]
效果例5
[0269]
参考区间:参考梅奥实验室提供的范围:
[0270]
表29
[0271][0272]
最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。