1.本发明涉及硫化氢检测技术领域,尤其是涉及一种生物样本中硫化氢的检测方法及其应用。
背景技术:
2.硫化氢(hydrogen sulfide,硫化氢)是一种无机化合物,是一种无色的水溶性气体,并且有臭鸡蛋的味道。硫化氢是继一氧化氮no和一氧化碳co之后的第三种重要的内源性气体信号分子,硫化氢参与很多生理病理过程,现在已经有相关研究发现硫化氢在心血管系统,神经系统,消化系统,内分泌系统以及免疫系统等系统中有较为广泛的分布,参与许多生理和疾病的病理生理过程。有文献报道,硫化氢与骨代谢以及骨质疏松等骨疾病中也参与了重要的调控作用,硫化氢有望成为骨代谢以及骨相关疾病研究的新靶点,但是现在缺乏较为准确的方法来测量血清中硫化氢的含量。
3.目前,国内外硫化氢常用的检测方法有气相色谱法;电极法以及亚甲基蓝分光光度法。至今为止,气相色谱的方法优点是检测血清硫化氢含量的金标准,虽然气相色谱的敏感性高,特异性好,但是气象色谱的方法缺点是对于检测器,标准气和取样的技术都有较高的要求,气象色谱设备的要求较高,并且检测仪器较为昂贵,检测的时间也比较长,所以一般不作为临床与科研实验的推广。而电极法是通过强碱对样品的蛋白质结构进行破坏,然后通过检测s
2-而实现样品中硫化氢的含量,但是电极法对于样品量的需求量大,重复性也不太好,所以也没有将电极法广泛推广。亚甲基蓝分光光度法操作标记简单,所需要的试剂相对低廉,所用的检测时间也比较短,所需仪器也比较常见,但是分光光度法的敏感性较差,只有超过10μmol/l的硫化氢才能够利用分光光度计的方法被检测的到。因此,如何改进内源性硫化氢的检测方法,以提高硫化氢检测的准确度和灵敏度,是目前有待解决的问题。
4.有鉴于此,特提出本发明。
技术实现要素:
5.本发明的第一目的在于提供一种生物样本中硫化氢的检测方法,该方法具有检测速度快且准确度和灵敏度高的优点,缓解了现有技术存在的内源性硫化氢的检测方法准确度和灵敏度不足的技术问题。
6.本发明的第二目的在于提供一种上述生物样本中硫化氢的检测方法在制备用于治疗骨相关疾病的药品中的应用。
7.为解决上述技术问题,本发明特采用如下技术方案:
8.根据本发明的一个方面,本发明提供了一种生物样本中硫化氢的检测方法,所述检测方法包括对样本进行前处理,使样本中的硫化氢反应生成亚甲基蓝,然后采用lc-ms检测样本中的亚甲基蓝,将lc-ms检测获得的亚甲基蓝检测值带入标准曲线中,计算得到亚甲基蓝对应的硫化氢的含量;
9.所述前处理包括使用提取试剂与样本中的硫化氢反应,得到含有硫化锌的沉淀,
然后在酸性介质中和三价铁离子存在的条件下,与n,n-二甲基对苯二胺反应,生成亚甲基蓝;
10.所述提取试剂为氢氧化锌悬浊液。
11.优选地,所述氢氧化锌悬浊液为乙酸锌溶液和氢氧化钠溶液混合后得到的悬浊液;
12.优选地,乙酸锌溶液的浓度为1~2%w/v;氢氧化钠溶液的浓度为1~2m;乙酸锌溶液和氢氧化钠溶液的体积比为(5~10):1;
13.优选地,乙酸锌溶液的浓度为1%w/v;氢氧化钠溶液的浓度为1.5m;乙酸锌溶液和氢氧化钠溶液的体积比为7:1。
14.优选地,所述反应试剂为三氯化铁反应液和二甲基对苯二胺反应液混合得到的混合体系,且所述混合体系的使用方式为现用现混合;
15.优选地,三氯化铁反应液中三氯化铁的浓度为20~50mm,溶剂为浓盐酸和水的混合体系,其中水和浓盐酸的体积比为(8~10):1;
16.优选地,三氯化铁反应液中三氯化铁的浓度为30mm,溶剂为浓盐酸和水的混合体系,其中水和浓盐酸的体积比为9:1;
17.优选地,n,n-二甲基对苯二胺反应液中n,n-二甲基对苯二胺的浓度为15~25mm,其中水和浓盐酸的体积比为4:(5~8)。
18.优选地,n,n-二甲基对苯二胺反应液中n,n-二甲基对苯二胺的浓度为20mm,其中水和浓盐酸的体积比为4:6。
19.优选地,所述标准曲线按照如下方法构建:用于构建标准曲线的标准品为包括具有系列浓度的硫化钠标准曲线工作液,将各浓度的硫化钠标准曲线工作液分别与所述反应试剂反应生成亚甲基蓝,然后使用lc-ms检测硫化钠标准曲线工作液中的亚甲基蓝,得到检测值;然后构建亚甲基蓝检测值与对应的硫化钠标准曲线工作液中硫化钠的浓度的对应关系作为标准曲线;
20.优选地,所述硫化钠标准曲线工作液中硫化钠的浓度分布范围为0.78μm~100μm;
21.优选地,所述标准曲线以硫化钠标准曲线工作液中硫化钠的浓度为自变量,以亚甲基蓝响应峰面积为因变量,构建标准曲线。
22.优选地,所述硫化钠标准曲线工作液中的基质为保护液,所述保护液为含有金属螯合剂的碱性溶液;
23.优选地,所述金属螯合剂选自edta;
24.优选地,所述保护液为含有50μm edta和200mm氢氧化钠的水溶液。
25.优选地,液相色谱色谱柱采用氨基色谱柱,优选采用waters acquity uplc beh amide色谱柱;
26.优选地,柱温为35~45℃,优选为40℃;
27.优选地,检测环境温度为不超过20℃,优选为4℃;
28.优选地,进样体积为1~2μl,优选为1μl。
29.优选地,液相色谱采用梯度洗脱程序,流动相a和流动相b按照体积比,梯度洗脱程序为:
30.0.00min,流动相a 5%,流动相b 95%;
31.1.50min,流动相a 5%,流动相b 95%;
32.4.00min,流动相a 50%,流动相b 50%;
33.6.00min,流动相a 50%,流动相b 50%;
34.4.50min,流动相a 5%,流动相b 95%;
35.10.00min,流动相a 5%,流动相b 95%;
36.其中,流动相a为水相,流动相b为有机相;流动相中还含有甲酸和甲酸铵;
37.优选地,所述流动相a为含0.1%v/v甲酸和5mm甲酸铵的水溶液;
38.优选地,所述流动相b为90%v/v乙腈水溶液,还含有0.1%v/v甲酸和5mm甲酸铵。
39.优选地,所述质谱条件为:离子源:电喷雾离子源;正离子检测模式;三重四极杆分析器;扫描方式为多反应监测模式;
40.鞘气温度:300℃;鞘气流速:6l/min;干燥气温度:350℃;干燥气流速10l/min;毛细管电压4000v;锥孔电压:500v;亚甲基蓝母离子:284.1m/z;定量离子:268.1m/z,定性离子:251.9m/z;ce值:40v,55v;驻留时间:25ms。
41.优选地,所述生物样本包括血液或从血液中分离得到的成分;
42.优选地,所述生物样本为血清。
43.根据本发明的另一个方面,本发明还提供了一种上述血清中硫化氢的检测方法在制备用于治疗骨相关疾病的药品中的应用。
44.与现有技术相比,本发明具有如下有益效果:
45.本发明提供的生物样本中硫化氢的检测方法,包括先使生物样本中的硫化氢反应生成亚甲基蓝。然后采用lc-ms检测样本中的亚甲基蓝,然后将亚甲基蓝的检测值带入标准曲线中,计算得到亚甲基蓝对应的硫化氢的含量。
46.本发明改进了硫化氢反应生成亚甲基蓝的处理方式,采用氢氧化锌悬浊液作为提取试剂,增加了沉淀量,并使得硫化锌附着在氢氧化锌颗粒中,避免在分离上清时随上清吸弃,降低了样本中硫化氢的损失,提高了检测的准确度。
47.本发明采用lc-ms(色谱串联质谱)检测生产的亚甲基蓝,特异性高,灵敏性好,宽线性范围及高稳定性,本发明提供的生物样本中硫化氢的检测方法和目前广泛使用的分光光度法测定相比,有更低的检测下限和更高的稳定性,标准曲线定量下限可低至0.78μm,检测级别可以到达nmol/l,信噪比s/n》50。rsd值小于20%,精密度符合定量检测要求,并且还具有回收率高和检测时间短的优点。
附图说明
48.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
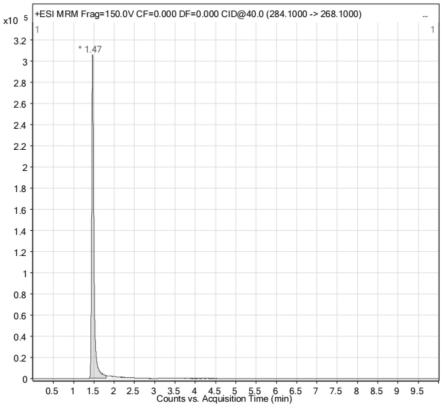
49.图1为实施例1提供的检测方法检测血清样本的亚甲基蓝色谱峰图;
50.图2为实施例1提供的检测方法检测标准品的亚甲基蓝色谱峰图;
51.图3为实施例2提供的检测方法检测血清样本的亚甲基蓝色谱峰图;
52.图4为实施例3提供的检测方法检测血清样本的亚甲基蓝色谱峰图。
具体实施方式
53.下面将结合实施例对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
54.根据本发明的一个方面,本发明提供了一种血清中硫化氢的检测方法。该检测方法包括:对样本进行前处理,使样本中的硫化氢反应生成亚甲基蓝,然后采用lc-ms检测样本中的亚甲基蓝,将lc-ms检测获得的亚甲基蓝检测值带入标准曲线中,计算得到亚甲基蓝对应的硫化氢的含量。
55.本发明的检测原理为,先使样本中的硫化氢反应生成亚甲基蓝,通过lc-ms方法检测样本中的亚甲基蓝,以替代难于检测的硫化氢。通过将亚甲基蓝lc-ms的检测值带入标准曲线,计算出对应的硫化氢含量,得到样本中的硫化氢含量。
56.样本前处理:
57.本发明提供的硫化氢的检测方法中,前处理的步骤的目的是,使样本中的硫化氢反应生成亚甲基蓝以用于lc-ms检测。硫化氢反应生成亚甲基蓝的原理是:使用氢氧化锌悬浊液吸收样品中的硫化氢,生成硫化锌,硫化锌在酸性介质中和三价铁离子存在下,同n,n-二甲基对苯二胺反应,生成稳定的亚甲基蓝。
58.本发明在前处理步骤中,改用氢氧化锌悬浊液作为提取试剂。由于血液中的硫化氢含量低,血样中的硫化氢反应生成的硫化锌沉淀是几乎看不到的,吸弃上清的步骤有极大概率吸走硫化锌沉淀,导致标准曲线和重复性都出现问题。因此本发明改进了提取试剂,将常规使用的1%乙酸锌溶液替换为氢氧化锌悬浊液,目的是增加沉淀量使得硫化锌附着在氢氧化锌颗粒中,避免固液分离步骤中随上清吸弃。
59.由于蛋白残留会堵住色谱柱,因此除去蛋白才能维持液相色谱体系的稳定。但采用本技术优选地色谱条件时,除蛋白试剂三氯乙酸和优选色谱体系并不兼容,会导致色谱峰出现毛刺和变形。由于改进了硫化锌的沉淀方式,去除了含蛋白的反应上清液,因此不再使用三氯乙酸。
60.提取试剂(氢氧化锌悬浊液)优选由1~2%w/v乙酸锌溶液与1~2m氢氧化钠溶液按照体积比(5~10):1混合后得到,更优选由1%w/v乙酸锌溶液与1.5m氢氧化钠溶液按照体积比7:1混合后得到。
61.在硫化锌与n,n-二甲基对苯二胺反应生成亚甲基蓝的步骤中,三价铁离子可选地为本领域任何可用于生成亚甲基蓝反应的能够供给三价铁离子的物质,优选由三氯化铁提供。酸性介质也可选地为本领域任何可用于为生成亚甲基蓝反应提供酸性环境的物质或体系,酸性介质优选由含有盐酸的体系提供。
62.在一些优选地实施方式中,硫化锌与n,n-二甲基对苯二胺反应生成亚甲基蓝的步骤优选包括:向含有硫化锌的沉淀中加入反应试剂;所述反应试剂由三氯化铁反应液和二甲基对苯二胺反应液混合得到的混合体系,且所述混合体系需现用现混合。
63.n,n-二甲基对苯二胺反应液中n,n-二甲基对苯二胺的浓度优选为15~25mm,更优选为20mm;所述n,n-二甲基对苯二胺反应液优选按照如下方法配制:将n,n-二甲基对苯二胺与水和浓盐酸的混合体系混合,使终体系中的n,n-二甲基对苯二胺的浓度为15~25mm;
水和浓盐酸的混合体系中水和浓盐酸的体积比优选为4:(5~8),更优选为4:6。
64.三氯化铁反应液中三氯化铁的浓度优选为20~50mm,更优选为30mm;所述三氯化铁反应液优选按照如下方法配制:将三氯化铁与水和浓盐酸的混合体系混合,使终体系中的三氯化铁的浓度为20~50mm;水和浓盐酸的混合体系中水和浓盐酸的体积比优选为(8~10):1,更优选为9:1。
65.由于生物样本中还含有细胞或细胞器碎及它们的碎片,以及蛋白、脂质、核酸和多糖等大分子,这些物质的去除可以包括本领域任选的可接受的方式,例如可以为但不限于包括调节ph以使不同等电点的物质分离、离心、沉淀、吸附、萃取、蛋白变性和絮凝等一种或多种分离、提取和纯化方式,本发明对此不做限制。
66.样本前处理的具体步骤优选按照如下进行:调节样本ph为9以上,此时离子为hs-,避免生成h2s挥发,再加入所述提取试剂混合均匀并超声,固液分离后留取沉淀并将沉淀复溶,再在酸性介质中和三价铁离子存在的条件下,与n,n-二甲基对苯二胺反应,生成亚甲基蓝。
67.以血液样本为例,对样本进行前处理的一个实施例如下:样本在冰水浴解冻,涡旋混匀,取50μl样本,加100μl浓度为1.5m的氢氧化钠溶液,涡旋混匀,再加入300μl提取试剂,涡旋混匀,冰水浴超声5min,在4℃,12000rpm离心15min,去除上清液,加入200μl纯水,再加入50μl反应试剂涡旋混匀,冰水浴超声5min,加入250μl甲醇,涡旋混匀,在4℃,12000rpm离心10min,取上清120μl上机检测。
68.上述实施例中提取试剂为1%乙酸锌溶液和1.5m氢氧化钠溶液按照体积比7:1混合得到悬浊液;
69.上述实施例中反应试剂为30mm三氯化铁反应液和20mm n,n-二甲基对苯二胺反应液按照体积比1:1混合得到的反应体系,且采用现用现混合的方式使用。30mm三氯化铁反应液的溶剂为按照体积比为9:1混合的纯水和浓盐酸;20mm n,n-二甲基对苯二胺反应液的溶剂为按照体积比为4:6混合的纯水和浓盐酸。
70.标准曲线
71.标准曲线用于建立样本中的硫化氢和亚甲基蓝经lc-ms检测后的检测值的对应关系。构建标准曲线主要包括配制标准品以及根据标准品的检测结果建立标准曲线。
72.标准品优选为含有系列浓度的硫化钠标准曲线工作液,硫化钠溶于水后生成hs-,后续反应也是硫化钠标准曲线工作液中hs-参加反应,因此硫化钠是供体,硫化钠反应生成亚甲基蓝为1:1转化,因此可以作为标准品使用。工作液中硫化钠的浓度分布优选为0.780μm~100μm。工作液优选由含有较高浓度的硫化钠的储备液经保护液稀释,优选按照梯度稀释,得到各浓度值的工作液。
73.硫化氢化学性质敏感容易被试剂中的金属杂质氧化且自身易挥发,为了保持其稳定存在需要碱性环境和金属离子螯合剂,因此保护液优选含有金属离子螯合剂edta,和用于提供碱性环境的氢氧化钠。所述保护液的优选组成为:含50μm edta和200mm氢氧化钠的水溶液。
74.采用lc-ms检测标准品,也需要先对标准品进行处理,使其中的已知浓度的硫化钠反应生成亚甲基蓝,然后获得标准品中亚甲基蓝的检测值,获取若干硫化钠浓度和对应的亚甲基蓝lc-ms检测值的成对数据,以构建标准曲线。
75.使标准品中的硫化钠生成亚甲基蓝和待测样本中生成亚甲基蓝的原理相同,因此也优选采用将硫化钠在酸性介质中和三价铁离子存在的条件下,与n,n-二甲基对苯二胺反应,生成亚甲基蓝;更优选将硫化钠与上述由含有三氯化铁反应液和含有n,n-二甲基对苯二胺反应液现用现混合的反应试剂反应生成亚甲基蓝。
76.标准曲线反应后采集色谱图,以亚甲基蓝(硫化钠)浓度为横坐标(x),以亚甲基蓝响应峰面积为纵坐标(y),权重为1/x,获得硫化氢的标准曲线方程。
77.色谱条件:
78.本发明提供的硫化氢的检测方法,采用lc-ms方法检测样本或标准品中反应生成的亚甲基蓝。lc-ms(高效液相色谱串联质谱法)方法具有特异性高,灵敏性好,宽线性范围及高稳定性的优点,其中色谱条件优选如下:
79.液相色谱色谱柱优选采用氨基色谱柱,本发明通过实验发现,相比于其他色谱柱,例如c18色谱柱和t3色谱柱,能够改善亚甲基蓝色谱峰拖尾现象,氨基色谱柱优选采用waters acquity uplc beh amide(100
×
2.1mm,1.7μm,waters)色谱柱。
80.其他反应条件优选如下:柱温为35~45℃,优选为40℃;检测环境温度为不超过20℃,优选为4℃;进样体积为1~2μl,优选为1μl。
81.洗脱程序优选采用梯度洗脱,流动相a和流动相b按照体积比,梯度洗脱程序优选如下:
82.0.00min,流动相a 5%,流动相b 95%;
83.1.50min,流动相a 5%,流动相b 95%;
84.4.00min,流动相a 50%,流动相b 50%;
85.6.00min,流动相a 50%,流动相b 50%;
86.4.50min,流动相a 5%,流动相b 95%;
87.10.00min,流动相a 5%,流动相b 95%;
88.其中,流动相a为水相,流动相b为有机相,流动相a和b中还含有甲酸和甲酸铵,加入甲酸铵盐用于调整流动相离子强度,流动相中加入甲酸铵可以进一步改进亚甲基蓝色谱峰的拖尾现象。
89.在一些优选地实施方式中,色谱柱采用waters acquity uplc beh amide色谱柱,流动相a为含0.1%v/v甲酸和5mm甲酸铵的水溶液;流动相b为90%v/v乙腈水溶液,还含有0.1%v/v甲酸和5mm甲酸铵。按照上述梯度洗脱程序洗脱,可得到尖锐对称峰型的亚甲基蓝色谱峰。
90.质谱条件优选如下:离子源:电喷雾离子源;正离子检测模式;三重四极杆分析器;扫描方式为多反应监测模式;
91.鞘气温度:300℃;鞘气流速:6l/min;干燥气温度:350℃;干燥气流速10l/min;毛细管电压4000v;锥孔电压:500v;亚甲基蓝母离子:284.1m/z;定量离子:268.1m/z,定性离子:251.9m/z;ce值:40v,55v;驻留时间:25ms。
92.需要说明的是,本发明提供的生物样本中硫化氢的检测方法是非诊断和治疗目的的,该检测方法所检测的生物样本例如可以为但不限于为但不限于为血液,或从血液中分离得到的成分,例如血浆或血清;或者其他体液;或者其他组织经预处理后可继续进行本发明的检测方法的生物样本。
93.根据本发明的另一个方面,本发明还提供了一种上述生物样本中硫化氢的检测方法在制备用于治疗骨相关疾病的药品中的应用。本发明提供的生物样本中硫化氢的检测方法能够快速、灵敏和准确的检测出生物样本中的硫化氢含量,硫化氢与骨代谢以及骨质疏松等骨疾病中参与了重要的调控作用,因此将上述检测方法应用于制备治疗骨相关疾病的药品,例如制备预防或治疗骨代谢或骨质疏松等疾病的药品中,能够提供一种快速且可靠的检测方法帮助判断药物的治疗效果。
94.下面结合优选实施例进一步说明本发明的技术方案和技术效果。
95.实验仪器
96.1290高效液相色谱仪(agilent);6460三重四极杆质谱仪(agilent);heraeus fresco17离心机(thermo fisher scientific);bsa124s-cw天平(sartorius);超声仪(深圳市方奥微电子有限公司)。
97.血清样本的采集:
98.采集研究对象为医院正常体检病人,1200
×
g离心10分钟分离血清。测定血清的硫化氢水平收集在红色抗凝管中,利用分离胶将血清分离。离心好的血清保存于1.5ml的离心管中,尽快离心以分离血清,并且保存于-80℃冷冻保存。
99.实验试剂
100.乙酸锌(纯度99.99%),九水合硫化钠(纯度99.99%),三氯化铁(纯度99.9%)购于上海阿拉丁生化科技股份有限公司;n,n-二甲基对苯二胺(纯度97%)购于北京百灵威科技有限公司;edta(纯度99.9%)购于sigma aldrich有限公司;亚甲基蓝购于medmol公司;浓盐酸,氨水购于fisher scientific公司;甲酸铵(纯度97%),甲酸(纯度98%),乙腈(lc-ms级),甲醇(lc-ms级)购于上海上海安谱实验科技股份有限公司;超纯水由超纯水机制备。
101.试剂配制:
102.1.硫化钠保护液:天平精准称量0.146g edta和0.8g氢氧化钠于100ml容量瓶中,加入纯水定容至刻度,上下颠倒容量瓶均匀溶解粉末,即为硫化钠保护液,含50μm edta和200mm氢氧化钠。
103.2.硫化钠储备液:天平精准称量0.240g九水合硫化钠于100ml容量瓶中,加入硫化钠保护液定容至刻度,上下颠倒容量瓶均匀溶解粉末,即为10mm硫化钠储备液,此溶液现配现用。
104.3.30mm三氯化铁反应液:天平精准称量48.7mg三氯化铁于10ml容量瓶中,加入预混的纯水:浓盐酸,v:v=9:1定容至刻度,上下颠倒容量瓶均匀溶解粉末,即为30mm三氯化铁反应液。
105.4.20mm n,n-二甲基对苯二胺反应液:天平精准称量27.2mg n,n-二甲基对苯二胺于10ml容量瓶中,加入预混的纯水:浓盐酸,v:v=4:6定容至刻度,上下颠倒容量瓶均匀溶解粉末,即为20mm n,n-二甲基对苯二胺反应液。
106.5.1%乙酸锌反应液:天平精准称量100mg乙酸锌于10ml容量瓶中,加入纯水定容至刻度,上下颠倒容量瓶均匀溶解粉末,即为1%乙酸锌反应液。
107.6.1.5m氢氧化钠溶液:天平精准称量0.6g氢氧化钠粉末于10ml容量瓶中,加入纯水定容至刻度,上下颠倒容量瓶均匀溶解粉末,即为1.5m氢氧化钠溶液。
108.实施例1
109.本实施例提供了一种血清中硫化氢的检测方法,包括:
110.1.配制硫化钠标准曲线工作液:精准量取10mm硫化钠储备液10μl至1ml容量瓶,加入硫化钠保护液定容至刻度,上下颠倒容量瓶使其均匀溶解,即为硫化钠标准曲线最高点s1,浓度为100μm。将s1精准量取500μl至1ml容量瓶,加入硫化钠保护液定容至刻度,上下颠倒容量瓶使其均匀溶解,即为硫化钠标准曲线次高点s2。按照上述步骤逐级稀释最终到s8,得到硫化钠标准曲线工作液,s1~s8浓度分别为100μm,50μm,25μm,12.5μm,6.25μm,3.13μm,1.56μm,0.78μm。
111.2.样本前处理:
112.样本在冰水浴解冻,涡旋混匀,取50μl样本,加100μl浓度为1.5m的氢氧化钠溶液,涡旋混匀,再加入300μl提取试剂(1%乙酸锌溶液:1.5m氢氧化钠溶液,v:v=7:1,悬浊液),涡旋混匀,冰水浴超声5min,在4℃,12000rpm离心15min,去除上清液,加入200μl纯水,再加入50μl反应试剂(n,n-二甲基对苯二胺:三氯化铁,v:v=1:1,现用现混),涡旋混匀,冰水浴超声5min,加入250μl甲醇,涡旋混匀,在4℃,12000rpm离心10min,取上清120μl上机检测。
113.3.硫化钠标准曲线工作液反应:分别取标准曲线各个点溶液50μl,加150μl纯水,涡旋混匀,再加入50μl反应试剂(n,n-二甲基对苯二胺:三氯化铁,v:v=1:1,现用现混),涡旋混匀,冰水浴超声5min,加入250μl甲醇,涡旋混匀,在4℃,12000rpm离心10min,取上清120μl上机检测。
114.4.色谱条件:
115.色谱柱:waters acquity uplc beh amide(100
×
2.1mm,1.7μm,waters)。
116.流动相a:水溶液含0.1%甲酸及5mm甲酸铵。
117.流动相b:90%乙腈水溶液含0.1%甲酸及5mm甲酸铵。
118.柱温40℃,样品室温度4℃,进样体积1μl。
119.洗脱梯度见表1
120.表1 液相梯度洗脱条件
121.time(min)a相(%)b相(%)0.005951.505954.0050506.0050506.5059510.00595
122.5.质谱条件:
123.离子源为电喷雾离子源(esi),正离子检测模式;三重四极杆分析器;扫描方式为多反应监测模式(multiple reaction monitoring,mrm)。鞘气温度:300℃;鞘气流速:6l/min;干燥气温度:350℃;干燥气流速10l/min;毛细管电压4000v;锥孔电压:500v;亚甲基蓝母离子:284.1m/z;子离子:268.1m/z(定量离子),251.9m/z(定性离子)ce值:40v,55v;驻留时间:25ms。
124.6.构建标准曲线:
125.标准曲线反应后采集色谱图,以亚甲基蓝(硫化钠)浓度为横坐标(x),以亚甲基蓝响应峰面积为纵坐标(y),权重为1/x,获得硫化氢的标准曲线方程y=30.208678x 4938.01,r2=0.9985,标准曲线全部点的准确率均大于80%,符合定量检测要求。标准曲线定量下限为0.78μm,信噪比s/n》50。
126.将样本的亚甲基蓝响应峰面积带入标准曲线y中,得到x值即为样本中硫化氢的浓度。
127.采用实施例1方法检测样本,标准品的色谱图见图1;血清样本中的色谱图见图2。保留时间为1.47min,由图1和图2可知亚甲基蓝色谱峰型对称且尖锐。
128.实施例2
129.实施例2与实施例1的区别仅在于,使用的色谱柱为c18柱,采用实施例2方法检测标准品的色谱图见图3所示,可以看出采用c18柱亚甲基蓝色谱峰存在拖尾现象且峰宽较大。图3中曲线1离子对为284m/z~268m/z;曲线2离子对为284m/z~252m/z。
130.实施例3
131.实施例1与实施例1的区别仅在于,使用的色谱柱为t3柱,采用实施例2方法检测标准品的色谱图见图3所示,可以看出采用t3柱亚甲基蓝色谱峰存在拖尾现象且峰宽较大。图4中曲线1离子对为284m/z~268m/z;曲线2离子对为284m/z~252m/z。
132.对比例1
133.对比例1为采用分光光度法检测待测样本,与实施例1的区别仅在于,实施例1采用lc-ms法检测样本,对比例1采用酶标仪测定同一样本,样本处理方法和实施例1相同。
134.效果例1
135.精密度和准确度:
136.使用多个血浆混合制备质控血浆样本,将质控血浆样本分为6份,其中3份独立按照步骤2(样本前处理)进行反应,测定其浓度并计算其rsd值;另外3份质控血浆加入硫化钠工作液(浓度:)独立按照步骤2(样本前处理)进行反应,测定其浓度并计算其rsd值。同时使用纯水加入硫化钠工作液进行3次独立反应测定其浓度并计算其rsd值。质控血浆rsd值为8.77%,质控血浆加标rsd值为4.58%,纯水加标rsd值为8.23%,均小于20%,精密度符合定量检测要求。另用上述数据测定加标回收率为103.5%,即(质控血浆加标测定均值-质控血浆测定均值)/纯水加标测定均值,准确度符合定量检测要求。
137.表2
138.139.效果例2
140.实施例1在完成硫化氢生成亚甲基蓝的反应后,将同一份样本分别使用了lc-ms法和对比例1的分光光度法进行测试。两种方法的标曲均有良好的线性,而lc-ms体系有着更低的定量下限。标准曲线的最后一个点s8(浓度0.78μm)在lc-ms体系中的准确度为89.43%,仍符合定量标准。同比分光光度计测定标准曲线的最后一个点s8的准确度为195.91%,已经无法使用。此外,分光光度法由于酶标仪的边缘效应还存在空白波动大的问题,三次空白平行测定的最大值和最小值的差值(δ0.0035)已经大于其检测下限s7(1.56μm)的吸光值(δ0.0027)。
141.最后应说明的是:以上各实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述各实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分或者全部技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。