1.本发明涉及核酸检测技术领域,尤其涉及一种核酸提取芯片、细菌微流控集成检测平台及检测方法。
背景技术:
2.细菌性疾病仍然是一类严重威胁人类健康的疾病。传统的细菌鉴定需要增菌、选择性培养和生化鉴定等3个步骤,是检测细菌的“金标准”,但其缺点是耗时长(3~5天),且检测灵敏度低,无法对疫病的爆发做出快速准确的响应,不能满足现场即时检测的要求。随着分子生物学技术的不断发展,在分子水平上研究生物大分子,特别是核酸,并以此建立的众多检测技术,已成为备受瞩目的革命新产物,并逐步应用于细菌的快速鉴定过程中。
3.核酸提取是进行生物反应的基础,关系到下游扩增的准确性和时效性。目前常采用的过柱式方法,虽然能够获得一定纯度的dna,但需要多次离心,对样品需求量大,不利于自动化操作,且对操作人员的健康具有潜在的危害。微流控芯片具有尺寸小、试剂用量少、高通量、耗时短等优点,在核酸检测领域具有一定的潜力。此外,在核酸扩增方面,重组酶聚合酶恒温扩增(recombinase polymerase amplification,简称rpa)是一种等温扩增技术,可在37~42℃室温条件下进行反应,反应时间只需10-20min,适用于现场检测,具有取代pcr的趋势。
4.综上所述,需要设计一种核酸提取芯片以及集成核酸提取和检测于一体的微流控平台,解决当前细菌检测技术中存在的过程繁琐、时间和人力成本高等问题。
技术实现要素:
5.针对上述现有技术中细菌检测过程繁琐、时间和人力成本高的不足,本发明的目的在于提供一种核酸提取芯片,对样品和试剂的需求量更少、耗时更短、降低了检测人员感染风险,提高了提取效率。
6.本发明提供的核酸提取芯片,包括从上至下依次紧密贴合的分流层、过滤层和聚流层;所述分流层具有进样口,所述进样口通过多个第一微通道分别连通多个分流口;所述过滤层包括滤纸,所述滤纸用于富集核酸;所述聚流层具有出样口,所述出样口通过多个第二微通道分别连通多个聚流口,所述聚流口的设置数量、分布位置均与所述分流口相对应;所述进样口、所述第一微通道、所述分流口、所述聚流口、所述第二微通道以及所述出样口依次连通,所述滤纸设置在所述聚流口和所述分流口之间。
7.通过将核酸提取芯片设计为上下多层的结构,充分利用纵向空间,有利于芯片微型化,并从进样口进入的待检测样品分流扩散到多个分流口,有效扩大了样品加热裂解、纯化、洗脱的处理空间和面积,从而有效提高的核酸提取效率。相较于传统的细菌核酸提取方法,本发明提供的核酸提取芯片微流控集成平台对样品和试剂的需求量更少、耗时更短、降低了检测人员感染风险,提高了提取效率。
8.优选地,所述过滤层还包括两个支撑层,所述支撑层上设置有多个支撑单元,所述
支撑单元的设置数量、分布位置均与所述分流口以及所述聚流口相对应;每个支撑单元内间隔设置有多个支撑柱以及通孔,所述通孔用于连通聚流口或分流口,两个支撑层上的支撑单元相对设置并夹持所述滤纸。
9.优选地,所述滤纸为玻璃纤维滤纸或whatman no.1滤纸,纸的孔径为0.5~1.0μm,该孔径范围内的滤纸,可在确保提取效果的同时,可兼顾提取速率。
10.本发明还提供了一种细菌微流控集成检测平台,包括细菌裂解单元和核酸扩增反应单元;所述的细菌裂解单元包括如权利要求1-3中任一项所述的核酸提取芯片和第一温控模块,所述第一温控模块用于控制所述核酸提取芯片的温度;所述核酸扩增反应单元用于将所述细菌裂解单元提取获得的核酸进行恒温扩增和检测。
11.该微流控集成平台对样品和试剂的需求量更少、耗时更短、降低了检测人员感染风险,提高了提取效率。采用等温扩增方法,不需要核酸变性步骤,灵敏度高,并将试剂预先冻干包埋在反应孔中,简化了操作流程。
12.优选地,所述核酸扩增反应单元包括样品检测芯片和第二温控模块,所述第二温控模块用于控制所述样品检测芯片的温度,所述样品检测芯片用于将所述细菌裂解单元提取获得的核酸进行恒温扩增和检测。
13.优选地,所述样品检测芯片具有进样孔,所述进样孔通过第三微通道连通至少一对并联的反应检测孔和阴阳性对照孔,所述反应检测孔内预埋有rpa核酸扩增试剂,所述rpa核酸扩增试剂包括rpa缓冲液、目标细菌靶基因的特异性引物和荧光探针。
14.优选地,rpa核酸扩增试剂在-80℃下冷冻干燥,然后封装于反应检测孔中。
15.优选地,还包括壳体和信号读取单元;所述信号读取单元包括荧光激发光源和图像采集装置;所述荧光激发光源和所述核酸扩增反应单元设置在所述壳体内,所述图像采集装置用于采集核酸恒温扩增和检查过程中的荧光信号。
16.优选地,所述荧光激发光源发出的光束与所述样品检测芯片的夹角为7~9
°
。
17.优选地,还包括第一滤光片和第二滤光片,所述第一滤光片设置在荧光激发光源与所述核酸扩增反应单元之间,所述第一滤光片的透射波段为蓝光波段;所述第二滤光片设置在所述核酸扩增反应单元和所述图像采集装置之间,所述第二滤光片的透射波段为绿光波段。
18.优选地,所述壳体包括下壳体和上壳体;所述下壳体用于装载所述细菌裂解单元和所述核酸扩增反应单元;所述上壳体扣合在所述下壳体上,所述荧光激发光源设置在所述上壳体内并位于所述所述核酸扩增反应单元的侧上方,所述上壳体上还开设有一通孔,所述通孔位于所述所述核酸扩增反应单元的正上方,所述图像采集装置设置在所述壳体外部并通过所述通孔采集核酸恒温扩增和检查过程中的荧光强度。
19.优选地,所述下壳体设置有第一装载模块、第二装载模块、导液管和废液收集装置;
20.所述第一装载模块包括具有上开口的第一安装槽以及具有侧开口的第二安装槽;所述第一安装槽用于安装所述核酸提取芯片,所述第一安装槽的底部开设有排液口;第二安装槽用于安装所述第一温控模块;
21.所述第二装载模块设置在所述第一装载模块的侧下方,所述第二装载模块包括具有上开口的第三安装槽和具有侧开口的第四安装槽;所述第三安装槽用于安装所述样品检
测芯片;第四安装槽用于安装所述第二温控模块;
22.所述导液管的一端连接所述排液口,另一端连接所述废液收集装置或所述样品检测芯片。
23.优选地,所述第一温控模块和所述第二温控模块均包括相连接的硅橡胶加热板和加热控制器。
24.本发明还提供了一种细菌检测方法,采用如上所述的细菌微流控集成检测平台进行检测,首先将细菌培养液注入到核酸提取芯片内,经过加热裂解、纯化、洗脱后得到核酸;将得到的核酸引入到核酸扩增反应单元进行核酸进行恒温扩增和检测。
25.优选地,在70~100℃下恒温加热至少30min进行裂解;在37~42℃下恒温加热10~20min进行恒温扩增和检测。
26.与现有技术相比,本发明提供的核酸提取芯片、细菌微流控集成检测平台和检测方法,对样品和试剂的需求量更少、耗时更短、降低了检测人员感染风险,提高了提取效率。
27.(1)相较于传统的细菌核酸提取方法,该微流控集成平台对样品和试剂的需求量更少、耗时更短、降低了检测人员感染风险,提高了提取效率。
28.(2)采用等温扩增方法,不需要核酸变性步骤,灵敏度高,并将试剂预先冻干包埋在反应孔中,简化了操作流程。
29.(3)与智能化设备相结合,更加便于该微流控集成平台的推广和使用,适宜于食品安全、临床检验、环境监测等领域。
30.上述技术特征可以各种适合的方式组合或由等效的技术特征来替代,只要能够达到本发明的目的。
附图说明
31.在下文中将基于仅为非限定性的实施例并参考附图来对本发明进行更详细的描述。其中:
32.图1为本发明一实施例提供的核酸提取芯片的分解图;
33.图2为本发明一实施例提供的样品检测芯片的分解图;
34.图3为本发明一实施例提供的细菌微流控集成检测平台的分解图;
35.图4为本发明一实施例提供的壳体的分解图;
36.图5为本发明一实施例提供的下壳体内侧的结构示意图;
37.图6为本发明一实施例提供的细菌微流控集成检测平台的的光路示意图。
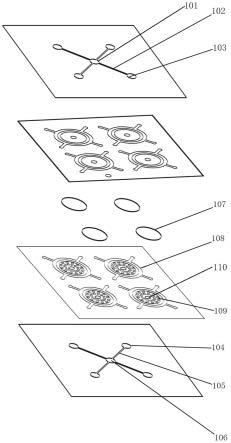
38.附图标记说明:
39.100、核酸提取芯片;101、进样口;102、第一微通道;103、分流口;104、聚流口;105、第二微通道;106、出样口;107、滤纸;108、支撑单元;109、支撑柱;110、通孔;200、样品检测芯片;201、进样孔;202、第三微通道;203、反应检测孔;204、阴阳性对照孔;205、基底层;300、第一温控模块;400、第二温控模块;500、led激发光源;600、图像采集装置;700、下壳体;701、第一安装槽、702、第二安装槽;703、第三安装槽;704、第四安装槽;705、排液口;706、废液收集装置;800、上壳体;801、卡槽;802、通孔;901、第一滤光片;902、第二滤光片。
具体实施方式
40.为使本发明的目的、技术方案和优点更加清楚,下面将对本发明的技术方案进行清楚、完整的描述,基于本发明中的具体实施方式,本领域普通技术人员在没有做出创造性劳动的前提下所得到的所有其它实施方式,都属于本发明所保护的范围。
41.本公开中使用的“第一”、“第二”以及类似的词语并不表示任何顺序、数量或者重要性,而只是用来区分不同的部分。“包括”或者“包含”等类似的词语意指在该词前的要素涵盖在该词后列举的要素,并不排除也涵盖其他要素的可能。“上”、“下”、“左”、“右”等仅用于表示相对位置关系,当被描述对象的绝对位置改变后,则该相对位置关系也可能相应地改变。
42.在本公开中,当描述到特定器件位于第一器件和第二器件之间时,在该特定器件与第一器件或第二器件之间可以存在居间器件,也可以不存在居间器件。当描述到特定器件连接其它器件时,该特定器件可以与所述其它器件直接连接而不具有居间器件,也可以不与所述其它器件直接连接而具有居间器件。
43.本公开使用的所有术语(包括技术术语或者科学术语)与本公开所属领域的普通技术人员理解的含义相同,除非另外特别定义。还应当理解,在诸如通用字典中定义的术语应当被解释为具有与它们在相关技术的上下文中的含义相一致的含义,而不应用理想化或极度形式化的意义来解释,除非这里明确地这样定义。
44.如图1所示,核酸提取芯片100包括从上至下依次紧密贴合的分流层、过滤层和聚流层。
45.分流层的中心位置设置有一个进样口101,进样口101的四周均匀分布有多个分流口103和多条第一微通道102,分流口103和第一微通道102的设置数量一致。本实施例中,设置四个分流口103和四条第一微通道102,四条第一微通道102分别将四个分流口103与进样口101相连通。进样口101的直径优选为1~5mm,第一微通道102的宽深比优选为1:6。
46.聚流层的中心位置设置有一个出样口106,出样口106的四周均匀分布有多个聚流口104和多条第二微通道105,聚流口104以及第二微通道105的设置数量与分流口103的设置数量一致。本实施例中,设置四条第二微通道105分别将四个聚流口104与出样口106相连通,聚流层上的四个聚流口104的分布位置均与分流层上的分流口103的分布位置相对应。出样口106的直径优选为1~5mm,第二微通道105的宽深比优选为1:6。
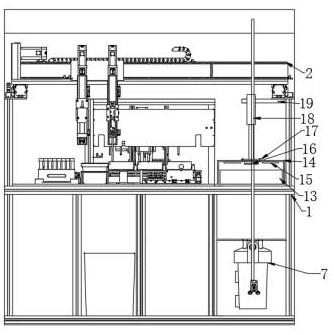
47.过滤层包括上下两个支撑层以及夹装在两个支撑层之间的滤纸107,上下两个支撑层通过等离子体氧化处理而永久键合。两个支撑层的结构相同,每个支撑层上均设置有多个支撑单元108,支撑单元108的设置数量与分流口103的设置数量一致。本实施例中,设置四个支撑单元108,四个支撑单元108分布位置与分流口103和聚流口104的分布位置相对应。每个支撑单元108内间隔设置有多个支撑柱109以及通孔110,两个支撑层上的支撑单元108相对设置,两个支撑层上的支撑柱109相互配合夹持滤纸107,滤纸107用于富集核酸。通过设置支撑柱109来支撑滤纸107,有利于滤纸107上下形成压差从而提高过滤效率。对于上方的支撑层,其支撑单元108在位置上垂直于顶部的分流口103,在面积上大于对应的分流口103,其上的通孔110与分流口103相连通;对于下方的支撑层,其支撑单元108在位置上垂直于底部的聚流口104,在面积上大于对应的聚流口104,其通孔110与聚流口104相连通。分流层、过滤层和聚流层依次紧密贴合,使进样口101依次通过第一微通道102、分流口103、滤
纸107、聚流口104、第二微通道105与出样口106相连通,形成从进样口101到出样口106的通道。通过将从进样口101进入的待检测样品分流扩散到多个分流口103,有效扩大了样品加热裂解、纯化、洗脱的处理空间和面积,从而有效提高的核酸提取效率。相较于传统的细菌核酸提取方法,本发明提供的核酸提取芯片100微流控集成平台对样品和试剂的需求量更少、耗时更短、降低了检测人员感染风险,提高了提取效率。
48.上述实施方式中,滤纸107优选核酸富集滤纸107,优选采用玻璃纤维滤纸或whatman no.1滤纸。滤纸107的直径优选3~15mm,孔径优选0.5~1.0μm;更有选地,滤纸107的直径优选5~9mm,孔径优选0.7~0.9μm。支撑柱109的高度优选50~500μm,直径优选为0.5~5mm;更优选地,支撑柱109的高度优选100~300μm,直径优选为1~3mm。
49.本发明提供的核酸提取芯片100,可应用于细菌微流控集成检测平台。
50.如图3所示,本发明提供的细菌微流控集成检测平台主要包括细菌裂解单元和核酸扩增反应单元。细菌裂解单元用于提取细菌中的核酸,核酸扩增反应单元用于将细菌裂解单元提取获得的核酸进行恒温扩增和检测。
51.细菌裂解单元包括第一温控模块300和本发明提供的核酸提取芯片100,第一温控模块300用于控制核酸提取芯片100的温度。核酸扩增反应单元包括样品检测芯片200和第二温控模块400,第二温控模块400用于控制样品检测芯片200的温度,样品检测芯片200用于将细菌裂解单元提取获得的核酸进行恒温扩增和检测。
52.如图2所示,样品检测芯片200的包括键合为一体的顶层和基底层205。顶层的中心位置设置有一个进样孔201,进样孔201的四周均匀分布有多条第三微通道202和多对并联的反应检测孔203和阴阳性对照孔204,反应检测孔203内预埋有rpa核酸扩增试剂,rpa核酸扩增试剂包括rpa缓冲液、目标细菌靶基因的特异性引物和荧光探针。优选rpa核酸扩增试剂在-80℃下冷冻干燥形成冻干剂,然后封装于反应检测孔203中。反应检测孔203和阴阳性对照孔204的设置数量根据需要检测的病原菌的类型数量来确定。样品检测芯片200上,优选地,进样孔201、第三微通道202、反应检测孔203和阴阳性对照孔204四者分布呈中心对称图形,进样孔201的直径优选为1~5mm,第三微通道202的宽深比优选为2:10,反应检测孔203和阴阳性对照孔204的直径优选为1~8mm。
53.第一温控模块300和第二温控模块400均包括相连接的硅橡胶加热板和加热控制器,加热功率优选为0.01-2w/cm2。
54.为了便于读取检测结果,细菌微流控集成检测平台还设置有信号读取单元,为了便于各个部件的组装、保护零部件、遮蔽外部环境的光线以确保信号读取的准确性,还可增设壳体。如图4、图5所示,壳体上包括可相互扣合为一体的下壳体700和上壳体800。下壳体700用于装载细菌裂解单元和核酸扩增反应单元。信号读取单元包括荧光激发光源和图像采集装置600;其中荧光激发光源设置在上壳体800内,其发出的光照射在样品检测芯片200上,图像采集装置600则用于采集核酸恒温扩增和检查过程中的荧光信号。
55.具体地,下壳体700设置有第一装载模块、第二装载模块、导液管和废液收集装置706。
56.第一装载模块用于装载细菌裂解单元,它包括具有上开口的第一安装槽701以及具有侧开口的第二安装槽702。第一安装槽701用于安装核酸提取芯片100,它的宽度和长度大于核酸提取芯片100,深度优选为10~15mm;第一安装槽701的底部的中心位置还开设有
排液口705,排液口705用于导液管(图中未示出)的穿过,排液口705的直径优选为1~2mm。第二安装槽702用于安装第一温控模块300的硅橡胶加热板。
57.第二装载模块包括具有上开口的第三安装槽703和具有侧开口的第四安装槽704。第三安装槽703用于安装样品检测芯片200,它的宽度和长度大于样品检测芯片200,深度优选为5~10mm;第四安装槽704用于安装第二温控模块400的硅橡胶加热板。优选将第二装载模块设置在第一装载模块的侧下方,以便于样品提取芯片中排出的流体在重力的作用下进入样品检测芯片200内,
58.第一装载模块和第二装载模块之间设置废液收集装置706,在一些实施方式中,废液收集装置706包括离心管放置槽,添加离心管用于废液的收集。
59.导液管的一端连接排液口705,另一端可选择地连接废液收集装置706或样品检测芯片200的进样孔201。
60.上壳体800内设置有用于安装荧光激发光源的卡槽801,当上壳体800扣合在下壳体700上时,荧光激发光源位于核酸扩增反应单元的侧上方。荧光激发光源优选为led激发光源500。荧光激发光源需要在检测芯片平面形成一个面光源,加上需要考虑光源的散射情况,为提高信号读取的准确性,荧光激发光源发出的光束与样品检测芯片200的夹角优选为5~10
°
,进一步优选为7~9
°
,荧光激发光源在样品检测芯片200所在平面形成2~4mm的光斑。上壳体800上还开设有一通孔802,当上壳体800扣合在下壳体700上时,通孔802位于核酸扩增反应单元的正上方,该通孔802与样品检测芯片200的距离优选为5~8cm,进一步优选为6~7cm。图像采集装置600设置在壳体外部并通过通孔802对样品检测芯片200进行拍摄,以此采集核酸恒温扩增和检查过程中的荧光信号。图像采集装置600可以是手机、平板或摄像机等可进行视频录制的设备。录制的视频利用c语言、r语言、python等自编程序进行处理。
61.为了提高信号读取的准确性,在荧光激发光源与样品检测芯片200之间设置第一滤光片901,在样品检测芯片200和图像采集装置600之间设置第二滤光片902。两个滤光片为二相色镜,第一滤光片901的透射波段为蓝光波段,进一步优选为480nm
±
5nm,第二滤光片902的透射波段为绿光波段,进一步优选为520nm
±
5nm。
62.本发明还提供了一种细菌检测方法,该方法采用本技术提供的细菌微流控集成检测平台进行检测,检测步骤包括:
63.首先将细菌培养液注入到核酸提取芯片100内,经过加热裂解、纯化、洗脱后得到核酸;将得到的核酸引入到核酸扩增反应单元进行核酸进行恒温扩增和检测。
64.加热裂解是在70~100℃下高温裂解,优选恒温加热至少30min进行裂解;裂解后用纯化液进行洗涤和洗脱液依次对其进行洗涤,最终获得高质量的dna产物。核酸扩增指的是rpa扩增反应,是将细菌靶基因的特异性引物和荧光探针加入到反应体系中,在37~42℃下反应10~20min。
65.核酸恒温扩增和检查过程中的荧光信号的读取是采用图像采集装置600进行的(例如使用手机进行录像),获得的记录荧光信号的视频利用c语言、r语言、python等自编程序进行处理。
66.实施例1:核酸提取芯片100的制备
67.通过掩膜法制备具有通道结构的分流层和聚流层,以及具有4个圆形的支撑单元
108的上下两个支撑层,分流层、上下两个支撑层和聚流层的材质均为pmds。分流层的进样口101、聚流层的出样口106的直径均为1mm,分流口103和聚流口104的直径均为4mm,第一微通道102和第二微通道105的长度均为12mm,宽度和深度均为100μm。圆形支撑单元108的直径为10mm,每个支撑单元108包含31个圆柱形的支撑柱109,支撑柱109的高度200μm,直径为1mm。支撑单元108上用2mm的打孔器打通孔110,从而使过滤层与上方的分流口103和下方的聚流口104相连通;上下两个支撑层的支撑柱109中间夹有直径为8mm、孔径为0.8μm的玻璃纤维滤纸107,用于细菌的过滤和核酸样品的提取。分流层、两个支撑层和聚流层依次叠合,相邻的层之间通过等离子体氧化处理而永久键合,整个芯片的尺寸在5
×5×
3cm3范围。等离子体氧化处理条件优选300mt,20w条件下暴露60s。
68.实施例2:样品检测芯片200的制备
69.在顶层开设进样孔201、多条第三微通道202、多对反应检测孔203和阴阳性对照孔204,进样孔201开设在顶层的中心位置,反应检测孔203和阴阳性对照孔204均分布于进样孔201的周围,并通过第三微通道202连接进样孔201,最后将顶层与玻璃基底层205进行键合。加样孔的直径为1mm,反应检测孔203和阴阳性对照孔204的直径为5mm,第三微通道202宽度100μm,深度200μm。反应检测孔203中预先加载含有常见食源性致病菌特异性引物和荧光探针的rpa试剂,然后贴一层透光密封膜,防止反应过程中的蒸发,整个芯片的尺寸在2
×2×
1cm3范围。
70.实施例3:检测平台的搭建
71.如图3所示,壳体由3d打印制作,细菌裂解单元和核酸扩增反应单元装载在下壳体700内,信号读取单元装载在上壳体800上。下壳体700中细菌裂解单元位于左侧,其中核酸提取芯片100位于6
×6×
10cm3中心有2mm排液口705的第一安装槽701内。扩增反应单元位于下壳体700右侧,其中样品检测芯片200位于3
×3×
5cm3的第三安装槽703内。此外,设置离心管放置槽用于废液的收集。上壳体800顶部有1.5
×
2cm2的通孔802作为拍照孔,内部有光源卡槽801,用于放置led激发光源500。整个检测平台的尺寸在16
×
10
×
7cm3范围。
72.检测平台的光路如图6所示,其中的箭头表示光的传播方向,led激发光源500与样品检测芯片200之间放置第一滤光片901,优选第一滤光片901紧贴led激发光源500的聚光环,用于滤除激发光源外的杂光。光源的散射角度为8
°
,照射到样品检测芯片200上形成3mm的光斑。样品检测芯片200与通孔802之间放置第二滤光片902,用于滤除检测光源外的杂光。图像采集装置600选用iphone12,与芯片间的距离6.5cm。
73.实施例4:细菌检测实例
74.检测对象以沙门氏菌、副溶血性弧菌、大肠杆菌、阪崎克罗诺杆菌、金黄色葡萄球菌、单增李斯特氏菌、铜绿假单胞菌杆菌和蜡样芽胞杆菌等8种常见食源性致病菌为例。检测原理:在rpa反应体系中,当有目标靶基因存在时,可在核酸外切酶的作用下特异性切割荧光探针,导致荧光信号的产生,从而对细菌进行定量化分析。
75.核酸提取芯片100的制备如实施例1所述。样品检测芯片200的制备如实施例2所述,在反应检测孔203中分别预先包埋上述8种病原菌特异性引物和荧光探针的冻干试剂,贴上透光密封膜进行保存。检测装置的搭建如实施例3所述,并将核酸提取芯片100和样品检测芯片200放置于相应的位置上。
76.检测流程如下:首先,将细菌培养液用移液枪或注射器加入到核酸提取芯片100
中,通过第一温控模块300使核酸提取芯片100在75℃加热30min进行加热裂解,之后,先用纯化液进行多次洗涤,洗涤过程的液体引入废液收集装置706;再加入洗脱液洗脱玻璃纤维滤纸107上的核酸,洗脱过程的液体在导液管的作用下引入到样品检测芯片200中;最后,利用第二温控模块400使样品检测芯片200处于37℃的环境下进行核酸进行恒温扩增和检测,用手机的视频功能实时记录荧光信号图像,并用自编程序对视频进行定量化分析。
77.最后应说明的是:以上实施方式及实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施方式及实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述实施方式或实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明实施方式或实施例技术方案的精神和范围。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。