1.本发明涉及有机小分子发光材料领域,具体涉及一种吡咯并吡咯二酮基红光转光剂材料。
背景技术:
2.有机小分子发光材料在光转换发光材料中具有重要的研究意义,其具有结构易调控、材料易提纯、发光性能优异等特点,在光转换农膜、照明、显示和探测等领域得到广泛的应用。吡咯并吡咯二酮是一类重要的人工合成染料,具有色彩鲜艳、优异的光稳定性和热稳定性等优势。近年来,作为电子受体单元,学界构筑了系列dpp基共轭分子和聚合物,并广泛应用于有机场效应晶体管、有机光伏器件、有机热电、单线态裂分、光动力治疗等领域的研究中。大多数的dpp衍生物n-位为烷基侧链,共轭单元如噻吩等通过单键与dpp相连接。
3.植物的生长离不开太阳,太阳光是植物进行光合作用的能量来源,然而不同的光质对植物生长发育有不同的作用,比如:蓝光利于植物茎叶的生长,红光有利于提高果蔬口感和品质。植物的光合作用发生在叶绿体中,叶绿体中的色素最大吸收光波为400~480nm的蓝光和600~680nm的红橙光,380nm以下的紫外光和500~580nm的绿光基本不被吸收而被反射。因此需要开发一种高效的光转换材料,将对植物不利或者有害的绿光和紫外光转换成光合作用所需的红光和蓝光,提高植物对光能利用效率,进而起到对农作物增产、早熟和提高营养成分的目的。
技术实现要素:
4.针对现有技术的缺陷或改进需求,本发明的目的在于提供一种吡咯并吡咯二酮基红光转光剂材料。该类材料可以通过调控桥联基团的种类和烷基链的长度来调控材料的发光性质,有效解决现有技术的缺陷。
5.为了实现上述目的或者其他目的,本发明提供了一种吡咯并吡咯二酮基红光转光剂材料。
6.本发明所提供的吡咯并吡咯二酮基红光转光剂材料,其结构通式如(i)所示,其中,x为桥联基团,n选自1~18任一项。
[0007][0008]
进一步地,所述桥联基团为式(ii)中的任意一种,其中,*代表键接位置。
[0009][0010]
进一步地,所述吡咯并吡咯二酮基红光转光剂材料选自以下化合物中的任意一种:
[0011]
[0012]
[0013][0014]
本发明所提供的吡咯并吡咯二酮基红光转光剂材料,其制备方法为:首先将吡咯并吡咯二酮和不同链长的卤代烷化合物进行反应生成不同烷基链长度的烷基吡咯并吡咯二酮化合物,随后经n-溴代丁二酰亚胺进行溴化,最后和9-蒽硼酸经过suzuki偶合反应得到最终的吡咯并吡咯二酮基红光转光剂材料。本发明所采用的制备方法为本领域内常规技术。
[0015]
本发明还提供了一种前面所述吡咯并吡咯二酮基红光转光剂材料在转光农膜领域的应用。优选地,将本发明的吡咯并吡咯二酮基红光转光剂材料采用农膜领域中常规技术进行改性处理,加入到农膜中,制备转光农膜。
[0016]
本发明所提供的吡咯并吡咯二酮基红光转光剂材料,可以通过调控桥联基团的种类和烷基链的长度来调控材料的发光性质。本发明的红光转光剂材料可以在300-600nm的光的激发下发射出600-750nm的红光,该红光与植物叶绿素在红光部分的吸收匹配度较高,可以有效提高植物的光合作用,可用于转光农膜领域。
附图说明
[0017]
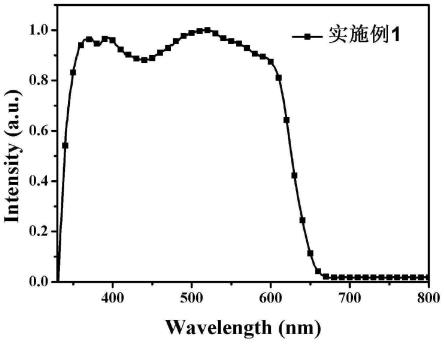
图1为实施例1制备的吡咯并吡咯二酮基红光转光剂材料的激发谱图。
[0018]
图2为实施例1制备的吡咯并吡咯二酮基红光转光剂材料的发射谱图。
具体实施方式
[0019]
以下通过特定的具体实施例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其他优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。
[0020]
需说明的是,在不冲突的情况下,以下实施例及实施例中的特征可以相互组合。还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。下列实施例中未注明具体条件的试验方法,通常按照常规条件,或者按照各制造商所建议的条件。
[0021]
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
[0022]
实施例1:
[0023][0024]
3,6-二(噻吩-2-基)-2,5-二甲基吡咯[3,4-c]吡咯-1,4-二酮的合成
[0025]
将3,6-二(噻吩-2-基)-2,5-二氢吡咯[3,4-c]吡咯-1,4-二酮(2.00g,6.66mmol)、碳酸钾(2.76g,19.98mmol)和磁力搅拌子加入到100毫升的三口烧瓶中,抽换氮气三次,随后将30毫升的无水n,n-二甲基甲酰胺用针管加入到三口烧瓶中,120摄氏度下搅拌反应1个小时。将碘甲烷(2.36g,16.65mmol)充分溶解在5毫升的无水n,n-二甲基甲酰胺中,随后用针管逐滴加入到三口烧瓶中,随后130摄氏度下反应24小时。反应结束后,将反应液冷却至室温,用二氯甲烷萃取、无水硫酸镁干燥、过滤、旋蒸得粗产品,粗产品用柱层析进行分离得深紫色固体1.95g(产率:89.04%)(即3,6-二(噻吩-2-基)-2,5-二甲基吡咯[3,4-c]吡咯-1,4-二酮)。将深紫色固体进行核磁氢谱的测试,结果为:1hnmr(500mhz,cdcl3,ppm)δ7.95(d,j=8.5hz,2h),7.85(d,j=7.9hz,2h),7.36(t,j=9.1hz,2h),3.67(s,6h)。
[0026]
3,6-二(5-溴化噻吩-2-基)-2,5-二甲基吡咯[3,4-c]吡咯-1,4-二酮的合成
[0027]
将所制备的3,6-二(噻吩-2-基)-2,5-二甲基吡咯[3,4-c]吡咯-1,4-二酮(1.50g,4.57mmol)、n-溴代丁二酰亚胺(1.79g,10.05mmol)和磁力搅拌子加入到100毫升的单口烧瓶中,加入40毫升三氯甲烷,室温搅拌8个小时。反应完成后通过柱层析得紫色固体2.01g(产率:90.54%),即为3,6-二(5-溴化噻吩-2-基)-2,5-二甲基吡咯[3,4-c]吡咯-1,4-二酮,对其进行核磁氢谱测试,1hnmr(500mhz,cdcl3,ppm)δ7.58(d,j=9.3hz,2h),7.26(d,j=7.5hz,2h),3.65(s,6h)。
[0028]
吡咯并吡咯二酮基红光转光剂材料的合成
[0029]
将所制备的3,6-二(5-溴化噻吩-2-基)-2,5-二甲基吡咯[3,4-c]吡咯-1,4-二酮、9-蒽硼酸和四(三苯基膦)钯按1:1.1:0.005的比例加入250毫升三口烧瓶中,抽换氮气三
次,随后将2摩尔/升的碳酸钾溶液(15毫升)、乙醇(15毫升)和甲苯(30毫升)加入到烧瓶中,抽换氮气三次,90摄氏度下搅拌反应12小时。反应完成后,将反应液降至室温,将多余的甲苯和乙醇蒸出,然后用二氯甲烷和水萃取、无水硫酸镁干燥、过滤得粗产品,粗产品通过柱层析提纯得红色固体,即为所需吡咯并吡咯二酮基红光转光剂材料,对其进行核磁测试:1h nmr(500mhz,cdcl3,ppm)δ8.55(s,2h),8.20(d,j=5.6hz,6h),8.01(d,j=7.8hz,4h),7.85(d,j=6.6hz,2h),7.48(t,j=8.6hz,8h),3.65(s,6h);
13
c nmr(125mhz,cdcl3)δ165.4,142.6,136.3,134.2,132.2,130.4,129.8,128.1,127.9,125.6,124.0,113.6,32.9;hrms(apci):理论值c
44h28
n2o2s2,680.84;实验值:681.7581[m h]
。
[0030]
实施例2
[0031][0032]
3,6-二(噻吩-2-基)-2,5-二丁基吡咯[3,4-c]吡咯-1,4-二酮的合成
[0033]
将3,6-二(噻吩-2-基)-2,5-二氢吡咯[3,4-c]吡咯-1,4-二酮(2.00g,6.66mmol)、碳酸钾(2.76g,19.98mmol)和磁力搅拌子加入到100毫升的三口烧瓶中,抽换氮气三次,随后将30毫升的无水n,n-二甲基甲酰胺用针管加入到三口烧瓶中,120摄氏度下搅拌反应1个小时。将溴丁烷(2.28g,16.65mmol)充分溶解在5毫升的无水n,n-二甲基甲酰胺中,随后用针管逐滴加入到三口烧瓶中,随后130摄氏度下反应24小时。反应结束后,将反应液冷却至室温,用二氯甲烷萃取、无水硫酸镁干燥、过滤、旋蒸得粗产品,粗产品用柱层析进行分离得深紫色固体2.55g(产率:92.73%),即为3,6-二(噻吩-2-基)-2,5-二丁基吡咯[3,4-c]吡咯-1,4-二酮,对其进行核磁测试:1h nmr(500mhz,cdcl3,ppm)δ7.89(d,j=8.2hz,2h),7.78(d,j=4.5hz,2h),7.37(t,j=8.7hz,2h),3.48(m,4h),1.50(m,4h),1.30(m,4h),0.91(t,j=8.6,6h)。
[0034]
3,6-二(5-溴化噻吩-2-基)-2,5-二丁基吡咯[3,4-c]吡咯-1,4-二酮的合成
[0035]
将3,6-二(噻吩-2-基)-2,5-二丁基吡咯[3,4-c]吡咯-1,4-二酮(2.00g,4.85mmol)、n-溴代丁二酰亚胺(1.90g,10.67mmol)和磁力搅拌子加入到100毫升的单口烧瓶中,加入40毫升三氯甲烷,室温搅拌8个小时。反应完成后通过柱层析得紫色固体2.48g(产率:89.53%),即为3,6-二(5-溴化噻吩-2-基)-2,5-二丁基吡咯[3,4-c]吡咯-1,4-二酮,对其进行核磁测试:1h nmr(500mhz,cdcl3,ppm)δ7.57(d,j=8.8hz,2h),7.19(d,j=5.7hz,2h),3.46(m,4h),1.52(m,4h),1.33(m,4h),0.90(t,j=7.7,6h)。
[0036]
吡咯并吡咯二酮基红光转光剂材料的合成
[0037]
将3,6-二(5-溴化噻吩-2-基)-2,5-二丁基吡咯[3,4-c]吡咯-1,4-二酮、9-蒽硼酸和四(三苯基膦)钯按1:1.1:0.005的比例加入250毫升三口烧瓶中,抽换氮气三次,随后将2摩尔/升的碳酸钾溶液(15毫升)、乙醇(15毫升)和甲苯(30毫升)加入到烧瓶中,抽换氮气三次,90摄氏度下搅拌反应12小时。反应完成后,将反应液降至室温,将多余的甲苯和乙醇蒸出,然后用二氯甲烷和水萃取、无水硫酸镁干燥、过滤得粗产品,粗产品通过柱层析提纯得红色固体,即为所需吡咯并吡咯二酮基红光转光剂材料,对其进行核磁测试:1h nmr(500mhz,cdcl3,ppm)δ8.54(s,2h),8.22(d,j=7.8hz,6h),8.04(d,j=4.4hz,4h),7.83(d,
j=5.2hz,2h),7.51(t,j=9.6hz,8h),3.46(m,4h),1.50(m,4h),1.31(m,4h),0.94(t,j=5.6,3h);
[0038]
13
c nmr(125mhz,cdcl3)δ165.1,142.3,136.1,134.2,132.1,130.6,129.7,128.2,127.8,125.3,124.1,113.4,45.1,30.4,20.2,13.8;
[0039]
hrms(apci):理论值c
50h40
n2o2s2,765.00;实验值:765.9593[m h]
。
[0040]
实施例3
[0041][0042]
3,6-二(呋喃-2-基)-2,5-二甲基吡咯[3,4-c]吡咯-1,4-二酮的合成
[0043]
将3,6-二(呋喃-2-基)-2,5-二氢吡咯[3,4-c]吡咯-1,4-二酮、碳酸钾和磁力搅拌子加入到100毫升的三口烧瓶中,抽换氮气三次,随后将30毫升的无水n,n-二甲基甲酰胺用针管加入到三口烧瓶中,120摄氏度下搅拌反应1个小时。将碘甲烷充分溶解在5毫升的无水n,n-二甲基甲酰胺中,随后用针管逐滴加入到三口烧瓶中,随后130摄氏度下反应24小时。反应结束后,将反应液冷却至室温,用二氯甲烷萃取、无水硫酸镁干燥、过滤、旋蒸得粗产品,粗产品用柱层析进行分离得深紫色固体,为3,6-二(呋喃-2-基)-2,5-二甲基吡咯[3,4-c]吡咯-1,4-二酮,进行核磁测试:1h nmr(500mhz,cdcl3,ppm)δ7.99(d,j=7.8hz,2h),7.83(d,j=6.3hz,2h),7.33(t,j=1.5hz,2h),3.65(s,6h)。
[0044]
3,6-二(5-溴化呋喃-2-基)-2,5-二甲基吡咯[3,4-c]吡咯-1,4-二酮的合成
[0045]
将3,6-二(呋喃-2-基)-2,5-二甲基吡咯[3,4-c]吡咯-1,4-二酮、n-溴代丁二酰亚胺和磁力搅拌子加入到100毫升的单口烧瓶中,加入40毫升三氯甲烷,室温搅拌8个小时。反应完成后通过柱层析得紫色固体,为3,6-二(5-溴化呋喃-2-基)-2,5-二甲基吡咯[3,4-c]吡咯-1,4-二酮,进行核磁测试,1h nmr(500mhz,cdcl3,ppm)δ7.61(d,j=7.9hz,2h),7.30(d,j=6.3hz,2h),3.67(s,6h)。
[0046]
吡咯并吡咯二酮基红光转光剂材料的合成
[0047]
将3,6-二(5-溴化呋喃-2-基)-2,5-二甲基吡咯[3,4-c]吡咯-1,4-二酮、9-蒽硼酸和四(三苯基膦)钯按1:1.1:0.005的比例加入250毫升三口烧瓶中,抽换氮气三次,随后将2摩尔/升的碳酸钾溶液(15毫升)、乙醇(15毫升)和甲苯(30毫升)加入到烧瓶中,抽换氮气三次,90摄氏度下搅拌反应12小时。反应完成后,将反应液降至室温,将多余的甲苯和乙醇蒸出,然后用二氯甲烷和水萃取、无水硫酸镁干燥、过滤得粗产品,粗产品通过柱层析提纯得红色固体,即为所需吡咯并吡咯二酮基红光转光剂材料,对其进行核磁测试:1h nmr(500mhz,cdcl3,ppm)δ8.57(s,2h),8.18(d,j=7.7hz,6h),8.05(d,j=6.3hz,4h),7.90(d,j=5.9hz,2h),7.47(t,j=9.3hz,8h),3.67(s,6h);
[0048]
13
c nmr(125mhz,cdcl3)δ165.6,142.4,136.5,134.3,132.4,130.3,129.8,128.1,127.9,125.6,124.0,113.6,33.1;
[0049]
hrms(apci):理论值c
44h28
n2o4,648.72;实验值:649.8184[m h]
。
[0050]
实施例4
[0051][0052]
3,6-二(呋喃-2-基)-2,5-二甲基吡咯[3,4-c]吡咯-1,4-二酮的合成
[0053]
将3,6-二(呋喃-2-基)-2,5-二氢吡咯[3,4-c]吡咯-1,4-二酮、碳酸钾和磁力搅拌子加入到100毫升的三口烧瓶中,抽换氮气三次,随后将30毫升的无水n,n-二甲基甲酰胺用针管加入到三口烧瓶中,120摄氏度下搅拌反应1个小时。将溴辛烷充分溶解在5毫升的无水n,n-二甲基甲酰胺中,随后用针管逐滴加入到三口烧瓶中,随后130摄氏度下反应24小时。反应结束后,将反应液冷却至室温,用二氯甲烷萃取、无水硫酸镁干燥、过滤、旋蒸得粗产品,粗产品用柱层析进行分离得深紫色固体,为3,6-二(呋喃-2-基)-2,5-二甲基吡咯[3,4-c]吡咯-1,4-二酮,其核磁测试结果为:1h nmr(500mhz,cdcl3,ppm)δ8.62(d,j=8.2hz,2h),8.58(d,j=4.5hz,2h),7.24(t,j=8.7hz,2h),3.48(m,4h),1.63(m,4h),1.28(m,20h),0.88(t,j=8.6,6h)。
[0054]
3,6-二(5-溴化呋喃-2-基)-2,5-二辛基吡咯[3,4-c]吡咯-1,4-二酮的合成
[0055]
将3,6-二(噻吩-2-基)-2,5-二辛基吡咯[3,4-c]吡咯-1,4-二酮、n-溴代丁二酰亚胺和磁力搅拌子加入到100毫升的单口烧瓶中,加入40毫升三氯甲烷,室温搅拌8个小时。反应完成后通过柱层析得紫色固体,其核磁测试结果为:1h nmr(500mhz,cdcl3,ppm)δ7.27(d,j=8.8hz,2h),6.89(d,j=5.7hz,2h),3.48(m,4h),1.63(m,4h),1.28(m,20h),0.88(t,j=8.6,6h)。
[0056]
吡咯并吡咯二酮基红光转光剂材料的合成
[0057]
将3,6-二(5-溴化呋喃-2-基)-2,5-二辛基吡咯[3,4-c]吡咯-1,4-二酮、9-蒽硼酸和四(三苯基膦)钯按1:1.1:0.005的比例加入250毫升三口烧瓶中,抽换氮气三次,随后将2摩尔/升的碳酸钾溶液(15毫升)、乙醇(15毫升)和甲苯(30毫升)加入到烧瓶中,抽换氮气三次,90摄氏度下搅拌反应12小时。反应完成后,将反应液降至室温,将多余的甲苯和乙醇蒸出,然后用二氯甲烷和水萃取、无水硫酸镁干燥、过滤得粗产品,粗产品通过柱层析提纯得红色固体,即为所需吡咯并吡咯二酮基红光转光剂材料,其核磁测试结果为:1h nmr(500mhz,cdcl3,ppm)δ8.54(s,2h),8.22(d,j=7.8hz,6h),8.04(d,j=4.4hz,4h),7.83(d,j=5.2hz,2h),7.51(t,j=9.6hz,8h),3.48(m,4h),1.63(m,4h),1.28(m,20h),0.88(t,j=7.6,6h);
[0058]
13
c nmr(125mhz,cdcl3)δ165.1,142.3,136.1,134.2,132.1,130.6,129.7,128.2,127.8,125.3,124.1,113.4,43.0,30.5,31.9,29.3,27.1,22.7,14.1;
[0059]
hrms(apci):理论值c
58h56
n2o4,845.10;实验值:846.2138[m h]
。
[0060]
性能测试
[0061]
1、取实施例1所制备的吡咯并吡咯二酮基红光转光剂材料,在650nm检测补偿下测试得到实施例1的激发光谱,其结果如图1所示,从图1可以看出,吡咯并吡咯二酮基红光转光剂材料可以被330-660nm光的激发,并发射650nm的红光。
[0062]
2、取实施例1所制备的吡咯并吡咯二酮基红光转光剂材料,在400nm的光激发下测其发射光谱,结果如图2所示,从图2可以看出,在400nm的光激发下,吡咯并吡咯二酮基红光
转光剂材料可以发射650nm的红光。
[0063]
3、分别取实施例1~4所制得的吡咯并吡咯二酮基红光转光剂材料,使用积分球分别测其荧光量子效率,结果如表1所示,从表1中数据可以看出实施例1-4的荧光量子效率都处于较高水平,能够具有更好的转光效率。
[0064]
表1实施例1~实施例4所得材料的荧光量子效率
[0065]
化合物荧光量子效率(plqy)实施例152.1%实施例254.8%实施例349.7%实施例453.3%
[0066]
综上可以看出,本发明所制备的吡咯并吡咯二酮基红光转光剂材料可以在300-600nm的光的激发下发射出600-750nm的红光,而且具有更好的转光效率,用于农膜中,具有较好的转光效果。
[0067]
上述实施例仅示例性说明本发明的原理及其功效,而非用于限制本发明。任何熟悉此技术的人士皆可在不违背本发明的精神及范畴下,对上述实施例进行修饰或改变。因此,举凡所属技术领域中具有通常知识者在未脱离本发明所揭示的精神与技术思想下所完成的一切等效修饰或改变,仍应由本发明的权利要求所涵盖。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。
