1.本发明涉及医疗产品的加工设备领域,具体涉及一种免疫组化质控芯片自动化加工设备。
背景技术:
2.随着个体化诊疗时代的来临,精准医学的快速发展,免疫组织化学已成为病理医生不可或缺的辅助诊断手段。同时随着免疫组织化学染色过程逐步自动化,免疫组织化学在病理诊断中的作用日益广泛。如今,免疫组织化学技术已不仅仅用于判断肿瘤的来源、分类及鉴别诊断,而且广泛应用于检测相关指标来判断预后和指导临床个性化治疗,因此其准确性和可靠性至关重要。尽管免疫组织化学染色在临床病理诊断的应用超过40年,但质量控制的标准化仍有待进一步完善,免疫组织化学染色过程中有很多因素可对染色结果产生不同程度的影响。为了促进临床免疫组织化学标准化,提高染色结果的可靠性,每批次染色时都应该进行有效的质量控制,不可或缺的便是阴阳性对照的设立。只有设立适当的阴阳性对照才能确保免疫组织化学染色过程的准确性、抗体及相关试剂的有效性。
3.目前实验室免疫组化质量控制面临着以下问题:免疫组化标准化程度低,不确定性强;制备管理控制所需的阳性对照组织花费大量精力;部分靶标所需质控组织难以获取;组织差异性为质控过程增加了更多的不可控过程;伦理问题导致质控体系难以平移。
技术实现要素:
4.有鉴于上述技术问题,本发明提供了一种免疫组化质控载玻片,所述免疫组化质控载玻片包括载玻片基片,所述载玻片基片包括检测区和对照区;所述对照区设置有若干孔,用于放置对照样本。
5.进一步地,所述检测区和所述对照区的表面设置有粘附层。
6.进一步地,所述若干孔呈阵列排布。
7.进一步地,所述对照区还包括用于指示所述若干孔的行和/或列的指示标记。
8.进一步地,所述若干孔的形状不全相同。
9.进一步地,所述载玻片基片还包括标签区,所述标签区和所述检测区分别设置在所述对照区的两侧。
10.进一步地,所述标签区设置有字形标记和/或图形标记。
11.本发明还提供了一种免疫组化质控载芯片,所述免疫组化质控载芯片包括载玻片基片和密封层,所述载玻片基片包括检测区和对照区;所述对照区设置有若干孔,所述孔内设置有作为对照样本的细胞溶液;所述密封层覆盖于所述对照区以封闭所述若干孔的开口。
12.进一步地,各所述孔内的细胞溶液不全相同。
13.进一步地,所述检测区和所述对照区的表面设置有粘附层。
14.进一步地,所述若干孔呈阵列排布。
15.进一步地,所述对照区还包括用于指示所述若干孔的行和/或列的指示标记。
16.进一步地,所述若干孔的形状不全相同。
17.进一步地,所述载玻片基片还包括标签区,所述标签区和所述检测区分别设置在所述对照区的两侧。
18.进一步地,所述标签区设置有字形标记和/或图形标记。
19.进一步地,所述细胞溶液中的细胞源自商业化细胞系或是基于商业化细胞系培养的细胞。
20.本发明还提供了一种免疫组化质控芯片自动化加工设备,所述免疫组化质控芯片自动化加工设备包括水平传送装置,所述水平传送装置适于承载和传送用于制作免疫组化质控芯片的载玻片,所述载玻片上设置有若干孔;沿所述水平传送装置的传送方向依次设置有:
21.载玻片出片装置,所述载玻片出片装置用于存放待加工的载玻片,以及驱动载波片移动至所述水平传送装置;
22.感应装置,所述感应装置用于感应所述水平传送装置上的载物状态;
23.点样装置,所述点样装置用于将细胞溶液加滴到所述水平传送装置上的载波片上的孔中;
24.烘干装置,所述烘干装置用于对所述水平传送装置上的已加滴细胞溶液的载波片进行烘干;
25.密封装置,所述密封装置用于在所述水平传送装置上的载波片表面形成密封层,以封闭载波片上的孔。
26.进一步地,所述水平传送装置上设置有若干载玻片放置位,所述载玻片放置位包括凹槽,所述凹槽的底部的尺寸与所需加工的载玻片尺寸相适应,所述凹槽的侧壁倾斜设置,以适于进入所述凹槽的载玻片滑落至所述凹槽的底部。
27.进一步地,所述载玻片出片装置包括片匣和转移机构;所述片匣适于容纳所需加工的载玻片;所述转移机构适于将所述片匣内的载玻片移至所述水平传送装置。
28.进一步地,所述片匣相对的两侧分别设置有进口和出口,所述转移机构的活动组件适于从所述进口进入并将所述片匣内的一载玻片从所述出口推出至所述水平传送装置上;所述出口的高度大于或等于所需加工的载玻片的厚度且小于所需加工的载玻片的两倍厚度。
29.进一步地,所述感应装置采用光传感器或图像传感器。
30.进一步地,所述点样装置包括与所需加工的载玻片上的若干孔的位置分布相对应的若干点样枪,各点样枪分别连接相应的细胞溶液储罐。
31.进一步地,所述点样装置还包括移动机构,所述点样枪被固定设置于所述移动机构的可动组件上,所述可动组件适于被驱动沿水平方向移动且移动方向垂直于所述水平传送装置的传送方向。
32.进一步地,所述细胞溶液中的细胞源自商业化细胞系或基于商业化细胞系培养的细胞。
33.进一步地,所述密封装置采用石蜡、盖玻片或高分子薄膜作为所述密封层的材料。
34.进一步地,所述免疫组化质控芯片自动化加工设备还包括外壳罩体,以形成具有
防护的加工环境。
35.本发明的免疫组化质控载玻片被设计用于制作新型的免疫组化质控芯片,具体地是在防脱载玻片的基片上设置微孔阵列,并在该结构上形成各类质控芯片(包含阳性和阴性对照),从而可以作为一种实用高效的免疫组织化学染色质控芯片对照体系。通过先将人类各种疾病相关的阳性组织利用原代培养技术,培养几十种不同的细胞制作成标准化的质控芯片(微阵列),同时这些细胞基本能涵盖目前病理科常用的免疫组化指标,并按照一定比例稀释并同时加入固定液固定好细胞,通过将不同细胞溶液滴加到固定好的微升微孔中,达到每一个微液滴或微孔中至多包含一种阳性的质控细胞,例如第一微孔滴加腺癌细胞,第二微孔滴加鳞癌细胞,第三微孔滴加淋巴细胞
……
依次滴加,将免疫组化临床上常见的阳性细胞集中在一张微阵列的载玻片上,并运用防脱片防降解技术处理成一张完整的特殊载玻片,供病理、免疫、分子生物技术领域应用。
36.本发明的免疫组化质控芯片的载玻片基片上每张切面都有阳性和阴性的质控对照,制片符合15189的质量管理体系,在载玻片基片上所形成的质控芯片相对于目前常用的石蜡组织芯片,不需要利用包埋蜡块再切片、捞片的整个制作阳性对照片的过程,直接利用液滴生成的装备与操作,设计灵活多变,效率高,同时可对生成液滴的大小、形态进行有效控制,极大地缩短了制片时间及简化流程,有利于提高效率,统一标准。
37.同时,本发明的免疫组化质控芯片的信息量大,阴性和不同程度的阳性细胞都可包含在内,使得染色结果更加可靠,并且细胞芯片排列规整,载玻片微整列的孔径能够保证非常方便阅片和查对,病理医师可以清楚地观察到同一抗体在不同组织细胞的表达状况,这对选择特异性抗体进行鉴别诊断很有帮助。
38.本发明中免疫组化质控芯片所采用的细胞溶液中的细胞是通过商业化的细胞培养方法获得,其优势在于:(1)可长期传代培养,保持细胞活性,便于各项指标的实时监控检测;(2)可以人为控制培养条件便于研究细胞代谢及理化和生物因素的影响;(3)不同代次细胞可长期保存,既可开展同代次不同条件的方法研究,又可观察不同代次的动态变化。
39.本发明的免疫组化质控芯片自动化加工设备提供了在免疫组化质控载玻片上制作免疫组化质控芯片的流水线设备,使得本发明的免疫组化质控芯片可以批量地、快速地生产和制造,为其商用化提供了保证。
40.以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
41.图1是本发明的一个实施例的免疫组化质控载玻片的结构示意图;
42.图2是沿图1中a-a向的剖面示意图;
43.图3是图1中的免疫组化质控载玻片添加孔行列标记的结构示意图;
44.图4是本发明的另一个实施例的免疫组化质控载玻片的结构示意图;
45.图5是图4中的免疫组化质控载玻片的另一结构示意图,其中密封层分离显示;
46.图6是沿图4中a-a向的剖面示意图;
47.图7是本发明的一个实施例的免疫组化质控芯片自动化加工设备的结构示意图;
48.图8是图1中传送带的结构示意图;
49.图9是图8中传送带的局部放大示意图,其中一载玻片放置位上放置有载玻片;
50.图10是图1中片匣的结构示意图;
51.图11是图10中片匣装置载玻片的结构示意图,其中示出了机械手将最底部的载玻片的部分推出片匣;
52.图12是图11中片匣另一视角的结构示意图。
53.附图标记说明:
54.10—载玻片基片,
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
11—检测区,
55.12—对照区,
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
13—标签区,
56.14—孔,
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
20—粘附层,
57.30—涂层,
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
31—二维码,
58.40—密封层,
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
100—主机,
59.200—载玻片出片装置,
ꢀꢀꢀꢀꢀꢀꢀꢀ
210—片匣,
60.211—开口,
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
212—进口,
61.213—出口,
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
220—机械手,
62.300—感应装置,
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
400—点样装置,
63.410—点样枪,
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
420—移动机构,
64.500—烘干装置,
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
600—密封装置,
65.700—传送带,
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
710—载玻片放置位,
66.711—凹槽底部,
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
712—凹槽侧壁,
67.800—载玻片。
具体实施方式
68.在本发明的实施方式的描述中,需要理解的是,术语“上”、“下”、“前”、“后”、“左”、“右”、“垂直”、“水平”、“顶”、“底”、“内”、“外”、“顺时针”、“逆时针”等指示的方位或位置关系为基于附图所示的方位或位置关系,仅是为了便于描述本发明和简化描述,而不是指示或暗示所指的装置或元件必须具有特定的方位、以特定的方位构造和操作,因此不能理解为对发明的限制。附图为原理图或者概念图,各部分厚度与宽度之间的关系,以及各部分之间的比例关系等等,与其实际值并非完全一致。
69.实施例一
70.本实施例是关于本发明的免疫组化质控载玻片、免疫组化质控芯片以及免疫组化质控芯片自动化加工设备所提及或使用到的细胞溶液的制备方法,以及细胞溶液中细胞的获得和培养方法。
71.在后续的各实施例(包括免疫组化质控载玻片、免疫组化质控芯片以及免疫组化质控芯片自动化加工设备)中所提及或采用的细胞溶液中的细胞的培养方法及操作步骤包括:
72.一、购买商业化细胞系,如胰腺癌calu-3细胞,肺鳞癌sk-mes-1细胞,乳腺导管癌t47d(t-47d)和mda-mb-175ⅶ细胞,结肠癌colo 205、hct 116和caco-2,甲状腺癌cal-62和ktc-1细胞,前列腺癌du 145和lncap clone fgc细胞,胰腺癌panc-1和hpaf-ii细胞,食管癌ec109和te-10细胞,胃癌mkn-45和kato iii细胞,肝癌plc/prf/5细胞,宫颈鳞癌siha细
胞,膀胱癌5637细胞,胎盘bewo细胞,胶质瘤u251细胞,肾癌g401细胞等等。
73.二、传代前准备
74.1、用75%酒精擦拭经过紫外线照射的超净工作台和双手,严格进行无菌操作前的准备工作。
75.2、正确摆放使用的器械:保证足够的操作空间,不仅便于操作而且可减少污染。
76.3、从培养箱内取出细胞:注意取出细胞时要旋紧瓶盖,用酒精棉球擦拭显微镜的台面,再在镜下观察细胞。
77.三、胰蛋白酶消化
78.1、加入消化液:小心吸出旧培养液,用pbs清洗(冲洗),加入适量(例如t25则加入2ml即可)消化液(胰蛋白酶液),消化液的量以盖住细胞为最佳,最佳消化温度是37℃。
79.2、培养箱消化:根据不同的细胞和培养时间控制细胞的消化时间(例如l929,已培养6天,则需消化2min即可取出终止消化)。
80.3、显微镜下观察细胞:倒置显微镜下观察消化细胞,若胞质回缩,细胞之间不再连接成片,表明此时细胞消化适度。
81.4、轻轻拍打培养瓶四周,使已消化的细胞脱离培养瓶,于显微镜下观察细胞90%以上脱落即可。
82.5、终止消化:向培养瓶内加入约fbs(胎牛血清)终止消化。
83.四、吹打分散细胞
84.1、用滴管将已经消化的细胞吹打成细胞悬液。
85.2、将细胞悬液吸入离心管中,如10ml离心管。
86.3、平衡后将离心管放入台式离心机中进行分离。
87.4、分离后弃去上清液,加入培养液,用滴管轻轻吹打细胞制成细胞悬液。
88.五、继续传代培养
89.1、准备新的培养瓶,在瓶中加入新的培养液和胎牛血清或其他添加物。
90.2、在上述新的培养瓶中加入预定量的步骤四.4中所获得的细胞。
91.3、将上述新的培养瓶放入培养箱进行细胞培养。
92.以下以l92l细胞培养和传代流程为例,对上述的细胞培养方法做进一步说明,具体步骤包括:
93.1、从二氧化碳培养箱内取出培养好的l929细胞。
94.2、在显微镜下观察,若细胞贴壁稳定达90%以上,即可视为成熟,可传代(一般培养6~8天能达到标准,若超时细胞则会老化、死亡)。
95.3、使用移液枪将培养瓶内液体吸出,弃之。
96.4、使用0-1000ul移液枪在培养瓶内加入2ml消化液(胰酶),随后放入二氧化碳培养箱消化1~2分钟(根据细胞增殖密度减少或增加消化时间,一般以1:30秒为宜)。
97.5、将消化后的细胞置于显微镜下观察,看到大部分细胞明显收缩、变圆、悬浮时,即可轻拍瓶身,将依旧贴壁的细胞震荡至悬浮状态,显微镜下确认90%以上细胞已脱壁即可。
98.6、使用0-100ul移液枪在培养瓶内加入100ul胎牛血清(fbs)终止消化。
99.7、使用自动移液枪全部吸取,放入10ml离心管,再加入pbs缓冲液。
100.8、配平后放入离心机1300转/分钟,离心3分钟,随后取出,去除上清液。
101.9、轻轻震荡离心管沉底聚合的细胞,使其分散,随后使用自动移液器加入pbs缓冲液,稀释细胞浓度(一般以3~5ml为适宜)。
102.10、取出96孔板,在孔中加入30ul台盼兰,先用0-1000ul移液枪将离心管内的细胞混匀,再用0-100ul移液枪吸取30ul的离心管内细胞,与30ul台盼兰混匀(2倍稀释),随后吸取30ul混合液,打入细胞计数板,在显微镜下进行计数。
103.11、显微镜下进行细胞计数(二倍稀释下,正常增殖的l929细胞每孔内计数约为180~260个),计算细胞增殖能,与前次传代计数结果对比,对比下
±
25%内为合格,可进行传代。
104.12、准备一个t25培养瓶,瓶内加入4.5ml l929培养基,0.5ml胎牛血清(fbs)。
105.13、用0-100ul移液枪,吸取已计数的l929细胞,大约10万个。将其加入准备好的t25培养瓶内,随后放入二氧化碳培养箱培养6~8天。
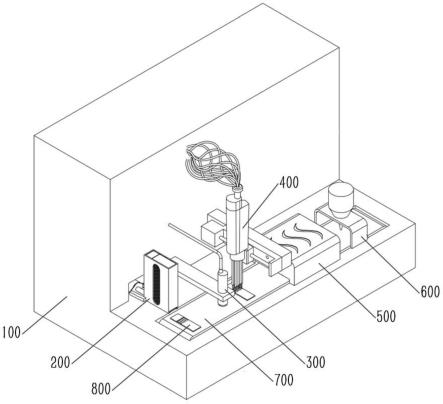
106.本实施例中的细胞溶液是基于上述方法所培养的细胞加固定液固定后所形成,以下以u251胶质瘤细胞系为例,对于细胞溶液的制备和操作过程做详细说明,具体步骤包括:
107.1、细胞提取:根据u251胶质瘤细胞系传代扩大培养,培养好的u251细胞进行提取。
108.2、离心机2000转/分钟离心2分钟后倒去上清液。
109.3、加入pbs配制的4%多聚甲醛固定液固定10分钟。
110.4、离心机2000转/分钟离心2分钟后,去掉上清液,并用pbs洗涤细胞2次。
111.5、用含0.2%tritonx-100的pbs溶液透化固定后的细胞2分钟(室温),pbs洗涤细胞2次,2000转/分钟离心后,去掉上清液。
112.6、加入pbs,将细胞制作成细胞悬浊液(液态细胞),细胞密度大约106/ml,即获得u251胶质瘤细胞系的细胞溶液。
113.实施例二
114.图1和图2示出了本发明的一个实施例的免疫组化质控载玻片的结构示意图,其中包括载玻片基片10,根据载玻片基片10上不同区域结构和/或功能的不同,将载玻片基片10划分为检测区11、对照区12和标签区13,三者依次相邻。
115.载玻片基片10可采用现有常规的载玻片材料,如制造玻璃载玻片或石英载玻片的材料。
116.检测区11位于载玻片基片10的一端,用于放置检测样本,如需要检测的细胞或组织,为提高检测样本在载玻片上的粘附性,检测区11的表面覆盖有粘附层20,细胞或组织适于粘附于粘附层20。粘附层20的材料可采用3-氨丙基-3-乙氧基甲硅烷(3-aminopropyl-triethoxysilane,apes)、多聚-l-赖氨酸(poly-l-lysine)或明胶。
117.对照区12位于载玻片基片10的中间部分,并与检测区11相邻。对照区12上设置有孔14,本实施例中设置有20个孔14,按5
×
4的阵列排布。
118.孔14用于放置对照样本,如阳性的细胞或组织,优选地,可在孔14滴加细胞溶液,可根据孔14的容积计算需滴加的细胞溶液的合适用量,从而每个孔内的样本容量可以基本一致,且细胞溶液易于填充孔14并在孔14内分散开来,同时各孔14内的细胞溶液通过物理方式得以有效隔离开来,互不影响。
119.各个孔14可以滴加不同的细胞溶液,从而制成质控芯片(微阵列)以适于不同检测
样本的对照质量控制,如细胞溶液可以是涵盖多种细胞成分,包括不同的上皮细胞、淋巴细胞、肌肉细胞、神经细胞等,以用于诊断淋巴、上皮、间叶和神经来源的肿瘤类抗体质量控制;如细胞溶液可以是包含甲状腺癌、肺癌、胸腺瘤、胶质瘤、宫颈癌、乳腺癌、大汗腺癌、肝癌、卵巢浆液性癌细胞以用于诊断这些肿瘤特异性比较高的抗体质量控制;如细胞溶液可以是包含恶性黑色素瘤、间质瘤和嗜铬细胞瘤、间皮瘤、精原细胞瘤、霍奇金,间变,nk淋巴瘤等肿瘤细胞以用于诊断这些肿瘤特异性比较高同时病种相对较少的抗体质量控制等。除上述各种质控芯片外,也可以构建只为一种抗体提供特定组织对照的单点对照或三点对照,因为这些抗体的阳性组织较难获取或者这是一种需要定量分析的抗体,尤其是靶向药物的单克隆抗体需要独立质量控制,如her-2对照质控芯片上的三个点可以分别为待测抗体阴性、中等强度阳性和强阳性的组织。在实际使用中,可以根据需要来设置孔14的数量,以及细胞溶液的种类,以满足质控的需要。
120.本实施例中,孔14采用结构相同的圆形孔,在另一些实施例中,孔14采用两种或以上不同结构的孔,如部分孔14采用与圆形孔,部分孔14采用多边形孔,如五边形孔或六边形孔等,可通过孔14的形状对其中添加的细胞溶液进行分类或区分,如在各圆形孔中分别滴加受某一病毒感染的人体不同部位的细胞溶液,在各六边形孔中分别滴加受另一病毒感染的人体不同部位的细胞溶液。
121.在另一些实施例中,针对孔14的阵列排布还标注有指示阵列行和列的指示标记,从而可以通过指示标记所形成的坐标,来确定特定细胞溶液的位置,如图3所示。
122.在本实施例中,粘附层20同时也覆盖于对照区12表面,包括孔14的外露面,从而能够对于孔14中的细胞溶液中的物质起到一定粘附作用。
123.标签区13位于载玻片基片10上相对于检测区11的另一端,并与对照区12相邻。本实施例中,标签区13的表面设置涂层30,涂层30表面具有一定的粗糙度,能够适于书写、打号和粘贴标签。涂层30可以采用现有的具有上述功能的油墨或涂层,在此不做限制,如现有的一种载玻片用涂层,涂层材料的组成及重量百分含量为:环氧树脂50-70%,潜伏性固化剂3%-8%,无机颜料10%-30%,亲水助剂3%-5%,稀释剂10%-20%,其它助剂3%-5%;如现有的一种油墨涂层,自下而上分别为硅烷偶联剂附着层、丙烯酸树脂层(内掺杂有粒径范围为3-5μm的颗粒)和氨基树脂透明膜层。
124.在另一些实施例中,标签区13不设置涂层,而直接通过物理喷砂或化学腐蚀的方式,使载玻片基片10表面具有一定粗糙度,从而形成标签区13。
125.病理科医生可以使用本实施例的免疫组化质控载玻片,通过在孔14中滴入作为对照样本的细胞溶液来制备所需要的质控芯片,在加滴细胞溶液完成后,可以使用盖玻片、石蜡或其它具有透明度的覆盖物吸附或粘附在对照区12的表面以密封孔14,以及在标签区手写、标记和/或粘贴标签,以便于表示该免疫组化质控载玻片的信息。
126.实施例三
127.图4至图6示出了本发明的一个实施例的免疫组化质控芯片的结构示意图,其中包括载玻片基片10,根据载玻片基片10上不同区域结构和/或功能的不同,可将载玻片基片10划分为检测区11、对照区12和标签区13,三者依次相邻。
128.载玻片基片10可采用现有常规的载玻片材料,如制造玻璃载玻片或石英载玻片的材料。
129.检测区11位于载玻片基片10的一端,用于放置检测样本,如需要检测的细胞或组织,为提高检测样本在载玻片上的粘附性,检测区11的表面覆盖有粘附层20,细胞或组织适于粘附于粘附层20。粘附层20的材料可采用3-氨丙基-3-乙氧基甲硅烷(3-aminopropyl-triethoxysilane,apes)、多聚-l-赖氨酸(poly-l-lysine)或明胶。
130.对照区12位于载玻片基片10的中间部分,并与检测区11相邻。对照区12上设置有孔14,孔14内放置作为对照样本的细胞溶液。粘附层20同时也覆盖于对照区12表面,包括孔14的外露面,从而能够对于孔14中的细胞溶液中的物质起到一定粘附作用。本实施例中设置有20个孔14,按5
×
4的阵列排布。
131.在本实施例中,在各个孔14中设置相应的细胞溶液,可根据孔14的容积计算需滴加的细胞溶液的合适用量,从而每个孔内的样本容量可以基本一致,且细胞溶液易于填充孔14并在孔14内分散开来,同时各个孔14内的细胞溶液通过物理方式得以有效隔离开来,互不影响。如图4和图6所示,密封层400被覆盖于对照区12的表面,以封闭各个孔14的开口,使细胞溶液被密封在孔14和密封层400所限定的封闭容腔内。密封层400可以采用盖玻片、石蜡或其它具有透明度的覆盖物吸附或粘附在对照区12的表面。
132.在一个实施例中,免疫组化质控芯片上不同孔14内的细胞溶液涵盖多种细胞成分,包括不同的上皮细胞、淋巴细胞、肌肉细胞、神经细胞等,从而可用于诊断淋巴、上皮、间叶和神经来源的肿瘤类抗体质量控制。
133.在一个实施例中,免疫组化质控芯片上不同孔14内的细胞溶液分别包含甲状腺癌、肺癌、胸腺瘤、胶质瘤、宫颈癌、乳腺癌、大汗腺癌、肝癌、卵巢浆液性癌细胞,从而可用于诊断这些肿瘤特异性比较高的抗体质量控制。
134.在一个实施例中,免疫组化质控芯片上不同孔14内的细胞溶液分别包含恶性黑色素瘤、间质瘤和嗜铬细胞瘤、间皮瘤、精原细胞瘤、霍奇金,间变,nk淋巴瘤等肿瘤细胞,从而可用于诊断这些肿瘤特异性比较高同时病种相对较少的抗体质量控制。
135.在一个实施例中,免疫组化质控芯片上构建只为一种抗体提供特定组织对照的单点对照或三点对照,因为这些抗体的阳性组织较难获取或者这是一种需要定量分析的抗体,尤其是靶向药物的单克隆抗体需要独立质量控制,如her-2对照质控芯片上的三个点可以分别为待测抗体阴性、中等强度阳性和强阳性的组织。
136.在实际生产制作中,可以根据需要来设置孔14的数量,以及细胞溶液的种类,以满足质控的需要。
137.如实施例一中所述的针对孔14设置不同的孔结构设置,以及针对孔14的阵列排布标注指示其行和列的指示标记,也可以用于本实施例中,在此不做赘述。
138.标签区13位于载玻片基片10上相对于检测区11的另一端,并与对照区12相邻。本实施例中,标签区13的设置与实施例一基本相同,不同之处在于,标签区13的涂层30上设置有二维码31,也可以采用其它的字形标记和/或图形标记来用于指示或识别该免疫组化质控芯片,如条形码、数字编码等。
139.本实施例的免疫组化质控芯片上可提供已预制的质控芯片,病理科医生可以根据检测需求直接选择相应的免疫组化质控芯片进行质控对照。
140.实施例四
141.图7示出了本发明的一个实施例的免疫组化质控芯片自动化加工设备的结构示意
图,其中包括主机100、载玻片出片装置200、感应装置300、点样装置400、烘干装置500、密封装置600和传送带700。
142.主机100构成本实施例的免疫组化质控芯片自动化加工设备的主体框架,主机100内布置有加工设备所需的控制板、电源、电机、细胞溶液储罐、液体泵、散热装置等。载玻片出片装置200、感应装置300、点样装置400、烘干装置500、密封装置600和传送带700被设置于主机100所限定的平台上。
143.传送带700适于承载和传送用于制作免疫组化质控芯片的载玻片,如实施例二中的免疫组化质控载玻片,在该载波片上设置有呈阵列排布的若干孔,在后续加工中需要在各孔内加滴作为对照样本的细胞溶液。传送带700沿水平方向直接移动,携带其上的载玻片到达各个工位。
144.如图8和图9所示,传送带700上沿其延伸方向设置有若干载玻片放置位710,载玻片放置位710具有凹槽结构,凹槽底部711尺寸与载玻片的尺寸相适应,凹槽侧壁712倾斜设置,具体地,是自槽口向槽底方向上,侧壁逐渐向凹槽内侧倾斜。当载玻片800进入凹槽时,其与凹槽侧壁712接触时,可以沿凹槽侧壁712滑落至凹槽底部711并与凹槽底部711贴合,从而可以自对准地将载玻片800定位到载玻片放置位710中的特定位置。
145.本实施例中,传送带700通过伺服电机或步进电机驱动,以精确地控制传送带700的移动距离,确保将传送带700在输送时能够将载波片定位到准确的工位位置。
146.在沿传送带700的传送方向上,依次设置载玻片出片装置200、感应装置300、点样装置400、烘干装置500和密封装置600。
147.载玻片出片装置200,载玻片出片装置200用于存放待加工的载玻片,以及驱动载波片移动至传送带700,载玻片出片装置200包括片匣210和转移机构。
148.如图10至图12所示,片匣210为长方体盒状结构,具有容纳载玻片的空间,片匣210的上端具有开口211,可以从开口211放入待加工的载玻片,放入片匣210的载玻片800可在片匣210的容纳空间内形成堆叠,容纳空间的尺寸与载玻片800的尺寸相适应,以使多片载玻片800可以被上下对齐地堆叠在片匣210中。
149.转移机构包括机械手220以及机械手220的驱动装置(设置于主机100内),在上述驱动装置的驱动下使机械手220可往复直线运动,运动沿水平方向且与传送带700的传送方向相垂直。片匣210的两侧还设置有进口212和出口213,具体地,进口212被设置于靠近转移机构的那一侧,并且进口212正对机械手220,机械手220和进口212相配合,可以使机械手220由进口212进入,并作用于片匣210最底部的载波片800;出口213被设置于靠近传送带700的那一侧,出口213的尺寸大小适于载波片800从该处被推离片匣210,具体是处于片匣210最底部的载玻片800,并且出口213的高度大于或等于单片载玻片800的厚度且小于单片载玻片800的两倍厚度。当需要将片匣210内的载玻片800转移至传送带700时,转移机构的机械手220自进口212进入片匣210,并推动片匣210最底部的载波片800,机械手220的伸入距离确保其所推动的载波片800能够脱离片匣210并移动至传送带700,此时传送带700上的载玻片放置位710正对出口213,使得被推出的载玻片800可以滑落至载玻片放置位710,从而完成向传送带700上装片的操作。
150.在将片匣210中的载玻片800移至传送带700后,即完成向传送带700上装片的操作后,后续需要在载波片800上阵列排布的孔内加滴细胞溶液,这步工序由点样装置400来完
成,可以设置将传送带输送预定距离以使载玻片800到达对应于点样装置400的工位。本实施例中,为确保传送带700的载玻片放置位710上已放置载玻片或已正确放置载玻片,为此在载玻片出片装置200和点样装置400之间还设置有感应装置300。
151.感应装置300用于感应传送带700上的载物状态,具体是传送带700的载玻片放置位710上的载玻片的装载状态。本实施例中,感应装置300采用光传感器,通过光传感器可以测量其与下方的传送带700间的距离,传送带700并非平整的,其上设置有载玻片放置位710,载玻片放置位710具有侧壁倾斜的凹槽结构,因此当载玻片放置位710移动经过感应装置300时,通过光传感器所采集的距离数据是与载玻片放置位710的凹槽轮廓相对应的,如从直观的距离数据曲线来看,曲线的轮廓也是与载玻片放置位710的凹槽轮廓相对应的,当载玻片放置位710上正常装载有载玻片时,这时的距离数据或距离数据曲线也是有特定规律,从而可以通过感应装置300来判断,经过光传感器的载玻片放置位710上是否有载玻片,以及载玻片是否正常放置,当采集到的距离数据反映出有异常时会触发相应的提示和/或操作,如设备报警、停止相关装置的运行等。
152.另一些实施例中,感应装置300采用图像传感器,通过采集到的图像信号来对传送带700的载玻片放置位710上的载玻片的装载状态进行判断。
153.在经感应装置300确认传送带700的载玻片放置位710上的载玻片的装载状态正常后,传送带700会将载玻片800传送至点样装置400所对应的工位。点样装置400用于将细胞溶液加滴到传送带700上的载波片800上的孔中。点样装置400包括若干点样枪410,点样枪410的数量与载玻片800上孔的数量相同,两者的排布也相同,从而使得每一个点样枪410都正对载玻片800上的一个孔。每一点样枪410分别连接相应的细胞溶液储罐(设置在主机100内),根据所需加工的质控芯片的要求设置各储罐中的细胞溶液的类型,对于细胞溶液的制备可采用实施例二中的方法;同时根据载玻片上孔的容积可计算获得需要加滴的细胞溶液的剂量,从而可通过各点样枪410一次性地向载玻片800上的孔内加滴所需的细胞溶液。
154.点样装置400还包括移动机构420,移动机构420采用丝杆螺母的驱动结构,配合的电机装置于主机100内。点样枪410被固定设置于移动机构420的可动组件上,从而通过移动机构420,点样枪410可被驱动沿水平方向移动且移动方向垂直于传送带700的传送方向。对于不同规则的载玻片,其上的孔的数量和/或位置也可能不尽相同,可以通过调整点样枪410的数量和分布以及通过移动机构420的位置来满足对于不同规格的载玻片的细胞溶液的点样需求。
155.在点样装置400完成对其工位上的载玻片800的点样操作后,传送带700将载玻片800继续传送至烘干装置500。烘干装置500用于对传送带700上的已加滴细胞溶液的载波片800进行烘干,以使细胞溶液能够更好地被固定在载波片800上的孔内。
156.在完成烘干装置500内的烘干操作后,传送带700将载玻片800继续传送至密封装置600。密封装置600用于在传送带700上的已经过烘干的载波片800表面形成密封层,以封闭载波片800上的孔,即形成如实施例二中的密封层400。密封装置600可以采用石蜡、盖玻片或透明的高分子薄膜作为密封层的材料。本实施例中,密封装置600采用覆蜡装置,使用石蜡涂层来作为密封层。在另一些实施例中,采用贴片装置或贴膜装置来采用盖玻片或高分子薄膜来作为密封层。
157.在密封装置600完成对其工位上的载玻片800的密封操作后,即获得如实施例二中
的免疫组化质控芯片,可通过进一步的转移方式传送至检验和包装工序,如在主机100内设置与本实施例中传送带700相配合的其余传送带或传送装置,以将制得的免疫组化质控芯片传送至本实施例的免疫组化质控芯片自动化加工设备的外部,以进行后续检验和包装,实现该功能有诸多现有的方式,并非本发明的主要内容,故在此不做赘述。
158.以上对于本实施例的描述中,主要通过一片载玻片的加工工序来对加工过程中的各装置进行说明,可以理解的是,传送带700上可以同时装载多片载玻片,同时在不同的工位上进行相应的加工操作,即本实施例的免疫组化质控芯片自动化加工设备可实现流水线化作业。
159.本实施例中的免疫组化质控芯片自动化加工设备还设置有外壳罩体(图中未示出),以使整个加工流水线被设置在具有防护的加工环境,在该环境中实现防尘、灭菌、超净等功能。
160.以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术人员无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。