1.本发明涉及复合降糖药物技术领域。具体地说是一种槲皮素-盐酸二甲双胍复合降糖药物的制备方法。
背景技术:
2.虽然类黄酮化合物具有各种药理学应用,但由于其水溶性差,而表现出较低的口服生物利用度。为了解决这个问题,已经开发并应用了许多有前途的策略,例如使用吸收增强剂、结构转化(前体药物、糖基化)和制药技术(载体复合物、纳米技术、共晶)。这些制剂方法通过提高黄酮的溶解度、溶解速率和渗透性,可以有效改善类黄酮的口服生物利用度,防止它们在胃肠道中降解或代谢,或将它们直接输送到其生理目标处。槲皮素(qu)是黄酮类化合物家族的关键成员,可以从各种蔬菜和水果,如洋葱、苹果、浆果、坚果、种子、树皮、花、茶、芸苔属蔬菜及叶子中提取得到。现代药理学研究表明,槲皮素对人体健康具有多种生物学功能,包括心血管保护、抗溃疡、抗过敏、抗癌、抗炎、抗糖尿病和白内障预防。越来越多的体内研究证明,槲皮素qu也可以被认为是一种抗氧化剂,因为它能够通过减少自由基的形成、改变抗氧化防御和抑制脂质来抑制黄嘌呤氧化酶。
3.二甲双胍(mh)是一种亲水性极强的药物,二甲双胍吸收半减期为0.9~2.6h,生物利用度50%~60%,但是由于其溶解能力过强,用药后很快以原形随尿液排出,清除半减期1.7~4.5h,12h内90%被清除。它主要从小肠中被吸收,且进入人体后不与血浆蛋白结合,但能迅速分布在人体的多个组织中,主要分布在肠壁中,通过增加外周组织对胰岛素的敏感性起到降血糖的作用。
4.槲皮素分子的主要局限性是溶解性低导致的口服生物利用度较差,而二甲双胍面临的问题恰好与之相反。因此,研究制备一种槲皮素与二甲双胍的复合物(qu-mh)来改善药物的溶解度、提高二者的生物利用度是解决当前槲皮素和二甲双胍应用局限的重要途径。
技术实现要素:
5.为此,本发明所要解决的技术问题在于提供一种槲皮素-盐酸二甲双胍复合降糖药物的制备方法,以解决当前槲皮素和盐酸二甲双胍在用于降糖时,槲皮素因溶解度过而盐酸二甲双胍因溶解能力过强而低导致其口服生物利用度较差的问题。
6.为解决上述技术问题,本发明提供如下技术方案:
7.一种槲皮素-盐酸二甲双胍复合降糖药物的制备方法,包括如下步骤:
8.步骤a:将槲皮素和盐酸二甲双胍混合均匀,得到混合原料;
9.步骤b:向混合原料中加入甲醇,采用加液研磨法或溶剂挥发法将混合原料中的槲皮素和盐酸二甲双胍进行复合反应【槲皮素上的酚羟基和二甲双胍的氨基发生反应】,得到槲皮素-盐酸二甲双胍复合降糖药物。
10.上述槲皮素-盐酸二甲双胍复合降糖药物的制备方法,步骤a中,槲皮素和盐酸二甲双胍的物质的量之比为1:(0.5~2.0)。
11.上述槲皮素-盐酸二甲双胍复合降糖药物的制备方法,步骤a中,槲皮素和盐酸二甲双胍的物质的量之比为1:1。
12.上述槲皮素-盐酸二甲双胍复合降糖药物的制备方法,步骤b中,加液研磨法的操作方法为:将混合原料置于研钵中,沿同一方向研磨,并在研磨过程中向混合原料中滴加甲醇,研磨结束后,对研磨后的产物进行干燥,即得到槲皮素-盐酸二甲双胍复合降糖药物。
13.上述槲皮素-盐酸二甲双胍复合降糖药物的制备方法,研磨时间为10~20min,甲醇的滴入体积与混合原料总物质的量二者之间的比值为200~500μl/mmol;干燥温度为40~60℃、干燥时间为1~2h。
14.上述槲皮素-盐酸二甲双胍复合降糖药物的制备方法,研磨时间为15min,甲醇的滴入体积与混合原料总物质的量二者之间的比值为300μl/mmol;干燥温度为50℃、干燥时间为2h。采用滴加的方式进行研磨反应,能够使两种反应原料混合均匀并充分反应。
15.上述槲皮素-盐酸二甲双胍复合降糖药物的制备方法,步骤b中,溶剂挥发法包括如下步骤:
16.步骤(b-1):将甲醇采用旋转蒸发仪旋蒸干净并加热后备用;
17.步骤(b-2):将混合原料置于超声设备中,边超声边向混合原料中加入经步骤(b-1)处理后的甲醇,直至混合原料完全分散,得到混合分散液;
18.步骤(b-3):将混合分散液用保鲜膜密封遮光【可以降低溶剂挥发速度,使原料充分复合】后,置于水浴中搅拌,进行水浴反应,反应结束后,得到反应混合体系;
19.步骤(b-4):将反应混合体系冷却至室温静置结晶,并将结晶产物进行干燥,干燥结束后,即得到槲皮素-盐酸二甲双胍复合降糖药物。
20.上述槲皮素-盐酸二甲双胍复合降糖药物的制备方法,步骤(b-1)中,将甲醇加热至45~55℃,保温备用【该温度范围内的甲醇能够将槲皮素和盐酸二甲双胍充分溶剂,有利于二者进行复合反应】;步骤(b-2)中,甲醇的加入量以使得混合原料恰好完全溶解为标准,该浓度下能够使两种原料充分参与反应,且有利于后续在结晶条件下析出更多目标产物。
21.上述槲皮素-盐酸二甲双胍复合降糖药物的制备方法,步骤(b-3)中,水浴反应的温度为40~60℃,水浴反应的时间为25~35min;步骤(b-4)中,干燥温度为40~60℃,干燥时间为2~4h。
22.上述槲皮素-盐酸二甲双胍复合降糖药物的制备方法,步骤(b-3)中,水浴反应的温度为50℃,水浴反应的时间为30min;步骤(b-4)中,干燥温度为50℃,若干燥温度过高,则会破坏目标产物的晶型结构;干燥时间为3h。
23.本发明的技术方案取得了如下有益的技术效果:
24.本发明采用加液研磨法或溶剂挥发法,将槲皮素与盐酸二甲双胍进行复合,形成槲皮素-盐酸二甲双胍复合降糖药物(qu-mh);该qu-mh复合药物中的槲皮素相比单纯的槲皮素具有更高的溶解性和生物利用度。将本发明制备的槲皮素-盐酸二甲双胍复合降糖药物(qu-mh)用于对糖尿病小鼠的治疗,结果表明qu-mh复合物对糖尿病小鼠具有协同降血糖效果。
附图说明
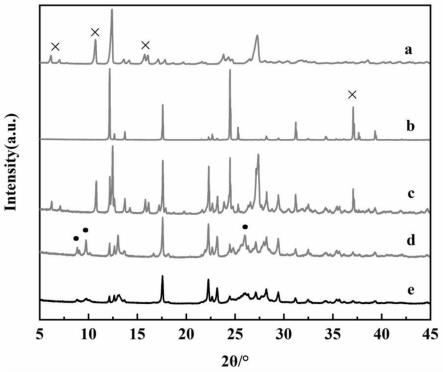
25.图1本发明实施例中qu、mh和制备的qu-mh的xrd图(图中:a-qu;b-mh;c-qu mh物理
混合;d-溶剂挥发法制备的qu-mh;e-加液研磨法制备的qu-mh);
26.图2本发明实施例中qu、mh和制备的qu-mh的ft-ir光谱图;
27.图3本发明实施例中qu、mh和制备的qu-mh的紫外图;
28.图4本发明实施例中qu的结构图;
29.图5本发明实施例中qu、mh和制备的qu-mh的tg分析图;
30.图6本发明实施例中qu、mh和制备的qu-mh的dtg分析图;
31.图7本发明实施例中qu的标准曲线图;
32.图8本发明实施例中qu-mh在水、pbs(ph=6.8或1.2)中的溶解度;
33.图9本发明实施例中qu和qu-mh在水中不同时间、不同波长下的吸光度曲线图;
34.图10本发明实施例中qu和qu-mh在水中的溶解度曲线图;
35.图11本发明实施例中qu和qu-mh在pbs(ph=6.8)中不同时间、不同波长下的吸光度曲线图;
36.图12本发明实施例中qu和qu-mh在pbs(ph=6.8)中的溶解度曲线图;
37.图13本发明实施例中qu和qu-mh在pbs(ph=1.2)中不同时间、不同波长下的吸光度曲线图;
38.图14本发明实施例中qu和qu-mh在pbs(ph=1.2)中的溶解度曲线图。
具体实施方式
39.1、本实施例中所用的试剂
40.本实施例中所用的盐酸二甲双胍和槲皮素均由上海易恩化学技术有限公司生产,其纯度均为97wt%;所用的甲醇为分析纯,由天津市鑫铂特化工有限公司。所用仪器设备均为市售常见仪器设备。
41.2、实验方法
42.2.1槲皮素-盐酸二甲双胍复合降糖药物的制备
43.加液研磨法:按物质的量比1:1准确称取反应原料槲皮素和盐酸二甲双胍(槲皮素qu:30.2mg,0.1mmol;盐酸二甲双胍mh:16.6mg,0.1mmol),置于干净的玛瑙研钵中混合均匀;按同一方向均匀充分研磨15min,在此过程中每5min滴加30μl甲醇【即,在第5min和第10min分别滴加30μl甲醇,共滴加60μl甲醇】,甲醇的滴入体积与混合原料总物质的量二者之间的比值为300μl/mmol;研磨结束后,对研磨后的产物在50℃进行干燥2h,即得到槲皮素-盐酸二甲双胍复合降糖药物,收集产物并用x-射线多晶衍射仪进行扫描分析。
44.溶剂挥发法:首先用旋转蒸发仪将甲醇旋蒸干净备并加热至50℃备用,按物质的量比1:1准确称取槲皮素qu和盐酸二甲双胍mh,在锥形瓶中混合均匀后边超声边缓慢加入甲醇溶解,直至反应物恰好完全溶解,得到黄色透明溶液,且此时溶液为饱和状态;使用保鲜膜密封遮光后锥形瓶在50℃水浴中搅拌30min;反应结束后室温静置冷却,结晶后所得产物在50℃干燥3h;收集产物并用x-射线多晶衍射仪进行扫描分析。
45.2.2槲皮素-盐酸二甲双胍复合降糖药物(qu-mh)的理化性质检测
46.2.2.1x-射线多晶衍射
47.用无水乙醇将载样台擦拭干净,待其挥干后将经过干燥、研磨好的样品颗粒粉末倒入载样台中,待测样品尽量集中于载样台内环凹槽中心处,用毛玻璃片按压使表面,尽量
使工作面平整;按下按钮打开设备门,将被测样品放置在测试架上,确认载样台安放正确后合紧设备门;修改合适的测试参数及模式,填入试样代号,点击开始扫描试样,进行测试。
48.2.2.2傅里叶变换红外
49.采用溴化钾压片法对实验进行红外光谱测定,为减少影响应使用高纯度级别的溴化钾,使用前用玛瑙研钵研细至200目以下,放置于数显红外烘烤灯下烘烤去除试剂及样品中残余的水分。扫描空白kbr压片,扣除背景。将样品分别取少量与溴化钾粉末充分碾磨混合(实验样品和溴化钾的质量比为1:100)进行压片,通常要求光谱图中绝大多数吸收峰处于80%~20%透光率范围内。扫描结束后,通过傅里叶红外光谱仪记录实验样品的ft-ir图,测量波数范围是4000~400cm-1
。
50.2.2.3热重分析
51.通过热重法来进行检测物质温度与质量变化关系的仪器被称为热重分析仪。机器预热后调节测试条件:在n2气氛下,温度范围为室温~800℃,升温速度为10℃/min。平衡后放入两个陶瓷坩埚,待3min后仪器上质量示数稳定后清零。此时可以取出一个坩埚装好样品再放回仪器内。待3min后仪器上质量示数稳定后即可开始运行仪器开始测试样品。
52.2.2.4材料的吸收曲线
53.用紫外分光光度计先对空白溶剂进行基线扫描,然后将待测样品溶解后,测量其在200~500nm波长范围的吸收曲线。
54.2.2.5槲皮素标准曲线的绘制
55.配置2mg/ml的槲皮素无水乙醇溶液作为储备液,分别取不同体积的储备液于10ml的容量瓶中,定容后得到40μg/ml、35μg/ml、30μg/ml、25μg/ml、20μg/ml、15μg/ml、10μg/ml、0.5μg/ml的槲皮素溶液,在使用紫外-可见分光光度法测量各372nm处各溶液吸光度值并绘制标准曲线。
56.2.2.6溶解度
57.在去离子水中的溶解度:称取qu和qu-mh样品各5mg于锥形瓶中,加入100ml去离子水放置在万向摇床上,于室温每分钟80转振荡下,分别于0、2、5、10、20、30、45、60、90、120min取样5ml,经0.22μm滤膜过滤,利用紫外-可见分光光度计进行全波长扫描,记录368nm处的吸光度,通过标准曲线计算去离子水中的溶解度,绘制曲线。
58.在ph=1.2的pbs中的溶解度:操作步骤同上,将去离子水替换为ph=1.2的磷酸缓冲溶液。
59.在ph=6.8的pbs中的溶解度:操作步骤同上,将去离子水替换为ph=6.8的磷酸缓冲溶液。
60.2.2.7降血糖活性研究
61.1)动物模型建立
62.本实施例选择链脲佐菌素(stz)试剂诱导,stz溶于0.1mmol
·
l-1
柠檬酸缓冲液,ph=4.4,冰浴,现配现用,5min内用完,连续5天(d)注射40mg
·
(kg
·
d)-1
,每次注射前小鼠禁食12h;注射72h后测定空腹血糖,将空腹血糖大于11.1mmol/l的小鼠纳入糖尿病模型。
63.2)体内血糖水平检测
64.糖尿病小鼠模型建立成功后,随机分组:正常对照组,糖尿病模型组、糖尿病模型 复合药物治疗组,糖尿病模型 单一药物治疗组,每组10只。治疗干预4周,实验过程中观察
各组小鼠的精神、营养、活动、饮食等情况,每周采血测定空腹12h后的血糖值。
65.3结果与讨论
66.3.1槲皮素-盐酸二甲双胍复合降糖药物(qu-mh)的物相
67.x-射线多晶衍射也可用于测定粉末样品的结晶。槲皮素、盐酸二甲双胍、两种药品物理混合,两种制备方法制得的qu-mh的xrd图谱见图1。三种化合物的xrd拓扑图形有显著差异。盐酸二甲双胍原料药的主要衍射峰在12.16
°
、17.6
°
、24.4824
°
、31.2103
°
、37.0831
°
峰形尖锐,衍射峰峰强,表明盐酸二甲双胍的晶型为非常良好的结晶型;槲皮素原料药的主要衍射峰为10.697
°
、12.397
°
、15.7352
°
、23.8127
°
、27.2437
°
;两种药品物理混合粉末的xrd谱图即为两种药品特征衍射峰的叠加;qu-mh的主要衍射峰为17.5691
°
、22.2673
°
、23.1431
°
、27.12
°
、28.2018
°
。虽然qu-mh的峰型相较前两者较钝,但衍射峰位置、强度均明显不同且有新的衍射峰出现和原料衍射峰的消失,三者存在显著差异,进一步证明了槲皮素与盐酸二甲双胍制得的纳米晶(盐)qu-mh形成了其独特的晶型;而且从整体峰强度比较可以看出,溶剂挥发法比加液研磨法制备的复合体结晶更好,因为在溶液中反应进行得更充分。
68.3.2槲皮素-盐酸二甲双胍复合降糖药物(qu-mh)的分子结构
69.mh、qu、qu-mh(溶剂挥发法制备的qu-mh)的ft-ir分析结果如图2所示,在盐酸二甲双胍的红外谱图中可以看出,在3372、3299cm-1
的吸收峰为
–
nh2的不对称及对称伸缩振动,3160cm-1
处吸收峰为
–
nh的伸缩振动吸收峰,1627cm-1
的吸收峰为c=n的伸缩振动,1476、1448cm-1
附近的双吸收峰为甲基c
–
h对称弯曲振动吸收峰。从槲皮素的红外谱图中可以看出,在1665cm-1
处出现的吸收峰为c=o的拉伸振动吸收峰,1610cm-1
的吸收峰为苯环骨架振动吸收峰,1562cm-1
、1521cm-1
的吸收峰分别为b环、a环苯环伸缩振动吸收峰,1382cm-1
的吸收峰为
–
oh的面内弯曲吸收峰,整个图谱中最明显的3401cm-1
位置出现的吸收峰为
–
oh的伸缩振动,说明羟基与羰基形成分子内氢键,从而提高分子的稳定性。在qu-mh的红外谱图中可以看出,两种药物通过复合后发生反应,由于新官能团的产生,一些吸收峰的峰形发生变化,如3000~3400cm-1
的吸收峰变得宽且钝,有些吸收峰位置发生了红移或蓝移,此外还有新的吸收峰出现。
70.从图3中可以看出槲皮素在255nm和372nm处有比较强的吸收,结合槲皮素的结构图4的分析,其中255nm处的吸收是由n
→
π*(a环)苯甲酰基的电子跃迁引起的,为ⅱ带,372nm处的吸收是由π
→
π*(b环)桂皮酰基系统的电子跃迁引起的,为ⅰ带。二甲双胍的紫外吸收图谱显示只有在238nm处出现强吸收峰,表示有k吸收带,则可能是两个双键形成共轭体系引起的。复合后qu-mh的紫外图谱同时体现出两个生色团组成和双键共轭体系的紫外吸收峰。
71.3.3槲皮素-盐酸二甲双胍复合降糖药物(qu-mh)的热力学性质
72.根据图5热重曲线可以看到,槲皮素的第一个吸热峰在104℃,失重5.31%,为水分子吸热蒸发失去的重量,第二个吸热峰在354℃,为槲皮素的主要熔融峰。二甲双胍有两个吸热峰(334℃和650℃),其中主要熔融峰在334℃,温度达到650℃是全部分解结束。复合物qu-mh(溶剂挥发法制备的qu-mh)含有一个主要吸热峰,而且此组峰不同于qu(354℃)和mh(334℃)的吸热峰,如图6所示,进一步证明了qu-mh的形成,而且此晶型为主要晶型。
73.3.4槲皮素-盐酸二甲双胍复合降糖药物(qu-mh)的溶解度曲线
74.为计算溶液中槲皮素的溶解率,精准绘制槲皮素的标准曲线:a=0.05671c-0.00164(r2=0.99923)。如图7所示槲皮素溶液在0.5~4μg/ml范围内呈良好的线性关系。与结晶型qu相比,qu-mh复合物(溶剂挥发法制备的qu-mh)显著提高了qu的溶解度。如图8至图14所示,溶解度实验显示qu几乎不溶于水,30min是达到溶解度最大值0.24μg/ml,2h后溶解度为0.18μg/ml,qu-mh在水中前45min溶解度迅速提高至2.85μg/ml,而后趋于平稳,2h时溶解度达到2.87μg/ml;在模拟胃部酸性条件ph=1.2的pbs中qu-mh的溶解度在2h内逐渐提高至2.71μg/ml;在模拟肠道酸性条件ph=6.8的pbs中qu-mh的溶解度在2h内逐渐提高至3.87μg/ml。对比室温溶解2h后的平衡溶解度可以明显的到结论,复合后槲皮素在肠道酸性条件的溶解度最高,在胃部酸性条件的溶解度最低,为qu作为一种有前途的化合物发展成为有效的药物产品奠定了基础。
75.3.5降糖活性
76.与对照组相比,糖尿病模型组小鼠血糖持续较高水平(p<0.05),4周时,盐酸二甲双胍(mh)、槲皮素(qu)单一组的血糖水平为模型组的84.0%、61.0%(p<0.05),qu-mh复合物(溶剂挥发法制备的qu-mh)的血糖水平仅为模型组的54.8%(p<0.05),且与单一药物组相比有统计学差异(p<0.05),提示qu-mh复合物对糖尿病小鼠具有协同降血糖效果。结果见表1。
77.表1 不同组分对糖尿病小鼠血糖水平影响(mmol/l)
[0078][0079]
本实施例研究了槲皮素与盐酸二甲双胍的复合方法,由于qu中含有丰富的羟基,极有可能与mh中的n形成n-h
…
o或o-h
…
n氢键。所以本实施例通过溶剂挥发法制备了复合体qu-mh,其外观形貌与qu和mh有明显不同,呈现微小圆球状且分散均匀。由于不同的物相结构不同,所以每个物相都有独特的x射线衍射角特征峰,结构的略微差异即可反应在其衍射谱中的衍射角有所偏移。通过比较qu、mh、qu-mh、qu/mh的特征衍射峰发现,qu与mh复合后有原料特征峰的消失和新特征峰的产生,证明形成了新的物相。热重分析检测结果显示,qu-mh的热稳定性有所改变,结合红外结果,表明是由qu与mh成功形成了复合物qu-mh。复合物qu-mh在常温下水中2h的溶解度提高到2.87μg/ml,在ph=1.2和ph=6.8的pbs中溶解度达到2.71μg/ml、3.87μg/ml。从溶出度曲线分析,qu-mh的溶出速度也明显高于qu,表明通过复合可以提高qu的溶解度,改善生物利用度。降糖实验结果表明提示qu-mh复合物对糖尿病小鼠具有协同降血糖效果。
再多了解一些
本文用于创业者技术爱好者查询,仅供学习研究,如用于商业用途,请联系技术所有人。