1.本发明涉及β-拉帕醌和替莫唑胺在制备治疗或抑制胶质母细胞瘤药物中的应用,属于医药技术领域。
背景技术:
2.胶质母细胞瘤(gbm)是一种原发性中枢神经系统癌症,是成年人中最常见的、恶性的、有高度侵袭性的原发性脑恶性肿瘤,占所有原发性中枢神经系统(cns)癌症的近50%,每年发病率约为3.22/100000,且预后极差,接受三联疗法后的患者的长期生存率为6.2个月到 16.7个月不等。
3.近几十年来,随着对gbm的分子和遗传特征不断的深入研究,相应的诊断和外科技术也取得了很大进步;同时也发展了很多新的治疗方法。目前对胶质母细胞瘤患者的治疗主要手段包括手术切除、放疗和替莫唑胺(tmz)结合化疗。
4.虽然各种新型药物制剂、给药系统和肿瘤靶向等用以抑制gbm的肿瘤进展或转移的策略已被广泛研究,但血脑屏障(bbb)依然是降低抗癌药物治疗gbm患者疗效的主要限制因素。
5.此外,替莫唑胺(tmz)作为gbm一线治疗药物已经被证明具有血浆半衰期短、易产生耐药性、依耐性、副作用大等多种缺点。bbb的障碍和tmz日益突出的缺陷是治疗gbm 的主要的两个临床挑战,这极大的限制了几乎所有的治疗手段。
技术实现要素:
6.为了解决上述现有技术中存在的缺陷,本发明的目的是提供β-拉帕醌和替莫唑胺在制备治疗或抑制胶质母细胞瘤药物中的应用,用于解决现有技术采用tmz治疗胶质母细胞瘤容易产生tmz耐药性,以及血脑屏障等影响治疗效果的问题。
7.为了实现上述目的,本发明所采用的技术方案为:
8.本发明的一个目的是提供了一种β-拉帕醌联合替莫唑胺在制备治疗或抑制胶质母细胞瘤的药物中的应用,所述药物包括载体和替莫唑胺、β-拉帕醌;所述载体为透明质酸-胱胺-花生四烯酸-angiopep-2。
9.本发明利用靶向修饰递送系统的方法用于突破血脑屏障,靶向载药系统可以将更多的治疗药物运输到gbm部位以达到良好的疗效;具体是通过构建氧化还原敏感性的靶向纳米颗粒透明质酸-胱胺-花生四烯酸-angiopep-2(hca-a2),并采用该hca-a2载体对tmz和β
‑ꢀ
拉帕醌(β-lapa)同时进行包载联用,利用angiopep-2的双重靶向性将两种药物输送到gbm 中,起到显著抑制肿瘤细胞生长的作用,为临床治疗gbm提供了一种新的策略。
10.在本发明的一种实施方式中,所述药物中替莫唑胺tmz与载体质量比为1:2~1:5,β
‑ꢀ
拉帕醌lapa与载体质量比为1:150~1:200。
11.在本发明的一种实施方式中,所述药物通过谷胱甘肽调控释放包载的tmz和lapa。
12.在本发明的一种实施方式中,所述载体的tmz载药量为30.1
±
2.2,包封率为85.7
±
6.0; lapa的载药量为0.41
±
0.005%,包封率为78.4
±
1.9%。
13.在本发明的一种实施方式中,所述替莫唑胺的浓度为10~280μg/ml,β-拉帕醌的浓度为 0.1~4μg/ml。
14.在本发明的一种实施方式中,所述替莫唑胺的浓度为17.5~140μg/ml,β-拉帕醌的浓度为0.25~2μg/ml。
15.在本发明的一种实施方式中,所述替莫唑胺的ic
50
为45.26;β-拉帕醌的ic
50
为0.658。
16.在本发明的一种实施方式中,所述透明质酸-胱胺-花生四烯酸-angiopep-2的制备包括如下步骤:
17.(1)透明质酸-胱胺(hc)的合成
18.将透明质酸溶于装有水的圆底烧瓶中,充分溶解;然后向该溶液添加1-乙基-(3-二甲基氨基丙基)碳化二亚胺盐酸盐和1-羟基苯并三唑,并搅拌溶解,调节反应液ph值,在冰水浴中活化透明质酸的羧基;待活化完毕,向溶液中加入胱胺二盐酸盐,调节溶液ph值,在室温下反应,反应结束后,透析,冻干,即得hc。
19.(2)透明质酸-胱胺-花生四烯酸(hca)的合成
20.在氮气保护下,将花生四烯酸用二氯甲烷溶解于圆底烧瓶中,并依次加入1-乙基-(3-二甲基氨基丙基)碳化二亚胺盐酸盐和1-羟基苯并三唑,冰水浴搅拌溶解,得花生四烯酸混合溶液;然后将上述步骤(1)制备的hc在ep管中用水溶解,并加入二异丙基乙胺,得到hc混合溶液;最后将hc的混合溶液加入花生四烯酸的混合溶液中搅拌混匀,氮气保护,抽真空,水浴恒温下搅拌反应;之后再采用二氯甲烷进行萃取,收集水相,透析,冷冻干燥,即得hca。
21.(3)透明质酸-胱胺-花生四烯酸-angiopep-2(hca-a2)的合成
22.称上述步骤(2)制备的hca,加水搅拌,然后超声破碎,1-乙基-(3-二甲基氨基丙基) 碳化二亚胺盐酸盐和1-羟基苯并三唑,调节溶液ph值,在冰水浴下活化;然后加入angiopep-2 靶肽,在室温下搅拌反应;反应结束后,透析,冷冻干燥,即得hca-a2。
23.在本发明的一种实施方式中,所述透明质酸的分子量为1-10w。
24.在本发明的一种实施方式中,所述透明质酸与胱胺的质量比为1:0.6~1.2。
25.在本发明的一种实施方式中,所述hc与花生四烯酸的质量比为1:10~20
26.在本发明的一种实施方式中,所述hca与angiopep-2的质量比为1:0.5~2。
27.在本发明的一种实施方式中,所述步骤(1)中调节反应液的ph值为2~6。
28.在本发明的一种实施方式中,所述步骤(1)中调节溶液ph值为6~7。
29.本发明的另一个目的是提供一种β-拉帕醌在制备治疗或抑制胶质母细胞瘤药物中的应用。
30.本发明的有益效果:
31.1、本发明在亲水性的透明质酸上通过接上含有二硫键的胱胺以连接疏水性花生四烯酸,形成两亲性分子hca,可以自组装成可包载脂溶性药物的纳米载体,使tmz的载药量高达 30%左右。
32.2、本发明中tmz和lapa联合包载使用时效果突出,单载时hca-a2-tmz中tmzic
50
=
hc。
51.(2)透明质酸-胱胺-花生四烯酸(hca)的合成
52.取1.9g花生四烯酸(2.5mmol)于100ml圆底烧瓶中用10ml二氯甲烷溶解,并依次加入 479.25mg(2.5mmol)1-乙基-(3-二甲基氨基丙基)碳化二亚胺盐酸盐和337.8mg(2.5mmol)1-羟基苯并三唑,在氮气保护、冰水浴条件下搅拌60min;然后取200mg的hc用8ml纯化水水混合溶液溶解,并加入0.44ml(2.5mmol)二异丙基乙胺;
53.最后将hc的混合溶液加入花生四烯酸的混合溶液中搅拌混匀,然后抽真空,氮气保护, 30℃水浴恒温下搅拌反应24h;之后采用二氯甲烷进行萃取,收集水相,用水洗三次后并入,装入截留分子量3500da的透析四天后,预冻干后冷冻干燥,即得到hca。
54.(3)透明质酸-胱胺-花生四烯酸-angiopep-2(hca-a2)的合成
55.称取20mg(0.05mmol)的hca,加10ml水搅拌4h,然后超声破碎30min,再加入1-乙基-(3-二甲基氨基丙基)碳化二亚胺盐酸盐28.75mg(0.15mmol),1-羟基苯并三唑20.25mg (0.15mmol),调ph值至6,在冰水浴下活化2h后;然后加入20mg的angiopep-2靶肽,在室温下搅拌反应24h;反应结束后,用蒸馏水透析三天,预冻后冻干,即得hca-a2。
56.具体合成路线图如下:
[0057][0058]
2、hca-a2载体数据表征
[0059]
对1中制备的hca-a2进行红外与核磁数据测定:
[0060]
结合附图1可知,在2930cm-1
附近出现ha中羧基中-oh的峰,在接上花生四烯酸后在 3000cm-1
左右会出现aa中ch=ch上的c-h峰,所以在2930cm-1
出峰强度增强;相对来说,其它位置上新出的特征峰并不明显;与没有接靶肽的载体hca相比,结合靶肽之后在 1553cm-1
左右新出一个很明显的在苯环上的碳氢键的特征峰。
[0061]
结合附图2核磁氢谱进行分析,a、b、c分别是hc、hca、hca-a2的核磁氢谱归属结果,图中3.4ppm附近a是胱胺中靠近氨基的碳原子的氢(-ch
2-nh2),3.0ppm附近b是胱胺中靠近s原子的c原子上的氢(-s-ch
2-);1.9ppm附近c是透明质酸糖环上甲基上的氢 (-ch3),0.9ppm附近d是花生四烯酸上甲基上的氢,5.2ppm附近e、f、g、h、i、j、k、l 是花生四烯酸上的碳碳双键上的氢,6.8、7.2、7.3ppm附近是靶肽中带苯环氨基酸上苯环上的氢。结合上述红外和核磁结果,表明hca-a2的成功合成。
[0062]
3.载体的制备
[0063]
(1)hca-a2纳米载体制备
[0064]
①
在室温下,取10mg的hca-a2溶于10ml水,搅拌10min,超声破碎40min,待浑浊的
液体变澄清,即为hca-a2纳米载体溶液制备完成,冻干后保存备用。
[0065]
②
在室温下,取10mg的hca溶于10ml水,搅拌10min,超声破碎40min,待浑浊的液体变澄清,即为hca纳米载体溶液制备完成,冻干后保存备用。
[0066]
(2)hca-a2-tmz、hca-a2-lapa、hca-a2-tmz&lapa载药纳米载体的制备
[0067]
先用四氢呋喃0.5ml和甲醇2ml将脂溶性的tmz 10mg溶解成4mg/ml的溶液;同时用甲醇4ml将lapa 2mg溶解成0.5mg/ml;
[0068]
①
将hca-a2 12mg用6ml蒸馏水溶解成2mg/ml溶液,充分搅拌之后,再加入与载体质量比为1:2的tmz;之后在通风橱中室温搅拌8h;然后再超声破碎,使hca-a2载体在组装成纳米颗粒的过程中将亲脂性药物tmz包裹,再通过3000rpm离心10min、用0.22μm滤头过滤除去游离药物后,得到hca-a2-tmz载药载体溶液,冻干后保存备用。
[0069]
②
将hca-a2 12mg用6ml蒸馏水溶解成2mg/ml溶液,充分搅拌之后,再加入与载体质量比为1:150的lapa;之后通风橱中室温搅拌8h;超声破碎,使hca-a2聚合物载体在组装成纳米颗粒的过程中将亲脂性药物lapa包裹,再通过3000rpm离心10min、用0.22μm 滤头过滤除去游离药物后,得到hca-a2-lapa载药载体溶液,冻干后保存备用。
[0070]
③
将hca-a2 12mg用6ml蒸馏水溶解成2mg/ml溶液,充分搅拌之后,再加入tmz(tmz 与载体质量比为1:2)和lapa(lapa与载体质量比为1:150)溶液;通风橱中室温搅拌8h;超声破碎,使hca-a2载体在组装成纳米颗粒的过程中将两种亲脂性药物tmz和lapa包裹,再通过3000rpm离心10min、用0.22μm滤头过滤除去游离药物后,得到hca-a2-tmz&lapa 载药载体溶液,冻干后保存备用。
[0071]
④
将hca 12mg用6ml蒸馏水溶解成2mg/ml溶液,充分搅拌之后,再加入tmz(tmz 与载体质量比为1:2)和lapa(lapa与载体质量比为1:150)溶液;通风橱中室温搅拌8h;超声破碎,使hca载体在组装成纳米颗粒的过程中将两种亲脂性药物tmz和lapa包裹,再通过3000rpm离心10min、用0.22μm滤头过滤除去游离药物后,得到hca-a2-tmz&lapa 载药载体溶液,冻干后保存备用。
[0072]
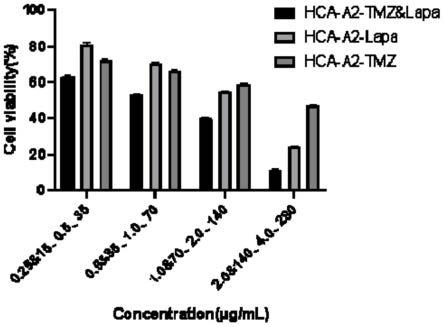
(3)粒径与电位
[0073]
用zeta电位及纳米粒度分析仪对制备好的hca-a2、hca-a2-tmz&lapa两种纳米载体进行粒径和电位进行测定分析,图3中a、b分别是hca-a2和hca-a2-tmz&lapa的zeta 电位图,图4中a是hca-a2-tmz&β-lapa的粒径分布图,表1是测定结果的统计:
[0074]
表1载体粒径与电位
[0075]
载体名称粒径大小/nmpdi值zeta电位/mvhca-a2155.830.267
±
0.012-10.43
±
0.52hca-a2-tmz&β-lapa148.90.242
±
0.011-10.08
±
0.34
[0076]
上表结果表明hca-a2粒径为155.83nm,载药后测得粒径148.9nm,几乎没有发生变化。
[0077]
(4)透射电镜表征
[0078]
将制备好的1.5mg/ml的hca-a2-tmz&lapa纳米载体溶液滴一滴到铜网上,在室温下晾干后用透射电镜进行观察,附图4中b、c是不同比例尺下的拍摄结果。
[0079]
透射电镜结果表明hca-a2-tmz&lapa纳米载体呈圆球形,粒径约在110nm左右。
[0080]
4、载药量与包封率测定
[0081]
取载药纳米颗粒溶液,各取0.1ml,分别用1ml二甲基亚砜溶解,破坏载药纳米颗粒的结构使包载的药物释放出来,然后用紫外分光光度计测试,测得药物的包封量,由此结合公式1、2可计算出载药量和包封率,结果汇总如表2所示;
[0082]
公式1
[0083][0084]
公式2
[0085][0086]
表2载体的载药量和包封率
[0087]
载药载体名称tmz载药量(%)tmz包封率(%)lapa载药量(%)lapa包封率(%)hca-tmz&lapa30.5
±
2.687.1
±
7.4
±
0.43
±
0.007
±
79.5
±
2.6
±
hca-a2-tmz&lapa30.1
±
2.285.7
±
6.00.41
±
0.00578.4
±
1.9
[0088]
上表结果表明:hca-a2的tmz载药量都高达30%左右,包封率达到87%以上,lapa 的载药量和包封率分别是0.4%和78%以上。
[0089]
实施例
[0090]
本发明的β-拉帕醌或β-拉帕醌联合替莫唑胺在制备治疗胶质母细胞瘤药物中的应用
[0091]
1.药物释放性能测定
[0092]
取上述2
‑③
中制备的hca-a2-tmz&lapa载药载体溶液1ml分别转移到两个3.5kda透析袋,放在棕色玻璃样品瓶中,分别加入20ml pbs(7.4)和20ml含谷胱甘肽的pbs(7.4),在37℃、100rpm摇床中进行释放,定时取样并补加同体积的、新的pbs。用紫外分光光度计检测出各组样品的吸收值,然后计算出累计释放量,结果如附图5所示。
[0093]
结合附图5中a、b可知,没有谷胱甘肽时,药物只能少量释放出来,48h释放出30%左右,说明载体可以相对稳定存在;而在谷胱甘肽存在的条件下可以快速、大量的释放出包载的药物tmz和lapa,20h左右就可以释放出80%左右;表明本发明的hca-a2纳米载体具有很好的氧化还原敏感性,也意味着当载药纳米粒子到达肿瘤部位时在谷胱甘肽的刺激下可以快速释放包载的tmz和lapa,以达到更好的治疗效果。
[0094]
2.细胞杀伤力测定
[0095]
(1)用mtt法检测空白载体hca-a2的细胞毒性如附图6所示。
[0096]
先培养nih 3t3细胞和c6肿瘤细胞,用胰酶消化后细胞计数,稀释到6万个/ml左右,在96孔板中铺两种细胞0.1ml/孔,培养24h后,用不同浓度的溶有hca-a2的培养液代替原来的培养液,每孔0.1ml,每组设置6个复孔,继续培养24h后弃掉含样品的培养液,每孔加入0.1ml 0.5mg/ml的mtt(二苯基四氮唑溴盐)溶液,在培养箱孵育4h后,弃掉mtt 溶液,每孔加入0.1ml二甲基亚砜溶液,在37℃100rpm摇床中震荡10min,最后用酶标仪进行测试。
[0097]
计算出两种细胞的存活率,存活率统计图如附图6,细胞生长存活率均在85%以下,在 hca-a2载体浓度为250μg/ml,细胞的存活率高达90%以上;可见,hca-a2具有良好的
生物相容性。
[0098]
(2)测定游离药物对c6细胞杀伤力
[0099]
先培养c6肿瘤细胞,用胰酶消化后细胞计数,稀释到6万个/ml左右,在96孔板中铺两种细胞0.1ml/孔,培养24h后,用不同浓度的溶有游离tmz和lapa的培养液代替原来的培养液,每孔0.1ml,每组设置6个复孔,继续培养24h后弃掉含样品的培养液,每孔加入 0.1ml 0.5mg/ml的mtt溶液,在培养箱孵育4h后,弃掉mtt溶液,每孔加入0.1ml二甲基亚砜溶液,在37℃100rpm摇床中震荡10min,最后用酶标仪进行测试。
[0100]
计算出两种细胞的存活率和抑制率,存活率结果统计如附图7中a、b所示;由此结果计算出两种药物对c6细胞的ic
50
值分别是tmz ic
50
=207.4μg/ml,lapa ic
50
=1.849μg/ml,表明lapa对c6细胞的杀伤力效果更佳突出。
[0101]
(3)hca-a2-tmz、hca-a2-lapa和hca-a2-tmz&lapa对c6细胞杀伤力
[0102]
先培养c6肿瘤细胞,用胰酶消化后细胞计数,稀释到6万个/ml左右,在96孔板中铺两种细胞0.1ml/孔,培养24h后;
[0103]
用不同浓度的溶有hca-a2-tmz(tmz的浓度为35、70、140和280μg/ml)、 hca-a2-lapa(lapa的浓度为0.5、1.0、2.0和4.0μg/ml)和hca-a2-tmz&lapa(tmz&lapa 浓度为17.5和0.25、35和0.50、75和1.00、140和2.00μg/ml)的培养液代替原来的培养液,每孔0.1ml,每组设置6个复孔,继续培养24h后弃掉含样品的培养液,每孔加入0.1ml 0.5mg/ml的mtt溶液,在培养箱孵育4h后,弃掉mtt溶液,每孔加入0.1ml二甲基亚砜溶液,在37℃100rpm摇床中震荡10min,最后用酶标仪进行测试。
[0104]
计算出两种细胞的存活率和抑制率,存活率结果如附图8所示,具体浓度、生长抑制率和联合作用指数如下表3所示。
[0105]
结合附图8和表3数据可知,hca-a2-tmz&lapa减半使用(hca-a2-tmz、hca-a2-lapa 浓度的0.5倍)在一定浓度范围内具有突出的效果,经过计算hca-a2-tmz&lapa中tmzic
50
=45.26μg/ml,lapa ic
50
=0.658μg/ml,而单载时hca-a2-tmz中tmz ic
50
=249.95μ g/ml,hca-a2-lapa中lapa ic
50
=2.33μg/ml,均比双载联合使用时的两倍量还多。
[0106]
采用联合作用指数(combined index,ci)判断两种药物的协同性;ci的计算公式:
[0107][0108]
ic
t
是单载tmz中hca-a2-tmz抑制率x%时的浓度,ic
l
是单载lapa中hca-a2-lapa 抑制率x%时的浓度,ic
tl-t
、ic
tl-l
是双载联用时hca-a2-tmz&lapa抑制率x%时的tmz 浓度和lapa浓度。
[0109]
表3 hca-a2-tmz&lapa的协同指数
[0110][0111]
由上述表3数据可知,tmz和lapa联合使用时效果显著,hca-a2-tmz&lapa浓度 17.5&0.25μg/ml表现出强协同作用,35&0.5μg/ml和70&1.0μg/ml时表现出高度协同作用,70&1.0μg/ml时表现出中度协同作用,在降低tmz用量的同时还可以大大提高的对c6 细胞杀伤力(根据soriano等的判断方法,0.9≤ci≤1.1为叠加作用,0.8≤ci《0.9为低度协同作用,0.6≤ci《0.8为中度协同作用,0.4≤ci《0.6为高度协同作用,0.2≤ci《0.4为强协同作用)。
[0112]
3.载药载体体外血脑屏障(bbb)模型穿透
[0113]
为了研究通过血脑屏障的药物传递,本发明建立了体外血脑屏障模型,其中将b end.3 细胞接种到上部小室,对照组只加培养液。7天后,待b end.3细胞在小室上底部完全长满后,向两组小室中加入100μg/ml的荧光素钠,下室加入0.5ml不含血清的培养液;分别在0.5h、 1h、1.5h、2h后各取下室培养液0.1ml到96孔板,每次取完补入0.1ml新鲜培养液,然后用酶标仪测各组样品的荧光值,最后根据标准曲线计算出渗透到下室培养液中荧光素钠的浓度和体积。计算出内皮通透性系数(pflu=4.5
×
10-7
cm/s)表明模型构建成功。
[0114]
先在下室中铺c6细胞(10万/孔),孵育24h。然后将准备好的游离tmz&lapa混合溶液(tmz 103.5μg/ml,lapa 0.925μg/ml)、游离tmz(tmz 207.4μg/ml)、游离lapa (lapa 1.849μg/ml)、hca-tmz&lapa(tmz 50μg/ml,lapa 0.71μg/ml)和 hca-a2-tmz&lapa(tmz50μg/ml,lapa 0.71μg/ml)无血清培养液溶液加到上室,12h 后用pbs把培养液和用胰酶消化下来的细胞一起离心收集,加am&pi染色剂染色30min, 37℃,离心,再用pbs洗涤,离心,收集细胞,加入pbs重悬成细胞悬液。
[0115]
细胞悬液用流式细胞仪分析,定量统计细胞存活率结果如附图9中a所示;细胞悬液滴到共聚焦皿底部盖上盖玻片后用共聚焦显微镜观察,附图9中b、c显示各组共聚焦荧光显微镜拍摄结果,绿色为活细胞,红色代表死细胞。
[0116]
从以上流式和共聚焦结果来看,由于游离的lapa和tmz都是脂溶性的小分子化合物,所以他们能更轻松得穿过构建的体外bbb模型,从而更多地到达下室造成更多c6肿瘤细胞的死亡,tmz&lapa组抑制率为65.85%,单独使用游离的tmz或者lapa抑制率分别为21.49%和23.66%。
[0117]
相比使用hca-tmz&lapa的组别,带有靶头的hca-a2-tmz&lapa可以造成更大比例的c6细胞的死亡,细胞抑制率为39.1%,抑制效果更好,而没有靶头的hca-tmz&lapa组抑制率为18.11%,表明带有靶头的hca-a2-tmz&lapa可以更容易穿透bbb模型,证明其靶向性;另一方面,hca-a2-tmz&lapa使用低浓度时依然可以造成大量的c6细胞死亡,较单独使用两种药物效果有显著提升,表明lapa和tmz联合使用潜力巨大。
[0118]
另外,此部分结果与前面细胞杀伤力实验结果一致,证明了lapa和tmz联合的显著效果和hca-a2-tmz&lapa的强穿透能力。
[0119]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。