1.本发明涉及纳米药物载体领域,具体地,本发明提供了一种阳离子脂质体分子,及其制备方法,和使用此类分子进行纳米药物递送的用途。
背景技术:
2.治疗性核酸,如信使rna(mrna)、反义寡核苷酸、核酶、dna酶、质粒、免疫刺激核酸、antagomir、antimir、模拟物(mimic)、supermir和适配子等,可以用于实现特定细胞产物的表达,从而用于治疗例如与蛋白质或酶的缺乏有关的疾病或症状。核酸类药物的治疗性应用极其广泛的,这是因为可以合成构建体以产生任何所选蛋白质序列,而核酸的表达产物可以提高蛋白质的存在水平,取代缺失的或非功能的蛋白质形式,或在细胞或生物体内引入新的蛋白质以及相关功能。
3.基于核酸的治疗具有巨大潜力,但这一治疗方法通常需要将核酸更有效地递送至细胞或生物体内的适当位点以实现这种治疗效果。关于递送核酸以便在生物系统中影响所期望的应答,还存在着诸多挑战。在治疗环境中使用寡核苷酸目前面临着两个问题:第一,游离的rna易于在血浆中核酸酶消化。第二,游离rna进入存在相关翻译机制的细胞内隔室的能力受限。
4.由阳离子脂质与其他脂质组分(如中性脂质、胆固醇、peg、peg化的脂质和寡核苷酸)形成的脂质纳米颗粒可以用于阻止rna在血浆中的降解并促进寡核苷酸的细胞摄取,然而,本领域仍然需要开发其他能够用于递送寡核苷酸的阳离子脂质和脂质纳米颗粒,从而提供更好的递送效果,例如,优化的药物:脂质比,保护核酸不在血清中被降解和清除,良好的耐受性,提供足够的治疗指数等。
5.综上所述,本领域尚需要开发具有全新结构的阳离子脂质体分子。
技术实现要素:
6.本发明的目的是提供一种具有全新结构的阳离子脂质体分子。
7.本发明的第一方面,提供了一种如下式i所示的脂质体化合物:
[0008][0009]
其中,
[0010]
侧链部分的主链(即最长链)上各自独立地具有1-40个碳;
[0011]
a1和a2各自独立地为0、1、2或3;
[0012]
x和y各自独立地选自n或ch,且至少一个x或y为n;
[0013]r11
和r
22
各自独立地选自下组:取代或未取代的直链或支链c
1-10
烷基,或r
11
和r
22
共同构成取代或未取代的直链或支链c
1-4
亚烷基;
[0014]
r2选自下组:取代或未取代的直链或支链c
1-4
亚烷基;
[0015]
r3和r4各自独立地选自下组:化学键,或取代或未取代的直链或支链c
2-10
亚烷基;
[0016]
各个r5和r6各自独立地选自下组:化学键,或取代或未取代的直链或支链c
1-10
亚烷基、取代或未取代的直链或支链c
2-10
亚烯基(即,当a1或a2为2或3时,各个r5和r6可以相同或不同);
[0017]
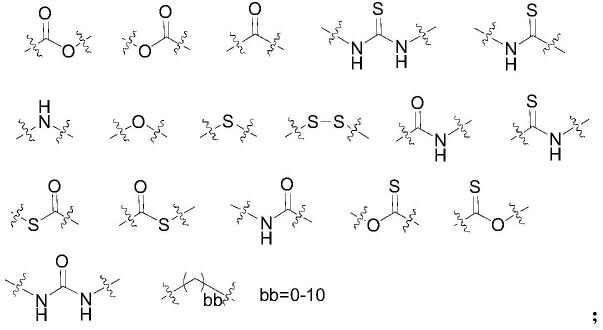
各个m1和m2各自独立地为选自下组的基团:
[0018][0019]
r7和r8各自独立地选自下组:化学键,或取代或未取代的直链或支链c
1-10
亚烷基、取代或未取代的直链或支链c
2-10
亚烯基;
[0020]
r9和r
10
各自独立地选自下组:取代或未取代的直链或支链c
1-20
亚烷基、取代或未取代的直链或支链c
2-20
亚烯基;
[0021]
其中,所述的侧链部分至少存在一个不为的m1或m2基团,与此同时,其对应的主链上具有10-40个碳,较佳地具有12-30个碳(如7、8、9、10、20、21、22、23、24、25、26、27、28、29个碳);
[0022]
除非特别说明,所述的取代指基团上的一个或多个氢原子被选自下组的取代基所取代:直链或支链c
1-10
烷基(例如直链或支链c
1-4
烷基)、直链或支链c
2-4
烯基、oh、nh2、羟基取代的直链或支链c
1-4
烷基、羟基取代的直链或支链c
2-4
烯基。
[0023]
在另一优选例中,所述的式i化合物中,当a1和a2各自独立地为1、2或3时,中至少一个为主链(即最长链)上具有2-10个碳的链段;且当r3、r4、r5或r6被取代时,所述的取代指基团上的一个或多个氢原子被选自下组的取代基所取代:直链或支链c
1-4
烷基、直链或支链c
2-4
烯基、oh、nh2、羟基取代的直链或支链c
1-4
烷基、羟基取代的直链或支链c
2-4
烯基。
[0024]
在另一优选例中,所述的式i化合物具有如下式ii所示的结构:
[0025][0026]
x和y各自独立地选自n或ch,且至少一个x或y为n;
[0027]
r1选自下组:其中,a、ggg、hhh、b、iii和kkk各自独立地为0、1、2或3;
[0028]
r2选自下组:
[0029]
r3选自下组:选自下组:其中,ww、xx、c、d、ff各自独立地为0、1、2、3、4、5、6、7、8、9或10;
[0030]
r4选自下组:选自下组:其中,yy、zz、e、f、gg各自独立地为0、1、2、3、4、5、6、7、8、9或10;
[0031]
上述各式中,cc、dd、a、b为选自下组的取代基:h、ch3、oh、ch2oh、c2h4oh、nh2;
[0032]
r5选自下组:其中,g、h、dd、jj和kk各自独立地为0、1、2、3、4、5、6、7、8、9或10;
[0033]
r6选自下组:其中,i、j、ee、mm和nn各自独立地为0、1、2、3、4、5、6、7、8、9或10;
[0034]
r7选自下组:其中,k、l和m各自独立地为0、1、2、3、4、5、6、7、8、9或10;
[0035]
r8选自下组:其中,n、o和q各自独立地为0、1、2、3、4、5、6、7、8、9或10;
[0036]
上述各式中,c、d、e、f、g、j各自独立地选自下组:h、ch3;
[0037]
r9选自下组:选自下组:其中,r、s、oo、pp、qq、rr、u、v、aaa、bbb、ccc、hh各自独立地为0、1、2、3、4、5、6、7、8、9、10、11或12;
[0038]r10
选自下组:选自下组:其中,w、x、ss、tt、uu、vv、u、aa、ddd、eee、fff、ii各自独立地为0、1、2、3、4、5、6、7、8、9、10、11或12;
[0039]
上述各式中,k、l、m和n各自独立地选自下组:h、ch3;aa和bb各自独立地选自下组:h、ch3、oh或nh2;
[0040]
前提条件是侧链部分的主链(即最长链)上各自独立地具有2-40个碳,且至少一条侧链部分上具有10-40个碳。
[0041]
在另一优选例中,a为0、1或2。
[0042]
在另一优选例中,b为0、1或2。
[0043]
在另一优选例中,ggg为0、1或2。
[0044]
在另一优选例中,hhh为0、1或2。
[0045]
在另一优选例中,iii为0、1或2。
[0046]
在另一优选例中,kkk为0、1或2。
[0047]
在另一优选例中,ww为0、1、2、3、4、5、6、7或8。
[0048]
在另一优选例中,xx为0、1、2、3、4、5、6、7或8。
[0049]
在另一优选例中,c为0、1、2、3、4、5、6、7、8或9。
[0050]
在另一优选例中,d为0、1、2、3、4、5、6、7、8或9。
[0051]
在另一优选例中,yy为0、1、2、3、4、5、6、7或8。
[0052]
在另一优选例中,zz为0、1、2、3、4、5、6、7或8。
[0053]
在另一优选例中,e为0、1、2、3、4、5、6、7、8或9。
[0054]
在另一优选例中,f为0、1、2、3、4、5、6、7、8或9。
[0055]
在另一优选例中,g为0、1、2、3、4、5、6、7、8或9。
[0056]
在另一优选例中,h为0、1、2、3、4、5、6、7、8、9或10,优选为0、1、2、3、4、5、6、7、8或9。
[0057]
在另一优选例中,i为0、1、2、3、4、5、6、7、8、9或10,优选为0、1、2、3、4、5、6、7、8或9。
[0058]
在另一优选例中,j为0、1、2、3、4、5、6、7、8、9或10,优选为0、1、2、3、4、5、6、7、8或9。
[0059]
在另一优选例中,jj为0、1、2、3、4、5、6、7、8、9或10,优选为0、1、2、3、4、5、6、7或8。
[0060]
在另一优选例中,kk为0、1、2、3、4、5、6、7、8、9或10,优选为0、1、2、3、4、5、6、7或8。
[0061]
在另一优选例中,mm为0、1、2、3、4、5、6、7、8、9或10,优选为0、1、2、3、4、5、6、7或8。
[0062]
在另一优选例中,nn为0、1、2、3、4、5、6、7、8、9或10,优选为0、1、2、3、4、5、6、7或8。
[0063]
在另一优选例中,k为0、1、2、3、4、5、6、7、8、9或10,优选为0、1、2、3、4、5、6、7或8。
[0064]
在另一优选例中,l为0、1、2、3、4、5、6、7、8、9或10,优选为0、1、2、3、4、5、6、7或8。
[0065]
在另一优选例中,m为0、1、2、3、4、5、6、7、8、9或10。
[0066]
在另一优选例中,n为0、1、2、3、4、5、6、7、8、9或10,优选为0、1、2、3、4、5、6、7或8。
[0067]
在另一优选例中,o为0、1、2、3、4、5、6、7、8、9或10,优选为0、1、2、3、4、5、6、7或8。
[0068]
在另一优选例中,p为0、1、2、3、4、5、6、7、8、9或10。
[0069]
在另一优选例中,r为0、1、2、3、4、5、6、7、8、9或10,优选为0、1、2、3、4、5、6、7或8。
[0070]
在另一优选例中,s为0、1、2、3、4、5、6、7、8、9或10,优选为0、1、2、3、4、5、6、7或8。
[0071]
在另一优选例中,oo为0、1、2、3、4、5、6、7、8、9或10,优选为0、1、2、3、4、5、6、7或8。
[0072]
在另一优选例中,pp为0、1、2、3、4、5、6、7、8、9或10,优选为0、1、2、3、4、5、6、7或8。
[0073]
在另一优选例中,qq为0、1、2、3、4、5、6、7、8、9或10,优选为0、1、2、3、4、5、6、7或8。
[0074]
在另一优选例中,rr为0、1、2、3、4、5、6、7、8、9或10,优选为0、1、2、3、4、5、6、7或8。
[0075]
在另一优选例中,u为0、1、2、3、4、5、6、7、8、9或10。
[0076]
在另一优选例中,v为0、1、2、3、4、5、6、7、8、9或10。
[0077]
在另一优选例中,hh为0、1、2、3、4、5、6、7、8、9或10。
[0078]
在另一优选例中,aaa为0、1、2、3、4、5、6、7或8。
[0079]
在另一优选例中,bbb为0、1、2、3、4、5、6、7或8。
[0080]
在另一优选例中,ccc为0、1、2、3、4、5、6、7或8。
[0081]
在另一优选例中,ss为0、1、2、3、4、5、6、7或8。
[0082]
在另一优选例中,tt为0、1、2、3、4、5、6、7或8。
[0083]
在另一优选例中,uu为0、1、2、3、4、5、6、7或8。
[0084]
在另一优选例中,vv为0、1、2、3、4、5、6、7或8。
[0085]
在另一优选例中,aa为0、1、2、3、4、5、6、7、8、9或10。
[0086]
在另一优选例中,ii为0、1、2、3、4、5、6、7、8、9或10。
[0087]
在另一优选例中,ddd为0、1、2、3、4、5、6、7或8。
[0088]
在另一优选例中,eee为0、1、2、3、4、5、6、7或8。
[0089]
在另一优选例中,fff为0、1、2、3、4、5、6、7、8、9或10。
[0090]
在另一优选例中,所述的式i化合物具有如下式iii所示的结构:
[0091]
[0092]
其中,
[0093]
x和y各自独立地选自n或ch,且至少一个x或y为n;
[0094]r11
选自下组:其中,b1和b2各自独立地为0、1、2、3、4、5、6、7、8、9或10;
[0095]r22
选自下组:
[0096]
r2选自下组:
[0097]
r3选自下组:选自下组:其中,ww、xx、c、d、ff各自独立地为0、1、2、3、4、5、6、7、8、9或10;
[0098]
r4选自下组:选自下组:其中,yy、zz、e、f、gg各自独立地为0、1、2、3、4、5、6、7、8、9或10;
[0099]
上述各式中,cc、dd、a、b为选自下组的取代基:h、ch3、oh、ch2oh、c2h4oh、nh2;
[0100]
r5选自下组:其中,g、h、dd、jj和kk各自独立地为0、1、2、3、4、5、6、7、8、9或10;
[0101]
r6选自下组:其中,i、j、ee、mm和nn各自独立地为0、1、2、3、4、5、6、7、8、9或10;
[0102]
r7选自下组:其中,k、l和m各自独立地为0、1、2、3、4、5、6、7、8、9或10;
[0103]
r8选自下组:其中,n、o和q各自独立地为0、
[0104]
1、2、3、4、5、6、7、8、9或10;
[0105]
上述各式中,c、d、e、f、g、j各自独立地选自下组:h、ch3;
[0106]
r9选自下组:
其中,r、s、oo、pp、qq、rr、u、v、aaa、bbb、ccc、hh各自独立地为0、1、2、3、4、5、6、7、8、9、10、11或12;
[0107]r10
选自下组:选自下组:其中,w、x、ss、tt、uu、vv、u、aa、ddd、eee、fff、ii各自独立地为0、1、2、3、4、5、6、7、8、9、10、11或12;
[0108]
上述各式中,k、l、m和n各自独立地选自下组:h、ch3;aa和bb各自独立地选自下组:h、ch3、oh或nh2;
[0109]
前提条件是侧链部分的主链(即最长链)上各自独立地具有2-40个碳,且至少一条侧链部分上具有10-25个碳。
[0110]
在另一优选例中,所述的式i化合物具有如下式iv所示的结构:
[0111][0112]
其中,各基团的定义如权利要求1-3任一所述。
[0113]
在另一优选例中,所述的侧链部分在另一优选例中,所述的侧链部分各自独立地为选自下组的结构:
[0114][0115][0116]
在另一优选例中,所述的化合物选自下组:
[0117]
[0118][0119]
本发明的第二方面,提供了一种如本发明第一方面所述的脂质体化合物的用途,所述的脂质体化合物用于制备纳米载药组合物。
[0120]
本发明的第三方面,提供了一种纳米载药组合物,所述的组合物包含本发明第一方面所述的脂质体化合物和治疗剂。
[0121]
在另一优选例中,所述的治疗剂包括核酸。
[0122]
在另一优选例中,所述的核酸选自反义rna和信使rna。
[0123]
在另一优选例中,所述的组合物还包含选自下组的赋形剂:中性脂质、类固醇、以及聚合物缀合的脂质。
[0124]
在另一优选例中,所述的中性脂质选自下组:dspc、dppc、dmpc、dopc、popc、dope、sm,或其组合;较佳地,所述中性脂质为dope和dspc。
[0125]
在另一优选例中,所述的组合物中,所述化合物与所述中性脂质的摩尔比为2:1-8:1。
[0126]
在另一优选例中,所述的组合物中,所述类固醇为胆固醇。
[0127]
在另一优选例中,所述的组合物中,所述化合物与胆固醇的摩尔比为1:1-2:1。
[0128]
在另一优选例中,所述的组合物中,所述聚合物缀合的脂质为聚乙二醇化脂质。
[0129]
在另一优选例中,所述的组合物中,所述化合物与所述聚乙二醇化脂质的摩尔比为100:1-20:1。
[0130]
在另一优选例中,所述的组合物中,所述聚乙二醇化脂质选自下组:peg-dag、peg-pe、peg-s-dag、peg-cer或peg二烷氧基丙基氨基甲酸酯。
[0131]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
具体实施方式
[0132]
本发明人经过长期而深入的研究,制备得到了一类结构新颖的脂质体分子,所述的脂质体分子可以与治疗性核酸共同形成包载rna的脂质体纳米粒,从而将治疗性核酸递送到需要形成药物浓度的部位。基于上述发现,发明人完成了本发明。
[0133]
治疗性核酸
[0134]
如本文所用,术语“治疗性核酸”指能够以寡核苷酸或表达对应寡核苷酸的载体的形式被施用于所需要的对象并产生治疗效果的核酸类物质。可以根据任何可用的技术来制备所述的治疗性核酸,例如对于mrna,主要的制备方法为,但不限于酶促合成(也称为体外转录),该方法目前代表着产生长序列特异的mrna的最有效的方法。体外转录描述了由工程化的dna模板进行rna分子的模板导向合成的方法,该工程化的dna模板包含与编码目标基因的下游序列连接的上游噬菌体启动子序列(例如包括但不限于来自t7、t3和sp6大肠杆菌噬菌体)。可以用本领域熟知的适当的技术由很多来源来制备模板dna用于体外转录,所述适当的技术包括,但不限于质粒dna和聚合酶链式反应扩增。
[0135]
使用线性化dna模板,在相应的rna聚合酶以及腺苷、鸟苷、尿苷和胞苷核糖核苷三磷酸(rntp)存在下,在支持聚合酶活性同时使所得的mrna转录物潜在的降解最小化的条件下,在体外发生rna的转录。可以使用各种商购的试剂盒以及商购的试剂来进行体外转录,所述试剂盒包括,但不限于ribomax大规模rna生产系统(promega)、megascript转录试剂盒(lifetechnologies),以及所述试剂包括rna聚合酶和rntp。mrna的体外转录方法是本领域熟知的。
[0136]
然后从转录或相关反应的不期望的组分(包括未并入的rntp、蛋白质酶、盐、短rna寡核苷酸等)中纯化期望的体外转录的mrna。mrna转录物的分离技术是本领域熟知的。熟知的程序包括用在单价阳离子存在下的醇(乙醇、异丙醇)或氯化锂的酚/氯仿萃取或沉淀。可以使用的纯化程序的另外非限制性实例包括尺寸排阻色谱、基于硅的亲和色谱和聚丙烯酰胺凝胶电泳。可以使用各种商购的试剂盒来进行纯化,所述试剂盒包括,但不限于sv总分离系统(promega)以及体外转录清洁和浓缩试剂盒(norgen biotek)。
[0137]
此外,虽然逆转录可以产生大量的mrna,但产物可以含有大量与不期望的聚合酶活性有关的异常rna杂质,所述杂质可能需要从全长的mrna制备物中去除。这些杂质包括由失败的转录起始导致的短rna以及由rna依赖的rna聚合酶活性、来自rna模板的rna引发的转录和自补3’延长生成的双链rna(dsrna)。已经证明这些具有dsrna结构的污染物可以通过与真核细胞中的各种先天免疫传感器相互作用而导致不期望的免疫刺激活性,所述先天免疫传感器的作用为识别特定核酸结构并诱导强效免疫应答。由于在先天细胞免疫应答期间蛋白质合成减少,因此可以进而显著减少mrna翻译。因此,已研发出用于去除这些dsrna污染物的另外的技术,并且其被本领域所知晓,包括但不限于可调比例的hplc纯化。已报导经hplc纯化的mrna以高得多的水平翻译,特别是在原代细胞中和体内。
[0138]
本领域中已描述了很多种用于改变体外转录的mrna的特定性质,并且改善其效用的修饰。这些修饰包括,但不限于对mrna的5’末端和3’末端的修饰。内源性真核mrna通常含有在成熟分子的5
’‑
端上的帽结构,其在介导mrna帽结合蛋白质(cbp)的结合中发挥重要作用,其进而负责增强细胞中的mrna稳定性和mrna翻译效率。因此,用加帽的mrna转录物实现最高水平的蛋白质表达。5
’‑
帽含有5
’‑
多数核苷酸与鸟嘌呤核苷酸之间的5
’‑5’‑
三磷酸连接。缀合的鸟嘌呤核苷酸在n7位置被甲基化。另外的修饰包括在2
’‑
羟基上的最后的和倒数第二的多数5
’‑
核苷酸的甲基化。
[0139]
多个不同的帽结构可以用于生成体外转录合成的mrna的5
’‑
帽。合成的mrna的5
’‑
加帽可以用化学帽类似物与转录共同进行(即在体外转录过程中加帽)。例如,抗反向帽类似物(arca)帽含有5
’‑5’‑
三磷酸鸟嘌呤-鸟嘌呤连接,其中一个鸟嘌呤含有n7甲基以及3
’‑
o-甲基。然而,多达20%的转录物在该共转录过程中保持未加帽,并且合成的帽类似物与真实细胞mrna的5
’‑
帽结构不相同,有可能降低可译性和细胞稳定性。可选地,合成的mrna分子还可以在转录后酶促加帽。这可以生成更真实的5
’‑
帽结构,其在结构上或功能上更接近地模拟内源性5
’‑
帽,该内源性5
’‑
帽具有增强的帽结合蛋白质的结合、增加的半衰期、对5’内切酶的降低的敏感性和/或减少的5’脱帽性。已研发出很多合成的5
’‑
帽类似物且被本领域所知晓,以增强mrna稳定性和可译性。
[0140]
在3
’‑
末端,通常在rna加工期间将腺嘌呤核苷酸的长链(聚腺苷酸尾)加至mrna分子。转录后,立即切割转录物的3’端以释放3’羟基,向3’端,聚腺苷酸聚合酶在被称为聚腺苷酸化的过程中将腺嘌呤核苷酸链加至rna。聚腺苷酸尾已广泛示出了增强翻译效率和mrna的稳定性。
[0141]
可以使用各种方法来实现体外转录的mrna的聚腺苷酸加尾,所述方法包括,但不限于,将聚(t)片段克隆至dna模板中,或者通过使用聚(a)聚合酶在转录后添加。第一种情况允许体外转录具有限定长度(取决于聚(t)片段的尺寸)的聚(a)尾的mrna,但需要对模板另外操作。后一种情况涉及使用催化腺嘌呤残基并入rna的3’末端的聚(a)聚合酶,将聚(a)尾酶促添加至体外转录的mrna,不需要对dna模板另外操作,而得到具有不同长度的聚(a)尾的mrna。可以使用各种商购的试剂盒以及商购的试剂、各种arca帽、聚(a)聚合酶等来进行5
’‑
加帽和3
’‑
聚(a)加尾,所述试剂盒包括,但不限于聚(a)聚合酶加尾试剂盒(epicenter)、mmessage mmachine t7ultra试剂盒和聚(a)加尾试剂盒(life technologies)。
[0142]
除5’帽和3’聚腺苷酸化以外,还报导了对体外转录物的其他修饰以提供与翻译效率和稳定性有关的益处。本领域熟知的是,病原dna和rna可以通过真核细胞内的各种传感器识别,并引发强效先天免疫应答。因为天然来源的大多数核酸含有修饰的核苷,因此已显示出辨别病原dna和rna与自身dna和rna的能力至少部分基于结构和核苷修饰。相反,体外合成的rna缺少这些修饰,因此导致其为免疫刺激的,进而可以抑制上文概述的有效的mrna翻译。将修饰的核苷引入体外转录的mrna可以用于阻止rna传感器的识别和激活,由此缓解这种不期望的免疫刺激活性,并且增强翻译能力。用于合成修饰的rna的修饰的核苷和核苷酸可以使用本领域已知的一般方法和程序来制备、监测和使用。可使用很多种核苷修饰,其可以单独或联用其他修饰的核苷以一定程度并入体外转录的mrna。已报导核苷修饰的mrna的体外合成减小了激活免疫传感器的能力,伴随着增强了翻译能力。
[0143]
可修饰以在可译性和稳定性方面提供益处的mrna的其他组分包括5’和3’非翻译区(utr)。针对两者的或单独的utr优化(有利的5’和3’utr可以得自细胞或病毒rna)已显示出增强了体外转录的mrna的mrna稳定性和翻译效率。
[0144]
除mrna以外,其他核酸净荷(payload)也可以用于本发明。对于寡核苷酸,制备方法包括但不限于化学合成和较长前体的酶促、化学裂解,上文描述的体外转录等。合成dna和rna核苷酸的方法被广泛使用,并且为本领域所熟知。
[0145]
对于质粒dna,与本发明联用的制备通常使用但不限于,在含有目标质粒的细菌的液体培养基中体外扩增和分离质粒dna。编码对特定抗生素(青霉素、卡那霉素等)的抗性的目标质粒内基因的存在允许那些含有目标质粒的细菌在含抗生素的培养基中选择性地生长。分离质粒dna的方法被广泛使用,并且为本领域所熟知。可以使用各种可商购的试剂盒
以及可商购的试剂来进行质粒分离,所述试剂盒包括,但不限于plasmid plus(qiagen)、genjet plasmid maxiprep(thermo)和pure yield maxiprep(promega)试剂盒。
[0146]
脂质纳米颗粒
[0147]
如本文所用,术语“脂质纳米颗粒”指使用阳离子脂质体与需要递送的核酸药物通过自组装方式形成的复合载药颗粒。本发明的脂质纳米颗粒和组合物可以用于各种目的,包括在体外和体内将封装的或缔合的(例如,复合的)诸如核酸的治疗剂递送至细胞,从而诱导期望蛋白质的表达或者抑制靶基因的表达。因此,本发明的实施方案提供通过使有此需要的对象接触封装适合的治疗剂或与适合的治疗剂缔合的脂质纳米颗粒,来治疗或预防所述对象的疾病和病症的方法,其中所述脂质纳米颗粒包含一种或多种本文描述的新型阳离子脂质。本发明的阳离子脂质、脂质纳米颗粒和包含脂质纳米颗粒的组合物、以及它们递送诸如核酸的活性剂(例如治疗剂),以调控基因和蛋白质表达的用途的各种示例性实施方案在下文进一步详细地描述。
[0148]
短语“诱导期望蛋白质的表达”指核酸增加期望蛋白质表达的能力。为检验蛋白质表达的程度,使测试样品(例如,表达期望蛋白质的培养基中的细胞样品)或测试哺乳动物(例如,诸如人的哺乳动物或者诸如啮齿动物(例如,小鼠)或非人灵长类动物(例如,猴)模型的动物模型)接触核酸(例如,结合本发明脂质的核酸)。将测试样品或测试动物中的期望蛋白质的表达与未接触或未施用核酸的对照样品(例如,表达期望蛋白质的培养基中的细胞样品)或对照哺乳动物(例如,诸如人的哺乳动物或者诸如啮齿动物(例如,小鼠)或非人灵长类动物(例如,猴)模型的动物模型)中的期望蛋白质的表达相比较。当在对照样品或对照哺乳动物中存在期望的蛋白质时,对照样品或对照哺乳动物中期望蛋白质的表达可以指定为1.0的值。在特定的实施方案中,当测试样品或测试哺乳动物中的期望蛋白质表达与对照样品或对照哺乳动物中的期望蛋白质表达水平的比例大于1时,例如,约1.1、1.5、2.0、5.0或10.0时,实现了诱导期望蛋白质的表达。当对照样品或对照哺乳动物中不存在期望的蛋白质时,当在测试样品或测试哺乳动物中检测到任何可测水平的期望蛋白质时,实现了诱导期望蛋白质的表达。本领域的普通技术人员将理解,确定样品中蛋白质表达水平的适合的测定例如,斑点印迹、northern印迹、原位杂交、elisa、免疫沉淀、酶功能和表型测定,或者基于在适当条件下可以产生荧光或发光的报告蛋白的测定。
[0149]
短语“抑制靶基因的表达”指核酸沉默、减少或抑制靶基因表达的能力。为检验基因沉默的程度,使测试样品(例如,表达靶基因的培养基中的细胞样品)或测试哺乳动物(例如,诸如人的哺乳动物或者诸如啮齿动物(例如,小鼠)或非人灵长类动物(例如,猴)模型的动物模型)接触沉默、减少或抑制靶基因表达的核酸。将测试样品或测试动物中的靶基因的表达与未接触或未施用核酸的对照样品(例如,表达靶基因的培养基中的细胞样品)或对照哺乳动物(例如,诸如人的哺乳动物或者诸如啮齿动物(例如,小鼠)或非人灵长类动物(例如,猴)模型的动物模型)中的靶基因的表达相比较。对照样品或对照哺乳动物中的靶基因的表达可以指定为100%的值。在特定的实施方案中,当测试样品或测试哺乳动物中的靶基因表达水平相对于对照样品或对照哺乳动物中的靶基因表达水平为约95%、90%、85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%、15%、10%、5%或0%时,实现了沉默、抑制或减少靶基因的表达。换言之,相对于未接触或未施用核酸的对照样品或对照哺乳动物中的靶基因表达水平,在测试样品或测试哺乳动物中,所述核
酸能够沉默、减少或抑制靶基因表达的至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或100%。确定靶基因表达水平的适合的测定包括,但不限于,使用本领域技术人员已知的技术进行的蛋白质或mrna水平的检验,所述技术例如,本领域技术人员已知的斑点印迹、northern印迹、原位杂交、elisa、免疫沉淀、酶功能以及表型测定。
[0150]
术语“脂质”指一组有机化合物,其包括但不限于脂肪酸的酯,并且特征通常为在水中具有差的溶解性,但在很多种有机溶剂中可溶。它们通常分为至少三类:(1)“简单脂质”,其包括脂肪和油以及蜡;(2)“化合物脂质”,其包括磷脂和糖脂;以及(3)“衍生脂质”,例如类固醇。
[0151]“阳离子脂质”指能够带正电的脂质。示例性的阳离子脂质包括一种或多种带有正电荷的胺基团。优选的阳离子脂质是可电离的,以便它们可以根据ph值以带正电的形式或中性形式存在。阳离子脂质的电离影响脂质纳米颗粒在不同ph条件下的表面电荷。这种电荷状态可以影响血浆蛋白质吸收、血液清除和组织分布,以及形成核内体溶解(endosomolytic)非双层结构的能力,对于核酸的细胞内递送是至关重要的。
[0152]
术语“聚合物缀合的脂质”指包含脂质部分和聚合物部分的分子。聚合物缀合的脂质的实例是聚乙二醇化脂质。术语“聚乙二醇化脂质”指包含脂质部分和聚乙二醇部分的分子。聚乙二醇化脂质为本领域已知的,并且包括1-(单甲氧基-聚乙二醇)-2,3-二肉豆蔻酰甘油(peg-dmg)等。
[0153]
术语“中性脂质”指在选定的ph下以无电荷或中性两性离子形式存在的许多脂质物质中的任一种。在生理ph下,此类脂质包括但不限于磷脂酰胆碱,例如1,2-二硬脂酰基-sn-甘油基-3-磷酸胆碱(dspc)、1,2-二棕榈酰基-sn-甘油基-3-磷酸胆碱(dppc)、1,2-二肉豆蔻酰基-sn-甘油基-3-磷酸胆碱(dmpc)、1-棕榈酰基-2-油酰基-sn-甘油基-3-磷酸胆碱(popc)、1,2-二油酰基-sn-甘油基-3-磷酸胆碱(dopc),磷脂酰乙醇胺如1,2-二油酰基-sn-甘油基-3-磷酸乙醇胺(dope),鞘磷脂(sm),神经酰胺,类固醇如甾醇及其衍生物。中性脂质可以是合成的或天然来源的。
[0154]
术语“带电脂质”指以下多种脂质物质中的任一种,其以带正电荷或带负电荷的形式存在,不依赖于在有用的生理学范围内的ph,例如ph~3至ph~9。带电脂质可以是合成的或天然来源的。带电脂质的实例包括磷脂酰丝氨酸、磷脂酸、磷脂酰甘油、磷脂酰肌醇、甾醇半琥珀酸酯、二烷基三甲铵-丙烷(例如dotap、dotma)、二烷基二甲基氨基丙烷、乙基磷酸胆碱、二甲基氨基乙烷氨基甲酰基甾醇(例如dc-chol)。
[0155]
术语“脂质纳米颗粒”指具有纳米量级上(例如,1nm至1,000nm)的至少一个维度的颗粒,其包含一种或多种结构(i)的化合物或其他特定阳离子脂质。在一些实施方案中,脂质纳米颗粒包含在可用于将诸如核酸(例如,mrna)的活性剂或治疗剂递送至目标靶位点(例如,细胞、组织、器官、肿瘤等)的制剂中。在一些实施方案中,本发明的脂质纳米颗粒包含核酸。这类脂质纳米颗粒通常包含结构(i)的化合物以及一种或多种选自中性脂质、带电脂质、胆固醇和聚合物缀合的脂质的赋形剂。在一些实施方案中,诸如核酸的活性剂或治疗剂可以封装于脂质纳米颗粒的脂质部分中,或者封装于由脂质纳米颗粒的一些或全部脂质部分包裹的水性空间中,从而保护其不被酶促降解,或者不受到由宿主生物体或细胞的机制诱导的其他不期望的作用,例如不良的免疫应答。
[0156]
本发明的脂质纳米颗粒的实施方案对于核酸的递送是特别有用的,所述核酸包括例如mrna、反义寡核苷酸、质粒dna、微小rna(mirna)、mirna抑制剂(antagomirs/antimirs)、信使-rna-干扰互补rna(micrna)、dna、多价rna、dicer底物rna、互补dna(cdna)等。因此,本发明的脂质纳米颗粒和组合物可以用于通过使细胞与包含一种或多种本文描述的新型阳离子脂质的脂质纳米颗粒接触,从而在体外和体内诱导所期望蛋白质的表达,其中所述脂质纳米颗粒封装或缔合如下核酸:被表达以产生所期望蛋白质的核酸(例如,编码所期望蛋白质的信使rna或质粒)或被表达以抑制终止mrna表达的过程的核酸(例如,mirna抑制剂)。可选地,本发明的脂质纳米颗粒和组合物可以用于通过使细胞与包含一种或多种本文描述的新型阳离子脂质的脂质纳米颗粒接触,从而在体外和体内减少靶基因和靶蛋白质的表达,其中脂质纳米颗粒封装或缔合减少靶基因表达的核酸(例如,反义寡核苷酸或小干扰rna(sirna))。本发明的脂质纳米颗粒和组合物还可以用于单独或联合共递送不同的核酸(例如mrna和质粒dna),例如可以用于提供需要不同核酸(例如编码适合的基因修饰酶的mrna和并入宿主基因组的dna片段)共同定位的作用。
[0157]
在各种实施方案中,所使用的脂质纳米颗粒具有以下的平均直径:约30nm至约150nm、约40nm至约150nm、约50nm至约150nm、约60nm至约130nm、约70nm至约110nm、约70nm至约100nm、约80nm至约100nm、约90nm至约100nm、约70至约90nm、约80nm至约90nm、约70nm至约80nm、或者约30nm、35nm、40nm、45nm、50nm、55nm、60nm、65nm、70nm、75nm、80nm、85nm、90nm、95nm、100nm、105nm、110nm、115nm、120nm、125nm、130nm、135nm、140nm、145nm或150nm,并且是基本无毒的。在某些实施方案中,核酸当存在于脂质纳米颗粒时,其在水溶液中抵抗被核酸酶降解。
[0158]
如本文所使用的,“脂质封装的”指为诸如核酸(例如,mrna)的活性剂或治疗剂提供完全封装、部分封装或二者的脂质纳米颗粒。在一个实施方案中,核酸(例如,mrna)完全封装于脂质纳米颗粒中。
[0159]
就核酸-脂质纳米颗粒而言,“血清稳定的”意指核苷酸在暴露于血清后或在暴露于会显著降解游离dna或rna的核酸酶测定后,不会显著降解。适合的测定包括,例如,标准的血清测定、dna酶测定或rna酶测定。
[0160]
如本文所使用的,“全身性递送”指可以导致活性剂在生物体内广泛暴露的治疗性产物的递送。一些施用技术可以导致某些试剂的全身性递送,但不会全身性递送其他试剂。全身性递送意味着有用量的,优选治疗量的试剂暴露于身体的多数部位。脂质纳米颗粒的全身性递送可以通过本领域已知的任何方式进行,包括,例如,静脉内、动脉内、皮下和腹膜内递送。在一些实施方案中,脂质纳米颗粒的全身性递送通过静脉内递送。
[0161]
如本文所使用的,“局部递送”指将活性剂直接递送至生物体内的靶位点。例如,可以通过直接注入诸如肿瘤的疾病位点,诸如炎症位点的其他靶位点,或诸如肝、心脏、胰腺、肾等靶器官中来局部递送试剂。局部递送也可以包括局部应用或局部注射技术,例如肌内、皮下或皮内注射。局部递送不妨碍全身性的药理学作用。
[0162]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
[0163]
实施例1化合物p-1的合成
[0164][0165]
p-1的合成:将亚油酸(3eq)溶于dcm中,加入edc(1.5eq),dmap(0.4eq)以及dipea(2eq),搅拌10min后,加入化合物a(1eq)室温搅拌过夜。tlc监测反应完全后,减压蒸馏除去溶剂。加入乙酸乙酯,饱和食盐水洗3次,无水硫酸钠干燥,浓缩,柱分离纯化,得产物。
[0166]
实施例2化合物p-2的合成
[0167][0168]
化合物a的合成:取一定量的亚油酸(1eq)溶于适量无水四氢呋喃中,氮气保护下,冰浴搅拌10min,然后逐滴加入氢化铝锂四氢呋喃溶液(2.5m,1.2eq),加毕,逐渐恢复至室温,搅拌过夜。tlc监测反应完全后,加入x ml水(x为加入的四氢铝锂的总质量,单位:g),加x ml 15%naoh水溶液,再加3x ml水,抽滤,减压蒸馏除去溶剂。加入适量体积乙酸乙酯,等体1mhcl溶液洗2次,饱和食盐水洗1次,无水硫酸钠干燥,浓缩。柱分离纯化,得产物。
[0169]
化合物b的合成:取一定量的化合物a(1eq)溶于适量无水二氯甲烷中,加入三乙胺(2eq),氮气保护下,冰浴搅拌10min,然后逐滴加入丙烯酰氯(1.5eq),加毕,逐渐恢复至室温,搅拌过夜。tlc监测反应完全后,减压蒸馏除去溶剂。加入适量体积乙酸乙酯,等体饱和碳酸氢钠溶液洗2次,饱和食盐水洗1次,无水硫酸钠干燥,浓缩。柱分离纯化,得产物。
[0170]
p-2的合成:取一定量的哌嗪(1eq)溶于适量无水四氢呋喃中,然后化合物b(3eq),氮气保护,70℃加热反应48h。tlc监测反应完全后,减压蒸馏除去溶剂。柱分离纯化,得产物。
[0171]
实施例3化合物p-4的合成
[0172][0173]
化合物c的合成:将化合物b(1eq)溶于dcm中,加入edc(1.5eq),dmap(0.4eq)以及dipea(2eq),搅拌10min后,加入化合物e(2eq)室温搅拌过夜。tlc监测反应完全后,减压蒸馏除去溶剂。加入乙酸乙酯,饱和食盐水洗3次,无水硫酸钠干燥,浓缩,柱分离纯化,得产物。
[0174]
化合物d的合成:将化合物c(1eq)溶于dcm中,加入nahco3(8eq),搅拌5min后,加入化合物戴斯马丁氧化剂(1.6eq)室温搅拌3h。tlc监测反应完全后,减压蒸馏除去溶剂。加入石油醚,饱和碳酸氢钠溶液洗3次,饱和食盐水洗1次,无水硫酸钠干燥,浓缩,柱分离纯化,得产物。
[0175]
化合物p-4的合成:将化合物d(2.2eq)溶于dcm中,加入哌嗪(1eq),搅拌10min后,加三乙酰氧基硼氢化钠(3eq),室温搅拌过夜。tlc监测反应完全后,减压蒸馏除去溶剂。加入乙酸乙酯,饱和食盐水洗3次,无水硫酸钠干燥,浓缩,柱分离纯化,得产物。
[0176]
实施例4化合物p-5的合成
[0177][0178]
化合物c的合成:将化合物a(1eq)溶于dcm中,加入edc(1.5eq),dmap(0.4eq)以及dipea(2eq),搅拌10min后,加入化合物b(2eq)室温搅拌过夜。tlc监测反应完全后,减压蒸馏除去溶剂。加入乙酸乙酯,饱和食盐水洗3次,无水硫酸钠干燥,浓缩,柱分离纯化,得产物。
[0179]
化合物d的合成:取一定量的化合物a(1eq)溶于适量无水二氯甲烷中,氮气保护,冰浴条件下加入间氯过氧苯甲酸(1.5eq),加毕,逐渐恢复至室温,搅拌过夜。tlc监测反应完全后,加入饱和亚硫酸氢钠溶液淬灭反应,减压蒸馏除去二氯甲烷。加入适量体积乙酸乙酯,等体饱和碳酸氢钠溶液洗2次,饱和食盐水洗1次,无水硫酸钠干燥,浓缩。柱分离纯化,得产物。
[0180]
p-5的合成:取一定量的哌嗪(1eq)溶于适量无水甲醇中,然后化合物d(3eq),氮气保护,加热回流反应3h。tlc监测反应完全后,减压蒸馏除去溶剂。柱分离纯化,得产物。
[0181]
采用与上述实施例1-4类似的方法,制备得到以下化合物p3,p6-p10,各个化合物的表征见下表:
[0182]
表1氢谱数据
[0183][0184][0185]
实施例5mrna-lnp的制备
[0186]
将阳离子脂质体,dspc或dope,胆固醇,以及peg-脂质体以50:40:25:2或者50:40:38.5:1.5的比例溶于乙醇中,并充分混匀。脂质体纳米粒(lnp)与mrna的质量比为10:1到30:1。使用柠檬酸盐或醋酸钠缓冲液(ph=3或5)将mrna稀释至0.2mg/ml。将上述阳离子脂质体乙醇溶液与mrna溶液以体积比为1:5到1:3的比例充分混匀。所获纳米粒通过超滤和透析的手段纯化。过滤除菌。表征mrna-lnp(包载mrna的脂质体纳米粒)的粒径约为30-150nm。
[0187]
生物测试例1脂质体动物试验
[0188]
雄性icr小鼠(6-8week,上海杰思捷实验动物有限公司)饲养在22
±
2℃以及相对湿度为45
–
75%的实验条件下,光照/黑暗周期为12h。使用编码荧光素酶的mrna(luciferase mrna)作为报道基因。荧光素酶催化荧光素产生生物荧光,通过检测单位时间内生物荧光强度,反映lnp的转染效率。以荧光素酶mrna(购自apexbio technology)为例,将上述获得的mrna-lnp,以150μg/kg mrna的剂量,通过肌肉注射给药。取特定的时间点,于小鼠腹腔注射荧光素,5分钟后,将小鼠置于小动物活体成像仪测定荧光强度,最后的结果以平均荧光强度表示。
[0189]
表1小鼠腹腔注射给药后荧光强度结果
[0190]
[0191][0192]
*(molar ratio:lipid/dope/cholesterol/peg)
[0193]
结果显示,相较于现有的商业可得的脂质体mc-3,本发明的脂质体均取得了更好的生物相容性以及更高的体内mrna转染效率。本发明的脂质体都能形成稳定的纳米结构,尺寸分布较窄,尺寸随不同的脂质体的结构有所变化,在30-150nm范围内。而且本发明的脂质体形成的lnp(脂质体纳米粒)可在低温储存较长时间。结构上,在脂质体的疏水尾部引入可降解的酯键,可以改变脂质体在体内的代谢行为,进而提高mrna-lnp的生物安全性。合成上,相比较mc-3,其合成路线简单易行,原料廉价易得,有利于其工业化生产。新脂质体具有
良好的应用前景。
[0194]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。