1.本发明属于生物医学相关技术领域,具体涉及一种改良的小鼠卵巢生殖干细胞的分离培养方法。
背景技术:
2.2004年,美国科学家tilly在《science》第428卷第6979期第145~150页上发表了一篇名为《出生后哺乳动物卵巢的生殖系干细胞和卵泡的自我更新》论文,指出在测定小鼠不同天数闭锁卵泡数和未闭锁卵泡数时,结果发现卵泡闭锁的发生率要高于未闭锁卵泡数量的减少率,因此便推测卵巢中存在具有增殖能力的的细胞,这对垄断生殖医学界的卵泡池固定理论提出了严峻的挑战。
3.此后,2009年4月12日,上海交通大学吴际教授研究团队在nature cell biology网络版公布了自己的研究成果,该研究分离纯化了小鼠卵巢中的生殖干细胞并可传代培养,将此干细胞移植到不孕小鼠卵巢后,能够发育成有功能的卵子并产生健康的后代。
4.目前虽有研究者通过干细胞分离纯化、体外培养和移植、转基因和体内世系追踪等方法,在多种哺乳动物包括人类的卵巢均发现卵巢生殖干细胞的存在,但仍有很多学者对哺乳卵巢干细胞扔持怀疑态度,因为按照原有的卵巢生殖干细胞分离培养方法,很多实验室还不能很高效地分离出卵巢生殖干细胞进行培养。这极大阻碍了学者们对卵巢生殖干细胞进一步的研究。
5.本实验室实验人员经过不断的摸索和自身对培养技术的改良,现在已经发现一种简单、实用的卵巢生殖干细胞分离方法。
技术实现要素:
6.本发明的目的在于提供一种改良的小鼠卵巢生殖干细胞的分离培养方法,以解决上述背景技术中提出的问题。
7.为实现上述目的,本发明提供如下技术方案:
8.一种改良的小鼠卵巢生殖干细胞的分离培养方法,包括取卵巢、两步酶法分离细胞、雌性生殖干细胞的原代培养及传代和雌性生殖干细胞的冻存,所述取卵巢的步骤如下:
9.步骤一:
10.小鼠的选择,小鼠年龄越小所含的卵巢生殖干细胞越多,我们一般选取刚出生3-5天的雌性乳鼠;
11.步骤二:
12.小鼠处死方法的选择,我们一般先采取颈椎脱臼法处死小鼠,然后在75%酒精中浸泡5-10分钟以消毒;如果是直接浸泡于75%酒精中处死小鼠,这样会使小鼠卵巢充血,会使分离的卵巢雌性生殖干细胞中存在大量红细胞,从而影响其生长,最后取出来的卵巢用显微镊剥除旁边的脂肪组织和输卵管,但保留卵巢表面的那一层膜;
13.优选的,所述两步酶法分离细胞步骤如下,将无菌采集的卵巢转移至一个新的
35mm皿中,用d-hanks液重悬2~3次,然后转移至15ml离心管;然后加入1mg/ml的collagenase iv(d-hanks液配置)5ml,将离心管置于37度恒温水浴锅缓慢顺时针摇晃,时间10-12分钟,时间到后1000rpm离心5min,弃去上清,加入3ml含有0.05%胰酶d-hanks液,37℃缓慢摇动消化3min(至组织分散后),加入2ml的含10%fbs的dmem培养液终止消化,1000rpm离心5min尽量弃去上清,不要搅动沉淀,加入5ml新鲜fgsc培养液重悬细胞,用直径40um的滤网过滤以移除未消化彻底的卵巢组织,1000rpm离心5min尽量弃去上清,加200μl新鲜fgsc培养液重悬细胞,加入到提前铺有sto饲养层的trans-well培养板中,37℃和5%co2培养箱中培养;
14.优选的,所述雌性生殖干细胞的原代培养及传代,隔天换新鲜fgscs培养液,继续培养,换液时操作尽量轻柔,卵巢生殖干细胞贴壁不牢,较大的动静会丢失大量的细胞;当细胞培养约4-7d时,可将细胞进行传代,传代时吸取皿内细胞雌性生殖干细胞培养液,加d-hanks液200μl,润洗,加胰酶200μl(0.05%)到细胞培养孔内(加入液体的量以48孔细胞培养板为例),37℃5%co2培养箱内2min;加入1ml 10%fbs的dmem培养液终止消化;轻柔地吹打细胞,使之悬浮起来,2000rpm/min,离心5min;弃上清,加200μl新鲜fgscs培养液,轻柔地吹打使细胞重悬,铺到含sto滋养层细胞的trans-well培养板上,于37℃5%co2培养箱中继续培养;
15.优选的,所述雌性生殖干细胞的冻存,提前30min打开超净台紫外灯,将培养液、胰酶置于37℃细胞培养箱中预热,用移液枪吸去处于对数生长期细胞的48孔板中的培养液,向培养板中加入200μl已经预热的d-hanks缓冲液洗一次,并吸去缓冲液,向培养板中加入100μl胰酶,于37℃细胞培养箱中放置约1-2min后,向培养皿中加入1ml10%fbs的dmem培养液终止胰酶消化。用移液枪缓缓吹打,使细胞从培养板底部全部剥落。将液体转移至1.5ml ep管内,2000rpm/min离心5min,用移液枪吸去ep管内上清液,加入500μl含10%dmso的fgsc细胞培养液(450μl新鲜的fgsc细胞培养液加50μl的dmso),吹打管底细胞团,使细胞重新悬浮,将细胞悬液转移至冻存管中,并轻轻吹打混匀,做好标记后将冻存管放入冻存盒中并迅速转移到-80℃,4h或过夜将冻存管转移至液氮中的冻存盒内长期保存。
16.优选的,所述sto细胞饲养层的制备方法,包括如下步骤:从液氮复苏sto细胞,用含10%fbs的dmem培养液常规培养,培养传代2-3代后,待sto细胞密度达70%-80%左右,加入1ml含丝裂霉素c的sto培养液(10μlμl的1mg/ml丝裂霉素c加入到990μl sto细胞培养液中),丝裂霉素c的终浓度为0.01mg/ml;37℃细胞培养箱中培养1h;将处理好的sto细胞用0.05%胰蛋白酶消化,离心去上清,重悬均匀铺到二十四孔板上;将二十四孔板放入细胞培养箱中过夜,让其贴壁,得到sto细胞饲养层。
17.优选的,所述雌性生殖干细胞培养液包括mem-α、胎牛血清(fbs)、非必需氨基酸(neaa)、l-谷氨酰胺、丙酮酸钠、四种因子(lif、bfgf、egf、gdnf)、青链霉素、β-巯基乙醇。
18.优选的,所述fbs的体积百分含量为10-15%,所述lif的含量为100-200ng/μl,所述bfgf的含量为200-300ng/μl,所述egf的含量为100-200ng/μl,所述gdnf的含量为100-200ng/μl。
19.优选的,在所述雌性生殖干细胞培养液中,所述fbs的体积百分比为15%,所述lif的含量为120ng/μl,所述bfgf的含量为200ng/μl,所述egf的含量为120ng/μl,所述gdnf的含量为120ng/μl。
20.优选的,所述雌性生殖干细胞培养液的具体配置步骤为:10ml雌性生殖干细胞培养液的配制为:取8ml mem-α,1.5ml fbs,0.1ml 200mm l-谷氨酰胺,0.1ml非必需氨基酸(100x),0.1ml100mm丙酮酸钠,0.07μlβ-巯基乙醇,0.1ml的青链霉素混合液(100x),1.2μl 100ug/ml lif,2μl 100ug/ml bfgf,1.2μl 100ug/ml egf,1.2μl 100ug/ml gdnf;将各组分混匀后过滤除菌,4℃保存。
21.优选的,所述的mem-α、胎牛血清(fbs)、非必需氨基酸(neaa)购买于gbico公司,l-谷氨酰胺、丙酮酸钠购买于sigma公司,四种因子(lif、bfgf、egf、gdnf)、青链霉素、β-巯基乙醇购买于proteintech公司。
22.与现有技术相比,本发明提供了一种改良的小鼠卵巢生殖干细胞的分离培养方法,具备以下有益效果:
23.本发明通过将改良的两步酶酶消化法和trans-well法共培养结合起来,从而大大优化了小鼠卵巢生殖干细胞的分离培养方法:收集3-5天雌性小鼠卵巢,将其剪碎后用胶原酶和胰蛋白酶消化,得到小鼠卵巢生殖干细胞悬液,用trans-well法与sto饲养层共培养,从而分离纯化得到卵巢生殖干细胞,该干细胞通过上述方式,可以很好的传代培养,也可用液氮低温冷冻保存;
24.与原有技术相比,本发明具有如下的明显优势:本发明改良了小鼠卵巢生殖干细胞的分离培养方法体系,对培养液的配制、两步酶处理的时间、纯化的方法、培养的方法都进行了改良,成功的分离并在体外培养了小鼠卵巢生殖干细胞,并能够稳定传代,对不孕不育、卵巢早衰治疗及整个干细胞领域的研究都具有重大意义,本发明的方法简单明了,实验条件要求低,可操作性强。
附图说明
25.附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制,在附图中:
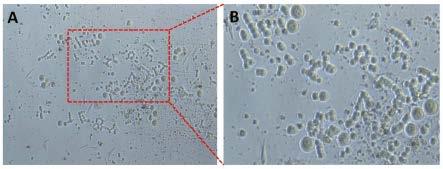
26.图1为小鼠卵巢生殖干细胞分离48小时后的形态照片;
27.图2为小鼠卵巢生殖干细胞的免疫荧光双标鉴定;
28.图3为rt-pcr对小鼠卵巢生殖干细胞的鉴定;
29.图4为小鼠卵巢生殖干细胞与sto细胞trans-well共培养模式图;
具体实施方式
30.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
31.请参阅图1-4,本发明提供一种技术方案:
32.a、卵巢生殖干细胞分离培养的实验前准备
33.1)卵巢生殖干细胞培养液的配制
34.配制10ml雌性生殖干细胞培养液的具体步骤为:先取8ml mem-α于15ml离心管,后面依次加入1.5ml fbs,0.1ml 200mm l-谷氨酰胺,0.1ml非必需氨基酸(100x),0.1ml100mm
丙酮酸钠,0.07μlβ-巯基乙醇,0.1ml的青链霉素混合液(100x),1.2μl 100ug/ml lif,2μl 100ug/ml bfgf,1.2μl 100ug/ml egf,1.2μl 100ug/ml gdnf,加完后补加mem-α到10ml后将各组分混匀后过滤除菌,4℃保存备用。
35.2)sto培养液的配制
36.配制50mlsto培养液的具体步骤为:先取44ml mem-α于50ml离心管,后面依次加入5ml fbs,0.5ml非必需氨基酸(100x),0.5ml的青链霉素混合液(100x),加完将各组分混匀后过滤除菌,4℃保存备用。
37.3)sto饲养层的制备
38.提前30min打开超净台紫外灯,将sto培养液、胰酶置于37℃细胞培养箱中预热。从液氮复苏sto细胞,用含10%fbs的dmem培养液常规培养,培养传代2-3代后,选取长势较好且密度适中的sto制备sto滋养层,用移液枪吸去35mm培养皿中的培养液,加入d-hanks冲洗一遍,再加入1ml含丝裂霉素c的sto培养液(10μl的1mg/ml丝裂霉素c加入到990μl sto细胞培养液中),丝裂霉素c的终浓度为0.01mg/ml;37℃细胞培养箱中培养2.5个小时;吸去处理液,向培养皿中加入1ml已预热的d-hanks,润洗细胞后吸去d-hanks,重复6次。将处理好的sto细胞用0.05%胰蛋白酶消化,离心去上清,重悬均匀铺到二十四孔板上;将二十四孔板放入细胞培养箱中过夜,让其贴壁,得到sto细胞饲养层。
39.b、卵巢生殖干细胞的分离培养及传代
40.1)卵巢生殖干细胞的分离
41.将3-5日龄雌性小鼠断头处死后,在无菌超净台中用75%的乙醇浸泡10分钟,然后剪开腹部,沿输子宫和输卵管找到卵巢。轻轻剪下卵巢,在预冷的d-hanks液中剔除脂肪以及输卵管末端部分。传统的方法在进行两步酶消化前会将卵巢尽可能剪碎,从而达到最大消化程度。在本改良方法中,无需剪碎,直接消化整个卵巢组织。因为卵巢生殖干细胞存在卵巢皮质区,剪碎消化容易得到大量的颗粒细胞,从而影响fgscs的纯度。将无菌采集的卵巢转移至一个新的35mm皿中,用d-hanks液重悬2~3次,然后转移至15ml离心管;然后加入1mg/ml的collagenase iv(d-hanks液配置)5ml,将离心管置于37度恒温水浴锅缓慢顺时针摇晃,时间10-12分钟,每隔2分钟观察消化状态,时间到后1000rpm离心5min,弃去上清。加入3ml含有0.05%胰酶d-hanks液,37℃缓慢摇动消化3min(至组织分散后),加入2ml的含10%fbs的dmem培养液终止消化,1000rpm离心5min尽量弃去上清,不要搅动沉淀。加入5ml新鲜fgsc培养液重悬细胞,用直径40um的滤网过滤以移除未消化彻底的卵巢组织,1000rpm离心5min尽量弃去上清。加200μl新鲜fgsc培养液重悬细胞,加入到铺有sto饲养层的trans-well培养板中,37℃培养箱中培养。
42.2)雌性生殖干细胞的原代培养及传代
43.隔天换新鲜fgscs培养液,继续培养,换液时操作尽量轻柔,卵巢生殖干细胞贴壁不牢,较大的动静会丢失大量的细胞;当细胞培养约4-7d时,可将细胞进行传代,传代时吸取皿内细胞培养液,加d-hanks液200μl,润洗,加胰酶200μl(0.05%)到细胞培养孔内,37℃5%co2培养箱内2min;加入1ml 10%fbs的dmem培养液终止消化;轻柔地吹打细胞,使之悬浮起来,2000rpm/min,离心5min;弃上清,加200μl新鲜fgscs培养液,轻柔地吹打使细胞重悬,铺到含滋养层细胞的细胞trans-well培养板上,于37℃5%co2培养箱中继续培养。
44.3)雌性生殖干细胞的冻存
45.实验前30min打开超净台紫外灯,将培养液、胰酶置于37℃细胞培养箱中预热。用移液枪吸去处于对数生长期细胞培养板中的培养液。向培养板中加入200μl已经预热的d-hanks缓冲液洗一次,并吸去缓冲液。向培养板中加入200μl0.05%胰酶,于37℃细胞培养箱中放置约1-2min。当细胞形态回缩变圆时,向培养皿中加入800μl培养液终止胰酶消化。用移液枪缓缓吹打,使细胞从培养板底部全部剥落。将液体转移至1.5mlep管内,2000rpm离心5min。用移液枪吸去ep管内上清液,加入500μl提前配好的细胞冻存液(450μl新鲜的fgsc细胞培养液和50μl的dmso),吹打管底细胞团,使细胞重新悬浮。将细胞悬液转移至冻存管中,并轻轻吹打混匀。将冻存管放入简易冻存盒中并迅速转移到-80℃,过夜后将冻存管转移至液氮中的冻存盒内长期保存。
46.c、卵巢生殖干细胞的鉴定
47.1)免疫荧光双标鉴定卵巢生殖干细胞
48.待细胞养至对数期,从培养箱中取出细胞,吸去细胞培养液,用d-hanks洗2次;
49.加入400μl4%的多聚甲醛的固定液,于室温放置20min;吸去固定液,用pbs洗2次;加入400μl 3%h2o2,室温放置10min后吸去多余液体,pbs洗3次;加入400μl 5%bsa,于湿盒中37℃,封闭10min;吸去血清,加入一抗mvh(羊抗兔,1:100)、oct-4(羊抗鼠1:100)混合液,于湿盒中4℃,过夜,pbs洗3次;避光加入tritc(抗鼠)、fitc(抗兔)标记的igg(1:500),于湿盒中37℃,放置1h;弃二抗,pbs洗3次;避光加入dapi(1:5000),于湿盒中37℃,放置15min;避光下弃去上清液,pbs洗3次;加入200μl pbs覆盖住细胞以免干涸,于荧光显微镜下观察结果。
50.2)rt-pcr鉴定卵巢生殖干细胞
51.将处于对数生长期的卵巢生殖干细胞从co2细胞培养箱中取出,置于冰上,弃培养液,pbs润洗2次,向每孔细胞中加1ml trizol溶液,用移液器反复吹打,待细胞从培养板上完全脱落后收集至无菌的ep管中,室温放置5min,加入500μl氯仿,用力震荡15s,室温放置3min;于4℃低温离心机中,12000g,15min;将上层水相于新的ep管内;加入与水相溶液等体积的预冷异丙醇,上下颠倒混匀,静置20min;将样品放入4℃低温离心机中,12000g,离心10min,离心后管底可见白色沉淀;去除上清,用预冷的75%乙醇(depc水处理)洗涤,涡旋震荡15s,于4℃下,7500g,离心5min,重复此步骤1次。弃上清,倒置干燥10min,让乙醇充分挥发,加30-50μl depc处理水,于55℃水浴锅中溶解10min;所提取的rna可经紫外分光光度计分析测其浓度,并用2%琼脂糖凝胶电泳测其纯度。采用takara反转录试剂盒,反转录。然后配制rt-pcr体系,检测mvh、oct-4、fragilis、stella、nanog、gapdh基因。上机跑完后琼脂糖凝胶电泳检测pcr结果。取50ml 1
×
tae,加入1g琼脂糖加热煮沸后冷却至50-60℃,加入genefinder核酸染料混匀后,倒入插有梳子的模具中;待凝胶完全冷却凝固后,拔出梳子置于电泳槽,加入1
×
tae电泳缓冲液,准备电泳;取5-10μl pcr产物及适量大小的dna marker上样,电压120v,25min后停止电泳,于凝胶成像系统中观察结果,并拍照。
52.尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
