pp2a及其激活剂在急性缺血性脑卒中制药、标记的应用
技术领域
1.本发明涉及生物医药领域的一种物质的应用,具体涉及一种蛋白磷酸酶2a(protein phosphatase 2a,pp2a)及其相关物质在急性缺血性脑卒中的制药、标记等中的应用。
背景技术:
2.急性缺血性脑卒中是指突然发作的脑部血液循环障碍、脑血流灌注下降,进而脑组织缺血、缺氧所致的局限性缺血性损伤,包括溺水、休克、心力衰竭等原因致心脏骤停引发的短暂性全脑缺血性脑卒中,以及局部脑血管栓塞引发的局灶性缺血性脑卒中,具有高发病率、高患病率、高复发率、高致残率及高死亡率的特点。急性缺血性脑卒中占我国脑卒中发病人群的69.6%,且有发病年轻化趋势,是危害公众健康的主要疾病之一,因此针对急性缺血性卒中的防治意义重大。
3.依据《中国脑血管病临床管理指南》,急性缺血性脑卒中患者紧急接受药物和/或血管内治疗等再灌注治疗是改善临床结局的有效方法。然而再灌注治疗方案仅适用于符合临床治疗指征的病例。更重要的是,再灌注治疗往往引发缺血再灌注损伤,进一步加重神经系统的病理损伤,增加患者的死亡率,即便是幸存的病人也常常遗留瘫痪、智力减退等严重神经、精神障碍。因而缓解急性缺血性脑卒中再灌注治疗伴随及继发的神经损伤是亟待解决的问题,目前临床上尚无减轻缺血再灌注损伤的有效手段。
4.脑缺血再灌注损伤诱发的细胞钙超载是造成神经元细胞死亡的核心事件,也是治愈急性缺血性脑卒中面临的关键问题。尽管抑制神经元细胞钙超载对急性缺血性脑卒中治疗的重要性和意义广受认可,但是目前靶向抑制神经元细胞钙超载在急性缺血性脑卒中治疗中的应用还没有比较满意的进展。另外,神经元细胞钙超载是多个钙离子通道蛋白及调节因子协同作用的结果,与急性缺血性脑卒中的病程发展密切相关,因此在恰当的时机精确地抑制神经元细胞钙超载成为急性缺血性脑卒中防治的新策略。
5.缺血再灌注引起钙离子-钙调素依赖性蛋白激酶ⅱ(ca2 /calmodulin-dependent protein kinaseⅱ,camkⅱ)迅速自磷酸化而激活,促进谷氨酸受体对钙离子的通透,加重钙超载,而抑制camkⅱ的磷酸化可以有效地抑制钙超载进而保护神经元细胞。camkⅱ的磷酸化状态受蛋白磷酸酶2a(pp2a)动态、精确地调控。pp2a是脑内去磷酸化的主要执行者之一,既往pp2a的应用主要聚焦在肿瘤治疗领域,例如,pp2a的缺失或失活促进肿瘤的发生和转移;pp2a激活剂可以穿透血脑屏障,具有强大的体内抗肿瘤活性,且没有明显的毒性。然而,pp2a在急性缺血性脑卒中后的变化规律尚不明确,且pp2a激活剂在急性缺血性脑卒中防治过程中的作用及机制也未见报道。
技术实现要素:
6.针对现有技术中的不足,本发明的第一个目的是提供蛋白磷酸酶2a(pp2a)激活剂在急性缺血性脑卒中治疗和制备急性缺血性脑卒中治疗药物中的应用。本发明的第二个目
的是提供pp2a酶活力作为急性缺血性脑卒中治疗靶点的应用,增强pp2a酶活力的药物或化合物可以用于急性缺血性脑卒中的治疗。本发明的第三个目的是提供pp2a酶活力作为生物标记物诊断、评估急性缺血性脑卒中早期病程进展和临床治疗效果的应用。
7.本发明的技术方案如下:
8.一、一种蛋白磷酸酶2a的应用:
9.在作为急性缺血性脑卒中的生物标记物和靶点的应用。
10.二、一种蛋白磷酸酶2a激活剂的应用:
11.在制备急性缺血性脑卒中药物中的用途,所述蛋白磷酸酶2a激活剂是指直接或间接作用于蛋白磷酸酶2a并提高其酶活性、产生生理作用的化合物。
12.通常蛋白磷酸酶2a激活剂用于抗肿瘤作用和制备抗肿瘤药物的作用,而本发明特别地发现蛋白磷酸酶2a激活剂能够用于治疗急性缺血性脑卒中,进而提出制备急性缺血性脑卒中药物的应用。
13.在制备治疗急性缺血性脑卒中的药物中的用途。
14.所述药物具体是靶向增强蛋白磷酸酶2a的酶活性进而发挥急性缺血性脑卒中治疗的用途。
15.所述急性缺血性脑卒中为溺水、休克等原因所致心脏骤停引发的短暂性全脑缺血或脑供血不足,以及脑血管栓塞所致的局灶性脑卒中。
16.所述急性缺血性脑卒中的主要特征表现为脑水肿、脑梗死、神经元细胞凋亡、运动功能和认知功能障碍等。
17.所述蛋白磷酸酶2a激活剂为dt061和ihap1中的其中一种或者两种的混合;
18.dt061为n-[(1r,2r,3s)-2-羟基-3-苯恶嗪-10-基环己基]-4-(三氟甲氧基)苯磺酰胺,cas no.1809427-19-7,分子式如下:
[0019][0020]
ihap1为2-氯-10-(4-甲氧基苯甲酰基)-10h-吩噻嗪,cas no.105925-39-1,分子式如下:
[0021][0022]
三、一种蛋白磷酸酶2a激活剂的应用,其特征在于:
[0023]
所述的蛋白磷酸酶2a激活剂在制备抑制神经元钙超载的实验试剂中的应用。
[0024]
所述蛋白磷酸酶2a激活剂的作用机制是抑制神经元细胞钙超载。所述蛋白磷酸酶2a激活剂通过抑制神经元细胞钙超载治疗急性缺血性脑卒中。
[0025]
所述蛋白磷酸酶2a激活剂,增强神经元细胞中蛋白磷酸酶2a的酶活力,促进钙离子-钙调素依赖性蛋白激酶ⅱ(ca
2
/calmodulin-dependent protein kinaseⅱ,camkⅱ)去磷酸化,促进α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionic acid,ampa)受体glua1亚基向突触后膜迁移,降低对钙离子的通透性,抑制神经元细胞钙超载。
[0026]
四、一种急性缺血性脑卒中药物,主要成分包括蛋白磷酸酶2a激活剂。
[0027]
五、一种急性缺血性脑卒中药物:所述药物用于治疗急性缺血性脑卒中。所述药物靶向激活神经元细胞中的蛋白磷酸酶2a。
[0028]
优选地,所述的药物为口服药或灌胃药。
[0029]
所述药物提高神经元细胞中蛋白磷酸酶2a的酶活性,而不影响蛋白磷酸酶2a的蛋白表达量。
[0030]
所述药物通过增强蛋白磷酸酶2a的酶活力抑制神经元细胞钙超载治疗急性缺血性脑卒中。
[0031]
所述药物靶向神经元细胞中的蛋白磷酸酶2a,增强蛋白磷酸酶2a的酶活力,促进camkii去磷酸化,抑制ampa受体对钙离子的通透,减轻神经元细胞钙超载,发挥急性缺血性脑卒中的治疗作用。
[0032]
所述药物的治疗包括减轻急性缺血性脑卒中后脑水肿、脑梗死、神经元细胞凋亡、运动功能和认知功能障碍中的至少一种。
[0033]
六、一种药物组合物,包含上述急性缺血性脑卒中药物,和临床上急性缺血性脑卒中治疗药物。
[0034]
所述的临床治疗急性缺血性脑卒中药物包括重组组织型纤溶酶原激活剂、尿激酶和替奈普酶。
[0035]
所述药物组合物的治疗作用包括减轻缺血性脑卒中后脑水肿、脑梗死、神经元细胞凋亡、运动功能和认知功能障碍中的至少一种。
[0036]
七、一种药物制剂,包括上述急性缺血性脑卒中药物或者上述药物组合物,为由药物或者药物组合物与药学上可接受的载体结合制备成的临床上可接受的制剂。
[0037]
制剂包括片剂、胶囊剂、颗粒剂、注射剂、丸剂、散剂以及各种微粒给药系统。
[0038]
八、一种试剂的应用,在制备诊断急性缺血性脑卒中的制剂或试剂盒中的用途,所述的试剂为检测pp2a酶活性的试剂,用于检测pp2a的单位酶活性变化。
[0039]
所述的试剂的检测对象为神经元细胞。
[0040]
所述酶活性为样本总pp2a酶活性与pp2a蛋白浓度的比值。
[0041]
所述的试剂尤其是检测诊断急性缺血性脑卒中早期病程的状况,早期病程为全脑缺血再灌注后0.5小时至8小时。
[0042]
急性缺血性脑卒中后早期pp2a表达不变,但pp2a酶活性呈现先升后降的变化特征,降低pp2a酶活性,神经元损伤加重,通过检测神经元中pp2a酶活性能用于判断病程进展或者临床治疗效果。
[0043]
具体实施中,将pp2a激活剂导入到细胞中,以神经元细胞中的pp2a酶活性为检测对象,检测获得pp2a激活剂的治疗和防治急性缺血性脑卒中的效果。
[0044]
本发明涉及pp2a激活剂在急性缺血性脑卒中制药、标记的应用。本发明发现pp2a激活剂通过提高pp2a酶活力,在小鼠短暂性全脑缺血性脑卒中模型、小鼠局灶性缺血性脑卒中模型中均有良好的治疗作用,具体表现为pp2a激活剂能减轻急性缺血性脑卒中所致脑水肿、脑梗死、神经元细胞凋亡、运动功能和认知功能障碍,其作用机制为通过增强pp2a酶活力抑制神经元细胞的钙超载,证明pp2a酶活力可作为治疗靶点,增强其活力的药物或化合物能用于治疗急性缺血性脑卒中。进一步发现急性缺血性脑卒中后,小鼠大脑皮层的pp2a酶活力随时间动态变化,可以用来判断、评估急性缺血性脑卒中的病程发展和药物治疗效果。基于此,本发明提供了pp2a激活剂在急性缺血性脑卒中制药、标记的应用,以及pp2a酶活力作为急性缺血性脑卒中治疗靶点和生物标记物的应用。
[0045]
本发明的优点在于:
[0046]
1.本发明发现,pp2a激活剂在多种急性缺血性脑卒中模型中表现出良好的治疗作用,可以通过抑制神经元细胞的钙超载减轻模型动物造模脑水肿、脑梗死、神经元细胞凋亡、运动功能和认知功能障碍,因此pp2a激活剂可以用于制备防治急性缺血性脑卒中的药物。
[0047]
2.本发明还发现,增强神经元细胞中pp2a的酶活力能抑制急性缺血性脑卒中导致的钙超载,钙超载是急性缺血性脑卒中的核心病理机制之一。因而,pp2a酶活力可以作为急性缺血性脑卒中的治疗靶点。pp2a酶活力与急性缺血性脑卒中导致的神经元细胞凋亡和认知障碍等病理特征呈负相关,增强神经元细胞中pp2a酶活力的药物或化合物能抑制钙超载,进而用于急性缺血性脑卒中的治疗。
[0048]
3.本发明发现pp2a酶活力和表达水平在急性缺血性脑卒中早期的变化特征,即pp2a酶活力在体内、体外急性缺血性脑卒中模型早期均表现为先反应性增加随后下降的特征。而pp2a蛋白水平未发生明显变化。因此pp2a酶活力可以作为急性缺血性脑卒中病程发展和治疗效果的生物标记物,检测pp2a酶活力的物质可用于制备诊断、评估病程发展和治疗效果的试剂或试剂盒。
附图说明
[0049]
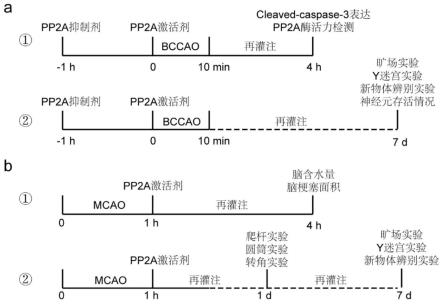
图1:为实施例1的实验流程图。其中,a为小鼠短暂性全脑缺血性脑卒中既双侧颈总动脉夹闭(bccao)造模后,使用pp2a激活剂治疗的实验流程,其中设置pp2a拮抗剂给药组用于进一步证明pp2a激活剂的治疗效果;b是小鼠局灶性缺血性脑卒中既大脑中动脉阻塞(mcao)造模后,使用pp2a激活剂治疗的实验流程。
[0050]
图2:a为dt061和ihap1给药4小时后小鼠海马区pp2a酶活力的变化(每组n=6,平均值
±
标准差,单因素方差分析,***p《0.001);b为dt061和ihap1给药4小时后小鼠海马ca1区凋亡标志蛋白cleaved-caspase-3的表达;c为cleaved-caspase-3的相对定量统计(control、bccao和lb-100组,n=11,dt061组,n=14,lb-100 dt061组,n=15,ihap1组,n=16,平均值
±
标准差,单因素方差分析,***p《0.001,**p《0.01,*p《0.05)。
[0051]
图3:a为旷场实验示意图;b为使用或不使用dt061或ihap1治疗后7天,小鼠的运动速度(control组,n=16,bccao组,n=18,dt061和lb-100组,n=12,ihap1组,n=14,lb-100 dt061组,n=13,平均值
±
标准差,单因素方差分析,ns,无显著差异);c为小鼠的运动距离(数据分析同b);c为小鼠的代表性运动轨迹,内部黑色方框为实验装置的中心区域(a中虚线区域)。
[0052]
图4:a为y迷宫实验示意图;b为使用或不使用dt061或ihap1治疗后7天,小鼠的自发交替反应率(control组,n=12,bccao、dt061和lb-100组,n=11,ihap1组,n=13,lb-100 dt061组,n=10,平均值
±
标准差,单因素方差分析,***p《0.001,*p《0.05);c为小鼠的进臂总次数(数据分析同b,其中,ns,无显著差异)。
[0053]
图5:a为新物体辨别实验示意图;b为使用或不使用dt061或ihap1治疗后7天,小鼠对新物体探索的优先指数(control和bccao组,n=10,dt061组,n=11,ihap1和lb-100 dt061组,n=9,lb-100组,n=8,平均值
±
标准差,单因素方差分析,**p《0.01,*p《0.05);c为代表性运动轨迹,其中黑色线表示小鼠对物体的探索轨迹,左上方和右下方的小正方形分别代表旧物体和新物体(a中轨迹示意图)。
[0054]
图6:a为使用或不使用dt061或ihap1治疗后7天,小鼠海马ca1区神经元标记物neun的表达情况(control组,n=9,bccao和dt061组,n=17,ihap1组,n=13,lb-100组,n=15,lb-100 dt061组,n=19,平均值
±
标准差,单因素方差分析,***p《0.001,*p《0.05);b为neun免疫染色图。
[0055]
图7:a为使用或不使用dt061治疗后4小时,小鼠的脑含水量(每组n=6,平均值
±
标准差,单因素方差分析,***p《0.001,**p《0.01);b为代表性map2免疫染色图,白色虚线框内为梗死区域;c为小鼠脑梗死体积(每组n=6,平均值
±
标准差,非配对双侧t检验,**p《0.01)。
[0056]
图8:a为小鼠使用dt061治疗后1天进行的爬杆实验、圆筒实验和转角实验;b为小鼠爬杆所用总时间(control和dt061组,n=12,mcao组,n=10,平均值
±
标准差,单因素方差分析,***p《0.001,**p《0.01);c为圆筒实验中小鼠使用双侧前肢次数的差异(数据分析同b);d为转角实验中小鼠向右侧转身的次数(数据分析同b)。
[0057]
图9:a为旷场实验中小鼠的代表性运动轨迹;b为使用或不使用dt061治疗后7天,小鼠的运动距离(control组,n=12,mcao组,n=17,dt061组,n=16,平均值
±
标准差,单因素方差分析,ns,无显著差异);c为小鼠的运动速度(数据分析同b)。
[0058]
图10:a为使用或不使用dt061治疗后7天,小鼠在y迷宫实验中的自发交替反应率(control组,n=20,mcao和dt061组,n=11,平均值
±
标准差,单因素方差分析,**p《0.01);b为小鼠的进臂总次数(数据分析同b,其中,ns,无显著差异)。
[0059]
图11:a为新物体辨别实验中小鼠的代表性轨迹;b为使用或不使用dt061治疗后7天,小鼠对新物体探索的优先指数(control和mcao组,n=21,dt061组,n=14,平均值
±
标
准差,单因素方差分析,*p《0.05)。
[0060]
图12:为实施例2的实验流程图。其中,a为在原代小鼠皮层神经元ogd模型中考察dt061或ihap1的治疗效果和作用机制的流程,使用pp2a拮抗剂验证pp2a激活剂的作用;b为原代小鼠皮层神经元经装载camkⅱα-t286位点自磷酸化或去磷酸化突变质粒的慢病毒感染,用于验证dt061或ihap1的治疗效果和作用机制,使用pp2a拮抗剂验证pp2a激活剂的作用;c为慢病毒装载的质粒信息图谱。
[0061]
图13:a为dt061或ihap1治疗对原代神经元细胞pp2a酶活力的影响(每组n=5,平均值
±
标准差,双因素方差分析,***p《0.001,*p《0.05);b为dt061或ihap1治疗后,原代神经元细胞活力(每组n=5,平均值
±
标准差,单因素方差分析,***p《0.001,**p《0.01,*p《0.05);c为dt061或ihap1治疗后培养基中乳酸脱氢酶(ldh)的活力(每组n=6,平均值
±
标准差,单因素方差分析,***p《0.001,**p《0.01,*p《0.05)。
[0062]
图14:a为dt061或ihap1治疗对ogd造模的原代神经元细胞中p-camkⅱ和camkⅱ表达的影响;b为dt061或ihap1治疗后,p-camkⅱ与camkⅱ的比值(每组n=5,平均值
±
标准差,单因素方差分析,***p《0.001,**p《0.01,*p《0.05);c为dt061或ihap1治疗后,glua1在细胞膜上(使用特异性识别跨膜片段的glua1抗体)的表达(每组n=18,平均值
±
标准差,单因素方差分析,***p《0.001,**p《0.01);d为glua1表达的代表图。
[0063]
图15:a为dt061或ihap1治疗后,经慢病毒感染后原代神经元细胞活力(每组n=5,平均值
±
标准差,单因素方差分析,***p《0.001,*p《0.05,ns,无显著差异);b为dt061或ihap1治疗后培养基中ldh的活力(每组n=6,分析同a)。
[0064]
图16:a为经慢病毒感染的原代神经元在dt061或ihap1治疗后,p-camkⅱ和camkⅱ的表达;b为dt061或ihap1治疗慢病毒感染的原代神经元后p-camkⅱ与camkⅱ的比值(每组n=4,平均值
±
标准差,单因素方差分析,***p《0.001,**p《0.01,ns,无显著差异);c为dt061或ihap1治疗后,glua1在感染慢病毒的原代神经元细胞膜上的表达(每组n=18,平均值
±
标准差,单因素方差分析,***p《0.001,**p《0.01,ns,无显著差异);d为慢病毒(mgfp)和glua1表达的代表图。
[0065]
图17:为实施例3的实验流程图。a代表在小鼠bccao后不同时间点检测pp2a蛋白表达和酶活力,以及cleaved-caspase-3的表达。
[0066]
图18:a为bccao后不同时间小鼠大脑皮层cleaved-caspase-3免疫染色图;b为cleaved-caspase-3的相对定量统计(nc组,n=14,1h组,n=13,2h组,n=16,4h组,n=19,8h组,n=20,平均值
±
标准差,分别与nc组进行非配对独立样本双侧t检验,***p《0.001,**p《0.01)。
[0067]
图19:a为bccao后不同时间小鼠大脑皮层的pp2a酶活力(各组n=4,平均值
±
标准差,分别与nc组进行非配对独立样本双侧t检验,**p《0.01);b为免疫印迹实验中pp2a的蛋白表达;c为免疫印迹实验中pp2a蛋白表达的半定量统计(各组n=5,平均值
±
标准差,分别与nc组进行非配对独立样本双侧t检验,ns,无显著差异);d为酶联免疫实验中pp2a蛋白的表达(数据分析同c)。
具体实施方式
[0068]
下面结合附图和具体实施对本发明作进一步说明。
[0069]
本发明的实施例如下:
[0070]
一、实验方法
[0071]
1.药物配置和给药方案。
[0072]
动物实验,dt061用dmso配置为100mg/ml母液,用生理盐水稀释,按1mg/kg剂量灌胃给药;ihap1,以10%dmso 90%玉米油为溶剂,按0.5mg/kg剂量灌胃给药,对照组小鼠等数量随机灌胃给与两种溶剂。此外,bccao实验设置pp2a抑制剂给药组验证dt061的治疗效果,lb-100用人工脑脊液(acsf)配置为1μg/ml,每只小鼠经套管给药1μl(每侧给药0.5μl)1小时后,经灌胃给与小鼠dt061(1mg/kg)并进行bccao造模,其余组小鼠经套管注射等体积的acsf。细胞实验,dt061和ihap1用dmso分别配置为100μm和50μm母液,再用神经元培养基分别稀释为终浓度1μm和0.5μm,lb-100用神经元培养基配置为终浓度3.5μm。lb-100处理原代神经元1小时后,再加入dt061或ihap1,同时进行ogd造模,在造模期间和造模后30分钟,药物持续存在。
[0073]
2.小鼠急性全脑缺血性脑卒中既双侧颈总动脉夹闭(bilateral common carotid artery occlusion,bccao)模型。小鼠分别经3%和1.5%的异氟烷诱导和维持进入麻醉状态。仰卧位固定小鼠,将电子测温仪探头插入小鼠肛门1厘米处,利用加热垫和加热灯将体温维持在38.0
±
0.2℃。将小鼠颈前部毛发除去,在颈部正前方纵向剪开小鼠皮肤约1.5厘米,钝性分离出双侧颈总动脉,用小鼠动脉夹夹闭双侧颈总动脉,经10分钟缺血后,松开动脉夹使血液复灌。最后恢复组织位置,缝合伤口并消毒。小鼠苏醒后,将其放回正常饲养环境,提供水和食物。假手术(control)组的小鼠进行上述除夹闭血管以外的流程。
[0074]
3.小鼠局灶性缺血性脑卒中既大脑中动脉栓塞(mcao)模型。麻醉、术前准备和术后护理同方法2。区别是分离小鼠颈外、颈内动脉,将8-0尼龙线栓从右侧颈外动脉插入颈内动脉约0.9厘米,直至大脑中动脉的起始处,60分钟后,将线栓取出,恢复血流再灌注。
[0075]
4.小鼠双侧海马ca1区套管埋置。小鼠分别经3%和1.5%的异氟烷诱导和维持进入麻醉状态。小鼠仰卧位固定于脑立体定位仪上,剔除其颅骨表面的毛发,剪开颅骨表皮用干棉花擦去附着的黏膜组织。用调整脑组织的高度,以保证左右水平以及前后水平一致。借助体视显微镜,根据小鼠脑图谱,在颅骨表面对双侧海马ca1区(ml=
±
1.15,ap=-1.83,dv=-1.45)和远离骨缝的2-3个固定点进行定位并小心钻孔,在固定点拧入微螺钉。之后将双套管经两侧ca1区钻孔缓慢下到目标核团。待小鼠颅骨表面干燥后,用医用牙科水泥轻轻将插芯针连同螺钉固定在小鼠颅骨表面,待牙科水泥凝固后取下小鼠,待其恢复7-10天后进行实验。
[0076]
5.免疫荧光染色。用异氟烷深度麻醉小鼠,将其四肢固定,暴露心脏,经右心房用生理盐水冲洗血液,然后用4%多聚甲醛溶液进行灌流,小心取出大脑放入4%多聚甲醛溶液中固定。用30%蔗糖脱水,将脑组织包埋于冰冻切片剂中,放置恒冷箱内速冻30分钟,然后获取目标脑区的30μm冠状脑组织冰冻切片。冰冻切片用10%正常山羊血清室温封闭2小时,按需加入cleaved-caspase-3、map2或neun一抗,4℃冰箱中过夜孵育。次日洗涤切片,室温孵育alexa-546标记的二抗1.5小时,再次洗涤后,用防荧光淬灭剂封片。用激光共聚焦显微镜拍取荧光照片,imagej统计荧光染色强度,并用对照组平均荧光强度进行校正。
[0077]
6.丝氨酸/苏氨酸免疫共沉淀试剂盒检测pp2a酶活力。小鼠大脑皮层或者培养的原代神经元细胞收集于1.5ml ep管中,加入300μl含蛋白酶和磷酸酶抑制剂的结合缓冲液
(50mm tris,150mm nacl,0.5%tritonx-100,ph 7.5),经超声破碎后置于冰上静置10分钟,之后在14,000
×
g,4℃离心10分钟,收集上清后进行蛋白定量,并将各个样品的总蛋白浓度调节一致。取50μl磁珠(100μg)于1.5ml ep管中,结合缓冲液洗涤两次,加入终浓度为4μg的pp2a(05-421,sigma-aldrich)一抗,室温混合均匀,15分钟后去除抗体并洗涤磁珠。加入200μl蛋白提取液,室温轻柔混匀1小时,使抗原和抗体充分结合。用缓冲液洗涤磁珠-抗体-抗原复合物三次,最后均匀转移到两个新的ep管中,其中一管加入酶底物检测pp2a的酶活力,另一管用酶联免疫吸附法检测pp2a的蛋白浓度,最终结果表示为:
[0078][0079]
7.小鼠脑含水量既脑水肿检测。小鼠经co2麻醉处死后,取脑组织,将受损侧半脑分离,分别称取湿重和在100℃干燥48小时后的干重,脑水肿计算公式为:
[0080]
8.脑梗死面积测试。在相同位置按照相同间隔收取6张脑组织切片,按照方法5获取map2荧光染色图片,用imagej统计非梗死侧map2阳性染色面积并减去梗死侧map2阳性染色面积即为的梗死面积,依据6张切片获取梗死体积。
[0081]
9.小鼠行为学实验。考察小鼠的运动能力:爬杆实验,考察小鼠的平衡调节能力和肢体协调能力,实验装置为表面粗糙的长50厘米、直径8厘米的垂直长杆,直立于小鼠生活的笼中,将小鼠头朝上放置在靠近顶端的位置,记录小鼠从开始转向并顺杆爬下所用的时间,如无法完成爬杆,记为120秒,每只小鼠测试3次取平均值。圆筒实验,考察小鼠肢体不对称使用的情况,实验装置为透明的有机玻璃圆筒(15
×
20厘米),将小鼠放入圆筒,记录5分钟内小鼠使用左(l)、右(r)和双侧(b)前肢接触筒壁并站立的次数。正常状态下小鼠倾向于使用双侧上肢碰触攀爬圆筒壁以做出探索行为,但mcao造模后,小鼠使用非受损侧上肢的比率会明显增加。转角实验,考察小鼠的对称感觉运动缺陷,实验装置由夹角30
°
的两壁组成,将小鼠放两壁尖端,记录10次实验中小鼠从角落转弯到身体未受损一侧的次数。旷场实验,反映小鼠的运动能力,实验装置是一个正方形的箱子(40
×
40厘米),在中间划出一个20
×
20厘米的中间区域。将小鼠放在中间区域,让其自由跑动5分钟,统计运动距离和速度。考察小鼠的认知功能:各组小鼠在旷场实验中的运动距离和速度无差异的前提下,测试认知功能。y迷宫,考察小鼠的运动能力和工作记忆,实验装置由三个等长臂组成“y”字形,即a、b、c三臂。将小鼠放入a臂的末端,记录5分钟内小鼠进入三个臂的顺序及进臂总次数,连续进入三个不同的臂为一次正确交替反(alternation),各组小鼠进臂总次数无差异时,计算自发交替反应率,公式为:新物体辨别实验,反映小鼠的形象辨别记忆,实验装置为一个正方形的箱子(40
×
40厘米),小鼠适应环境后5分钟后,将动物未曾见过的两个完全相同的物体置于距边缘等距离的位置上,记录5分钟内小鼠探索两物体的时间,之后将一个物体换成颜色、形状及材质方面均不相同但大小
相同的新物体,1小时后将小鼠再次放入,记录小鼠探索两物体的时间(t
旧
、t
新
),小鼠对新物体探索的优先指数(preferential index)计算公式为:
[0082]
10.原代皮层神经元培养。用乙醚麻醉孕18天c57bl/6j鼠,快速处死母鼠并取出胎鼠,酒精消毒,置于杜氏缓冲液中。于解剖镜下分离出干净的皮层转移至15ml离心管。加入0.25%的胰酶,在37℃恒温水浴中消化12分钟。加入10%血清终止消化,1,000
×
g室温离心5分钟,用神经元培养液轻轻重悬细胞沉淀。将神经元细胞种到提前用多聚赖氨酸包被的培养皿或孔板中,每4-5天半量更换新的培养液。体外培养神经元10天后用于实验。
[0083]
11.原代皮层神经元氧糖剥夺(oxygen-glucose deprivation,ogd)模型。吸出培养皿或孔板中原有神经元细胞培养液,换入已做缺氧处理的无糖无血清培养液,并置于billups-rothenberg细胞缺氧小室中,于95%n2-5%co2、37℃培养箱中培养30分钟后,恢复至正常培养基及95%空气和5%co2培养条件。
[0084]
12.细胞活力。cell counting kit(cck8)能被线粒体内的脱氢酶还原生成水溶性橙黄色的甲臜产物,反应后颜色的深浅与细胞的增殖成正比,与细胞毒性成反比,间接反映活细胞数量。原代神经元细胞培养于96孔板,造模或给药处理后的适当时间,去除原培养基,每孔加入含10%的cck8培养基100μl,并设置无细胞的空白组。孔板在培养箱内孵育2小时,用酶标仪测定450纳米波长处的吸光度值(a)。细胞活力计算公式为:
[0085][0086]
13.细胞培养基中乳酸脱氢酶(ldh)活力。ldh是一种稳定的细胞质酶,正常情况下无法透过细胞膜。当细胞受损时细胞膜渗漏,ldh释放到细胞外。检测细胞培养基中ldh酶活力用于评估细胞的损伤程度。实验时,利用试剂盒提供的标准品制作标准曲线,并设置阳性对照孔。收取细胞上清,1,000
×
g室温离心5分钟去除悬浮的细胞,每孔加入0.05ml细胞上清液,再加入50μl含4%ldh底物的分析缓冲液。间隔5分钟用酶标仪测定450纳米波长处的吸光度值,直至最大吸光度值接近标准曲线的最大值。依据标准曲线计算ldh的浓度(c nmol),以及测试时间间隔(δt),细胞培养基中ldh的活力(ldh activity)计算公式为:
[0087]
14.蛋白免疫印迹实验。小鼠用co2麻醉后,迅速断头取脑,并分离大脑皮层,收取原代培养的皮层神经元,1,000
×
g离心5分钟获取细胞团。进行蛋白免疫印迹实验时,按1:10(10ml/mg)比例加入含蛋白酶抑制剂cocktail的ripa裂解液,于冰上制备组织匀浆,12,000
×
g,4℃离心20分钟。取10μl上清液按bca试剂盒说明书进行蛋白定量,并将样品稀释为相同浓度,加入上样缓冲液,沸水浴5分钟,使蛋白充分变性。自然冷却后储存于-80℃冰箱。将4-12%的sds-page胶安装在电泳槽中,加入电泳缓冲液后,每孔分别加入30μg蛋白,在160v进行电泳。湿转法将凝胶上的蛋白转移到pvdf膜上。pvdf膜用5%脱脂奶粉-pbs封闭液室温封闭2小时后孵育一抗,置于4℃冰箱中过夜7-12小时。室温孵育辣根过氧化酶标记的二抗1.5小时。pvdf膜再次清洗后,加入ecl发光液,利用凝胶成像系统法显影。利用imagej软件对结果进行分析。
[0088]
15.免疫细胞化学实验。用于免疫细胞化学染色实验的原代神经元细胞培养于多
聚赖氨酸包被过的爬片。爬片用pbs清洗一遍,用10%普通驴血清室温封闭2小时。室温孵育glua1(mab2263,millipore,特异性识别glua1跨膜片段)一抗1小时。pbs轻洗去一抗,室温避光孵育alexa-546标记的二抗1小时。避光轻洗二抗,用dapi封片剂封片,用激光共聚焦显微镜拍取荧光照片,利用imagej软件分析图像的荧光强度,并用对照组荧光强度均值校正。
[0089]
16.病毒感染实验。原代神经元细胞培养第5天为适宜感染时间。先吸取一半原培养基无菌保存,然后按照感染复数=10加入慢病毒。慢病毒感染8-12小时,弃去培养基,然后迅速加入预热好的感染前收集的另一半原培养基。含病毒的培养基不可直接弃去,应先进行灭活操作。继续培养5天后,荧光显微镜下观察只表达mgfp的空载体慢病毒感染组的感染情况,并收取蛋白样品,进行后续实验。
[0090]
17.酶联免疫附实验。利用pp2a特异性酶联免疫吸附试剂盒配套的pp2a标准品制作标准曲线,将未知浓度的样品加入微孔酶标板,与生物素标记的抗体共同孵育,再加入亲和素标记的辣根过氧化酶,经温育和洗涤后,加入显色底物,用酶标仪读取样品吸光度,利用标准曲线检测样品中pp2a的蛋白浓度。
[0091]
二、实验结果
[0092]
1.dt061和ihap1对bccao模型小鼠有治疗作用(图1-6)。
[0093]
实验设计如图1所示。
[0094]
检测pp2a酶活力和神经元凋亡的结果如图2所示,dt061和ihap1给药4小时后显著增强小鼠海马区pp2a酶活力,并减轻bccao造模引起的海马ca1区凋亡标记蛋cleaved-caspase-3的表达。dt061的上述作用被pp2a抑制剂lb-100阻断,且lb-100给药显著增加bccao后cleaved-caspase-3的表达。
[0095]
旷场实验如图3所示,图中可见,bccao造模后第7天,小鼠的运动能力没有变化。
[0096]
y迷宫实验如图4所示,图中可见,dt061和ihap1治疗能显著改善bccao造模引起的工作记忆障碍,dt061的此作用被lb-100阻断。
[0097]
新物体辨别实验如图5所示,图中可见,dt061和ihap1治疗能显著改善bccao造模引起的形象辨别记忆障碍,dt061的此作用被lb-100阻断。
[0098]
免疫荧光实验检测神经元标记物neun如图6所示,图中可见,与对照组小鼠相比,bccao引起海马ca1区神经元细胞大量丢失,dt061和ihap1治疗能显著改善小鼠海马ca1区神经元细胞丢失现象,dt061的此作用被lb-100阻断。
[0099]
2.dt061对mcao模型小鼠有治疗作用(图7-11)。
[0100]
检测小鼠脑含水量和脑梗死面积如图7所示,图中可见,mcao造模后4小时,小鼠脑组织发生明显的脑水肿和脑梗死,dt061治疗能显著抑制mcao引起的脑水肿和脑梗死。
[0101]
检测小鼠运动能力和认知能力的行为学实验如图8所示,图中可见,mcao造模后1天进行爬杆实验、圆筒实验和转角实验,发现小鼠的运动能力受损,dt061治疗能显著改善mcao引起的小鼠平衡调节和肢体协调失衡,以及对称感觉运动缺陷和肢体运动不对称现象。
[0102]
旷场实验如图9所示,图中可见,mcao造模后第7天,小鼠的运动能力没有变化。
[0103]
y迷宫实验如图10所示,图中可见,dt061治疗能显著改善mcao造模引起的工作记忆障碍。
[0104]
新物体辨别实验如图11所示,图中可见,dt061治疗能显著改善mcao造模引起的形
象辨别记忆障碍。
[0105]
3.dt061和ihap1对ogd造模的原代神经元细胞有治疗作用(图12-16)。
[0106]
实验设计如图12所示。
[0107]
检测pp2a酶活力、细胞活力和细胞培养基中ldh活力的结果如图13所示,图中可见,dt061和ihap1治疗显著增强原代皮层神经元细胞的pp2a酶活力,并减轻ogd造模引起的细胞活力下降和培养基中ldh活力增强。dt061的上述作用被lb-100阻断,且lb-100给药显著抑制pp2a酶活力和加重细胞损伤。
[0108]
蛋白免疫印迹实验检测camkii磷酸化和免疫细胞化学实验检测glua1水平的结果如图14所示,图中可见,原代神经元经ogd造模后,pt286-camkii磷酸化水平和glua1在细胞膜上的分布与对照组相比显著增加。dt061和ihap1治疗显著抑制pt286-camkii磷酸化水平和glua1在细胞膜上的分布。dt061的上述作用被lb-100阻断,且lb-100给药显著增加ogd造模后pt286-camkii磷酸化水平和glua1在细胞膜上的分布。
[0109]
检测细胞活力和细胞培养基中ldh活力的结果如图15所示,图中可见,感染慢病毒的原代神经元细胞ogd造模后,感染camkii自磷酸化t286d慢病毒后细胞活力下降和培养基中ldh活力增强,此时dt061和ihap1失去治疗作用。而感染camkii去磷酸化t286a慢病毒的后细胞活力增强,培养基中ldh活力下降,此时lb-100处理并未加重细胞损伤。
[0110]
蛋白免疫印迹实验检测camkii磷酸化和免疫细胞化学实验检测glua1水平的结果如图16所示,图中可见,感染慢病毒的原代神经元细胞ogd造模后,感染camkii自磷酸化t286d慢病毒的神经元的pt286-camkii磷酸化水平和细胞膜上glua1的水平均显著增高,且dt061和ihap1也无法发挥作用。而感染camkii去磷酸化t286a慢病毒的神经元的pt286-camkii磷酸化水平和细胞膜上glua1的水平均显著降低,此时lb-100处理并不影响pt286-camkii磷酸化水平和细胞膜上glua1的水平。
[0111]
4.pp2a蛋白表达和酶活力在急性缺血性脑组织后的变化特征(图17-图19)
[0112]
实验设计如图17所示。
[0113]
免疫荧光染色实验如图18所示,图中可见,bccao造模后8小时内,小鼠大脑皮层cleaved-caspase-3的表达随时间延长逐渐增加。
[0114]
检测pp2a酶活力和pp2a蛋白表达实验如图19所示,图中可见,bccao造模后8小时内,小鼠大脑皮层pp2a酶活力反应性增加,在2小时达到峰值,之后下降。而pp2a的蛋白表达水平不改变。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
