1.本发明属于应用型生物技术领域,具体涉及一种精原干细胞移植受体制备的方法。
背景技术:
2.雄性精子发生过程受睾丸支持细胞和其它类型睾丸体细胞的共同调节。ssc移植是将供体ssc注射到受体睾丸网中,重新迁移并定植在精原干细胞“龛”中,建立起稳定的供体来源的精子发生过程。精原干细胞是生精上皮近基底膜的一群具有高度自我更新和多向分化潜能的二倍体细胞,是成年动物体内唯一能将遗传信息传递给下一代的成体干细胞。精原干细胞既能持续自我更新保持自身群体数量恒定,又能不断分化产生各级精原细胞,并最终生成精子。精原干细胞移植是实现干细胞育种的第一步,其主要障碍是缺乏成熟且高效的受体制备方法。为了保证供体精原干细胞移植到受体睾丸网中不会被内源性种系所消融,要求受体模型保留正常体细胞功能和曲细精管结构。自1994年,brinster团队首次将ssc细胞悬液移植到生育缺陷小鼠睾丸的曲细精管中,并观察到完整的精子发生过程,经自然交配后产生了正常后代,为男性生殖医学和研究人类生精理论提供了可能。
3.受体制备是精原干细胞移植技术的重要组成部分,是成功移植的必要条件和前提基础,受体制备的效率直接关系到移植效果。目前,已经建立了腹腔注射白消安、睾丸注射白消安等受体制备技术,通过这些技术处理,使受体睾丸的各级生精细胞发生凋亡,在曲精细管支持细胞包围的近腔小室和基底小室中形成空腔,便于移植后供体精原干细胞的内迁和附植,进而完成再生分化和精子发生。虽然已经建立了较为成熟的受体制备方法,但由于白消安自身的毒性,会对试验动物产生严重的机体损伤,而且随着血液循环的不断更新,白消安逐渐被代谢,最终会减弱白消安的作用效果。同时,白消安受个体差异、注射手法和位置等因素的影响很难准确判断到达精原干细胞龛的实际作用浓度,过高会损机体引起动物死亡。
4.目前,精原干细胞移植受体的制备方法正在被不断完善,虽然白消安注射法简单易操作是现阶段最常用的受体制备方法,但如何降低血液更新对白消安的代谢以及白消安对机体产生的毒害作用亟待解决。因此,建立一种简单易操作、高效且基本无副作用的精原干细胞移植受体方法至关重要。
5.虽然目前已有许多化合物如白消安、双酚a和奥美拉唑等能够用于抑制内源性生殖细胞,但在制备精原干细胞移植受体方面仍然有许多缺陷,并不能成功制备精原干细胞移植受体。本发明经过大量的研究,意外发现,通过睾丸注射苯扎氯铵的方法成功制备了精原干细胞移植受体,而且所述苯扎氯铵为fda批准的无毒药物,具有良好的安全性,为建立简单易操作、高效且低副作用的精原干细胞移植受体提供了一种新思路。
技术实现要素:
6.针对现有技术中的不足,本发明提供了一种简单易操作、高效且基本无副作用的
精原干细胞移植受体方法,具体包括以下内容:
7.第一方面,本发明提供一种苯扎氯铵用于制备精原干细胞移植受体的新用途。
8.优选地,将所述苯扎氯铵注射于受体睾丸得到精原干细胞移植受体。
9.优选地,所述受体为家畜。
10.优选地,所述受体为羊。
11.第二方面,本发明提供了一种苯扎氯铵在制备用于制备精原干细胞移植受体的试剂中的应用。
12.优选地,所述受体为家畜。
13.优选地,所述受体为羊。
14.第三方面,本发明提供了一种精原干细胞移植受体的制备方法,所述方法为:苯扎氯铵溶液注射于受体睾丸得到精原干细胞移植受体。
15.优选地,所述方法为:避开睾丸白膜上的血管,穿透阴囊皮肤,将苯扎氯铵溶液注入受体睾丸两侧得到精原干细胞移植受体。
16.优选地,所述受体为家畜。
17.优选地,所述受体为羊。
18.优选地,所述苯扎氯铵的浓度为0.02%-0.03%w/v/侧睾丸;或7.758-11.637mg/kg体重。
19.优选地,所述注射方式为注射器注射。
20.优选地,所述方法为:
21.将受体动物进行全身麻醉,保持仰卧姿势,将受体睾丸从腹腔挤入阴囊,用75%酒精消毒;
22.固定单侧睾丸,避开睾丸白膜上的血管,注射器穿透阴囊皮肤进入睾丸,将苯扎氯铵溶液注入一侧睾丸;
23.以相同方式将苯扎氯铵溶液注入另一侧得到精原干细胞移植受体。
24.本发明的有益效果是:(1)本发明经过大量的研究,意外发现,通过睾丸注射苯扎氯铵的方法成功制备了精原干细胞移植受体;(2)所述方法不仅能够快速制备精原干细胞移植受体,且不会对试验动物产生严重的机体损伤,属于一种新型精原干细胞移植受体制备方法;(3)所述苯扎氯铵为fda批准的无毒药物,具有良好的安全性;(4)所述方法简单易操作、高效低毒,是一种成本低廉,操作简便、高效、快速、安全、可行的精原干细胞移植受体制备方法,具有广泛的应用价值。
附图说明
25.图1受体睾丸注射苯扎氯铵溶液18d后的血常规分析结果;
26.图2受体睾丸注射苯扎氯铵溶液后湖羊睾丸组织切片的染色结果;
27.图3受体睾丸注射苯扎氯铵溶液后试验羊睾丸rna完整性检测结果;
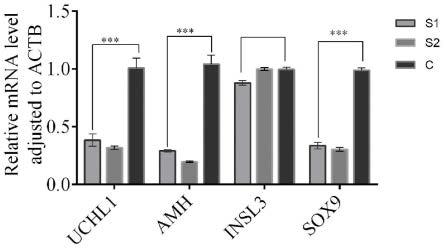
28.图4受体睾丸注射苯扎氯铵溶液18d后睾丸组织中sox9、mah、uchl1和insl3的相对表达量结果。
具体实施方式
29.以下结合具体实施例对上述方案做进一步说明。应理解,这些实施例是用于说明本发明而不限于限制本发明的范围。实施例中采用的实施条件可以根据具体厂家的条件做进一步调整,未注明的实施条件通常为常规实验中的条件。
30.以下实施例中所使用的10只体重接近、繁殖性能正常的4月龄湖羊均购自甘肃省庆阳市庆环肉羊育种公司;实验羊在庆环肉羊育种公司16号舍单栏饲养,自由采食、饮水并精心照料。
31.以下实施例中所使用的试剂均可通过市售获得。
32.以下实施例所用试剂的配置如下:
33.50%dmso:注射前30分钟,取1ml dmso加入1ml pbs,混匀后置于37℃恒温水浴锅;
34.0.02%bc(苯扎氯铵)溶液:20%w/v bc溶液加pbs稀释制备0.02%w/v的溶液;
35.0.03%bc溶液:20%w/v bc溶液加pbs稀释制备0.03%w/v的溶液;
36.pbs:称0.2g氯化钾、0.2g磷酸二氢钾、8g氯化钠、1.1.5磷酸氢二钠,加入900m超纯水搅拌溶解,然后定容至1l调节溶液ph值在7.1~7.3,用0.22μm滤膜进行过滤除菌,分装在50ml离心管后,4℃保存;
37.4%多聚甲醛:称取40g多聚甲醛粉末溶解于800ml pbs中,在65℃水浴锅中持续搅拌至完全溶解,待溶液透明后,冷却至室温,pbs定容至1000ml,4℃保存备用。
38.以下实施例所用血液样本的采集方式为:试验羊睾丸注射bc后,每组羊于18d颈静脉采血,用干燥真空抗凝血采血管收集血样,并在4h内低温运输到甘肃省兰州市畜牧与兽医研究所进行血常规检测,对相关指标进行数据分析以评估注射bc后对湖羊公羔造血功能的影响。采血前12h禁食,前1h禁水。
39.以下实施例所用睾丸组织样的采集方式为:试剂处理18d和60d,静脉采血后将试验动物固定在保定器上,使其仰卧,腹腔注射戊巴比妥钠进行全身麻醉,75%消毒擦拭阴囊区后用无菌手术刀进行阉割,取出睾丸称重和测量睾丸周长后置于冰盒,并采用二号缝合线进行缝合。睾丸组织纵向切开,首先取不同位置的睾丸组织分为2cm
×
2cm的组织块放入含有4%pfa的50ml离心管,其次取睾丸组织放入1.5ml冻存管并置于液氮中。
40.实施例1精原干细胞移植受体的制备
41.1.睾丸注射剂量
42.10只4月龄公羊随机分为3组,试验组各4只,空白对照组2只。
43.睾丸注射组,分别以0.02%和0.03%剂量对试验羊睾丸注射bc。首先,对试验动物进行保定,以60mg/kg体重剂量腹腔注射2%戊巴比妥钠进行全身麻醉,使其保持仰卧姿势,把睾丸从腹腔慢慢挤入阴囊,然后用75%酒精进行擦拭消毒,以左手食指和拇指固定单侧睾丸,右手持1.5ml无菌注射器(内含浓度为0.02%和0.03%的bc溶液)避开睾丸白膜上的血管直接穿透阴囊皮肤进入睾丸,缓慢用力将bc溶液注入睾丸,另一侧睾丸进行相同处理。注射结束后观察试验羊生命体征,待试验动物清醒后,放回饲养舍并单栏饲养18-60d,以用于检测不同浓度bc溶液的受体制备效果。
44.注射bc溶液的体积根据成人给药量公式计算,公式如下:
45.m1=c
×
387.9
46.v1=m1/c
47.v2=v1
×
2m2/m3
48.m1、m2和m3分别为成人、试验组湖羊和成年湖羊的体重(kg),c为试验组bc浓度(0.02%和0.03%),387.9为给药系数,v1和v2分别为成人和试验组湖羊给药体积(ml)。
49.空白对照组,参考睾丸注射组方法向双侧睾丸注射等体积50%dmso。
50.2.精原干细胞移植受体的制备
51.10只4月龄公羊随机分为3组,试验组各4只,空白对照组2只。
52.睾丸注射组,分别以0.02%和0.03%剂量对试验羊睾丸注射bc。首先,对试验动物进行保定,以60mg/kg体重剂量腹腔注射2%戊巴比妥钠进行全身麻醉,使其保持仰卧姿势,把睾丸从腹腔慢慢挤入阴囊,然后用75%酒精进行擦拭消毒,以左手食指和拇指固定单侧睾丸,右手持1.5ml无菌注射器(内含浓度为0.02%和0.03%的bc溶液)避开睾丸白膜上的血管直接穿透阴囊皮肤进入睾丸,缓慢用力将bc溶液注入睾丸,另一侧睾丸进行相同处理。注射结束后观察试验羊生命体征,待试验动物清醒后,放回饲养舍并单栏饲养18-60d,以用于检测不同浓度bc溶液的受体制备效果。注射bc溶液的体积根据成人给药量公式计算。
53.空白对照组,参考睾丸注射组方法向双侧睾丸注射等体积50%dmso。
54.3.注射bc后雄性湖羊睾丸体重及睾丸重变化
55.bc处理后第18天,在药物作用下,睾丸注射组(0.02%和0.03%)受体羊睾丸重量缓慢降低(结果如表1所示),在处理后第28天达到最低值,最低值分别为78.43g和62.21g。试验组最低值均显著低于对照组148.56g(p《0.05),0.02%处理和0.03%处理组睾丸重差异不显著。从bc处理后第28天起,处理组睾丸重逐渐增加,在第3个月时试验组睾丸重分别达到149.89g和154.88g。在整个试验期间,空白对照组受体羊的睾丸重始终在缓慢增加,各处理组受体羊的体重也在缓慢增加,并且bc处理组与空白对照组相比差异不显著。
56.表1注射bc后雄性湖羊睾丸体重及睾丸重变化
[0057][0058]
4.血常规检测
[0059]
在对实验组和对照组bc处理18d后受体羊进行的血常规检测分析显示,试验组受体羊血液中的白细胞(wbc)数量和血小板(plt)数量与对照组相比明显下降,但两处理组间
差异不显著(p>0.05)。其它如红细胞计数(rbc)、血红蛋白质量浓度(hgb)、平均红细胞体积(mcv)、红细胞压积(hct)、平均红细胞血红蛋白含量(mch)和平均血小板体积(mpv)等指标与空白对照组相比无明显差异且均在绵羊正常范围内,结果如图1所示。上述结果显示了睾丸注射不同浓度的bc溶液会对的造血功能产生短期影响,但所有参与试验的湖羊公羔并未出现死亡或健康状况受到明显影响的情况。并且最终研究结果显示,0.02%和0.03%处理组在睾丸注射处理3个月后试验羊的血常规已恢复到正常水平。
[0060]
5.睾丸组织切片he染色
[0061]
受体羊睾丸注射bc溶液后,不同时间点睾丸切片染色结果显示(如图2所示,a为空白对照组睾丸切片;b1、b2和b3为0.02%组处理后第18d、28d和90d睾丸切片;c1、c2和c3为0.03%组处理后第18d、28d和90d睾丸切片),随着处理时间的增加(18d、28d和90d),睾丸组织中支持细胞数从大量减少、持续减少到最低后逐渐恢复的发展过程。睾丸注射0.02%和0.03%的bc溶液都会造成湖羊睾丸支持细胞的减少,疏散睾丸间质细胞。各组受体羊在处理后第18d时,支持细胞间的紧密程度大幅降低,曲细精管外周的支持细胞基本被耗尽,管腔内的生殖细胞也开始消失,但一些精原细胞仍存活在支持细胞被大量消除的曲细精管中。然而,受体羊生精小管结构完整,未受试剂处理的影响。着处理后时间的推移,曲细精管内的各级生精细胞逐渐被耗竭,形成一个中空管腔,这种状态一直持续到第28天。随后开始恢复,曲细精管外周出现新生的支持细胞,直到bc处理后3个月,受体羊曲细精管结构恢复到正常,支持细胞和各级生精细胞出现。睾丸注射组的情况根据注射浓度的不同差别较小。
[0062]
6.荧光定量pcr
[0063]
(1)引物信息
[0064]
根据genebank中gapdh、amh、sox9、uchl1、insl3基因序列,利用ncbi在线工具pick primer设计引物,由西安擎科泽西生物科技有限责任公司和上海生工生物工程有限公司合成,引物详细信息见表2。
[0065]
表2 rt-pcr引物信息
[0066][0067]
(2)睾丸组织总rna提取与完整性检测
[0068]
使用trizol提取睾丸组织的总rna,具体步骤见附录a。取2μl总rna与加有gelred
染料的6
×
loading buffer混匀,用1%琼脂糖凝胶电泳检测rna完整性。
[0069]
取1μl总rna使用超微量分光光度计nanodrop 2000检测rna的浓度和od值,并根据浓度大小用rna free ddh2o将样品稀释至同一浓度。
[0070]
从试验羊睾丸中提取总rna,随机挑选rna样品用1%琼脂糖凝胶电泳检测其完整性,结果如图3所示:总rna电泳检测结果中有三条清晰的28s、18s和5s条带,表明总rna未发生降解,完整性及质量良好;核酸浓度测定仪测得总rna样品在260nm和280nm处的吸光度比值(od260/280)均在1.8~2.0范围内,说明rna纯度较好,符合后续试验的要求。
[0071]
(3)cdna的合成与rt-pcr扩增
[0072]
使用takara反转录试剂盒进行反转录合成cdna,产物不稀释保存于-20℃备用。具体步骤见附录b。选取gapdh作为内参基因,分别以试剂处理后的睾丸组织和正常睾丸组织的cdna为模板进行rt-pcr扩增,每个样本重复三次,反应条件如表3所示。反应总体系为10μl,包括cdna 0.8μl,上下游引物各0.4μl,2
×
taq pcr master mix 5μl,rnase-free ddh2o 3.4μl。扩增后的产物使用琼脂糖凝胶电泳检测pcr产物。
[0073]
表3 rt-pcr反应条件
[0074][0075]
用rt-pcr技术检测sox9、mah、uchl1和insl3基因在不同浓度bc处理后的第18天受体羊睾丸中的表达情况,求三个样本ct值的平均值,以actb内参基因表达量为基准将各平均ct值归零(δct),计算sox9和mah的相对表达量=2^-δδct,结果如图4所示:由图可知,支持细胞特异性标记(sox9和amh)在bc浓度为0.03%处理组中的表达量最低,且睾丸间质细胞标记基因(insl3)在三组试验羊睾丸中的表达量差异较小,这与睾丸组织he染色的结果是一致的。bc溶液处理后的第18d,受体羊睾丸支持细胞大量耗竭,呈现了“中空”的睾丸曲细精管结构。随后,在bc处理30天后,曲细精管周围逐渐出现新的支持细胞,sox9和amh基因表达量开始逐渐上升,直到试剂处理3个月后睾丸曲细精管结构恢复到正常。在bc处理组的睾丸组织中,生殖细胞特异性基因uchl1的表达量与空白对照组相比显著下降,表明生殖细胞发生凋亡。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。