1.本发明属于基因工程领域,具体的说是涉及一种提高乳酸片球菌的电转化效率的方法。
背景技术:
2.乳酸片球菌(pediococcus acidilactici)是革兰氏阳性菌,无运动性,兼性厌氧菌,隶属于厚壁菌门芽孢杆菌纲乳杆菌目乳杆菌科片球菌属,呈圆球状,分裂后一般细胞成对或者成团排列,不成链状。乳酸片球菌具有改善动物机体肠道形态、调控血清生化指标、治疗便秘、腹泻、增强免疫功能、维持肠道微生态平衡和调节胃肠道菌群的功能,位列在农业农村部允许使用的菌种目录中。乳酸片球菌因具有无污染、无残留等优势,可代替或减少抗生素的应用,保证了食品安全。乳酸片球菌还可以做为产乳酸的发酵菌株,进行科学研究和工业生产。
3.为了探索乳酸片球菌的代谢调控分子机制,需要进行相应的基因操作。通常,会在乳酸片球菌中通过质粒进行基因的过表达或基因敲除等手段来了解相关基因的作用。目前为止,在乳酸片球菌都是通过电转化的方式把质粒转入菌中。研究者们通过优化电转电压、感受态浓度、质粒浓度、菌生长od、培养基中添加苏氨酸、溶菌酶破壁浓度等各种参数提高电转化效率。感受态细胞对电转化效率影响权重较大。因为乳酸片球菌是革兰氏阳性菌,其细胞壁较厚,现在常用的感受态制备方法是在培养细胞的培养基中加入苏氨酸使细胞壁不完整,出现“残缺”,其后利用溶菌酶进一步破坏细胞壁,使细胞成感受态,易于“吸入”质粒而电转成功。遗憾的是,乳酸片球菌质粒的转化效率一直不高,虽然对挑取转化成功阳性菌落影响不大。但是,有些基因操作是需要高转化效率才能进行下去。比如,优化改造木糖苷酶(xylosidase)在乳酸片球菌中的酶解效率,酶基因进行易错pcr,混合酶基因和质粒进行连接后电转化入乳酸片球菌感受态细胞,筛选平板中加入对硝基酚木糖苷,培养3天后进行高通量筛选,如果木糖苷酶效率变高,会产生黄色的对硝基酚,菌落周边会出现黄色斑迹,根据其大小挑选菌落再进行酶效率的验证。此时,如果转化效率低下,筛选平板上的阳性菌落数少,达不到高通量筛选的效果,对酶基因进行优化改造将非常困难。
4.在原核生物的基因表达中,核糖体结合位点(ribosome binding site,简称rbs)和基因起始codon(aug)之间的距离影响翻译(translation)效率,其间长度一般为5-8个碱基,如果加长,效率会随之下降。
5.革兰氏阳性菌细胞壁较厚,化学组成简单,一般有90%肽聚糖和10%磷壁酸组成。细胞壁的机械强度有赖于肽聚糖的存在。细菌合成肽聚糖的途径已经解析出来了,其中mray负责催化udp-n-acetylmuramic acid-pentapeptide(磷酸-n-乙酰胞壁酸酯-胸腺喷丁)和脂质载体十一异戊烯磷酸合成细胞壁前体脂i(lipid i),再由murg催化与n-乙酰葡萄糖胺结合形成lipid ii(肽聚糖的重要前体)。同时,在乳酸片球菌中mary和murg基因序列高度保守,本发明利用此原理,把乳酸片球菌的murg基因与rbs之间的距离加长使其表达弱化,造成其细胞壁的不完善,最终制备的感受态细胞大幅提高了转化效率。
技术实现要素:
6.本发明的目的是:设计一种提高乳酸片球菌的电转化效率的方法,通过把rbs和murg基因起始codon(aug)之间的碱基加长来弱化细胞壁合成的murg基因的表达,造成其细胞壁的不完善,最终制备的感受态细胞大幅提高了转化效率。此方法只需把菌改造一次,之后因为电转化效率的大幅提高,基因操作简单,阳性率高,特别是可用于高通量筛选用。
7.本发明的另一目的是提供一种经过碱基加长的高电转化效率的乳酸片球菌基因工程菌,所述基因工程菌rbs和murg基因起始codon(aug)之间的碱基加长,电转化效率的大幅提高。
8.为了实现上述目的,本发明采用的技术方案为:
9.一种提高乳酸片球菌的电转化效率的方法,在murg起始codon前插入4-8个碱基序列,把rbs和murg基因起始codon之间的碱基加长来弱化细胞壁合成的murg基因的表达,造成其细胞壁的不完善,提高乳酸片球菌的电转化效率。
10.在murg起始codon前插入的碱基序列为除了ag组合以外的a、t、c、g任意组合。
11.在murg起始codon前插入的碱基序列优选为(ac)n,n=2~4。
12.插入的碱基序列主要限定长度,长度小于4几乎无效果,大于8效果差,优选插入4~8个碱基,进一步优选插入6个碱基。
13.插入的碱基序列没有特别的限定,a、t、c、g任意组合,要避免出现a和g的组合,因为a和g组合极易出现和rbs类似序列,会被核糖体误识别成rbs,从而不影响翻译效率,比如aaggag、agagag这种ag组合一起的,电转化效率提高不显著。插入的碱基序列优选为ac ac ac。
14.包括如下步骤:
15.1)制备敲入质粒pset4e-rbslength,以敲除质粒pset4e为模板,设计引物序列1得到质粒骨架序列pset4eb,以乳酸片球菌基因组为模板,分别设计引物序列2和引物序列3进行无缝克隆,pcr得到同源臂右片段序列murgr和同源臂左片段序列rbsmurgf;
16.2)把序列片段murgr、rbsmurgf和质粒骨架pset4eb进行连接后转入大肠杆菌e.coli top10感受态细胞,涂布lb平板后培养挑选阳性菌落验证筛选,获得在rbs位点后含有增加碱基的敲入质粒pset4e-rbslength的大肠杆菌;然后进行质粒抽提获得质粒pset4e-rbslength;
17.3)制备乳酸片球菌常规感受态细胞;
18.4)将敲入质粒pset4e-rbslength转入乳酸片球菌;
19.5)将含有质粒pset4e-rbslength的乳酸片球菌进行单交换,使敲入质粒进入乳酸片球菌基因组;
20.6)将单交换的乳酸片球菌进行双交换,使质粒序列部分从基因组中脱离,rbs和murg基因起始codon(aug)之间的碱基得到了加长碱基序列;弱化细胞壁合成的murg基因的表达,提高乳酸片球菌的电转化效率。
21.引物序列1为pset_primerf:gcaactgttgggaagggcgatc
22.pset_primerr:gcagcctgaatggcgaatggcg。
23.引物序列2为:murg_primerf:atgagactgatggtttcaggag,
24.murg_primerr:gatcgcccttcccaacagttgcacggtagcaccgccactttcc,其中“gatcgcccttcccaacagttgc”碱基序列为质粒骨架同源序列。
25.引物序列3为:murgrbs_primerf:cgccattcgccattcaggctgctagattggcacaaaactcgg,
26.murgrbs_primerr:((ac)n)ttagtaacatctccttttt,其中(ac)n为增加的碱基,根据实际效果决定n为2-4,“cgccattcgccattcaggctgc”碱基序列为质粒骨架同源序列。
27.步骤1)中以乳酸片球菌atcc8042基因组为模板。
28.优选地,在murg起始codon前插入的碱基序列为acacac。
29.本发明方法是一种适用于提高乳酸片球菌电转化效率的通用方法,改造的murg基因保守性非常高。实施例是用乳酸片球菌atcc8042菌株作为一个示例,并不限定于仅在该菌株上适用。
30.一株高电转化效率的乳酸片球菌,所述乳酸片球菌的murg起始codon前插入有4-8个碱基序列。
31.所述碱基序列为acac或者acacac或者acacacac。
32.有益效果:
33.制备原始乳酸片球菌和双交换后的乳酸片球菌感受态细胞,将pmg36e质粒电转入感受态细胞,比对结果显示在rbs和murg基因起始codon(aug)之间增长碱基序列显著提高了电转化效率100~2000倍,证明了把乳酸片球菌的murg基因与rbs之间的距离加长使其表达弱化,造成其细胞壁的不完善,最终制备的感受态细胞大幅提高了转化效率,为高通量筛选等基因操作提供了方便可行的途径。
附图说明
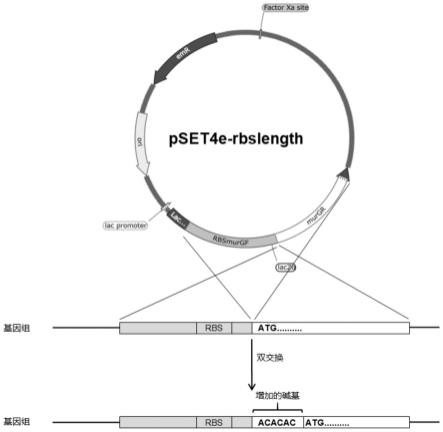
34.图1:敲入质粒pset4e-rbslength制备流程图。
35.图2:双交换使菌murg基因与rbs之间的距离加长。
36.图3:实施例1中的质粒制备过程的电泳图,其中泳道1是murg(约1kb),泳道2是rbsmurgf(约1kb),泳道3是pset4e骨架(约4.4kb),m是marker。
37.图4:实施例1制备得到的质粒pset4e-rbslength电泳图。
具体实施方式
38.下面结合具体的实施例进一步详细地描述本发明。本领域技术人员应当理解,这些实施例只是为了举例说明本发明,而非以任何方式限制本发明的范围。
39.实施例中采用的是乳酸片球菌atcc8042菌株,并不限定于仅在该菌株上适用。
40.实施例1
41.第一步:制备敲入质粒pset4e-rbslength,其作用是在murg起始codon前插入4个碱基序列,使rbs和murg基因起始codon(aug)之间的碱基变长。
42.以敲除质粒pset4e为模板,设计引物序列pset_primerf:“gcaactgttgggaagggcgatc”和pset_primerr:“gcagcctgaatggcgaatggcg”,pcr的方法得到质粒骨架序列pset4eb。
43.以乳酸片球菌atcc8042基因组为模板,设计引物序列murg_primerf:“atgagactgatggtttcaggag”和murg_primerr:“gatcgcccttcccaacagttgcacggtagcaccgcc
actttcc”,其中“gatcgcccttcccaacagttgc”碱基序列为质粒骨架同源序列,用于无缝克隆用,pcr得到同源臂右片段序列murgr,长度~800bps;以乳酸片球菌atcc8042基因组为模板,设计引物序列murgrbs_primerf:“cgccattcgccattcaggctgctagattggcacaaaactcgg”和murgrbs_primerr:“acacttagtaacatctccttttt”(acac为4个增加的碱基),其中“cgccattcgccattcaggctgc”碱基序列为质粒骨架同源序列,用于无缝克隆用,pcr得到同源臂左片段序列rbsmurgf,长度~800bps。
44.利用碧云天seamless cloning kit(无缝克隆试剂盒),采用无缝克隆的方法把序列片段murgr、rbsmurgf和质粒骨架pset4eb进行连接后转入大肠杆菌e.coli top10感受态细胞,涂布lb平板(含300ug/ml红霉素)后37度培养24h后挑选阳性菌落验证筛选,获得在rbs位点后含有增加碱基的敲入质粒pset4e-rbslength的大肠杆菌。
45.第二步:提取质粒pset4e-rbslength,其作用是富集质粒,用于转入乳酸片球菌。
46.在第一步中得到的含有敲入质粒pset4e-rbslength的大肠杆菌接种至5ml含有lb培养液(含300ug/ml红霉素)的试管中,37度180rpm培养过夜。次日,利用碧云天质粒小量抽提试剂盒进行质粒抽提获得50ul质粒pset4e-rbslength。
47.第三步:采用常规方法制备乳酸片球菌常规感受态细胞,起作用是电转化转入敲入质粒pset4e-rbslength。
48.准备电转化试剂:
49.1)电转缓冲液1:0.2g六水氯化镁,205.4g蔗糖,1.86g磷酸钾,用去离子水定容至1l,浓盐酸调节ph至7.5。
50.2)电转缓冲液2:171.15g(0.5mol)蔗糖,量取100ml甘油,用去离子水定容至1l。
51.3)复苏液(mrs 17%蔗糖):20g葡萄糖,2g柠檬酸氢二铵,171.15g(0.5mol)蔗糖,2g磷酸氢二钾,10g胰蛋白胨,0.2g七水硫酸镁,4g酵母提取物,3g乙酸钠,0.05g一水硫酸锰,8g牛肉膏,1ml的吐温80,用去离子水定容至1l。
52.4)tris-cl缓冲液(ph8.0):121mg tris溶于去离子水中,浓盐酸调节ph至8.0,用去离子水定容至100mlo
53.5)溶菌酶母液(1mg/ml):5mg溶菌酶干粉溶于5ml tris-cl缓冲液(ph8.0)中,0.22um滤膜过滤除菌,-20℃避光保存。溶菌酶为碱性溶菌酶。
54.6)dl苏氨酸母液(0.8m):470mg dl苏氨酸溶于5ml去离子水中,0.22um滤膜过滤除菌。
55.7)红霉素母液(100mg/ml):称取500mg红霉素粉末溶于5ml无水乙醇中,完全溶解后,0.22um滤膜过滤除菌,并于-20℃避光保存。
56.制备感受态:
57.冻存管乳酸片球菌atcc8042菌株菌液10ul接种至10ml mrs螺口小瓶,于42℃培养箱中静置培养过夜(约16h),次日早上将过夜生长的菌液3ml-5ml转接至100ml mrs(含终浓度40mm的dl苏氨酸=加5ml dl苏氨酸母液)摇瓶于42℃,150rpm培养od
600
≈1时,把菌液放在冰上10分钟后,分装至50ml离心管,在4℃下8000rpm离心5分钟弃上清,用1ml的电转缓冲液1(冰上预冷)将管内菌体悬浮,再加入20ml的电转缓冲液1混匀,在4℃下8000rpm离心5分钟弃上清,重复洗涤2次后,菌体合并(100ml收集的菌体)加入6ml电转缓冲液1(冰上预冷)同时加入600ul 1mg/ml溶菌酶混匀,37℃水浴30分钟。再次在4℃下8000rpm离心5分钟弃上
清,用1ml的电转缓冲液1(冰上预冷)将管内菌体悬浮,再加入20ml的电转缓冲液1混匀,在4℃下8000rpm离心5分钟弃上清,重复洗涤3次后,菌体用3ml的电转缓冲液2(冰上预冷)混匀,每管分装75ul使用或-80℃保存备用。
58.第四步:将敲入质粒pset4e-rbslength转入乳酸片球菌
59.1)取5ul敲入质粒pset4e-rbslength加入75ul感受态细胞,轻轻混合后,冰上放置10分钟;
60.2)将质粒与感受态的混合液转移至预冷的1mm电击杯中,在2000v,200ω,25uf条件下进行电击,然后将电击后的液体立即转移至900ml冰上预冷的复苏液中,冰上放置5分钟;
61.3)30℃,150rpm培养大约6小时(视菌实际生长情况),菌液刚开始混浊,6000rpm离心5min,弃去800ul上清,剩余混匀涂布于含10ug/ml的红霉素mrs平板;
62.4)平板30℃培养~72小时,挑取菌落进行pcr验证,确保菌落无误。
63.第五步:将含有质粒pset4e-rbslength的乳酸片球菌进行单交换,使敲入质粒进入乳酸片球菌基因组。
64.将含有质粒pset4e-rbslength的乳酸片球菌接入含10ug/ml的红霉素mrs液体试管,30度培养至od
600
约0.6,稀释不同倍数后涂布于含10ug/ml的红霉素mrs平板,42度静置培养24~48小时,待菌落出现,挑取菌落进行pcr验证。此时验证无误的菌已经进行了单交换。
65.第六步:将单交换的乳酸片球菌进行双交换,使质粒序列部分从基因组中脱离,rbs和murg基因起始codon(aug)之间的碱基得到了加长碱基序列。
66.将单交换的乳酸片球菌接入含10ug/ml的红霉素mrs液体试管,42度培养至od
600
约0.6,稀释不同倍数后涂布于mrs平板,42度静置培养24~48小时,待菌落出现。将同一个菌落分别挑至含10ug/ml的红霉素mrs平板和mrs平板(不含10ug/ml的红霉素),标上序号,以便分清菌落。再将平板42度静置培养24~48小时,待菌落出现进行比对。当同一序号的菌在10ug/ml的红霉素mrs平板上没生长而在mrs平板(不含10ug/ml的红霉素)生长的,就视为潜在的双交换菌,再进行pcr验证确认为双交换菌后进行甘油冻存管保存。此步保存的菌为rbs和murg基因起始codon(aug)之间的碱基得到了加长碱基序列的乳酸片球菌。
67.第七步:用在乳酸菌中常用的pmg36e质粒在双交换的乳酸片球菌进行常规操作电转化,比较电转化效率的区别。
68.用本方法描述的第三步分别制备原始乳酸片球菌和双交换后的乳酸片球菌感受态细胞。将pmg36e质粒电转入感受态细胞,具体步骤如下:
69.1)取5ul质粒pmg36e加入75ul感受态细胞,轻轻混合后,冰上放置10分钟。
70.2)将质粒与感受态的混合液转移至预冷的1mm电击杯中,在2000v,200ω,25uf条件下进行电击,然后将电击后的液体立即转移至900ml冰上预冷的复苏液中,冰上放置5分钟。
71.3)42℃,150rpm培养大约3小时(视菌实际生长情况),菌液刚开始混浊,6000rpm离心5min,弃去800ul上清,剩余混匀涂布于含10ug/ml的红霉素mrs平板。
72.4)平板30℃培养~72小时后,进行菌落计数。
73.传统电转方法的电转效率为(5.3
±
0.2)
×
102转化子/ug dna,本发明方法的电转
效率为(6.7
±
0.5)
×
104转化子/ug dna,电转化效率提高了126倍。
74.实施例2
75.本实施例与实施例1的区别在于:第一步制备敲入质粒pset4e-rbslength1,不同的地方为设计引物murgrbs_primerr:“acacacttagtaacatctccttttt”(acacac为6个增加的碱基),随后按照实施例1方法第二步至第七步进行。最后统计,传统电转方法的电转效率为(5.3
±
0.2)
×
102转化子/ug dna,本发明方法的电转效率为(1.1
±
0.1)
×
106转化子/ug dna,电转化效率提高了2075倍。
76.实施例3
77.本实施例与实施例1的区别在于:第一步制备敲入质粒pset4e-rbslength1,不同的地方为设计引物murgrbs_primerr:“acacacacttagtaacatctccttttt”(acacacac为8个增加的碱基),随后按照实施例1中第二步至第七步进行。最后统计,传统电转方法的电转效率为(5.3
±
0.2)
×
102转化子/ug dna,本发明方法的电转效率为(2.3
±
0.3)
×
105转化子/ug dna,电转化效率提高了434倍。
78.实施例4
79.本实施例与实施例1的区别在于:第一步制备敲入质粒pset4e-rbslength1,不同的地方为设计引物murgrbs_primerr:“agagagttagtaacatctccttttt”(agagag为6个增加的碱基),随后按照实施例1中第二步至第七步进行。最后统计,传统电转方法的电转效率为(5.3
±
0.2)
×
102转化子/ug dna,本发明方法的电转效率为(4.9
±
0.3)
×
102转化子/ug dna,电转化效率几乎无变化。
80.实施例5
81.本实施例与实施例1的区别在于:第一步制备敲入质粒pset4e-rbslength1,不同的地方为设计引物murgrbs_primerr:“aaggagttagtaacatctccttttt”(aaggag为6个增加的碱基),随后按照实施例1中第二步至第七步进行。最后统计,传统电转方法的电转效率为(5.3
±
0.2)
×
102转化子/ug dna,本发明方法的电转效率为(5.8
±
0.3)
×
102转化子/ug dna,电转化效率几乎无变化。
82.以上实施例中电转效率的测定方法为涂板数菌落数。参见李欣,杨坤宁,刘志勇,等.电转化法制备高转化效率的e.coli感受态细胞研究[j].食品与生物技术学报,2007(6)。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。