1.本发明涉及一种糖尿病性痴呆症和血管性痴呆症的预防或治疗剂,包含rgma抑制物质。
背景技术:
2.糖尿病和痴呆症患者伴随老龄化而逐年增加,在患有糖尿病的情况下,阿尔茨海默症、血管性痴呆症的发病风险增大,且已明确了在两种疾病之间存在密切的病理学相关性(非专利文献1、非专利文献2)。另外,许多报告指出在未合并痴呆症的糖尿病患者中,与非糖尿病患者相比,确认到认知功能的降低,作为这样的糖尿病患者的认知功能障碍,报告了注意-集中力的降低、视觉记忆或言语记忆的降低、简易精神状况检查(mini-mental state examination;mmse)的降低等(非专利文献3)。
3.近年来,作为伴有糖尿病的痴呆症的分类,除了阿尔茨海默症、血管性痴呆症以外,还提出了糖代謝异常与痴呆症的发病密切相关的糖尿病性痴呆症这样的临床病型(非专利文献4、非专利文献5)。糖尿病性痴呆症呈现阿尔茨海默症的特征脑影像所见(海马萎缩等)的情况较少,但可见更多的微梗死病变等血管性病变的合併例(非专利文献6),临床上略微高龄,糖尿病的控制不良、与记忆障碍相比,更具有注意力
·
集中力下降、执行功能的障碍明显,行走略微缓慢这样的特征。
4.另一方面,血管性痴呆症是主要由脑血管障碍引起的痴呆症,特别是以皮层下动脉硬化脑病(binswanger病)、多发性腔隙性脑梗死等脑小血管病为主要原因,定义为(1)具有痴呆症、(2)具有脑血管障碍、(3)两者有因果关系的病症。
5.作为基于临床诊断标准即ninds-airen(national institute of neurological disorders and stroke-association international pour la recherche et l’enseignement en neurosciences)的病型分类,举出了(1)多发梗塞性、(2)单一病变性、(3)小血管病变性、(4)低灌注性、(5)脑出血性这5种。然而,这些各病型具有病因上、临床上均不一致的问题,因此认为血管性痴呆症是包含各种病状的异质性(heterogeneous)疾病概念(非专利文献7、非专利文献8)。
6.另外,广泛已知作为血管性痴呆症的危险因素,包含糖尿病(非专利文献8、非专利文献9)
7.rgm(排斥性引导分子,repulsive guidance molecule)是最初被鉴定为视觉系统的轴突诱导分子的膜蛋白(非专利文献10)。已知rgm家族中包含被称为rgma、rgmb和rgmc的3种成员(非专利文献11),且至少rgma和rgmb以相同的信号转导机制发挥作用(非专利文献12)。rgmc在铁代谢中发挥重要的作用。
8.根据其后的研究,明确了rgm具有诱导爪蟾(xenopus)和鸡胚胎的轴突和层形成,以及控制小鼠胚胎的头部神经管的闭合等功能(非专利文献13)。在专利文献1中公开了含有抗rgm中和抗体作为有效成分的轴突再生促进剂。
9.除发育阶段的功能之外,还由于在成年人类和大鼠的中枢神经系统损伤后重新表
达,以及在大鼠中,rgma抑制会使脊髓损伤后的轴突生长亢进、促进功能恢复(非专利文献14),因此,认为rgma是中枢神经系统损伤后的轴突再生抑制物质。作为中和rgma的具体的抗体,记载于例如专利文献2(例如5f9、8d1)、专利文献3(例如ae12-1、ae12-1y)以及专利文献4(例如r116a3、r70e4、r116a3c、rh116a3)。
10.另外,专利文献2中公开了抗rgma抗体的痴呆症的治疗用途。
11.如此,对于中枢神经系统损伤,已明确rgma的作用,但特别是尚未鉴定出rgma参与糖尿病性痴呆症和血管性痴呆症的治疗,且尚未知晓这样的治疗药。
12.现有技术文献
13.专利文献
14.专利文献1:国际公开wo2005/087268号
15.专利文献2:国际公开wo2009/106356号
16.专利文献3:国际公开wo2013/112922号
17.专利文献4:国际公开wo2016/175236号
18.非专利文献
19.非专利文献1:neurology,45:1161,1995
20.非专利文献2:am.j.epidemiol.1455:301,1997
21.非专利文献3:diabetes care,20:438,1997
22.非专利文献4:dement geriatr cogn disord,35:280-290,2013
23.非专利文献5:j.neurol.sci.349:45-51,2015
24.非专利文献6:nat rev neurol 5:305-306,2009
25.非专利文献7:neurology,43:250-260,1993
26.非专利文献8:痴呆症治疗指南2017第14章血管性痴呆症
27.非专利文献9:neuron 83:844-866,2013
28.非专利文献10:neuron 5,735-743(1990)
29.非专利文献11:philos.trans.r.soc.lond.b biol.sci.,361:1513-29,2006
30.非专利文献12:biochem.biophys.res.commun.382,795-800(2009)
31.非专利文献13:curr.opin.neurobiol.17,29-34(2007)
32.非专利文献14:j.cell biol.173,47-58(2006)
技术实现要素:
33.本发明的课题在于提供一种对糖尿病性痴呆症和血管性痴呆症有效的药剂。
34.本发明人等为了解决上述课题而进行了深入研究,结果发现rgma抑制物质、尤其是抗rgma中和抗体对糖尿病性痴呆症和血管性痴呆症显示改善效果,从而完成了本发明。
35.即,本发明如下所述。
36.[1]一种选自糖尿病性痴呆症和血管性痴呆症中的痴呆症的预防剂或治疗剂,包含rgma抑制物质。
[0037]
[2]一种糖尿病性痴呆症的预防剂或治疗剂,包含rgma抑制物质。
[0038]
[3]一种血管性痴呆症的预防剂或治疗剂,包含rgma抑制物质。
[0039]
[4]根据[1]~[3]中任一项所述的预防或治疗剂,其中,rgma抑制物质为抗rgma中
和抗体。
[0040]
[5]根据[4]所述的预防或治疗剂,其中,抗rgma中和抗体为人源化抗体。
[0041]
[6]根据[4]或[5]所述的预防或治疗剂,其中,抗rgma中和抗体为识别选自序列号16、序列号36、序列号37、序列号38和序列号39中的氨基酸序列的抗体。
[0042]
[7]根据[4]~[6]中任一项所述的预防或治疗剂,其中,抗rgma中和抗体为选自下述(a)~(l)中的抗体:
[0043]
(a)包含轻链可变区以及重链可变区的抗rgma中和抗体,该轻链可变区包含lcdr1、lcdr2和lcdr3,该lcdr1包含序列号5中记载的氨基酸序列,该lcdr2包含序列号6中记载的氨基酸序列,该lcdr3包含序列号7中记载的氨基酸序列,该重链可变区包含hcdr1、hcdr2和hcdr3,该hcdr1包含序列号8中记载的氨基酸序列,该hcdr2包含序列号9中记载的氨基酸序列,该hcdr3包含序列号10中记载的氨基酸序列,
[0044]
(b)包含轻链可变区以及重链可变区的抗rgma中和抗体,该轻链可变区包含lcdr1、lcdr2和lcdr3,该lcdr1包含序列号11中记载的氨基酸序列,该lcdr2包含序列号12中记载的氨基酸序列,该lcdr3包含序列号13中记载的氨基酸序列,该重链可变区包含hcdr1、hcdr2和hcdr3,该hcdr1包含序列号14中记载的氨基酸序列,该hcdr2包含序列号15中记载的氨基酸序列,该hcdr3在氨基酸序列中包含sfg,
[0045]
(c)包含轻链可变区以及重链可变区的抗rgma中和抗体,该轻链可变区包含lcdr1、lcdr2和lcdr3,该lcdr1包含序列号17中记载的氨基酸序列,该lcdr2包含序列号18中记载的氨基酸序列,该lcdr3包含序列号19中记载的氨基酸序列,该重链可变区包含hcdr1、hcdr2和hcdr3,该hcdr1包含序列号20中记载的氨基酸序列,该hcdr2包含序列号21中记载的氨基酸序列,该hcdr3包含序列号22中记载的氨基酸序列,
[0046]
(d)包含轻链可变区以及重链可变区的抗rgma中和抗体,该轻链可变区包含lcdr1、lcdr2和lcdr3,该lcdr1包含序列号23中记载的氨基酸序列,该lcdr2包含序列号24中记载的氨基酸序列,该lcdr3包含序列号25中记载的氨基酸序列,该重链可变区包含hcdr1、hcdr2和hcdr3,该hcdr1包含序列号26中记载的氨基酸序列,该hcdr2包含序列号27中记载的氨基酸序列,该hcdr3包含序列号28中记载的氨基酸序列,
[0047]
(e)包含轻链可变区以及重链可变区的抗rgma中和抗体,该轻链可变区包含lcdr1、lcdr2和lcdr3,该lcdr1包含序列号29中记载的氨基酸序列,该lcdr2包含序列号30中记载的氨基酸序列,该lcdr3包含序列号31中记载的氨基酸序列,该重链可变区包含hcdr1、hcdr2和hcdr3,该hcdr1包含序列号32中记载的氨基酸序列,该hcdr2包含序列号33中记载的氨基酸序列,该hcdr3包含序列号34中记载的氨基酸序列,
[0048]
(f)包含轻链可变区以及重链可变区的抗rgma中和抗体,该轻链可变区包含lcdr1、lcdr2和lcdr3,该lcdr1包含序列号29中记载的氨基酸序列,该lcdr2包含序列号30中记载的氨基酸序列,该lcdr3包含序列号35中记载的氨基酸序列,该重链可变区包含hcdr1、hcdr2和hcdr3,该hcdr1包含序列号32中记载的氨基酸序列,该hcdr2包含序列号33中记载的氨基酸序列,该hcdr3包含序列号34中记载的氨基酸序列,
[0049]
(g)包含轻链可变区以及重链可变区的抗rgma中和抗体,该轻链可变区包含lcdr1、lcdr2和lcdr3,该lcdr1包含序列号29中记载的氨基酸序列,该lcdr2包含序列号30中记载的氨基酸序列,该lcdr3包含序列号40中记载的氨基酸序列,该重链可变区包含
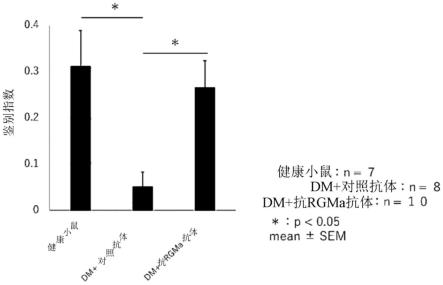
index)(di)值和健康小鼠的di值的图。
[0061]
图2是示出对非糖尿病(non-dm)小鼠或糖尿病(dm)小鼠给予抗rgma中和抗体或同型对照抗体时的双皮质素(doublecortin)阳性细胞数的图。双皮质素(doublecortin)阳性细胞数是以海马齿状回面积来标准化。
[0062]
图3是示出由慢性脑低灌注模型下的抗rgma中和抗体给药组、同型对照抗体给药组分别获得的鉴别指数(di)值和sham小鼠的同型对照抗体给药组获得的di值的图。
具体实施方式
[0063]
以下,对本发明中使用的术语进行说明。
[0064]
[中和]
[0065]
在本技术中,中和是指与目标靶结合且能够阻碍该靶的任一功能的作用。例如,rgma抑制物质是指结合于rgma,结果显示抑制rgma的生物活性的作用的物质。
[0066]
[表位]
[0067]
在本技术中,表位包含能够与免疫球蛋白或t细胞受体特异性结合的多肽决定基。在某个实施方式中,表位包含分子化学活性表面基团(例如氨基酸、糖侧链、磷酰基或磺酰基),在某个实施方式中,可以具有特定的3维结构特性和/或特定的电荷特性。表位是通过抗体而结合的抗原区域。
[0068]
[经分离的]
[0069]
在本技术中,经分离的rgma抑制物质(例如抗体等)等的“经分离的”是经鉴定且分离的、和/或从自然状态下的成分中回收的含义。自然状态下的杂质是可能妨碍该抗体的诊断或治疗用途的物质,可举出酶、激素和其它蛋白质性或非蛋白质性的溶质。一般而言,对rgma抑制物质等进行分离时,只要通过至少1个纯化工序进行纯化即可,可以将通过至少1个纯化工序而纯化的rgma抑制物质称为“经分离的rgma抑制物质”。
[0070]
[抗体]
[0071]
在本技术中,抗体在广义上是指保持免疫球蛋白(ig)分子的实质上与表位结合的特征的由2条重链(h链)和2条轻链(l链)这4条多肽链构成的ig分子。
[0072]
[人类抗体]
[0073]
在本技术中,人类抗体是指轻链、重链均来自人免疫球蛋白的抗体。人类抗体根据重链的恒定区的不同,包含具有γ链的重链的igg(包含igg1、igg2、igg3和igg4)、具有μ链的重链的igm、具有α链的重链的iga(包含iga1、iga2)、具有δ链的重链的igd或具有ε链的重链的ige。另外,原则上轻链包含κ链和λ链中的任一者。
[0074]
[人源化抗体]
[0075]
在本技术中,人源化抗体是指由可变区和来自人类抗体的恒定区构成的抗体,该可变区由来自非人类动物的抗体的互补决定区和来自人类抗体的构架区构成。
[0076]
[嵌合抗体]
[0077]
在本技术中,嵌合抗体是指轻链、重链或这两者由来自非人类的可变区和来自人类的恒定区构成的抗体。
[0078]
[单特异性抗体]
[0079]
在本技术中,单特异性抗体是指具有单一抗原特异性并同时具有单一的独立的抗
原识别部位的抗体。在本说明书中,例如将识别rgma的单特异性抗体称为rgma单特异性抗体。
[0080]
[多特异性抗体]
[0081]
在本技术中,多特异性抗体是指具有2个以上不同的抗原特异性并同时具有2个以上的独立的抗原识别部位的抗体,可举出具有2个抗原特异性的双特异性抗体、具有3个抗原特异性的三特异性抗体等。
[0082]
[互补性决定区(cdr)]
[0083]
互补决定区(cdr)是指免疫球蛋白分子的可变区中形成抗原结合位点的区域,也称为超可变区,是每个免疫球蛋白分子中氨基酸序列的变化特别大的部分。对于cdr,在轻链和重链中分别具有3个cdr。有时将轻链中所含的3个cdr分别称为lcdr1、lcdr2和lcdr3,并且将重链中所含的3个cdr分别称为hcdr1、hcdr2和hcdr3。例如,免疫球蛋白分子的cdr可以按照卡巴特(kabat)的编号系统(kabat等,1987、sequences of proteins of immunological interest、us department of health and human services、nih、usa)来决定。
[0084]
[有效量]
[0085]
有效量是指足以减轻或改善障碍或其1种以上的症状的严重程度和/或期间,预防障碍恶化,减缓障碍,预防与障碍相关的1种以上的症状的复发、发生、发病或恶化,检测出障碍,或者强化或提高其它治疗(例如预防药或治疗药)的种个以上的预防或治疗效果的预防或治疗剂的量。
[0086]
[氨基酸序列的百分比(%)同源性]
[0087]
可变区等的候补多肽序列的氨基酸序列与参考多肽序列的氨基酸序列相关的“百分比(%)同源性”定义为使序列对齐,为了得到最大的%同源性,根据需要导入间隙,且任何的保守取代均不认为是序列同源性的一部分后的与特定的参考多肽序列中的氨基酸残基相同的候补序列中的氨基酸残基的百分比。用于测定%同源性的目的的比对(alignment)可以通过使用本领域技术人员能力范围内的各种方法、例如使用blast、blast-2、align或megalign(dnastar)软件这样的可公开获得的计算机软件来实现。只要是本领域技术人员,则能够决定包含为了对比较的序列的全长实现最大比对所必需的任意算法的用于比对序列的适当的参数。但是,为了这里的目的,%同源性值通过在成对比对中使用序列比较计算机程序blast而得到。
[0088]
在氨基酸序列比较中使用blast的状况下,所提供的氨基酸序列a与所提供的氨基酸序列b的%同源性如下计算:
[0089]
分数x/y的100倍
[0090]
这里,x为通过序列比对程序blast的a和b的程序比对而为相同时则为一致的评分的氨基酸残基数,y为b的总氨基酸残基数。在氨基酸序列a的长度与氨基酸序列b的长度不同的情况下,可以理解为a相对于b的%同源性与b相对于a的%同源性不同。只要没有特别说明,则这里所有的%同源性值如上一段所示使用blast计算机程序而得到。
[0091]
[保守取代]
[0092]
保守取代是指以实质上未改变肽的活性的方式将氨基酸残基以其它化学上类似的氨基酸残基取代。例如,可举出将某一疏水性残基由其它疏水性残基取代的情况、将某一
极性残基由具有相同电荷的其它极性残基取代的情况等。作为能够进行这样的取代的功能上类似的氨基酸的例子,作为非极性(疏水性)氨基酸,可举出丙氨酸、缬氨酸、异亮氨酸、亮氨酸、脯氨酸、色氨酸、苯丙氨酸、甲硫氨酸等。作为极性(中性)氨基酸,可举出甘氨酸、丝氨酸、苏氨酸、酪氨酸、谷氨酰胺、天冬酰胺、半胱氨酸等。作为带正电荷的(碱性)氨基酸,可举出精氨酸、组氨酸、赖氨酸等。另外,作为带负电荷的(酸性)氨基酸,可举出天冬氨酸、谷氨酸等。
[0093]
以下,对本发明的实施方式进行详细说明。
[0094]
本发明提供作为rgma抑制物质的新型用途的选自糖尿病性痴呆症和血管性痴呆症中的痴呆症的预防或治疗剂。
[0095]
另外,本发明提供选自糖尿病性痴呆症和血管性痴呆症中的痴呆症的预防或治疗方法,包含对需要治疗的哺乳动物给予包含有效量的rgma抑制物质的预防或治疗剂。
[0096]
<rgma抑制物质>
[0097]
本发明的rgma抑制物质只要是作用于rgma本身而抑制或减弱rgma的活性(以下,在本说明书中有时简称为“rgma活性”)的物质即可,例如,将具有结合于rgma而直接抑制(减弱)rgma活性的活性、或者抑制rgma与受体的结合而间接地抑制(减弱)rgma活性的活性的物质(例如后述的化合物或抗体等)称为本发明的rgma抑制物质。
[0098]
另外,本发明的rgma抑制物质也可以为抑制rgma的表达的物质,例如,抑制rgma的表达而抑制(减弱)rgma活性的物质(例如后述的核酸分子等)也包含在本发明的rgma抑制物质中。
[0099]
rgma被鉴定为中枢神经系统中的神经突生长抑制蛋白质,人rgma蛋白质如序列号1所示,以由450个氨基酸构成的前体蛋白质的形式被生物合成。除去存在于n末端的信号肽met1~pro47(是指从n端侧起第1号蛋氨酸残基到第47号脯氨酸残基的肽,以后同样地记载),切断asp168与pro169之间的肽键,生成n末端结构域,进一步从pro169除去c末侧的片段的c末端肽ala425~cys450,并且在成为c末端的ala424的c末端羧基附加gpi锚定物,生成c末侧结构域。人rgma蛋白质以通过二硫键将上述n末侧结构域(cys48~asp168)与c末侧结构域(pro169~ala424)连接而成的成熟蛋白质的形式经由gpi锚定物在细胞膜上表达。
[0100]
在本发明中,rgma可以来自任一种动物,但优选为人rgma。人的rgma的前体蛋白质由序列表的序列号1所示的氨基酸序列构成。虽然小鼠的rgma的前体蛋白质由序列表的序列号2所示的氨基酸序列构成,大鼠的rgma的前体蛋白质由序列表的序列号3所示的氨基酸序列构成,但由于c末端肽被除去,因此作为成熟蛋白质成为相同的氨基酸序列。
[0101]
作为rgma基因,可举出例如由序列号4所示的碱基序列构成的人rgma基因等,但不限于此。来自各种生物的rgm基因的碱基序列可以从公知的数据库(genbank等)容易地获得。
[0102]
作为本发明的rgma抑制物质,具体而言,可举出低分子化合物、抗rgma中和抗体、其功能改变抗体、其偶联抗体或它们的抗原结合片段等,另外,可举出作为rgma的核酸分子的sirna(short interfering rna)、shrna(short hairpin rna)或反义寡核苷酸等。这些rgma抑制物质中,优选为抗rgma中和抗体、其功能改变抗体、其偶联抗体和它们的抗原结合片段,更优选为抗rgma中和抗体或其抗原结合片段,特别优选为抗rgma中和抗体。
[0103]
<抗rgma中和抗体>
[0104]
在本发明中,抗rgma中和抗体只要是结合于rgma而中和rgma活性的抗体即可,可以为多克隆抗体或单克隆抗体。在本发明中,优选为单克隆抗体。另外,本发明的抗rgma中和抗体可以为rgma单特异性抗体,也可以为识别多种rgma和其它抗原的多特异性抗体,优选为rgma单特异性抗体。
[0105]
另外,作为具体的表位,对于人rgma,优选为序列号16(序列号1的氨基酸序号47-69)、序列号36(序列号1的氨基酸序号298-311)、序列号37(序列号1的氨基酸序号322-335)、序列号38(序列号1的氨基酸序号349-359)、序列号39(序列号1的氨基酸序号367-377)中的1种以上,更优选为序列号36和37的组合,特别优选为序列号36、37和39的组合。
[0106]
本发明的抗rgma中和抗体包含以rgma蛋白质或其部分片段(例如上述的表位片段)作为抗原,并将该抗原对小鼠等哺乳动物进行免疫而得到的多克隆抗体和单克隆抗体,使用基因重组技术制造的嵌合抗体和人源化抗体,以及使用产生人类抗体的转基因动物制造的人类抗体等。在将本发明的抗体作为药物对人类进行给药的情况下,从副作用的观点出发,优选人源化抗体或人类抗体。
[0107]
作为本发明的抗rgma中和抗体,具体而言,可举出下述(a)~(l)的抗体,各自的制造方法可以使用专利文献2-4中记载的方法。
[0108]
可举出选自如下(a)~(l)中的抗体:
[0109]
(a)抗rgma中和抗体(该抗rgma中和抗体还进一步包含以序列号36、37和39为表位的抗体),包含轻链可变区和重链可变区,该轻链可变区包含lcdr1、lcdr2和lcdr3,该lcdr1包含序列号5中记载的氨基酸序列,该lcdr2包含序列号6中记载的氨基酸序列,该lcdr3包含序列号7中记载的氨基酸序列,该重链可变区包含hcdr1、hcdr2和hcdr3,该hcdr1包含序列号8中记载的氨基酸序列,该hcdr2包含序列号9中记载的氨基酸序列,该hcdr3包含序列号10中记载的氨基酸序列,
[0110]
(b)抗rgma中和抗体(该抗rgma中和抗体还进一步包含以序列号36、37和38为表位的抗体),包含轻链可变区和重链可变区,该轻链可变区包含lcdr1、lcdr2和lcdr3,该lcdr1包含序列号11中记载的氨基酸序列,该lcdr2包含序列号12中记载的氨基酸序列,该lcdr3包含序列号13中记载的氨基酸序列,该重链可变区包含hcdr1、hcdr2和hcdr3,该hcdr1包含序列号14中记载的氨基酸序列,该hcdr2包含序列号15中记载的氨基酸序列,该hcdr3在氨基酸序列中包含sfg,
[0111]
(c)抗rgma中和抗体,包含轻链可变区和重链可变区,该轻链可变区包含lcdr1、lcdr2和lcdr3,该lcdr1包含序列号17中记载的氨基酸序列,该lcdr2包含序列号18中记载的氨基酸序列,该lcdr3包含序列号19中记载的氨基酸序列,该重链可变区包含hcdr1、hcdr2和hcdr3,该hcdr1包含序列号20中记载的氨基酸序列,该hcdr2包含序列号21中记载的氨基酸序列,该hcdr3包含序列号22中记载的氨基酸序列,
[0112]
(d)抗rgma中和抗体,包含轻链可变区和重链可变区,该轻链可变区包含lcdr1、lcdr2和lcdr3,该lcdr1包含序列号23中记载的氨基酸序列,该lcdr2包含序列号24中记载的氨基酸序列,该lcdr3包含序列号25中记载的氨基酸序列,该重链可变区包含hcdr1、hcdr2和hcdr3,该hcdr1包含序列号26中记载的氨基酸序列,该hcdr2包含序列号27中记载的氨基酸序列,该hcdr3包含序列号28中记载的氨基酸序列,
[0113]
(e)抗rgma中和抗体(该抗rgma中和抗体还进一步包含以序列号16为表位的抗
体),包含轻链可变区和重链可变区,该轻链可变区包含lcdr1、lcdr2和lcdr3,该lcdr1包含序列号29中记载的氨基酸序列,该lcdr2包含序列号30中记载的氨基酸序列,该lcdr3包含序列号31中记载的氨基酸序列,该重链可变区包含hcdr1、hcdr2和hcdr3,该hcdr1包含序列号32中记载的氨基酸序列,该hcdr2包含序列号33中记载的氨基酸序列,该hcdr3包含序列号34中记载的氨基酸序列,
[0114]
(f)抗rgma中和抗体(该抗rgma中和抗体还进一步包含以序列号16为表位的抗体),包含轻链可变区和重链可变区,该轻链可变区包含lcdr1、lcdr2和lcdr3,该lcdr1包含序列号29中记载的氨基酸序列,该lcdr2包含序列号30中记载的氨基酸序列,该lcdr3包含序列号35中记载的氨基酸序列,该重链可变区包含hcdr1、hcdr2和hcdr3,该hcdr1包含序列号32中记载的氨基酸序列,该hcdr2包含序列号33中记载的氨基酸序列,该hcdr3包含序列号34中记载的氨基酸序列,
[0115]
(g)抗rgma中和抗体(该抗rgma中和抗体还进一步包含以序列号16为表位的抗体),包含轻链可变区和重链可变区,该轻链可变区包含lcdr1、lcdr2和lcdr3,该lcdr1包含序列号29中记载的氨基酸序列,该lcdr2包含序列号30中记载的氨基酸序列,该lcdr3包含序列号40中记载的氨基酸序列,该重链可变区包含hcdr1、hcdr2和hcdr3,该hcdr1包含序列号32中记载的氨基酸序列,该hcdr2包含序列号33中记载的氨基酸序列,该hcdr3包含序列号34中记载的氨基酸序列,
[0116]
(h)抗rgma中和抗体(该抗rgma中和抗体还进一步包含以序列号16为表位的抗体),包含轻链可变区和重链可变区,该轻链可变区包含lcdr1、lcdr2和lcdr3,该lcdr1包含序列号29中记载的氨基酸序列,该lcdr2包含序列号30中记载的氨基酸序列,该lcdr3包含序列号41中记载的氨基酸序列,该重链可变区包含hcdr1、hcdr2和hcdr3,该hcdr1包含序列号32中记载的氨基酸序列,该hcdr2包含序列号33中记载的氨基酸序列,该hcdr3包含序列号34中记载的氨基酸序列,
[0117]
(i)抗rgma中和抗体(该抗rgma中和抗体还进一步包含以序列号16为表位的抗体),包含轻链可变区和重链可变区,该轻链可变区包含lcdr1、lcdr2和lcdr3,该lcdr1包含序列号29中记载的氨基酸序列,该lcdr2包含序列号30中记载的氨基酸序列,该lcdr3包含序列号42中记载的氨基酸序列,该重链可变区包含hcdr1、hcdr2和hcdr3,该hcdr1包含序列号32中记载的氨基酸序列,该hcdr2包含序列号33中记载的氨基酸序列,该hcdr3包含序列号34中记载的氨基酸序列,
[0118]
(j)抗rgma中和抗体(该抗rgma中和抗体还进一步包含以序列号16为表位的抗体),包含轻链可变区和重链可变区,该轻链可变区包含lcdr1、lcdr2和lcdr3,该lcdr1包含序列号29中记载的氨基酸序列,该lcdr2包含序列号30中记载的氨基酸序列,该lcdr3包含序列号43中记载的氨基酸序列,该重链可变区包含hcdr1、hcdr2和hcdr3,该hcdr1包含序列号32中记载的氨基酸序列,该hcdr2包含序列号33中记载的氨基酸序列,该hcdr3包含序列号34中记载的氨基酸序列,
[0119]
(k)抗rgma中和抗体(该抗rgma中和抗体还进一步包含以序列号16为表位的抗体),包含轻链可变区和重链可变区,该轻链可变区包含lcdr1、lcdr2和lcdr3,该lcdr1包含序列号29中记载的氨基酸序列,该lcdr2包含序列号30中记载的氨基酸序列,该lcdr3包含序列号44中记载的氨基酸序列,该重链可变区包含hcdr1、hcdr2和hcdr3,该hcdr1包含序列
号32中记载的氨基酸序列,该hcdr2包含序列号33中记载的氨基酸序列,该hcdr3包含序列号34中记载的氨基酸序列,以及
[0120]
(l)抗rgma中和抗体(该抗rgma中和抗体还进一步包含以序列号16为表位的抗体),包含轻链可变区和重链可变区,该轻链可变区包含lcdr1、lcdr2和lcdr3,该lcdr1包含序列号29中记载的氨基酸序列,该lcdr2包含序列号30中记载的氨基酸序列,该lcdr3包含序列号45中记载的氨基酸序列,该重链可变区包含hcdr1、hcdr2和hcdr3,该hcdr1包含序列号32中记载的氨基酸序列,该hcdr2包含序列号33中记载的氨基酸序列,该hcdr3包含序列号34中记载的氨基酸序列。
[0121]
这些之中,特别优选可举出(a)中记载的抗体。
[0122]
本发明的抗rgma中和抗体的制造方法可以使用现有的一般使用的制造方法。抗原可以直接用于免疫,也可以制成与载体蛋白的复合物而使用。抗原与载体蛋白的复合物的制备可以使用戊二醛、碳二亚胺、马来酰亚胺活性酯等缩合剂。载体蛋白可例示牛血清白蛋白、甲状腺球蛋白、血蓝蛋白、klh等。
[0123]
作为进行免疫的哺乳动物,可举出小鼠、大鼠、仓鼠、豚鼠、兔子、猫、狗、猪、山羊、马或牛等,接种方法可举出皮下给药、肌肉给药或腹腔内给药。在给药时,可以与完全弗氏佐剂、不完全弗氏佐剂混合而给药,给药通常每2~5周各进行1次。由免疫后的动物的脾脏或淋巴结得到的抗体产生细胞与骨髓瘤(myeloma)细胞进行细胞融合,以杂交瘤的形式被分离。作为骨髓瘤细胞,可以使用来自哺乳动物、例如来自小鼠、大鼠、人类等的骨髓瘤细胞。
[0124]
<多克隆抗体>
[0125]
多克隆抗体例如可以通过将如上所述的抗原与根据需要的弗氏佐剂(freund's adjuvant)一起对如上所述的哺乳动物进行免疫,从而从由该免疫敏化动物得到的血清获得。
[0126]
<单克隆抗体>
[0127]
具体而言,单克隆抗体可以按照下述方式获得。即,将如上所述的抗原作为免疫原,将该免疫原与根据需要的弗氏佐剂(freund's adjuvant)一起对如上所述的哺乳动物的皮下、肌肉内、静脉内、足垫内或腹腔内注射1~多次或者进行移植,从而施加免疫敏化。通常,从初次免疫开始每约1~14天进行1~4次免疫,从最终免疫起约1~5天后,从经免疫敏化的该哺乳动物获得抗体产生细胞。
[0128]
单克隆抗体可以使用本领域技术人员周知的方法得到(例如“current protocols in molecular biology”(john wiley&sons(1987))、antibodies:a laboratory manual,ed.harlow and david lane,cold spring harbor laboratory(1988))。
[0129]
分泌单克隆抗体的“杂交瘤”的制备可按照和milstein等人的方法(自然(nature),256,495,1975)和依据其的修饰方法来进行。即,通过使由经免疫敏化的哺乳动物获得的脾脏等中所含的抗体产生细胞与来自哺乳动物、优选小鼠、大鼠或人类的没有自身抗体产生能力的骨髓瘤细胞进行细胞融合来制备。
[0130]
作为细胞融合中使用的骨髓瘤细胞,例如可以使用来自小鼠的骨髓瘤p3/x63-ag8.653(653),p3/nsi/1-ag4-1(ns-1),p3/x63-ag8.u1(p3u1),sp2/0-ag14(sp2/o、sp2)、pai、f0或bw5147、来自大鼠的骨髓瘤210rcy3-ag.2.3.、来自人类的骨髓瘤u-
266ar1、gm1500-6tg-a1-2、uc729-6、cem-agr、d1r11或cem-t15等。
[0131]
作为融合促进剂,可举出聚乙二醇等,通常可以通过使用20~50%左右浓度的聚乙二醇(平均分子量1000~4000)在20~40℃、优选30~37℃的温度下,抗体产生细胞数与骨髓瘤细胞数的比通常为1:1~10:1左右,反应约1~10分钟左右,从而实施细胞融合。
[0132]
产生单克隆抗体的杂交瘤克隆的筛选可以通过将杂交瘤在例如微量滴定板中进行培养,通过elisa等免疫化学的方法测定孔的培养上清液对免疫抗原的反应性而进行。
[0133]
抗体产生杂交瘤细胞的筛选中,除进行与rgma蛋白质的结合分析外,还进行该抗体是否阻碍本发明的rgma活性的评价。通过这些筛选方法,能够选择本发明的抗rgma中和抗体。
[0134]
从包含产生目标抗体的杂交瘤的孔中进一步通过极限稀释法进行克隆,能够得到克隆体。杂交瘤的挑选、育种通常添加hat(次黄嘌呤、氨基蝶呤、胸苷),在包含10~20%牛胎儿血清的动物细胞用培养基中进行。
[0135]
由杂交瘤的单克隆抗体的制造可以通过将杂交瘤在体外培养或者使其在小鼠、大鼠等哺乳动物的腹水中等体内进行增殖,从所得到的培养上清液或哺乳动物的腹水中进行分离而进行。
[0136]
在体外培养的情况下,可以根据进行培养的细胞种类的特性和培养方法等的各种条件,使杂交瘤增殖、维持和保存,使用适于在培养上清液中产生单克隆抗体的营养培养基。营养培养基可举出公知的营养培养基或由基本培养基制备的营养培养基等。
[0137]
作为基本培养基,例如可举出ham’f12培养基、mcdb153培养基或者低钙mem培养基等低钙培养基以及mcdb104培养基、mem培养基、d-mem培养基、rpmi1640培养基、asf104培养基或rd培养基等高钙培养基等,该基本培养基可以根据目的含有例如血清、激素、细胞因子和/或各种无机或有机物质等。
[0138]
单克隆抗体的分离、纯化可以通过将上述的培养上清液或腹水供给到饱和硫酸铵、优球蛋白沉淀法、己酸法、辛酸法、离子交换色谱法(deae或de52等)、抗免疫球蛋白柱或蛋白质a柱等亲和柱色谱等而进行。具体而言,单克隆抗体的纯化只要使用已知的方法作为免疫球蛋白的纯化法即可,例如,可以通过硫酸铵分级法、peg分级法、乙醇分级法、利用阴离子交换体、进一步使用rgma蛋白质的亲和色谱等手段而容易地实现。
[0139]
单克隆抗体也可以通过噬菌体展示法而获得。在噬菌体展示法中,使用目标免疫原对从任意的噬菌体抗体库所挑选的噬菌体进行筛选,选择对免疫原具有期望的结合性的噬菌体。接下来,对噬菌体中所含的抗体对应序列进行分离或序列决定,基于所分离的序列或所决定的序列信息来构建包含编码抗体或抗原结合结构域的核酸分子的表达载体。然后,通过培养该表达载体经转染的细胞株,能够产生单克隆抗体。通过使用人类抗体库作为噬菌体抗体库,能够生成具有期望的结合性的人类抗体。
[0140]
<核酸分子>
[0141]
编码本发明的抗rgma中和抗体或其抗原结合片段的核酸分子例如可以通过以下的方法而得到。首先,使用市售的rna提取试剂盒,由杂交瘤等的细胞制备全rna,使用随机引物等,通过逆转录酶合成cdna。接下来,在已知的人类抗体重链基因、轻链基因的可变区中,通过将分别保存的序列的寡核苷酸用于引物的pcr法使编码抗体的cdna扩增。对于编码恒定区的序列,可以通过使用pcr法将已知的序列进行扩增而得到。dna的碱基序列可以通
过编入到序列决定用质粒中等并通过常规方法来决定。
[0142]
或者,通过化学合成可变区或其部分序列并与包含恒定区的序列结合,从而也能够得到编码本发明的单克隆抗体的dna。
[0143]
该核酸分子可以为编码所有重链和轻链的恒定区和可变区的核酸分子,也可以为仅编码重链和轻链的可变区的核酸分子。编码所有恒定区和可变区时的重链和轻链的恒定区的碱基序列优选为nucleic acids research vol.14,p1779,1986、the journal of biological chemistry vol.257,p1516,1982和cell vol.22,p197,1980中记载的碱基序列。
[0144]
<功能改变抗体>
[0145]
抗rgma中和抗体的功能改变抗体可以通过如下所述的方法来制备。例如,如果使用破坏α1,6-岩藻糖转移酶(fut8)基因的cho细胞作为宿主细胞来制造本技术的抗rgma中和抗体,则可得到糖链的岩藻糖含量降低而提高细胞杀伤功能的抗体,如果将导入有fut8基因的cho细胞作为宿主细胞来制造,则可得到低细胞杀伤功能的抗体(国际公开第2005/035586号、国际公开第2002/31140号、国际公开第00/61739号)。另外,通过改变fc区的氨基酸残基,从而能够调节补体活化功能(美国专利第6737056号、美国专利第7297775号、美国专利第7317091号)。进而,通过使用提高了对作为fc受体的1种的fcrn的结合的fc区域的变异体,能够实现血中半衰期的延长(桥口周平等,生物化学,2010、vol.82(8),p710)。这些功能改变抗体可以采用基因工程来制造。通过使用提高了与作为fc受体之一的fcrn的结合的fc区域的变异体,能够实现血中半衰期的延长(桥口周平等,生物化学,2010、vol.82(8),p710)。这些功能改变抗体可以采用基因工程来制造。
[0146]
<偶联抗体>
[0147]
作为本发明的抗rgma中和抗体的改变分子,可举出偶联抗体。作为偶联抗体,可举出以化学或基因工程方式在抗rgma中和抗体结合聚乙二醇(peg)等非肽性聚合物、放射性物质、毒素、低分子化合物、细胞因子、生长因子(tgf-β、ngf、神经营养蛋白等)、白蛋白、酶、其它抗体等本技术的抗rgma中和抗体以外的功能分子而成的偶联抗体。
[0148]
在结合peg作为功能分子的情况下,peg可以非限定地使用分子量2000至100000da、更优选10000至50000da的peg,可以为直链型,也可以为分支型。peg例如通过使用nhs活性基团而能够结合于抗rgma中和抗体的氨基酸的n末端氨基等。
[0149]
在使用放射性物质作为功能分子的情况下,可使用
131
i、
125
i、
90
y、
64
cu、
99
tc、
77
lu或
211
at等。放射性物质能够通过氯胺t法等而直接结合于抗rgma中和抗体。
[0150]
在使用毒素作为功能分子的情况下,可以使用细菌毒素(例如白喉毒素)、植物毒素(例如蓖麻毒蛋白)、低分子毒素(例如格尔达霉素)、美登素和卡奇霉素等。
[0151]
在使用低分子化合物作为功能分子的情况下,可举出道诺霉素、阿霉素、甲氨蝶呤、丝裂霉素、新抑癌素、长春地辛和fitc等荧光色素等。
[0152]
在使用酶作为功能分子的情况下,可以使用荧光素酶(例如萤火虫荧光素酶和细菌荧光素酶;美国专利第4737456号)、苹果酸脱氢酶、脲酶、过氧化物酶(例如,辣根过氧化物酶(hrpo))、碱性磷酸酶、β-半乳糖苷酶、葡糖淀粉酶、溶菌酶、糖氧化酶(例如葡萄糖氧化酶、半乳糖氧化酶和葡萄糖-6-磷酸脱氢酶)、杂环式氧化酶(例如尿酸酶和黄嘌呤氧化酶等)、乳过氧化物酶、微过氧化物酶等。
[0153]
作为将毒素、低分子化合物或酶化学结合时使用的连接子,可举出二价自由基(例如亚烷基、亚芳基、杂亚芳基)、-(cr2)no(cr2)n-(r为任意的取代基、n为正整数)表示的连接子、烷氧基的重复单元(例如聚亚乙基氧基、peg、聚亚甲基氧基等)和烷基氨基(例如聚亚乙基氨基、jeffamine(商标))、以及二酸酯和酰胺(可举出琥珀酸酯、琥珀酰胺、二甘醇酸酯、丙二酸酯和己酰胺等)。使功能分子结合的化学修饰方法已经在该领域中建立(d.j.king.,applications and engineering of monoclonal antibodies.,1998t.j.international ltd,monoclonal antibody-based therapy of cancer.,1998marcel dekker inc;chari et al.,cancer res.,1992vol152:127;liu et al.,proc natl acad sci usa.,1996vol 93:8681)。
[0154]
<抗原结合片段>
[0155]
在本发明的实施方式中,抗体的“抗原结合片段”是指如上所述的抗体的具有抗原结合性的一部分区域,具体而言,可举出f(ab')2、fab'、fab、fv(variable fragment of antibody)、二硫键fv、单链抗体(scfv)以及它们的聚合物等,进而,抗原结合片段包含以化学或基因工程方式结合了聚乙二醇(peg)等非肽性聚合物、放射性物质、毒素、低分子化合物、细胞因子、生长因子(tgf-β、ngf、神经营养蛋白等)、白蛋白、酶、其它抗体等本技术的抗rgma中和抗体以外的功能分子的偶联片段。
[0156]“f(ab')
2”和“fab'”是指通过利用作为蛋白分解酶的胃蛋白酶或木瓜蛋白酶等对免疫球蛋白进行处理而制造,且在存在于铰链区中的2条重链间的二硫键前后被消化而生成的抗体片段。例如,如果利用木瓜蛋白酶对igg进行处理,则在存在于铰链区中的2条重链间的二硫键的上游被切断,能够制造由vl(轻链可变区)和cl(轻链恒定区)构成的轻链以及由vh(重链可变区)和chγ1(重链恒定区中的γ1区域)构成的重链片段在c末端区域通过二硫键而结合的相同的2个抗体片段。将这2个相同的抗体片段分别称为fab。另外,如果利用胃蛋白酶对igg进行处理,则在存在于铰链区中的2条重链间的二硫键的下游被切断,能够制造比上述2个fab在铰链区连接的抗体片段稍大的抗体片段。将该抗体片段称为f(ab')2。
[0157]
<嵌合抗体>
[0158]
作为本发明的抗rgma中和抗体的优选的方式,可举出嵌合抗体。作为“嵌合抗体”,可例示可变区为来自非人类动物(小鼠、大鼠、仓鼠、鸡等)的免疫球蛋白的可变区、恒定区为来自人免疫球蛋白的恒定区的嵌合抗体。例如,可以将抗原对小鼠进行免疫,从该小鼠单克隆抗体的基因中切出与抗原结合的可变区,与来自人骨髓的抗体恒定区结合而制作。来自人免疫球蛋白的恒定区根据igg(igg1、igg2、igg3、igg4)、igm、iga(iga1、iga2)、igd和ige等同型而各自具有固有的氨基酸序列,本发明中的重组嵌合抗体的恒定区可以为属于任一同型的人免疫球蛋白的恒定区。优选为人igg的恒定区。可以使用如此制作的嵌合抗体的基因来制作表达载体。利用该表达载体将宿主细胞进行转化,从而得到嵌合抗体产生转化细胞,通过对该转化细胞进行培养,从而从培养上清液中得到目标嵌合化抗体。
[0159]
<人源化抗体>
[0160]
作为本发明的抗rgma中和抗体的其它优选的方式,可举出人源化抗体。本发明中的“人源化抗体”是仅将小鼠等非人类动物抗体的抗原结合位点(cdr、互补决定区)的dna序列移植(cdr grafting)到人类抗体基因而成的抗体。例如,可以参照日本特表平4-506458号公报和日本专利2912618号说明书等中记载的方法来制作。具体而言,是指一种人源化抗
体,其特征在于,其cdr的一部分或全部为来自非人类哺乳动物(小鼠、大鼠、仓鼠等)的单克隆抗体的cdr,其可变区的构架区为来自人免疫球蛋白的可变区的构架区,且其恒定区为来自人免疫球蛋白的恒定区。
[0161]
本发明中的人源化抗体例如可以按照以下方式来制造。然而,当然并不限定于这样的制造方法。
[0162]
例如,来自小鼠单克隆抗体的重组人源化抗体可以参照日本特表平4-506458号公报和日本特开昭62-296890号公报等,以基因工程方式来制作。即,从产生小鼠单克隆抗体的杂交瘤分离小鼠重链cdr部分的dna和小鼠轻链cdr部分的dna,从人免疫球蛋白基因分离除人重链cdr以外的全部区域的人重链基因和除人轻链cdr以外的全部区域的人轻链基因。
[0163]
将移植了分离出的小鼠重链cdr部分的dna的人重链基因以能够表达的方式导入到适当的表达载体中,同样地将移植了小鼠轻链cdr部分的dna的人轻链基因以能够表达的方式导入到适当的另1个表达载体中。或者也可以将移植了小鼠的cdr的人的重链和轻链基因以能够表达的方式导入到同一表达载体中。利用如此制作的表达载体将宿主细胞进行转化,从而得到人源化抗体产生转化细胞,通过对该转化细胞进行培养而从培养上清液中得到目标人源化抗体。
[0164]
<人类抗体>
[0165]
作为本发明的抗rgma中和抗体的其它优选的方式,可举出人类抗体。人类抗体是包含构成免疫球蛋白的重链的可变区和重链的恒定区以及轻链的可变区和轻链的恒定区的全部区域为来自编码人免疫球蛋白的基因的免疫球蛋白的抗体,可以将人类抗体基因导入到小鼠中来制作。具体而言,例如可以至少将人免疫球蛋白基因编入到小鼠等人类以外的哺乳动物的基因座中而制作转基因动物,并利用抗原对该转基因动物进行免疫敏化,从而与上述多克隆抗体或单克隆抗体的制作方法同样地制造。
[0166]
例如,产生人类抗体的转基因小鼠可以按照nature genetics,vol.7,p.13-21,1994;nature genetics,vol.15,p.146-156,1997;日本特表平4-504365号公报;日本特表平7-509137号公报;国际公开wo94/25585号公报;nature,vol.368,p.856-859,1994;以及日本特表平6-500233号公报等中记载的方法来制作。更具体而言,可举出humab(注册商标)小鼠(medarex,princeton nj)、kmtm小鼠(kirin pharma company,japan)、km(fcγriib-ko)小鼠等。
[0167]
作为本发明的抗rgma中和抗体,具体而言,可举出在重链可变区具有包含特定的氨基酸序列的cdr且在轻链可变区具有包含特定的氨基酸序列的cdr的抗rgma中和抗体(优选为上述(a)~(l)的抗rgma中和抗体)。
[0168]
应予说明,只要具有与rgma的结合能力且可维持抑制(中和)rgma的活性这样的本发明的抗体的特性,则在抗rgma中和抗体(优选为上述(a)~(l)的抗rgma中和抗体)的氨基酸序列中也可以取代、缺失、附加或插入1或多个氨基酸(1~20个、1~10个或1~5个,优选1~2个)。这样的取代、缺失、附加可以导入于cdr,但优选导入于cdr以外的区域。另外,为了维持本发明的特性,该氨基酸取代优选为保守取代。
[0169]
在氨基酸序列中包含取代、缺失等的本发明的抗rgma中和抗体(优选为上述(a)~(l)的抗rgma中和抗体)的氨基酸序列例如为如下氨基酸序列:氨基酸序列改变后的重链可
变区与改变前的氨基酸序列具有90%以上(更优选为95%、96%、97%、98%、99%以上)的%同源性,且氨基酸序列改变后的轻链可变区与改变前的氨基酸序列具有90%以上(更优选为95%、96%、97%、98%、99%以上)的%同源性。
[0170]
在本发明中,sirna是指能够抑制靶基因(在本发明中为rgma基因)的表达的短的双链rna。只要作为抑制本发明的rgma活性的sirna发挥作用,则碱基序列、长度(碱基长度)没有特别限定,优选小于约30个碱基,更优选为约19~27个碱基,进一步优选为约21~25个碱基。
[0171]
在本发明中,shrna是指通过在单链rna中部分包含廻文状的碱基序列而在分子内形成双链结构,由在3'末端具有突出部的短的发夹结构(hairbin)构成的约20个碱基对以上的分子。这样的shrna在导入到细胞内后,在细胞内分解成约20个碱基(代表性为例如21个碱基、22个碱基、23个碱基)的长度,能够与sirna同样地抑制靶基因的表达。
[0172]
在本发明中,上述sirna和shrna只要能够抑制rgma基因的表达,则可以为任何形态。
[0173]
在本发明中,sirna或shrna可以人工进行化学合成。另外,例如可以使用t7rna聚合酶和t7启动子,由模板dna在体外合成反义和正义的rna。反义寡核苷酸只要是与rgma基因的dna序列中连续的5至100个碱基序列互补或杂交的核苷酸即可,可以为dna或rna中的任一者。另外,只要不影响功能,则也可以进行修饰。反义寡核苷酸可以按照常规方法进行合成,例如,可以利用市售的dna合成装置而容易地合成。
[0174]
优选的序列可以使用通常的选择方法来选择,作为本发明中的sirna或shrna,可以通过评价功能性rgma的表达抑制来确认。
[0175]
<糖尿病性痴呆症>
[0176]
本发明中的糖尿病性痴呆症是指由糖代谢异常引起的痴呆症,典型而言,可举出伴随糖尿病的痴呆症。作为其发病机理,推测除了脑梗塞、动脉硬化等血管因素以外,还与糖毒性、氧化应激、age(糖化终产物,advanced glycation end-product)等所致的老化变化的促进、以及高胰岛素血症、胰岛素抵抗、胰岛素信号转导的障碍有关(lancet neurol,5:64-74,2006)。糖尿病性痴呆症在临床上显示或暗示与糖代谢异常密切相关,与此相对,没有确认到阿尔茨海默症的病理变化、血管性病变,或者为更轻微的痴呆症。另外,这样的糖尿病性痴呆症还包括由糖代谢障碍(包含高血糖等)所致的神经障碍参与的痴呆症。本发明中的糖尿病性痴呆症还包含达不到痴呆症的轻度的认知功能障碍、即糖尿病性认知功能障碍。
[0177]
<血管性痴呆症>
[0178]
本发明中的血管性痴呆症是指由脑血管病引起的痴呆症,脑血管病与痴呆症之间存在因果关系。作为血管性痴呆症的原因,除了脑梗塞、脑出血、蛛网膜下腔出血以外,还包括脑循环功能不全、低灌注、白质病变等病型。本发明中的血管性痴呆症还包括达不到痴呆症的轻度的认知功能障碍即血管性认知功能障碍。另外,也可以依据与血管性痴呆症有关的诊断标准来确定本发明的血管性痴呆症(非专利文献8)。
[0179]
本发明中的治疗对象(优选哺乳动物、特别是人)以患有糖尿病性痴呆症或血管性痴呆症的患者为对象,可以将本发明的选自糖尿病性痴呆症和血管性痴呆症中的痴呆症的预防或治疗剂给予这些患者。
[0180]
这里,“治疗”是包含对治疗对象、优选为哺乳动物、特别是人类的疾病的任意的治疗,包含阻止疾病和症状的恶化,并消除、治愈、减轻或缓和这样的疾病和症状。
[0181]
另外,“预防”是包含对治疗对象、优选为哺乳动物、特别是人类防止或抑制上述疾病的发病。进而,本发明中的“预防”是包含对治疗对象、优选为哺乳动物、特别是人类缓解或防止反复复发的上述疾病的复发的“预防复发”。
[0182]
<药物组合物>
[0183]
本发明中的选自糖尿病性痴呆症和血管性痴呆症中的痴呆症的预防或治疗剂通常是全身或局部地以口服或非口服的形式给药。
[0184]
本发明中的选自糖尿病性痴呆症和血管性痴呆症中的痴呆症的预防或治疗剂以rgma抑制物质为有效成分,可以适当地配合药学上允许的载体或添加剂而制剂化。如此制剂化的药物组合物能够以口服或非口服的形式给药。具体而言,可以制成片剂、包衣片剂、丸剂、散剂、颗粒剂、胶囊剂、液剂、悬浮剂、乳剂等口服剂,另外,可以制成注射剂、输液、栓剂、软膏、贴剂等非口服剂。对于载体或添加剂的配合比例,只要基于医药品领域中通常采用的范围适当地设定即可。可以配合的载体或添加剂没有特别限定,可举出例如水、生理盐水、其它水性溶剂、水性或油性基剂等各种载体、例如赋形剂、粘合剂、ph调节剂、崩解剂、吸收促进剂、润滑剂、着色剂、矫味剂、香料等各种添加剂。
[0185]
在rgma抑制物质为抗rgma中和抗体、其功能改变抗体、其偶联抗体或它们的抗原结合片段的情况下,优选作为与药学上允许的载体一起制剂化的注射剂或输液以非口服给药途径、例如静脉内、肌肉内、皮肤内、腹腔内、皮下或局部进行给药。
[0186]
例如,包含抗rgma中和抗体的注射剂或输液剂可以作为溶液、悬浮液或乳浊液来使用。作为其溶剂,可以使用例如注射用蒸馏水、生理盐水、葡萄糖溶液和等渗溶液(例如氯化钠、氯化钾、甘油、甘露醇、山梨糖醇、硼酸、硼砂、丙二醇等的溶液)等。
[0187]
进而,包含这样的抗rgma中和抗体的注射剂或输液还可以包含稳定剂、助溶剂、悬浮剂、乳化剂、舒缓剂、缓冲剂、保存剂、防腐剂、ph调节剂等。
[0188]
作为稳定剂,可以使用例如白蛋白、球蛋白、明胶、甘露醇、葡萄糖、葡聚糖、乙二醇、丙二醇、抗坏血酸、亚硫酸氢钠、硫代硫酸钠、edta钠、柠檬酸钠、二丁基羟基甲苯等。
[0189]
作为助溶剂,可以使用例如醇(例如乙醇等)、多元醇(例如丙二醇、聚乙二醇等)、非离子性表面活性剂(例如polysolvate80(注册商标)、hco-50等)等。
[0190]
作为悬浮剂,可以使用例如单硬脂酸甘油酯、单硬脂酸铝、甲基纤维素、羧甲基纤维素、羟甲基纤维素、月桂基硫酸钠等。
[0191]
作为乳化剂,可以使用例如阿拉伯胶、海藻酸钠、黄蓍胶等。
[0192]
作为舒缓剂,可以使用例如苄醇、氯丁醇、山梨糖醇等。
[0193]
作为缓冲剂,可以使用例如磷酸缓冲液、乙酸缓冲液、硼酸缓冲液、碳酸缓冲液、柠檬酸缓冲液、tris缓冲液等。
[0194]
作为保存剂,可以使用例如对羟基苯甲酸甲酯、对羟基苯甲酸乙酯、对羟基苯甲酸丙酯、对羟基苯甲酸丁酯、氯丁醇、苄醇、苯扎氯铵、脱氢乙酸钠、依地酸钠、硼酸、硼砂等。
[0195]
作为防腐剂,可以使用例如苯扎氯铵、对羟基苯甲酸、氯丁醇等。
[0196]
作为ph调节剂,可以使用例如盐酸、氢氧化钠、磷酸、乙酸等。
[0197]
在rgma抑制物质为核酸(sirna、shrna、反义寡核苷酸等)的情况下,可以以非病毒
载体或病毒载体的形式进行给药。在非病毒载体形式的情况下,可以利用使用脂质体导入核酸分子的方法(脂质体法、hvj-脂质体法、阳离子脂质体法、脂质体转染法、脂转染胺(lipofectamine)法等)、微注射法、用基因枪(gene gun)将核酸分子与载体(金属颗粒)一起移入到细胞中的方法等。例如,在使用病毒载体将sirna或shrna对生物体进行给药的情况下,可以利用重组腺病毒、逆转录病毒等病毒载体。通过对经无毒化的逆转录病毒、腺病毒、腺伴随病毒、疱疹病毒、牛痘病毒、痘病毒、脊髓灰质炎病毒、辛德比斯病毒、仙台病毒、sv40等dna病毒或rna病毒导入表达sirna或shrna的dna,使细胞或组织感染该重组病毒,从而能够将基因导入到细胞或组织内。
[0198]
由此得到的制剂可以通过例如对人、其它哺乳动物(例如大鼠、小鼠、兔子、绵羊、猪、牛、猫、狗、猴子等)给予其有效量来预防或治疗选自糖尿病性痴呆症和血管性痴呆症中的痴呆症。给药量可考虑目的、疾病的严重程度、患者的年龄、体重、性别、病史、有效成分的种类等而适当地设定。例如,在有效成分为抗rgma中和抗体的情况下,将平均具有约65~70kg体重的人类作为对象时,优选每1天0.02mg~4000mg左右,更优选0.1mg~200mg左右。每1天的总给药量可以为单一给药量,也可以为分割给药量。
[0199]
<与其它药剂或治疗的并用>
[0200]
本发明中,选自糖尿病性痴呆症和血管性痴呆症中的痴呆症的预防或治疗剂可以以与抗糖尿病药并用的方式进行给药。作为并用的抗糖尿病药的治疗剂,例如,可举出胰岛素抵抗性改善药等。
[0201]
本发明中,选自糖尿病性痴呆症和血管性痴呆症中的痴呆症的预防或治疗剂可以以抗血栓疗法、与降压剂并用的方式进行给药。作为并用的降压剂,例如,可举出血管紧张素ii受体拮抗剂(坎地沙坦等)、ace抑制剂(培哚普利等)等。
[0202]
上述其它药剂或治疗可以在本发明的选自糖尿病性痴呆症和血管性痴呆症中的痴呆症的预防或治疗剂的给药前或给药后进行给药或实施,另外,也可以同时给药或实施。
[0203]
实施例
[0204]
以下,举出实施例对本发明进行更具体的说明,但本发明并不限定于这些实施例。
[0205]
应予说明,作为抗rgma中和抗体,在各实施例中使用包含本说明书中记载的(a)的氨基酸序列(序列号5~10)的抗rgma中和抗体。
[0206]
[实施例1]
[0207]
使用药剂诱导性1型糖尿病模型小鼠,通过新奇物体识别试验来研究抗rgma中和抗体对认知功能障碍的治疗效果。
[0208]
<糖尿病的引导>
[0209]
将7~8周龄的c57bl/6j雌性小鼠用于实验。对于糖尿病诱导组,以10ml/kg的用量单次腹腔内给予链脲佐菌素(stz:sigma-aldrich co.llc,st.louis,mo,usa)20mg/ml,对于非糖尿病诱导组,以10ml/kg的用量给予溶剂。以现有研究为参考(参考文献1、2),从糖尿病诱导起1周后进行血糖值测定,将血糖值低于300mg/dl的个体排除。
[0210]
<分组、抗体给药时间表>
[0211]
将购入的小鼠分成“糖尿病-抗rgma中和抗体给药组”或“糖尿病-同型对照抗体(帕利珠单抗(palivizumab))给药组”这2组,两组均从糖尿病诱导3天后开始给予抗体。任一抗体均调整为6mg/ml的浓度后,以30mg/kg的用量每周1次合计进行4次尾静脉给药。物体
识别试验中“糖尿病-抗rgma中和抗体给药组”使用14只,“糖尿病-同型对照抗体(palivizumab)给药组”使用15只。将满足物体识别试验的基准的“糖尿病-抗rgma中和抗体给药组”10只、“糖尿病-同型对照抗体(palivizumab)给药组”8只用于解析。另外,非糖尿病小鼠(健康小鼠)的di值的算出使用7只。
[0212]
<新奇物体识别记忆试验>
[0213]
熟悉(管理(handling))3天,次日,将各个体放入开放场地,使其自由探索15分钟而进行对场地的驯化(熟悉试验1)。次日起进行获得试验。在获得试验之前对各个体实施5分钟的场地自由探索(熟悉试验2)。实施熟悉试验2后,暂时使各个体返回到居住笼,将使用方块制作的具有相同形状的物体(物体a)设置于场地的对角线上左上和右下这2个位置后,使各个体返回到场地进行自由探索(获得试验)。获得试验结束后,隔开12小时的间隔(通过预先的条件研究来决定)而实施测试试验。测试试验时,配置作为新奇物体的装入不透明珠子的瓶子(物体b)代替配置于场地的对角线上右下的物体a。另一方面,场地对角线上左上的物体a与获得试验同样地配置。测试试验中,使各个体返回到配置有上述物体a和b的场地,自由探索10分钟。应予说明,物体a和物体b基于现有研究制作(参考文献3)。所有试验都用摄像机进行录像,行动试验结束后分别算出各试验中的各个体对两物体的探索时间。探索行动包括对各物体闻气味的行动和触摸物体的行动,攀登物体的行动除外。解析以现有研究为参考而算出,使用测试试验中的鉴别指数(di)(参考文献4)。di定义为{(对物体b的探索时间)-(对物体a的探索时间)}/{(对物体b的探索时间) (对物体a的探索时间)}。解析中不使用测试试验中的对物体a和b的探索时间的合计不足30秒的个体。应予说明,作为基准的健康小鼠的di在16周龄非糖尿病小鼠中实施本行动试验来算出。
[0214]
<结果>
[0215]
将糖尿病病状发病后经过4周的时刻的抗rgma中和抗体给药组、同型对照抗体给药组分别获得的di值、以及健康小鼠的di值示于图1。“糖尿病-同型对照抗体给药组”与健康小鼠相比,可见显著的di的降低(p《0.05,tukey’s multiple comparisons test)。另一方面,“糖尿病-抗rgma中和抗体给药组”与“糖尿病-同型对照抗体给药组”相比,可见显著的di值的上升(p《0.05,tukey’s multiple comparisons test),与健康小鼠的比较中看不到差异(p=0.8640,tukey’s multiple comparisons test)。根据其结果可知,通过给予抗rgma中和抗体,能够改善因糖尿病而发生障碍的物体记忆障碍。
[0216]
根据以上的结果表明,rgma抑制物质、特别是抗rgma中和抗体对糖尿病性痴呆症显示药效。
[0217]
[实施例2]
[0218]
作为糖尿病的动物模型中的海马依赖性的认知功能障碍的原因,指出了海马中的神经新生障碍(参考文献6)。使用药剂诱导性1型糖尿病模型小鼠,利用免疫组织化学染色法来研究抗rgma中和抗体对由糖尿病引起的海马齿状回神经新生的抑制的治疗效果。
[0219]
<糖尿病的诱导>
[0220]
实验使用7~8周龄的c57bl/6j雌性小鼠。对于糖尿病诱导组,以10ml/kg的用量单次腹腔内给予链脲佐菌素(stz:sigma-aldrich co.llc,st.louis,mo,usa)20mg/ml,对于非糖尿病诱导组,以10ml/kg的用量给予溶剂。以现有研究为参考(参考文献1,2),从糖尿病诱导起1周后进行血糖值测定,将血糖值不足300mg/dl的个体排除。
[0221]
<抗体给药>
[0222]
将购入的小鼠分成“非糖尿病-抗rgma中和抗体给药组”、“非糖尿病-同型对照抗体(帕利珠单抗(palivizumab))给药组”、“糖尿病-抗rgma中和抗体给药组”和“糖尿病-同型对照抗体(帕利珠单抗(palivizumab))给药组”这4组,糖尿病组给予stz溶液,非糖尿病诱导组给予溶剂,从3天后开始给予抗rgma中和抗体或同型对照抗体。任一抗体均调整为6mg/ml的浓度后,以30mg/kg的用量每周1次合计进行6次尾静脉给药。
[0223]
<组织采样和免疫组织化学染色>
[0224]
在糖尿病诱导6周后实施小鼠脑的采样。充分麻醉后,利用4%多聚甲醛(pfa)进行灌注固定后摘除脑,在4%pfa中进行后固定。接着,将组织转移到以pbs为溶剂的30%蔗糖溶液中,在4℃静置2天~3天后使用oct compound(sakura finetek usa inc.,torrance,ca,usa)进行包埋。使用低温恒温器将脑以厚度30μm进行薄切,将所制作的切片贴附于mas涂层载玻片,供于免疫染色。利用包含3%正常驴血清(nds)、0.3%triton x-100的pbs(封闭溶液)在常温下封闭1小时,进行pbs清洗后,使用抗小鼠双皮质素(doublecortin)抗体(1:100;abcam,cambridge,uk,用封闭液稀释)作为一次抗体在4℃反应过夜。用pbst清洗后,使用alexa fluor 568驴抗兔igg(h l)抗体(1:500;invitrogen,waltham,ma,usa,用封闭液稀释)作为二次抗体在室温下反应1小时。用pbst清洗后,使用dapi(1μg/ml)进行核染色后封入。使用共聚焦激光显微镜fv3000(olympus,tokyo,japan)对整个海马齿状回进行拍摄,测量双皮质素(doublecortin)阳性神经前体细胞的细胞体数。对各个体各6个切片进行海马齿状回的测量。双皮质素(doublecortin)阳性细胞数以使用imagej测定的海马齿状回的面积进行标准化。
[0225]
<结果>
[0226]
将以海马齿状回面积标准化的双皮质素(doublecortin)阳性细胞数示于图2。非糖尿病诱导组间,无论所给予的抗体的种类,双皮质素(doublecortin)阳性细胞数均没有变化(p》0.9999,tukey’s multiple comparisons test)。另外,“糖尿病-同型对照抗体给药组”与“非糖尿病-抗rgma中和抗体给药组”和“非糖尿病-同型对照抗体给药组”相比,双皮质素(doublecortin)阳性细胞数显著减少(vs“非糖尿病-同型对照抗体给药组”;p《0.001,tukey’s multiple comparisons test,vs“非糖尿病-抗rgma中和抗体给药组”;p《0.001,tukey’s multiple comparisons test)。另一方面,“糖尿病-抗rgma中和抗体给药组”与“糖尿病-同型对照抗体给药组”相比,双皮质素(doublecortin)阳性细胞数显著改善(p《0.05,tukey’s multiple comparisons test)。“糖尿病-抗rgma中和抗体给药组”与“非糖尿病-同型对照抗体给药组”和“非糖尿病-抗rgma中和抗体给药组”相比,双皮质素(doublecortin)阳性细胞数看不到显著差异(vs非糖尿病-同型对照抗体给药组;p=0.1071,tukey’s multiple comparisons test,vs非糖尿病-抗rgma中和抗体给药组;p=0.1130,tukey’s multiple comparisons test)。根据这些结果可知:通过给予抗rgma中和抗体,能够改善由糖尿病引起的海马齿状回中的双皮质素(doublecortin)阳性神经前体细胞所致的神经新生的减少。
[0227]
根据以上的结果表明,rgma抑制物质、特别是抗rgma中和抗体对作为糖尿病性痴呆症的原因之一的海马中的神经新生的障碍显示药效。
[0228]
[实施例3]由使用抗rgma中和抗体的治疗介入带来的对新奇物体识别记忆的影响
[0229]
通过新奇物体识别试验来研究抗rgma中和抗体对由双侧颈内动脉微线圈留置诱导的慢性脑低灌注模型小鼠(bilateral common carotid artery stenosis model:bcas model)的认知功能障碍的治疗效果。
[0230]
<慢性脑低灌注模型的诱导>
[0231]
实验使用9周龄~10周龄的c57bl/6j雄性小鼠。在异氟烷吸入麻酔(导入4%,保持1.5%)下,将小鼠以俯卧位固定,用激光散斑血流仪(laser speckle flowmetry)来测量脑血流。测量中使用热垫将直肠温度管理在35.0~36.5℃。然后,将以仰卧位固定,将颈部切开,将颈动脉鞘打开后,在双侧颈内动脉留置微线圈(参考文献5)。从bcas诱导起1天后进行脑血流测定,将脑血流与手术前相比未降低至90%以下的个体排除。脑血流的测定使用oz-3(omegawave,tokyo,japan)。
[0232]
<新奇物体识别记忆试验>
[0233]
将各个体放入开放场地,使其自由探索15分钟而进行对场地的驯化(熟悉试验1)。次日,在获得试验之前对各个体实施5分钟的场地自由探索(熟悉试验2)。实施熟悉试验2后,暂时使各个体返回到居住笼,在场地的对角线上左上和右下这2个位置使用双面胶在离壁10cm的距离设置使用方块制作的具有相同形状的物体(物体a)后,使各个体返回到场进行自由探索(获得试验)。获得试验结束后,隔开12小时的间隔,实施测试试验。测试试验中将作为新奇物体的装入不透明珠子的瓶子(物体b)代替配置于场地的对角线上右下的物体a使用双面胶配置于离壁10cm的位置。另一方面,场地对角线上左上的物体a与获得试验同样地配置。经过间隔后,使各个体返回到配置有上述物体a和b的场地,自由探索10分钟(测试试验)。各试验使用的物体a和物体b根据现有研究而制作(参考文献3)。间隔期间,各个体在居住笼中均自由摄取水、饵料。将全部试验用摄像机进行录像,行动试验结束后算出各试验中的各个体对物体的探索时间。探索行动包括对各物体闻气味的行动和触摸物体的行动,攀登物体的行动除外。解析使用测试试验中的鉴别指数(di)。di定义为{(对物体b的探索时间)-(对物体a的探索时间)}/{(对物体b的探索时间) (对物体a的探索时间)}。解析中不使用测试试验中的对物体a和b的探索时间的合计不足30秒的个体。
[0234]
<抗体给予>
[0235]
将购入的小鼠分为bcas-抗rgma中和抗体给药组、bcas-同型对照抗体(帕利珠单抗(palivizumab))给药组、sham-同型对照抗体(帕利珠单抗(palivizumab))给药组这3组,3组均从bcas手术或sham手术3天后起开始给予抗体。任一抗体均调整为2mg/ml的浓度后,体重依赖性地以10mg/kg的用量每周2次合计进行7次腹腔给药。各群的只数如下。
[0236]
bcas-抗rgma中和抗体给药组13只
[0237]
bcas-同型对照抗体(帕利珠单抗(palivizumab))给药组9只
[0238]
sham-同型对照抗体(帕利珠单抗(palivizumab))给药组9只
[0239]
<结果>
[0240]
bcas-同型对照抗体组与sham-同型对照抗体(帕利珠单抗(palivizumab))给药组相比,可见显著的di的降低(p《0.001,tukey’s multiple comparisons test)。另一方面,bcas-抗rgma中和抗体给药组与bcas-同型对照抗体组相比,di显著上升(p《0.001,tukey’s multiple comparisons test)。由此可知,基于给予抗rgma中和抗体的治疗介入显著地改善了因慢性缺血而发生障碍的物体识别记忆障碍。(图3)
[0241]
根据以上的结果表明,rgma抑制物质、特别是抗rgma中和抗体对血管性痴呆症显示药效。
[0242]
[参考文献]
[0243]
1.deedsmc,andersonjm,armstrongas,etal.singledosestreptozotocin-induceddiabetes:considerationsforstudydesigninislettransplantationmodels.labanim.2011;45(3):131-140.doi:10.1258/la.2010.010090
[0244]
2.o’brienpd,sakowskisa,feldmanel.mousemodelsofdiabeticneuropathy.ilarj.2014;54(3):259-272.doi:10.1093/ilar/ilt052
[0245]
3.legerm,quiedevillea,bouetv,etal.objectrecognitiontestinmice.natprotoc.2013;8(12):2531-2537.doi:10.1038/nprot.2013.155
[0246]
4.grinan-ferrec,puigoriol-illamolad,palomera-avalosv,etal.environmentalenrichmentmodifiedepigeneticmechanismsinsamp8mousehippocampusbyreducingoxidativestressandinflammagingandachievingneuroprotection.frontagingneurosci.2016;8(oct).doi:10.3389/fnagi.2016.00241
[0247]
5.hattoriyetal,gradualcarotidarterystenosisinmicecloselyreplicateshypoperfusivevasculardementiainhumans.journaloftheamericanheartassociation20162feb.22;5(2):e002757.doi:10.1161/jaha.115.002757
[0248]
6.stranahan,a.,arumugam,t.,cutler,r.etal.diabetesimpairshippocampalfunctionthroughglucocorticoid-mediatedeffectsonnewandmatureneurons.natneurosci11,309-317(2008).https://doi.org/10.1038/nn2055
[0249]
<序列表的说明>
[0250]
序列号1:人rgma前体蛋白的氨基酸序列
[0251]
序列号2:小鼠rgma前体蛋白的氨基酸序列
[0252]
序列号3:大鼠rgma前体蛋白的氨基酸序列
[0253]
序列号4:人rgma基因的dna序列
[0254]
序列号5:抗rgma中和抗体r116a3的lcdr1的氨基酸序列
[0255]
序列号6:抗rgma中和抗体r116a3的lcdr2的氨基酸序列
[0256]
序列号7:抗rgma中和抗体r116a3的lcdr3的氨基酸序列
[0257]
序列号8:抗rgma中和抗体r116a3的hcdr1的氨基酸序列
[0258]
序列号9:抗rgma中和抗体r116a3的hcdr2的氨基酸序列
[0259]
序列号10:抗rgma中和抗体r116a3的hcdr3的氨基酸序列
[0260]
序列号11:抗rgma中和抗体r70e的lcdr1的氨基酸序列
[0261]
序列号12:抗rgma中和抗体r70e的lcdr2的氨基酸序列
[0262]
序列号13:抗rgma中和抗体r70e的lcdr3的氨基酸序列
[0263]
序列号14:抗rgma中和抗体r70e的hcdr1的氨基酸序列
[0264]
序列号15:抗rgma中和抗体r70e的hcdr2的氨基酸序列
[0265]
序列号16:人rgma的表位的氨基酸序列
[0266]
序列号17:抗rgma中和抗体5f9的lcdr1的氨基酸序列
[0267]
序列号18:抗rgma中和抗体5f9的lcdr2的氨基酸序列
[0268]
序列号19:抗rgma中和抗体5f9的lcdr3的氨基酸序列
[0269]
序列号20:抗rgma中和抗体5f9的hcdr1的氨基酸序列
[0270]
序列号21:抗rgma中和抗体5f9的hcdr2的氨基酸序列
[0271]
序列号22:抗rgma中和抗体5f9的hcdr3的氨基酸序列
[0272]
序列号23:抗rgma中和抗体8d1的lcdr1的氨基酸序列
[0273]
序列号24:抗rgma中和抗体8d1的lcdr2的氨基酸序列
[0274]
序列号25:抗rgma中和抗体8d1的lcdr3的氨基酸序列
[0275]
序列号26:抗rgma中和抗体8d1的hcdr1的氨基酸序列
[0276]
序列号27:抗rgma中和抗体8d1的hcdr2的氨基酸序列
[0277]
序列号28:抗rgma中和抗体8d1的hcdr3的氨基酸序列
[0278]
序列号29:抗rgma中和抗体ae12-1的lcdr1的氨基酸序列
[0279]
序列号30:抗rgma中和抗体ae12-1的lcdr2的氨基酸序列
[0280]
序列号31:抗rgma中和抗体ae12-1的lcdr3的氨基酸序列
[0281]
序列号32:抗rgma中和抗体ae12-1的hcdr1的氨基酸序列
[0282]
序列号33:抗rgma中和抗体ae12-1的hcdr2的氨基酸序列
[0283]
序列号34:抗rgma中和抗体ae12-1的hcdr3的氨基酸序列
[0284]
序列号35:抗rgma中和抗体ae12-1y的lcdr3的氨基酸序列
[0285]
序列号36:人rgma的表位的氨基酸序列
[0286]
序列号37:人rgma的表位的氨基酸序列
[0287]
序列号38:人rgma的表位的氨基酸序列
[0288]
序列号39:人rgma的表位的氨基酸序列
[0289]
序列号40:抗rgma中和抗体ae12-1f的lcdr3的氨基酸序列
[0290]
序列号41:抗rgma中和抗体ae12-1h的lcdr3的氨基酸序列
[0291]
序列号42:抗rgma中和抗体ae12-1l的lcdr3的氨基酸序列
[0292]
序列号43:抗rgma中和抗体ae12-1v的lcdr3的氨基酸序列
[0293]
序列号44:抗rgma中和抗体ae12-1i的lcdr3的氨基酸序列
[0294]
序列号45:抗rgma中和抗体ae12-1k的lcdr3的氨基酸序列产业上的可利用性
[0295]
本发明的rgma抑制物质对预防或治疗糖尿病性痴呆症或血管性痴呆症有用,因此在医药品产业中具有高利用价值。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。