1.本发明属于小麦分子育种方法技术领域,涉及聚合多性状有利等位变异的小麦抗赤霉病分子育种方法。
背景技术:
2.我国是小麦第一大生产国和消费国,小麦生产状况对国家粮食安全、社会经济发展和人民生活水平提高具有极其重要的意义。目前,小麦生产仍面临着各种病害、虫害和非生物胁迫等威胁。小麦赤霉病(fusarium headblight,fhb)是危害最大的真菌性病害之一,该病主要由禾谷镰刀菌(fusarium graminearum)等引起。病原菌于小麦开花期侵染穗部小花,在籽粒灌浆成熟过程中沿穗轴不断扩展,产生和积累脱氧雪腐镰孢菌烯醇 (deoxynivalenol,don)、雪腐镰孢菌烯醇(nivalenol,niv)和玉米赤霉烯酮(zearalenol,zen)等毒素,严重时导致穗轴发黑、整穗死亡、籽粒干瘪,进而降低产量、损害品质,产生的don毒素易造成人畜呕吐、中毒和流产,对人畜健康造成巨大伤害。全球小麦赤霉病危害呈逐步加重的趋势。黄淮麦区和长江中下游麦区是我国第一、二大小麦主产区,约占全国小麦年种植总面积的70%。长江中下游麦区一直是小麦赤霉病常发区和重发区。近年来,由于气候变暖、降雨带北移和水稻、玉米秸秆还田等因素影响,小麦赤霉病也已成为黄淮麦区常发病害。最近十年,我国发生5次赤霉病大爆发,年均发病面积约占总种植面积的1/4。2012年我国赤霉病大流行,发生面积高达990万公顷,2016年和2018年发生面积分别为680万公顷和570万公顷。《江苏省农作物品种审定标准》中抗赤霉病小麦品种审定标准:淮南麦区抗性达到抗、淮北麦区抗性达到中抗及以上的品种。而目前无论是淮南淮北乃至全国审定的小麦品种中少有能达到“抗”。培育抗赤霉病小麦品种仍然是解决小麦赤霉病危害最经济、安全和有效的途径,但至今未能育成大面积推广的抗赤霉病高产品种,赤霉病抗性与高产的矛盾仍是制约我国小麦育种的“卡脖子”问题。
3.目前对小麦赤霉病和抗性的选择主要是以表型为主。小麦的赤霉病抗性是典型的数量性状,不是单基因控制,易受包括环境在内的多因素影响,育种多世代的赤霉病抗性鉴定非常复杂繁琐,需要投入大量的人力物力财力,加上近几年气候条件反常,极端气候时常发生,给赤霉病的表型鉴定带来了巨大的挑战。当前,前沿生物技术与信息技术、智能技术的融合发展,正在催生新一代生物育种技术快速发展。“我国将加快实施种业振兴行动,开展种源关键核心技术攻关和突破性新品种培育推广。近几年来种业科技基础理论正在不断突破,很多单位已经将分子设计育种、基因编辑等生物关键技术应用到育种中。一般来说,某个重要农艺性状是由多个数量位点控制,这些数量性状位点发挥效应的大小可能跟遗传背景有关,并且不同农艺性状的位点之间存在一定程度的相关性,经常发生模块化调控。这种复杂性成为传统育种的瓶颈,例如如何克服穗数、穗粒数和千粒重之间相互制约发展的关系,如何克服抗病与产量协调的难题。生物育种时代的关键落脚点就是合理设计亲本组合、规划杂交方案和选择指标等,提高育种效率。为了实现这一目标,优化抗病和农艺性状的调控遗传基础是极其重要的。
4.小麦抗赤霉病和产量都是作物复杂的数量性状,国内外定位了大量的相关qtl,也克隆了部分基因,但是对于育种来说要选择最适合在本麦区利用的抗病位点/基因和产量相关位点/基因加以开发分子标记应用于生物育种。
5.因此,加强小麦抗赤霉病遗传与育种研究,培育抗性和产量等协同提高的小麦品种十分迫切。
技术实现要素:
6.为了克服上述技术问题,本发明提供了一种聚合多性状有利等位变异的小麦抗赤霉病分子育种方法,分别采用含有抗赤霉病基因fhb1、抗赤霉病位点qfhb.3b、每穗小穗数位点qsns.2b和千粒重位点qtkw.2b的有利等位变异的基因型互补的亲本进行杂交或者复交,收获杂交或者复交后杂交种;并结合多世代抗病性、农艺性状和产量的精准鉴定,达到小麦赤霉病和高产协同改良的育种目标。
7.本发明提供了一种聚合多性状有利等位变异的小麦抗赤霉病分子育种方法,所述方法包括以下步骤,
8.步骤s1,选择携带抗赤霉病基因fhb1的抗病基因型、抗赤霉病位点q fhb.3b的抗性等位变异,每穗小穗数位点qsns.2b和千粒重位点qtkw.2b 的增效等位变异的基因型互补的亲本,将选择出的亲本进行杂交或者复交,收获杂交或者复交后种子f1;
9.步骤s2,种植f1代杂交种,收获自交种f2;
10.步骤s3,在温室种植f2代进行抗白粉病和黄花叶病、抗倒伏和分蘖性的筛选,淘汰自然条件下感病、易倒伏、株高大于80cm及晚熟的单株,收获中选单株种子f3;
11.步骤s4,在温室大棚种植f3世代,每单株取叶片提dna,进行fhb1、 qfhb.3b、qsns.2b和qtkw.2b的有利等位变异筛选,选择基因型检测包含杂合的均呈阳性的有利等位变异的单株挂牌,同时在小麦全生育期进行抗白粉病和黄花叶病、抗倒伏和分蘖性的筛选,淘汰易倒伏、株高大于80cm 及晚熟的单株,中选的按照单株收种子f4;
12.步骤s5,在田间种植f4,种成株行,首先在苗期利用分子标记筛选保留同时携有fhb1、qfhb.3b、qsns.2b和qtkw.2b的包含杂合的均呈阳性的有利等位变异的株行,挂牌标记,根据育种目标,全面考察中选株行的综合农艺性状、生育期和其他抗病性,选择优良的株行,其中收5~6个性状一致的单株,收获后进行产量鉴定,选择产量水平高于对照的株行种子 f5;
13.步骤s6,在田间种植f5,种成株系,首先在苗期利用分子标记筛选保留同时携有fhb1、qfhb.3b、qsns.2b和qtkw.2b均呈纯合阳性的有利等位变异的株系,挂牌标记,在扬花期对挂牌株系单花滴注接种赤霉病病原菌保留鉴定结果为“抗”的株系,然后根据育种目标,全面考察中选株系的综合农艺性状、生育期和其他抗病性等,选择优良的株系,中选株系混收,收获后进行产量鉴定,选择产量水平高于对照的株系;
14.步骤s7,在田间种植f6,根据育种目标,全面考察小区品系的综合农艺性状和其他抗病性,收获后进行产量鉴定,选择产量水平与对照相比高出5%的小区,进入下一代多点产量鉴定。
15.进一步地,所述抗赤霉病基因fhb1的特异性检测引物序列为seq idno.1和seq id no.2所示。
16.进一步地,所述赤霉病抗性位点qfhb.3b的特异性检测引物序列为seq id no.4、seq id no.5和seq id no.6所示。
17.进一步地,所述粒重位点qsns.2b的特异性检测引物序列为seq idno.8、seq id no.9和seq id no.10所示。
18.进一步地,所述千粒重位点qtkw.2b的特异性检测引物序列为seq i d no.12、seq id no.13和seq id no.14所示。
19.进一步地,所述步骤s3和s4中种植f2代和f3代进行抗白粉病和抗黄花叶病、抗倒伏和分蘖性的筛选,淘汰感病、易倒伏、株高大于80cm及晚熟的单株具体为:以镇麦9号为抗白粉病对照,在温室中单株与单株的间隔处提前正常播种4-6天均匀种植苏麦3号(高感白粉病)诱发白粉病;以宁麦13为抗黄花叶病对照,全生育期对比筛选抗黄花叶病单株;分蘖性好坏的判断以扬麦25为对照,淘汰每单株穗数少于扬麦25的单株;倒伏与熟期的筛选以扬麦25为对照。
20.进一步地,所述步骤s6中在扬花期对挂牌株行单花滴注接种赤霉病病原菌保留鉴定结果为“抗”的株行具体为:制备赤霉菌孢子悬浮液4
×
105~5
×ꢀ
105孢子/ml,大田里,在小麦开花期,采用单花滴注法接种,每个株行或者株系随机选择20个穗子,在每穗的中部张开的小花处接种,并做上标记,接种后每天7:00~18:00,每隔2小时对接种穗喷一次水,均匀且充分地喷到小麦穗部,每次喷10分钟,小麦开花20天后立即停止喷水;接种21天后,调查被接种的穗子发病情况,数每穗发病小穗数和总小穗数,赤霉病严重度pss=发病小穗数/总小穗数
×
100%,保留pss小于25%、与苏麦3 号“抗”水平接近的株行或者株系,苏麦3号和安农8455分别作为抗病和感病对照,扬麦25作为中抗对照,扬麦13作为中感对照。
21.进一步地,所述步骤s5、s6和s7中其他抗病性的鉴定具体为:黄花叶病、白粉病的鉴定采用自然发病鉴定;选择黄花叶病、白粉病的抗病鉴定结果均呈抗病(r)级的株行挂牌标记。
22.进一步地,所述步骤s5、s6和s7中白粉病、黄花叶病的鉴定中还包括种植镇麦9号为白粉病抗病(r)对照;宁麦13为黄花叶病抗病(r)对照。
23.进一步地,所述步骤s5、s6和s7中全面考察中选株行、株系和品系的综合农艺性状具体为:选择株高小于90cm,抗倒性好,单株穗数大于或等于8,每穗粒数大于或等于45,熟期与扬麦25相当的株行。
24.进一步地,所述步骤s5、s6和s7中农艺性状和生育期的对照品种指扬麦25。
25.本发明相对于现有技术具有以下技术效果:
26.本发明首次利用不同于已知抗源例如苏麦3号、望水白等的普通小麦品种扬麦16为抗赤霉病位点来源,其不携带fhb1,农艺性状优良,曾经是长江中下游推广面积最大的品种之一,获得农业农村部“中华农业科技一等奖”,申请人首次发掘扬麦16携带一个新的抗赤霉病位点qfhb.3b,对产量性状无负向效应。申请人在偃展1号和扬麦12中新发掘出每穗小穗数位点qsns.2b和千粒重位点qtkw.2b,这些产量位点的增效等位变异对赤霉病无负向效应,通过这些抗性位点和产量位点的有利等位变异聚合,可以克服抗病基因对产量性状的不利影响。因此,在育种中选择携有fhb1 qfhb.3b qsns.2b qtkw.2b的有利等位变异,既可以使赤霉病抗性显著提高,又可以同时提高产量。这种聚合多性状有利等位变异的小麦抗赤霉病分子育种方法可以成为生物育种的典范被推广应用。利用本发明方法选育的小
麦品种赤霉病抗性与产量均可取得突破,大大缩短了育种周期,减少了田间工作量和农药化肥施用,有利于保证我国小麦原粮生产安全可持续发展。
附图说明
27.为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式描述中所需要使用的附图作简单地介绍。
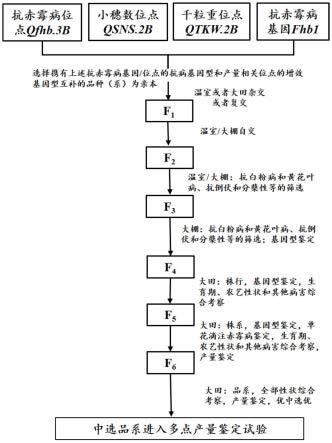
28.图1为一种聚合多性状有利等位变异的小麦抗赤霉病分子育种方法路线图。
29.图2为实施例2中抗赤霉病基因fhb1位点紧密连锁分子标记在亲本和后代中的扩增结果示意图,箭头所指为抗赤霉病基因阳性条带。
30.图3为实施例3中抗赤霉病位点qfhb.3b在自然群体里的扩增检测结果示意图。
31.图4为实施例6中小穗数位点qsns.2b(a)和千粒重位点qtkw.2b (b)在自然群体里的扩增检测结果示意图。
具体实施方式
32.下面将结合附图对本发明技术方案的实施例进行详细的描述。以下实施例仅用于更加清楚地说明本发明的技术方案,因此只是作为示例,而不能以此来限制本发明的保护范围。需要注意的是,除非另有说明,本技术使用的技术术语或者科学术语应当为本发明所属领域技术人员所理解的通常意义。
33.实施例1一种聚合多性状有利等位变异的小麦抗赤霉病分子育种方法按照图1所示流程,包括以下步骤,
34.步骤s1,亲本选择:选择小麦自然群体中主栽品种及其衍生品系为对象,提取种子或者苗期叶片dna,选择携带抗赤霉病基因fhb1的抗病基因型、抗赤霉病位点qfhb.3b的抗病基因型,每穗小穗数位点qsns.2b和千粒重位点qtkw.2b的增效等位变异互补的品种(系)为亲本,选择出携带抗赤霉病基因fhb1抗性等位变异的品系扬麦28,携带抗赤霉病位点qfhb.3b抗性等位变异的扬麦30,同时扬麦28携有千粒重位点qtkw.2b的增效基因型,扬麦30携有小穗数位点qsns.2b的增效基因型,这两个亲本的抗病位点和产量相关位点的基因型/等位变异实现了互补。
35.将选择出的亲本2016年8月在温室种植,10月下旬进行杂交配组,2 016年12月收获f1代杂交种;
36.2)步骤s2,2017年1月温室种植f1代杂交种,6月收获自交种f2;
37.3)步骤s3,2017年8月在温室种植f2代,在温室种植f2代进行抗白粉病和黄花叶病、抗倒伏和分蘖性等的筛选,淘汰感病、易倒伏、株高大于80cm及晚熟的单株:以镇麦9号为抗白粉病对照;以宁麦13为抗黄花叶病对照,全生育期对比筛选抗黄花叶病单株;分蘖性、倒伏和熟期的判断以扬麦25为对照。12月收获中选单株种子;
38.4)步骤s4,2018年1月在温室大棚种植f3世代,上一世代收的每1 单株种1行,行长2m,行距0.25m,每行40粒,每单株取叶片提dna,进行fhb1、qfhb.3b、qsns.2b和qtkw.2b的有利等位变异筛选,选择基因型检测含有全部有利等位变异(含杂合阳性)的单株挂牌,同时在小麦全生育期进行抗白粉病和黄花叶病、抗倒伏和分蘖性的筛选,淘汰易倒伏、株高大于80cm及熟期晚于扬麦25的单株。6月收获最终中选单株;
39.5)步骤s5,2018年10月在大田种植f4世代,种成株行,上一代收的每个单株种2行,行长2m,行距0.25m,每行40粒,首先在苗期,随机挑选每株行10个单株的叶片混合,提取dna,分子标记鉴定保留同时携有抗赤霉病基因fhb1、抗赤霉病位点qfhb.3b的抗性等位变异,每穗小穗数位点qsns.2b和千粒重位点qtkw.2b的有利等位变异(含杂合阳性)的株行,挂牌标记,根据育种目标,全面考察中选株行的综合农艺性状和其他抗病性等:黄花叶病、白粉病和锈病(叶锈)的鉴定采用自然发病鉴定,宁麦13作为黄花叶病抗病(r)对照;镇麦9号作为白粉病抗病(r)对照。选择黄花叶病、白粉病和锈病的病害鉴定结果均呈抗病(r)级的株行考察农艺性状,以扬麦25为基本对照,选择株高小于90cm,抗倒性好,单株穗数大于或等于8,每穗粒数大于或等于45的株行挂牌标记。对中选的优良株行,混收5~6个性状一致的单株,6月收获后进行产量鉴定。选择产量水平高于对照品种扬麦25的株行。
40.6)步骤s6,2019年10月在田间种植f5,种成株系,6行区,行长2 m,行距0.25m,每行50粒,首先在苗期,每株系随机挑选10个单株的叶片混合,提取dna,分子标记鉴定保留同时携有抗赤霉病基因fhb1、qfhb.3b位点的纯合抗性等位变异,每穗小穗数位点qsns.2b和千粒重位点q tkw.2b的有利等位变异(纯合)的株系,挂牌标记,制备赤霉菌孢子悬浮液4
×
105~5
×
105孢子/ml,2020年4月~5月大田里,在小麦开花期,采用单花滴注法接种,每个株系随机选择20个穗子,在每穗的中部张开的小花处接种,并做上标记,接种后每天7:00~18:00,每隔2小时对接种穗喷一次水,均匀喷到小麦穗部,每次喷10分钟,小麦开花20天后立即停止喷水。接种21天后,调查被接种的穗子发病情况,数每穗发病小穗数和总小穗数,赤霉病严重度pss=发病小穗数/总小穗数
×
100%,保留pss小于 25%的、抗性水平与苏麦3号“抗”水平接近的株系,苏麦3号和安农845 5分别作为抗病和感病对照,扬麦25作为中抗对照,扬麦13作为中感对照,有6个株系的平均严重度低于25%。然后根据育种目标,全面考察中选株系的综合农艺性状和其他抗病性等:白粉病、黄花叶病的鉴定采用自然发病鉴定,宁麦13为黄花叶病抗病(r)对照;镇麦9号为白粉病抗病(r) 对照。选择白粉病和黄花叶病的抗病鉴定结果均呈r级的株行考察农艺性状,以扬麦25为基本对照,选择株高低于90cm,抗倒性好,单株穗数大于或等于8,每穗粒数大于或等于45的株系挂牌标记。对中选的优良株系,收15个左右性状一致的单株,6月收获后进行产量和粒重鉴定,产量水平全部转化为每亩产量的数值,当年扬麦25的平均产量为530.6kg/亩,选择产量均显著高于对照扬麦25的株系,中选株系有2个,分别为20-16、20
‑ꢀ
88,产量分别为559.9kg/亩、568.3kg/亩,比扬麦25增产5.52%和7.11%。这两个系的赤霉病严重度分别为8.1%和9.4%,均显著低于25%,与当年苏麦3号的严重度(pss=6.4%)接近。根据发病平均情况转化成平均严重度。抗病调查和鉴定标准按照《中华人民共和国农业行业标准ny/t 2954-201 6:小麦区域试验品种抗赤霉病鉴定技术规程》,病小穗率小于25%的即严重度小于2级的视为r级。
41.7)步骤s7,2020年10月在田间种植f6,每个中选株系种成10行区,行长3.2米,行距0.23米,根据育种目标,全面考察小区品系的综合农艺性状和其他抗病性等,白粉病、黄花叶病的鉴定采用自然发病鉴定,镇麦9 号为白粉病抗病(r)对照;宁麦13为黄花叶病抗病(r)对照。选择白粉病和黄花叶病的抗病鉴定结果均呈r级的品系考察农艺性状,以扬麦25为基本对照,选择抗倒性好,单株穗数大于或等于8,每穗粒数大于或等于4 5的品系挂牌标记。2021年6月收获后进行产量鉴定,产量水平全部转化为每亩产量的数值,20-16、20-88的产量水平依然与对照扬麦25相比高出 5%,当年扬麦25的产量水平是541.6kg/亩,20-16、
20-88产量分别达到5 71.3kg/亩和578.5kg/亩,比对照扬麦25分别增产5.48%和6.81%,进入下一年多点产量鉴定。
42.附图1为一种聚合多性状有利等位变异的小麦抗赤霉病分子育种方法路线图,可见,通过本发明的方法能够通过合理的亲本选择和设计,聚合抗病、产量相关性状基因/位点的有利基因型或者等位变异,大幅度提高育种效率和性状改良精准性。
43.实施例2分子标记辅助选择抗赤霉病基因fhb1方法的建立
44.采用ctab法提取实施例1涉及的候选亲本材料、f3单株叶片、f4株行叶片和f5株系混合叶片的基因组dna,经稀释得到dna浓度为约30n g/μl的模板溶液,检测小麦的抗赤霉病基因fhb1的连锁his标记。
45.分子标记检测抗赤霉病基因fhb1的连锁his标记的特异性引物组的序列见表1:
46.表1抗赤霉病基因fhb1连锁标记引物序列信息
[0047][0048]
采用pcr扩增的方法检测抗赤霉病主效基因fhb1的对应连锁标记his,所述pcr扩增的方法为:所述pcr扩增的体系为10μl,包含30ng/μl小麦基因组dna 1.0μl、10
×
pcr buffer 1.0μl、10mm dntp 0.2μl、10mmmgcl
2 1.0μl、5u taq聚合酶0.2μl、5μm的上游引物0.4μl、5μm的下游引物0.4μl和无菌去离子水5.8μl;所述pcr扩增程序为:(1)94℃预变性5min;94℃变性30s,62℃退火20s,68℃延伸2~3.5min;(2)94℃变性20s,57℃退火20s,72℃延伸1min,32个循环;(3)72℃延伸5分钟; 4℃保存。
[0049]
采用his引物在1%琼脂糖电泳液中检测实施例1涉及小麦材料,目标基因型与宁麦13相同,为中选材料。附图2为fhb1位点紧密连锁分子标记his在亲本和后代中的扩增结果示意图,箭头所示即为扩增阳性的目标条带。
[0050]
实施例3挖掘稳定的小麦抗赤霉病位点qfhb.3b并且开发有效的 kasp引物组
[0051]
田间试验:以174份来源于“扬麦16/中麦895”的dh系为材料,2016 年、2017和2018年连续3个生长季将该dh系及其亲本种植于江苏里下河地区农业科学研究所万福试验基地赤霉病鉴定圃(江苏扬州),试验当年扬州小麦播期设为10月20日,试验采用随机区组设计,2行区,2次重复,每行30粒,行长1.5m,行距0.23m。田间施肥及管理参照当地大田栽培生产,及时防治虫草害,制备赤霉菌孢子悬浮液4
×
105~5
×
105孢子/ml,在小麦开花期,采用单花滴注的方法接种赤霉病,在每穗中部1个小花处接种10μl孢子液,每系随机标记20个穗子,28天后,调查被接种穗子发病情况,数每穗发病小穗数和总小穗数,赤霉病严重度pss=发病小穗数/总小穗数
×
100%,最终取2次重复的平均值为该家系平均严重度pss。
[0052]
基因型检测及qtl定位:采用ctab法提取基因组dna,利用小麦 wheat 660k芯片获取基因型,利用icimapping v4.1软件(http://www.isbreeding.net)的snp和bin功能过滤和去冗余基因型数据,利用map功能初步构建遗传连锁图谱,利用joinmap v4.0校正遗传
图谱,利用mapchart 2.3(https://www.wur.nl/en/show/mapchart.htm)绘制遗传图谱。利用icimapping v4.1软件的完备区间作图法(inclusive composite interval mapping,icim)检测与赤霉病严重度(平均病小穗率,pss)显著相关的qtl,lod阈值设为3.0。为了与前人结果比较,将连锁标记或者基因序列与中国春2.1 参考基因组序列的ensemblplants数据库(http://202.194.139.32/blast/blast.html)进行比对。实验获得对小麦抗赤霉病显著增效位点qfhb.3b,抗性基因型来源于扬麦16,如表2。申请人通过对“扬麦16/中麦895”的dh系进行农艺性状和产量考察,对该位点的相关snp基因分型与农艺性状和产量的表型进行t测验,发现该位点的抗性等位变异(有利等位变异)对农艺性状和产量均无负向效应,因此认为该位点的抗性等位变异是生产上很适合利用的抗赤霉病基因型。
[0053]
表2 qfhb.3b位点情况
[0054][0055]
分子标记开发:鉴于qfhb.3b初定位区间705.28—742.44mb较大,不利于进一步利用,申请人根据赤霉病表型鉴定结果将dh家系分成2个混池,抗赤霉病混池(pss《25%)和感赤霉病混池(pss》75%)各15个家系,进行小麦叶片基因组混池外显子捕获、混池rna测序(bulked segregantrna-seq,bsr),也将亲本扬麦16和中麦895进行了小麦660k snp芯片扫描和重测序,以挖掘更多的多态性snp位点,根据小麦中国春参考基因组2.1版本信息,利用primer 5.0软件共开发了目标区间14个snp对应的 kasp标记,经过在原始群体中进行扫描和验证,在3b染色体物理位置 726.43mb处发掘出的一个多态性snp开发出来的kasp标记,能够最好的与赤霉病表型连锁,因此,将此标记命名为ym16-fhb-3b,引物相关信息如表3。
[0056]
表3 ym16-fhb-3b相关信息
[0057]
[0058]
kasp标记引物工作液的制备:分别取上游引物30μl(100μm),取下游引物各12μl(100μm),用无菌超纯水补充至100μl,充分混匀,作为kasp标记的引物工作液,备用。pcr扩增反应体系:待测小麦dna 模板2.2μl(约30ng/μl)、引物工作液0.06μl、kasp master mix 2. 5μl(lgc公司,kbs-1016-002),用无菌超纯水补充至5μl;pcr反应程序:(1)94℃预变性10min;(2)95℃变性20s、61
–
55℃(每个循环下降0.6℃)45s,共10个循环;(3)94℃变性20s、56℃复性45 s,31个循环;4℃保存。实验同时设置反应体系中不添加模板dna的空白对照(ntc),每个板设置1个或多个空白对照。
[0059]
取小麦幼苗,采用ctab法提取待测小麦基因组dna。以待测小麦基因组dna为模板,采用如上kasp引物组、pcr试剂进行pcr扩增,获得pcr扩增产物。pcr反应在abi veriti 384pcr仪(thermo fisher) 上进行,用omega f snp分型检测仪(lgc genomics ltd,kbs-0024-0 02)对pcr扩增产物进行扫描读取荧光值。fam激发波长为485nm,发射波长为520nm;vic激发波长为535nm,发射波长为556nm,系统参比荧光rox激发波长为575nm,发射波长为610nm。采用kluster callertm(kbioscience)进行基因分型,根据分析结果确定qfhb.3b位点的基因型。将部分“扬麦16
×
中麦895的dh系”连同两个亲本按照如上方法进行扩增,扩增产物的荧光信号数据经kluster caller软件分析聚集在分型结果荧光信号坐标系中靠近x轴的位置(蓝色),与扬麦16相同,即证明这些小麦在kasp标记侧翼核苷酸序列(如seq id no.3和4)的第36位碱基 (snp位点)的基因型分别为c;而扩增产物的荧光信号数据经kluster c aller软件分析聚集在坐标系中靠近y轴的位置(红色),与扬麦16分型不同,则证明这些家系在该snp位点的基因型分别为t。“扬麦16
×
中麦89 5的dh系”在qfhb.3b位点基因型与赤霉病严重度的t测验结果如表4所示。
[0060]
表4部分dh家系赤霉病严重度(pss)与qfhb.3b位点抗感等位变异的t测验结果
[0061][0062]
由表4可见,qfhb.3b位点上,含有等位基因t的小麦赤霉病严重度平均值总体上显著高于含有等位基因c的小麦,利用excel 2019的双样本t 测验部分dh家系的基因型和表型(有7个家系未检测到基因型),结果表明:92个家系与扬麦16基因型相同为c,75个家系与中麦895基因型相同为t,基因型为c的家系比基因型为t的家系赤霉病严重度平均值降低20.57%,在p《0.01水平上有显著差异,说明qfhb.3b位点的kasp标记 ym16-fhb-3b的引物组及基因型检测体系可以应用于小麦抗赤霉病分子标记辅助育种中。
[0063]
实施例4抗赤霉病位点qfhb.3b位点的kasp引物组育种应用及其与fh b1的聚合效应分析
[0064]
田间试验:本实施例以于2019年种植于湾头实验基地鉴定圃的小麦品种(系)共77份为材料,试验当年扬州的小麦播期设为10月20日,试验采用随机区组设计,3行区,2次重复,每行40粒,行长1.5m,行距0.2 3m。田间施肥及管理参照当地大田栽培生产,及时防治虫草害。2015年,制备赤霉菌孢子悬浮液4
×
105~5
×
105孢子/ml,4月中旬,在小麦开花期,采
用单花滴注的方法接种赤霉病,在每穗中部1个小花处接种10μl孢子液,每行随机标记10个穗子,每个家系总共调查30个穗子,21天后,调查被接种穗子发病情况,数每穗发病小穗数和总小穗数,赤霉病严重度pss=发病小穗数/总小穗数
×
100%,最终取2次重复的平均值为该家系平均严重度 pss。
[0065]
基因型检测:利用实施例3获得的qfhb.3b位点kasp引物组和实施例2的fhb1的引物组对上述77个品种(系)进行基因分型。qfhb.3b位点的kasp标记ym16-fhb-3b的引物组扩增产物的荧光信号数据经klustercaller软件分析聚集在分型结果荧光信号数据经kluster caller软件分析聚集与扬麦16相同,即证明这些小麦品系在qfhb.3b位点的基因型为c;若小麦品系的扩增产物的荧光信号数据经kluster caller软件分析聚集与扬麦 16分型不同,则证明这些小麦品系在该snp位点的基因型为t,附图3为ym16-fhb-3b的引物组扩增自然群体的荧光信号结果。77个品种(系)的在fhb1和qfhb.3b两个位点基因分型结果如表5,r表示携有fhb1的抗性等位变异,s表示不携有该基因的抗性等位变异。
[0066]
表5 77个品种(系)的赤霉病严重度平均值和fhb1、qfhb.3b位点基因型检测结果
[0067]
[0068][0069][0070]
注:fhb1:s表示不携有该基因的抗病基因型;r表示携有该基因的抗病基因型
[0071]
在去除fhb1的效应影响下(即将携有fhb1抗病基因型的材料挑出来),有26个家系不携有qfhb.3b位点的抗性等位变异,携有感病等位变异tt,有32个家系携有qfhb.3b位点抗性等位变异cc,t测验结果如表6。
[0072]
表6去除fhb1的效应影响下赤霉病严重度(pss)与qfhb.3b位点抗感等位变异的t测验结果
[0073][0074]
由表6可见,去除fhb1的影响下,含有qfhb.3b位点等位基因t的小麦赤霉病严重度平均值总体上显著高于含有等位基因c的小麦,利用excel 2019的双样本t测验两种等位基因型的表型,结果表明:32个品种(系) 与扬麦16基因型相同为c,26个品种(系)与中麦895基因型相同为t,基因型为c的品种(系)比基因型为t的品种(系)赤霉病严重度平均值降低22.48%,在p《0.01水平上有显著差异,说明qfhb.3b位点的kasp标记ym16-fhb-3b的引物组及基因型检测体系可以应用于小麦抗赤霉病分子标记辅助育种中。
[0075]
表7考虑fhb1的效应影响下赤霉病严重度(pss)与qfhb.3b位点抗感等位变异的t测验结果
[0076][0077][0078]
由表7可见,不去除fhb1的影响下,含有qfhb.3b位点等位基因t的小麦赤霉病严重度平均值总体上显著高于含有等位基因c的小麦,利用e xcel 2019的双样本t测验两种等位基因型的表型,结果表明:40个品种(系) 与扬麦16基因型相同为c,37个品种(系)与中麦895基因型相同为t,基因型为c的品种(系)比基因型为t的品种(系)赤霉病严重度平均值降低19.10%,在p《0.01水平上有显著差异,说明qfhb.3b位点的kasp标记ym16-fhb-3b的引物组及基因型检测体系可以应用于小麦抗赤霉病分子标记辅助育种中。我们再将fhb1与qfhb.3b位点聚合的效应进行分析,s 代表fhb1感病基因型,r代表fhb1抗病基因型,结果如表8所示。
[0079]
表8 fhb1与qfhb.3b位点的抗性等位变异的综合效应分析
[0080][0081]
注:pss(%)后不同小写字母表示数字在p《0.01水平上有显著差异
[0082]
由表8可见,方差分析结果表明:携带fhb1和qfhb.3b位点均为抗性等位基因型(r cc)的品种(系)比单独携带fhb1抗性等位基因型(r tt)或者单独携带qfhb.3b抗性等位基因型(cc)的品种(系)赤霉病严重度平均值降低24.13%和43.22%,在p《0.01水平上有显著差异,说明fhb1和qfhb.3b抗病基因型的聚合比单个基因/位点的抗性基因型具有更显著的抗赤霉病效应。同时说明fhb1的引物组his和qfhb.3b位点的ym16-fhb-3b的引物组及基因型检测体系可以应用于小麦抗赤霉病分子标记辅助育种中。
[0083]
实施例5挖掘小穗数位点qsns.2b、千粒重位点qtkw.2b及其kasp 引物组的开发
[0084]
田间试验:本实施例以于2017-2019年种植于湾头实验基地产量鉴定圃的扬麦12/偃展1号ril群体共205份家系为材料,试验当年扬州的小麦播期设为10月20日,试验采用随机区组设计,3行区,2次重复,每行50 粒,行长2m,行距0.3m。田间施肥及管理参照当地大田栽培生产,及时防治病虫草害。记录ril群体和亲本的抽穗期(3行区中大约有50%的小麦抽穗)。2018、2019、2020三年于小麦的灌浆后期-成熟期调查每穗小穗数,每家系随机标记10个单株,调查每单株10个穗子的每穗小穗数,最终取10个单株的平均值为该家系每穗小穗数(sns)。待成熟时收获这10 个单株,脱粒,去除病粒,大小粒保留,考察3个300粒的重量,取平均值,最后换算成1000粒的重量即为千粒重,最终取2次重复的平均值为该家系平均千粒重(tgw)。
[0085]
基因型检测及qtl定位:采用ctab法提取基因组dna,利用小麦 wheat 55k芯片获取基因型,利用icimapping v4.1软件(http://www.isbreeding.net)的snp和bin功能过滤和去冗余基因型数据,利用map功能初步构建遗传连锁图谱,利用mapchart2.3(https://www.wur.nl/en/show/mapchart.htm)绘制遗传图谱。利用icimapping v4.1软件的完备区间作图法(i nclusive composite interval mapping,icim)检测与每穗小穗数和千粒重显著相关的qtl,lod阈值设为3.0。为了与前人结果比较,将连锁标记或者基因序列与中国春2.1参考基因组序列的ensemblplants数据库(http://202. 194.139.32/blast/blast.html)进行比对。实验获得与小麦每穗小穗数位点qsns.2b和千粒重增效位点qtkw.2b如表9。申请人同时对扬麦12/偃展1号r il群体的赤霉病抗性进行的鉴定,将定位到的每穗小穗数位点qsns.2b和千粒重增效位点qtkw.2b区间的snp基因型与群体的赤霉病表型进行t 测验,发现这两个位点目标区间snp的增效基因型(等位变异)均对赤霉病抗性无负向效应,因此认为这两个位点的增效等位变异是适合在生产上利用的基因型。
[0086]
表9每穗小穗数位点qsns.2b和千粒重增效位点qtkw.2b的情况
[0087][0088]
分子标记开发:根据qsns.2b和qtkw.2b目标区间的snp信息与性状的表型鉴定数据,在目标区间的显著关联的5-7个snp中挖掘出与每穗小穗数和千粒重最显著相关的snp为ax109358385和ax109907473,利用snp侧翼序列、参考基因组2.1版本信息和primer 5.0软件成功开发出对应的kasp引物组yz1-sns-2b和ym12-tkw-2b,具体信息如表10所示
[0089]
表10 yz1-sns-2b和ym12-tkw-2b引物组信息
[0090][0091]
[0092]
kasp标记yz1-sns-2b引物工作液的制备:分别取上游引物各12μl (100μm),取下游引物30μl(100μm),用无菌超纯水补充至100μl,充分混匀,作为kasp标记的引物工作液,备用。kasp标记ym12-tkw
‑ꢀ
2b引物工作液的制备:取上游引物30μl(100μm),取下游引物各12μl (100μm),用无菌超纯水补充至100μl,充分混匀,作为kasp标记的引物工作液,备用。
[0093]
kasp标记yz1-sns-2b和kasp标记ym12-tkw-2b的pcr扩增反应体系:待测小麦dna模板2.2μl(约30ng/μl)、引物工作液0.06μl、 kasp master mix 2.5μl(lgc公司,kbs-1016-002),用无菌超纯水补充至5μl;pcr反应程序:(1)96℃预变性10min;(2)94℃变性20 s、61
–
55℃(每个循环下降0.6℃)40s,共10个循环;(3)94℃变性20 s、57℃复性45s,32个循环;4℃保存。实验同时设置反应体系中不添加模板dna的空白对照(ntc),每个板设置1个或多个空白对照。
[0094]
取小麦幼苗,采用ctab法提取待测小麦基因组dna。以待测小麦基因组dna为模板,采用如上kasp引物组、pcr试剂进行pcr扩增,获得pcr扩增产物。pcr反应在abi veriti 384pcr仪(thermo fisher) 上进行,用omega f snp分型检测仪(lgc genomics ltd,kbs-0024-0 02)对pcr扩增产物进行扫描读取荧光值。fam激发波长为485nm,发射波长为520nm;vic激发波长为535nm,发射波长为556nm,系统参比荧光rox激发波长为575nm,发射波长为610nm。采用kluster callertm(kbioscience)进行基因分型,根据分析结果确定qsns.2b和qtkw. 2b位点的基因型。将部分“扬麦12/偃展1号的ril系”连同两个亲本按照如上方法进行扩增,对于qsns.2b位点,偃展1号相同的基因型t是优异等位变异(有利等位变异),扩增产物的荧光信号数据经kluster caller软件分析聚集在分型结果荧光信号坐标系中靠近x轴的位置(蓝色),与扬麦 12相同,与偃展1号不同,即证明这些小麦在kasp标记侧翼核苷酸序列 (如seq id no.7的第36位碱基(snp位点)的基因型分别为c,是降低每穗小穗数的等位变异;而扩增产物的荧光信号数据经kluster caller软件分析聚集在坐标系中靠近y轴的位置(红色),与扬麦12分型不同,与偃展1号相同,则证明这些家系在该snp位点的基因型分别为t,是提高每穗小穗数的等位变异(有利等位变异)。对于qtkw.2b位点,扬麦12 相同的基因型c是增效等位变异(优异等位变异),扩增产物的荧光信号数据经kluster caller软件分析聚集在分型结果荧光信号坐标系中靠近x轴的位置(蓝色),与扬麦12相同,与偃展1号不同,即证明这些小麦在k asp标记侧翼核苷酸序列(如seq id no.7的第36位碱基(snp位点) 的基因型分别为c,是提高千粒重的等位变异;而扩增产物的荧光信号数据经kluster caller软件分析聚集在坐标系中靠近y轴的位置(红色),与扬麦12分型不同,与偃展1号相同,则证明这些家系在该snp位点的基因型分别为t,是降低千粒重的等位变异。
[0095]
实施例6每穗小穗数位点qsns.2b、千粒重位点qtkw.2b的kasp引物组验证
[0096]
田间试验:本实施例以于2019年种植于湾头实验基地产量鉴定圃的1 73个小麦自然群体为材料,试验当年扬州的小麦播期设为10月20日,试验采用随机区组设计,3行区,2次重复,每行50粒,行长2m,行距0.3 m。田间施肥及管理参照当地大田栽培生产,及时防治病虫草害。记录ril群体和亲本的抽穗期(3行区中大约有50%的小麦抽穗)。2020年于小麦的灌浆后期-成熟期调查每穗小穗数,每家系随机标记10个单株,调查每单株10个主茎穗子的每穗小穗数,最终取10个单株的平均值为该家系每穗小穗数(sns)。待成熟时收获这10个单株,脱粒,去除病粒,大小粒保留,考察3个300粒的重量,取平均值,最后换算成1000粒的重量即为千粒重,最终取2次重复的平均值为该家系平均千粒重(tgw)。
[0097]
基因型检测:利用实施例5获得的qsns.2b和qtkw.2b的kasp引物组yz1-sns-2b和ym12-q-2b对上述173个品种(系)进行基因分型。对于qsns.2b位点,偃展1号相同的基因型t是优异等位变异,扩增产物的荧光信号数据经kluster caller软件分析聚集在分型结果荧光信号坐标系中靠近x轴的位置(蓝色),与扬麦12相同,与偃展1号不同,即证明这些小麦在kasp标记侧翼核苷酸序列(如seq id no.7的第36位碱基(snp位点)的基因型分别为c,是降低每穗小穗数的等位变异;而扩增产物的荧光信号数据经kluster caller软件分析聚集在坐标系中靠近y轴的位置 (红色),与扬麦12分型不同,与偃展1号相同,则证明这些家系在该s np位点的基因型分别为t,是提高每穗小穗数的等位变异。对于qtkw2b 位点,扬麦12相同的基因型c是优异等位变异,扩增产物的荧光信号数据经kluster caller软件分析聚集在分型结果荧光信号坐标系中靠近x轴的位置(蓝色),与扬麦12相同,与偃展1号不同,即证明这些小麦在kasp 标记侧翼核苷酸序列(如seq id no.7的第36位碱基(snp位点)的基因型分别为c,是提高千粒重的等位变异;而扩增产物的荧光信号数据经k luster caller软件分析聚集在坐标系中靠近y轴的位置(红色),与扬麦1 2分型不同,与偃展1号相同,则证明这些家系在该snp位点的基因型分别为t,是降低千粒重的等位变异。附图4a和附图4b分别为yz1-sns-2b 和ym12-tkw-2b的引物组扩增自然群体的荧光信号结果。173个品种(系) 在qsns.2b和qtkw.2b两个位点基因型和表型鉴定结果、t测验结果如表 11、表12。
[0098]
表11 173个品种(系)的每穗小穗数(sns)和千粒重(tkw)与qsns.2b 和qtkw.2b位点基因型检测结果
[0099]
[0100]
[0101]
[0102]
[0103][0104]
表12携带qsns.2b和qtkw.2b两个位点不同基因型的品种(系)的每穗小穗数和千粒重平均值t测验结果
[0105][0106]
由表11、12可知,就qsns.2b位点来说,携有与偃展1号相同的基因型t是优势等位变异,能显著增加每穗小穗数。93个品种(系)携有与偃展1号相同的基因型tt,80个品种(系)携有与扬麦12相同的基因型 cc,tt基因型能比cc基因型显著提高2.75%的每穗小穗数,在p《0.01 水平上有显著差异,说明qsns.2b位点的kasp标记yz1-sns-2b的引物组及基因型检测体系可以应用于小麦每穗小穗数的分子标记辅助育种中。就qtkw.2b位点来说,携有与扬麦12相同的基因型c是优势等位变异,对千粒重具有显著的增效作用。125个品种(系)携有与扬麦12相同的基因型cc,48个品种(系)携有与偃展1号相同的基因型tt,cc基因型能比tt基因型显著提高3.73%的千粒重,在p《0.01水平上有显著差异,说明 qtkw.2b位点的kasp标记ym12-tkw-2b的引物组及基因型检测体系可以应用于小麦每穗小穗数的分子标记辅助育种中。
[0107]
实施例7分子标记辅助选择qfhb.3b抗病基因型,qsns.2b和qtkw.2b 增效等位变异方法的建立
[0108]
用分子标记ym16-fhb-3b、yz1-sns-2b和ym12-tkw-2b的引物组检测实施例1中涉及的亲本、f3单株叶片、f4株行混合叶片、f5株系混合叶片材料是否携带性状的优势等位变异。
[0109]
1、以提取的亲本基因组dna为模板,采用实施例3所述用于检测小麦的抗赤霉病位点的连锁kasp标记ym16-fhb-3b引物组和实施例5所述用于检测小麦每穗小穗数和千粒重位点的连锁kasp标记yz1-sns-2b和 ym12-tkw-2b引物组进行pcr扩增,得到扩增产物,确定
qfhb.3b位点与扬麦16基因型相同、qsns.2b位点与偃展1号基因型相同、qtkw.2b位点与扬麦12基因相同的目标材料。
[0110]
2、采用ctab法提取亲本、f3单株、f4株行混合叶片、f5株系混合叶片的基因组dna,经稀释得到dna浓度为约30ng/μl的模板溶液。
[0111]
将实施例1中步骤1),4),5)和6)中的材料连同两个亲本按照如上方法进行扩增。对qfhb.3b位点扩增产物的荧光信号数据经kluster caller软件分析聚集在分型结果荧光信号坐标系中靠近x轴的位置(蓝色),与扬麦16相同,即证明这些小麦在分子标记ym16-fhb-3b侧翼核苷酸序列 (如seq id no.3)的第36位碱基(snp位点)的基因型为c,是中选材料;而扩增产物的荧光信号数据经kluster caller软件分析聚集在坐标系中靠近y轴的位置(红色),与扬麦16分型不同,则证明这些小麦在该snp位点的基因型为t,要淘汰这种材料。对qsns.2b位点扩增产物的荧光信号数据经kluster caller软件分析聚集在分型结果荧光信号坐标系中靠近y轴的位置(红色),与偃展1号相同,即证明这些小麦在分子标记yz1
‑ꢀ
sns-2b侧翼核苷酸序列(如seq id no.7)的第36位碱基(snp位点) 的基因型为t(有利等位变异),是中选材料;而扩增产物的荧光信号数据经kluster caller软件分析聚集在坐标系中靠近x轴的位置(蓝色),与偃展1号分型不同,则证明这些小麦在该snp位点的基因型为c,要淘汰这种材料。对qtkw.2b位点扩增产物的荧光信号数据经kluster caller软件分析聚集在分型结果荧光信号坐标系中靠近x轴的位置(蓝色),与扬麦 12相同,即证明这些小麦在分子标记ym12-tkw-2b侧翼核苷酸序列(如 seq id no.11)的第36位碱基(snp位点)的基因型为c(有利等位变异),是中选材料;而扩增产物的荧光信号数据经kluster caller软件分析聚集在坐标系中靠近y轴的位置(红色),与扬麦12分型不同,则证明这些小麦在该snp位点的基因型为t,要淘汰这种材料。
[0112]
除非另外具体说明,否则在这些实施例中阐述的数值并不限制本发明的范围。在这里示出和描述的所有示例中,除非另有规定,任何具体值应被解释为仅仅是示例性的,而不是作为限制,因此,示例性实施例的其他示例可以具有不同的值。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。