alpk1基因在白内障诊断治疗及构建动物模型中的应用
技术领域
1.本发明属于医用动物模型、临床诊疗技术领域,具体涉及alpk1基因在白内障诊断治疗及构建动物模型中的应用。
背景技术:
2.白内障是以晶状体浑浊、透明度降低为表型的眼部疾病,根据发病时间可分为先天性和后天获得性两大类。先天性白内障是晶状体在胚胎发育过程中出现异常,导致出生后或出生后早期(十年内)逐渐形成的晶状体浑浊,是世界范围内最常见的致盲眼病,也是儿童视力障碍的第二大病因;who估计全球超过1400万儿童因白内障而失明。
3.先天性白内障导致儿童视力障碍的主要原因是因为晶状体的浑浊严重影响了婴幼儿的视觉发育,造成了不可逆的视功能障碍(即弱视)。目前临床上治疗先天性白内障的主要方法是手术摘除浑浊晶状体,解除视觉抑制,但术后患者常合并后发障、弱视、青光眼和视网膜脱离等。因此,先天性白内障发病机制的研究一直是眼科基础和临床研究的重点。
4.研究表明,除去外环境、胎内感染等因素,约有27-39%的先天性白内障由遗传因素导致。由于导致晶状体浑浊的潜在因素很多,白内障致病基因和相关基因位点也很多。目前明确与先天性遗传性白内障相关基因超过40个,包括晶状体蛋白基因(cryaa、cryab、cryba1、cryba3、crybb1、crybb2、crygc、crygd)、缝隙连接蛋白基因(gja8、gja3)、晶状体内在膜蛋白基因(lim2)、细胞骨架蛋白基因(bfsp2)、转录调控因子基因(pitx3、pax6、maf、hsf4)等。发病机制涉及细胞骨架、物质转运、rna剪接、内质网稳态等多个方面。
5.由于疾病相关基因和发病机制的复杂性、多样性,目前先天性白内障的治疗和干预仍缺乏有效的药物。为了进一步揭示白内障的致病机制,同时为临床诊断和治疗提供手段和措施,新的致病基因和分子靶点的探索仍然非常重要。
技术实现要素:
6.本发明的目的是提供α-激酶1(alpha-kinase 1,alpk1)基因在白内障诊断治疗及构建动物模型中的应用,所构建的小鼠白内障动物模型和人类的核性与皮质性的混合型白内障极其相似,可以用作研究白内障发生发展机制、早期干预、基因治疗、药物治疗及药物筛选和研发。
7.本发明首先提供检测alpk1基因的制剂在制备用于诊断白内障的制品中的应用,
8.其中检测alpk1基因的制剂,可以是蛋白水平检测制剂,也可以是rna或dna水平的检测制剂;
9.所述的蛋白水平检测制剂,为western blot检测试剂、酶活性、免疫荧光、免疫组化或elisa检测制剂;
10.所述的rna检测制剂,为检测mrna表达量的检测制剂;
11.所述dna检测制剂,为pcr扩增测序检测试剂或分子杂交检测、组学分析等分析dna序列的制剂。
12.本发明再一个方面还提供一种白内障动物模型的构建方法,是通过降低动物体内alpk1蛋白表达量或alpk1蛋白的活性来构建动物模型;
13.所述的降低动物体内alpk1蛋白表达量,其一种方式是通过基因编辑来完成的;
14.其中通过基因编辑,一种方式是敲除alpk1基因的至少一个外显子的全部或部分片段;
15.作为实施例的具体记载,所述的外显子为alpk1基因的3号外显子;
16.所述的降低动物体内alpk1蛋白表达量,还可以通过rna干涉方式来降低蛋白的表达量;
17.本发明另一个方面还提供一种动物模型,是使用上述的构建方法建立的;
18.本发明还提供一种筛选能够用于预防或治疗白内障的药物组分的方法,是用上述方法建立的动物模型来进行筛选;
19.本发明另一个方面还提供alpk1的另一种用途,是在制备预防或治疗白内障的制品中的应用。
20.本发明还提供具有预防或治疗白内障效果的制品,其中包含有alpk1蛋白酶本身,和/或能够促进alpk1基因表达的物质、和/或抑制alpk1蛋白降解的物质。
21.所述的制品,为功能性食品或药品。
22.本发明在确定alpk1基因的表达缺陷与白内障存在关联的基础上,通过基因敲除等方式制备核性及皮质性的混合型先天性遗传性白内障小鼠模型,为白内障发病机制的研究和药物筛选提供新的分子靶点、分子机制和动物模型。
附图说明
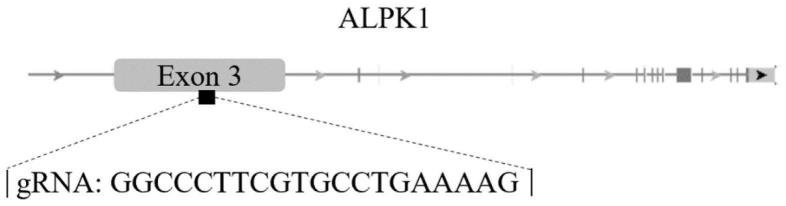
23.图1为本发明实施例提供的grna序列靶向小鼠alpk1基因的结构示意图;
24.图2为本发明实施例提供的alpk1缺失突变敲除小鼠基因型鉴定图;
25.图3为本发明实施例测序得到的缺失移码突变结果图;
26.图4为野生型小鼠(alpk1
/
)和模型小鼠(alpk1-/-)在2周、8周龄时,晶状体情况对比图(裂隙灯观察);
27.图5为野生型小鼠(alpk1
/
)和模型小鼠(alpk1-/-)在8周龄时晶状体情况对比图(苏木素-伊红染色);
28.图6为8周龄野生型小鼠(alpk1
/
)和模型小鼠(alpk1-/-)晶状体alpk1蛋白表达情况图(免疫荧光)
29.图7为2周龄模型小鼠(alpk1-/-)用alpk1过表达慢病毒(lv-alpk1)干预6周(小鼠8周龄)后,晶状体alpk1蛋白表达情况图(免疫荧光)
30.图8为2周龄模型小鼠(alpk1-/-)用alpk1过表达慢病毒(lv-alpk1)干预3周(小鼠5周龄)、6周(小鼠8周龄)后,晶状体情况图(裂隙灯观察)
31.图9为2周龄模型小鼠(alpk1-/-)用alpk1过表达慢病毒(lv-alpk1)干预3周(小鼠5周龄)、6周(小鼠8周龄)后,白内障发病率情况图。
具体实施方式
32.本发明说明书中α-激酶1和alpk1都可代表alpk1基因或alpk1蛋白,其中人alpk1
基因(gene id:80216)的一个具体的gene bank登录号为nc_000004.12或nc_060928.1,位于4q25,由16个外显子组成,转录产生3个转录剪接体(nm_025144.4,nm_001102406.2,nm_001253884.2),其中剪接体1和2编码alpk1亚型1蛋白(np_079420.3,np_001095876.1),剪接体3编码alpk1亚型2(np_001240813.1)。
33.本发明一个方面是通过检测alpk1基因的dna序列、mrna表达水平或蛋白表达水平来诊断白内障的发病风险。
34.其中检测蛋白表达水平,其目的是检测α-激酶1在待测物中的含量,可以采用常规的western blot检测方法、免疫荧光、免疫组化或elisa方法;还可以通过检测α-激酶1的酶活性来确定蛋白表达水平。
35.而检测dna序列,可以通过pcr扩增α-激酶1基因的核苷酸片段,并通过测序来检测α-激酶1基因是否发生了转录终止突变,或是其它可能导致α-激酶1表达水平下降或活性下降的突变;还可以通过分子杂交检测制剂来确定是否发生了突变。
36.rna检测制剂,其目的是检测mrna的表达量或影响mrna翻译功能的突变,例如荧光定量rt-pcr等常规方法。
37.本发明再一个方面还提供一种白内障动物模型的构建方法,是通过降低动物体内α-激酶1蛋白表达量或导致α-激酶1蛋白功能缺失来构建动物模型。
38.可以采用分子生物学领域中常用的方法来减少α-激酶1蛋白表达量或导致α-激酶1蛋白功能缺失。
39.例如通过基因编辑方法来敲除小鼠alpk1基因(gene id:71481;nc_000069.7)1-15号外显子至少一个外显子上的部分或全部序列,造成编码序列的移框突变或功能域序列的缺失,例如3号外显子的部分序列来使alpk1基因表达量降低,从而构建白内障动物模型。
40.本发明还提供α-激酶1在制备预防或治疗白内障的制品中的应用,所提供的制品可以是液体或固体制品,其中包含有alpk1蛋白酶本身、和/或能够促进alpk1基因表达的物质、和/或alpk1激活剂、和/或抑制alpk1蛋白降解的物质。所述的制品,为功能性食品或药品。
41.下面结合实施例和附图对本发明进行详细的描述。
42.实施例1:构建小鼠白内障模型
43.1、构建步骤
44.i.设计靶向小鼠alpk1基因(gene id:71481;gdna gene bank登录号为nc_000069.7)的3号外显子的grna,序列为ggcccttcgtgcctgaaaag(图1);
45.ii.体外转录guide rna和cas9 mrna;
46.iii.将guide rna和cas9 mrna显微注射进c57bl/6小鼠受精卵,并转移入小鼠体内,出生小鼠即为f0,经发育成熟后,得到发生基因突变的首建者小鼠;
47.首建者小鼠筛选鉴定方法:抽提尾静脉血基因组dna进行pcr扩增后进行sanger测序,筛选鉴定可导致移框突变的插入缺失突变基因型,获得3号外显子缺失gtgcctgaaaa(11bp)小鼠。
48.iv.将带有突变的首建者小鼠与野生型小鼠交配,得到基因突变的杂合子小鼠( /-)f1代;
49.v.将基因型相同的杂合子小鼠( /-)f1代相互交配,得到alpk1基因突变
(c.56080delgtgcctgaaaa)纯合子小鼠(-/-)f2代
50.2、alpk1基因敲除小鼠(alpk1-/-)基因型鉴定
51.采用琼脂糖凝胶电泳法和sanger测序法进行小鼠alpk1的基因型鉴定和序列分析。
52.i.琼脂糖凝胶电泳法:
53.1)基因组提取:剪取1.0~1.2cm鼠尾组织。依据dneasy血液及组织核酸提取试剂盒(qiagen,ref:69504)说明书步骤提取dna。
54.2)pcr扩增:pcr反应体系(10μl):supermix(bio-rad,ref:1725201)5μl,正向引物和反向引物各0.5μl,dna 1μl,ddh2o 3μl。pcr反应条件为:95℃预变性5min,95℃变性30s,56℃退火30s,72℃延伸45s,36个循环后72℃延伸7min。
55.3)基因分型pcr引物组:
56.wt引物:正向引物aattgattgccttctcgggtg,反向引物gtattgccacttttcaggcac;用于扩增野生型(wt)alpk1基因。
57.ko引物:正向引物aattgattgccttctcgggtg,反向引物ggcttgtttgtattgccacga;用于扩增突变型alpk1基因。
58.4)基因型鉴定:将pcr扩增产物进行琼脂糖凝胶电泳。以1
×
tae buffer为缓冲液,1.7%琼脂糖凝胶,恒压75v电泳约60min。将凝胶放入bio-rad凝胶成像仪中进行成像,参照下表对小鼠基因型进行判断。
59.表1:小鼠alpk1基因型判断标准表
[0060] wt引物扩增子长度ko引物扩增子长度alpk1
/
467bp无alpk1
/-467bp465bpalpk1-/-无465bp
[0061]
结果判定wt引物无扩增产物、而ko引物可扩增出465bp片段的小鼠为alpk1敲除纯合子(alpk1-/-)小鼠(图2)。
[0062]
ii.sanger测序
[0063]
委托公司对pcr扩增产物进行sanger测序,发现alpk1基因敲除小鼠(alpk1-/-)3号外显子缺失突变(c.56080delgtgcctgaaaa)(图3)。
[0064]
3、裂隙灯照相
[0065]
取alpk1-/-小鼠和同龄wt小鼠各15只,分别在2周龄和8周龄时进行裂隙灯检查。小鼠眼使用0.5%托吡卡胺散瞳后,用裂隙灯眼前节照相系统(s350,上海美沃精密仪器股份有限公司,杭州,中国)对小鼠眼前节进行拍照,检查小鼠晶状体浑浊情况,计算小鼠白内障发病率(发病率=单眼或双眼发病小鼠数/总小鼠数
×
100%)。
[0066]
结果表明(图4),alpk1-/-小鼠2周龄时20%发生核性白内障,表现为晶状体核区出现明显的“y”型缝,且发病率呈现增龄性变化。8周龄时,白内障发病率上升为73%,且其中部分小鼠晶状体皮质区出现浑浊并逐渐加重,形成核性与皮质性的混合型白内障。同期平行观察的同龄野生型小鼠(alpk1
/
)未见白内障病变。
[0067]
实施例2:小鼠晶状体组织切片苏木素-伊红染色分析
[0068]
1、石蜡切片
[0069]
取实施例1构建的8周龄白内障模型小鼠(alpk1-/-)和同龄c57bl/6小鼠(alpk1
/
),麻醉后将小鼠眼球突出,使用眼科镊伸入眼球后部,沿视神经走向迅速提拉摘取眼球,置于fas眼球固定液(servicebio,ref:g1109)中固定24h以上后,依次用梯度酒精进行脱水再浸蜡,于包埋机内进行包埋。将包埋好的蜡块切片(4μm),于60℃烘箱内烤片。
[0070]
2、苏木素-伊红染色
[0071]
i.石蜡切片脱蜡至水后,用苏木素染液染3-5min,然后依次水洗、分化、再水洗、返蓝、再水洗。
[0072]
ii.将切片依次放入85%、95%酒精脱水各5min后,用伊红染液染色5min
[0073]
iii.将切片用无水乙醇重复处理3次进行脱水,再用二甲苯重复处理2次进行透明后,滴加中性树胶封片,显微镜下观察并采集图像。
[0074]
结果表明(图5),野生型小鼠(alpk1
/
)晶状体上皮细胞排列整齐,纤维层形态完整,排列紧密有序。与野生型小鼠相比较,模型小鼠(alpk1-/-)晶状体上皮细胞整体数量减少、排列疏松、间距增宽;晶状体纤维整体排列疏松紊乱,有大量空泡,导致上皮细胞与纤维细胞间的紧密联系被破坏;赤道部有核细胞数量明显减少。
[0075]
实施例3:小鼠晶状体alpk1表达情况分析
[0076]
1、石蜡切片
[0077]
取实施例1构建的8周龄白内障模型小鼠(alpk1-/-)和同龄c57bl/6小鼠(alpk1
/
),参照实施例2方法,取眼球固定、包埋、切片。
[0078]
2、免疫荧光染色
[0079]
石蜡切片脱蜡至水后,用0.3%triton破膜30min,再抗原修复10min,自然冷却后滴加5%牛血清白蛋白溶液37℃封闭1h,再滴加alpk1抗体溶液(huabio,ref:er65387,1:100),4℃孵育过夜。洗涤后,滴加异硫氰酸荧光素标记的驴抗兔igg溶液(jackson immunoresearch,ref:711095152,1:100),37℃孵育1h。滴加抗荧光淬灭剂封片,于荧光显微镜下观察并采集图像。
[0080]
结果表明,野生型小鼠(alpk1
/
)晶状体前部上皮细胞有明显的alpk1表达,模型小鼠(alpk1-/-)晶状体前部上皮细胞的alpk1表达缺失(图6)。
[0081]
另外,在原代培养的c57bl/6小鼠(alpk1
/
)晶状体上皮细胞中也已检测到了alpk1的胞浆表达。
[0082]
实施例4:alpk1过表达慢病毒对模型小鼠白内障的治疗效果
[0083]
取实施例1构建的2周龄模型小鼠(alpk1-/-),用裂隙灯眼前节照相系统检查小鼠白内障发生情况,选取其中尚未发生白内障的小鼠分成两组,每组小鼠12只进行实验。
[0084]
4%水合氯醛(0.05ml/10g)麻醉后,将两组小鼠右眼使用0.5%托吡卡胺散瞳,在眼科显微镜下使用带有33g针头的hamilton玻璃注射器,分别进行前房注射alpk1过表达慢病毒(lv-alpk1,上海吉凯基因医学科技股份有限公司)和阴性对照慢病毒(lv-gfp),注射病毒量为3
×
10^5tu。注射后,局部给予氧氟沙星眼药膏以预防眼部感染。两组小鼠左眼均不做处理。分别在注射病毒3周(小鼠5周龄)和6周(小鼠8周龄)后,同前检查小鼠左眼和右眼的白内障发生情况,计算白内障发病率:右眼白内障发病率=右眼发病小鼠数/总小鼠数
×
100%;左眼白内障发病率=左眼发病小鼠数/总小鼠数
×
100%。实验结束后,参照实施例2方法,取右眼眼球固定、包埋、切片,检测两组小鼠右眼晶状体中alpk1表达水平。采用
spss26.0软件卡方检验两组小鼠右眼白内障发病率的差异,*p《0.05为差异有统计学意义。
[0085]
结果表明,右眼前房注射lv-alpk1慢病毒能显著增加模型小鼠(alpk1-/-)晶状体前部上皮细胞中alpk1蛋白表达水平(图7),显著降低模型小鼠(alpk1-/-)白内障发病率(图8和图9)。在右眼注射lv-alpk1慢病毒3周(小鼠5周龄)和6周(小鼠8周龄)后,模型小鼠(alpk1-/-)右眼均未出现白内障;而注射阴性对照病毒(lv-gfp)的模型小鼠在3周(小鼠5周龄)和6周后(小鼠8周龄)的右眼白内障发病率分别为33.33%和46.67%,发病率与未处理左眼无显著差异,且8周龄时均已进展为核性与皮质性的混合型白内障。
[0086]
上述结果表明,在alpk1基因敲除小鼠中恢复alpk1蛋白表达就可以有效降低白内障的发病率。结果表明alpk1基因的表达与白内障之间存在着关联。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。
