2005 012874.2,de 10 2005 012873.4,jp2006160733,wo2006071752,wo2006065826,wo2006078676,wo2006073167,wo2006068163,wo2006090915,wo2006104356,wo2006127530,wo2006111261,wo2007015767,wo2007024993,和wo2007029086等中公开的化合物。
8.磺酰脲类药物通过增加胰腺β细胞的胰岛素分泌发挥作用,主要是通过关闭胰腺β细胞膜上atp敏感k 通道,使细胞去极化,导致细胞内钙离子升高,并增加胰岛素颗粒与细胞膜的融合,进而导致成熟胰岛素分泌增加。该类别的药物包括格列苯脲(格列本脲)、格列波脲、格列齐特、格列吡嗪、格列喹酮、格列派特和格列吡脲,以及早期的其他磺酰脲类药物(如醋磺己脲、氮磺丙脲、氯丙酰胺、格列环脲(甲磺环己脲)等)。美国专利号4696815、4346709、5518730、5100669、6875793、5091190和5024843等中描述了含有上述任何磺酰脲的药物组合物。
9.美格替尼是另一类抗糖尿病药物,其作用机制与磺脲类药物相似,但结合亲和力较弱,解离速度较快。这类药物包括瑞格列奈、那格列奈和米格列奈,其描述见ep0147850a2、ep0207331a1、ep196222、ep526171和us 5488510等。副作用包括体重增加和低血糖。
10.噻唑烷二酮类,通常缩写为tzd,是一类杂环化合物,主要通过激动过氧化物酶体一增殖体活化受体(ppar)来降低胰岛素抵抗,可以调节特定基因的转录,从而增加脂肪酸在脂肪细胞中的储存,从而使身体更好地利用胰岛素和葡萄糖。该类别包括吡格列酮、罗格列酮和洛贝格列酮,其已在专利申请号ep0306228、ep0008203、ep0508740、wo92/18501、wo93/02079和美国专利号5104888和5478852中描述。与tzd相关的常见副作用包括水肿、体重增加、黄斑水肿和心力衰竭。此外,当与其他抗糖尿病药物联合使用时,它们可能会导致低血糖,并降低红细胞压积和血红蛋白水平。骨折风险增加是tzd相关的另一个副作用。
11.sglt-2抑制剂是一类可抑制肾脏对葡萄糖的再吸收的药物,从而降低血糖。sglt2抑制剂主要通过抑制钠-葡萄糖转运蛋白2(sglt2)而发挥作用。
12.该药物类别的药剂包括卡格列净、艾格列净、恩格列净、厄格列净、伊格列净、托格列净、达格列净、鲁格列净、瑞格列净、舍格列净等,以及其药学上可接受的盐。在wo2007128749、wo2011117295、wo2005012326、wo2009035969、wo2005092877、wo2006120208、wo2011039108、wo2003099836、wo2007140191、wo2008013280、wo2004080990、wo2004007517、wo200909035969、wo2005092877、wo2006120208、wo2011039108、wo200309836、wo2007140191、wo2008013280、wo2004080790、wo2004007517、wo2005012326和wo2007114475等中描述了上述sglt-2抑制化合物及其药学上可接受的盐、晶型或制剂等。它们作为单一成分药品提供,并与二甲双胍等其他糖尿病药物联合使用。副作用包括尿路感染和低血压。
13.α-葡萄糖苷酶抑制剂是一类抗糖尿病药物,其作用是阻止碳水化合物的消化,从而降低膳食碳水化合物对血糖的影响。这些药物实质上是糖类,作为消化碳水化合物所需的小肠膜结合α-葡萄糖苷酶的竞争性抑制剂。例如在ep0638317a1、cn102872062a、wo2005/030698等中公开了这类药物成分包括阿卡波糖、米格列醇和伏格列波糖,以及这些化学品的描述以及其药学上可接受的盐、制剂或晶型。常见的副作用包括胃肠道副作用,如肠胃胀气和腹泻。
14.对于上述任何抗糖尿病药物类别,当将感兴趣的药物施用于患者时,制剂对于传递其理想的药效至关重要。这些理想的药学效果可以参考感兴趣的药物在人体内的药学动力学(pk)和药学动力学(pd)曲线。
15.在一个显著的例子中,二甲双胍盐,尤其是盐酸二甲双胍,通常是高度水溶性的,如果以不受控制的方式给药,经常会引起胃肠道(gi)副作用,例如腹泻、恶心和呕吐,其副作用的发生超过所有其他成分的降糖药,同时,鉴于其药代动力学(pk)和药效学(pd)特征,其药物作用的持续时间也有限。尽管这些胃肠道副作用会随着时间的推移而减小,以及可以通过在进餐时服用二甲双胍或谨慎调整剂量来降低胃肠道副作用,但它们可能会削弱患者的依从性,甚至导致某些患者停止治疗。
16.鉴于这些问题,包括美国专利号4915952、5328942、5451409、5945125、6090411、6210710、6217903、6488962和6723340、6866866和8323692,以及国际专利申请号wo1996026718a2和wo1997018814a1在内的多个专利文件公开了控释、缓释或长效释放的盐酸二甲双胍的缓释药物剂型。通过限制周围胃液通过基质扩散并到达药物、溶解药物并与溶解药物再次扩散的速率,或通过使用缓慢溶蚀的基质,实现这种缓释或控释的释放,从而将新鲜药物持续暴露在周围液体中。因此,在由胃和上消化道(gi)组成的体内的至少一部分之内,该药物实现了一个可控的释放,从而在12~24小时期间,向需要此类治疗的人类受试者提供连续且非脉动的盐酸二甲双胍治疗水平。
17.类似地,美国专利号6699871、7879848、8093236、8404727、8628799、9181256和国际专利申请号wo201213105a1、wo201512887a1公开了ddp-4抑制剂的药物制剂,如西格列汀、沙格列汀、美格列汀等,也通常考虑了这些dpp-4抑制剂在人体中的药代动力学和药效学图谱。
18.类似地,关于sglt2抑制剂,专利申请号us20150272977a1、us20170258761a1、us20170056365a1、cn106606489a、us20200179328a1和kr200047466a等公开了某些sglt2抑制剂的药物制剂,例如卡格列净、达格列净或恩格列净,也可以考虑它们在人类或其他动物中的药代动力学或药效学图谱。
19.上述的其他类型或级别的抗糖尿病药物的不同制剂,例如磺酰脲类药物、α-葡萄糖苷酶抑制剂、美格替尼类药物和噻唑烷二酮类药物,类似地,考虑到了这些药物的药代动力学或药效学图谱,也已在专利文件中描述,其列表在此略去
20.对于许多2型糖尿病患者,已经观察到,如果单独使用上述疗法作为抗糖尿病治疗,在长期治疗期间无法充分控制血糖。因此,需要一种包含两种或两种以上口服降糖药的联合治疗,这种药物可以发挥相加、互补和协同降糖作用,从而更好地控制这些2型糖尿病患者的血糖。然而,两种或两种以上口服降糖药的联合处方可能会导致治疗方案复杂,因此许多患者难以遵循。
21.因此,将两种或两种以上的口服降糖药组合成单独的一片,提供了一种潜在的联合给药的治疗方法,而不会增加患者日常治疗方案的复杂性。一些专利或专利申请记录了这种情况。
22.美国专利号7785627公开了一种药物剂型,其包含双胍(例如,盐酸二甲双胍或其他二甲双胍盐)或其医药上可接受的盐与噻唑烷二酮(tzd)衍生物的组合。美国专利号9616028公开了双层片制剂,其包含二甲双胍配方作为第一层,sglt-2抑制剂配方作为第二
层。国际专利申请号wo20131967a1公开了盐酸二甲双胍(存在于缓释片芯中)与dpp-4抑制剂或sglt-2抑制剂(存在于速释层中)中至少一种的组合。
23.二甲双胍和/或其盐制剂与dpp-4抑制剂(例如西格列汀、维达列汀、沙格列汀、地那列汀等)及其盐制剂,用于治疗2型糖尿病的药物组合物的组合,已被广泛研究,并已在美国专利号9155705、美国专利申请号20100330177a1中公开,国际专利申请号:wo2007078726a2、wo2009099734a1、wo2009111200a1、wo2011098483a1、wo2013110085a1、wo2014167437a1和wo2014170770a1。
24.值得注意的是,在临床方面,使用上述任何两种抗糖尿病药物的联合疗法已通过全球监管机构的批准。例如,在美国和欧洲,西格列汀与二甲双胍、磺酰脲类药物、噻唑烷二酮类药物联合使用,或与二甲双胍和磺酰脲类药物或二甲双胍和噻唑烷二酮类药物三联使用。近年来,西格列汀和二甲双胍的固定组合也已问世。2010年,fda和ema批准了西格列汀与胰岛素联合用药。2007年,在美国和欧洲,沙格列汀可与其他口服抗糖尿病药物联合使用,如二甲双胍、磺脲类药物和噻唑烷二酮类药物。
25.然而,用于联合治疗的许多现有药物组合物相关的一个问题是,在药物制剂中包括两种或两种以上的口服降糖药的每一种常具有不同的药物动力学(pk)和药物动力学(pd)特征,这些不同药物的制剂没有根据其不同的pk/pd曲线进行优化。因此,这些现有制剂通常不会发挥最佳的药效。
26.一方面,口服包含第一种有效成分和第二种有效成分的一种此类药物组合物后,在人体内,第一药物成分的代谢速度可能比第二药物成分快得多,因此,这两种成分不会同时或互补地发挥降血糖作用,从而形成协同效应和产生最大的降糖效果。
27.另一方面,不同类别的抗糖尿病药物可能因各自的药物动力学(pd)特征,从而产生不良的药物相互作用。例如,西格列汀(januvia)和磺脲类药物联用会增加低血糖风险,而由于二甲双胍不会直接刺激胰岛素分泌,因此低血糖风险可低于其他口服抗糖尿病药物。
28.在现有技术中,许多技术已被用于提供控释和缓释药物剂型,以维持药物的治疗血清水平,并最大限度地减少因患者缺乏依从性而导致漏服药物的影响,并通过减少药物倾泻在胃肠道的可能性,或者减少药物在胃肠道系统表面的过度暴露来减小副作用。
29.尽管对控释或缓释组合物和尤其在渗透泵剂型进行了大量研究,但在抗高血糖药物领域进行的研究很少,尤其是当两种抗高血糖药物联合时,可产生更好的临床效果;至少一种降血糖药物可以在控释或缓释组合物上,尤其是渗透泵剂型上,以增加可能的临床疗效并减少副作用。
技术实现要素:
30.在第一方面,本发明提供了一种用于治疗受试者糖尿病的药物组合物的口服剂型。
31.该口服剂型包括片芯部分、外部部分和控释膜。片芯部分包含至少一种第一抗糖尿病剂,外部部分包含至少一种第二抗糖尿病剂。每种第一抗糖尿病剂和第二抗糖尿病剂以治疗有效量存在。控释膜包裹了片芯部分,并夹在片芯部分和外部部分之间。所述控释膜具有至少一个通道,当所述该口服剂型处于水环境中时,例如在所述受试者的胃肠道中,其
通道被配置成允许所述至少一种第一抗糖尿病剂通过所述通道从所述片芯部分释放。该口服剂型配置为实现至少一种第一抗糖尿病剂的控释释放,使得在单剂量口服给药时,在给药后约7.5至15小时内,该口服剂型向受试者提供所述至少一种第一抗糖尿病剂的最大血浆浓度。
32.在药物组合物的口服剂型的某些实施例中,第一种抗糖尿病剂可选约占片芯部分重量70-90%。在此,片芯部分中的至少一种第一抗糖尿病剂可包含双胍(例如二甲双胍)或其药学上可接受的盐。因此,片芯中可进一步包含至少一种颗粒粘合剂聚合物。至少一种粘合剂聚合物的每一种可选自羟丙甲基纤维素(hpmc)、羟丙基纤维素(hpc)、羟乙基纤维素(hec)、聚(乙烯)氧化物(peo)、聚乙烯醇(pva)、聚维酮(pvp)和共聚维酮。也可使用上述粘合剂的混合物。优选的粘合剂是水溶性的,例如具有平均分子量25000~3000000的聚乙烯吡咯烷酮。粘合剂约占0%~40%的片芯总重量,优选约3%~15%的片芯总重量。片芯应包括至少一种渗透/吸收促进剂。吸收促进剂可以是本领域公知的任何类型的吸收促进剂,例如脂肪酸、表面活性剂、螯合剂、胆盐或其混合物。一些优选吸收促进剂的实例为脂肪酸,例如癸酸、油酸及其单甘酯;表面活性剂,例如十二烷基硫酸钠、牛磺胆酸钠和聚山梨酯80;螯合剂,例如柠檬酸,植酸、乙二胺四乙酸(edta)和乙二醇大(b-氨基乙醚
–
n,n,n,n-四乙酸(egta))。所述片芯包含基于所述片芯的总重量的约0%~20%的吸收促进剂,且最优选地包含所述片芯的总重量的约2%~10%。在该实施例中,包含抗高血糖药物、粘合剂(优选药学上可接受的水溶性聚合物)和吸收促进剂,所述片芯优选通过将所述片芯成分湿法制粒,并在旋转压力机上压缩加入润滑剂的所述颗粒制备片芯。也可通过将片芯成分干法制粒,并通过压缩加入润滑剂的上述颗粒制备片芯,或通过直压来形成片芯。在片芯中也可包括其他常见的赋形剂,例如润滑剂、颜料或染料。
33.优选地,片芯部分中的至少一种第一抗糖尿病剂可包含二甲双胍或其药学上可接受的盐。第一种抗糖尿病剂的一个优选实例是盐酸二甲双胍,其可具有约250-2000mg的剂型。例如,口服剂型中提供的口服剂型可包括250mg、500mg、750mg、1000mg或2000mg,且优选500mg、750mg和1000mg的盐酸二甲双胍。
34.可选地,在口服剂型中,其片芯部分中的至少一种第一抗糖尿病剂包含盐酸二甲双胍,在usp ii型仪器中,以约37℃、约50rpm的速度在900ml的ph 6.8介质条件下测试,在该口服剂型与介质接触时盐酸二甲双胍呈现以下溶解曲线:在约2小时释放少于30%的盐酸二甲双胍;在约4小时释放10-60%的盐酸二甲双胍;在约8小时释放30-92%的盐酸二甲双胍;盐酸二甲双胍在大约16小时的释放量不低于55%。
35.可选地,在该口服剂型中,其片芯部分中的至少一种第一抗糖尿病剂包含盐酸二甲双胍,该口服剂型被配置为提供二甲双胍的平均最大血浆浓度(cmax)为约0.5*x ng/ml~1.6*x ng/ml,基于包含x mg盐酸二甲双胍的口服剂型的给药,其中x在约250-1000的范围内。在某些实施例中,该口服控释剂型包含1000mg盐酸二甲双胍,因此该口服剂型被配置为每天服用一次1000mg剂量的二甲双胍,提供约500-1600ng/ml的平均最大血浆药物浓度(cmax)。在另一个实施例中,该口服控释剂型包含500mg盐酸二甲双胍,该口服剂型被配置为每天服用一次500mg剂量的二甲双胍,提供约250-800ng/ml的平均最大血浆药物浓度(cmax)。
36.可选地,在该口服制剂中,其片芯部分中的至少一种第一抗糖尿病剂包含盐酸二
甲双胍,该口服制剂被配置为,基于口服含有y mg盐酸二甲双胍的口服剂型,可提供约7*y hr*ng/ml~16*y hr*ng/ml的平均最大auc
0-t
,其中y在约250-1000的范围内。在某些实施例中,该口服控释剂型包含1000mg盐酸二甲双胍,基于每天服用一次1000mg二甲双胍,其提供约7000~16000ng.hr/ml的平均auc
0-24hr
。在另一个实施例中,该口服控释剂型包含500mg盐酸二甲双胍,基于每天服用一次500mg二甲双胍的剂量,其提供约3500-8000ng.hr/ml的平均auc
0-24hr
。
37.在如上所述的口服剂型的任何实施例中,所述控释膜可包含至少一种控释聚合物。所述至少一种控释聚合物中的每一种选自醋酸纤维素或醋酸纤维素邻苯二甲酸酯。根据一些实施例,在此药物组合物中,该口服剂型的控释膜的至少一种控制聚合物可为纤维素酯、纤维素二酯、纤维素三酯、纤维素醚、醋酸纤维素邻苯二甲酸酯、醋酸纤维素、二醋酸纤维素、三醋酸纤维素、醋酸纤维素丙酸酯和醋酸纤维素丁酸酯。其他合适的聚合物在专利号为3845770、3916899、4008719、4036228和411210的美国专利中进行了描述,通过引用并入本文。最优选的膜材料选自ca-320s、ca-398-3、ca398-6、ca398-10、ca398-30、ca398-60s。在一些特定实施例中,至少一种控释聚合物包含醋酸纤维素-398-10。根据该药物组合物的口服剂型的一些实施例,控释膜中至少一种控释聚合物的相对量可为控释膜重量的约1%至100%。在此任选地,至少一种控释聚合物的相对量可约为片剂重量的1.5%至5.0%。根据该药物组合物的口服剂型的一些实施例,控释膜还包括至少一种增塑剂,例如聚乙二醇,其相对量约为控释膜重量的0.1-40%。在此任选地,所述至少一种聚乙二醇可包含聚乙二醇(peg)3350,其被配置为具占约0.1-40%(按重量计)控释膜的相对量。
38.在如上所述的该口服剂型的任何实施例中,所述口服剂型的外部部分包含的至少一种第二抗糖尿病剂可包含至少一种ddp-4抑制剂或其药学上可接受的盐。
39.根据某些实施例,所述至少一种ddp-4抑制剂包含西格列汀、沙格列汀、利格列汀、阿洛列汀、维达列汀、吉格列汀、阿拉格列汀、特力利汀、曲格列汀、奥格列汀、依格列汀、戈格列汀、杜格列汀或小檗碱中的一种或多种。
40.在此优选地,所述至少一种第二抗糖尿病剂包含磷酸西格列汀,其具有约25-200mg的剂型,且具有立即释放制剂。例如,该口服剂型中提供的口服剂量可包括25mg、50mg、100mg或200mg,且优选50mg或100mg磷酸西格列汀。
41.可选地,该口服剂型外部部分的至少一种第二抗糖尿病剂包含磷酸西格列汀,当该口服剂型在usp i型仪器中测试时,在约37℃、约75rpm、900ml的0.025mol/ml氯化钠溶液中,磷酸西格列汀被配置成表现出这样的溶出曲线:在该口服剂型与介质接触时,在10分钟释放超过25%的磷酸西格列汀。
42.进一步优选地,磷酸西格列汀表现出这样的溶出曲线:该口服剂型与介质接触后,在60分钟释放超过80%的磷酸西格列汀。
43.根据该口服剂型的某些实施例,所述至少一种第二抗糖尿病剂包括以下中的一种或多种:
44.磺酰脲类或其药学上可接受的盐;
45.美格替尼类或其药学上可接受的盐;
46.噻唑烷二酮类或其药学上可接受的盐;
47.钠-葡萄糖转运蛋白2(sglt2)抑制剂或其药学上可接受的盐;或
48.α-葡萄糖苷酶抑制剂或其药学上可接受的盐。
49.优选地,所述至少一种第二抗糖尿病剂具有速释制剂并且包含以下之一:
50.达格列净,剂量强度约为2.5-10mg;
51.恩格列净,剂量强度约为2.5-25mg;
52.格列吡嗪,剂量强度约为1.25-10mg;
53.格列本脲,剂量强度约为1.25-10mg;
54.瑞格列奈,剂量强度约为0.5-5mg;
55.那格列奈,剂量强度约为30-60mg;
56.吡格列酮,剂量强度约为15-45mg;
57.罗格列酮,剂量强度约为1-4mg;
58.阿卡波糖,剂量强度约为12.5-100mg;或
59.米格列醇,剂量强度约为12.5-100mg。
60.根据某些实施例,该口服剂型还包含内层封膜,其夹在片芯部分和控释膜之间,被配置为给封装在其内的片芯部分提供保护性的包衣。
61.根据某些实施例,该口服剂型还包含包被在外部部分的外表面的外层封膜,其被配置为封装在其内的外部部分提供保护性的包衣。
62.根据某些实施例,该口服剂型还包含夹在片芯部分和控释膜之间的内层封膜和包被外部部分的外表面的外层封膜。
63.在上述该口服剂型的实施例中,内层封膜或外层封膜中的至少一种包含至少一种成膜聚合物,每种聚合物选自羟丙甲纤维素、羟丙基甲基纤维素(hpmc)、羟丙基纤维素(hpc)、羧甲基纤维素、聚乙烯吡咯烷酮(pvp),聚乙烯醇和聚乙二醇(peg)。
64.在上述该口服剂型的实施例中,内层封膜或外层封膜的比例约为该口服剂型重量的0.4%~40%,优选2%-10%。
65.在该口服剂型的上述实施例中,内层封膜、外层封膜或两者,可进一步包含增塑剂、或颜料、或分散剂、或抗氧化剂中的至少一种。
66.根据药物组合物的该口服剂型的一些实施例,在膜包衣片剂的中间,机械地或光学地产生至少一个通道。
67.如本文所用,术语通路包括孔、孔口、钻孔、洞、薄弱区或易蚀元件,例如明胶塞,其腐蚀后以形成用于从该剂型中释放抗高血糖药物的渗透通路。在美国专利中可找到通道的详细描述,诸如美国专利3,845,770、3,916,899、4,034,758、4,063,064、4,077,407、4.088,864、4,783,337和5.071,607等(其公开内容通过引用并入本文)。在某些实施例中,通道是通过激光钻孔形成的。在本发明的优选实施例中,该剂型在每个片剂的每一侧包含一个通道,以提供所需的制剂的药代动力学参数。
68.在上述该口服剂型的任何实施例中,可以有两个通道,其可以布置在控释膜的每一侧。优选地,两个通道中的每一个都可以布置在控释膜每侧的中心的
±
5mm内,优选地在
±
2mm内。每个通道可具有大约0.30-2.00mm的直径,优选0.40-0.60mm。每个通道可具有大约0.10~2.00mm的深度,优选0.30~1.40mm。
69.在上述药物组合物的口服剂型的任何实施例中,受试者可以是患有糖尿病的人或哺乳动物。
70.在第二方面,本发明还提供了一种制备药物组合物的口服剂型的方法。该口服剂型可以是如上文第一方面所述的任一实施例的组合物的口服剂型。
71.该方法可以包括以下步骤(a-c):
72.(a)制备包含至少一种第一抗糖尿病剂的片芯片芯部分;
73.(b)用控释膜包覆片芯部分,其中控释膜设置有至少一个通道,该通道被配置为允许所述至少一种第一抗糖尿病剂通过其释放出片芯部分;
74.(c)用包含至少一种第二抗糖尿病剂的外部部分包覆所述控释膜。
75.可选地,该方法包括步骤(a)和步骤(b)之间的步骤,包括:
76.用内层封膜包覆片芯部分,其中内层封膜被配置为封装在其内的片芯部分提供保护涂层。
77.可选地,该方法包括在步骤(c)之后的步骤,包括:用外层封膜包覆外部部分,其中外层封膜被配置为为封装在其中的外部部分提供保护涂层。
78.在该方法的步骤(a)中,包含至少一种第一抗糖尿病剂的片芯部分,可通过以下子步骤进行制备:(1)制粒-通过干法制粒、湿法制粒或流化床制粒;(2)整粒;(3)混合;(4)压片。
79.可选地,在获得片芯部分的子步骤(4)之后,步骤(a)还包括子步骤(5)用密封包衣溶液对片芯部分进行包衣,其中所述密封包衣溶液可由羟丙甲纤维素或羟丙基纤维素和聚乙二醇或其他合适的水溶性材料配制而成,首先溶解羟丙甲纤维素或羟丙基纤维素和聚乙二醇,然后使用盘式包衣机将包衣液喷涂到片芯上。封膜占该口服剂型重量的约2%-10%。在该方法的步骤(b)中,控释膜可包含至少一种控释的聚合物,每种聚合物任选自醋酸纤维素或醋酸邻苯二甲酸纤维素聚合物;然后可在控释膜中产生至少一个通道。
80.根据该方法的一些实施例,用控释膜涂覆片芯部分的步骤(b)包括以下子步骤:(1)制备喷雾液,其中喷雾液包括ca-398-10和peg3350;以及(2)用所述喷雾液涂覆所述片芯部分,从而获得包衣的片芯;以及(3)固化包衣的片芯。
81.在该方法的上述实施例中,固化包衣过的片芯的上述子步骤(3)包括:在50℃下固化包衣过的片芯约一小时。
82.在某些实施例中,通过激光钻孔形成所述至少一个通道中的每一个。在本发明的优选实施例中,该口服剂型在每片片剂的每一侧上包含一个通道,以提供所需的制剂药代动力学参数,孔口应在片剂中部
±
2mm范围内,孔口直径应在0.40~.60mm之间,孔口深度应在0.30~1.40mm之间。
83.在该方法的某些实施例中,在步骤(c)中的外部部分中的至少一种第二抗糖尿病剂,通过混合所有辅料(高岭土除外),使用合适的均质机将至少一种第二抗糖尿病剂加入所需量的纯净水中,直至固体溶解或分散,可制备至少一种第二抗糖尿病剂的混悬液。然后可以将预筛分的(#60目)高岭土粉末加入到至少一种第二抗糖尿病剂包衣混悬液中,并用合适的混合器和刀片混合,直到粉末均匀分散在包衣混悬液中。
84.在该方法的某些实施例中,可制备步骤(c)中外部部分中的至少一种第二抗糖尿病剂,可通过使用合适的均质机,在所需量的纯化水中,将所有赋形剂和第二抗糖尿病剂混合直到固体溶解溶解或分散,来制备至少一种第二抗糖尿病剂的溶液或混悬液。然后,将薄膜包衣片剂装入一个合适的穿孔侧通风包衣盘中,该包衣盘带有挡板,挡板上装有单喷枪
或多喷枪,以产生覆盖片剂床整个宽度的喷雾;将加热的未包衣片剂的平均重量确定为初始起始重量;第二种抗糖尿病涂层悬浮液或溶液可以以合适的喷涂速率和雾化压力喷涂到片剂床上;在监测片剂重量的同时继续喷洒,直到获得所需的增重。
85.在该方法的某些实施例中,其中来自口服剂量的外部部分进一步涂覆有外层封膜,可通过以下步骤制备外层封膜。简单地说,使用合适的均质器,在所需量的纯化水中将所有赋形剂混合,直到固体溶解,来制备外层封涂层溶液。
86.涂有至少一种第二抗糖尿病剂(即外部部分)的片剂可装入适当的穿孔侧通风包衣盘中,该包衣盘中带有挡板,挡板装有单喷枪或多喷枪,以产生覆盖整个片剂床宽度的喷雾;将加热后的未包衣片剂的平均重量确定为初始起始重量;将密封涂层溶液以合适的喷涂速率和雾化压力喷涂到片剂床上;在监测片剂重量的同时继续喷洒,直到获得所需的增重。
87.在本发明中,术语“片剂”旨在包括各种形状和大小的压缩药物剂型,无论是包衣还是未包衣。
88.本文所使用的术语“药学上可接受”是指在合理的医学判断范围内,适合与人类和动物组织接触使用且没有过度毒性、刺激性、过敏反应或任何其他问题或并发症的化合物、材料、组合物和/或剂型,与合理的收益/风险比相称。
89.本文中使用的术语“药物组合物”或“剂型”可以互换使用,并被定义为包括药物或活性药物剂量的药物组合物、制剂或系统。药物组合物或剂型可通过本领域技术人员已知的任何给药途径给药,包括但不限于口服、肠外、肺、直肠、阴道、鼻和局部给药。
90.本文中使用的术语“剂型”是指本发明的至少一种单位剂型(例如,对于每天一次的单次给药,抗高血糖剂的每日剂量可包含在本发明的2种单位剂型中)。
91.本文中使用的术语“口服剂型”是指通过口腔给药、口腔粘膜吸收和/或吞咽后通过胃肠道吸收的剂型。此类口服剂型包括但不限于溶液、糖浆、悬浮液、乳剂、凝胶、粉末、颗粒、胶囊、片剂、口腔剂型和舌下剂型。
92.此处使用的术语“治疗有效”是指当人类患者以一天一次的方式口服该控释剂型时,一种抗糖尿病药的量可以将血糖水平降低至与速释参考标准(例如,janumet tm)大致相同的量或更多。
93.就本发明而言,术语“速释”(简称“ir”)被定义为在给药后的短时间内将活性药物内容物从口服剂型释放到胃肠道,并且通常在给药后不久血浆药物水平也达到峰值。因此,术语“速释剂型”指表现出活性药物“速释”的剂型,并因此提供活性药物基本上立即释放的速率。
94.在整个公开中,提到的术语“控释”(简称“cr”)被认为可以与术语“缓释”(简称“er”)、“延长释放”(简称“pr”)、“持续释放”(简称“sr”)互换,并且就本发明而言,定义为与速释剂型相比,活性药物在延长的时间段(例如从约12小时到约24小时)内的释放,以使活性药物的血浆浓度在治疗水平上保持更长的时间,而且治疗效果会持续很长一段时间。因此,术语“控释剂型”、“速释剂型”、“延长释放剂型”和/或“缓释剂型”被称为表现出“控释”、“速释”、“延长释放”的剂型,和/或活性药物的“持续释放”。
95.在整个公开内容中,fortamet的不同制剂被称为盐酸二甲双胍的缓释剂型,该剂型已在andrx labs和其他公司注册,并已在美国专利号6866866中描述。janumet xr是指西
格列汀和二甲双胍的一种剂型,由默克公司生产,已在美国专利号7759366中描述。
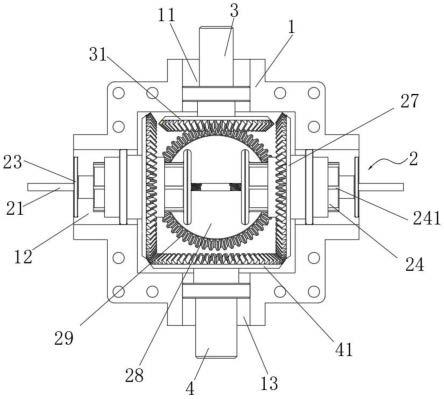
96.在整个公开内容中,在数字后面的相对术语“大约”、“几乎”、“左右”等被称为对在指示数字的5%以内的实际数字的描述。在一个说明性示例中,“大约1.00”可以解释为实际数字在0.95和1.05之间。
附图说明
97.图1是根据本发明一些实施例的药物组合物的剂型的示意图;
98.图2a和图2b分别显示了样品口服剂型(即本发明实施例1中提供的100/1000mg西格列汀二甲双胍控释片制剂)的盐酸二甲双胍和磷酸西格列汀的溶出曲线;
99.图3a和图3b分别显示了在空腹状态下的受试者中,参考制剂(“参考”)和试验制剂(“试验”,即本公开实施例1中提供的100/1000mg西格列汀二甲双胍控释片制剂)的盐酸二甲双胍平均血浆浓度与时间的线性和半对数曲线图;和
100.图4a和4b分别显示了在饱腹状态的受试者中,参考制剂(简称“参考”)和试验制剂(简称“试验”,即本公开的实施例1中提供的100/1000mg西格列汀二甲双胍控释片制剂)盐酸二甲双胍平均血浆浓度与时间的线性和半对数图。
具体实施方式
101.在下文中,结合本文所公开的各个实施例的上述附图,对本发明各个实施例的技术方案进行清楚、易懂的描述。需要说明的是,所描述的实施例仅代表本发明实施例的一部分,而非全部。基于本发明中的实施例,本领域普通技术人员可以获得的所有其他实施例,都属于本发明保护的范围。
102.在第一方面中,本发明提供了一种药物组合物的剂型,其专门用于治疗患有糖尿病或糖尿病前期的受试者。
103.在此,剂型优选为受试者口服的口服剂型,且受试者可以是人类,但不限于人类,并且还可以是另一种产生胰岛素的哺乳动物,例如猴子、黑猩猩、狗、猫等。
104.在本文公开的剂型中,药物组合物包含两种或两种以上的抗糖尿病剂,每种抗糖尿病剂具有不同的作用机制,并且共同使用时在血糖控制中具有附加、补充和/或协同效应。根据一些实施例,两种或多种抗糖尿病剂中的一种包含双胍或其药学上可接受的盐。优选地,双胍可以是二甲双胍,或其药学上可接受的盐(例如盐酸二甲双胍)。除双胍外,该药物组合物的口服剂型中的两种或多种抗糖尿病剂还包括一种或多种其他类型的抗糖尿病药物,例如磺酰脲类、美格列奈、噻唑烷二酮、dpp-4抑制剂、钠-葡萄糖转运蛋白2(sglt2)抑制剂或α-葡萄糖苷酶抑制剂等。
105.在该药物组合物的剂型中,两种或两种以上抗糖尿病剂中的每一种可进一步配置为具有经优化的剂量和/或剂型,使得当在受试者中口服该剂型时,两种或两种以上降糖药可以互补和协同地发挥各自的降糖作用,从而实现对受试者的最佳治疗效果。换言之,在剂型中分别优化所含两种或两种以上抗糖尿病药物的剂量和/或配方,以便在受试者服用药物组合物的该剂型后,以允许它们各自的机制作用的最大协同互补。根据该剂型的一些实施例,基于其在受试者中的各自pk/pd曲线,其中所含的两种或两种以上抗糖尿病剂的剂量和/或剂型被优化设计或配置。
106.在本文提供的该药物组合物的剂型中,两种或多种抗糖尿病剂的任一种,可根据已经建立的它们各自的pk/pd曲线,配置成在一个即时释放制剂或控制释放制剂。
107.关于药物组合物口服剂型中的含抗糖尿病剂的速释层处方,该抗糖尿病剂可以是以颗粒、球体、小珠、微粒、小丸(以下统称为“多颗粒”)等形式提供。在治疗上有效,可以提供所需药物剂量的一定数量的多颗粒,可以放入胶囊中,也可以以任何其他合适的口服形式结合使用。
108.关于药物组合物口服固体制剂中的含抗糖尿病药的控释层处方,制备含抗糖尿病药物的片芯,然后在片芯上进一步涂布控释膜,该膜旨在实现片芯中抗糖尿病药的控制释放。
109.图1是根据本发明公布的某些实施例说明了药物组合物口服剂型的结构图。如图所示,药物组合物的口服剂型001包括片芯部分100,其至少包括一种第一种抗糖尿病药物,和外层部分200,其至少包括一种第二种抗糖尿病药物。
110.控释膜150位于片芯部分100和外层部分200之间。控释膜“150”上设置了一个或多个输送通道151(例如孔腔、孔隙、孔等),为片芯部分100中的至少一种第一种抗糖尿病药物从控释膜150中释放出来提供输送通道,从而实现控释或延长释放。在图1中,只显示了两个输送通道151,但请注意,它仅用于说明目的,对控释膜150中排列的输送通道数量没有限制。或者,每个输送通道都可以进一步配备可溶性栓(图中未显示),例如水溶性材料(如明胶)或肠溶材料,该材料形成密封通道,但可以在水溶液中溶解或浸出(例如胃肠道液)从而打开输送通道,让片芯部分100中的至少一种第一种抗糖尿病药物释放出来。控释膜150占整个片剂重量的约1%-约7%,优选的为约1.5%-约4%。在公布的某些首选实施例中,固体药物包含两个通道,这些通道为制剂提供所需的药代动力学参数。
111.控释膜150可以为半渗透膜,水和生物液体等外部流体可渗透通过,而片芯中的抗糖尿病药物不能渗透通过。因此,控释膜150可以包含至少一种不溶性聚合物。可用于形成控释膜150的不溶性聚合物包括纤维素酯、纤维素二酯、纤维素三酯、纤维素醚、纤维素醚-醚、纤维素酯醚、纤维素酰化物、纤维素二酰化物、三酰化纤维素、醋酸纤维素、二乙酸纤维素、三醋酸纤维素、丙酸纤维素或乙酸纤维素丁酸纤维素等。其他合适的聚合物可以参考美国专利pat 3,845,770、3,916,899、4,008,719、4,036,228和4,11210。例如,一种控释膜材料可以是醋酸纤维素ca-398-10,其乙酰含量为39.3%-40.3%,可从伊士曼精细化学品公司获得。
112.可选地,控释膜150可以包含至少一种不溶性聚合物和至少一种可溶性赋形剂(如致孔剂),由这些材料共同混合制备而成。至少一种可溶性辅料可选地包括至少一种致孔剂和或至少一种增塑剂。控释膜150主要的组合物和比例见表1。
113.表1固体制剂控释膜主要成分
114.组成优选更优选聚合物50-99%75-95%致孔剂0-40%2-20%增塑剂0-25%或0-30%0-15%
115.可选地,控释膜150可以包括上述一种或多种不溶性聚合物和至少一种致孔剂。至少一种致孔剂会增加渗透到片芯的液体(水和生物液体)体积,使药物组合物的剂量形式能
够通过通道和/或多孔膜,从而大量释放所有的抗糖尿病药物。致孔剂可以是水溶性材料或肠溶材料。作为致孔剂的首选材料包括氯化钠、氯化钾、蔗糖、山梨醇、甘露醇、聚乙二醇(peg)、丙二醇、羟丙基纤维素、羟丙基甲基纤维素、邻苯二甲酸羟丙基甲基纤维素、邻苯二甲酸乙酸纤维素、聚乙烯醇、甲基丙烯酸共聚物及其混合物。优选地,致孔剂是peg 400、peg 3350、peg 6000和peg 8000。致孔剂约占涂层总重量的0-40%,优选地,占涂层总重量的2%-20%。致孔剂从控释膜中溶解或浸出,在控释膜中形成通道,使液体进入片芯并溶解活性成分。致孔剂也可以是水溶性药物,如二甲双胍或其药物上可接受的盐,或在肠道条件下可溶性的药物。如果致孔剂是一种药物,则目前的剂量形式具有被选为致孔剂的药物立即释放的额外优势。
116.可选地,控释膜150也可以与某些辅料如增塑剂等共同形成。一些众所周知的增塑剂包括阿迪帕酸盐、阿泽尔酸盐、苯甲酸盐、硬脂酸盐、异戊酸酯、芝酸酯、柠檬酸三乙酯、柠檬酸三n丁酯、乙酰柠檬酸三丁酯、柠檬酸酯,以及john wiley&sons出版的《聚合物科学和技术百科全书》第10卷(1969年)中描述的增塑剂。优选地增塑剂是三乙素、乙酰化单甘油酯、葡萄籽油、橄榄油、芝麻油、乙酰三丁基柠檬酸盐、乙酰三乙酯、甘油山梨醇、二乙基甲酸酯、二乙基马酸酯、二丁酯、琥珀酸二丁酯、二乙基丙二醇酸酯、二丁酯、二丁基三乙酸盐、柠檬酸三丁酯、甘油三丁酯等。根据特定的增塑剂,占涂层的总重量0-25%,优选地为2%-15%。
117.如本文所用,术语“通道”可以指控释膜150的开口(例如,缝隙、孔腔、孔隙、孔等),允许被包封在片芯部分100中的至少一种抗糖尿病药释放出来,并且还可以指控释膜150中的弱化区域或易腐蚀区域(例如,在水环境中腐蚀的易腐蚀塞),其可以被诱导在其中形成开口从而允许至少一种抗糖尿病药通过其释放。“通道”的详细描述可以在美国专利例如3,845,770、3,916,899、4,034,758、4,063,064、4,077,407、4,088,864、4,783,337和5,071,607中找到,其公开内容通过引用并入本文。在某些实施方案中,口服剂型001中的控释膜150的通道通过机械或激光钻孔形成。在其他实施例中,通过在膜涂覆之前在片芯上形成凹痕,以在凹痕点处形成膜的弱化区域来形成通道。
118.可选地,药物组合物的口服剂型可以进一步包含内层封膜(图1中未显示),其位于片芯部分100和控释膜150之间。内层封膜包封片芯部分100,使得片芯部分100被控释膜150包被之前为其提供密封装置,从而使得本发明提供的药物组合物口服固体制剂的片芯部分中包含的活性药物成分的特性在包衣过程中不受影响。
119.在此,内层封膜可包含至少一种成膜聚合物和一种或多种药学上可接受的赋形剂。成膜聚合物包括羟丙基甲基纤维素(hpmc)、羟丙基纤维素(hpc)、羧甲基纤维素钠、聚乙烯吡咯烷酮(pvp)、聚乙烯醇、聚乙二醇(peg)、羟丙甲纤维素或其他合适的水溶性聚合物材料。外层封膜中所含的赋形剂包括增塑剂、颜料(即染料或着色剂)、分散剂和抗氧化剂。增塑剂、颜料、分散剂和抗氧化剂的组合物是本领域人员已知的。增塑剂包括聚乙二醇400至3350和柠檬酸三乙酯。分散剂可以是水合硅酸铝(高岭土)。抗氧化剂包括α-生育酚、γ-生育酚、δ-生育酚、富含生育酚的天然提取物、l-抗坏血酸及其钠盐或钙盐、棕榈酸抗坏血酸酯、没食子酸丙酯、没食子酸辛酯、没食子酸十二烷基酯、丁基化羟基甲苯(bht)或丁基化羟基苯甲醚(bha)等。优选的抗氧化剂是没食子酸丙酯。在此,抗氧化剂用于防止本公开提供的药物组合物的口服剂型的片芯部分的氧化降解。
120.在此,内层封膜相对于整个片剂重量可以在本发明的范围内变化并且取决于所需的药物载量,其范围可以为约0.5%-40%,优选地为按重量计占片剂重量的2%-10%。
121.根据某些实施方案,药物组合物的口服剂型001的片芯部分100中的至少一种第一抗糖尿病药包含双胍或其药学上可接受的盐。根据口服制剂的一些实施方案,双胍可以是二甲双胍,并且进一步任选地,口服制剂的片芯部分100中的至少一种第一抗糖尿病药由盐酸二甲双胍组成,其剂量可以是500-1000毫克。因此,通过本文提供的口服制剂提供的这种实质性渗透泵制剂,受试者服用口服制剂后双胍或其药学上可接受的盐可以实现控释或持续释放,而无需使用任何膨胀聚合物。
122.在某些实施方案中,本发明的盐酸二甲双胍控释口服剂型的片芯部分除了至少一种抗糖尿病药(即抗糖尿病药或活性药物,例如盐酸二甲双胍)外,还包括任选地至少一种粘合剂,和/或任选地至少一种吸收促进剂,和/或任选地至少一种润滑剂,见表2中所列。
123.表2.口服剂型片芯部分的主要成分(活性药物和赋形剂)。
124.组成优选更优选抗糖尿病药50-98%75-95%粘合剂0-40%3-15%促进吸收剂0-20%2-10%润滑剂0-10%1-3%
125.本文中,粘合剂可以是任何常规已知的药学上可接受的粘合剂,例如聚乙烯吡咯烷酮(也称为“providone”或“polyvidone”,简称为“pvp”)、羟丙基纤维素、羟乙基纤维素、乙基纤维素、聚甲基丙烯酸酯、蜡之类的。也可以使用上述粘合剂的混合物。优选的粘合剂是水溶性的,例如平均分子量为25,000至3,000,000的聚乙烯吡咯烷酮。粘合剂占片芯部分重量的约0-约40%,优选地为约3%-约15%。
126.片芯部分可任选地包含吸收促进剂。吸收促进剂可以是本领域公知的任何类型的吸收促进剂,例如脂肪酸、表面活性剂、螯合剂、胆汁盐或它们的混合物。优选的吸收促进剂是脂肪酸例如癸酸、油酸和它们的甘油单酯,表面活性剂例如十二烷基硫酸钠、牛磺胆酸钠和聚山梨醇酯80,螯合剂例如柠檬酸、植酸、乙二胺四乙酸(edta)和乙二醇-大(b-氨基乙基醚-n,n,n,n-四乙酸(egta))。吸收促进剂占片芯部分总重量约0-约20%,优选地为约2%-约10%。
127.可用于本文提供的口服剂型的片芯部分的润滑剂可以是本领域公知的任何类型的润滑剂,如硬脂酸镁、硬脂酸、富马酸钠、山嵛酸甘油酯等,优选地占片芯部分总重量的约0.2%-约2%。
128.除了上述粘合剂、吸收促进剂和润滑剂之外,任选地,在口服固体制剂的片芯部分中的其他赋形剂可以包括颜料或染料。
129.在口服剂型的一个具体实施方案中,片芯片剂(即片芯部分)可以包含盐酸二甲双胍(即活性药物)、聚维酮(聚乙烯吡咯烷酮或pvp)、usp(美国药典)级(即粘合剂)、十二烷基钠(即吸收促进剂)和硬脂酸镁(即润滑剂)。
130.根据某些实施方案,盐酸二甲双胍可以在各种条件下给药后7.5至15小时获得峰值血浆水平。此外,二甲双胍的控释可有效降低该药剂经常引起的胃肠道(gi)副作用(如腹泻、恶心、呕吐等)。根据图3和图4,控制释放二甲双胍/西格列汀片在空腹和进食条件下的
血浆浓度图,在7.5-15小时间达到血浆浓度峰值。
131.在片芯部分100中的至少一种第一抗糖尿病药是二甲双胍或其药学上可接受的盐的实施方案中,基于提供1000mg/100mg每天一次剂量的二甲双胍/西格列汀的控释口服剂型的给药,控释口服剂型提供的药物平均最大血浆浓度(cmax)为约700-1500ng/ml,优选地为约900-1250ng/ml。
132.在片芯部分100中的至少一种第一抗糖尿病药是二甲双胍或其药学上可接受的盐的实施方案中,基于提供1000mg/100mg每天一次剂量的二甲双胍/西格列汀的控释口服剂型的给药,控释口服剂型提供平均auc0-24hr为约7000-16000ng.hr/ml,优选地为约9000-14000ng
·
hr/ml。
133.由于上述配置,对于包含双胍(例如,二甲双胍)的药物组合物的控释剂型,该药物组合物适用于非胰岛素依赖型糖尿病或前驱糖尿病患者每天一次给药。该剂型可以控制血糖水平长达约24小时,并且可以在给药后提供药物的控制释放,达到药物最大血浆浓度(tmax)的平均时间为7.5-15小时和药物平均血浆浓度/时间曲线高度的50%处的宽度约6-15小时。
134.根据一些实施例,片芯部分100中的至少一种第一抗糖尿病药除了双胍或其药学上可接受的盐之外,还可以包括一种或多种其他类型的抗糖尿病药,由于药物组合物的口服剂型中的控释膜150,在口服给药后其也可以实现从口服剂型控释释放。
135.根据一些其他实施方案,片芯部分100中的至少一种第一抗糖尿病药可以不包括双胍,而是包括一种或多种其他类型的抗糖尿病药,其可以在口服后从口服剂型中实现控释。
136.根据本文提供的药物组合物的口服固体制剂001的某些实施方案,外部部分200中的至少一种第二抗糖尿病药可包含dpp-4抑制剂(例如西格列汀、沙格列汀、利格列汀或阿格列汀等),磺脲类(如格列吡嗪或格列本脲等),格列奈(如瑞格列奈,那格列奈或米格列奈等),噻唑烷二酮(如吡格列酮或罗格列酮等),sglt2抑制剂(如卡格列净、艾格列净、恩格列净或达格列净等),或α-葡萄糖苷酶抑制剂中的至少一种。在本文提供的药物组合物的口服固体制剂中,包含有至少一种第二种抗糖尿病药的外部部分200包被在控释膜150的外表面上,在服用口服剂型后其立即释放,因此至少一种第二种抗糖尿病药对片芯部分100中的至少一种第一种抗糖尿病药(例如盐酸二甲双胍)从口服剂型的控制释放几乎没有影响。
137.在本文提供的药物组合物的口服剂型中,所述至少一种第二种抗糖尿病药的每一种可以被配置为具有与所述至少一种第一种抗糖尿病药(如二甲双胍)的剂量和处方相应匹配的剂量和处方,从而实现互补和协同效应。例如,可以基于二甲双胍的剂量和处方以及每一种至少一种第二种抗糖尿病药中的pk/pd曲线来配置至少一种第二种抗糖尿病药中的每一种的剂量和处方。
138.在一具体实施方案中,药物组合物的口服剂型包含剂量为约500-1000mg的二甲双胍的控释形式和剂量约25-100mg的dpp-4抑制剂西格列汀的速释形式。它们分别存在于口服剂型的片芯部分100和外部部分200。
139.在另一个具体的实施方案中,药物组合物的口服固体制剂包含剂量为约500-1000mg的二甲双胍的控释形式和剂量为约2.5-10mg的sglt-2抑制剂达格列净的速释形式。它们分别存在于口服剂型的片芯部分100和外部部分200中。
140.根据本文提供的药物组合物的口服固体制剂的某些实施方案,外层封膜250位于外部部分200的外表面,如图1所示。外层封膜250用于为口服剂型提供保护涂层,使口服剂型中所含的活性药物成分的特性不受环境影响。
141.在此,口服剂型的外层封膜250可以具有与上述内层封膜相似的组成。简而言之,外层封膜可包含至少一种药学上可接受的成膜聚合物和一种或多种药学上可接受的赋形剂。
142.成膜聚合物包括羟丙基甲基纤维素(hpmc)、羟丙基纤维素(hpc)、羧甲基纤维素钠、聚乙烯吡咯烷酮(pvp)、聚乙烯醇、聚乙二醇(peg)、羟丙甲纤维素或其他合适的水溶性聚合物材料。用作成膜聚合物的一种hpmc是hpmc 2910。
143.外层封膜中包含的赋形剂可包括增塑剂、颜料(即染料或着色剂)、分散剂和抗氧化剂。增塑剂包括聚乙二醇等级400至3350和柠檬酸三乙酯。分散剂可以是水合硅酸铝(高岭土)。抗氧化剂包括α-生育酚、γ-生育酚、δ-生育酚、富含生育酚的天然提取物、l-抗坏血酸及其钠盐或钙盐、棕榈酸抗坏血酸酯、没食子酸丙酯、没食子酸辛酯、没食子酸十二烷基酯、丁基化羟基甲苯(bht)或丁基化羟基苯甲醚(bha)等。优选的抗氧化剂是没食子酸丙酯。在此,抗氧化剂用于防止本公开提供的药物组合物的口服制剂的片芯部分的氧化降解。
144.在本文中,外层封膜相对于整个片剂的相对量可以在本发明的范围内变化并且取决于所需的药物载量,其可以为约0.5%-40%,优选地为约2%-10%。
145.在此,成膜聚合物和增塑剂的用量可以在本发明的范围内变化。增塑剂可以单独使用或以各种比例组合使用。增塑剂占整个片剂的用量可以在本发明的范围内变化,其取决于所需的载药量。在大多数情况下,增塑剂占片剂重量约0.1%至10%,优选地为1%至8%。此外,抗氧化剂占片剂重量约0.03%至0.05%。水合硅酸铝作为分散剂,占片剂重量约0.2%至5%,优选地为0.5%至2%。
146.以下实施例进一步描述和证明了在本发明范围内的实施方案。这些实施例仅出于说明的目的并且不旨在被解释为对本发明的限制,因为在不背离本发明的精神和范围的情况下其许多变化是可能的。
147.根据一些优选的实施例,药物组合物口服制剂包含控释形式的二甲双胍或其药学上可接受的盐和速释形式的西格列汀或其药学上可接受的盐的固定剂量组合。在此,更具体地,二甲双胍或其药学上可接受的盐作为第一种抗糖尿药对应于如图1所示口服固体制剂001的片芯部分100。西他列汀或其药学上可接受的盐作为第二种抗糖尿病药对应于如图1所示的口服固体制剂001的外部部分200。在口服剂型的这些实施例中,上述两种抗糖尿病药被制成适合同时给药的剂型。
148.一种特定的固体剂型涉及包含用速释形式的磷酸西格列汀包裹的控释形式的盐酸二甲双胍的,其片剂。任选地,用于本发明的固定剂量药物组合物中的盐酸二甲双胍的单位剂量可以是500、750或1000毫克。选进一步任地,用于本发明的固定剂量药物组合物中的西格列汀游离碱无水物(活性部分)的单位剂量可以是25、50或100毫克。与药物组合物中使用的西格列汀游离碱无水物等量的磷酸西格列汀一水合物可以相应地为32.125、64.25或128.5毫克。
149.根据一些其他实施例,药物组合物的口服剂型是包含控释形式的二甲双胍或其药学上可接受的盐和速释形式的sglt-2抑制剂(例如达格列净)或其药学上可接受的盐的固
定剂量组合。一种特定的固体制剂本身涉及包含用速释形式的达格列净包裹控释形式的盐酸二甲双胍的固定剂量组合的片剂。任选地,用于本发明的固定剂量药物组合物中盐酸二甲双胍的单位剂量可以是500、750或1000毫克,用于本发明的固定剂量药物组合物中达格列净的单位剂量可以是2.5-10毫克。
150.根据又一些其他实施方案,药物组合物的口服剂型包含控释形式的二甲双胍或其药学上可接受的盐和速释形式的磺酰脲(例如格列吡嗪)的固定剂量组合。格列吡嗪或格列本脲或其药学上可接受的盐,例如格列吡嗪或格列本脲,用于并入本公开的固定剂量组合的格列吡嗪或格列本脲的单位剂量可以是1.25-10mg。
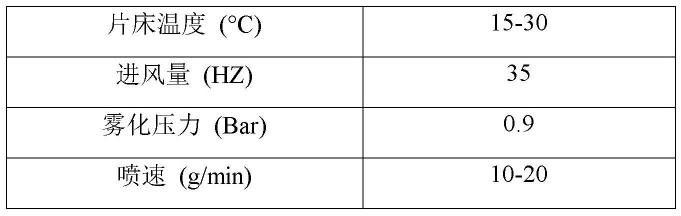
151.根据又一些其他实施例,药物组合物的口服固体制剂包含控释形式的二甲双胍或其药学上可接受的盐和速释形式的格列奈类药物(例如瑞格列奈或那格列奈)或其药学上可接受的盐的固定剂量组合。例如瑞格列奈或那格列奈,用于本发明的固定剂量组合的瑞格列奈的单位剂量可以是0.5-5mg;用于本发明固定剂量组合的那格列奈的单位剂量可以为30-60mg。
152.根据又一些其他实施例,药物组合物的口服固体制剂包含控释形式的二甲双胍或其药学上可接受的盐和速释形式的噻唑烷二酮类(例如吡格列酮或罗格列酮)或其药学上可接受的盐的固定剂量组合。在此,用于本发明的固定剂量组合的吡格列酮的单位剂量可以是15-45mg,而用于本发明的固定剂量组合的罗格列酮的单位剂量可以是1-4mg。
153.根据又一些其他实施方案,药物组合物的口服固体制剂包含控释形式的二甲双胍或其药学上可接受的盐和速释形式的α-葡糖苷酶抑制剂(例如阿卡波糖或米格列醇)或其药学上可接受的盐的固定剂量组合。例如,用于本发明固定剂量组合的阿卡波糖单位剂量可以是12.5-100mg,而用于本发明固定剂量组合米格列醇的单位剂量可以是12.5mg-100mg。
154.以下实施例进一步阐述本发明。但是,当然其不应当看作以任何方式限制本发明的范围。
155.实施例1
156.本实施例举例说明了该药物组合物的口服剂型的制备,该组合物主要包括渗透泵控释(cr)的盐酸二甲双胍(hcl)片芯(即片芯部分,1000mg组合物),用立即释放(ir)的磷酸西格列汀薄膜(即外部部分,100mg组合物)包覆。
157.更具体而言,包覆控释膜的盐酸二甲双胍片芯是通过流化床制粒来制备的,其中将羟丙基纤维素(hpc-ef)溶解在水中以制备约5%固体(w/w)hpc-ef溶液,然后以喷雾形式喷洒在粉碎的盐酸二甲双胍、山梨醇和十二烷基硫酸钠上。
158.将干颗粒干燥并通过装有0.8mm筛网的整粒机整粒。将整粒后的颗粒与硬脂酸镁在v型混合机中以25转混合约5分钟。口服剂型片芯部分的制粒条件,即二甲双胍片芯(即为“二甲双胍cr(控释)”)见表3。
159.表3.二甲双胍er制粒条件
160.进风温度(℃)45-55进风量(hz)25-45雾化压力(bar)2-3喷液速度(g/min)5-10
161.注:干燥后颗粒的lod%为nmt 3%,由快速水分测定仪测定,其中术语lod是“loss on dry”的缩写,术语nmt是“no more than”的缩写。
162.将总混物使用10.0
×
20.5mm冲模在自动压片机上压制成片剂。
163.然后,将片芯进行控释膜包衣,通过包含醋酸纤维素ca-398-10(即,用于控释膜的聚合物材料)和peg 6000(即,用于控释膜的增塑剂)的丙酮溶液进行包衣,然后在50℃下老化60分钟。控释膜包衣条件见表4。
164.表4控释膜包衣条件
[0165][0166][0167]
将包衣片用激光打两个孔(例如片剂每侧一个孔,如图1所示),每个孔应在片剂中部的
±
5mm,孔的直径应在0.40至0.60mm,孔的深度应在0.10至2.00mm。
[0168]
磷酸西格列汀包衣溶液制备:使用合适的搅拌器将所有赋形剂和磷酸西他列汀混合在所需量的纯化水中直到固体溶解。制备总固含量约为18.0%(w/w)磷酸西格列汀包衣溶液,然后将其施涂到二甲双胍包衣片剂上。通过控制活性药物成分(“api”)薄膜层(即口服剂型的外部部分)中固体的量以达到所需的西格列汀剂量。
[0169]
将膜包衣的盐酸二甲双胍控释片芯装入包衣锅中,该包衣锅装有单喷枪,能够产生覆盖整个片床宽度的喷雾扇;将预热后的未包衣片的平均重量确定为初始重量;以合适的喷雾速率和雾化压力将磷酸西他列汀包衣混悬液喷雾到片床上;继续用磷酸西他列汀包衣混悬液喷雾,同时监测片重,直到获得所需的包衣增重;当干燥包衣重量达到130mg相当于50mg西格列汀(作为游离碱)或260mg相当于100mg西格列汀(作为游离碱)时,停止喷雾,将包衣片进行干燥并从包衣锅中取出。西格列汀薄膜包衣条件见表5。
[0170]
表5西格列汀薄膜包衣条件
[0171]
片床温度(℃)35-45进风量(hz)35/45雾化压力(bar)1.0喷速(g/min)9-10包衣锅转速(rpm)15进风温度(℃)55-65
[0172]
然后用封闭包衣溶液对西格列汀包衣片进行包衣,该溶液由羟丙甲纤维素和聚乙二醇等欧巴代材料或其他合适的水溶性材料制成。优选地是欧巴代clear(ys-1-7006),其是一种含有羟丙甲纤维素和聚乙二醇的混合包衣材料。首先将羟丙甲纤维素和聚乙二醇溶
解于纯化水中。然后在以下条件下使用包衣机将欧巴代包衣溶液喷涂到片芯上:出风温度为38-42℃;雾化压力为28-40psi;喷雾速度为10-15毫升/分钟。欧巴代clear包衣增重约20-25mg/片。
[0173]
通过上述方法(即实施例1)制备的口服剂型(即盐酸二甲双胍控释片芯(1000mg组合物)外层包覆磷酸西格列汀速释膜(100mg组合物))。片芯部分(即盐酸二甲双胍控释片,1000mg组合物)和外部部分(即磷酸西他列汀薄膜,100mg组合物)的组合物见表6和表7。
[0174]
表6盐酸二甲双胍控释片,1000毫克组合物
[0175]
组分%w/w盐酸二甲双胍83.3十二烷基硫酸钠3.8山梨醇5.2羟丙基纤维素ef5.1硬脂酸镁0.8醋酸纤维素1.7聚乙二醇0.25总计100.0
[0176]
表7磷酸西格列汀包衣膜,100毫克组合物
[0177]
组分%w/w磷酸西格列汀(100mg游离碱)52.05羟丙甲基纤维素e547.95总计100.0
[0178]
实施例2
[0179]
该实施例说明了药物组合物口服剂型的制备,该组合物为渗透泵控释(cr)的盐酸二甲双胍(hcl)片芯(即片芯部分,1000mg组合物),用立即释放(ir)的磷酸西格列汀薄膜(即外部部分,100mg组合物)包覆。
[0180]
更具体地说,包覆控释膜的盐酸二甲双胍片芯是通过流化床制粒来制备的。聚维酮(pvp-k90)在水中溶解以制备约7%固体(w/w)pvp溶液,然后以喷雾形式喷洒在粉碎的盐酸二甲双胍、山梨醇和十二烷基硫酸钠上。
[0181]
将干颗粒进行干燥并通过装有0.8mm筛网的整粒机整粒。将整粒后的颗粒与硬脂酸镁在v型混合机中以25转混合约5分钟。口服剂型片芯部分的制粒条件,即二甲双胍片芯(即为“二甲双胍cr(控释)”)见表8。
[0182]
表8二甲双胍er制粒条件
[0183]
片床温度(℃)33-45进风量(hz)25-45雾化压力(bar)2-2.5喷液速度(g/min)5-10
[0184]
注:干燥后颗粒的lod%为nmt 3%,由快速水分测定仪测定,其中术语lod是“loss on dry”的缩写,术语nmt是“no more than”的缩写。
[0185]
将总混物使用12.0
×
12.0mm圆形冲模在自动压片机上压制成500mg规格片剂和10.0
×
20.5mm或10.3
×
21.2mm椭圆形冲模压制成1000mg规格片剂。然后将此片芯(即口服固体制剂的芯部)用封闭包衣液进行包衣。该封闭包衣液由羟丙甲纤维素和聚乙二醇或其他合适的水溶性材料制成,优选地是欧巴代clear(ys-1-7006),其是一种含有羟丙甲纤维素和聚乙二醇的混合包衣材料。首先将羟丙甲纤维素和聚乙二醇溶解于纯化水中。然后在以下条件下使用锅包衣机将包衣溶液喷涂到片芯上:出风温度为38-42℃;雾化压力为28-40psi;喷雾速度为10-15毫升/分钟。欧巴代clear包衣增重约10-15mg/片。
[0186]
然后,将封闭包衣片进行控释膜包衣,通过包含醋酸纤维素ca-398-10(即,控释膜的聚合物材料)和peg 6000(即,控释膜的增塑剂)的丙酮溶液进行包衣,然后在50℃下老化60分钟。控释膜包衣条件见表9。
[0187]
表9.控释膜包衣条件
[0188]
片床温度(℃)18.4-24.8进风量(hz)35雾化压力(bar)0.9喷速(g/min)14.4-15.9锅转速(rpm)17-18进风温度(℃)24.3-30
[0189]
将包衣片用激光打两个孔(例如片剂的每一侧一个孔,如图1所示),每个孔应在片剂中间的
±
5mm,孔的直径应在0.30至0.80mm之间,孔的深度应在0.10至2.00mm之间。
[0190]
磷酸西格列汀包衣溶液制备:使用合适的搅拌器将所有赋形剂和磷酸西他列汀混合在所需量的纯化水中直到固体溶解,制备总固含量约为18.0%(w/w)磷酸西格列汀包衣溶液,然后将其施涂到二甲双胍包衣片剂上。通过控制活性药物成分(“api”)薄膜层(即口服剂型的外部部分)中固体的量以达到所需的西格列汀剂量。
[0191]
将膜包衣的盐酸二甲双胍控释片芯装入包衣锅中,该包衣锅装有单喷枪,能够产生覆盖整个片床宽度的喷雾扇;称量预热后的未包衣片的平均重量,将其确定为初始重量;以合适的喷雾速率和雾化压力将磷酸西他列汀包衣混悬液喷雾到片床上,继续用磷酸西他列汀包衣混悬液喷雾,同时监测片重,直到获得所需的包衣增重;当干燥包衣重量达到130mg相当于50mg西格列汀(作为游离碱)或260mg相当于100mg西格列汀(作为游离碱)时,停止喷雾,将包衣片进行干燥并从包衣锅中取出。西格列汀薄膜包衣条件见表10。
[0192]
表10西格列汀薄膜包衣条件
[0193]
片床温度(℃)37.4-45.0进风量(hz)35/45雾化压力(bar)1.0喷速(g/min)9-10锅转速(rpm)15进风温度(℃)58.6-65.6
[0194]
然后用封闭包衣溶液对西格列汀包衣片进行包衣,该溶液由羟丙甲纤维素和聚乙二醇等欧巴代材料或其他合适的水溶性材料制成。优选地是欧巴代clear(ys-1-7006),其是一种含有羟丙甲纤维素和聚乙二醇的混合包衣材料。首先将羟丙甲纤维素和聚乙二醇溶
解于纯化水中。然后在以下条件下使用锅包衣机将欧巴代包衣溶液喷涂到片芯上:出风温度为38-42℃;雾化压力为28-40psi;喷雾速度为10-15毫升/分钟。欧巴代clear包衣增重约20-25mg/片。
[0195]
通过上述方法(即实施例2)制备的口服固体制剂剂型(即盐酸二甲双胍控释片芯(1000mg组合物)外层包覆磷酸西格列汀速释膜(100mg组合物))。具体地,片芯(即盐酸二甲双胍控释片,1000mg组合物)和外部部分(即磷酸西他列汀薄膜,100mg组合物)的组合物见表11和表12。
[0196]
表11盐酸二甲双胍控释片,1000毫克组合物
[0197][0198][0199]
表12磷酸西格列汀包衣膜,100毫克组合物
[0200]
组分%w/w磷酸西格列汀(100mg游离碱)52.05羟丙甲基纤维素e547.95总计100.0
[0201]
实施例3
[0202]
该实施例说明了药物组合物口服剂型的制备,该组合物为渗透泵控释(cr)的盐酸二甲双胍(hcl)片芯(即片芯部分,1000mg组合物),用立即释放(ir)的磷酸西格列汀薄膜(即外部部分,50mg组合物)包覆。
[0203]
其制备过程与上述实施例2相似,参考实施例2,其中具有某些变化。更具体地,二甲双胍cr制粒条件、控释膜包衣条件和西他列汀膜包衣条件见表13、表14和表15。
[0204]
表13二甲双胍cr制粒条件
[0205]
片床温度(℃)33-45进风量(hz)25-45雾化压力(bar)2-2.5喷速(g/min)5-10
[0206]
注:干燥后颗粒的lod%为nmt 3%,由快速水分测定仪测定,其中术语lod是“loss on dry”的缩写,术语nmt是“no more than”的缩写。
[0207]
表14控释膜包衣条件
[0208][0209][0210]
表15西格列汀膜包衣条件
[0211]
片床温度(℃)37.6-42.0进风量(hz)25/40雾化压力(bar)1.0喷速(g/min)7-8.8锅转速(rpm)15进风温度(℃)64.4-65.2
[0212]
通过上述方法(即实施例3)制备口服剂型剂(即盐酸二甲双胍控释片芯(1000mg组合物)外层包覆磷酸西格列汀速释膜(50mg组合物))。具体地,片芯部分(即盐酸二甲双胍控释片,1000mg组合物)和外部部分(即磷酸西他列汀薄膜,50mg组合物)的组合物见表16和表17。
[0213]
表16盐酸二甲双胍控释片,1000mg组合物
[0214]
组分%w/w盐酸二甲双胍84.7十二烷基硫酸钠4.2聚维酮k906.8硬脂酸镁0.4羟丙甲基纤维素1.4聚乙二醇0.6醋酸纤维素1.7聚乙二醇0.2总计100.0
[0215]
表17西格列汀膜,50mg组合物
[0216]
[0217][0218]
实施例4
[0219]
该实施例说明了药物组合物口服剂型的制备,该组合物为渗透泵控释(cr)的盐酸二甲双胍(hcl)片芯(即片芯部分,500mg组合物),用立即释放(ir)的磷酸西格列汀薄膜(即外部部分,50mg组合物)包覆。
[0220]
其制备过程与上述实施例2相似,参考实施例2,其中具有某些变化。更具体地,二甲双胍cr制粒条件、控释膜包衣条件和西他列汀膜包衣条件见表18、表19和表20。
[0221]
表18二甲双胍cr制粒条件
[0222]
片床温度(℃)33.7-45.4进风量(hz)25-35雾化压力(bar)2-2.5喷速(g/min)7.54
[0223]
注:干燥后颗粒的lod%为nmt 3%,由快速水分测定仪测定,其中术语lod是“loss on dry”的缩写,nmt是“no more than”的缩写。
[0224]
表19控释膜包衣条件
[0225]
片床温度(℃)17.8-23.4进风量(hz)35雾化压力(bar)0.9喷速(g/min)14.5锅转速(rpm)19进风温度(℃)22.1-38.0
[0226]
表20西格列汀膜包衣条件
[0227][0228][0229]
通过上述方法(即实施例4)制备口服制剂(即盐酸二甲双胍控释片芯(500mg组合物)外层包覆磷酸西格列汀速释膜(50mg组合物))。具体地,片芯部分(即盐酸二甲双胍控释片,500mg组合物)和外部部分(即磷酸西他列汀薄膜,50mg组合物)的组合物见表21和表22。
[0230]
表21盐酸二甲双胍控释片,500mg组合物
[0231]
组分%w/w盐酸二甲双胍82.5十二烷基硫酸钠4.1聚维酮k906.6硬脂酸镁0.4羟丙甲基纤维素1.3聚乙二醇0.6醋酸纤维素4.0聚乙二醇0.5总计100.0
[0232]
表22西格列汀膜,50mg组合物
[0233]
组分%w/w磷酸西格列汀(50mg游离碱)52.05羟丙甲基纤维素e547.95总计100.0
[0234]
实施例5
[0235]
该实施例说明了药物组合物口服剂型的制备,该组合物为渗透泵控释(cr)的盐酸二甲双胍(hcl)片芯(即芯部,1000mg组合物),用立即释放(ir)的磷酸西格列汀薄膜(即外部部分,100mg组合物)包覆。
[0236]
其制备过程与上述实施例1相似,参考实施例1,其中具有某些变化。更具体地,二甲双胍cr制粒条件、控释膜包衣条件和西他列汀膜包衣条件见表23、表24和表25。
[0237]
表23二甲双胍cr制粒条件
[0238]
片床温度(℃)33-45进风量(hz)25-45雾化压力(bar)2-2.5喷速(g/min)5-10
[0239]
注:干燥后颗粒的lod%为nmt 3%,由快速水分测定仪测定,其中术语lod是“loss on dry”的缩写,nmt是“no more than”的缩写。
[0240]
表24控释膜包衣条件
[0241]
片床温度(℃)18.4-24.8进风量(hz)35雾化压力(bar)0.9喷速(g/min)14.4-15.9锅转速(rpm)17-18进风温度(℃)24.3-30
[0242]
表25西格列汀膜包衣条件
[0243]
片床温度(℃)39.2-49.2
进风量(hz)25/40雾化压力(bar)1.0喷速(g/min)4.64锅转速(rpm)15进风温度(℃)64.8-65.2
[0244]
通过上述方法(即实施例5)制备口服剂型(即盐酸二甲双胍控释片芯(1000mg组合物)外层包覆磷酸西格列汀速释膜(100mg组合物))。具体地,片芯(即盐酸二甲双胍控释片,1000mg组合物)和外部部分(即磷酸西他列汀薄膜,100mg组合物)的组合物见表26和表27。
[0245]
表26盐酸二甲双胍控释片,1000mg组合物
[0246]
组分%w/w盐酸二甲双胍84.7十二烷基硫酸钠4.2聚维酮k906.8硬脂酸镁0.4羟丙甲基纤维素1.4聚乙二醇0.6醋酸纤维素1.7聚乙二醇0.2总计100.0
[0247]
表27西格列汀膜,100mg组合物
[0248]
组分%w/w磷酸西格列汀(100mg游离碱)61.19羟丙甲基纤维素e531.19聚乙二醇33507.62总计100.0
[0249]
实施例6
[0250]
该实施例说明了药物组合物口服剂型的制备,该组合物为渗透泵控释(cr)的盐酸二甲双胍(hcl)片芯(即片芯部分,1000mg组合物),用立即释放(ir)的磷酸西格列汀薄膜(即外部部分,100mg组合物)包覆。
[0251]
其制备过程与上述实施例1相似,参考实施例1,其中具有某些变化。更具体地,二甲双胍cr制粒条件、控释膜包衣条件和西他列汀膜包衣条件见表28、表29和表30。
[0252]
表28二甲双胍cr制粒条件
[0253]
片床温度(℃)33-45进风量(hz)25-45雾化压力(bar)2-2.5喷速(g/min)5-10
[0254]
注:干燥后颗粒的lod%为nmt 3%,由快速水分测定仪测定,其中术语lod是“loss on dry”的缩写,nmt是“no more than”的缩写。
[0255]
表29控释膜包衣条件
[0256]
片床温度(℃)18.4-24.8进风量(hz)35雾化压力(bar)0.9喷速(g/min)14.4-15.9锅转速(rpm)17-18进风温度(℃)24.3-30
[0257]
表30西格列汀膜包衣条件
[0258]
片床温度(℃)40.8-47.4进风量(hz)25/40hz雾化压力(bar)1.2喷速(g/min)2.82-5.20锅转速(rpm)19进风温度(℃)64.8-68.0
[0259]
通过上述方法(即实施例6)制备口服固体剂型(即盐酸二甲双胍控释片芯(1000mg)外层包覆磷酸西格列汀速释膜(100mg))。具体地,片芯部分(即盐酸二甲双胍控释片,1000mg组合物)和外部部分(即磷酸西他列汀薄膜,100mg组合物)的组合物见表31和表32。
[0260]
表31盐酸二甲双胍控释片,1000mg组合物
[0261]
组分%w/w盐酸二甲双胍84.7十二烷基硫酸钠4.2聚维酮k906.8硬脂酸镁0.4羟丙甲基纤维素1.4聚乙二醇0.6醋酸纤维素1.7聚乙二醇0.2总计100.0
[0262]
表32西格列汀膜,100mg组合物
[0263]
组分%w/w磷酸西格列汀(100mg游离碱)61.19羟丙甲基纤维素e520.24聚乙二醇335018.57总计100.0
[0264]
在下文中,对一些实施例的抗糖尿病药物组合物口服剂型的盐酸二甲双胍和磷酸西格列汀的体外溶出曲线和二甲双胍的体内血浆生物利用度进行测定。
[0265]
图2a和2b分别显示了本发明实施例1提供的盐酸二甲双胍/磷酸西格列汀控释片
cr 1000/100mg片剂中盐酸二甲双胍和磷酸西格列汀的体外溶出曲线。盐酸二甲双胍的体外溶出试验溶出介质为ph 6.8的缓冲液,通过usp溶出装置ii在37℃下以50rpm进行测试;磷酸西他列汀的体外溶出试验溶出介质为0.025mol/ml氯化钠溶液,通过usp溶出装置i在37℃下以75rpm测试。如图2b所示,磷酸西格列汀在nacl溶液中溶解速度非常快,大约10分钟溶解29%,60分钟后几乎完全溶解,从而在口服剂型中实现速释。如图2a进一步所示,与磷酸西格列汀相比,盐酸二甲双胍溶解速度慢,大约4小时溶解30-40%,大约8小时溶解55-85%,大约16小时后几乎完全溶解。
[0266]
此外,分别测定了每个上述实施例中药物组合物口服剂型的盐酸二甲双胍和磷酸西格列汀的体外溶出曲线,并进一步与一些市售的抗糖尿病处方药(janumet xr 1000mg、fortamet 500mg和fortamet 1000mg)作为比较。
[0267]
本文中,janumet xr是磷酸西格列汀和盐酸二甲双胍缓释片的商标名称,其是一种含有磷酸西格列汀和缓释盐酸二甲双胍的抗糖尿病处方药。fortamet是盐酸二甲双胍片剂的商标名称,它是一种抗糖尿病处方药,含有500mg或1000mg盐酸二甲双胍。
[0268]
以下为溶出曲线测试条件:
[0269]
溶出介质:900ml,ph 6.8磷酸盐缓冲液(美国药典),制备的详细程序参见美国药典。
[0270]
溶出方法:溶出测试装置为usp溶出装置ⅰ(篮法,美国药典),100rpm,37℃。
[0271]
检测方法:高效液相色谱法,于测试时间点测量采集样品中溶解的盐酸二甲双胍和磷酸西格列汀。
[0272]
上述六个实施例的口服固体剂型和三种市售的抗糖尿病处方药(janumet xr 1000mg,fortamet 500mg和fortamet 1000mg)磷酸西格列汀和盐酸二甲双胍溶出结果见下表(即表33和表34)。
[0273]
表33.磷酸西格列汀溶出度结果
[0274][0275][0276]
注:*磷酸西格列汀游离碱剂量
[0277]
表34.盐酸二甲双胍控释片溶出度结果
[0278][0279]
注:*二甲双胍游离碱剂量
[0280]
以本发明实施例1中的盐酸二甲双胍/磷酸西他列汀控释片,1000/100mg,作为“试验制剂”,检测受试者在禁食或进食条件下服用该药物组合物的体内生物利用度,并与一种市售的抗糖尿病处方药(fortamet,1000mg,即“参比制剂”)的体内血浆生物利用度进行比较,该药物用作参比对照。
[0281]
具体地,受试者在服用实施例1制备的制剂(试验制剂t)和市售制剂(参比制剂r)后,分别于不同的时间点(0、2.0、3.0、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0、11.5、12.0、14.0、16.0、16.0、20.0、24.0、28.0和36.0小时)取样检测试验制剂t和参比制剂r中的二甲双胍血浆浓度。空腹条件下的二甲双胍血浆浓度结果分别见表35和表36。
[0282]
值得注意的是,二甲双胍的血浆浓度以ng/ml为单位;两个表格中的每个突出显示的值(即粗体和下划线字体的值)表示每个受试者在口服单剂量的试验制剂t或参比制剂r的口服固体制剂后二甲双胍的最大血浆浓度(tmax);时间点0代表二甲双胍给药前浓度。
[0283]
表35空腹条件下不同受试者口服单剂量参比制剂后不同时间点测定的二甲双胍血浆浓度(ng/ml)曲线
[0284][0285]
表36空腹条件下不同受试者口服单剂量试验制剂后不同时间点测定的二甲双胍血浆浓度(ng/ml)曲线
[0286][0287]
如表36所示,每个受试者口服单剂量试验制剂t后,二甲双胍的最大血浆浓度(tmax)约为8.5-14小时,其中平均在口服给药后12小时达到血浆浓度峰值。
[0288]
此外,试验制剂t在口服给药后的关键药代动力学(pk)参数进一步总结于表37中。
[0289]
表37.试验制剂t的药代动力学(pk)参数
[0290][0291][0292]
注:
#
为t
max
平均值(最小值
–
最大值)
[0293]
进一步比较试验制剂和参比制剂之间二甲双胍的平均血浆浓度。
[0294]
图3a和3b分别显示了在空腹条件下的受试者服用参比制剂(“参比”)和试验制剂(“试验”,即本发明实施例1中提供的盐酸二甲双胍/磷酸西格列汀控释片,1000/100mg)的
盐酸二甲双胍平均血浆浓度与时间的线性和半对数图。
[0295]
图4a和4b分别显示了在进食条件下的受试者服用参比制剂(“参比”)和试验制剂(“试验”,即本发明实施例1中提供的盐酸二甲双胍/磷酸西格列汀控释片,1000/100mg)的盐酸二甲双胍平均血浆浓度与时间的线性和半对数图。
[0296]
应当指出,包含盐酸二甲双胍和磷酸西格列汀的药物组合物的上述实施方案和实施例仅用作说明性实例并且不应作为对范围的限制。
[0297]
在此,将本公开中引用的所有参考文献并入本文。尽管上面已经详细描述了具体实施例,但是描述仅仅是为了说明的目的。除非另有说明,在说明书中的用语不应当被解释为对于实施本发明必须的任何未要求保护的要素。
[0298]
本发明的优选实施方案描述在本文中,包括本发明人用于实施本发明所知的最佳方式。那些优选的实施方案的变化在本领域普通技术人员阅读前述说明书后可变得是显然的。本发明人预期本领域技术人员可酌情实施这样的变化,并且本发明人打算按照除了本文特别地描述之外地方式实施本发明。因此,本发明包括所有在附加权力要求中描述的主题的修饰和同等物,如适用法律所允许的。因此,除非本文另有说明,或者明显与本文内容矛盾,上述要素以其所有可能变化的任何组合包括在本发明内。
再多了解一些
本文用于企业家、创业者技术爱好者查询,结果仅供参考。